Область техники, к которой относится изобретение
Настоящее изобретение относится к новым конденсированным производным индана, их фармацевтически приемлемым солям, способу получения таких производных, композиции и противоопухолевым средствам, содержащим такие производные, и способу лечения опухолей у млекопитающих. Соединения изобретения обладают превосходной противоопухолевой активностью и в связи с этим полезны в качестве противоопухолевых средств.
Предпосылки создания изобретения
В качестве производных индено/2,1-с/хинолина известны, например, соединения, замещенные пиперазинильной группой в положении 6, описанные в Med. Chem. Res. , 3, 44 - 51 (1993). Хотя в работе раскрывается их антисеротониновая активность, в ней не сообщается и не описывается противоопухолевая активность таких соединений. Следовательно, противоопухолевая активность конденсированных производных индана изобретения является неизвестной.
Целью настоящего изобретения является создание соединений, которые обладают превосходной противоопухолевой активностью и пригодны в качестве лекарственного препарата для лечения опухолей.
Раскрытие изобретения Авторы настоящего изобретения провели исследования и обнаружили, что конденсированные производные индана показывают превосходную противоопухолевую активность и являются пригодными в качестве противоопухолевых средств. Таким образом осуществлено настоящее изобретение.
Настоящее изобретение предлагает конденсированные производные индана, изображаемые формулой (1), или их фармацевтически приемлемые соли.

В этой формуле кольцо A представляет собой необязательно замещенное бензольное кольцо или нафталиновое кольцо, или бензольное кольцо, имеющее низшую алкилендиоксигруппу, кольцо B представляет собой необязательно замещенное бензольное кольцо или бензольное кольцо, имеющее низшую алкилендиоксигруппу. Y представляет собой -N=CR- или -CR=N-, R представляет собой группу -NR1R2, необязательно замещенную азотсодержащую гетероциклическую группу или группу -OR3, где R1 и R2 являются одинаковыми или различными, и каждый представляет собой атом водорода; фенильную группу; необязательно замещенную азотсодержащую гетероциклическую группу; низшую алкильную группу, которая может быть замещена по крайней мере одним заместителем, выбираемым из группы, состоящей из необязательно замещенной аминогруппы, низшей алкилоксигруппы, фенильной группы, азотсодержащей гетероциклической группы, аминооксидной группы, замещенной низшей алкильной группой или гидроксильной группой; R3 представляет собой низшую алкильную группу, необязательно замещенную замещенной аминогруппой, при условии, что кольцо A и кольцо B не являются бензольными кольцами, не имеющими заместителей, когда R представляет собой необязательно замещенную азотсодержащую гетероциклическую группу.
Соединения настоящего изобретения, изображаемые упомянутой формулой (1), имеют превосходную противоопухолевую активность и являются эффективными при лечении многих опухолей.
Соответственно, изобретение предлагает композицию, содержащую эффективное количество соединения упомянутой формулы (1) или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель для них.
Настоящее изобретение предлагает, в частности, противоопухолевое средство, содержащее эффективное количество соединения упомянутой формулы (1) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель для них.
Настоящее изобретение также предлагает способ лечения опухолей у млекопитающих, который включает введение млекопитающему эффективного количества соединения упомянутой формулы (1) или его фармацевтически приемлемой соли.
Примеры групп в упомянутой формуле (1), обозначенных R1, R2 и R3, и других групп, описанных в описании, приводятся ниже.
Примерами групп-заместителей, включенных в бензольное кольцо и нафталиновое кольцо, обозначенные как кольцо A и кольцо B, являются атом галогена, низшая алкильная группа, низшая алкоксигруппа, гидроксильная группа, нитрогруппа, аминогруппа, низшая ацилоксигруппа, бензилоксигруппа, низшая ациламиногруппа, цианогруппа, карбоксильная группа, низшая алкоксикарбонильная группа, и предпочтительными являются атом галогена, низшая алкильная группа, низшая алкоксигруппа, гидроксильная группа, нитрогруппа, аминогруппа, низшая ацилоксигруппа, бензилоксигруппа и низшая ациламиногруппа.
Упомянутые группы-заместители могут располагаться в любом положении каждого кольца, которые могут иметь одинаковые или разные 1-4 заместителя. Что касается кольца A, предпочтительными положениями являются положения 8-, 9- и 10-индено/2,1-c/-хинолинового кольца и индено/2,1-c/изохинолинового кольца. Что касается кольца B, предпочтительными являются подобные 2-, 3- и 4-положения. Число групп-заместителей в каждом кольце составляет предпочтительно 1 и 2 соответственно.
Структура и положение заместителей в индено/2,1- с/хинолине приводятся ниже в табл. 1, а структура и положение заместителей в индено/2,1-с/изохинолине приводятся ниже в табл. 2.
Примерами низших алкилендиоксигрупп являются метилендиоксигруппа, этилендиоксигруппа, триметилендиоксигруппа, тетраметилендиоксигруппа и подобные алкилендиоксигруппы, содержащие 1 - 4 атома углерода. Положениями замещения низшими алкилендиоксигруппами являются предпочтительно положения 8, 9 или 9, 10 индено/2,1-с/хинолинового кольца и индено/2,1-с/изохинолинового кольца в случае кольца A; и подобным образом положения 2, 3 или 3, 4 в случае кольца B. Когда кольцо A представляет собой необязательно замещенное нафталиновое кольцо, положениями для присоединения заместителей в другом бензольном кольце, которое является частью нафталинового кольца, соединенной с бензольным кольцом в инденоновом каркасе, являются любыми положениями из трех вариантов, т.е. положение 8 - 9, положение 9 - 10 и положение 10 - 11 кольца A.
Примерами атома галогена являются атом фтора, атом хлора, атом брома и атом иода.
Примерами низшей алкильной группы являются линейные или разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.
Примерами низшей алкоксигруппы являются линейные или разветвленные алкоксигруппы, содержащие от 1 до 6 атомов углерода, такие как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, гексилоксигруппа и т.п.
Примерами низших ацилоксигрупп являются линейные или разветвленные ацилоксигруппы, содержащие от 1 до 6 атомов углерода, такие как формилоксигруппа, ацетоксигруппа, пропионилоксигруппа, бутирилоксигруппа, 2-метилпропионилоксигруппа, пивалоилоксигруппа, пентаноилоксигруппа, 3-метилбутирилоксигруппа, гексаноилоксигруппа и т.п.
Примерами низших ациламиногрупп являются линейные или разветвленные ациламиногруппы, содержащие от 1 до 6 атомов углерода, такие как формиламиногруппа, ацетиламиногруппа, пропиониламиногруппа, бутириламиногруппа, 2-метилпропиониламиногруппа, пивалоиламиногруппа, пентаноиламиногруппа, 3-метилбутириламиногруппа, гексаноиламиногруппа и т.п.
Примерами низших алкоксикарбонильных групп являются линейные или разветвленные алкоксикарбонильные группы, содержащие от 2 до 7 атомов углерода, такие как метоксикарбонильная, этоксикарбонильная, н-пропоксикарбонильная, изопропоксикарбонильная, н-бутоксикарбонильная, изобутоксикарбонильная, втор-бутоксикарбонильная, трет-бутоксикарбонильная, пентилоксикарбонильная, гексилоксикарбонильная группа и т.п.
Примерами групп-заместителей, включенных в азотсодержащие гетероциклы, представленные R, R1 и R2, являются низшие алкильные группы, низшие алкильные группы, содержащие гидроксильную группу (гидроксильные группы), предпочтительно - низшие алкильные группы.
Примерами групп-заместителей в замещенных аминогруппах, называемых "необязательно замещенные аминогруппы", относящихся к R1 и R2, и называемых "низшие алкильные группы, необязательно замещенные замещенной аминогруппой", представленных R3, являются низшая алкильная группа, низшая циклоалкильная группа, ди- (низший алкил)аминоалкильная группа, гидрокси-низшая алкильная группа, бензилоксикарбонильная группа, низшая ацильная группа, и предпочтительными являются низшая алкильная группа, ди(низший алкил)аминоалкильная группа, гидрокси-низшая алкильная группа и бензилоксикарбонильная группа. Упомянутые замещенные аминогруппы могут быть монозамещенными или дизамещенными, предпочтительно дизамещенными.
Примерами низших алкильных групп, содержащих замещенную аминогруппу, являются метиламинометил, этиламинометил, метиламиноэтил, этиламиноэтил, диметиламинометил, диметиламиноэтил, диметиламинопропил, диэтиламинометил, диэтиламиноэтил, диэтиламинопропил, диэтиламинобутил, диэтиламинопента-2-ил, дипропиламиноэтил, дибутиламиноэтил, дибутиламиногексил и подобные моно- или диалкиламиноалкильные группы, содержащие 1 или 2 (C1-C6)-алкильные части; N-диметиламиноэтил-N-метиламиноэтильная группа, ацетиламиноэтил, ацетиламинопропил, пропиониламиноэтил, пропиониламинопропил, пивалоиламиноэтил, пивалоиламинопропил и подобные алкильные группы, замещенные (C2-C6)-ациламиногруппами; циклопропиламинометил, циклопентиламинометил, циклопентиламиноэтил, циклогексиламинометил, циклогексиламиноэтил и подобные алкильные группы, замещенные (C3-C6)-циклоалкиламиногруппами; гидроксиметиламинометил, 2-гидроксиэтиламинометил, 3-гидроксипропиламинометил, гидроксиметиламиноэтил, 2-гидроксиэтиламиноэтил, 3-гидроксипропиламиноэтил, 4-гидроксибутиламиноэтил и подобные алкильные группы, замещенные (C1-C4)-гидроксиалкиламиногруппами; бензилоксикарбониламинометил, бензилоксикарбониламиноэтил, N-бензилоксикарбонил-N-метиламиноэтил и подобные алкильные группы, замещенные бензилоксикарбониламиногруппой.
Примерами низших алкильных групп, содержащих низшую алкоксигруппу, являются метоксиметильная, этоксиметильная, пропоксиметильная, метоксиэтильная, этоксиэтильная, метоксипропильная группа и подобные линейные или разветвленные (C1-C6)-алкильные группы, замещенные (C1-C6)-алкоксигруппами.
Примерами низших алкильных групп, замещаемых фенильной группой, являются бензил, фенетил, 2-фенетил, фенилпропил, бензгидрил, тритильная группа и подобные линейные или разветвленные (C1-C4)-алкильные группы, замещенные 1-3 фенильными группами.
Примерами азотсодержащих гетероциклических групп, представленных группами R, R1 и R2, являются предпочтительно 5- или 6-членные гетероциклические группы моноциклического типа, содержащие 1 - 4 атома азота и 0 или 1 атом кислорода или атом серы, например пирролил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиразолил, имидазолил, оксадиазолил, тиадиазолил, триазолил, оксатриазолил, тиатриазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперидиногруппа, пиперазинил, морфолинил, морфолиногруппа и т.п., предпочтительнее 5- или 6-членные гетероциклические группы моноциклического типа, содержащие 1 - 3 атома азота и 0 или 1 атом кислорода, в частности пиридил, пирролидинил, пиперидил, пиперидиногруппа, пиперазинил, морфолинил, морфолиногруппа, 1,2,4-триазолильная группа.
Примерами замещенных азотсодержащих гетероциклических групп являются 4-метилпиперазинил, 4-этилпиперазинил, 4-метил-пиперидиногруппа, 4-этилпиперидиногруппа, 2-гидроксиметилпирродилинил, 2-(2-гидроксиэтил)пирролидинил и т.п.
Примерами низших алкильных групп, содержащих азотсодержащую гетероциклическую группу, представленных группами R1 и R2, являются 2-пиридилметил, 3-пиридилметил, 4-пиридилметил, 2-пиридилэтил, 3-пиридилэтил, 4-пиридилэтил, пирролидинилметил, пирролидинилэтил, пиперидинометил, пиперидиноэтил, пиперазинилметил, пиперазинилэтил, морфолинометил, морфолиноэтил и подобные линейные или разветвленные (C1-C6)-алкильные группы, имеющие азотсодержащую гетероциклическую группу.
Примерами аминоксидных групп, замещенных низшими алкильными группами, являются метиламинооксидная, этиламинооксидная, бутиламинооксидная, диметиламинооксидная, диэтиламинооксидная, дибутиламинооксидная группа, и подобные моно- или диалкиламинооксидные группы, в которых алкильная часть содержит 1 - 4 атома углерода.
Примерами низших алкильных групп, содержащих аминооксидную группу, замещенную низшей алкильной группой, являются метиламинооксидметил, метиламинооксидэтил, этиламинооксидметил, этиламинооксидэтил, диметиламинооксидметил, диметиламинооксидэтил, диэтиламинооксидметил, диэтиламинооксидэтил, дибутиламинооксидпропил и подобные линейные или разветвленные (C1-C6)-алкильные группы, содержащие моно- или диалкиламинооксидную группу, в которой алкильная часть содержит 1 - 4 атома углерода.
Примерами низших алкильных групп, содержащих гидроксильную группу, являются гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 2,3- дигидроксипропил, 4-гидроксибутил, 2,3-дигидроксибутил, 5- гидроксипентил, 2,3-дигидроксипентил, 6-гидроксигексил, 2,3- дигидроксигексильная группа и подобные линейные или разветвленные (C1-C6)-алкильные группы, содержащие 1 или 2 гидроксильные группы.
Примеры солей соединений изобретения специально не ограничиваются, если эти соли являются фармацевтически приемлемыми солями, и включают соли, образованные органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, трифторуксусная кислота, винная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота; и неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота.
Что касается соединений, изображаемых формулой (1), то
- кольцо A предпочтительно представляет собой бензольное кольцо, необязательно замещенное гидроксильной группой (группами) или атомом (атомами) галогена, или бензольное кольцо, имеющее низшую алкилендиоксигруппу, предпочтительнее - представляет собой бензольное кольцо, необязательно замещенное 1 или 2 гидроксильными группами и/или атомами галогена, или бензольное кольцо, содержащее низшую алкилендиоксигруппу;
- кольцо B представляет собой предпочтительно бензольное кольцо, замещенное гидроксильной группой (группами), предпочтительнее - представляет собой бензольное кольцо, замещенное 1 или 2 гидроксильными группами;
- Y предпочтительно представляет собой -CR=N-;
- R предпочтительно представляет собой группу -NR1R2, пиперазинильную группу, замещенную низшей алкильной группой, или группу -OR3, предпочтительнее - представляет собой группу -NR1R2;
- R1 и R2 являются одинаковыми или различными, и каждый представляет собой предпочтительно атом водорода, фенильную группу или низшую алкильную группу, необязательно замещенную необязательно замещенной аминогруппой, азотсодержащей гетероциклической группой, аминооксидной группой, замещенной низшей алкильной группой или гидроксильной группой, предпочтительнее - представляют собой атомы водорода или низшие алкильные группы, необязательно замещенные ди(низший алкил)замещенными аминогруппами или азотсодержащими гетероциклическими группами, в частности R1 представляет собой низшую алкильную группу, замещенную диметиламиногруппой, диэтиламиногруппой или пирродинильной группой, и R2 представляет собой атом водорода; и
- R3 представляет собой предпочтительно низшую алкильную группу, необязательно замещенную ди(низший алкил) замещенной аминогруппой.
Предпочтительными соединениями изобретения являются производные индено/2,1-с/хинолина, представленные формулой (1), в которых кольцо A представляет собой бензольное кольцо, незамещенное или замещенное 1 или 2 гидроксильными группами и/или атомом (атомами) галогена; или бензольное кольцо, содержащее низшую алкилендиоксигруппу; кольцо B представляет собой бензольное кольцо, замещенное 1 или 2 гидроксильными группами; Y представляет собой -CR=N-, R представляет собой группу -NR1R2 (где R1 и R2 являются одинаковыми или различными, и каждый представляет собой атом водорода или низшую алкильную группу, необязательно замещенную ди(низший алкил)замещенной аминогруппой или азотсодержащей гетероциклической группой), пиперазинильную группу, замещенную низшей алкильной группой, или группу OR3 (где R3 представляет собой низшую алкильную группу, необязательно замещенную ди(низший алкил)замещенной аминогруппой).
Более предпочтительными соединениями изобретения являются производные индено/2,1-с/хинолина, изображаемые формулой (1), в которых кольцо A представляет собой бензольное кольцо, незамещенное или замещенное 1 или 2 гидроксильными группами и/или атомами галогена, или бензольное кольцо, содержащее низшую алкилендиоксигруппу; кольцо B представляет собой бензольное кольцо, замещенное 1 или 2 гидроксильными группами; Y представляет собой -CR=N-, R представляет собой группу -NR1R2 (где R1 представляет собой низшую алкильную группу, замещенную ди(низший алкил)замещенной аминогруппой или азотсодержащей гетероциклической группой, в частности низшую алкильную группу, замещенную диметиламиногруппой, диэтиламиногруппой или пирролидинильной группой, R2 представляет собой атом водорода).
Соединения настоящего изобретения, формулы (1), могут быть получены в соответствии с приведенной ниже схемой реакций 1.

где кольцо A, кольцо B и Y являются такими, как определено выше. Z представляет собой -CX=N- или -N=CX-, X представляет собой атом галогена.
Стадия A
Целевое соединение настоящего изобретения формулы (1) получают путем взаимодействия производного 6-галогениндено/2,1-с/-хинолина или производного 5-галогениндено/2,1-с/изохинолина формулы (2), с амином RH (что соответствует NH(R1)(R2) или необязательно замещенной азотсодержащей гетероциклической группе), или со спиртом (R3ОН) в присутствии, или в отсутствие подходящего растворителя для аминирования или алкоксилирования. При осуществлении реакции аминирования могут быть использованы гидрид натрия, трет-бутоксид калия, гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, бикарбонат натрия, триэтиламин и т.п. в подходящем растворителе. При осуществлении реакции алкоксилирования спирт может использоваться в форме свободного спирта или в форме алкоголята, полученного добавлением натрия, гидрида натрия, трет-бутоксида калия и т.п., в подходящем растворителе.
Примерами растворителей являются метанол, этанол, пропанол, трет-бутанол и подобные спирты, диметилформамид, диметилацетоамид, пиридин, толуол, бензол, ацетонитрил, тетрагидрофуран, вода и т.п. Растворители используются отдельно каждый или в виде смеси двух или нескольких из них.
При осуществлении реакции амин или спирт используют в количестве, составляющем 0,1 - 100-, предпочтительно 1 - 10-кратное от молярного количества соединения формулы (2). Температура реакции лежит в пределах 0 - 200oC, предпочтительно 50 - 150oC, и время реакции составляет от 0,1 до 100 часов, предпочтительно 1 - 60 часов. Такие условия являются благоприятными для протекания реакции.
Когда кольцо A или кольцо B соединения формулы (1), полученного в соответствии со схемой реакции 1, содержит в качестве заместителей низшие алкоксильные группы или бензилоксигруппы, заместители могут быть превращены в гидроксильные группы при взаимодействии соединения с бромисто-водородной кислотой, иодисто-водородной кислотой, хлористо-водородной кислотой, серной кислотой и т. п., в присутствии или в отсутствие подходящего растворителя. Примерами растворителей являются уксусная кислота и вода, которые могут использоваться по отдельности или в смеси. При осуществлении реакции бромисто-водородную кислоту, иодисто-водородную кислоту, хлористо-водородную кислоту или серную кислоту используют в количестве 0,1 - 1000 частей (об/вес), предпочтительно - 5 - 100 частей (об/вес), от количества низших алкоксигрупп или бензилоксигрупп. Температура реакции лежит в интервале 0 - 200oC, предпочтительно 50 - 150oC, и время реакции составляет от 0,1 до 100 часов, предпочтительно 0,5 - 60 часов. Такие условия являются благоприятными для протекания реакции.
Когда кольцо A или кольцо B соединения формулы (1), полученного по схеме реакции 1, содержит в качестве заместителя нитрогруппу, нитрогруппа при желании может быть превращена в аминогруппу путем восстановления. Реакцию восстановления можно осуществить в подходящем растворителе, используя хлорид олова, в присутствии гидрохлорида. Примерами растворителя являются метанол, этанол и подобные спирты, диметилформамид и т.п. При осуществлении реакции молярное количество используемого гидрохлорида составляет предпочтительно 1 - 100-кратное от молярного количества нитрогруппы, и молярное количество используемого хлорида олова составляет предпочтительно 1 - 10-кратное от молярного количества нитрогруппы. Температура реакции лежит в интервале 0 - 50oC, и время реакции составляет 0,1 - 100 часов, предпочтительно 1 - 12 часов. Такие условия являются благоприятными для протекания реакции.
Когда кольцо A или кольцо B соединения формулы (1), полученного в соответствии со схемой реакции 1, содержит в качестве заместителей гидроксильные группы, при желании гидроксильные группы можно превратить в алкоксигруппы, бензилоксигруппы или ацилоксигруппы посредством алкилирования, бензилирования или ацилирования соответственно. Реакция алкилирования и реакция бензилирования могут осуществляться в подходящем растворителе при воздействии алкилирующего агента или агента бензилирования, к тому же, в присутствии основания. Примерами растворителей являются диметоксиэтан, диоксан, тетрагидрофуран, диметилформамид, ацетон и т.п. Примерами основания являются карбонат калия, карбонат натрия, гидроксид калия и т.п. Примерами агента алкилирования являются галогениды, сульфат-эфиры и сульфонат-эфиры необязательно замещенных алканов. Примерами агентов бензилирования являются бензилгалогениды и т.п. При осуществлении реакции молярное количество используемого основания составляет 1 - 5-кратное, и молярное количество используемого агента алкилирования или агента бензилирования составляет 1 - 5-кратное от молярного количества гидроксильных групп. Температура реакции лежит в интервале 0 - 80oC, и время реакции составляет 0,1 - 24 часа, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
Когда R в соединении формулы (1), полученном в соответствии со схемой реакции 1, содержит аминогруппу, замещенную низшей алкильной группой, аминогруппа, замещенная низшей алкильной группой, может быть превращена в аминооксидную группу, замещенную низшей алкильной группой, при взаимодействии аминогруппы с окислителем в подходящем растворителе. Растворитель не имеет особых ограничений, если он не оказывает вредного влияния на ход реакции. Примерами растворителей являются эфир, тетрагидрофуран и подобные простые эфиры, метиленхлорид, хлороформ и подобные галогенированные углеводороды, ацетон, метилэтилкетон и подобные алкилкетоны, метанол, этанол и подобные спирты, N,N-диметилформамид, диметилсульфоксид, ацетонитрил и подобные апротонные полярные растворители, уксусная кислота, вода и т.п., которые могут использоваться по отдельности или в виде смесей двух или нескольких из них. Окислители не имеют особых ограничений, но включают диоксид марганца, гипохлорит натрия, CAN /церий (IV)аммонийнитрат/, DDQ /2,3-дихлор-5,6-дициано-1,4-бензохинон/, хлоранил /2,3,5,6-тетрахлор-1,4-бензохинин/, комплекс ДМСО-пиридин-триоксид серы, реагент Джонса (Jones), пиридиний-хлорхромат, пиридинийдихромат, диметилсульфоксид-оксалилхлорид, пероксид водорода, трет-бутилгидропероксид и подобные пероксиды, пермуравьиную кислоту, перуксусную кислоту, м-хлорпербензойную кислоту и подобные перкислоты (надкислоты), которые могут использоваться по отдельности или в смесях друг с другом.
При осуществлении реакции окисляющий агент используют в количестве 1 - 100 эквивалентов, предпочтительно 1 - 10 эквивалентов соединения, изображаемого формулой (1). Температура реакции колеблется от температуры при охлаждении льдом до температуры кипения растворителя, и время реакции составляет 0,1 - 96 часов, предпочтительно - от 0,1 до 1 часа. Такие условия являются благоприятными для протекания реакции.
Реакцию ацилирования осуществляют путем взаимодействия соединения с нужной карбоновой кислотой или с ее реакционноспособным производным. Когда используют реакционноспособные производные, реакцию проводят в подходящем растворителе, необязательно в присутствии основания для ускорения реакции, хотя условия реакции изменяются в соответствии с видом реакционноспособных производных и исходных фенольных производных. Примерами реакционноспособных производных являются ангидриды кислот, смешанные ангидриды, хлорангидриды кислот и т.п. Примерами растворителей являются хлороформ, дихлорметан, диоксан, тетрагидрофуран, диметилформамид, пиридин и т.п. Примерами оснований являются бикарбонат натрия, бикарбонат калия, триэтиламин, пиридин, 4-диметиламинопиридин и т.п. При осуществлении реакции используемое молярное количество предпочтительно составляет для основания 1 - 5-кратное, для ацилирующего агента 1 - 5-кратное от молярного количества гидроксильной группы. Температура реакции находится в интервале 0 - 50oC, и время реакции составляет 0,1 - 24 часа, предпочтительно - 0,5 - 3 часа. Такие условия являются благоприятными для протекания реакции.
Когда кольцо A или кольцо B соединения формулы (1), полученного в соответствии со схемой реакции 1, содержит аминогруппу в качестве заместителя, аминогруппа при желании может быть превращена в ациламиногруппу посредством ацилирования. Реакцию ацилирования осуществляют путем реакции с нужной карбоновой кислотой или ее реакционноспособным производным. Когда используют реакционноспособные производные, реакцию проводят в подходящем растворителе, необязательно в присутствии основания для ускорения реакции, хотя условия реакции изменяются в соответствии с видом реакционноспособных производных и исходных анилинпроизводных. Примерами реакционноспособных производных являются ангидриды кислот, смешанные ангидриды, хлорангидриды и т.п. Примерами растворителей являются хлороформ, дихлорметан, диоксан, тетрагидрофуран, диметилформамид и т. п. Примерами оснований являются бикарбонат натрия, карбонат натрия, карбонат калия, триэтиламин, пиридин, 4-диметиламинопиридин и т. п. При осуществлении реакции используемое молярное количество составляет предпочтительно для основания 1 - 5-кратное, для ацилирующего агента 1 - 5-кратное от молярного количества аминогруппы. Температура реакции находится в интервале 0 - 50oC, и время реакции составляет 0,1 - 100 часов, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
В соединение формулы (1), полученное по схеме реакции 1, посредством реакции нитрования можно ввести нитрогруппы. Реакцию нитрования проводят используя нитрирующий агент, такой как дымящая азотная кислота и азотная кислота в присутствии или в отсутствие серной кислоты. При осуществлении реакции молярное количество используемого агента нитрования составляет предпочтительно 1 - 100 частей от молярного количества соединения формулы (1). Температура реакции находится в интервале 0 - 30oC, и время реакции составляет 0,1 - 20 часов, предпочтительно 0,5 - 5 часов. Такие условия являются благоприятными для протекания реакции.
Когда R в соединении формулы (1), полученном в соответствии со схемой реакции 1, содержит защитные группы, такие как бензилоксикарбонильная группа, низшая ацильная группа и т.п., защитные группы могут быть удалены при взаимодействии защитной группы с бромисто-водородной кислотой, иодисто-водородной кислотой, хлористо-водородной кислотой, серной кислотой и т.п. в подходящем растворителе или без растворителя. К числу растворителей относятся уксусная кислота, вода и т.п., которые используются по отдельности или в виде смеси двух или большего их числа.
При осуществлении реакции бромисто-водородную кислоту, иодисто-водородную кислоту, хлористо-водородную кислоту, серную кислоту и т.п. используют в количестве, составляющем 1 - 1000 (об/вес), предпочтительно - 5 - 100 (об/вес) частей от количества защитной группы. Температура реакции находится в интервале 0 - 200oC, предпочтительно - 50 - 150oC, и время реакции составляет 0,1 - 100 часов, предпочтительно - 0,5 - 60 часов. Такие условия являются благоприятными для протекания реакции.
Соединения изобретения, полученные упомянутыми реакциями, могут быть превращены в свои соли в соответствии с обычными способами, при взаимодействии соединений с упомянутыми органическими или неорганическими кислотами, в подходящих растворителях. Примерами растворителей являются вода, метанол, этанол, дихлорметан, тетрагидрофуран и т.п. Температура реакции находится предпочтительно в интервале 0 - 50oC.
Производные 6-галогениндено/2,1-с/хинолина формулы 1, используемые в качестве исходных веществ в реакции по схеме 1, могут быть получены в соответствии со способом, описанным в J. Heterocyclic Chem., 28, 1809 (1991), или по схемe 2 и 3, см. ниже.
В схеме реакций 2 (см. в конце описания) кольцо A, кольцо B и X являются такими, как определены выше. R4 представляет собой низшую алкильную группу.
Стадия B
Карбоновая кислота формулы (4) может быть получена гидролизом соединения формулы (3) в подходящем растворителе в присутствии основания.
Соединение формулы (3) может быть получено по способу, раскрытому в не прошедшей экспертизу патентной публикации Японии N 3-223254.
Примеры растворителей специально не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают метанол, этанол, пропанол и подобные спирты, диоксан, тетрагидрофуран, диметоксиэтан и подобные простые эфиры, и воду, которые используются по отдельности или в виде смесей двух или большего их числа. Примерами оснований являются гидроксид натрия, гидроксид калия, гидроксид бария и подобные гидроксиды щелочных и щелочно-земельных металлов.
При осуществлении реакции молярное количество используемого основания составляет предпочтительно 1 - 10 частей от молярного количества соединения формулы (3). Температура реакции находится в интервале 0 - 100oC, предпочтительно 50 - 100oC, и время реакции составляет 0,5 - 100 часов, предпочтительно 1 - 50 часов. Такие условия являются благоприятными для протекания реакции.
Стадия C
Соединения формулы (5) или (6) могут быть получены путем взаимодействия галогенирующего агента с соединениями формулы (3) или (4), обычно в отсутствие растворителя или необязательно в инертном растворителе соответственно. Примеры инертного растворителя специально не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают хлороформ, бензол, толуол, ксилол и т.п. Примерами галогенирующих агентов являются тионилхлорид, тионилбромид, оксихлорид, хлорид фосфора, бромид фосфора, пентахлорид фосфора, пентабромид фосфора и т.п. Для ускорения реакции могут быть добавлены пиридин или диметилформамид.
При осуществлении реакции молярное количество используемого галогенирующего агента составляет предпочтительно 1 - 100 частей от молярного количества соединения формулы (3) или (4). Температура реакции находится в интервале 0 - 200oC, предпочтительно 50 - 150oC, и время реакции составляет 0,5 - 100 часов, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
Соединение формулы (5) или формулы (6) необязательно выделяют и очищают, но их можно использовать на следующей стадии без очистки.
Стадия D
Соединение формулы (2a) получают взаимодействием соединения формулы (5) или формулы (6), полученного на стадии C, с протонной кислотой или кислотой Льюиса в отсутствие растворителя или необязательно в присутствии инертного растворителя.
Примеры инертного растворителя специально не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают нитробензол, ксилол, дихлорметан, тетрахлорид углерода и т.п. Примерами протонных кислот являются серная кислота, фосфорная кислота, полифосфорная кислота, бромисто-водородная кислота и т.п. Примерами кислоты Льюиса являются хлорид алюминия, хлорид олова, хлорид железа и т.п.
При осуществлении реакции молярное количество используемой протонной кислоты или кислоты Льюиса составляет 1 - 1000-кратное, предпочтительно 1 - 100-кратное количество от молярного количества соединения формулы (5) или (6). Температура реакции находится в пределах 0 - 200oC, и время реакции составляет 0,5 - 50 часов, предпочтительно 0,5 - 20 часов. Такие условия являются благоприятными для протекания реакции.
В схеме реакций 3 (см. в конце описания) кольцо A, кольцо B, X и R4 являются такими, как определены выше. R5 представляет собой низшую алкильную группу.
Стадия E
Соединение формулы (9) получают взаимодействием соединения формулы (7) с соединением формулы (8), обычно в подходящем растворителе.
Примеры растворителей специально не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают метанол, этанол, пропанол и подобные спирты, бензол, толуол, ксилол, диоксан, тетрагидрофуран и т.п.
При осуществлении реакции молярное количество используемого соединения (8) составляет предпочтительно 0,5 - 2-кратное количество молярного количества соединения формулы (7). Температура реакции находится в пределах 20 - 150oC, предпочтительно 90 - 130oC. Время реакции составляет 0,1 - 50 часов, предпочтительно 0,1 - 2 часа. Такие условия являются благоприятными для протекания реакции.
Стадия F
Соединение формулы (10) получают путем взаимодействия соединения формулы (9), полученного на стадии E, с протонной кислотой обычно в отсутствие растворителя, необязательно в присутствии инертного растворителя.
Примеры инертного растворителя специально не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают нитробензол, ксилол и т.п. Примерами протонных кислот являются серная кислота, фосфорная кислота, полифосфорная кислота, бромисто-водородная кислота и т.п.
При осуществлении реакции количество используемой протонной кислоты является таким же, как количество растворителя, и составляет предпочтительно 5 - 15-кратное количество от соединения формулы (9). Температура реакции находится в интервале 90 - 150oC. Время реакции составляет 0,5 - 50 часов, предпочтительно 1 - 10 часов. Такие условия являются благоприятными для протекания реакции.
Стадия G
Соединение формулы (10) также получают путем взаимодействия соединения формулы (3) или (4) с протонной кислотой обычно в отсутствие растворителя, необязательно в присутствии инертного растворителя.
Примеры инертного растворителя для этой реакции особенно не ограничиваются, если растворитель не оказывает вредного влияния на ход реакции, и включают нитробензол, ксилол и т.п. Примерами протонных кислот являются серная кислота, фосфорная кислота, полифосфорная кислота, бромисто-водородная кислота и т.п.
При осуществлении реакции количество используемой протонной кислоты составляет, как и количество растворителя, предпочтительно 5 - 15-кратное количество от соединения формулы (3) или (4). Температура реакции находится в пределах 50 - 200oC. Время реакции составляет 0,5 - 50 часов, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
Стадия H
Соединение формулы (2a) получают путем взаимодействия соединения формулы (10), полученного на стадии F или на стадии G, с галогенирующим агентом обычно в отсутствие растворителя, необязательно в присутствии инертного растворителя.
Примеры инертных растворителей не имеют особых ограничений, если растворитель не оказывает вредного влияния на ход реакции, но включают хлороформ, бензол, толуол, ксилол и т.п. Примерами галогенирующих агентов являются тионилхлорид, тионилбромид, оксихлорид фосфора, хлорид фосфора, бромид фосфора, пентахлорид фосфора, пентабромид фосфора и т.п. Для ускорения реакции могут использоваться пиридин, диметилформамид и т.п.
При осуществлении реакции молярное количество используемого галогенирующего агента составляет предпочтительно 1 - 100-кратное от молярного количества соединения формулы (10). Температура реакции находится в интервале 0 - 200oC, предпочтительно - 50 - 150oC. Время реакции составляет 0,5 - 50 часов, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
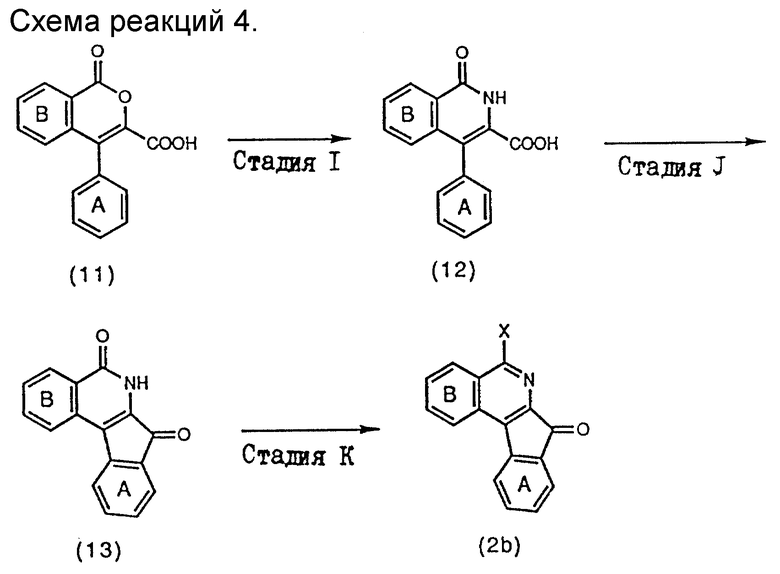
Производные 5-галогениндено/2,1-с/изохинолина, изображаемые формулой (2), которые используются в качестве исходных веществ в схеме реакций 1, могут быть получены в соответствии со схемой реакций 4, приведенной ниже.
В схеме реакций 4 (см. в конце описания) кольцо A, кольцо B и X являются такими, как определено выше.
Стадия I
Карбоновую кислоту формулы (12) получают путем обработки соединения формулы (11) аммиаком в инертном растворителе. Реакция может быть осуществлена по известному способу, раскрытому в Bolletino Chimico Farmaceutico, 125, 437 (1986).
Кроме того, соединения формулы (11) можно синтезировать в соответствии с описанием в Boll. Sedute Accad. Gioenia Sci. Nat. Catania, 6, 606 (1960) или по публикации не прошедшего экспертизу патента Японии N 5-132463.
Примеры растворителей не имеют особых ограничений, если растворитель не оказывает вредного влияния на ход реакции, но включают метанол, этанол, пропанол и подобные спирты и т.п.
При осуществлении реакции молярное количество используемого аммиака составляет 1 - 1000-кратное, предпочтительно 10 - 100-кратное от молярного количества соединения формулы (11). Температура реакции находится в интервале 0 - 100oC, предпочтительно - около комнатной температуры, и время реакции составляет 0,5 - 100 часов, предпочтительно 2 - 20 часов. Такие условия являются благоприятными для протекания реакции.
Стадия J
Соединения формулы (13) получают путем взаимодействия соединений формулы (12), получаемых на стадии 1, с протонной кислотой или кислотой Льюиса в отсутствие растворителя или необязательно в присутствии инертного растворителя.
Примеры инертных растворителей не имеют особых ограничений, если растворитель не оказывает вредного влияния на ход реакции, и включают нитробензол, дисульфид углерода, нитропарафин, хлорэтилен, дихлорметан и т.п. Примеры протонных кислот включают фтористый водород, серную кислоту, фосфорную кислоту, оксид фосфора, полифосфорную кислоту и т.п. Примерами кислот Льюиса являются хлорид алюминия, хлорид железа, хлорид олова (4), хлорид цинка, фторид бора и т.п.
При осуществлении реакции молярное количество протонной кислоты составляет 5 - 15-кратное, а кислоты Льюиса 1 - 10-кратное от молярного количества соединения формулы (12). Температура реакции находится в интервале 0 - 200oC, и время реакции составляет 0,5 - 50 часов, предпочтительно 0,5 - 20 часов. Такие условия являются благоприятными для протекания реакции.
Стадия K
Соединения формулы (2b) получают путем взаимодействия соединения формулы (13), полученного на стадии J, с галогенирующим агентом обычно в отсутствие растворителя, необязательно в присутствии инертного растворителя.
Примеры инертных растворителей не имеют особых ограничений, если растворитель не оказывает вредного влияния на ход реакции, и включают хлороформ, бензол, толуол, ксилол и т.п. Примерами галогенирующих агентов являются тионилхлорид, тионилбромид, оксихлорид фосфора, хлорид фосфора, бромид фосфора, пентахлорид фосфора, пентабромид фосфора и т.п. Для ускорения реакции могут добавляться пиридин, диметилформамид и т.п.
При осуществлении реакции молярное количество используемого галогенирующего агента составляет предпочтительно 1 - 100-кратное от молярного количества соединения формулы (13). Температура реакции находится в интервале 0 - 200oC, предпочтительно - 50 - 150oC. Время реакции составляет 0,5 - 50 часов, предпочтительно 0,5 - 10 часов. Такие условия являются благоприятными для протекания реакции.
Соединения изобретения и другие соединения, получаемые по какому-либо из вышеупомянутых способов, могут быть извлечены и очищены обычными приемами отделения и очистки, применяемыми в соответствующей области техники, например путем концентрации, экстрагирования растворителем, фильтрацией, перекристаллизацией, различными хроматографическими способами и т.д.
Когда соединения изобретения используют в качестве лекарственных препаратов для случая злокачественных опухолей у млекопитающих, соединения могут быть приготовлены в виде различных фармацевтических лекарственных форм в соответствии с целями лечения. Примерами фармацевтических лекарственных форм являются препараты для перорального введения, такие как таблетки, таблетки с покрытием, пилюли, порошки, гранулы, капсулы, жидкости, суспензии, эмульсии, и препараты для парентерального введения, такие как инъекции, суппозитории, мази, пластыри и т.п. Такие препараты могут быть составлены способами, известными или обычными для специалистов в этой области техники.
При составлении композиций в форме таблеток в качестве носителей используют эксципиенты, такие как лактоза, сахароза, хлорид натрия, глюкоза, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза и кремниевая кислота; связующие, такие как обыкновенный сироп, раствор глюкозы, раствор крахмала, желатиновый раствор, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, фосфат калия и поливинилпирролидон; дезинтеграторы, такие как сухой крахмал, альгинат натрия, порошок агара, измельченный в порошок ламинаран, бикарбонат натрия, карбонат кальция, полиоксиэтиленсорбитановые эфиры жирных кислот, лаурилсульфат натрия, моноглицериды стеариновой кислоты, масло какао, гидрогенизированное масло; промоторы абсорбции, такие как четвертичные аммониевые основания, лаурилсульфат натрия; увлажнители, такие как глицерин, крахмал; адсорбенты, такие как крахмал, лактат, каолин, бентонит, коллоидный диоксид кремния; смазки, такие как очищенный тальк, соли стеариновой кислоты, бура и полиэтиленгликоль. Таблетки могут быть необязательно изготовлены в виде таблеток, на которые нанесены обычные покрытия, такие как таблетки с сахарным покрытием, таблетки с желатиновым покрытием, таблетки с энтеросолюбильным покрытием, таблетки с пленочным покрытием, таблетки двухслойные, многослойные таблетки и т.п.
При составлении пилюль в качестве носителей используют эксципиенты, такие как глюкоза, лактоза, крахмал, масло какао, гидрогенизированные растительные масла, каолин, тальк; связующие, такие как порошок аравийской камеди, порошок трагаканта, желатин; дезинтеграторы, такие как ламинаран, агар.
Капсулы могут быть изготовлены обычными способами, путем смешения соединения изобретения с упомянутыми носителями, с последующим заполнением смесью твердой желатиновой капсулы, мягкой эластичной капсулы и т.п.
Для композиций суппозиториев в качестве носителей используют полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и т.п.
При приготовлении инъекций жидкости, эмульсии и суспензии являются предпочтительно стерильными и изотоническими для крови. При составлении упомянутых препаратов используют разбавители, такие как вода, этанол, макрогол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, полиоксиэтиленсорбитановые эфиры жирных кислот и т.п. К лекарственным препаратам добавляют не только хлорид натрия, глюкозу и глицерин в количестве, достаточном для получения изотонического раствора, но также традиционные солюбилизаторы, буферы, местные анестетики и т.п.
Мази могут быть приготовлены обычными способами путем необязательного смешивания с соединением изобретения основы, стабилизатора, смачивателя, консерванта и т. п., и получающуюся в результате композицию смешивают, чтобы получить препараты-мази. Примерами основы являются жидкий парафин, белый вазелин, белый пчелиный воск, парафин и т.п. Примерами консервантов являются метил-4-гидроксибензоат, этил-4-гидроксибензоат, пропил-4-гидроксибензоат и т.п.
Пластыри готовят путем нанесения упомянутых мазей, паст, кремов, гелей и т.п. на обычные носители. Примерами носителей /подложек/ являются подходящим образом сотканные ткани и нетканые материалы, изготовленные из хлопка, штапельного волокна или некоторых других химических волокон, пленки, или листы пенопласта, изготовленные из пластифицированного поливинилхлорида, полиэтилена, полиуретана и т.п.
К формулировкам лекарственных препаратов могут добавляться необязательно окрашивающие вещества, консерванты, отдушки, вкусовые добавки, подслащиватели и другие лекарственные средства.
Количество соединений изобретения в формулировках лекарственных препаратов конкретно не ограничивается, но составляет обычно 1 - 70 мас.% лекарственного препарата.
Способ введения упомянутых лекарственных препаратов особенно не ограничивается, но будет должным образом определяться типом препарата, возрастом, полом и другими данными пациента, тяжестью заболевания и т.п. Например, таблетки, пилюли, жидкости, суспензии, эмульсии, гранулы, капсулы вводят перорально. Инъекции дают внутривенно, отдельно или в смеси с традиционными добавками, такими как глюкоза, аминокислоты и пр. Инъекции могут вводиться внутримышечно, внутрикожно, подкожно или интраперитонеально в виде только этого препарата. Суппозитории вводят в прямую кишку. Мази наносят на кожу, на слизистую оболочку носа (oris) и т.п.
Количество соединения настоящего изобретения, которое включают в каждую дозированную единицу, изменяется в зависимости от симптомов у пациента или типа препарата. Предпочтительное количество на единицу введения составляет от 1 до 1000 мг для пероральных препаратов, от 0,1 до 500 мг для инъекций, или от 5 до 1000 мг для суппозиториев. Суточная дозировка лекарственного средства в вышеупомянутых лекарственных формах меняется в соответствии с симптомами, массой тела, возрастом, полом и другими данными пациента, но обычно находится в интервале от 0,1 до 5000 мг, предпочтительно - от 1 до 1000 мг, для взрослого человека. Препарат вводят предпочтительно в виде единичной дозы или разделяют на две - четыре дозы.
Примеры злокачественных опухолей, которые лечат путем введения препаратов, содержащих соединения изобретения, не ограничиваются конкретно, но к ним относятся рак головы и шеи, эзофагиальная карцинома, рак желудка, рак толстой кишки, рак прямой кишки, рак печени, рак желчного пузыря или холангиома, рак поджелудочной железы, рак легких, рак молочной железы, рак яичников, рак мочевого пузыря, рак предстательной железы, рак семенников, остеохондрома, злокачественная лимфома, лейкоз, цервикальный рак, рак кожи, рак головного мозга и т.п.
Наилучший вариант осуществления изобретения
Ниже приводятся ссылочные примеры, примеры, примеры фармакологических испытаний и примеры лекарственных форм по настоящему изобретению.
Ссылочный пример 1
Синтез 1,2-дигидро-4-(3,4- метилендиоксифенил)-2-оксо-3-хинолинкарбоновой кислоты.
Смесь этилового эфира 1, 2-дигидро-4-(3,4-метилендиоксифенил)-2-оксо-3-хинолинкарбоновой кислоты (40 г, 118,6 ммоль), метанола (200 мл), воды (300 мл) и гидроксида калия (33,3 г, 593,5 ммоль) кипятят с обратным холодильником в течение 40 часов. К реакционной смеси добавляют 110 мл 6N HCl, чтобы подкислить смесь, и отделяют выпавшие кристаллы фильтрацией. Полученные кристаллы промывают диэтиловым эфиром, и получают 35 г (выход 95,4%) названного в заголовке соединения.
Т.пл. 247 - 250oC (разл.).
1H ЯМР (ДМСО-d6) δ: 7,45 (1H, м.), 7,35 (1H, д., j=8 Гц), 7,13 (1H, м.), 7,06 (1H, д., j=8 Гц), 6,98 (1H, д., j=8 Гц), 6,87 (1H, с.), 6,76 (1H, д., j=8 Гц), 6,08 (2H, с.).
ИК (KBr) см-1 : 3440, 1646, 1577, I486, 1441, 1395, 1238, 1039.
Ссылочный пример 2
Синтез 6-хлор-9,10-метилендиокси-7H-индено/2,1-с/хинолин-7-она.
Смесь 1,2-дигидро-4-(3,4-метилендиоксифенил) -2-оксо-3-хинолинкарбоновой кислоты, полученной в ссылочном примере 1 (10 г, 32,3 ммоль), и оксихлорида фосфора (100 мл, 1,07 моль) кипятят с обратным холодильником в течение 4 часов. Реакционную смесь перегоняют до сухого остатка, и несколько раз промывают н-гексаном. К полученному остатку добавляют 50 г полифосфорной кислоты, и смесь нагревают при 90oC в течение 2 часов. Реакционную смесь выливают в смесь воды со льдом, и отфильтровывают выпавшие кристаллы. Полученные кристаллы растворяют в тетрагидрофуране, отфильтровывают нерастворившиеся вещества, очищают колоночной хроматографией на силикагеле (элюент хлороформ) и получают 6,0 г (выход 59,9%) названного в заголовке соединения.
Т. пл. 265 - 270oC.
1H ЯМР (CDCl3) δ: 8,34 (1H, д., j=8 Гц), 8,04 (1H, д., j=8 Гц), 7,84 (1H, д. -д., j=8,7 Гц), 7,66 (1H, д.-д., j=8 Гц), 7,58 (1H, с.,), 7,23 (1H, с.), 6,17 (2H, с.).
ИК (KBr) см-1: 3450, 1713, 1556, 1504, 1478, 1420, 1384, 1335, 1266, 1037.
Ссылочный пример 3
Синтез 1,2-дигидро-4-фенил-2-оксо-3-хинолинкарбоновой кислоты.
Смесь этилового эфира 1,2- дигидро-4-фенил-2-оксо-3-хинолинкарбоновой кислоты (5 г, 17 ммоль), этанола (20 мл), воды (40 мл) и гидроксида калия (5 г, 89 ммоль) кипятят с обратным холодильником в течение 1,5 часов. К реакционной смеси добавляют 60 мл 2N HCl, чтобы ее подкислить, и отделяют выпавшие кристаллы фильтрацией. Полученные кристаллы перекристаллизовывают из этанола и получают 4,2 г (выход 92,9%) названного в заголовке соединения.
Т. пл. 246 - 254oC (разл.).
1H ЯМР (ДМСО-d6) δ: 13,10 (1H, ш.с.), 12,28 (1H, с.), 7,60-7,05 (9H, м. ).
ИК (KBr) см-1: 3000, 2970, 2950, 2880, 2850, 2840, 2790, 1699, 1653, 1608, 1598, 1557, 1506, 1488, 1435, 1411, 1262, 1100, 753, 709, 591.
Ссылочный пример 4
Синтез 5H-индено/2,1-с/хинолин-6,7-диона.
Смесь 1,2-дигидро-4-фенил-2-оксо-3-хинолинкарбоновой кислоты, полученной в ссылочном примере 3 (2 г, 7,5 ммоль), и полифосфорной кислоты (20 г) вводят в реакцию при 130oC в течение 4 часов. Реакционную смесь выливают в воду со льдом, и отделяют фильтрацией выпавшие кристаллы. Полученные кристаллы переосаждают с метанолом, и получают 1,7 г (выход 91,2%) названного в заголовке соединения.
Т. пл. >290oC.
1H ЯМР (ДМCО-d6) δ: 12,12 (1H, ш.с.), 8,55 (1H, д., j=8 Гц), 8,40 (1H, д., j=8 Гц), 7,78-7,33 (6H, м.).
ИК (KBr) см-1: 2860, 1724, 1652, 1618, 1601, 1585, 1503, 1484, 1404, 763, 743, 576.
Ссылочный пример 5
Синтез 3-метил-5H-индено/2,1-с/хинолин-6,7-диона.
Смесь этилового эфира 1,2-дигидро- 4-фенил-7-метил-2-оксо-3-хинолинкарбоновой кислоты (2,5 г, 8,1 ммоль) и концентрированной серной кислоты (20 мл) перемешивают при нагревании при 95oC в течение 10 часов. Реакционную смесь выливают в смесь воды со льдом, и отделяют фильтрацией выпавшие кристаллы. Полученные кристаллы промывают водой и метанолом в такой последовательности, и получают 1,5 г (выход 70,6%) названного в заголовке соединения.
Т. пл. >290oC.
1H ЯМР (ДМCО-d6) δ: 12,03 (1H, ш.с.), 8,41 (1H, д., j=8 Гц), 8,36 (1H, д., j= 7 Гц), 7,70-7,17 (5H, м.), 2,44 (3H, с.).
ИК (KBr) см-1: 3440, 1711, 1643, 1599, 1580, 1543, 1481, 1465, 1437, 1404.
Ссылочный пример 6
Синтез 6-хлор-3-метил-7H-индено/2,1-с/хинолин-7-она/
Смесь 3-метил-5H-индено/2,1-с/хинолин-6,7-диона, полученного в ссылочном примере 5 (700 мг, 2,7 ммоль), и оксихлорида фосфора (10 мл, 107 ммоль) кипятят с обратным холодильником в течение 1,5 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют воду, чтобы после фильтрации получить выпавшие кристаллы. Полученные кристаллы промывают водой и растворяют в хлороформе, и отфильтровывают нерастворившиеся вещества. Перекристаллизацией из бензола получают 550 мг (выход 73,4%) названного в заголовке соединения.
Т. пл. 208 - 211oC.
1H ЯМР (CDCl3) δ: 8,38 ( 1H, д., j=9 Гц), 8,13 (1H, д., j=7 Гц), 7,85 (1H, с.), 7,80 (1H, д., j=6 Гц), 7,64 (1H, д.-д.-д., j=8, 8,1 Гц), 7,56-7,50 (2H, м.), 2,60 (3H, с.).
ИК (KBr) см-1: 1718, 1623, 1557, 1494, 1460, 1413, 1064, 915, 867, 755, 715.
Ссылочный пример 7
Синтез 1,3- диоксо-3'-метокси-2-инданкарбоксианилида.
К суспензии 2- этоксикарбонил-1,3-индандиона (2,7 г, 12,5 ммоль) в толуоле (100 мл) добавляют м-анизидин (1,7 г, 13,8 ммоль), и смесь кипятят с обратным холодильником в течение 0,5 часа. Отгоняют приблизительно половину количества растворителя, и получают фильтрацией выпавшие кристаллы. Полученные кристаллы перекристаллизовывают из этанола, и получают 1,7 г (выход 46,0%) названного в заголовке соединения.
Т. пл. 128 - 138oC.
1H ЯМР (CDCl3) δ: 9,52 (1H, ш.с.), 7,70-7,55 (4H, м.), 7,31 (1H, д., j= 8 Гц), 7,17 (1H, д.-д., j=2,2 Гц), 7,10-6,74 (2H, м.), 3,84 (1H, с.).
ИК (KBr) см-1: 1658, 1604, 1584, 1563, 1537, 1496, 1455, 1416.
Ссылочный пример 8
Синтез 3-метокси-5H-индено/2,1-с/хинолин-6,7-диона.
Смесь 1,3-диоксо-3'-метокси-2-инданкарбоксианилида (1,6 г, 5,4 ммоль), полученного в ссылочном примере 7, и полифосфорной кислоты (18 г) реагирует при 120oC в течение 1,5 часов. Реакционную смесь выливают в смесь воды со льдом, и получают фильтрацией выпавшие кристаллы. Полученные кристаллы промывают тетрагидрофураном, и получают 1,0 г (выход 66,6%) названного в заголовке соединения.
Т.пл. 236 - 246oC (разл.).
1H ЯМР (ДМСО-d6) δ: 8,48 (1H, д. , j=9 Гц), 8,35 (1H, д., j=7 Гц), 7,71-7,55 (3H, м.), 6,99-6,92 (2H, м), 3,90 (3H, с.).
ИК (KBr) см-1: 1705, 1640, 1621, 1585, 1480, 1415, 1394,
Ссылочный пример 9
Синтез 6-хлор-3-метокси-7H-индено/2,1-с/хинолин-7-она.
Смесь 3-метокси-5H-индено/2,1-с/хинолин-6,7-диона (550 мг, 2,0 ммоль), полученного в ссылочном примере 8, и оксихлорида фосфора (20 мл, 214 ммоль) кипятят с обратным холодильником в присутствии каталитического количества N, N-диметилформамида в течение 4 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют воду, и получают фильтрацией выпавшие кристаллы. Полученные кристаллы растворяют в хлороформе, и отфильтровывают нерастворившиеся вещества. Перекристаллизацией из бензола получают 460 мг ( выход 78,4%) названного в заголовке соединения.
Т.пл. 261 - 266oC.
1H ЯМР (CDCl3) δ: 8,39 (1H, д., j=9 Гц), 8,11 (1H, д., j=8 Гц), 7,81 (1H, м.), 7,64 (1H, д.-д.-д., j=8, 8,1 Гц), 7,53 (1H, м.),7,41 (1H, д., j= 2 Гц), 7,33 (1H, д.-д., j=9,2 Гц), 4,00 (3H, с.).
ИК (KBr) см-1: 1706, 1618, 1564, 1496, 1474, 1464, 1428, 1208, 1186, 1157, 1122, 1060, 1012,
Ссылочный пример 10
Синтез этилового эфира 1,2-дигидро-7-метокси-4-фенил-2-оксо-3-хинолинкарбоновой кислоты.
Смесь 2-амино-4-метоксибензофенона /20 г, 88 ммоль/, диэтилмалоната /26,7 мл, 176 ммоль/, 1,8-диазабицикло /5,2,0/-ундека-7-ена /ДБУ/ /0,66 мл, 4,4 ммоль/ перемешивают при нагревании при 160oC в течение 2 часов. Реакционную смесь охлаждают на воздухе. К охлажденной смеси добавляют этанол /30 мл/, и извлекают фильтрацией выпавшие кристаллы. Полученные кристаллы промывают этанолом, и получают 25,7 г /выход 90,2%/ названного в заголовке соединения.
Т.пл. 175 - 177oC.
1H ЯМР (CDCl3) δ: 12,60 (1H, ш.с.), 7,48-7,35 (5H, м.), 7,18 (lH, д., j= 9 Гц), 6,91 (1H, д., j=3 Гц), 6,72 (lH, д.-д., j=9, 3 Гц), 4,08 (2H, к., j=7 Гц), 3,90 (3H, с.), 0,97 (3H, т., j=7 Гц).
ИК (KBr) см-1: 2980, 2940, 1735, 1642, 1597, 1516, 1238, 1213, 1094.
Ссылочный пример 11
Синтез 1,2-дигидро-7-метокси-4-фенил-2-оксо-3-хинолинкарбоновой кислоты.
Этиловый эфир 1,2-дигидро-7-метокси-4-фенил-2-оксо-3-хинолинкарбоновой кислоты /3,0 г/, получен в ссылочном примере 10, вводят во взаимодействие и обрабатывают по такой же методике, какая изложена в ссылочном примере 1, продукт промывают этанолом, и получают 2,7 г /выход 99,0%/ названного в заголовке соединения.
Т.пл. 292 - 294oC.
1H ЯМП (ДМСО-d6) δ: 13,23 (1H, с.), 12,25 (1H, с.), 7,54-7,44 (3H, м.), 7,31-7,27 (2H, м.), 6,99-6,90 (2H, м.), 6,80 (1H, м.), 3,83 (3H, с.).
ИК (KBr) см-1: 3170, 1731, 1625, 1476, 1403, 1243, 1212, 847.
Ссылочный пример 12
Синтез 6-хлор-3-метокси-7H- индено/2,1-с/хинолин-7-она (другой способ).
Упомянутую 1,2-дигидро-7- метокси-4-фенил-2-оксо-3-хинолин-карбоновую кислоту, полученную в ссылочном примере 11, вводят во взаимодействие и обрабатывают по той же методике, какая изложена в ссылочном примере 2, и получают названное в заголовке соединение. Физико-химические свойства полученного соединения аналогичны свойствам соединения ссылочного примера 9.
Ссылочный пример 13
Синтез 6-хлор-3-гидрокси-7H-индено/2,1- с/хинолин-7-она.
Смесь 6-хлор-3-метокси-7H-индено/2,1-с/хинолин-7-она (10,0 г, 33,8 ммоль), полученного в ссылочном примере 9, и 100 мл конц. серной кислоты перемешивают с нагреванием при 160oC в течение 2 часов. Реакционную смесь выливают в смесь воды со льдом, чтобы получить фильтрацией выпавшее кристаллическое вещество. Полученные кристаллы промывают водой и этанолом в этой последовательности, и получают 8,5 г (выход 89,4%) названного в заголовке соединения.
Т. пл.> 300oC.
1H ЯМР (ДМСО-d6) δ: 11,18 (1H, ш.с.), 8,66 (1H, д., j=9 Гц), 8,43 (lH, д., j=8 Гц), 7,77-7,59 (3H, м.), 7,35 (1H, д.-д., j= 9, 2 Гц), 7,23 (1H, д., j=2 Гц).
ИК (KBr) см-1: 3110, 1711, 1623, 1610, 1461, 1435, 1398, 1179, 1067, 750.
Ссылочный пример 14
Синтез 3-бензилокси-6-хлор-7H-индено/2,1-с/хинолин-7-она.
К суспензии 6-хлор-3- гидрокси-7H-индено/2,1-с/хинолин-7- она (500 мг, 1,8 ммоль), полученного в ссылочном примере 13, и карбоната калия (300 мг, 2,1 ммоль) в N,N- диметилформамиде (5 мл) добавляют бензилхлорид (247 мг, 2,0 ммоль), и смесь перемешивают при 90oC в течение 3 часов. Реакционную смесь выливают в смесь воды со льдом, и посредством фильтрации получают выпавшее кристаллическое вещество. Полученные кристаллы промывают водой и 2-пропанолом в такой последовательности, и получают 610 мг (выход 92,4%) названного в заголовке соединения.
Т. пл. 212 - 214oC.
1H ЯМР (CDCl3) δ: 8,40 (1H, д., j=9,5 Гц), 8,10 (1H, д., j=7,5 Гц), 7,80 (1H, д., j=7,5 Гц), 7,67-7,31 (9H, м.), 5,24 (2H, с.).
ИК (KBr) см-1: 3090, 1711, 1623, 1570, 1461, 1435, 1397, 1179, 1067, 750.
Ссылочный пример 15
Синтез 1,2-дигидро-4-фенил-1-оксо-3-изохинолинкарбоновой кислоты.
К раствору 4-фенилизокумалин-3-карбоновой кислоты (36,2 г, 136 ммоль) в метаноле (50 мл) добавляют 100 мл насыщенного раствора аммиака в метаноле, и смесь перемешивают при комнатной температуре в течение 8 часов. Смесь перегоняют, чтобы удалить растворитель. К остатку добавляют 300 мл метанола и 100 мл 4N раствора хлористого водорода в этилацетате, чтобы подкислить смесь. Растворитель удаляют отгонкой. К остатку добавляют воду, чтобы получить фильтрацией выпавшие кристаллы. Полученное кристаллическое вещество перекристаллизовывают из этанола с водой, и получают 32,0 г (выход 88,7%) названного в заголовке соединения.
Т. пл. >300oC.
1H ЯМР (ДМСО-d6) δ: 13,53 (1H, ш.с.), 11,11 (1H, ш.с.), 8,32 (1H, д., j= 8 Гц), 7,72-7,26 (7H, м.), 7,10 (1H, д., j=8 Гц).
ИК (KBr) см-1: 3160, 1704, 1656, 1643, 1622, 1606, 1598, 1468, 1446, 1307, 761, 706.
Ссылочный пример 16
Синтез 6H-индено/2,1-с/изохинолин-5,7-диона.
Смесь 1,2-дигидро-4-фенил-1-оксо-3-изохинолинкарбоновой кислоты (32 г), полученной в ссылочном примере 15, и полифосфорной кислоты (300 г) вводят во взаимодействие при 100oC в течение 5 часов. Реакционную смесь выливают в смесь воды со льдом и получают фильтрацией выпавшие кристаллы. Полученные кристаллы промывают этилацетатом и получают 26,6 г (выход 89,2%) названного в заголовке соединения.
Т. пл. > 300oC.
1H ЯМР (ДМCО-d6) δ: 12,18 (1H, ш.с.), 8,40-8,35 (2H, м.), 7,94-7,88 (2H, м.), 7,73 (1H, д.-д., j=8,8 Гц), 7,54-7,46 (2H, м.), 7,24 (1H, д.-д., j=7, 7 Гц).
ИК (KBr) см-1: 3060, 1716, 1681, 1645, 1620, 1604, 1598, 1588, 1462, 1328, 716.
Ссылочный пример 17
Синтез 5-хлор-7H-индено/2,1-с/изохинолин-7-она.
Смесь 6H-индено/2,1-с/изохинолин-5,7-диона, полученного в ссылочном примере 16 (26,6 г, 108 ммоль), и оксихлорида фосфора (300 мл) кипятят с обратным холодильником в присутствии 1 мл N.N-диметилформамида в течение 2 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют смесь воды со льдом, и получают фильтрацией выпавшие кристаллы. Полученное кристаллическое вещество промывают водой и перекристаллизовывают из толуола, получают 22,5 г (выход 78,7%) названного в заголовке соединения.
Т. пл. 242 - 244oC.
1H ЯМР (CDCl3) δ: 8,51-8,47 (2H, м.), 7,99-7,82 (3H, м.), 7,74 (1H, д., j=7 Гц), 7,59 (1H, д.-д., j=8, 8 Гц), 7,40 (1H, д.-д., j=8, 7 Гц).
ИК (KBr) см-1: 1738, 1722, 1615, 1602, 1461, 1412, 1347, 1253, 765, 713, 682, 616.
Ссылочный пример 18
Перечисленные далее соединения синтезируют, используя соединения ссылочных примеров 1-17.
*2,6-Дихлор-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 282 - 284oC.
1H ЯМР (CDCl3) δ: 8,46 (1H, д., j=8 Гц), 8,11 (1H, д., j=7 Гц), 8,03 (1H, д. , j=9 Гц), 7,84-7,79 (2H, м.), 7,69 (1H, д.-д., j=8, 8, 1 Гц), 7,57 (1H, д.-д., j=7, 7 Гц).
*6-Хлор-2-метокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 261 - 262oC.
1H ЯМР (CDCl3) δ: 8,06 (1H, д., j=8 Гц), 8,00 (1H, д., j=9 Гц), 7,82 (1H, д., j=7 Гц), 7,68-7,50 (4H, м.), 4,06 (3H, с.).
*6-Хлор-2-нитро-7H-индено/2,1-с/хинолин-7-он.
Т.пл. > 300oC.
1H ЯМР (CDCl3) δ: 9,47 (1H, д., j=2 Гц), 8,46 (1H, д.-д., j=9, 2 Гц), 8,25 (1H, д. , j=8 Гц), 8,24 (2H, д., j=9 Гц), 7,88 (1H, д., j=7 Гц), 7,78 (1H, д.-д., j=8, 8, 1 Гц), 7,64 (1H, д.-д., j=8, 8 Гц).
*6-Хлор-2,3-метилендиокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. > 300oC.
1H ЯМР (CDCl3) δ: 8,02 (1H, д., j=8 Гц), 7,81 (1H, д., j=7 Гц), 7,72 (1H, с. ), 7,64 (1H, д.- д.-д., j=8, 8, 1 Гц), 7,52 (1H, д.-д., j=8, 8 Гц), 7,37 (1H, с.), 6,23 (2H, с.).
*6-Хлор-2,3-диметокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 300 - 302oC.
1H ЯМР (CDCl3) δ: 8,00 (1H, д., j=7 Гц), 7,82 (1H, д., j=7 Гц), 7,65 ( 1H, д.-д., j=8, 8 Гц), 7,61 (1H, с.), 7,52 (1H, д.-д., j=8, 7 Гц), 7,41 (1H, с.), 4,14 (3H, с.), 4,07 (3H, с.).
*6-Хлор-3-фтор-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 257 - 259oC.
1H ЯМР (CDCl3) δ: 8,55 (1H, м.), 8,12 (1H, A., j=7 Гц), 7,84 (1H, д., j= 7 Гц), 7,76-7,47 (4H, м.).
*6-Хлор-3,9-диметокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 298 - 300oC.
1H ЯМР (CDCl3) δ: 8,31 (1H, д., j=9 Гц), 7,98 (1H, д., j=9 Гц), 7,37 (1H, д. , j=3 Гц), 7,33 (1H, д., j=3 Гц), 7,29 (1H, д.-д., j=9, 3 Гц), 7,08 (1H, д.-д., j=8, 3 Гц), 3,99 (3H, с.), 3,94 (3H, с.).
*3,6-Дихлор-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 250 - 252oC.
1H ЯМР (CDCl3) δ: 8,40 (1H, д., j=9 Гц), 8,07 (1H, д., j=9 Гц), 8,05 (1H, с.), 7,80 (1H, д., j=7 Гц), 7,69-7,52 (3H, м.).
*3-Бензилокси-6-хлор-9,10-метилендиокси-7H-индено/2, 1- с/хинолин-7-он.
Т.пл. 241 - 243oC.
1H ЯМР (CDCl3) δ: 8,19 (1H, д., j=9 Гц), 7,60-7,31 (8H, м.), 7,19 (1H, с.), 6,15 (2H, с.), 5,21 (2H, с.).
*6-Хлор-3-метокси-9,10-метилендиокси-7H-индено/2, 1-с/хинолин-7-он.
Т.пл. > 300oC.
1H ЯМР (CDCl3) δ: 8,22 (1H, д., j=9 Гц), 7,53 (1H, с.), 7,36 (1H, д., j= 3 Гц), 7,30 (1H, д., j=3 Гц), 7,23 (1H, с.), 6,16 (2H, с.), 3,98 (3H, с.).
*6-Хлор-8-метокси-7H-индено/2,1- с/хинолин-7-он.
Т.пл. 259 - 260oC.
1H ЯМР (CDCl3) δ: 8,48 (1H, д., j=8 Гц), 8,06 (1H, д., j=8 Гц), 7,84 (1H, д.-д.-д., j=8, 7, 1 Гц), 7,77 (1H, д., j=8 Гц), 7,67 (1H, д.-д.-д., j= 8, 7, 1 Гц), 7,60 (1H, д.-д., j=9, 8 Гц), 7,09 (1H, д., j=9 Гц), 4,04 (3H, с.).
*6-Хлор-8- гидрокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 240 - 241oC.
1H ЯМР (CDCl3) δ: 8,83 (1H, с.), 8,46 (1H, д., j=9 Гц), 8,09 (1H, д., j= 9 Гц), 7,88 (1H, д.-д.-д., j=7, 7, 1 Гц), 7,73-7,65 (2H, м.), 7,52 (1H, д. -д., j=9, 7 Гц), 7,03 (1H, д., j=9 Гц).
*6-Хлор-9-метокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. 210 - 212oC.
1H ЯМР (CDCl3) δ: 8,39 (1H, д., j=8 Гц), 8,04-7,97 (2H, м.), 7,83 (1H, д.-д.-д., j=9, 7, 1 Гц), 7,65 (1H, д.-д.-д., j=8, 7, 1 Гц), 7,29 (1H, д., j= 3 Гц), 7,07 (1H, д.-д., j=8, 3 Гц), 3,93 (3H, с.).
*6-Хлор-10-метокси-7H- индено/2,1-с/хинолин-7-он.
Т.пл. 255 - 256oC.
1H ЯМР (CDCl3) δ: 8,43 (1H, д., j=9 Гц), 8,08 (1H, д., j=9 Гц), 7,86 (1H, д.-д.-д., j=9, 7, 1 Гц), 7,76 (1H, д., j=8 Гц), 7,69 (1H, д.-д.-д., j= 8, 7, 1 Гц), 7,65 (1H, д., j=2 Гц), 6,94 (1H, д.-д., j=8, 2 Гц), 3,99 (3H, с.).
*6-Хлор-10-гидрокси-7H-индено/2,1-с/хинолин-7-он.
Т.пл. > 300oC.
1H ЯМР (ДМСО-d6) δ: 8,64 (1H, д., j=8 Гц), 8,05-7,81 (4H, м.), 7,63 (1H, д., j=8 Гц), 6,95 (1H, д.-д., j=8, 2 Гц).
*2-Aза-1-хлор-13H-дибензо/с,i/фтор-13-он.
Т.пл. 258 - 261oC.
1H ЯМР (CDCl3) δ: 9,00 (1H, д., j=8 Гц), 8,53 ( 1H, д., j=9 Гц), 8,22 (1H, д., j=9 Гц), 8,09 (1H, д., j=8 Гц), 8,03 (1H, д., j=9 Гц), 7,81 (1H, д. , j=8 Гц), 7,71-7,47 (4H, м.).
Пример 1
Синтез 6-(((диметиламино)этил)амино) -3-метокси-7H-индено/2,1-с/хинолин-7-она (соединение 1).
К суспензии 6-хлор-3-метокси-7H-индено/2,1-с/хинолин-7-она, полученного в ссылочном примере 9 (2 г, 6,8 ммоль), в пиридине (20 мл) добавляют N,N-диметилэтилендиамин (3 г, 33,8 ммоль), и смесь перемешивают при нагревании при 100oC в течение 24 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют воду и хлороформ для экстракции. Хлороформный слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ: этанол = 10:1 (об/об)), и кристаллизуют из этанола, получают 1,3 г (выход 55,3%) названного в заголовке соединения 1. Физико-химические свойства этого соединения приводятся в табл. 1.
Полученное соединение растворяют в смеси хлороформа с метанолом, и отфильтровывают нерастворившиеся вещества. Фильтрат подкисляют 4N хлористым водородом в этилацетате, и собирают выпавшие кристаллы. Полученные кристаллы сушат при пониженном давлении, и получают соль соединения 1 (соединение 1-а) с количественным выходом. Физико-химические свойства этого соединения приводятся в табл. 1.
Пример 2
Синтез дигидрохлорида 6-(((диметиламино)этил)амино)-3-фтор- 7H-индено/2,1-с/хинолин-7-она (соединение 2).
К суспензии 6-хлор-3-фтор-7H-индено/2,1-с/хинолин-7-она (860 мг, 3,0 ммоль) в пиридине (10 мл) добавляют N,N-диметил-этилендиамин (800 мг, 9,0 ммоль), и смесь перемешивают при нагревании при 90oC в течение 12 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют воду и хлороформ для экстракции. Хлороформный слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ: этанол = 10:1 (об/об)). Очищенное вещество растворяют в 20 мл тетрагидрофурана. К раствору добавляют 4N раствор хлористого водорода в диоксане (2 мл), и смесь концентрируют при пониженном давлении. Полученный остаток кристаллизуют из диэтилового эфира, и получают 420 мг (выход 34,3%) названного в заголовке соединения. Физико-химические свойства этого соединения приводятся в табл. 1.
Пример 3
Синтез 6-(((диметиламино)этил)амино)-3-гидрокси-7H- индено-/2,1-с/хинолин-7-она (соединение 3).
К раствору 6-(((диметиламино)этил)амино)-3-метокси-7H -индено/2,1-с/хинолин-7-она, полученного в примере 1 (3 г, 8,6 ммоль), в уксусной кислоте (40 мл) добавляют 47% водную бромисто-водородную кислоту (40 мл), и смесь кипятят с обратным холодильником в течение 60 часов. Реакционную смесь перегоняют до сухого остатка. К остатку добавляют воду, и pH раствора доводят до 8 водным раствором аммиака, и затем экстрагируют хлороформом. Хлороформный слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ:метанол:вода = 8:3:1 (об/об/об)), и продукт кристаллизуют из циклогексана, получают 2,1 г (выход 73%) названного в заголовке соединения. Его физико-химические свойства приводятся в табл. 1.
Полученное соединение растворяют в смеси хлороформа с метанолом и отфильтровывают нерастворившиеся вещества. Фильтрат подкисляют 4N хлористым водородом в этилацетате, и собирают выпавшее кристаллическое вещество. Полученные кристаллы сушат при пониженном давлении, и получают соль соединения 3 (соединение 3-а, выход 89,4%). Его физико-химические свойства приводятся в табл. 1.
Пример 4
Синтез 6-(((диметиламино)этил)амино)-3-(пивалоилокси)-7H-индено/2,1- с/хинолин-7-она (соединение 4).
К раствору 6-(((диметиламино) этил) амино)-3-гидрокси-7H-индено/2,1-с/хинолин-7-она, полученного в примере 3 (100 мг, 0,3 ммоль), в дихлорметане (10 мл) добавляют 4-диметиламино-пиридин (100 мг, 0,8 ммоль) и пивалоилхлорид (37 мкл, 0,3 ммоль), и смесь перемешивают при комнатной температуре в течение 3 часов. К реакционной смеси добавляют воду, чтобы промыть органический слой, который затем сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ:этанол = 10:1 (об/об)), и кристаллизуют из гексана, получают 105 мг (выход 80,0%) названного в заголовке соединения. Его физико- химические свойства приводятся в табл. 1.
Пример 5
Синтез 6-(((диметиламино)этил)амино)-3-гидрокси-4-нитро-7H-индено/2,1- с/хинолин-7-она (соединение 5).
Смесь 6-(((диметиламино)этил) амино)-3-гидрокси-7H-индено/2,1-с/хинолин-7-она, полученного в примере 3 (100 мг, 0,3 ммоль), конц. серной кислоты (1 мл) и азотной кислоты (1 мл) перемешивают при 5oC в течение 2 часов. Реакционную смесь выливают в смесь воды со льдом, и выпавшие кристаллы собирают фильтрацией. Полученное кристаллическое вещество очищают колоночной хроматографией на силикагеле (элюент - нижний слой смеси хлоро-форм: метанол: вода = 9:3:1 (об/об/об)) и кристаллизуют из этанола и диэтилового эфира, получают 60 мг (выход 52,9%) названного в заголовке соединения. Его физико-химические свойства приводятся в табл. 1.
Пример 6
Синтез дигидрохлорида 6-((аминоэтил)амино)-3- гидрокси-7H-индено/2,1-с/хинолин-7-она (соединение 59).
К соединению 56 (1,1 г) добавляют 20 мл конц. соляной кислоты по процедуре примера 1, и получившаяся в результате смесь реагирует при наружной температуре 100oC в течение 12 часов. После этого к смеси добавляют изопропанол. Получающейся в результате смеси позволяют остыть, и собирают фильтрацией выпавшее сырое кристаллическое вещество. Полученные сырые кристаллы подвергают колоночной хроматографии на высокопористом полимерном геле (гель MC1; Mitsubishi Chemical Co. , Ltd. ) и элюируют смесью растворителей (метанол: вода = 1:1 с добавлением 1 капли конц. соляной кислоты). Элюированные фракции концентрируют при пониженном давлении. Выпавшие кристаллы отфильтровывают, промывают этанолом и сушат при пониженном давлении, получают 524 мг (выход 63,7%) названного в заголовке соединения.
Пример 7
Синтез тригидрохлорида 6-(((метиламино)этил) амино)-3-гидрокси-7H-индено/2,1-с/хинолин-7-она (соединение 60).
Смесь конц. соляной кислоты и диоксана (10 мл - 10 мл) добавляют к соединению 57 (1,0 г), полученному по процедуре примера 1, и получающаяся в результате смесь реагирует при наружной температуре 100oC в течение 3 часов. После завершения реакции смесь концентрируют при пониженном давлении. К остатку снова добавляют 10 мл конц. соляной кислоты, и получившаяся в результате смесь реагирует при наружной температуре 100oC в течение 2 часов. После завершения реакции к смеси добавляют 30 мл изопропанола, и собирают фильтрацией выпавшее кристаллическое сырое вещество. Полученные сырые кристаллы растворяют в воде. К раствору добавляют 0,5 мл конц. соляной кислоты и 30 мл изопропанола, и смесь перемешивают при охлаждении льдом для кристаллизации, и получают 560 мг (выход 68,8%) названного в заголовке соединения.
Пример 8
Синтез дигидрохлорида 6-(((диметиламинооксид)этил)амино) -3-гидрокси-7H-индено/2,1-с/хинолин-7-она (соединение 61).
Соединение 53 (2,0 г), полученное по процедуре примера 1, растворяют в 10 мл хлороформа. После перемешивания раствора при охлаждении льдом к раствору добавляют раствор м-хлорпербензойной кислоты (1,2 г) в хлороформе (10 мл), и получающаяся в результате смесь реагирует при комнатной температуре в течение 3 часов. Продукт реакции очищают колоночной хроматографией на оксиде алюминия (элюент хлороформ: метанол = 40: 1) и получают 6-(((диметиламинооксид)этил)амино) -3-бензилокси-7H-индено/2,1-с/хинолин-7-он. К соединению добавляют 7,5 мл конц. соляной кислоты, и смесь реагирует при наружной температуре 100oC в течение 1,5 часов. После завершения реакции к смеси добавляют 12 мл этанола, получающейся в результате смеси дают остыть, и собирают фильтрацией выпавшие сырые кристаллы. Полученное сырое кристаллическое вещество суспендируют в 15 мл этанола. Суспензию перемешивают при нагревании, позволяют ей остыть, и собирают фильтрацией кристаллическое вещество. Полученные кристаллы затем суспендируют в 15 мл дихлорметана и перемешивают при нагревании. Суспензии дают возможность остыть, и собирают фильтрацией кристаллическое вещество, получают 1,34 г (выход 84,1%) названного в заголовке соединения.
Пример 9
Синтез 6-(диметиламиноэтокси)-9, 10-метилендиокси-7H-индено-/2,1-с/хинолин-7-она (соединение 64).
К раствору, полученному при растворении натрия (1,78 г, 77,4 ммоль) в 2-диметиламиноэтаноле (80 мл, 796 ммоль), добавляют 6-хлор-9,10-метилендиокси-7H-индено/2,1-с/хинолин-7-он (8 г, 25,8 ммоль), полученного в ссылочном примере 2, и смесь перемешивают при нагревании при 60oC в течение 24 часов. Реакционную смесь выливают в смесь воды со льдом и экстрагируют хлороформом. Хлороформный слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ:метанол = 10:1 (об/об)), и кристаллизуют из этилацетата, получают 6,37 г (выход 68,1%) названного в заголовке соединения. Его физико-химические свойства приводятся в табл. 2.
Полученное соединение растворяют в хлороформе и отфильтровывают нерастворившиеся вещества. Фильтрат подкисляют 4N раствором хлористого водорода в этилацетате, и собирают выпавшее кристаллическое вещество. Полученные кристаллы сушат при пониженном давлении, и получают соль соединения 64 (соединение 64-а) с количественным выходом. Физико-химические свойства этого соединения приводятся в табл. 2.
Примеры 10 - 74
Соединения 6 - 58 и 62 - 63, показанные в табл. 1, соединения 65 - 72, показанные в табл. 2, соединение 73, показанное в табл. 3, и соединение 74, показанное в табл. 4, синтезируют из соответствующих исходных материалов по тем же методикам, которые описаны в примерах 1-9.
Кроме того, соединения 9-а, 23-а, 26-а, 28-а, 31-а, 41-а, 47-а, 49-а, 50-а, 66-а и 73-а получают как гидрохлориды по тем же методикам, которые описаны в примерах 1, 3 и 9 для получения гидрохлоридов - соединений 1-а, 3-а и 64-а.
Пример 75
Синтез 6-(1-(4-метилпиперазинил))-7H-индено/2,1-с/изохинолин-7-она (соединение 75).
Смесь 5-хлор-7H-индено/2,1-с/изохинолин-7-она, полученного в ссылочном примере 17 (1,0 г, 3,7 ммоль), N-метилпиперазина (2 мл, 18 ммоль) и N.N-диметилформамида (10 мл) перемешивают при 100oC в течение 4 часов. К реакционной смеси добавляют воду, и смесь экстрагируют этилацетатом. Этилацетатный слой сушат над сульфатом магния и упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент хлороформ:метанол = 100:1 (об/ об)) и кристаллизуют из этанола, получают 400 мг (выход 32,3%) названного в заголовке соединения. Его физико-химические свойства приводятся в табл. 5.
Примеры 76 - 80
Соединения 76 - 80, которые приводятся в табл. 5, синтезируют в соответствии с процедурой примера 75 из соответствующих исходных материалов.
Результаты испытаний соединений изобретения на противоопухолевую активность приводятся ниже и поясняют полезность соединений настоящего изобретения.
Пример 1 фармакологических испытаний. Цитотоксичность.
Клетки лейкоза мыши P388 помещают в 96-луночный планшет при плотности 2•103 клеток на лунку. Соединения изобретения растворяют в очищенной воде или диметилсульфоксиде, и раствор разбавляют средой до различных концентраций и добавляют в соответствующие лунки. После инкубации планшета в течение 3 суток культуры фиксируют глутаральдегидом, и число выживших клеток определяют методом окрашивания кристаллическим фиолетовым.
Цитотоксическое действие каждого соединения определяют как концентрацию соединения, при котором число клеток снижается до 50% от числа клеток контрольного образца, т.е. IC50. Результаты приводятся в табл. 6.
Пример 2 фармакологических испытаний. Противоопухолевое действие.
Клетки лейкоза мыши P388 (1•106 клеток на мыши) инъецируют интраперитонеально мыши CDF1. Каждое из соединений изобретения, растворенное в 5%-ной глюкозе или в 5%-ном диметилсульфоксиде, в определенных концентрациях инъецируют интраперитонеально на 1 и 5 сутки после инъекции лейкозных клеток. Противоопухолевую активность соединений изобретения оценивают как процент возрастания жизненного цикла (% ILS) по сравнению со средним выживанием необработанной контрольной группы. Результаты приводятся в табл. 7.
Пример 1 дозированной лекарственной формы. Капсулы.
Капсулы готовят обычным способом со следующим составом:
Соединение 3-a - 200 мг
Лактоза - 30 мг
Кукурузный крахмал - 50 мг
Кристаллическая целлюлоза - 10 мг
Стеарат магния - 3 мг
На одну капсулу - 293 мг
Пример 2 дозированной лекарственной формы. Таблетки.
Таблетки следующего состава готовят обычным способом:
Соединение 7 - 100 мг
Лактоза - 47 мг
Кукурузный крахмал - 50 мг
Кристаллическая целлюлоза - 50 мг
Гидроксипропилцеллюлоза - 15 мг
Тальк - 2 мг
Стеарат магния - 2 мг
Этилцеллюлоза - 30 мг
Глицерид ненасыщенной жирной кислоты - 2 мг
Диоксид титана - 2 мг
На одну таблетку - 300 мг
Пример 3 дозированной лекарственной формы. Гранулы.
Гранулы следующего состава готовят обычным способом:
Соединение 28-a - 200 мг
Маннит - 540 мг
Кукурузный крахмал - 100 мг
Кристаллическая целлюлоза - 100 мг
Гидроксипропилцеллюлоза - 50 мг
Тальк - 10 мг
На одну обертку - 1000 мг
Пример 4 дозированной лекарственной формы. Мелкие гранулы.
Мелкие следующего состава гранулы получают обычным способом:
Соединение 64-a - 200 мг
Маннит - 520 мг
Кукурузный крахмал - 100 мг
Кристаллическая целлюлоза - 100 мг
Гидроксипропилцеллюлоза - 70 мг
Тальк - 10 мг
На одну упаковку - 1000 мг
Пример 5 дозированной лекарственной формы. Инъекции.
Инъекционный раствор следующего состава готовят обычным способом:
Соединение 41-a - 100 мг
Дистиллированная вода для инъекции - подходящее количество
На одну ампулу - 2 мг
Пример 6 дозированной лекарственной формы. Суппозитории.
Суппозитории следующего состава готовят обычным способом:
Соединение 73-a - 200 мг
Витепсол S-55 (Witepsol S-55, зарегистрированная торговая марка; смесь моно-, ди- и триглицеридов насыщенных жирных кислот от лауриновой до стеариновой кислоты; продукт Dynamit Nobel Co., Ltd.) - 1300 мг
На один суппозиторий - 1500 мг



























Изобретение относится к новым конденсированным производным индана формулы I
в которой A представляет собой необязательно замещенное бензольное, нафталиновое кольцо или бензольное кольцо, сконденсированное с низшей алкилендиоксигруппой; кольцо B представляет собой необязательно замещенный бензол, Y = -N= CR- или -CR=N-. Производные индана получают взаимодействием производных 6-галогениндено [2,1-c] хинолина с амином или спиртом в присутствии или отсутствие подходящего растворителя. Соединения могут найти применение в качестве противоопухолевых средств в фармацевтических композициях, содержащих производное индана и фармацевтически приемлемый носитель. 3 с. и 12 з.п. ф-лы, 7 табл.

где кольцо А представляет собой необязательно замещенное бензольное или нафталиновое кольцо, имеюющее в качестве заместителей атом галогена, низшую алкоксильную группу, гидроксильную группу или бензольное кольцо, сконденсированное с низшей алкилендиоксигруппой;
кольцо В представляет собой необязательно замещенный бензол, имеющий в качестве заместителей атом галогена, низшую алкильную группу, низшую алкоксильную группу, гидроксильную группу, нитрогруппу, аминогруппу, бензилоксигруппу, низшую ациламиногруппу, низшую алкоксикарбонильную группу или бензольное кольцо, сконденсированное с низшей алкилендиоксигруппой;
Y = -N=CR- или -CR=N-,
где R представляет собой (1) необязательно замещенную азотсодержащую гетероциклическую группу, (2) группу -NR1R2, или (3) группу - OR3, где R1 и R2 одинаковые или разные и каждый из них представляет собой (а) атом водорода, (в) фенильную группу или (с) низшую алкильную группу, которая может быть замещена по крайней мере одним из заместителей, выбранным из группы, состоящей из: (с-1) необязательно замещенной аминогруппы, (с-2) азотсодержащей гетероциклической группы, (с-3) аминооксидной группы, замещенной низшей алкильной группой или (с-4) гидроксильной группы;
R3 представляет собой низшую алкильную группу, необязательно замещенную замещенной аминогруппой,
при условии, что когда R - необязательно замещенная азотсодержащая гетероциклическая группа, кольцо А и кольцо В - незамещенные бензольные кольца.
где кольцо А представляет собой бензольное, нафталиновое кольцо или бензольное кольцо, сконденсированное с низшей алкилендиоксигруппой, кольцо В представляет собой необязательно замещенный бензол или имеет в качестве заместителей атом галогена или низшую алкоксигруппу Y =-N=CR- или -CR=N-, где R представляет (2) группу -NR1R2 или (3) группу -OR3, в которой R1 и R2 - одинаковые или разные и каждый из них представляет собой (а) атом водорода или (в) низшую алкильную группу, замещенную необязательно замещенной аминогруппой; R3 представляет собой низшую алкильную группу, замещенную замещенной аминогруппой, заключающийся в том, что соединение формулы II
где кольцо А, кольцо В имеют указанные выше значения;
Z=-CX=N- или -N=CXS-, где X представляет собой атом галогена,
подвергают взаимодействию с соединением RH, где R имеет значения, указанные выше.
| SU, 1453661 A, 1989 | |||
| SU, 1574598, 1990 | |||
| US, 4704458 , 1987 | |||
| EP, 0204251 A2, 1986. |
Авторы
Даты
1998-12-27—Публикация
1995-05-18—Подача