Предпосылки изобретения
Настоящее изобретение относится к новым азотсодержащим, тиозамещенным гетероциклическим фосфонатным соединениям, в том числе бисфосфонатам, фосфоноалкилфосфинатам, фосфонокарбоксилатам и фосфоносульфонатам.
Это изобретение также относится к фармацевтическим композициям, содержащим эти новые соединения, а также к способу лечения или предупреждения некоторых метаболических костных заболеваний, характеризующихся аномальным кальциевым и фосфатным метаболизмом, в котором используется соединение или фармацевтическая композиция настоящего изобретения.
Конкретно настоящее изобретение относится к способу лечения или предупреждения остеопороза и артрита, особенно ревматоидного артрита и остеоартрита, при использовании соединения или фармацевтической композиции настоящего изобретения.
Ряд патологических состояний, которые поражают теплокровных животных, включает аномальный кальциевый и фосфатный метаболизм. Такие состояния могут быть разделены на две большие категории.
1. Состояния, которые характеризуются аномальной подвижностью кальция и фосфата, приводящей к общему или специфическому поражению кости, такие как остеопороз и болезнь Педжета, или к исключительно высокому содержанию кальция в жидкостях тела, таким как гиперкальцемия опухолей.
Такие состояния иногда называются в данном описании патологической деминерализацией твердых тканей.
2. Состояния, которые вызывают или являются следствием аномального отложения кальция и фосфата в теле, такие как ревматоидные артриты и остеоартриты. Эти состояния иногда называются ниже как патологическая кальцификация (кальциноз).
В первую категорию входит наиболее часто встречающееся метаболическое костное заболевание - остеопороз; остеопороз представляет собой состояние, при котором твердые костные ткани разрушаются непропорционально образованию новых твердых тканей. В общем случае остеопороз может быть определен как снижение качества костей или как атрофия скелетных тканей. Костный мозг и полости костей становятся больше, уменьшается связывание волокон, а компактный слой костей становится хрупким.
Остеопороз может быть под-классифицирован как климактерический, старческий, вызванный лекарствами (например, адренокортикоидами, которые могут применяться при стероидной терапии), вызванный заболеванием (артритом и опухолью), и т. д.; однако, проявление в обоих случаях практически одинаково. В общем случае существуют два типа остеопороза: первичный и вторичный.
"Вторичный остеопороз" является результатом отдельного установленного болезненного процесса или агента. Однако, приблизительно 90% всех случаев остеопороза является "первичным остеопорозом".
Такие первичные остеопорозы включают постклимактерический осгеопороз, (disuse) остеопороз, возрастной остеопороз (поражающий большинство индивидуумов в возрасте более 70 - 80 лет) и идиопатический остеопороз, поражающий мужчин и женщин среднего возраста и более молодых.
Для некоторых людей, страдающих остеопорозом, разрежение костной ткани является достаточно высоким и приводит к механическому разрушению костной структуры. Часто встречаются костные трещины, например, бедер и позвоночника, у женщин, страдающих постклимактерическим остеопорозом. Кифоз (горб) (аномально увеличенное искривление торакального позвоночника) также может быть результатом остеопороза.
Механизм разрушения кости при остеопорозе, как полагают, включает разбалансирование процесса "костного перестроения". Костное перестроение происходит в течение всей жизни, при этом обновляется скелет и поддерживается прочность костей. Такое перестроение включает эрозию и заполнение дискретных участков на поверхности костей с помощью организованной группы клеток, называемых "основными мультиклеточными единицами" или "ОМЕ". ОМЕ прежде всего состоят из "остеокластов", "остеобластов" и их клеточных прекурсоров.
В процессе цикла обновления кость рассасывается на участке "активированной" ОМЕ с помощью остеокласта с образованием полости поглощения. Эта полость затем заполняется костью посредством остеобласта.
Обычно у взрослых цикл обновления приводит к небольшому дефициту костной ткани вследствие неполного заполнения полости поглощения. Следовательно, даже у здоровых взрослых имеет место возрастное разрежение кости. Однако, при остеопорозе может увеличиваться число активированных ОМЕ. Эта повышенная активизация ускоряет обновление костных тканей, приводя к аномально высокому разрежению кости.
Хотя этиология остеопороза пока полностью не ясна, существует много факторов риска, которые связаны с остеопорозом. К ним относятся низкий вес тела, низкое поглощение кальция, физическая неактивность и дефицит эстрогена.
В настоящее время лечение большинства случаев остеопороза состоит в назначении кальция и эстрогена.
Вторая категория, включающая состояния, проявляющиеся в аномальном отложении кальция и фосфата, включает прогрессивное миозитное костеобразование (myositis ossificans progressiva), общий кальциноз, а также такие заболевания, как артриты (включая, например, ревматоидные артриты и остеоартриты), невриты, бурситы, тендиниты и другие состояния, которые создают предрасположенность к отложению кальция.
Кроме остеопороза, разрежение кости может быть результатом ревматоидного артрита и остеопороза. Ревматоидный артрит представляет собой хроническое, системное и суставное воспалительное заболевание, характеризующееся ослаблением суставных капсул и связок, с последующим разрушением хряща, связок, сухожилий и кости, и уменьшением вязкости и другими изменениями синовиальной жидкости.
Симптомы ревматоидного артрита включают общую слабость, утомление, локализованную боль, тугоподвижность и слабость, а также опухание и деформацию суставов тела. Ревматоидный артрит представляет собой наиболее часто встречающееся заболевание у женщин в возрасте от 40 до 60 лет.
Патогенезис ревматоидного артрита, приводящего к разрушению суставов, характеризуется двумя фазами:
1) эксудативной фазой, включающей микроциркуляцию и синовиальные клетки, что допускает втекание плазменных протеинов и клеточных элементов в сустав, и
2) хронической воспалительной фазой, протекающей на субсиновиальной мембране, которая характеризуется образованием паннуса (грануляция ткани) в суставе и подхрящевой кости, эрозией кости и разрушением хряща.
Паннус может приводить к сращиванию и рубцеванию ткани, что вызывает деформацию сустава, характерную для ревматоидного артрита.
Этиология ревматоидного артрита остается неясной. Инфекционные агенты, такие как бактерии и вирусы, играют существенную роль. Современная гипотеза состоит в том, что вирус Epstein-Barr (EBV) является агентом, вызывающим ревматоидный артрит.
Современное лечение ревматоидного артрита заключается предпочтительно в ослаблении симптоматики путем введения нестероидных противовоспалительных лекарств. Нестероидное противовоспалительное лекарственное лечение эффективно, главным образом, на ранних стадиях ревматоидного артрита; маловероятно, что оно будет подавлять воспаление суставов, если болезнь протекает в течение более одного года.
Золото, метотрексат, иммунодепрессанты и кортикостероиды применялись с удовлетворительным результатом.
С другой стороны, остеоартрит представляет собой врожденное не воспалительное заболевание синовиальных соединений, которое характеризуется истощением и стиранием суставного хряща, а также образованием новой кости на поверхности сустава. По мере развития остеоартрита поверхность суставного хряща разрушается и сношенные частицы получают доступ к синовиальной жидкости, что, в свою очередь, стимулирует фагоцитоз за счет клеток макрофага. Следовательно, воспалительный ответ в конечном счете возникает и при остеоартрите.
Общие клинические симптомы остеоартрита включают хрящевые и костные разрастания суставов пальцев и тугоподвижность при пробуждении, а также боль при движении. Общепринятым лечением симптомов остеоартрита является использование анальгетиков, противовоспалительных агентов, стероидов и физической терапии.
Различные производные фосфоновой кислоты предлагались для использования при лечении и профилактике заболеваний, включающих аномальный кальциевый и фосфатный метаболизм.
Например, ряд работ, которые включены в данное описание в качестве справочного материала, раскрывают композиции, содержащие полифосфонаты, в частности, бисфосфонаты, такие как этан-1-гидрокси-1,1-дифосфоновая кислота (ЭГДК), и их использование для ингибирования аномального отложения и подвижности кальция и фосфата в тканях животных: Патент США 3683080, выдан 8 августа 1972 г. и Патент США 4230700, выдан 28 октября 1980 (оба Francis), Патент США 4868164 (Ebetino), выдан 19 сентября 1989 г.
Ряд других работ описывает гетероцикл-замещенные дифосфоновые кислоты, которые могут быть использованы для лечения остеопороза и/или артрита: Патент США 4868164 (Ebetino et al.), выдан 19 сентября 1989; Патент США 5104863 (Benedict et al.), выдан 14 апреля 1992; Патент США 4267108 (Blum et al.), выдан 12 мая 1981; Европейская патентная заявка (Boehringer Mannheim GmbH) N 170228, опубликована 5 февраля 1986; Европейская патентная заявка N 186495 (Benedict and Perkins), опубликована 2 июля 1986; Патент США 4754993 (Bosies et al. ), выдан 15 ноября 1988; Патент США 4939130 (Jaeggi et al.), выдан 3 июля 1990; Патент США 4971958 (Bosies et al.), выдан 20 ноября 1990; DE 4011777 (Jaeggi К), опубликована 18 октября 1990; заявка WO 90/12017 (Dunn et al.), опубликована 18 октября 1990; заявка WO 91/10646 (Youssefyeh R., et al. ), опубликована 25 июля 1991; AU-A-26738/88 (Jaeggi), опубликована 15 июня 1989, AU-A-45467/89 (Ciba-Geigy), опубликована 31 мая 1990; и Патент США 4208401 (Bauman), выдан 17 июня 1980.
Кроме того, в некоторых работах описываются серосодержащие фосфоновые кислоты, которые, как указывается, могут быть использованы при лечении симптомов воспаления (см, например, Патент США 4746654 (Breliere et al., передан Sanoli), выдан 24 мая 1988; Патент США 4876247 (Barbier et al.), выдан 24 октября 1989; и EPO 100718 (Breliere et al., передан Sanofi), опубликован 15 февраля 1984.
Также в Патенте США 5071840 (Ebetino et al.), выданном 10 декабря 1991, раскрываются серосодержащие гетероцикл-замещенные дифосфонаты, в которых дифосфонат-замещенный углеродный фрагмент присоединен к атому углерода в азотсодержащем шестичленном гетероцикле. Соединения, описанные в патенте, могут быть использованы для лечения состояний, включающих аномальный кальциевый и фосфатный метаболизм, особенно остеопороз и артрит.
Кроме того, в Европейском патенте 0298553 (Ebetino), опубликованном 11 января 1989, описываются тиолзаместители наряду с большим числом других заместителей, которые приемлемы в качестве заместителей для метиленфосфоноалкилфосфиновых кислот. Однако, не указывается, что тиольный заместитель увеличивает противорезорбтивную и противоартритную активность по сравнению с другими описанными заместителями.
Однако, ни в одной из указанных работ не раскрывается использование тиозамещенных азотсодержащих гетероциклических бисфосфонатов, фосфонокарбоксилатов и фосфоносульфонатов для предупреждения и лечения остеопороза и ревматоидного артрита и остеоартрита.
Тиозаместители, описываемые в данной работе, включают тиол, алкилтиолы, тиоэфиры, алкилтиоэфиры, дитиоэфиры и алкилдитиоэфиры, тиокарбаматы, алкилтиокарбаматы, дитиокарбаматы, алкилдитиокарбаматы, тиокарбонаты, алкилтиокарбонаты, алкилдитиокарбонаты и дитиокарбонаты.
Кроме того, соединения настоящего изобретения обладают остеозащитной активностью при разрушении суставов при артритах и обладают этой активностью в качестве дополнительного положительного эффекта при лечении артрита по сравнению с вышеупомянутым простым ослаблением симптомов воспаления.
Понятие "остеозащитная активность", используемое в данном описании, означает модифицирующую заболевание активность на кости и окружающих мягких тканях участка.
Неожиданно установлено, что соединения настоящего изобретения имеют более сильнодействующую костную противорезорбтивную активность и также большее терапевтическое применение при лечении остеопороза и артрита, чем гетероциклические бисфосфонатные соединения, не содержащие тиозаместителя.
Таким образом, объектом настоящего изобретения является создание новых, более эффективных соединений, и эти соединения являются сильнодействующими ингибиторами костной резорбции, полезными при лечении остеопороза, а также противоартритными агентами, полезными при лечении остеоартрита и ревматоидного артрита.
Дополнительным объектом настоящего изобретения является создание фармацевтических композиций, полезных для лечения и профилактики аномального кальциевого и фосфатного метаболизма и для лечения и профилактики артрита, особенно ревматоидного артрита и остеопороза.
Кроме того, объектом настоящего изобретения является создание способа лечения и профилактики заболеваний, характеризующихся аномальным кальциевым и фосфатным метаболизмом у человека и других млекопитающих, включая остеопороз и артрит, особенно ревматоидный артрит и остеоартрит.
Эти и другие объекты настоящего изобретения станут очевидными из детального описания изобретения, которое представлено ниже.
Настоящее изобретение относится к тиозамещенным азотсодержащим гетероциклическим фосфонатным соединениям, в том числе бисфосфонатам, фосфоноалкилфосфонатам, фосфонокарбоксилатам и фосфоносульфонатам, а также к их фармацевтически приемлемым солям и эфирам.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим безопасное и эффективное количество соединения настоящего изобретения и фармацевтически приемлемый наполнитель.
Наконец, настоящее изобретение относится к способу лечения или профилактики патологических состояний, характеризующихся аномальным кальциевым и фосфатным метаболизмом у человека или других млекопитающих, включая лечение или предупреждение остеопороза и артрита, особенно ревматоидного артрита и остеоартрита.
Этот способ включает введение человеку или другому млекопитающему, нуждающемуся в таком лечении, безопасного и эффективного количества соединения или композиции настоящего изобретения. Эти соединения имеют следующую общую формулу:
где
R1 - водород, группы -SH, -(CH2)mSH или -S-C(O)-R3;
R3- C1-C8-алкил;
m = 1 - 6, целое число;
n = 0 - 6, целое число;
Q - ковалентная связь или группа -NH-,
Z - пиридинил;
R2 - водород, группы -SH, -(CH2)mSH, - (CH2)mS-C(O)R3 или -NH-C(O)-R4-SH, где R3 и m имеют указанные значения;
R4 - C1-C8-алкилен,
или их фармацевтически приемлемые соли или эфиры.
Приемлемыми тио-заместителями в соединениях настоящего изобретения являются тиолы, алкилтиолы, тиоэфиры, алкилтиоэфиры, дитиоэфиры, алкилдитиоэфиры, алкилкарбамат, алкилтиокарбамат, дитиокарбамат, алкилдитиокарбамат, тиокарбонат, алкилтиокарбонат, дитиокарбонат и алкилдитиокарбонат.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим безопасное и эффективное количество соединения изобретения и фармацевтически приемлемый наполнитель.
Наконец, настоящее изобретение относится к способу лечения или предупреждения патологических состояний, характеризующихся аномальным кальциевым и фосфатным метаболизмом у человека и других млекопитающих. Этот способ включает введение вышеуказанному человеку или другому млекопитающему, нуждающемуся в таком лечении, безопасного и эффективного количества соединения или композиции настоящего изобретения.
Ниже приводится список определений для понятий, используемых в данном описании.
"Алкил" представляет собой незамещенную или замещенную, линейную или разветвленную, насыщенную или ненасыщенную углеводородную цепочку, причем вышеуказанная углеводородная цепочка может быть насыщенной, содержащей от 1 до 8 атомов углерода, и предпочтительно, если не оговорено особо, от 1 до 4 атомов углерода; вышеуказанная углеводородная цепочка может быть ненасыщенной, содержащей от 2 до 8 атомов углерода, и предпочтительно, если не оговорено особо, от 2 до 4 атомов углерода.
Соответственно, понятие "алкил", которое используется в данном описании, охватывает алкенильные углеводородные ненасыщенные цепочки, содержащие по меньшей мере одну олефиновую двойную связь и алкинильные углеводородные ненасыщенные цепочки, содержащие по меньшей мере одну тройную связь. Предпочтительными алкильными группами являются, но не ограничиваются только ими, метил, этил, пропил, изопропил и бутил.
Понятия "бисфосфонат" или "бисфосфоновая кислота", которые также используются в настоящем описании, относятся к тем фосфонатам и фосфоновым кислотам, которые содержат две фосфонатные группы, присоединенные к одному и тому же атому углерода, и взаимозаменяемы с понятиями дифосфонат и дифосфоновые кислоты.
"Фармацевтически приемлемая" соль представляет собой катионную соль, образующуюся при любой кислой группе (например, карбоксильной), или анионную соль, образующуюся при любой основной группе (например, аминной).
В данной области известно большое число таких солей, которые описаны в Мировой заявке 87/05297 (Johnston et al.), опубликованной 11 сентября 1987 г. Предпочтительными катионными солями являются соли щелочного металла (такого, как натрий и калий) и соли щелочноземельного металла (такого, как магний и кальций). Предпочтительными анионными солями являются галогениды (например, хлориды), ацетаты и фосфаты.
"Биогидролизующиеся эфиры" представляют собой тиозамещенные фосфатные соединения, которые не вмешиваются в активность соединений или которые легко метаболизируют в организме человека или другого млекопитающего с выделением активного соединения.
Большое число таких эфиров описано в Мировой заявке 87/05297 (Johnston et al.), которая опубликована 11 сентября 1987 и включена в данное описание в качестве справочного материала.
Такие эфиры представляют собой низшие алкиловые эфиры, низшие ацилоксиалкиловые эфиры (такие как ацетоксиметиловый, ацетоксиэтиловый, аминокарбонилоксиметиловый, пивалоилоксиметиловый и пивалоилоксиэтиловый эфиры), лактониловые эфиры (такие как фталидиловый и тиофталидиловый эфиры), низшие алкоксиацилоксиалкиловые эфиры (такие как метоксикарбонилоксиметиловый, этоксикарбонилоксиэтиловый и изопропоксикарбонилоксиэтиловый эфиры), алкоксиалкиловые эфиры, холиновые эфиры, а также ациламиноалкиловые эфиры (такой, как ацетамидометиловый эфир).
Как указывалось выше, замещающие группы сами могут быть замещены. Такие заместители включают, но не ограничиваются только ими, заместители, перечисленные в работе С. Hansch, A. Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology (1979), которая введена в описание в качестве справочного материала.
Предпочтительными заместителями являются, но не ограничиваются только ими, алкил, алкенил, алкокси, гидрокси, оксо, амино, аминоалкил (например, аминометил и др.), циано, галоген, карбокси, алкоксиацетил (например, карбоэтокси и др.), тио, тиол, арил, циклоалкил, гетероарил, гетероциклоалкил (например, пиперидинил, морфолинил, пирролидинил, пиперазинил и подобных.), имино, тиоксо, гидроксиалкил, арилокси, арилалкил, а также их сочетания.
Тиозамещенные азотсодержащие гетероциклические фосфонатные соединения.
Соединения настоящего изобретения представляют собой тиозамещенные гетероциклические фосфоновые кислоты, а также их фармацевтически приемлемые соли и эфиры, в которых атом углерода, содержащий остаток фосфоновой кислоты, присоединен к атому углерода азотсодержащего гетероциклического фрагмента, предпочтительно пиридинового кольца.
Соединение атома углерода, содержащего остаток фосфоновой кислоты, с гетероциклическим остатком может быть осуществлено непосредственно ковалентной связью (предпочтительно одинарной связью) или с помощью цепочки длиной приблизительно от 1 до 6 атомов.
Если связь осуществляется через цепочку, то эта цепочка может состоять только из атомов углерода, представлять собой атом азота или азотсодержащую цепочку, атом кислорода или кислородсодержащую цепочку, атом серы или серосодержащую цепочку.
Атомы углерода и азота в связующих цепочках могут быть независимо друг от друга не замещены или замещены одним или несколькими заместителями, выбираемыми из тиозаместителей (в том числе тиолов, алкилтиолов, тиоэфиров, алкилтиоэфиров, дитиоэфиров, алкилдитиоэфиров, тиокарбаматов, алкилтиокарбаматов, дитиокарбаматов, алкилдитиокарбаматов, тиокарбонатов, алкилтиокарбонатов, дитиокарбонатов и алкилдитиокарбонатов), атома водорода, гидрокси-группы, метила, этила или пропила.
Атомы углерода и атомы азота в цепочке могут также быть незамещенными. Также предпочтительны цепочки с одним атомом, то есть, -CH2-, -NH- и О.
Для соединений, в которых атомы азота, серы или кислорода в связывающей цепочке присоединяются к гетероциклическому фрагменту, этот атом азота, серы или кислорода присоединяется к атому углерода цикла и не присоединяется непосредственно к атому азота цикла.
Настоящее изобретение также включает те соединения, в которых атом азота в связывающей цепочке присоединяется к гетероциклическому кольцу, где этот атом азота связан с атомом углерода, непосредственно рядом с атомом азота в гетероцикле, и эти соединения имеют илиденовую структуру (которая более полно описывается ниже).
Когда Q представляет собой NH, то Q предпочтительно соединяется с циклом по атому углерода. Когда Q представляет собой ковалентную связь, то связующая цепочка может быть присоединена или к атому углерода, или к атому азота кольца.
Атом углерода, который содержит фосфонатную группу, может быть незамещенным (то есть, атом водорода) или замещенным. Атом углерода может быть замещен двумя фосфонатными группами (превращаясь в бисфосфонатное соединение); или одной фосфонатной группой и одной фосфинатной группой (образуя фосфоноалкилфосфинатное соединение); фосфонатной группой и сульфонатной группой (давая фосфоносульфонатное соединение); или фосфонатной группой и карбоксильной группой (давая фосфонокарбоксильное соединение).
Кроме того, углеродные атомы в гетероциклическом кольце могут быть незамещенными или замещенными независимо друг от друга одним или более заместителями. Атом азота в гетероциклическом кольце также может быть замещенным или незамещенным.
Существенным является то, что соединения настоящего изобретения должны содержать по меньшей мере один тиозаместитель, например, -SH или -(CH2)mSH. Соответственно, по меньшей мере один из заместителей R1 и R2 должен быть -SH или - (CH2)nSH.
Для того, чтобы определить и оценить фармакологическую активность, проводятся испытания дифосфонатных соединений на животных с использованием различных тестов, которые известны квалифицированным в данной области специалистам.
Таким образом, костная антирезорбтивная активность in vivo может быть показана с использованием теста, предназначенного для исследования способности этих соединений ингибировать резорбцию кости, и эта костная резорбция характеризуется аномальным кальциевым и фосфатным метаболизмом.
Примерами таких известных тестов является модель Шенка на крысах и адъювантный артритный тест. Также полезным является тест in vitro на ингибирование роста кристаллов гидроксиапатита. Эти и другие подходящие тесты для оценки фармакологической активности описаны и/или упоминаются в работах Shinoda et al. , Calcified Tissue International, 35, pp. 87 - 99 (1983); Schenk et al., Calcified Tissue Research, 11, pp. 196 - 214 (1973); Russel et al. , Calcified Tissue Research, 6, pp. 183 - 196 (1970); Muhlbauer and Fleisch, Mineral Electrolyte Metab., 5, pp. 296 - 303; Nancollas et al., Oral Biol., 15, 731 (1970); Пат. США 3683080 (Francis), выдан 8 августа 1972; пат. США 4134969 (Schmidt-Dunker), выдан 16 января 1979; и в заявке ЕРО 189662, опубликована 6 августа 1986; все работы включены в данное описание в качестве справочного материала.
Некоторые из указанных тестов на фармакологическую активность также описаны более детально в Примерах, представленных ниже.
Кроме использования для лечения или предупреждения патологических состояний, характеризующихся аномальным кальциевым или фосфатным метаболизмом, соединения настоящего изобретения могут быть использованы и для других целей. Например, соединения настоящего изобретения, как полагают, могут быть использованы в качестве костного сканирующего агента после маркировки 99m-технецием.
Кроме того, соединения настоящего изобретения могут быть использованы в качестве агента, связывающего ионы поливалентного металла в хелатный комплекс, предпочтительно ионы двух- (например, ионы кальция и магния) и трехвалентных металлов (например, индия). Следовательно, соединения настоящего изобретения могут быть использованы в качестве компонентов детергентов и чистящих средств, или для обработки воды. Они также могут быть использованы в качестве стабилизаторов для соединений.
Кроме того, они могут быть полезными при предупреждении образования винного камня (например, конкремента) и/или зубного камня. Наконец, соединения настоящего изобретения могут быть использованы в качестве гербицидов, которые являются нетоксичными для животных.
Тиозамещенные азотсодержащие гетероциклические фосфонатные соединения настоящего изобретения могут быть получены по методикам, представленным в Примерах A-H.
Композиции, содержащие новые тиозамещенные азотсодержащие гетероциклические фосфонатные соединения.
Новые тиозамещенные фосфонатные соединения настоящего изобретения могут быть введены людям или другим млекопитающим различными путями, в том числе, но не ограничиваясь ими, с помощью оральных дозирующих форм или инъекций (внутривенно, внутримышечно, внутрибрюшинно и подкожно).
Ряд других дозирующих форм, содержащих новые тиозамещенные соединения настоящего изобретения, могут быть легко рецептурированы любым квалифицированным в данной области специалистом с применением подходящих фармацевтических наполнителей, которые описаны ниже. С точки зрения удобства для пациента наиболее предпочтительными являются оральные дозирующие формы.
Понятие "фармацевтическая композиция", которое используется в описании, означает комбинацию, которая включает безопасное и эффективное количество тиозамещенного фосфонатного соединения в качестве активного ингредиента или их смесей и фармацевтически приемлемого наполнителя.
Фраза "безопасное и эффективное количество" означает такое количество соединения или композиции, которого вполне достаточно, чтобы существенно положительным образом изменить симптомы и/или состояние, которое должны быть подвергнуты лечению, но достаточно небольшого, чтобы исключить возникновение серьезных побочных эффектов (при разумном соотношении положительный эффект/риск), в пределах, установленных медицинскими законами.
Безопасное и эффективное количество активного ингредиента для использования в фармацевтической композиции, которая должна использоваться в способе настоящего изобретения, будет меняться в зависимости от конкретных состояний, подвергающихся лечению, возраста и физического состояния пациента, нуждающегося в лечении, степени серьезности заболевания, продолжительности лечения, природы сопутствующей терапии, конкретного используемого активного ингредиента, конкретного фармацевтически приемлемого носителя и подобных факторов, известных и учитываемых внимательным врачом.
Понятие "фармацевтически приемлемый носитель", которое используется в данном описании, включает физиологически инертный, фармакологически неактивный материал, известный квалифицированному в данной области специалисту, который совместим с физическими и химическими характеристиками конкретного фосфонатного соединения, выбранного в качестве активного ингредиента.
Фармацевтически приемлемые носители представляют собой, но не ограничиваются только ими, полимеры, смолы, пластификаторы, наполнители, связывающие вещества, смазывающие вещества, вещества для скольжения, дезинтегрирующие вещества, растворители, со-растворители, буферные системы, поверхностно-активные вещества, консерванты, подслащивающие агенты, корригирующие агенты, красители или пигменты фармацевтического качества, агенты, повышающие вязкость.
Понятие "оральная дозирующая форма" означает любую фармацевтическую композицию, которая предназначена для систематического введения пациенту путем доставки вышеуказанной композиции в желудочно-кишечный тракт пациента через рот.
Для целей настоящего изобретения форма для доставки может представлять собой таблетку с оболочкой или без оболочки, раствор, суспензию или капсулу с оболочкой или без оболочки.
Понятие "инъекция", используемое в данном описании, означает любую композицию, предназначенную для систематического введения человеку или другому млекопитающему путем доставки раствора или эмульсии, содержащей активный ингредиент, при прокалывании кожи вышеуказанного пациента для того, чтобы ввести вышеуказанный раствор или эмульсию в циркулирующую систему пациента, при внутривенной, внутримышечной, внутрибрюшинной или подкожной инъекции.
Скорость систематического введения может быть соответствующим образом проконтролирована квалифицированным специалистом путем манипулирования одним или несколькими параметрами из числа следующих:
(a) собственно активный ингредиент;
(b) фармацевтически приемлемые эксипиенты, поскольку вариации не влияют на активность конкретного выбранного активного ингредиента;
(с) тип эксипиента, а также желаемая плотность и проницаемость (способность к набуханию) вышеуказанного эксипиента;
(d) зависимость от времени состояния самого эксипиента и/или в пределах эксципиентов;
(е) размер частиц гранулированного активного ингредиента;
(f) pH-зависимое состояние эксипиента.
В частности, растворимость, кислотность и чувствительность к гидролизу различных тиозамещенных фосфонатных активных ингредиентов, таких как кислотно-аддитивные соли, соли, образованные по карбоксильной группе, например, соли щелочных металлов, соли щелочноземельных металлов и др., и эфиры, например, алкиловые, алкениловые, ариловые, аралкиловые, могут быть использованы для руководства при выборе компонентов.
Кроме того, приемлемые pH-условия должны быть созданы в дозирующей форме путем добавления буфера к активному ингредиенту в соответствии с желаемой моделью выделения.
Как указывалось выше, фармацевтически приемлемыми эксипиентами (наполнителями) являются, но не ограничиваются только ими, смолы, наполнители, связывающие вещества, смазывающие вещества, растворители, вещества для улучшения скольжения, дезинтегрирующие добавки, со-растворители, поверхностно-активные вещества, консерванты, подслащивающие агенты, добавки, корригирующие вкус и запах, буферные системы, красители и пигменты фармацевтического качества, а также добавки, повышающие вязкость.
Предпочтительным растворителем является вода.
Добавки, корригирующие вкус и запах, которые могут быть использованы в настоящем изобретении, представляют собой добавки, описанные в Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Company, 1990, pp. 1288-1300. Фармацевтические композиции, которые могут быть использованы в настоящем изобретении, содержат 0 - 2% корригирующих агентов.
Красители или пигменты, которые могут быть использованы, описаны в Handbook of Pharmaceutical Excipients, pp. 81 - 90, 1986, опубликована the American Pharmaceutical Association & the Pharmaceutical Society of Great Britain. Фармацевтические композиции настоящего изобретения содержат 0 - 2% красителя или пигмента. Предпочтительными со-растворителями являются, но не ограничиваются только ими, этанол, глицерин, пропиленгликоль, полиэтиленгликоль. Фармацевтические композиции настоящего изобретения содержат 0 - 50% со-растворителей. Предпочтительными буферными системами являются, но не ограничиваются только ими, уксусная, борная, угольная, фосфорная, янтарная, малеиновая, винная, лимонная, бензойная, молочная, глицериновая, глюконовая, глутаровая и глутаминовая кислоты и их натриевые, калиевые и аммонийные соли. Особенно предпочтительными являются фосфорная, винная, лимонная и уксусная кислоты и их соли. Фармацевтическая композиция настоящего изобретения обычно содержит 0 - 5% буферных систем.
Предпочтительными поверхностно-активными веществами являются, но не ограничиваются только ими, полиоксиэтиленсорбитановые эфиры жирных кислот, полиоксиэтиленмоноалкиловые эфиры, моноэфиры сахарозы и простые и сложные эфиры ланолина, алкилсульфатные соли, натриевые, калиевые и аммонийные соли жирных кислот.
Фармацевтические композиции настоящего изобретения содержат 0 - 2% поверхностно-активных веществ.
Предпочтительными консервантами являются, но не ограничиваются только ими, фенол, алкиловые эфиры парагидроксибензойной кислоты, о-фенилфенолбензойная кислота и ее соли, борная кислота и ее соли, сорбиновая кислота и ее соли, хлорбутанол, бензиловый спирт, тимеросал, ацетат и нитрат фенилртути, нитромерсол, бензалконий хлорид, цетилпиридиний хлорид, метилпарабен и пропилпарабен.
Особенно предпочтительными являются соли бензойной кислоты, цетилпиридиний хлорид, метилпарабен и пропилпарабен. Композиции настоящего изобретения обычно содержат 0 - 2% консервантов.
Предпочтительными подслащивающими добавками являются, но не ограничиваются только ими, сахароза, глюкоза, сахарин, сорбит, маннит, а также аспартам; особенно предпочтительными являются сахароза и сахарин. Фармацевтические композиции настоящего изобретения содержат 0 - 5% подслащивающих добавок.
Предпочтительными агентами для повышения вязкости являются, но не ограничиваются только ими, метилцеллюлоза, натрий карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, альгинат натрия, карбомер, повидон, аравийская камедь, кизельгур, ксантановая смола и трагакант.
Особенно предпочтительными являются метилцеллюлоза, карбомер, ксантановая смола, кизельгур, повидон, натрий карбоксиметилцеллюлоза, а также алюмосиликат магния. Композиции настоящего изобретения содержат 0 - 5% агента, повышающего вязкость.
Предпочтительными наполнителями являются, но не ограничиваются только ими, лактоза, маннит, сорбит, трехосновный фосфат кальция, двухосновный фосфат кальция, сжимаемый сахар, крахмал, сульфат кальция, декстро- и микрокристаллическая целлюлоза. Композиции настоящего изобретения содержат 0 - 75% наполнителей.
Предпочтительными смазывающими веществами являются, но не ограничиваются только ими, стеарат магния, стеариновая кислота, а также тальк. Фармацевтические композиции настоящего изобретения включают 0,5 - 2% смазывающих веществ.
Предпочтительными веществами для улучшения скольжения являются, но не ограничиваются только ими, тальк и коллоидная двуокись кремния. Композиции настоящего изобретения содержат обычно 1-5% веществ для скольжения.
Предпочтительными дезинтегрирующими (диспергирующими) веществами являются, но не ограничиваются только ими, крахмал, крахмал-гликолят натрия, кросповидон, кроскармелоз натрия и микрокристаллическая целлюлоза. Фармацевтические композиции настоящего изобретения содержат 4 - 15% диспергирующих добавок.
Предпочтительными связующими веществами являются, но не ограничиваются только ими, аравийская камедь, трагакант, гидроксипропилцеллюлоза, преджелатинизированный крахмал, желатин, повидон, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, растворы сахара, такого как сахароза и сорбит, а также этилцеллюлоза. Композиции настоящего изобретения содержат 1 - 10% связующих веществ.
Соединения настоящего изобретения могут составлять приблизительно от 0,1 до 99,9 мас.% фармацевтической композиции настоящего изобретения. Предпочтительно соединения настоящего изобретения составляют приблизительно от 15 до 95 мас.% композиций настоящего изобретения.
Таким образом, фармацевтические композиции настоящего изобретения содержат 15 - 95% тиозамещенного фосфонатного активного ингредиента или их смесь, 0 - 2% корригирующих агентов, 0 - 50% со-растворителей, 0 - 5% буферной системы, 0 - 2% поверхностно-активных веществ, 0 - 2% консервантов, 0 - 5% подслащивающих добавок, 0 - 5% добавок для повышения вязкости, 0 - 75% наполнителей, 0,5 - 2% связывающих веществ, 1-5% веществ для улучшения скольжения, 4-15% диспергирующих добавок, а также 1 - 10% связующих веществ.
Выбор фармацевтического наполнителя, который должен использоваться в сочетании с тиозамещенными фосфонатами настоящего изобретения, принципиально определяется способом введения фосфонатного соединения.
Если соединение должно быть введено путем инъекций, то предпочтительным фармацевтическим носителем является стерильный физиологический раствор, pH которого доводится до приблизительно 7,4. Однако, предпочтительным способом введения фосфонатов настоящего изобретения является оральный и предпочтительной дозирующей формой являются, следовательно, таблетки, капсулы и другие подобные формы, содержащие приблизительно от 0,1 мг P до 600 мг P дифосфоновых кислот, описанных здесь.
Фармацевтические носители, приемлемые для приготовления дозирующих единичных форм для орального применения, хорошо известны в данной области. Их выбор будет зависеть от вторичного рассмотрения вкуса, стоимости, также стабильности, который не является критическим для данного изобретения и может быть осуществлен без всяких затруднений любым квалифицированным в данной области специалистом.
Понятие "мг P", используемое в данном описании, означает массу атомов фосфора, которые присутствуют в некотором количестве дифосфоновой кислоты настоящего изобретения. Эта единица используется для стандартизации количества дифосфоновой кислоты настоящего изобретения, которое должно быть использовано в фармацевтической композиции и в способе настоящего изобретения.
Например, [[5-(2-меркапто-1-оксопропиламино-2- пиридинил] аминометилен] бис[фосфоновая кислота] имеет молекулярный вес 371 г/моль, из которых 16,7% (62 г/моль) обусловлено двумя атомами фосфора, присутствующими в этой молекуле. Один миллиграмм этого соединения, следовательно, содержит 0,17 мг P (1 мг х 16,7%).
Таким образом, чтобы приготовить фармацевтическую композицию, содержащую 1 мг P этого соединения, в композицию надо включить 6 мг соединения; и чтобы обеспечить дозу 1 мг Р/кг этого соединения для пациента весом 50 кг, пациент должен принимать по 300 мг этого соединения.
Фармацевтически приемлемый носитель, используемый в смеси с фосфонатами настоящего изобретения, применяется в концентрации, достаточной для того, чтобы обеспечить практическое дозирование. Предпочтительно фармацевтически приемлемый носитель может содержать приблизительно от 0,1 до 99,9 мас.% из расчета на массу всей композиции, и более предпочтительно - от 20 до 80%.
Приемлемые фармацевтические композиции представлены в данном описании в Примерах I - L. Квалифицированный в данной области специалист может производить изменения в неограничивающих примерах, представленных в описании, для получения широкого спектра фармацевтических композиций.
Способ лечения или предупреждения заболеваний, характеризующихся аномальным кальциевым и фосфатным метаболизмом.
Другим объектом настоящего изобретения является способ лечения или предупреждения заболеваний, характеризующихся аномальным кальциевым и фосфатным метаболизмом.
Такие способы включают введение человеку или низшим животным, нуждающимся в таком лечении, безопасного и эффективного количества дифосфонатного соединения настоящего изобретения.
Предпочтительным способом введения является оральный, но другие известные способы введения также могут быть использованы, например, накожнослизистые (например, накожный, ректальный и другие) и парентеральные (например, подкожная инъекция, внутримышечная инъекция, внутрисуставная инъекция, внутривенная инъекция и другие). Также могут быть использованы ингаляции.
Следовательно, конкретными способами введения являются, без ограничения, оральный, трансдермальный, слизистый, подъязычный, внутримышечный, внутривенный, внутрибрюшинный и подкожный способы, а также локальный способ нанесения.
Понятие "аномальный кальциевый и фосфатный метаболизм", которое используется в данном описании, означает, что [1] состояния, которые характеризуются аномальной подвижностью кальция и фосфата, приводящей к общему и специфическому поражению кости или избыточно высокому содержанию кальция и фосфата в жидкостях тела; и [2] состояния, которые вызывают или являются результатом аномального отложения кальция и фосфата в теле.
Первая категория включает, но не ограничивается ими, остеопороз, болезнь Педжета, гиперпаратиорез, гиперкальцемию злокачественных образований, гетеротропное окостенение, а также остеолитические костные метастазы.
Вторая категория включает, но не ограничивается ими, прогрессивное миозитное костеобразование, общий кальциноз, а также такие болезни, как артриты, ревматоидные артриты, остеоартриты, невриты, бурситы, тендиниты, а также другие состояния, которые создают предрасположенность для отложения кальция и фосфата в тканях.
Понятие "ревматоидные артриты", которое используется в данном описании, означает хроническое системное и суставное воспалительное заболевание неизвестной этиологии. Оно характеризуется разрушением суставного хряща, связок, сухожилий и кости.
Понятие "остеоартриты" означает невоспалительное заболевание синовиальных соединений. Оно характеризуется истощением и истиранием суставного хряща и новым костным образованием на поверхности сустава.
Понятия "субъект из группы риска" или "субъект, нуждающийся в таком лечении", которые используются в данном описании, относятся к любому человеку или другому млекопитающему, у которого имеется значительная вероятность возникновения аномального кальциевого и фосфатного метаболизма, если его не лечить, а также к любому человеку или другому млекопитающему, у которых установлено наличие аномального кальциевого и фосфатного метаболизма.
Например, женщины в постклимактерический период, субъекты, подвергшиеся определенной стероидной терапии, субъекты, принимавшие антиконвульсивные лекарства, субъекты с болезнью Педжета, гиперпаратиорезом, гиперкальцемией злокачественных образований или остеолитическими костными метастазами, субъекты, страдающие от одной или более различных форм остеопороза, субъекты, принадлежащие к группам населения, для которых опасность развития остеопороза значительно выше среднего, например, женщины в постклимактерический период, мужчины старше 65 лет, а также субъекты, при лечении которых использовались лекарства, которые, как известно, в качестве побочного эффекта способны вызвать остеопороз, субъекты, страдающие прогрессивным миозитным костеобразованием или общим кальцинозом, а также субъекты, страдающие артритами, остеоартритами, невритами, бурситами, тендинитами и другими воспалительными состояниями, которые создают предрасположенность к отложению кальция и фосфата в тканях.
Понятие "безопасное и эффективное количество", которое используется в данном описании, означает количество соединения или композиции настоящего изобретения, достаточно высокое, чтобы в значительной степени положительным образом модифицировать состояния, которые должны быть подвергнуты лечению, но достаточно низкое, для того чтобы исключить возникновение побочного эффекта (при разумном соотношении положительный эффект/риск) в пределах, установленных медицинским законодательством.
Безопасное и эффективное количество дифосфонатных соединений настоящего изобретения будет изменяться в зависимости от конкретного состояния, которое должно быть подвергнуто лечению, возраста и физического состояния пациента, нуждающегося в лечении, серьезности заболевания, продолжительности лечения, природы сопутствующей терапии, конкретного используемого фосфоната, конкретных используемых фармацевтически приемлемых наполнителей, а также аналогичных факторов в рамках знаний и опыта внимательного врача.
Однако, единичные дозировки могут лежать в интервале приблизительно от 0,01 мг P до 3500 мг P, или приблизительно от 0,0002 до 70 мг P/кг веса (из расчета на вес тела 50 кг).
Предпочтительной единичной дозирующей дозой является доза приблизительно от 1 мг P до 600 мг P или приблизительно от 0,02 до 12 г P/кг массы тела (из расчета на массу тела 50 кг). Может применяться приблизительно до четырех единичных доз в день. Требуется дневная дозировка не более приблизительно 500 мг P/кг для того, чтобы получить желаемый результат, а более высокая доза может привести к нежелательному эффекту.
Более высокие дозы в пределах указанного интервала требуются, конечно, в случае орального введения из-за ограниченного поглощения.
Следующие Примеры дополнительно описывают и демонстрируют предпочтительные воплощения в пределах объема притязаний настоящего изобретения. Примеры приводятся исключительно для целей иллюстрации и не должны рассматриваться как ограничивающие объем притязаний настоящего изобретения, так как возможно большое число изменений в этих примерах, которые не затрагивают объем и сущность изобретения.
Пример A. Синтез [(5-3-меркаптопропил)2- пиридинил)аминометилен] бис[фосфоновой кислоты]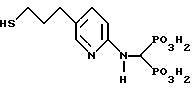
Приведенное выше соединение получают по методике, описанной ниже.
I. Синтез тетраэтилового эфира [(5-бром-2-пиридинил) аминометилен] бис[фосфоновой кислоты].
2-Амино-5-бромпиридин (12,5 г, 72 ммоль), триэтилортоформиат (79,2 ммоль) и диэтилфосфит (158, 4 ммоль) нагревают при 140oC в круглодонной колбе, снабженной дистилляционной насадкой для сбора этанола в процессе реакции. После нагревания в течение 8 ч реакционную массу охлаждают и затем концентрируют в вакууме. Желаемый продукт выделяют путем быстрой хроматографии на силикагеле с использованием в качестве элюента 5%- ного раствора изопропанола в метиленхлориде.
II. Синтез тетраэтилового эфира [(5-(3-гидроксипропил)-2- пиридинил)аминометилен]бис[фосфоновой кислоты].
К раствору тетраэтилового эфира [(5-бром-2-пиридинил) аминометилен] бис[фосфоновой кислоты] (10 ммоль) в ТГФ (10 мл), охлажденному до - 78oC, добавляют раствор н-бутиллития (2,1 эквивалента) в гексане в течение 30 мин. Реакционную массу выдерживают при -78oC в течение еще 30 мин.
К полученному раствору добавляют З-иодпропанолтриметилсилиловый эфир (ТМС) (2,5 эквивалента) и реакционной массе дают нагреться до комнатной температуры в течение 30 мин. После стандартной водной обработки выделяют тетраэтиловый эфир [(5-(3- гидроксипропил-, ТМС-эфир)-2-пиридинил)аминометилен] бис[фосфоновой кислоты] , который используют на следующей стадии без очистки.
Снятие ТМС-эфира из молекулы продукта осуществляется при перемешивании его в ТГФ с добавлением по каплям в течение 30 мин тетрабутиламмоний фторида (1М в ТГФ). После стандартной водной обработки выделяют конечный первичный спирт в виде масла и используют на следующей стадии.
Ill. Синтез тетраэтилового эфира [(5-(3-бромпропил)-2-пиридинил)аминометилен]бис[фосфоновой кислоты].
Смесь тетраэтилового эфира [(5-(3-гилроксипропил)-2- пиридинил)аминометилен] бис[фосфоновой кислоты] (10 ммоль), тетрабромида углерода (11 ммоль) и трифенилфосфина (11 ммоль) в дихлорметане (100 мл) перемешивают при комнатной температуре в течение 5 час. Добавляют воду и продукт экстрагируют дихлорметаном. Объединенные органические экстракты сушат и концентрируют. Полученный остаток очищают быстрой колоночной хроматографией, получают тетраэтиловый эфир [(5-(3-бром-пропил)-2-пиридинил)аминометилен] бис[фосфоновой кислоты].
IV. Синтез тетраэтилового эфира [(5-(3-ацетилтиопропил)-2-пиридинил)аминометилен]бис[фосфоновой кислоты].
Раствор тетраэтилового эфира [(5-(3-бромпропил)-2-пиридинил)аминометилен] бис[фосфоновой кислоты] (5 ммоль) перемешивают в сухом ацетоне (35 мл) и добавляют тиоацетат натрия (5,2 ммоль). Смесь перемешивают при 50oC в течение 12 час. После охлаждения до комнатной температуры упаривают в вакууме растворитель. Сырой остаток растворяют в метиленхлориде и промывают водой. Органический слой затем сушат и концентрируют в вакууме. Желаемый продукт очищают быстрой хроматографией на силикагеле с использованием в качестве элюента 5 - 10%-ного раствора изопропанола в метиленхлориде.
V. Синтез [(5-(3-меркаптопропил)-2-пиридинил)аминометилен]бис[фосфоновой кислоты].
Тиоацетат (4,2 ммоль) нагревают при температуре кипения с обратным холодильником в 1N HCl (15 мл) в течение 5 час. Реакционную смесь охлаждают, обрабатывают древесным углем, фильтруют и концентрируют в вакууме. Целевой продукт желаемой степени чистоты получают при растирании с ацетоном и при дополнительной сушке в вакууме в течение ночи.
Пример B. Синтез [(5-(3-ацетилтиопропил)-2-пиридинил)аминометилен] бис[фосфоновой кислоты].
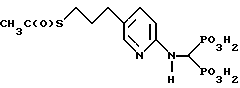
[(5-(3-Ацетилтиопропил) -2-пиридинил)аминометилен] бис[фосфоновую кислоту] получают нагреванием при температуре кипения с обратным холодильником тетраэтилового эфира [(5-(3-ацетилтиопропил)-2-пиридинил) аминометилен] бис[фосфоновой кислоты] (получен по методике Примера A, часть III, см. выше) в дистиллированной воде в атмосфере аргона в течение 18 час. Реакционную смесь концентрируют в вакууме и продукт перекристаллизовывают из воды и изопропанола.
Пример C.
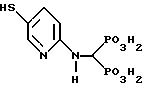
Приведенное выше соединение получено по методике, описанной ниже.
I. Синтез тетраэтилового эфира [(5-нитро-2-пиридинил) аминометилен] бис[фосфоновой кислоты].
2-Амино-5-нитропиридин (10 г, 71,9 ммоль), триэтилортоформиат (11,7 г, 79,1 ммоль) и диэтилфосфит (21,86 г, 158,2 ммоль) нагревают при 140oC в круглодонной колбе, снабженной дистилляционной насадкой для сбора этанола в течение реакции. После нагревания в течение 10 ч реакционную массу охлаждают, а затем концентрируют в вакууме. Желаемый продукт получают с помощью быстрой хроматографии на силикагеле с использованием в качестве элюента 5%-ного раствора изопропанола в метиленхлориде.
II. Синтез тетраэтилового эфира [(5-амино-2-пиридинил) аминометилен]бис[фосфоновой кислоты].
Тетраэтиловый эфир [(5-нитро- 2-пиридинил)аминометилен]бис[фосфоновой кислоты] (5,29 г, 12,4 ммоль), абсолютный этанол (100 мл) и 10%-ный палладий на угле (1,3 г) помещают в аппарат гидрирования Парра на 500 мл и гидрируют в течение 4 ч при давлении 40 фунтов/кв. дюйм.
Реакционную смесь фильтруют через целит, затем концентрируют в вакууме. Полученный твердый продукт используют без дополнительной очистки.
III. Синтез тетраэтилового эфира [(5-меркапто-2-пиридинил) аминометилен] бис[фосфоновой кислоты].
К нитрозоний тетрафторборату (NOBF4) (22 мг, 0,19 ммоль) в метиленхлориде (6 мл) при комнатной температуре добавляют тетраэтиловый эфир [(5-амино-2-пиридинил)аминометилен]бис[фосфоновой кислоты] (75 мг, 0,19 ммоль).
Реакционную смесь перемешивают 3 ч и затем концентрируют в вакууме. Полученный сырой остаток растворяют в ацетонитриле (6 мл) и добавляют сульфид натрия (46 мг, 0,19 ммоль). После перемешивания в течение 12 ч при комнатной температуре реакцию останавливают добавлением воды и смесь экстрагируют метиленхлоридом.
Органические экстракты объединяют и промывают 10%-ным водным Na2S2O3. Органические экстракты затем сушат сульфатом натрия, фильтруют и концентрируют в вакууме. Желаемый тиол получают очисткой с помощью быстрой хроматографии, элюент - 2%-ный изопропанол в метиленхлориде.
IV. Синтез [(5-меркапто-2-пиридинил)аминометилен]бис[фосфоновой кислоты] .
Бисфосфоновую кислоту получают при кипячении с обратным холодильником тетраэтилового эфира (0,5 ммоль) в дистиллированной воде (25 мл) в течение 12 ч в атмосфере азота.
Реакционную массу обрабатывают активированным углем, фильтруют и концентрируют в вакууме. Сырой остаток перекристаллизовывают из воды и этанола и получают [(5- меркапто-2-пиридинил)аминометилен]бис[фосфоновую кислоту].
Пример D. Синтез [(4-(4-меркаптобутил)-2-пиридинил)аминометилен] бис[фосфоновой кислоты].
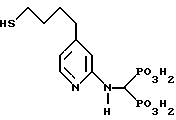
Приведенное выше соединение получают по методике, описанной ниже.
I. Синтез тетраэтилового эфира [(4-бром-2-пиридинил) аминометилен] бис[фосфоновой кислоты].
С использованием методики примера A (часть I) из 2-амино-4-бромпиридина, триэтилортоформиата и диэтилфосфита получают тетраэтиловый эфир [(4-бром-2-пиридинил) аминометилен]бис[фосфоновой кислоты].
II. Синтез тетраэтилового эфира [(4-(4-гидроксибутил)-2- пиридинил)аминометилен]бис[фосфоновой кислоты].
К раствору тетраэтилового эфира [(4-бром-2-пиридинил)aминoмeтилeн] биc[фocфoнoвoй кислоты] (10 ммоль) в ТГФ (10 мл), охлажденному до -78oC, добавляют раствор н-бутиллития (2,1 эквивалента) в гексане в течение 30 мин.
Реакционную массу выдерживают при -78oC в течение еще 30 мин. К полученному раствору добавляют 4- иодбутанолтриметилсилиловый эфир (ТМС) (2,5 эквивалента) и реакционной массе дают нагреться до комнатной температуры в течение 30 мин. После стандартной водной обработки выделяют тетраэтиловый эфир [(4-(4-бутанол-, ТМС-эфир)-2-пиридинил)аминометилен]бис [фосфоновой кислоты], который используют на следующей стадии без очистки.
Снятие ТМС-эфира из молекулы продукта осуществляется при перемешивании его в ТГФ с добавлением по каплям в течение 30 мин тетрабутиламмоний фторида (1М в ТГФ). После стандартной водной обработки выделяют конечный первичный спирт в виде масла и используют на следующей стадии.
III. Синтез тетраэтилового эфира [(4-(4-ацетилтиобутил)-2-пиридинил)аминометилен]бис[фосфоновой кислоты].
С использованием той же последовательности реакций, которая описана в Примере A (часть III-IV), тетраэтиловый эфир [(4-(4-гидроксибутил)-2-пиридинил)аминометилен] бис [фосфоновой кислоты] превращают в тетраэтиловый эфир [(4-(4-ацетилтио-бутил)-2-пиридинил)аминометилен]бис[фосфоновой кислоты].
IV. Синтез [(4-(4-меркаптобутил)-2-пиридинил) аминометилен] бис[фосфоновой кислоты].
Тиоацетат (5,0 ммоль) нагревают при температуре кипения с обратным холодильником в 1N HCl (20 мл) в течение 8 час. Реакционную массу охлаждают, обрабатывают древесным углем, фильтруют и концентрируют в вакууме. Желаемый продукт с нужной степенью чистоты получают при последующем растирании с ацетоном и после дополнительной сушки в вакууме.
Пример E. Синтез [(4-(4-ацетилтиобутил)-2-пиридинил) аминометилен] бис[фосфоновой кислоты]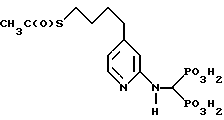
[(4-(4-Ацетилтиобутил)-2-пиридинил)аминометилен]бис [фосфоновую кислоту] получают нагреванием при температуре кипения с обратным холодильником тетраэтилового эфира [(4-(4-ацетилтиобутил)-2- пиридинил)аминометилен] бис[фосфоновой кислоты] (получен по методике Примера D, см. выше) в дистиллированной воле в течение 18 ч в атмосфере аргона.
Реакционную смесь концентрируют в вакууме и продукт перекристаллизовывают из воды и изопропанола.
Пример F. Синтез [[5-[(2-меркапто-1-оксопропил)амино]-2-пиридинил]аминометилен] бис[фосфоновой кислоты].
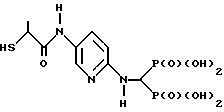
Приведенное выше соединение получают в соответствии с методикой, приведенной ниже.
I. Синтез тетраэтилового эфира [[5-[(2-меркапто-1-оксопропил) амино]-2-пиридинил]аминометилен]бис[фосфоновой кислоты].
Тиомолочную кислоту (1,95 г, 18,38 ммоль) медленно добавляют к реагенту сопряжения гидрохлориду 1-(3-диметиламинопропил)-3-этилкарбодиимида (3,52 г, 18,38 ммоль) в метиленхлориде (15 мл) при 0oC. Затем к этой смеси добавляют тетраэтиловый эфир [(5-амино-2-пиридинил)аминометилен] бис[фосфоновой кислоты] [получен по методике, описанной в Примере C (часть II)] (4,84 г, 12,25 ммоль) в метиленхлориде (10 мл).
Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 24 час. Реакционную массу разбавляют метиленхлоридом (150 мл), затем промывают водой (2 х 150 мл), а затем насыщенным водным раствором NaCl (1 х 125 мл).
Органический слой сушат сульфатом натрия, фильтруют и концентрируют в вакууме. Амид очищают быстрой хроматографией на силикагеле, элюент 5% изопропанола в метиленхлориде, и получают желтое масло (3,05 г), выход 52%.
II. Синтез [[5-[(2-меркапто-1-оксопропил)амино] -2-пиридинил] аминометилен]бис[фосфоновой кислоты].
Тетраэтилбисфосфонат (3,05 г, 6,31 ммоль) обрабатывают бромтриметилсиланом (5,80 г, 37,89 ммоль) в хлороформе (25 мл) при комнатной температуре в атмосфере азота в течение 22 час.
Реакцию останавливают добавлением метанола и затем реакционную массу концентрируют в вакууме. Сырой остаток растирают с этилацетатом и дополнительно сушат в высоком вакууме, получают бисфосфоновую кислоту (2,34 г) в виде светло-желтого твердого продукта, выход 100%.
Элементный анализ для C9H15N3O7P2S;
Рассчитано: C 29,11; H 4,07; N 11,32.
Найдено: C 28,48; H 4,41; N 10,92.
Пример G. Синтез [2-ацетилтио-2-(3-пиридинил)этилиден]бис[фосфоновой кислоты]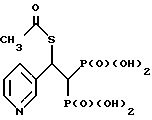
Приведенное выше соединение получают в соответствии с методикой, приведенной ниже.
I. Синтез 4,4'-(3-пиридинилметилен)бисморфолина.
Суспензию, содержащую бензол (10 мл), 3-пиридин-карбоксальдегид (3,97 г, 37,09 ммоль), триоксид бора (4,31 г, 61,94 ммоль) и морфолин (7,76 г, 89,02 ммоль), перемешивают при комнатной температуре в течение 2 час. Реакционную массу фильтруют через целит для удаления гидратированного борного комплекса и фильтрат концентрируют в вакууме, получают 73% (7,17 г) бисаминаля с хорошей степенью чистоты.
II. Синтез тетраэтилового эфира [3-(2-пиридинил)этенилиден] бис[фосфоновой кислоты].
К бисаминалю (1,00 г, 3,80 ммоль) в толуоле (6 мл) добавляют трифторуксусную кислоту (0,89 г, 7,79 ммоль). Смесь нагревают в течение 15 мин при 60oC, добавляют тетраэтилметилендифосфонат (1,10 г, 3,80 ммоль) и реакционную массу перемешивают в течение 22 ч при 60oC.
Реакционную смесь охлаждают и добавляют воду. Слои разделяют и водный слой экстрагируют метиленхлоридом (3 х 15 мл). Органические слои объединяют, сушат сульфатом натрия, фильтруют и концентрируют в вакууме. Бисфосфонат отделяют от непрореагировавшего метилендифосфоната и пиридинкарбоксилата с помощью быстрой хроматографии на силикагеле (элюент метиленхлорид/изопропиловый спирт, 97:3).
Получают винильный аддукт (296 мг) с выходом 20% в виде светло-желтого масла.
III. Синтез [3-(2-пиридинил)этенилиден]бис[фосфоновой кислоты]
Бисфосфонат (1,66 г, 4,39 ммоль) обрабатывают бромтриметилсиланом (5,38 г, 35,12 ммоль) в хлороформе при 50oC в течение 12 ч в атмосфере азота. Реакционную смесь затем перемешивают в течение 30 мин с водой (20 мл) и этилацетатом (20 мл). Слои разделяют и водный слой обрабатывают древесным углем, фильтруют через целит и концентрируют. Получают бисфосфоновую кислоту (0,66 г, выход 57%) в виде светло-желтого масла.
VI. Синтез [2-ацетилтио-2-(3-пиридинил)этилиден]бис[фосфоновой кислоты].
К [3-(2-пиридинил)этенилилен]бис[фосфоновой кислоте] (0,56 г, 2,11 ммоль) в воде (5 мл) добавляют тиоуксусную кислоту (0,80 г, 10,55 ммоль). После перемешивания при комнатной температуре в течение 5 ч реакционную массу концентрируют в вакууме, растирают с ацетоном и затем сушат в высоком вакууме. Получают бисфосфоновую кислоту в виде светло-желтого твердого продукта (375 мг, выход 52%).
НЯМР (D2O) δ 8,89 (1H, с); 8,71 (1H, м); 8,55 (1H, д, J=6 Гц); 7,88 (1H, м); 5,51 (1H, дт, J=6,18 Гц); 2,85 (1H, дт, J=6,21 Гц); 2,24 (3H, с).
ПЯМР (D2O) δ/ 15,99; 15,29.
Пример H. Синтез [2-меркапто-2-(3-пиридинил)этилиден]бис[фосфоновой кислоты].
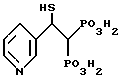
Приведенное выше соединение получают в соответствии с методикой, приведенной ниже.
I. Синтез тетраэтилового эфира [2-ацетилтио-2-(3-пиридинил) этилиден] бис[фосфоновой кислоты].
Тетраэтиловый эфир [3-(2-пиридинил)этенилиден] бис[фосфоновой кислоты] (1,0 г, 2,65 ммоль) [приготовлен по методике, описанной в Примере G (часть II)] и тиоуксусную кислоту (0,30 г, 3,98 ммоль) перемешивают в безводном хлороформе (15 мл) в течение 48 ч при комнатной температуре.
Реакционную массу затем концентрируют в вакууме. Остаток растворяют в ацетоне и концентрируют второй раз в вакууме, получают тиоацетат (1,01 г, выход 83%).
II. Синтез [2-меркапто-2-(3-пиридинил)этилиден]бис[фосфоновой кислоты].
Бисфосфоновую кислоту получают нагреванием с обратным холодильником тетраэтилового эфира [2-ацетилтио-2-(3-пиридинил) этилиден]бис[фосфоновой кислоты] (1,01 г, 2,21 ммоль) в концентрированной соляной кислоте в течение 3 час.
Раствор затем упаривают досуха в вакууме. Сырой остаток растворяют в теплой воде и обрабатывают древесным углем, затем фильтруют через целиты. Водный фильтрат экстрагируют дважды метиленхлоридом. Продукт осаждают из водного фильтрата при добавлении этанола. Осадок отфильтровывают, промывают диэтиловым эфиром и сушат в вакуумном десикаторе.
Элементный анализ для C7H11NO6P2S:
Рассчитано: C 28,46; H 3,90; N 4,53.
Найдено: C 28,44; H 3,93; N 4,52.
Пример I. Синтез [5-меркапто-2-(3-пиридинил) пентилиден]бис[фосфоновой кислоты]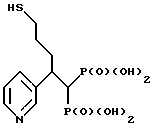
Приведенное выше соединение получают в соответствии с методикой, приведенной ниже.
I. Синтез этилового эфира, трет-бутилдиметилсилилового эфира 5- гидрокси-2-(3-пиридинил)пентановой кислоты.
К раствору этил 3-пиридилацетата (0,76 г, 4,60 ммоль) в безводном ТГФ (125 мл) при - 78oC в атмосфере аргона добавляют литий ди-изопропиламид (4,60 ммоль) в ТГФ (25 мл). Раствор перемешивают в течение 30 мин при -78oC и затем к этому раствору добавляют 3-иодпропанол, трет-бутилдиметилсилиловый эфир (5,00 моль) в ТГФ (20 мл).
Реакционную массу перемешивают при -78oC дополнительные 2 часа и затем при комнатной температуре 8 час. Реакцию останавливают добавлением водного раствора хлорида аммония. Слои разделяют и водный слой экстрагируют диэтиловым эфиром. Органические слои объединяют, сушат и концентрируют. Продукт очищают быстрой хроматографией на силикагеле (элюент 20%-ный метиленхлорид в гексане).
II. Синтез 5-трет-бутилдиметилсилилового эфира 2-(3-пиридинил) пентан-1,5-диола.
Карбоксилат (2,25 ммоль) восстанавливают до соответствующего спирта обработкой алюмогидридом лития (5,50 ммоль) при кипячении с обратным холодильником в ТГФ (100 мл) в атмосфере азота. Реакцию останавливают осторожным добавлением воды с последующей обработкой алюминиевых солей разбавленным водным раствором NaOH.
Реакционную массу фильтруют через целит и затем слои разделяют. Водный слой экстрагируют диэтиловым эфиром. Органические слои объединяют, сушат и концентрируют в вакууме. Полученное масло используют без дополнительной очистки.
III. Синтез трет-бутилдиметилсилилового эфира 5-бром-4-(3-пиридинил)пентанола.
Смесь 5-трет-бутилдиметилсилилового эфира 2-(3- пиридинил)пентан-1,5-диола (10 ммоль), тетрабромида углерода (11 ммоль и трифенилфосфина (11 ммоль) в дихлорметане (100 мл) перемешивают при комнатной температуре в течение 5 час. Добавляют воду и продукт экстрагируют дихлорметаном. Объединенные органические экстракты сушат и концентрируют. Остаток очищают быстрой хроматографией на колонке и получают трет-бутилдиметилсилиловый эфир 5-бром-4-(3-пиридинил)пентанола.
IV. Синтез диэтилового эфира, трет-бутилдиметилсилилового эфира 5-гидрокси-2-(3-пиридинил)пентилфосфоновой кислоты.
Раствор трет-бутилдиметилсилилового эфира 5-бром-4-(3- пиридинил)пентанола (0,75 ммоль) и триэтилфосфита (1,12 ммоль) выдерживают при 90oC в течение 72 ч, удерживая реакционную смесь в токе азота. Избыток триметилфосфита отгоняют и сырой остаток хроматографируют на силикагеле с использованием в качестве элюента 2%- ного раствора изопропанола в метиленхлориде. Полученный продукт используют в последующих реакциях без дополнительной очистки.
V. Синтез диэтилового эфира, трет-бутилдиметилсилилового эфира [5-гидрокси-2-(3-пиридинил) пентилиден]бис[фосфоновой кислоты].
К раствору диэтилового эфира, трет-бутилдиметилсилилового эфира 5-гидрокси-2-(3-пиридинил)пентилфосфоновой кислоты (15,0 ммоль) в безводном ТГФ (200 мл) добавляют втор-бутиллитий (33,0 ммоль, 1,3 М раствор в циклогексане) при 0oC. После окончания добавления перемешивание продолжают еще 30 мин. Полученный раствор медленно добавляют к раствору диэтилхлорфосфата (2,50 г, 14,47 ммоль) в безводном ТГФ (100 мл) при комнатной температуре.
После перемешивания реакционной массы в течение ночи реакцию останавливают добавлением насыщенного водного раствора бикарбоната натрия и реакционную массу экстрагируют метиленхлоридом. Объединенные органические экстракты сушат безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой продукт очищают быстрой хроматографией на силикагеле с использованием в качестве элюента 30%-ного раствора ацетона в гексане.
VI. Синтез диэтилового эфира [5-гидрокси-2-(3-пиридинил) пентилиден] бис[фосфоновой кислоты]
Силиловый эфир (0,50 ммоль) расщепляют путем его обработки тетрабутиламмоний фторидом (0,75 ммоль) в ТГФ при комнатной температуре в течение 30 мин. После снятия защиты реакционную массу промывают насыщенным раствором NaCl. Органический слой сушат сульфатом натрия, фильтруют и затем концентрируют в вакууме. Полученный остаток используют без дополнительной очистки.
VII. Синтез диэтилового эфира [5-бром-2-(3-пиридинил) пентилиден] бис[фосфоновой кислоты].
По методике, описанной в части III, диэтиловый эфир [5-гидрокси- 2-(3-пиридинил)пентилиден] бис[фосфоновой кислоты] превращают в диэтиловый эфир [5-бром-2-(3-пиридинил)пентилиден]бис[фосфоновой кислоты].
VIII. Синтез диэтилового эфира [5-ацетилтио-2-(3- пиридинил)пентилиден] бис[фосфоновой кислоты].
Раствор диэтилового эфира [5-бром-2-(3-пиридинил)пентилиден] бис[фосфоновой кислоты] (5,0 ммоль) перемешивают в сухом ацетоне (35 мл) и добавляют тиоацетат натрия (5,2 ммоль). Смесь перемешивают при 50oC в течение 12 час. После охлаждения до комнатной температуры растворитель упаривают в вакууме, полученный сырой остаток растворяют в метиленхлориде и промывают водой.
Органический слой затем сушат и концентрируют в вакууме. Желаемый продукт очищают быстрой хроматографией на силикагеле с использованием в качестве элюента градиента 5 - 10%-ного раствора изопропанола в метиленхлориде.
IX. Синтез [5-меркапто-2-(3-пиридинил)пентилиден]бис[фосфоновой кислоты] .
Диэтиловый эфир [5-ацетилтио-2-(3-пиридинил)пентилиден] бис[фосфоновой кислоты] (4,2 ммоль) растворяют в 2,5 М соляной кислоте (65 мл) и нагревают при температуре кипения с обратным холодильником в течение 7 час. Реакционную массу охлаждают и концентрируют в вакууме. Твердый остаток растирают в ацетоне и затем кристаллизуют из воды и этанола. Получают [5-меркапто-2- (3-пиридинил)пентилиден]бис[фосфоновую кислоту].
Пример J. Модель Шенка (Schenk Model).
Соединения настоящего изобретения оценивались in vivo на ингибирование костной резорбции и ингибирование минерализации с помощью модельной системы на животных, известной в области костного метаболизма как модель Шенка.
Общие принципы этой модельной системы раскрываются в работах Shinoda et al., Calcif. Tissue Int., 35, 87 - 99 (1983); - и Schenk et al., Calcif. Tissue Res. II, 196-214 (1973), которые введены в данное описание в качестве справочного материала.
Материалы и методы.
Животные.
Питающихся материнским молоком 17-дневных (30 г) самцов крыс Sprague Dawley (Charles River Breeding Laboratories) перевозят вместе с самками и после прибытия помещают в пластиковые камеры вместе с самками. В возрасте 19 дней молокососов, получающих крысиную еду и воду adlibitum, произвольно распределяют на испытуемые и контрольные группы, включающие по семь животных на группу.
В первый день и на 7 день снова всем животным вводят внутрибрюшинно (в/б) Кальцеин (1%-ный раствор в 0,9%-ном солевом растворе, доза - 0,2 мл/100 г веса тела). На 4 день всем животным делают инъекцию гидрохлорида тетрациклина (1%-ный раствор в 0,9%-ном солевом растворе, доза 0,2 мл/100 г веса тела).
Эти соединения служат маркерами активно минерализующихся (кальцинирующихся) кости и хряща.
Дозировка растворов и методика дозирования.
Все растворы готовят для подкожной инъекции в 0,9%-ном нормальном физиологическом растворе и доводят pH до 7,4 с помощью NaOH и/или HCl.
Расчет доз раствора осуществляют исходя из рассмотрения массы порошка (из расчета на молекулярный вес, гидратацию) активного материала в мг/кг (веса тела), что соответствует мг P/кг. Концентрации базируются на дозах 0,2 мл/100 г веса тела. Обычно все соединения назначаются из расчета 0,01, 0,1, 1,0 и 10,0 мг P/кг/день в течение 7 дней.
Соединения, проявляющие активность при 0,1 мг P/кг/день, затем испытывают при логарифмическом снижении к дозе 0,001 мг P/кг/день. Регулирование доз с учетом изменений веса тела проводят за счет дневной дозировки.
Аутопсия, работа с тканями и гистоморфометрия.
На 8 день после начала введения соединений все животные умерщвляются путем введения внутрибрюшинно сверхдозы пентабарбитола. Большеберцовые кости отсекают и помещают в 70%-ный этиловый спирт. Одну большую берцовую кость дегидратируют в растворах этанола и вносят в метилметакрилат, как это описано Шенком в работе Methods of Calcified Tissue Preparation (G. R, Dickson, Editor; Elsevier Science Publ., The Netherlands, 1984), которая введена в данное описание в качестве справочного материала.
Большую берцовую кость рассекают продольно через метафизарную зону. По одной из поверхностей образцы окрашивают нитратом серебра и устанавливают на предметном стекле микроскопа для оценки с помощью Quantimet Image Analyzer (Cambridge Instruments, Inc.), с использованием как накаливания, так и ультрафиолетового освещения.
Метафизарный трабекулярный костный состав измеряют в области между флуоресцентной меткой и пластиной новообразования: выражается как процент от общей площади (кость + костный мозг). Ширину эпифизарной пластины новообразования получают в виде среднего значения 10 одинаково ориентированных измерений поперечного сечения.
Статистическую оценку данных делают с использованием параметрического и непараметрического анализа вариаций и по тесту Wilcoxons rank sum для оценки статистически значимого эффекта по сравнению с контрольными животными.
С помощью модели Шенка получают данные для in vivo ингибирования костной резорбции с помощью соединений изобретения. Наиболее низкие эффективные (антирезорбтивные) дозы (НЭД) для конкретных испытанных соединений, которые определены с помощью модели Шенка.
Пример K. Адъювантная артритная модель.
Существует ряд примеров моделирования артрита на животных, например, спровоцированный адъювантом артрит, где используется Mycobacterium butyricum.
Эта модель представляет собой один из способов имитации ревматоидного артрита у человека (набухание суставов, связанное с инверсией клеток и паннуса суставной плоскости, костной резорбцией и высвобождением хемотоксических факторов и липосомных составляющих в суставное пространство) [1, 2].
Ряд профилактических и терапевтических исследований показывает на потенциальное использование при артритах противовоспалительных лекарств [3, 4] и дифосфонатов [5, 6].
Ссылки
1. Pearson С. , Wood F. (1959), Studies of Polyarthritis and Other Lesions Induced by Injection of Mycobacterial Adjuvant. 1. General Clinical and Pathological Characteristics and Some Modifying Factors, Arth. Rheum., 2:440-459.
2. Blackman A., Burns J.W., *Radziwonik H., Westwick J. (1977), An X-ray Analysis of Adjuvant Arthritis in the Rat. The Effect of Prednisolone and Indomethacin, Agents and Actions, 7:145-151. * Framer J.B.
3. Winter C. A., Nuss G. W. (1966), Treatment of Adjuvant Arthritis in the Rat with Anti-inflammatory Drugs, Arth. Rheum., 9:394-404.
4. Winder С. V., Lembke L. A., Stephens M. D. (1969), Comparative Bioassay of Drugs in Adjuvant-Induced Arthritis in Rats: Flufenamic Acid, Mefenamic Acid, and Phenylbytazone, Arth. Rheum., 12:472-482.
5. Francis M. D., Flora L., King W. R. (1972), The Effects of Disodium Ethane-l-Hydroxy-l-Diphosphonate on Adjuvant Induced Arthritis in Rats, Calcif. Tiss. Res., 9:109-121.
6. Flora L. (1979), Comparative Antiinflammatory and Bone Protective Effects of Two Diphosphonates in Adjuvant Arthritis, Arth. Rheum., 22:340-346.
Адъювантный артрит представляет собой тяжелый целлюлит и синовит, вызванный в самцах крыс (или линии Sprague Dawley или линии Lewis) при единичной подкожной инъекции (п/к) Mycobacterium butyricum (8 мг/мл) в минеральном масле в 0 день.
Соединения дозируются один раз в день или орально (п/о), или парентерально (п/к) и могут быть испытаны по профилактическому (с 0 дня) или терапевтическому (с 9 - 10 или 14 дня) режимам.
Антиартритная эффективность может быть измерена как уменьшение объема лапы, потеря веса тела, поражение кости или реактивированного образования новой кости по сравнению с контролем, обработанным физиологическим раствором. Обработка может быть остановлена с последующим изучением "внезапного обострения" (быстрого роста воспаления), по которому оценивают способность соединения сохранять активность.
Материалы и методы.
A. Животные.
Используются самцы крыс линии Lewis (LEW). По прибытии крыс случайным образом распределяют с помощью полученных на компьютере случайных чисел и размещают в отдельных, подвешенных на проволоке камерах. Пища и вода вводятся ad libitum в течение всего исследования. Уход и сохранность животных обеспечивают в соответствии с Государственным и Федеральным законодательством. Каждая крыса идентифицируется номером, который наносится впереди камеры и на хвосте крысы.
B. Экспериментальная методика.
В первый лень для всех животных измеряют вес тела (ВТ) и объем задней лапы [(ОЛ), регистрируемый по методу вытеснения ртути с помощью датчика давлений, соединенного с компьютером].
В 0 день следующим образом вызывают артрит с использованием MFA (Mycobacterium butyricum (Mb) 4,4 мг/кг в масле): крыс анестезируют и проводят единичную п/к инъекцию MFA в основание хвоста в асептических условиях.
Объемы лап и вес тел измеряют в различные дни, обычно дважды в неделю. При профилактическом режиме крыс случайным образом распределяют в две группы по 8 - 10 крыс и обработку начинают в 0 день и продолжают ежедневно до окончания опыта. При режиме лечения крыс случайным образом распределяют в группы по 8 - 10 крыс в соответствии ОЛ на 10 день.
Дозирование начинают на 10 день и продолжают ежедневно до окончания опыта. При обоих режимах на 10 день или после 10 дня животных размещают в обувных коробках с глубоко расположенной подстилкой.
Дозирующие растворы, для соединений, которые не могут окисляться.
Лекарства взвешивают на калибровочных весах и затем смешивают в мерной колбе с дистиллированной водой. Раствор доводят до pH 7,4 с помощью О,1N NaOH. Затем раствор фильтруют через 0,45 мкм стерильный фильтр в стерильный контейнер для хранения. Если раствор не используется, то его хранят в холодильнике.
Для соединений, которые могут окисляться.
Лекарства взвешивают на калибровочных весах и затем смешивают в мерной колбе с деионизированной водой. Исходный раствор фильтруют через 0,45 мкм стерильный фильтр в стерильный контейнер для хранения. Если раствор не используется, то его хранят в холодильнике.
Из расчета на дневную потребность конкретное количество раствора отбирают из базового раствора, помещают в небольшой мерный лабораторный стакан и затем доводят величину pH до 7,4 в соответствии с заранее произведенными расчетами. При необходимости могут быть сделаны дальнейшие разбавления раствора с установленным значением pH (с применением деионизированной воды).
Расчет лекарства осуществляется на основе молекулярного веса, степени чистоты соединения, количества из расчета на мг/кг (веса тела) и желаемой конечной концентрации в мг P/кг. Объем из расчета на одну крысу составляет 0,1 мл/100 г веса тела подкожно, получаемый в виде инъекции в паховую складку животного в разные стороны каждый день или 1 мл/200 г Вт, получаемых орально с использованием искривленной дозирующей рубки из нержавеющей стали.
Еженедельно, основываясь на изменениях веса тела, проводят корректировку доз.
Рентгенограмма, аутопсия и сбор тканей.
По окончании опыта каждую крысу умерщвляют с помощью введения внутрибрюшинно 1 мл Socomb®. Сразу же получают рентгенограмму всего тела с помощью рентгеновского элемента Torrox 1200 при MA = 5, ISUP = 50 и при времени = 60 сек на медицинской неэкранированной пленке Кодак.
Задние конечности каждой крысы отделяют и фиксируют в 10%-ном буферном формалине вместе с кусочками печени, почки, селезенки и thimus. Тибиотарзальные суставы декальцифицируют с помощью 4%-ного EDTA при pH 7,4 и обычным способом переводят в парафиновые блоки и H + E пятно.
Гистологические части оценивают количественно для патологических изменений кости и мягких тканей с использованием световой микроскопии. Рентгенограммы градуируют по костной резорбции (КР) на 6 анатомических трабекулярных участков кости в каждой задней лапе и 4 участка на каждой передней лапе по шкале 0 - 3, давая условный балл 0 - 60 для всех четырех конечностей.
Для реактивированного образования новой кости (РНК) рентгенограмму градуируют по шкале 0 - 3 для вторичной и медицинской поверхности большой берцовой кости и затем по шкале 0 - 2 для всех других поверхностей, которые упоминались выше, присваивая им условный балл 0 - 44.
D. Статистический анализ.
Данные анализа по объему лапы, костной резорбции и реактивированному образованию новой кости проводят с помощью student's t-test и одномаршрутному анализу вариаций с Tukeys (SAS) [12]. Различия рассматриваются значительными при pH 0,05 или ниже.
Рассматриваемая модель обеспечивает данные in vivo по эффективности антиартритных соединений с точки зрения уменьшения распухания костей лап и реактивированного нового образования кости в сравнении с артритными животными, обрабатываемыми физиологическим раствором.
Пример L. Капсулы готовят по обычным методикам, и они содержат следующие компоненты:
Активный ингредиент - мг на капсулу
[5-Меркапто-2-(3-пиридинил)пентилиден]бис[фосфоновая кислота] - 350,0
Наполнители
Лактоза - 99,0
Микрокристаллическая целлюлоза - 60,0
Стеарат магния - 1,0
Капсулы, имеющие приведенный выше состав, готовят с использованием обычных способов по методике, описанной ниже:
Активный ингредиент смешивают с микрокристаллической целлюлозой во вращающемся барабанном смесителе в течение приблизительно 10 мин.
Полученную смесь пропускают через молотковую мельницу с экраном в 80 меш.
Смесь вместе с лактозой снова помещают в смеситель с двойным барабаном и перемешивают в течение приблизительно 15 мин.
Далее добавляют стеарат магния и перемешивают еще 5 мин. Полученную смесь затем сжимают на поршневом устройстве для наполнения капсул.
Пример M. Готовят таблетки, имеющие следующий состав:
Активный ингредиент - мг на таблетку
[5-Меркапто-2-(3-пиридинил)этилиден]бис[фосфоновая кислота] - 700
Наполнители
Лактоза - 200
Крахмал (1500) - 100
Стеарат магния - 25
Таблетки, имеющие приведенный выше состав, готовят обычным способом, который описан ниже:
Активный ингредиент измельчают в шаровой мельнице в течение приблизительно 30 мин. Измельченный активный ингредиент затем смешивают в течение приблизительно 20 мин в двухлопастном смесителе с лактозой, высушенной при распылении.
К полученной смеси добавляют крахмал и смесь дополнительно перемешивают в течение 15 мин. Смесь прессуют в таблетки на стандартном прессе.
Описанные выше таблетки, используемые дважды в день в течение 6 месяцев, значительно уменьшают костную резорбцию у пациента, весящего приблизительно 70 кг, страдающего болезнью Педжета.
Аналогичные результаты получены при замене в описанных выше таблетках [2-меркапто- 2-(3-пиридинил)этилиден] бис[фосфоновой кислоты] на [(5-(3- меркаптопропил)-2-пиридинил)аминометилен] бис[фосфоновую кислоту]; [(5-(3-ацетилтиопропил)-2-пиридинил)аминометилен]бис[фосфоновую кислоту]; [(5-меркапто-2-пирилинил)аминометилен] бис[фосфоновую кислоту] ; [(4-(4-ацетилтиобутил)-2-пиридинил)аминометилен] бис[фосфоновую кислоту]; [(4-(4-меркаптобутил)-2-пиридинил)аминометилен] бис[фосфоновую кислоту]; а также их фармацевтически приемлемые соли или эфиры.
Пример N. Растворы для инъекций готовят обычными способами с использованием 10,0 мл физиологического раствора и 7,0 мг P [2-меркапто-2-(3-пиридинил)этилиден]бис[фосфоновой кислоты], при доведении pH до 7,4.
Одна инъекция, один раз в день в течение 4 дней приводит к заметному облегчению гиперкальцемии злокачественных образований у пациентов с весом приблизительно 70 кг.
Пример O. Мужчина-кавказец весом приблизительно 92 кг 72-летнего возраста страдает от умеренной до сильной боли, а также от периодического опухания правого коленного сустава. После приблизительно одного года постоянно увеличивающегося дискомфорта он посещает врача, который при клинической диагностике устанавливает остеоартрит правого колена, который впоследствии подтвердился при рентгеновском исследовании.
После периода улучшающей терапии различными NSAID-ами, в том числе аспирином, напросином и кетопрофеном, симптомы заболевания продолжают усиливаться, и состояние ухудшается. Он возвращается к своему врачу, который прописывает ему таблетки, приготовленные в соответствии с примером М, для приема дважды в день за два часа до или через два часа после еды в течение трех месяцев.
Клинические симптомы - боли и опухание суставов, особенно при продолжительной ходьбе, значительно улучшаются после трех месяцев лечения. После трех месяцев лечение продолжают неограниченно при дозировке 1 капсула, приготовленная по методике примера L, в лень, при половинной дозе, прописанной первоначально (то есть 1 капсула в лень).
Пример P. Женщина черной расы весом приблизительно 65 кг 55 - летнего возраста страдает опуханием и деформацией суставов пальцев обеих рук с частичной потерей прочности и/или гибкости ее пальцев и рук. После визуального и рентгеновского исследования, а также после различных клинических испытаний, проведенных Американской Ревматологической ассоциацией (АРА), устанавливается наличие ревматоидного артрита.
После безуспешного лечения анальгетиками и противовоспалительными агентами, врач прописывает ей таблетки, приготовленные по Примеру M, дважды в день за два часа до или после еды в течение четырех месяцев. После лечения в течение месяца, симптомы, связанные с опуханием суставов пальцев, заметно улучшаются и значительно повышается подвижность пальцев; она продолжает лечение в течение остальных четырех месяцев, после чего ее врач прописывает продолжение лечения предписанными дозами еще в течение 2 месяцев.
Пример Q. Девочка испанского происхождения 12-летнего возраста, весом приблизительно 37 кг, обращается к врачу с идиопатическим подростковым ревматоидным артритом. Симптомы заболевания включают воспаление большого числа суставов, сопровождающееся повышением температуры и болезненностью, что указывает на быструю и патологическую деградацию функции суставов.
Врач направляет ее к ревматологу, который немедленно прописывает ей интенсивное лечение путем введения по режиму IV раствора, приготовленного по Примеру N, в течение трех дней при дозе 1 инъекция в день, вводимая в течение 2 часов.
По окончании IV режима врач прописывает прием двух таблеток, полученных по Примеру М, дважды в день, за два часа до или через два часа после еды в течение двух месяцев, в течение которых наблюдается значительное улучшение, сопровождающееся увеличением подвижности и уменьшением болей.
По прошествии двух месяцев врач уменьшает дозу до 3/4 от первоначальной оральной дозы, прописывая 3 таблетки в течение двух дней, то есть один раз 2 капсулы в день и один раз 1 капсула в день.
По окончании этого режима дозу снова уменьшают до 1/4 от первоначальной дозы, давая пациентке капсулы, приготовленные по Примеру L, из расчета 1 капсула каждый день в течение дополнительных четырех месяцев.
Изобретение относится к новым тиозамещенным пиридинилбисфосфоновым кислотам ф-лы R2-Z-Q-(CR1R1)n-CH[P(O)(OH)2]2 (I), где R1-H, -SH, -(CH2)mSH или -S-C(O)-R3, R3 - C1-C8-алкил, m = 1 - 6, n = 0 - 6, Q - ковалентная связь или -NH-, Z - пиридинил, R2 - H, -SH, -(CH2)m, SH, -(CH2)mS-C(O)R3 или -NH-C(O)-R4-SH, где R3 и m имеют указанные значения, R4 - C1-C8-алкилен, или их фармацевтически приемлемым солям или эфирам. Изобретение относится также к фармацевтической композиции для лечения или предупреждения заболеваний, связанных с аномальным кальциевым и фосфатным метаболизмом, которая содержит соединение формулы (I) в эффективном количестве, и способу лечения указанного заболевания. 3 с. и 7 з.п. ф-лы.
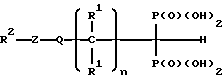
где R1 - водород, группы -SH, - (CH2)mSH или -S-C(O)-R3;
R3 - C1-C8-алкил;
m = 1 - 6, целое число;
n = 0 - 6, целое число;
Q - ковалентная связь или группа -NH-;
Z - пиридинил;
R2 - водород, группы - SH, -(CH2)mSH, -(CH2)mS-C(O)-R3 или -NH-C(O)-R4-SH, где R3 и m имеют указанные значения;
R4 - C1-C8-алкилен,
или их фармацевтически приемлемые соли или эфиры.
| Способ получения @ -аминозамещенных- @ -оксипропилидендифосфоновых кислот | 1981 |
|
SU1002300A1 |
| Способ получения производных дифосфоновой кислоты или их натриевых солей | 1985 |
|
SU1475487A3 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОАНТИМОНАТА НАТРИЯ | 0 |
|
SU186405A1 |
| EP 0230068 A, 1987 | |||
| EP 0243173 A, 1987. | |||
Авторы
Даты
1998-12-27—Публикация
1993-05-26—Подача