Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для определения in vitro активности комплемента по классическому пути активации при различных заболеваниях, которые могут протекать с вовлечением системы комплемента, в т.ч. при системных васкулитах, аутоиммунных заболеваниях (псориаз, хронический гепатит и т. д. ); коллагенозах (системная красная волчанка, ревматоидный артрит, ревматизм и т.д.); иммунокомплексных заболеваниях (гломерулонефрит, геморрагический васкулит и т.д.); аллергических заболеваниях (экзема, нейродермит, бронхиальная астма и т.д.); острых и хронических заболеваниях легких (пневмония, острый и хронический бронхит, экзогенный аллергический альвеолит, бронхолегочный аспергиллез) и других.
Известен способ количественного определения активности комплемента по 50%-ному гемолизу сенсибилизированных эритроцитов барана в рабочем буфере (содержащем барбиталовый буфер и раствор желатина) с фотометрической оценкой результатов [1]. При этом активность комплемента оценивают в единицах гемолитической активности (активность комплемента в норме составляет 80 - 120 ед.CH50) [2]. Указанный способ обеспечивает точность определения 99 - 100%.
Однако способ-аналог [1], предусматривающий гемолиз сенсибилизированных эритроцитов в присутствии комплемента в жидкой фазе, не позволяет обеспечить стабилизацию мембран сенсибилизированных эритроцитов в отношении неспецифического лизиса, что обусловливает необходимость наличия свежих эритроцитов барана и проведения их сенсибилизации непосредственно перед каждой процедурой определения, что значительно увеличивает продолжительность и трудоемкость процедуры. Кроме того, необходимость приготовления рабочего раствора каждые 7 дней, а также необходимость приготовления стандартов и разведений исследуемой пробы дополнительно увеличивают длительность и трудоемкость анализа.
Наиболее близким к заявленным решениям по совокупности существенных признаков являются способ и гель для определения активности комплемента [1]. Гель, принятый за прототип, содержит взвесь сенсибилизированных гемолитической сывороткой эритроцитов барана в агарозе. Способ-прототип включает следующие операции. Предварительно готовят гель для определения активности комплемента. При этом получают 2% золь агарозы в рабочем буфере (содержащем барбиталовый буфер, раствор желатина и воду) и охлаждают его до температуры 50oC. Затем на водяной бане (48oC) смешивают равные объемы полученного 2% золя агарозы и сенсибилизированных эритроцитов барана (сенсибилизация гемолитической сывороткой при температуре 37oC в течение 30 мин с последующим 3-кратным отмыванием), предварительно нагретых до этой температуры. Суспензию постепенно заливают между двумя стеклами, используя, например, пластины с габаритами 100 х 200 х 3 мм, имеющими зазор 1,5 мм. После охлаждения одну из пластин удаляют и в геле (на рабочей поверхности) проделывают специальным штампом по шаблону отверстия диаметром 3 мм на расстоянии 15 мм друг от друга (всего до 60 отверстий). Пластины с гелем можно сохранять при температуре 4oC в течение 3-4 дней без ущерба для качества геля. Для определения активности комплемент в каждое отверстие на рабочей поверхности геля вносят по 5 мкл неразведенной сыворотки крови (в опытной пробе - исследуемой сыворотки, в контрольной пробе - стандартной сыворотки). Пластину с гелем инкубируют 18 ч при температуре 4oC (для того, чтобы прошла диффузия) и еще 2 ч при температуре 37oC (для прохождения гемолиза). Считают, что величина зоны гемолиза пропорциональна активности комплемента. Зоны гемолиза оценивают визуально, иногда со слабым увеличением. При этом измеряют диаметр зоны гемолиза в геле в опытной и контрольной пробах (с помощью линейки, в мм). Выражают значение ширины зоны гемолиза в опыте в % от контроля и при совпадении результатов измерений в опыте и в контроле определяют нормальную активность комплемента, при снижении указанного показателя в опыте по сравнению с контролем определяют пониженную активность комплемента, а при его повышении - повышенную активность комплемента.
Однако способ и гель [1], принятые за прототип, не обеспечивают достигаемого при использовании заявленных объектов технического результата. Это обусловлено следующим. Используемый в способе-прототипе в качестве среды для гемолиза агарозный гель позволяет обеспечить только кратковременную (в течение 3-4 дней) стабилизацию структурно-функциональных свойств мембран эритроцитов, обусловливающих их устойчивость в отношении неспецифического лизиса и способность к комплементзависимому лизису. Это приводит к необходимости приготовления геля каждые 3-4 дня, в т.ч. проведения сенсибилизации свежих эритроцитов барана, что значительно увеличивает продолжительность и трудоемкость процедуры определения. Определение величины зоны гемолиза путем измерения ее диаметра (оценивается радиальная диффузия исследуемой сыворотки в геле), включая диаметр лунки, обусловливает неоднородность измеряемой зоны гемолиза (наличие гетерогенных участков), что снижает точность определения, особенно в случаях, когда величины зон гемолиза в опыте и в контроле незначительно различаются между собой. Негативно влияет на точность определения и отсутствие в способе-прототипе четко обозначенных диагностически достоверных количественных границ для значений показателя, характеризующего активность комплемента в норме с учетом индивидуальных колебаний, что не позволяет в ряде случаев однозначно установить, находится ли полученная величина зоны гемолиза в исследуемой пробе в пределах или за пределами нормы.
Задачей изобретения является создание способа и геля для определения активности комплемента, обеспечивающих пролонгированную стабилизацию структурно-функциональных свойств мембран сенсибилизированных эритроцитов, обусловливающих их повышенную устойчивость в отношении неспецифического лизиса и способность к комплементзависимому лизису при отсутствии ингибирующего влияния на комплементзависимый лизис и при гомогенности измеряемой зоны гемолиза.
Поставленная задача решается тем, что в способе определения активности комплемента, включающем приготовление геля, содержащего взвесь сенсибилизированных эритроцитов барана в агарозе, приготовление сыворотки крови обследуемого пациента, нанесение на рабочую поверхность геля в опытной пробе исследуемой сыворотки крови, а в контрольной пробе стандартной сыворотки крови (пул сывороток здоровых доноров), выдерживание опытной и контрольной пробы последовательно в течение не менее 18 ч при температуре 4oC, затем в течение не менее 2 ч при температуре 37oC и определение активности комплемента по отклонению значений величины зоны гемолиза в геле в опытной пробе по сравнению с контрольной, согласно изобретению в ходе приготовления геля во взвесь сенсибилизированных эритроцитов барана в агарозе дополнительно вводят селективный β2- адреностимулятор в концентрации 0,005 - 0,01 г/л взвеси. Полученную взвесь вносят в емкость из прозрачного материала, формируя гель таким образом, чтобы площадь рабочей поверхности геля составляла не более 16 мм2, а высота геля превышала величину зоны гемолиза в норме не менее чем в 2,5 - 3 раза. Оптимальным является заполнение емкости взвесью на 50 - 75% по высоте, причем наиболее эффективно использование емкости, имеющей внутреннюю полость прямоугольного сечения. Оптимальным является также нанесение сыворотки крови в опытной и контрольной пробах на рабочую поверхность геля таким образом, чтобы она равномерно распределялась по поверхности геля с толщиной слоя сыворотки не менее 2 мм. Величину зоны гемолиза в геле определяют путем измерения ее глубины и при значении указанного показателя в опытной пробе, составляющем менее 80% от значения показателя в контрольной пробе, определяют пониженную активность комплемента, при значении показателя в опыте, составляющем от 80 до 120% значения показателя в контроле, определяют нормальную активность комплемента, а при значении показателя в опыте свыше 120% от контроля определяют повышенную активность комплемента. Поставленная задача решается также тем, что гель для определения активности комплемента, содержащий взвесь сенсибилизированных гемолитической сывороткой эритроцитов барана в агарозе, согласно изобретению дополнительно содержит селективный β2- адреностимулятор при следующем соотношении компонентов, г/л: агароза 9,0 - 11,0; желатин 0,18 - 0,22; β2- адреностимулятор 0,005 - 0,010; барбиталовый буфер 176 - 216 мл/л; сенсибилизированные гемолитической сывороткой эритроциты барана 8,8 - 10,8 мл/л; вода дистиллированная до 1 литра. В качестве селективного β2- адреностимулятора наиболее эффективным является использование, например, фенотерола, сальбутамола, тербуталина.
Выбор оптимальных параметров заявленных объектов, обеспечивающих наибольшую эффективность изобретения при его реализации, осуществляли следующим образом. Предварительно по результатам обследования 253 здоровых детей в возрасте от 1 месяца до 15 лет с использованием заявленного способа и геля авторами изобретения было установлено, что глубина зоны гемолиза в норме составляет 4 ± 1 мм.
Для установления оптимальных геометрических параметров и оптимальной конфигурации геля заявленного состава исследовали влияние различных величин рабочей поверхности и высоты геля с учетом формы сечения внутренней полости емкости, содержащей гель, на срок сохранения диагностических свойств сенсибилизированных эритроцитов барана в геле и на точность определения активности комплемента. При этом срок сохранения качества геля устанавливали путем периодического (первые 7 дней, начиная с момента внесения геля в емкость, - ежедневно, затем 1 раз в каждые 5-7 дней в течение всего срока наблюдения) измерения оптической плотности геля на фотоэлектроколориметре "КФК-2МП" и параллельного (в те же сроки) определения с помощью заявленного способа активности комплемента в сыворотках крови с подтвержденной контрольным способом активностью комплемента. В качестве контрольного способа использовали оценку активности комплемента по 50%-ному гемолизу сенсибилизированных бараньих эритроцитов в рабочем буфере с фотометрической оценкой результатов [1] (способ-аналог). Приготовление геля (в 3-х вариантах) осуществляли согласно заявленному способу с добавлением различных β2- адреностимуляторов: в 1 варианте - беротека-100 (производства фирмы Boehringer Ingelheim, Германия); во 2 варианте - вентолина (производства фирмы Glaxo, Великобритания) и в 3 варианте - бриканила (производства фирмы EGIS, Венгерская республика) в концентрации 0,005 г/л взвеси. В качестве емкостей для внесения геля (и последующего его хранения) использовали прозрачные пробирки, выполненные из материала типа пластигласа в форме прямоугольного параллелепипеда (имеющие внутреннюю полость прямоугольного сечения) и пробирки цилиндрической формы (имеющие внутреннюю полость круглого сечения) с различными габаритами, обеспечивающими заданное варьирование исследуемых геометрических параметров геля (площади рабочей поверхности и высоты геля).
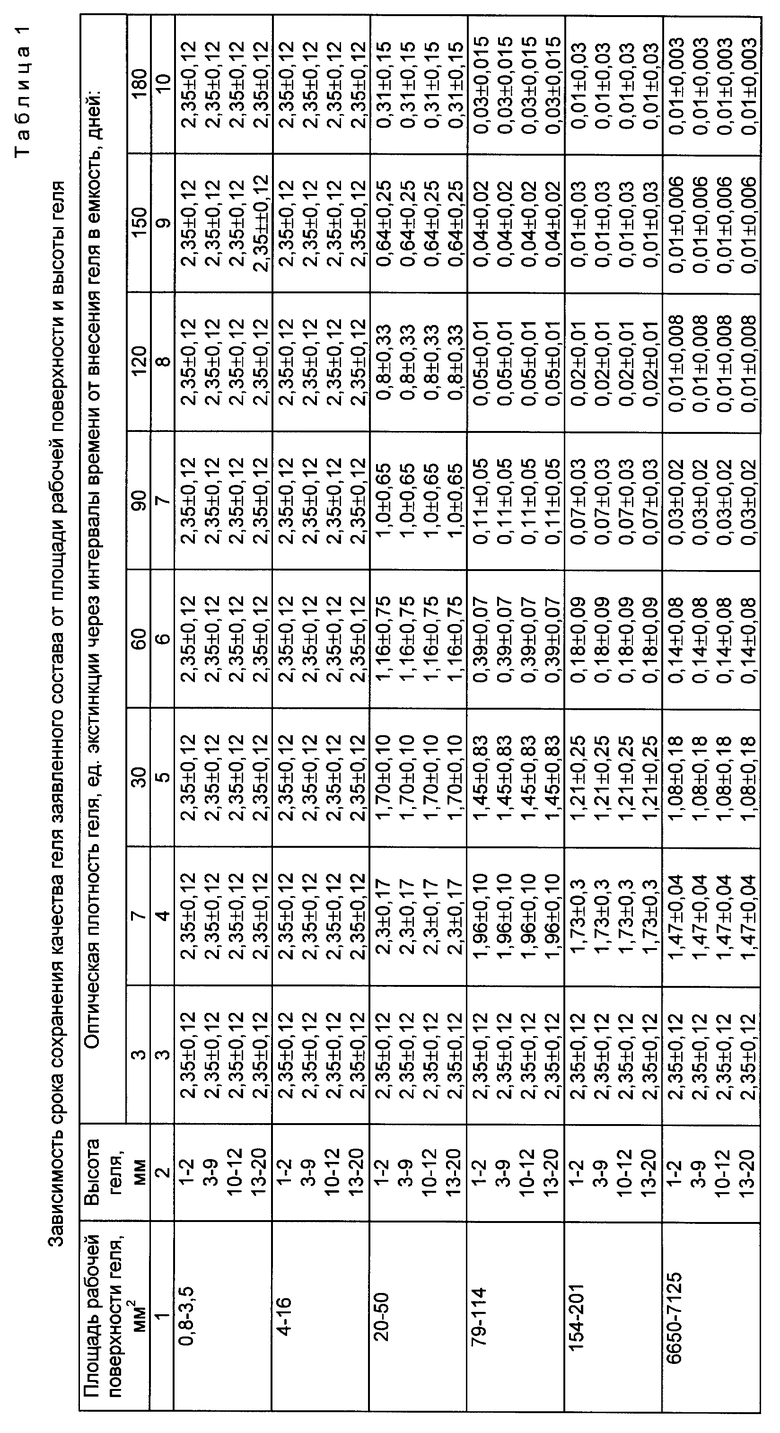
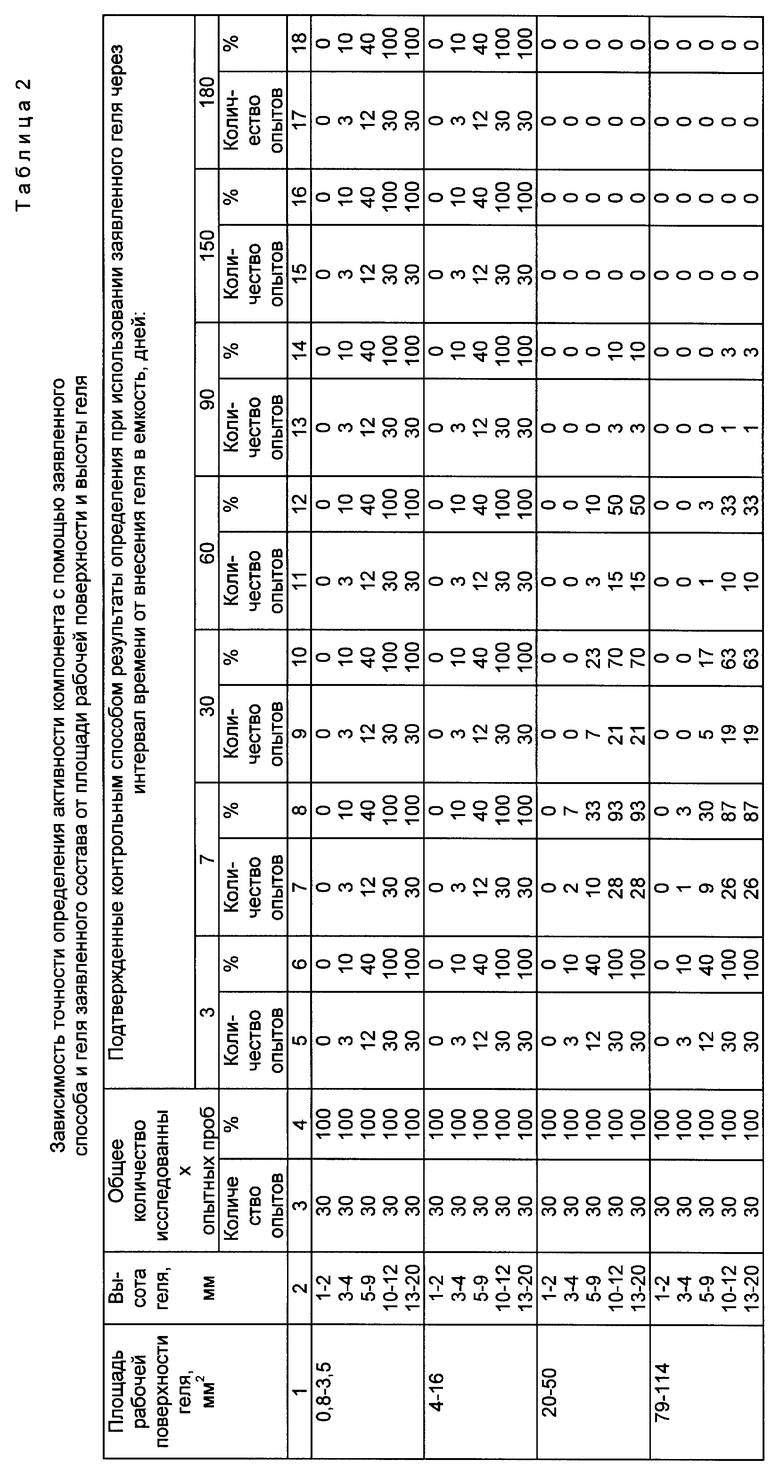
Зависимость срока сохранения качества геля заявленного состава от площади рабочей поверхности и высоты геля приведена в таблице 1 (выборочно). Зависимость точности определения активности комплемента с помощью заявленного способа и геля заявленного состава от площади рабочей поверхности и высоты геля приведена в таблице 2 (выборочно).
Авторами заявленного способа и геля выявлено наличие нелинейной зависимости между снижением оптической плотности геля и уменьшением точности определения активности комплемента с использованием указанного геля. Учитывая, что снижение оптической плотности геля с наибольшей вероятностью связано с неспецифическим лизисом эритроцитов барана в геле, а точность определения зависит в т.ч. от наличия в геле достаточного количества нелизированных эритроцитов, а также от способности сенсибилизированных эритроцитов к комплементзависимому лизису, оценка качества геля по двум указанным параметрам в целом позволяет судить о степени сохранения диагностических качеств сенсибилизированных эритроцитов барана в геле в течение срока наблюдения. Точность определения активности комплемента, которая является сложной функцией от нескольких аргументов, с одной стороны, выступает в качестве показателя, позволяющего оценить качество геля в различные периоды наблюдения, а с другой стороны, - в качестве показателя эффективности заявленного способа, позволяющего учесть влияние различных факторов на результаты анализа в ходе процедуры определения.
Авторами изобретения установлено, что оптическая плотность геля практически не зависит от высоты геля и его конфигурации (которая, в свою очередь, обусловливается формой сечения внутренней полости емкости). Однако величина площади рабочей поверхности геля оказывает существенное влияние на указанный показатель качества геля. Так, из данных таблицы 1 видно, что при площади рабочей поверхности геля, составляющей от 0,8 до 16 мм2, оптическая плотность геля практически не меняется в течение 6 месяцев (180 дней), что свидетельствует об отсутствии неспецифического лизиса эритроцитов барана в геле в течение указанного срока. При увеличении рабочей поверхности геля свыше 16 мм2 оптическая плотность геля снижается, начиная уже с 7-го дня наблюдения, причем тем более значительно, чем больше площадь рабочей поверхности геля. Точность определения активности комплемента зависит не только от площади рабочей поверхности геля, но и от его высоты и конфигурации. Так, данные таблицы 2 свидетельствуют о снижении точности определения (возрастает количество ложнозавышенных результатов) с увеличением площади рабочей поверхности геля свыше 16 мм2, начиная с 7-го дня наблюдения (коррелируя со снижением оптической плотности). Выявлено, что наибольшая точность определения в течение срока наблюдения от 1 до 180 дней имеет место в интервале значений рассматриваемого геометрического параметра от 0,8 до 16 мм2, однако при использовании гелей с площадью рабочей поверхности 0,8 - 3,5 мм2 возникают технические сложности, связанные с необходимостью внесения сыворотки в емкость сверхмалых габаритов. Результаты, представленные в таблице 2, показывают также, что наибольшая точность определения при любой площади рабочей поверхности геля наблюдается при высоте геля 10 - 12 мм (превышающей величину зоны гемолиза в норме в 2,5 - 3 раза), достигая максимальных величин (100%) при площади рабочей поверхности геля 4 - 16 мм2. Использование гелей с меньшей высотой даже при оптимальной площади рабочей поверхности геля (4 - 16 мм2) приводит к значительному снижению точности определения (на 60 - 100%) при уменьшении высоты геля соответственно от 5 - 9 до 1 - 2 мм за счет увеличения количества ложнозаниженных результатов определения. При увеличении высоты геля свыше 12 мм точность определения не меняется, однако при этом неоправданно возрастает количество геля, необходимое для достижения указанного параметра. Кроме того, авторами изобретения обнаружено, что использование емкостей с круглой формой сечения внутренней полости при любых площадях рабочей поверхности геля обеспечивает несколько меньшую точность определения активности комплемента, чем в случае использования емкостей с прямоугольной формой указанного сечения. Так, при оптимальной площади и высоте геля разница в точности определения при использовании рассматриваемых вариантов емкостей составляет 8 - 10%.
Установлено, что для емкости, имеющей как прямоугольную, так и круглую форму сечения внутренней полости, оптимальным является заполнение ее гелем на 50 - 75% по высоте. Это обусловлено тем, что заполнение емкости гелем менее чем на 50% при заданной оптимальной рабочей поверхности геля (4 - 16 мм2) не позволяет обеспечить оптимальную высоту геля (10 - 12 мм). Верхний предел заполнения емкости гелем по высоте (75%) обусловлен необходимостью наличия пространства для заполнения его исследуемой сывороткой крови при проведении анализа (не мене 4 мм), а также свободного пространства (не менее 1 - 2 мм) для исключения контакта исследуемой сыворотки крови с крышкой.
Для определения оптимального количественного и качественного состава геля исследовали влияние различных адреностимуляторов (селективных β2- адреностимуляторов и неселективных α+β- адреностимуляторов) в составе геля в различных концентрациях на срок сохранения диагностических свойств сенсибилизированных эритроцитов барана в геле. Указанный срок устанавливали путем измерения оптической плотности геля и точности определения активности комплемента с использованием тех же средств и методов и с той же периодичностью, что и при установлении оптимальных геометрических параметров и конфигурации геля. Приготовление геля осуществляли согласно заявленному способу в 25 вариантах, причем готовый гель содержал соответственно:
1 вариант - взвесь сенсибилизированных эритроцитов барана в агарозе;
2 - 7 варианты - взвесь сенсибилизированных эритроцитов барана в агарозе с добавлением беротека-100 β2- адреностимулятора) в концентрациях 2,5; 5,0; 7,5; 10,0; 12,5; 15,0 г/л взвеси;
8 - 13 варианты - взвесь сенсибилизированных эритроцитов барана в агарозе с добавлением вентолина ( β2- адреностимулятора) в тех же концентрациях;
14 - 19 варианты - взвесь сенсибилизированных эритроцитов барана в агарозе с добавлением бриканила ( β2- адреностимулятора) в тех же концентрациях;
20 - 25 варианты - взвесь сенсибилизированных эритроцитов барана в агарозе с добавлением адреналина производства Московского эндокринного завода (госконцерн "Биопрепарат" ( α+β- стимулятора) в тех же концентрациях.
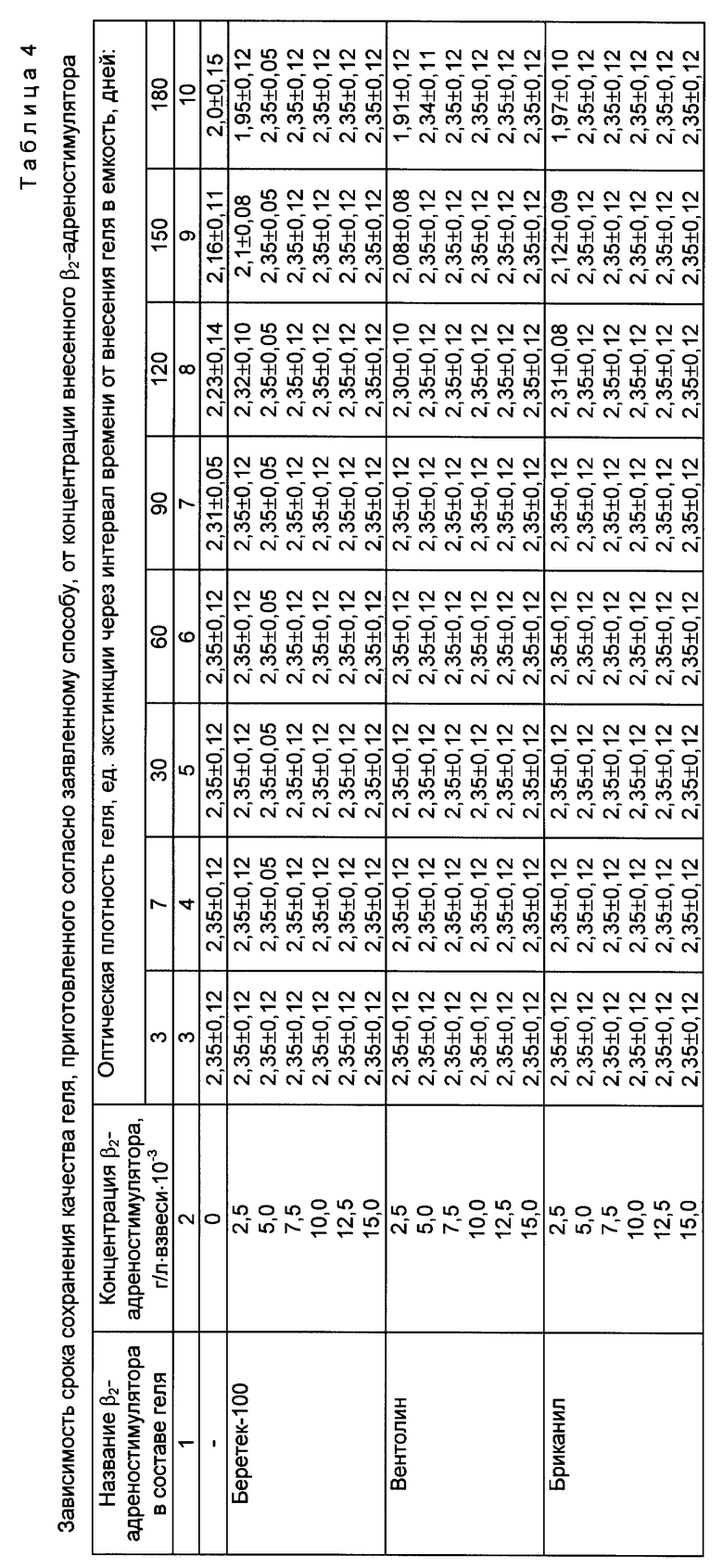
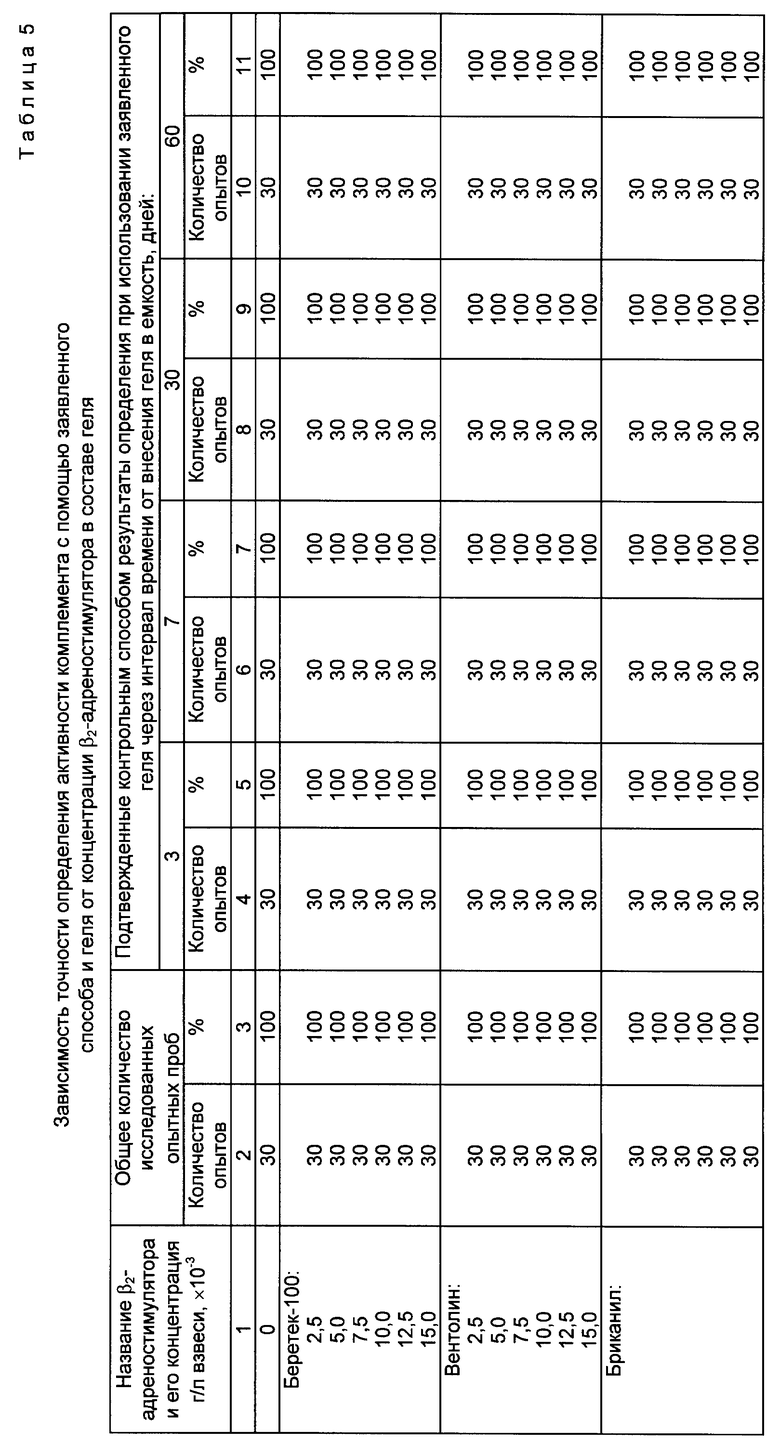
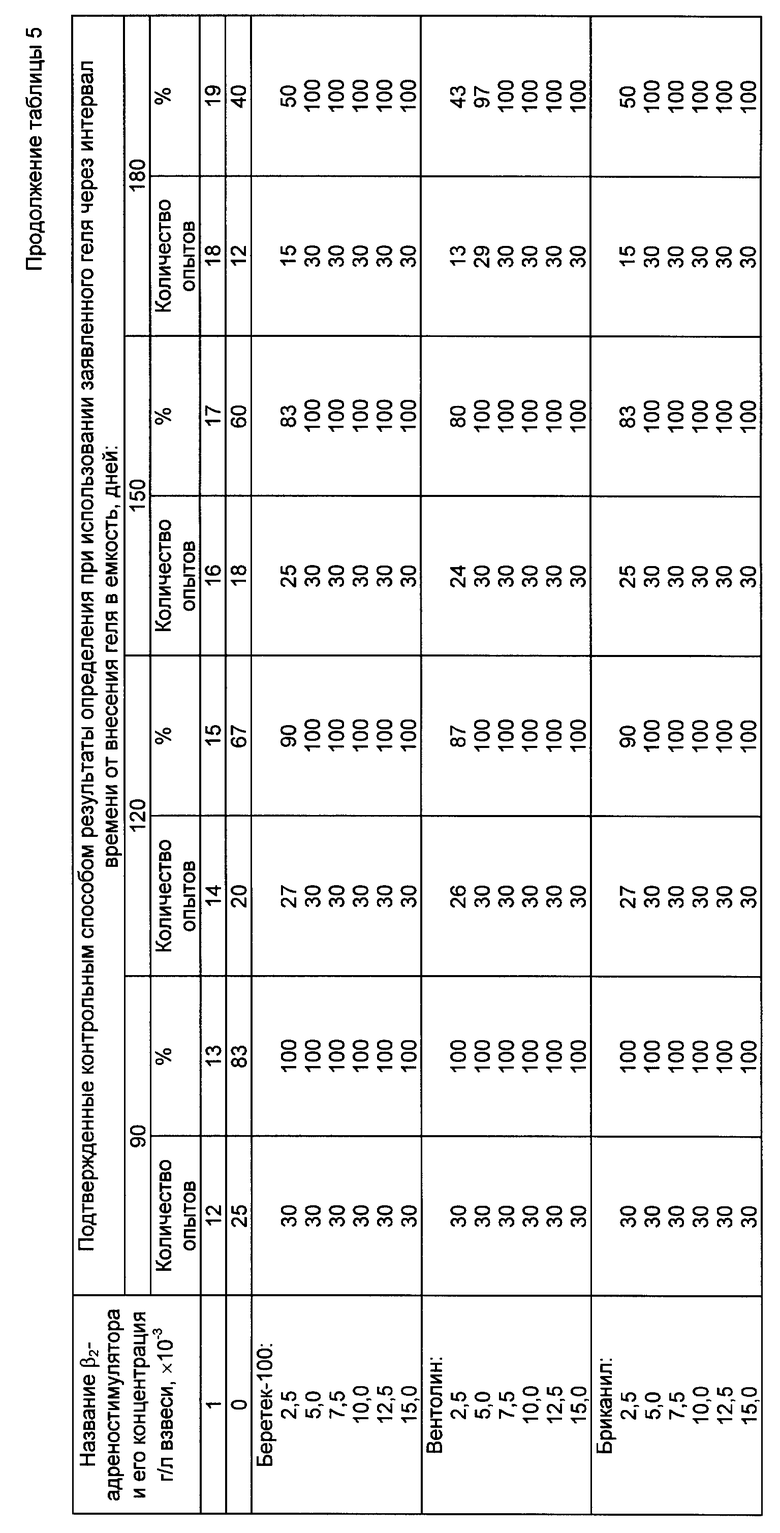
При этом учитывали, что в процессе приготовления геля суммарная погрешность опыта составляет примерно 10%. В качестве емкостей для внесения геля (и последующего его хранения вплоть до проведения анализа) использовали прозрачные пробирки, выполненные в виде прямоугольного параллелепипеда с габаритами 4 х 9,5 х 18 мм (толщина стенок 1 мм). Зависимость срока сохранения качества геля, приготовленного согласно заявленному способу, от его состава представлена в таблице 3 (выборочно). Зависимость срока сохранения качества геля, а также зависимость точности определения активности комплемента с помощью заявленного способа и геля от концентрации внесенного β2- адреностимулятора представлены соответственно в таблицах 4 и 5 (выборочно).
Из данных таблиц 3 - 5 следует, что введение β2- адреностимулятора в состав геля (при его приготовлении согласно заявленному способу) позволяет увеличить срок сохранения диагностических свойств сенсибилизированных эритроцитов барана в геле по сравнению с гелем (приготовленным согласно заявленному способу), содержащим только взвесь сенсибилизированных эритроцитов барана в агарозе (срок сохранения качества последнего составляет 2 месяца). При этом максимальное пролонгирование указанного срока (до 6 месяцев включительно) достигается начиная с концентрации β2-адреностимулятора 0,005 г/л взвеси и не изменяется при дальнейшем увеличении концентрации. В пределах интервала значений концентраций 0,005 - 0,01 г/л взвеси показатели, характеризующие срок сохранности геля (оптическая плотность, точность определения), стабилизируются ( на нижней границе интервала -0,005 г/л взвеси для некоторых из рассмотренных β2 -адреностимуляторов, например вентолина, показатели оптической плотности и точности определения незначительно снижаются при сроке хранения 170 - 180 дней, однако указанное снижение недостоверно). Использование концентраций β2-адреностимулятора выше 0,01 г/л взвеси нецелесообразно, т.к. не обеспечивает дальнейшего роста показателей качества геля, однако приводит к неоправданному расходу дорогостоящих импортных препаратов. Использование концентраций меньших чем 0,005 г/л взвеси снижает срок сохранения качества геля (при концентрации 0,0025 г/л взвеси указанный срок составляет 3 месяца). При внесении адреналина в различных концентрациях наблюдалось ухудшение качества геля начиная с 1 - 1,5 месяцев (в таблице 3 приведены выборочные данные при концентрации препарата 0,005 г/л взвеси). Таким образом, срок сохранения качества геля при введении в его состав неселективного адреностимулятора оказался меньше, чем аналогичный срок для геля без добавок адреностимулятора.
Для выявления диагностически значимого интервала значений величины зоны гемолиза (измеряемой согласно заявленному способу), позволяющего четко разграничить норму и патологию, с использованием заявленного способа и геля были обследованы 3 группы больных детей в возрасте от 1 месяца до 15 лет:
I группа - больные с подтвержденным контрольным способом [1] понижением активности комплемента (60 человек (чел.), в том числе больные с ревматоидным артритом - 3 чел., с системной красной волчанкой - 4 чел., с хроническим гепатитом - 7 чел., с геморрагическим васкулитом - 8 чел., с гломерулонефритом - 38 чел.;
II группа - больные с подтвержденным контрольным способом [1] нормальным уровнем активности комплемента (60 чел.), в том числе больные с бронхиальной астмой - 35 чел., с атопическим дерматитом (экзема, нейродермит) - 25 чел.;
III группа - больные с подтвержденной контрольным способом [1] повышенной активностью комплемента (60 чел.), в том числе больные с острой пневмонией - 51 чел., с острым бронхитом - 9 чел. При определении активности комплемента с использованием заявленного способа и геля в опытную пробу вносили исследуемую сыворотку крови больного, в контрольную пробу - стандартную сыворотку крови (пул сывороток от 30 здоровых доноров). Установлено, что глубина зоны гемолиза стандартной сыворотки крови составляет в среднем (4,0 ± 0,2) мм. Распределение больных с различной активностью комплемента в зависимости от величины зоны гемолиза в сравнении с контролем представлено в таблице 6.
Из данных таблицы 6 видно, что величины зон гемолиза, полученные в опытных пробах у больных детей с подтвержденной нормальной активностью комплемента, со 100%-ной вероятностью попадают в интервал значений, составляющих 80 - 120% от значений аналогичных показателей контрольных проб. У больных с подтвержденной пониженной активностью комплемента показатели опытных проб находятся в интервале 0 - 79% от значений показателей контрольных проб, а у больных с подтвержденной повышенной активностью комплемента - в интервале 121 - 200% от значений величин гемолиза в контрольных пробах.
Для установления оптимальной толщины слоя исследуемой сыворотки крови, наносимой на рабочую поверхность геля, в ходе процедуры определения активности комплемента заявленным способом в прозрачные пробирки, выполненные в виде параллелепипеда с габаритами 4 х 9,5 х 18 мм (толщина стенок 1 мм), вносили исследуемые сыворотки крови с подтвержденной контрольным способом [1] активностью комплемента в различных количествах (0,008; 0,015; 0,03; 0,045; 0,06; 0,075 мл) с тем, чтобы обеспечить формирование слоя исследуемой сыворотки на рабочей поверхности геля толщиной соответственно 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 мм. Зависимость точности определения активности комплемента от толщины слоя исследуемой сыворотки крови представлена в таблице 7.
Из данных таблицы 7 следует, что при толщине слоя исследуемой сыворотки крови 2 мм и более точность определения активности комплемента достигает максимальных значений (100%). Однако увеличение слоя свыше 3 мм нецелесообразно, т.к. приводит к неоправданному увеличению расхода сыворотки крови, которая может быть использован для других иммунологических анализов. При толщине слоя исследуемой сыворотки менее 2 мм точность определения падает за счет увеличения количества ложнозаниженных результатов определения.
Достижение обеспечиваемого изобретением технического результата обусловлено следующим. Известно, что агарозный гель оказывает кратковременное стабилизирующее действие в отношении эритроцитов, которое позволяет предотвратить неспецифический гемолиз и способствует сохранению способности эритроцитов к комплементзависимому лизису в течение 3 - 4 дней [1]. Известно, что β- адренергические вещества или β- адреностимуляторы ( β- адреномиметики) оказывают избирательное действие на β1 и β2 адренорецепторы. Существует ряд β- адреностимуляторов, оказывающих избирательное действие только на β2 адренорецепторы. К селективным β2 адреностимуляторам по современным представлениям относят такие препараты, как фенотерол (беротек), сальбутамол (вентолин), тербуталин (бриканил) и др. По последним данным β- адреностимуляторы (в т. ч. β2 адреностимуляторы) тормозят высвобождение из тучных клеток хемотаксических факторов (гистамин, медленнореагирующее вещество анафилаксии и др.), способствующих бронхоспазму и явлениям воспаления [3, 4, 5] . Имеются также сведения о способности β2- адреностимуляторов стабилизировать мембраны тучных клеток в отношении специфических (влияние аллергенов) и неспецифических воздействий (влияние либераторов гистамина из тучных клеток) [6] . Известно, что стимуляция α- рецепторов неселективными адреностимуляторами (воздействующими на α, β1 и β2- адренорецепторы) может приводить к выбросу гистамина из тучных клеток [5]. Однако при анализе патентной и научно-технической литературы не обнаружено каких-либо сведений о влиянии адреномиметиков (как селективных, так и неселективных) на мембраны эритроцитов и на способность сенсибилизированных эритроцитов к комплементзависимому лизису. Не выявлено также данных о влиянии геометрических параметров, конфигурации и состава агарозного геля на его стабилизирующие свойства в отношении мембран эритроцитов, а также на точность определения активности комплемента.
По мнению авторов изобретения, агарозный гель (приготовленный и сформированный согласно заявленному способу), контактируя с мембраной эритроцита, препятствует в течение длительного времени выходу из эритроцитов в окружающую среду органических и неорганических составных частей цитоплазмы. Входящий в состав геля β2- адреностимулятор (в оптимальной концентрации) в комплексе с агарозой способствует сохранению в течение длительного времени (до 6 месяцев) структурно-функциональных свойств мембран эритроцитов, обусловливающих их повышенную устойчивость в отношении неспецифического лизиса, а также способность сенсибилизированных эритроцитов к комплементзависимому лизису. Выявленное авторами заявленных объектов ухудшение качеств геля при введении в его состав неселективного адреностимулятора - адреналина (по сравнению с агарозным гелем без добавок адреностимулятора) может быть обусловлено тем, что указанный препарат, возбуждая α- адренорецепторы, по-видимому, представленные в незначительном количестве и на мембране эритроцитов (в последнее время появились сведения и о наличии α- рецепторов на мембранах лейкоцитов [7] ), вызывает повышение проницаемости мембраны, тем самым создавая условия для ускоренного неспецифического лизиса эритроцита. Оптимальная площадь рабочей поверхности геля в сочетании с β2- адреномиметиком (в составе геля), по мнению авторов изобретения, позволяет также обеспечить сохранение структуры поверхностного слоя геля и тем самым предотвратить спонтанные негативные изменения свойств мембран эритроцитов, в т.ч., по-видимому, за счет исключения возможности создания условий для возникновения центров образования гетерогенных структур, а также возможности образования полимерных соединений, обладающих свойствами лектинов, которые, связываясь с мембраной эритроцита, способствуют его неспецифическому лизису.
Оптимальная высота геля заявленного состава (в сочетании с оптимальной площадью его рабочей поверхности) является необходимой и достаточной, чтобы обеспечить существование (после окончания процесса комплементзависимого лизиса эритроцитов в ходе определения) как зоны гемолиза, так и зоны негемолизированных эритроцитов. Это, в свою очередь, создает возможность адекватной оценки реальной активности комплемента даже при максимально возможной (с учетом характера заболевания и индивидуальных колебаний) глубине зоны гемолиза. При высоте геля меньше оптимальной в ряде случаев (особенно при высоте геля 3 - 4 мм и менее, а также при повышенной активности комплемента) лизируется вся содержащаяся в емкости гемолитическая смесь, что приводит к недооценке реальной активности комплемента и увеличению процента ложнозаниженных результатов определения.
Прямоугольная форма внутренней полости емкости, в которую вносится гель в ходе его приготовления, обеспечивает формирование ровной горизонтальной рабочей поверхности геля прямоугольной формы, которая позволяет точно измерить глубину гемолиза в геле. Использование емкостей с круглой формой сечения внутренней полости приводит в ряде случаев к формированию рабочей поверхности геля сложной конфигурации (дисковидной), что затрудняет измерение глубины зоны гемолиза в ходе анализа и приводит к повышению процента ложнозавышенных и/или ложнозаниженных результатов определения активности комплемента.
Использование геля, сформированного согласно заявленному способу, позволяет оценивать глубину вертикальной диффузии исследуемой сыворотки в геле. При этом сыворотка непосредственно контактирует только с гелем, что обеспечивает однородность (гомогенность) измеряемой зоны гемолиза, что, в свою очередь, повышает точность определения активности комплемента (по сравнению с прототипом) за счет снижения ложнозавышенных результатов определения.
Оптимальная толщина слоя исследуемой сыворотки крови, наносимой на рабочую поверхность геля в ходе заявленной процедуры определения, позволяет получить величину зоны диффузии сыворотки в геле, адекватно отражающую реальную активность комплемента в исследуемой сыворотке. При формировании более тонкого (чем оптимальный) слоя сыворотки на рабочей поверхности геля зона максимально возможной для данной толщины слоя диффузии может в ряде случаев оказаться меньше зоны диффузии, необходимой и достаточной, чтобы адекватно отразить реальную активность комплемента в данной сыворотке. Это приведет к повышению количества ложнозаниженных результатов определения.
И, наконец, экспериментально установленные заявленные интервалы значений величин зон гемолиза, характеризующие нормальную (составляющую 80 - 120% от контроля), пониженную (0 - 79% от контроля) или повышенную (121% и более от контроля) активность комплемента у больных позволяет учесть индивидуальные колебания и дает возможность четко выявить принадлежность полученных в ходе анализа (с помощью заявленного способа и геля) результатов к норме или к патологии. Это повышает точность определения (по сравнению с прототипом) за счет исключения ложнозавышенных и ложнозаниженных результатов определения.
Таким образом, именно заявленная совокупность действий в ходе процедуры определения активности комплемента, а также заявленный количественный и качественный состав геля, предназначенного для использования в ходе указанной процедуры, обеспечивают стабилизацию специфических структурно-функциональных свойств мембран сенсибилизированных эритроцитов при отсутствии ингибирующего влияния на комплементзависимый лизис и отсутствие гетерогенных участков в измеряемой зоне гемолиза. При этом из известного уровня техники не выявляется, по мнению заявителей, влияния предписываемых изобретением преобразований, характеризуемых отличительными от прототипа существенными признаками, на достижение технического результата.
Способ осуществляют следующим образом. Предварительно готовят гель для определения активности комплемента. При этом сначала готовят рабочий буфер, содержащий барбиталовый буфер, дистиллированную воду и раствор желатина, по прописи, приведенной в руководстве [1], pH рабочего буфера 7,2. Получают 2% золь агарозы в рабочем буфере и охлаждают его до температуры 50oC. На водяной бане (48oC) смешивают равные объемы полученного золя агарозы и сенсибилизированных эритроцитов барана (сенсибилизация гемолитической сывороткой при температуре 37oC в течение 30 мин с последующим 3-кратным отмыванием рабочим буфером по методике [1], предварительно нагретых до этой температуры. В полученную смесь добавляют селективный β2- адреностимулятор, например фенотерол (беротек), сальбутамол (вентолин), тербуталин (бриканил) и т. д. в концентрации 0,005 - 0,01 г/л взвеси. Быстро разносят взвесь в прозрачные емкости, например, пробирки, выполненные в виде прямоугольного параллелепипеда из материала типа пластигласа, заполняя их взвесью на 50 - 75% по высоте таким образом, чтобы обеспечить формирование геля с площадью рабочей поверхности 4 - 16 мм2 и высотой 10 -12 мм, и закрывают емкости (пробирки) крышками (пробками). Емкости (пробирки) с гелем хранят до использования в холодильнике при температуре 4oC (до 6 месяцев включительно).
У больного утром натощак берут 0,5 мл крови из пальца или из вены в сухую пробирку. Получают сыворотку крови, например, по методике [8] путем центрифугирования крови при 1500 об/мин в течение 15 мин. Для определения активности комплемента берут 4 пробирки с гелем: две опытные и две контрольные. В каждую опытную пробирку вносят исследуемую сыворотку больного в количестве, необходимом и достаточном, чтобы она равномерно распределилась по рабочей поверхности геля с толщиной слоя сыворотки не менее 2 мм. В каждую контрольную пробирку вносят в таком же количестве стандартную сыворотку (пул сывороток от 30 здоровых доноров можно хранить при температуре (-)80oC). Все пробирки (опытные и контрольные) помещают сначала в холодильник, где выдерживают при температуре 4oC не менее 18 ч, затем - в термостат, где их выдерживают при температуре 37oC не менее 2 ч. После этого измеряют глубину зоны гемолиза в геле в опытных и контрольных пробирках, например, визуально с помощью линейки (в мм). Выражают среднее численное значение глубины зоны гемолиза в опыте в % от контроля и при значении указанного показателя в опыте, составляющем менее 80% от значения показателя в контроле, определяют пониженную активность комплемента, при значении показателя в опыте, составляющем от 80 до 120% от значения показателя в контроле, определяют нормальную активность комплемента, а при значении показателя в опыте свыше 120% от контроля определяют повышенную активность комплемента. Используя стандарты и разведения исследуемой пробы, можно также оценивать активность комплемента в единицах гемолитической активности (CH50).
Изобретение иллюстрируется следующими примерами.
Пример 1.
Готовили 3 варианта геля для определения активности комплемента (по 50 мл геля каждого из вариантов).
Для приготовления 50 мл геля предварительно готовили рабочий буфер по прописи, приведенной в руководстве [1]. При этом сначала готовили 2 исходных раствора:
1) Барбиталовый буфер при следующем соотношении компонентов, г/л:
NaCl - 42,5
барбитал - 2,875
барбитал Na - 1,875
CaCl2 • 6H2O - 0,164
MgCl2 6H2O - 0,616
H2O дист. - до 1 литра
2) Раствор желатина: 2 г желатина на 100 мл H2O.
Из этих растворов готовили рабочий буфер при следующем соотношении компонентов, мл:
барбиталовый буфер - 200
H2O дист. - 800
раствор желатина - 10
pH рабочего буфера составлял 7,2.
Получали сенсибилизированные гемолитической сывороткой эритроциты барана по методике [1]. При этом сначала готовили 5% раствор бараньих эритроцитов в рабочем буфере. К одному объему порученной суспензии эритроцитов барана добавляли равный объем разведенной гемолитической сыворотки, содержащей 4 гемолитических единицы (получали путем титрования), перемешивали жидкости и инкубировали в течение 30 мин при температуре 37oC с последующим 3-кратным отмыванием. Готовили 2% взвесь сенсибилизированных гемолитической сывороткой эритроцитов барана в рабочем буфере. Отдельно готовили 2% золь агарозы в рабочем буфере. На водяной бане (48oC) смешивали 25 мл полученного 2% золя агарозы и 25 мл 2% взвеси сенсибилизированных эритроцитов барана, предварительно нагретой до этой же температуры. В полученную взвесь сенсибилизированных бараньих эритроцитов в агарозе добавляли селективный β2- адреностимулятор:
в 1 варианте геля - беротек-100 (производства фирмы Boehriger Ingelheim, Германия) в количестве 500 мкг;
во 2 варианте геля- вентолин (производства фирмы Glaxo, Великобритания), в количестве 300 мкг;
в 3 варианте геля - бриканил (производства фирмы EGIS, Венгерская республика, по лицензии Asrta, Швеция) в количестве 250 мкг.
Быстро разносили взвесь в прозрачные пробирки, выполненные из материала типа пластигласа в виде прямоугольного параллелепипеда с габаритами 4 х 9,5 х 18 мм (толщина стенок 1 мм): в 1 варианте геля - по 0,15 мл взвеси в каждую пробирку; во 2 варианте - по 0,165 мл; и в 3 варианте - по 0,18 мл взвеси в каждую пробирку. Пробирки закрывали пробками. Площадь рабочей поверхности геля во всех 3-х вариантах составляла 15 мм2. Высота геля составляла: в 1 варианте - 10 мм; во 2 варианте - 11 мм; в 3 варианте - 12 мм. Время, затраченное на приготовление одного варианта геля, составляло в среднем 1,3 - 1,5 ч (по результатам хронометрирования).
Пробирки хранили до использования в холодильнике при температуре 4oC. Для осуществления анализов использовали гели заявленного состава различных сроков хранения - начиная от момента застывания геля и кончая гелями со сроком хранения до 6 месяцев (от момента внесения геля в емкость) включительно.
Пример 2.
Больная Аня С., 12 лет. Диагноз: Системная красная волчанка.
Было проведено определение активности комплемента у больной in vitro различными способами с использованием соответствующих сред для гемолиза. При этом у пациентки утром натощак взяли 1 мл крови из пальца в сухую пробирку. Получили сыворотку крови по методике [8] путем центрифугирования крови при 1500 об./мин в течение 15 мин.
Для определения активности комплемента с использованием способа и геля взяли 4 пробирки с гелем 1-го варианта приготовления (содержащем беротек-100 в концентрации 0,01 г/л, с высотой геля в пробирке 10 мм): две опытные и две контрольные. В каждую опытную пробирку вносили по 0,03 мл исследуемой сыворотки крови больной. В каждую контрольную пробирку вносили по 0,03 мл стандартной сыворотки крови (пул сывороток от 30 здоровых доноров). Все пробирки (опытные и контрольные) выдерживали сначала в холодильнике при 4oC в течение 18 ч, затем - в термостате при 37oC в течение 2 ч. После этого измеряли глубину зоны гемолиза в геле в опытных и контрольных пробирках визуально с помощью линейки. Получены следующие результаты: контроль - 4 мм (100%); опыт - 2 мм (50%), что позволило сделать вывод о пониженной (по сравнению с нормой) активности комплемента у обследуемой пациентки. Время, затраченное на процедуру определения, составило 5 мин (по результатам хронометрирования).
Параллельно проводили определение активности комплемента с помощью способа-прототипа и геля, принятого за прототип [1]. Получены следующие результаты: контроль - 8 мм (100%); опыт - 5,5 мм (69%), что также свидетельствовало о сниженной (по сравнению с нормой) активности комплемента у больной. Процедура определения (включая приготовление геля) заняла 1,5 ч, в т. ч. время, затраченное непосредственно на определение, составило 6 мин (по результатам хронометрирования).
Проводили также количественное определение активности комплемента по 50%-ному гемолизу сенсибилизированных бараньих эритроцитов в рабочем буфере по методике [1] (контрольный способ). Получены следующие результаты: контроль - 90 ед. CH50 (100%); опыт - 45 ед. CH50 (50%), что свидетельствовало о пониженной активности комплемента. Процедура определения с помощью контрольного способа заняла 6 ч (по результатам хронометрирования).
Таким образом контрольный способ подтвердил результаты определения, полученные как с помощью заявленного способа и геля, так и с помощью способа и геля, принятых за прототип. Однако при использовании заявленной группы объектов степень совпадения результатов определения с результатами контрольного способа была выше.
Пример 3.
Больная Ольга К., 13 лет. Диагноз: Бронхиальная астма (во внеприступном периоде).
У пациентки проведено определение активности комплемента in vitro с использованием заявленного способа и геля; способа и геля, принятых за прототип, а также контрольного способа, аналогичного примеру 2.
При определении активности комплемента заявленным способом использовали гель 2-го варианта приготовления (содержащий вентолин в концентрации 0,006 г/л, с высотой геля в пробирке 11 мм). Процедура определения (включая отбор крови у больной и приготовление сыворотки крови) аналогична примеру 2. Получены следующие результаты: контроль 0 4 мм (100%); опыт - 3,3 мм (82,5%), что свидетельствовало о нахождении активности комплемента у больной в пределах нормы. На анализ затрачено 4 мин.
Результаты определения активности комплемента с помощью способа-прототипа и геля-прототипа [1]: контроль - 8 мм (100%); опыт - 7,5 мм (94%), что свидетельствовало о пониженной активности комплемента у больной. Процедура определения (включая приготовление геля) заняла 1,4 ч, в т.ч. непосредственно на анализ затрачено 5 мин.
Результаты количественного определения активности комплемента с помощью контрольного способа [1]: контроль - 90 ед. CH50 (100%); опыт - 75 ед. CH50 (83,3%), что свидетельствовало о нормальной активности комплемента. Время, затраченное на процедуру определения, составило 5,5 ч.
Таким образом контрольный способ подтвердил результаты определения, полученные с помощью заявленного способа и геля, и опроверг результаты определения, полученные при использовании способа и геля, принятых за прототип.
Пример 4.
Больной Сергей К., 8 лет. Диагноз: Правосторонняя нижнедолевая пневмония.
У пациента проведено определение активности комплемента in vitro с использованием заявленного способа и геля; способа и геля, принятых за прототип, а также контрольного способа аналогично примеру 2.
При определении активности комплемента заявленным способом использовали гель 3-го варианта приготовления (содержащий бриканил в концентрации 0,005 г/л, с высотой геля в пробирке 12 мм). Ход определения аналогичен примеру 2. Получены следующие результаты: контроль - 4 мм (100%); опыт - 8 мм (200%), что свидетельствовало о повышенной активности комплемента у больного. Процедура определения заняла 5,5 мин.
Результаты определения с помощью способа и геля, принятых за прототип [1] : контроль - 8 мм (100%); опыт - 20 мм (250%), что также позволило сделать вывод о повышенной активности комплемента. Процедура определения заняла 1,5 ч, в т.ч. время, непосредственно затраченное на анализ - 5 мин.
Результаты количественного определения активности комплемента с помощью контрольного способа [1]: контроль - 90 ед. CH50 (100%); опыт - 178 ед. CH50 (198%), что свидетельствовало о повышенной активности комплемента. Процедура определения заняла 4,5 ч.
Таким образом контрольный способ подтвердил результаты, полученные как с помощью заявленного способа и геля, так и с помощью способа и геля, принятых за прототип, однако при использовании заявленной группы решений степень совпадения результатов определения с результатами контрольного способа была выше.
С использованием заявленного способа и геля было обследовано in vitro 325 больных детей в возрасте от 1 месяца до 15 лет, в т.ч. больных с бронхиальной астмой - 83 чел., с респираторными аллергозами - 11 чел., с атопическим дерматитом - 69 чел., с крапивницей - 15 чел., с гломерулонефритом - 63 чел., с пневмониями - 61 чел., с острым бронхитом - 13 чел., с ревматоидным артритом - 7 чел, с системной красной волчанкой - 3 чел. Исследования проводили на базе Санкт-Петербургской государственной педиатрической медицинской академии (кафедра детских болезней N 3) и Детской городской больницы N 1 г. Санкт-Петербурга (отделения: аллергологическое, соматическое, нефрологическое, гематологическое, инфекционное, пульманологическое, ревматологическое, реанимационное). Критериями эффективности определения с использованием заявленной группы объектов служили точность определения (количество подтвержденных контрольным способом результатов определения), срок сохранения диагностических свойств сенсибилизированных эритроцитов барана в геле, а также длительность процедуры определения (по результатам хронометрирования авторов изобретения).
Те же дети были параллельно обследованы с помощью способа и геля, принятых за прототип [1]. Эффективность определения оценивали с помощью тех же критериев, что и в случае заявленных объектов.
В качестве контрольного способа при оценке эффективности объектов изобретения и объектов, принятых за прототип, было использовано количественное определение активности комплемента по 50%-ному гемолизу сенсибилизированных бараньих эритроцитов в рабочем буфере с фотометрической оценкой результатов [1] (способ-аналог).
Результаты представлены в таблице 8.
Из данных таблицы 8 видно, что заявленный способ и гель обеспечивают повышение точности определения на 28% по сравнению со способом и гелем, принятыми за прототип, при отсутствии ложнозавышенных и ложнозаниженных результатов определения. Предложенные решения также позволяют увеличить срок сохранения диагностических свойств сенсибилизированных эритроцитов в 45 - 63 раза и сократить длительность процедуры определения в 14 - 24 раза (за счет исключения необходимости приготовления геля каждые 3 - 4 дня).
Таким образом использование заявленной группы объектов, связанных единым изобретательским замыслом, позволяет повысить эффективность процесса определения активности комплемента при снижении его трудоемкости и длительности.
Источники информации.
1. Иммунологические методы /под ред. Г.Фримеля, пер. с нем./.-М.: Медицина, 1987. - с. 171, 173-174 (прототип), 174-176 (аналог).
2. Смердова Т.В., Нишева Е.С. Антикомплементарная активность и общее содержание комплемента сыворотки при бронхиальной астме у детей.//В сб.: "Вопросы клиники и иммунологии ревматических и аллергических заболеваний у детей". - Л., 1982. - с. 96 - 100.
3. Машковский М. Д. Лекарственные средства. В двух частях. Ч. I - 12-е изд. перераб. и доп. - М.: Медицина, 1993. - с. 298 - 302, 310, 313 - 315.
4. Справочник Видаль. Лекарственные препараты в России: Справочник. - М. : АстраФармСервис, 1995. - с. 311, 321, 341 - 342, 791 - 792, 866, 925 - 926.
5. Белоусов Ю.Б., Омельяновский В.В. Клиническая фармакология болезней органов дыхания. Справочное руководство. - М.: Универсум Паблишинг, 1996. - с. 86 - 93
6. Guidelines for the Diagnosis and Management of asthma. - Bethesds, Maryland, 1991. - p. 39.
7. Ried L.M., Gleich G.J., Hogg J., Kleinerman J., Laitinen L.A. The role of inflammatory processes in airway hyperresponsiveness. - Blackwell Scientific Publications: London, 1989. - p. 36 - 79.
8. Truedsson L., Sjoholm G., Laurell A.B. Screening for deficiencies in the classical and alternative pathways of complement by hemolysis in gel. - Acta path. microbiol. Scand. Sect.C.1981, vol. 89, p. 161 - 166.



Способ и гель могут быть использованы в области медицины, а именно в иммунологии для определения in vitro активности комплемента по классическому пути активации при различных заболеваниях, которые могут протекать с вовлечением системы комплемента. Способ и гель обеспечивают пролонгированную стабилизацию структурно-функциональных свойств мембран сенсибилизированых эритроцитов, обуславливающих их повышенную устойчивость в отношении неспецифического лизиса и способность к комплементзависимому лизису при отсутствии ингибирующего влияния на комплементзависимый лизис и при гомогенности измеряемой зоны гемолиза. Предварительно осуществляют приготовление геля, в ходе которого во взвесь сенсибилизированных эритроцитов в агарозе дополнительно вводят селективный β2-адреномиметик в концентрации 0,005-0,01 г/л взвеси. Полученную взвесь вносят в емкость из прозрачного материала, формируя гель таким образом, чтобы площадь рабочей поверхности геля составляла не более 16 мм2, а высота геля превышала величину зоны гемолиза в норме не менее чем в 2,5-3 раза. Готовят сыворотку крови обследуемого пациента. Наносят на рабочую поверхность геля в опытной пробе исследуемую сыворотку крови, в контрольной пробе - стандартную сыворотку крови. Выдерживают опытную и контрольную пробы последовательно в течение 18 ч при 4°С, затем в течение 2 ч при 37 °С, определяют активность комплекта по отклонению значений глубины зоны гемолиза в геле в опытной пробе по сравнению с контрольной. При этом при значении указанного показателя в опытной пробе, составляющем менее 80% от значения показателя в контрольной пробе, определяют пониженную активность комплемента, при значении показателя в опыте, составляющем от 80 до 120 % от контроля, определяют нормальную активность комплемента, а при значении показателя в опыте свыше 120% от контроля определяют повышенную активность комплемента. Гель для определения активности комплемента содержит взвесь сенсибилизированных эритроцитов барана в агарозе, а также дополнительно содержит селективный β2-адреностимулятор, например, фенотерол, сальбутамол или тербуталин при следующем соотношении компонентов, г/л: агароза 9,0-11,0, желатин 0,18-0,22, барбиталовый буфер 176-216 мл/л, сенсибилизированные гемолитической сывороткой эритроциты барана 8,8 -10,8 мл/л, вода дистиллированная - до 1 л. 2 с. и 9 з.п.ф-лы, 8 табл.
Агароза - 9,0 - 11,0
Желатин - 0,18 - 0,22
β2 -адреностимулятор - 0,005 - 0,010
Барбиталовый буфер, мл/л сенсибилизированные гемолитической сывороткой - 176 - 216
Эритроциты барана, мл/л - 8,8 - 10,8
Вода дистиллированная - до 1 л
9. Гель по п.8, отличающийся тем, что в качестве селективного β2 -адреностимулятора он содержит фенотерол.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Иммунологические методы./Под ред | |||
| Г.Фримеля | |||
| - М.: Медицина, 1987, с | |||
| Аппарат для передачи изображений на расстояние | 1920 |
|
SU171A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| РАССЕИВАЮЩИЙ ТОПЛИВО МЕХАНИЗМ | 1920 |
|
SU298A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Руководство по клинической лабораторной диагностике./Под ред | |||
| В.В.Меньшикова | |||
| - М.: Медицина, 1982, с.407-417. | |||
Авторы
Даты
1998-12-27—Публикация
1996-12-26—Подача