Изобретение относится к области клинической медицины, а именно к лабораторной диагностике миастении.
Согласно современным представлениям (Mac-Lemman C. et al, 1993 г.) в патогенезе миастении играют роль антитела к холинорецепторам.
Известен способ диагностики миастении исследованием исходной крови больного путем добавления к лейкоцитам крови 0,1-0,2 мл 0,5% суспензии эритроцитов барана, нагруженных ацетилхолином, инкубируют смесь при температуре +37-37,5oC, с последующим подсчетом в мазке розеткообразующих лимфоцитов. При наличии в нем числа розеткообразующих клеток, равном или более 18%, диагностируют миастению (авт.свид. N 1363074, Бюсова А.А. и др., опубл. , в БИ N 48 от 30.12.87).
Недостатками способа являются: техническая сложность его осуществления, недостаточная специфичность и достоверность.
Изобретение направлено на решение задачи: повышение специфичности и достоверности способа и его удешевление.
Указанная задача достигается путем определения розеткообразующих лимфоцитов, специфичных ацетилхолину. Новым в способе является то, что исследуют исходную кровь донора (здоровый человек) до и после внесения инактивированной сыворотки крови больного, разведенной средой 199 в соотношении 1:10 и 1: 20, с последующей инкубацией при температуре +37-37,5oC в течение 30-40 минут, и после добавления эритроцитов барана, сенсибилизированных ацетилхолином, подсчитывают в мазке количество розеткообравующих лимфоцитов; при увеличении их количества в 2,5 раза по сравнению с фоном диагностируют миастению.
Способ осуществляют следующим образом: из вены обследуемого забирают кровь в количестве 2-2,5 мл в сухую чистую центрифужную пробирку, после отстаивания выделяют сыворотку путем центрифугирования в течение 5 мин при скорости 1500 оборотов в минуту, затем сыворотку инактивируют в течение 30-40 мин, инкубируя при температуре +56-57oC, и разводят в соотношении 1:10 (к 0,1 мл сыворотки, добавляя 0,9 мл среды 199) и 1:20 (к 0,1 мл сыворотки добавляя 1,9 мл среды 199).
Из вены донора забирают кровь в количестве 2,5-3 мл центрифужную пробирку, содержащую 0,8 - 1,0 мл 5% раствора цитрата натрия, смесь перемешивают. После отстаивания вносят по 0,4 мл этой взвеси в 3 чистые центрифужные пробирки (одна - для определения исходного содержания розеток в суспензии лимфоцитов крови донора (здоровый человек, животное), две другие - для изучения действия на клетки сыворотки крови обследуемого). В каждую пробирку добавляют по 3,0 мл дистиллированной воды для лизиса эритроцитов, затем по 3,0 мл 1,8% раствора натрия хлорида для восстановления pH 7,2. Центрифугируют 5 мин при скорости 1,5 тыс. оборотов в минуту. Оттянув надосадочную жидкость из всех пробирок, оставив в них 0,2 мл, добавляют по 1 мл среды 199 в каждую пробирку, встряхивают и оставляют в термостате на 15 мин при температуре +37-37,5oC. Затем суспензию лимфоцитов центрифугируют 5 мин при скорости 1,5 тыс. оборотов в минуту, надосадочную жидкость отсасывают пипеткой, осадок первой пробирки оставляют временно без воздействия. Осадок двух других пробирок соединяют с 0,4 мл исследуемой сыворотки крови больного, разведенной средой 199 в соотношении 1:10 (вторая пробирка) и 1:20 (третья пробирка). Смеси осторожно встряхивают и инкубируют 30-40 мин при температуре 37-37,5oC. После инкубации с сывороткой лимфоциты дважды отмывают изотоническим раствором натрия хлорида, pH которого 7,2, путем центрифугирования при скорости 1500 оборотов в минуту в течение 5 мин, надосадочную жидкость отсасывают пипеткой. Во вторую и третью пробирки добавляют по 1 мл среды 199 и инкубируют при температуре +37-37,5oC 15 мин, затем центрифугируют 5 мин при скорости 1500 об/мин, надосадочную жидкость удаляют. Осадок ресуспендируют во всех трех пробирках в 0,1 мл среды 199. К полученным взвесям лейкоцитов добавляют по 0,1 мл 0,5% взвеси эритроцитарного диагностикума, смеси инкубируют при температуре +37-37,5oC в течение 15 мин центрифугируют 5 мин при 1500 об/мин, выдерживают 1 ч в условиях холодильника (при температуре 4 - 6oC). После инкубации во все пробирки, стянув надосадочную жидкость и осторожно пропипетировав осадок, добавляют по 1 капле 0,5% раствора глютарового альдегида, выдерживают при комнатной температуре 20 мин. Затем отмывают 0,75 мл дистиллированной воды, стягивают надосадочную жидкость пипеткой. Во все пробирки добавляют по 0,5 мл 50% раствора бычьей сыворотки, центрифугируют смеси 5 мин при 1500 об/мин, надосадочную жидкость сливают, а из осадка делают мазки, которые высушивают на воздухе, фиксируют этиловым спиртом 30 мин и окрашивают по Романовскому-Гимза. Просматривают под микроскопом при 900-кратном увеличении 100 лимфоцитов, отмывают среди них число (в процентах) лимфоцитов, фиксированных на себе 3 и более эритроцитов (РОК). При увеличении числа РОК в 2,5 и более раз (второй и третий мазки) по сравнению с фоном (первый мазок) диагностируют миастению.
Для приготовления ацетилхолинового диагностикума используют эритроциты барана, обработанные глютаровым альдегидом. Свежие эритроциты барана трижды отмывают изотоническим раствором натрия хлорида (pH 7,2), центрифугируя взвесь в течение 5 мин при 1500 об/мин. Из отмытых эритроцитов готовят 5% взвесь, соединения 0,5 мл осадка эритроцитов и 9,5 мл забуференного изотонического раствора натрия хлорида pH 7,2. При глутаризации смешивают 5% взвесь эритроцитов с 0,25% свежеприготовленным раствором глутарового альдегида в соотношении 1: 1. Выдерживают смесь при температуре +37 - 37,5oC в течение 15 мин, после чего эритроциты тщательно отмывают от глутарового альдегида забуференным изотоническим раствором натрия хлорида и тем же раствором доводят объем до первоначального (5% взвесь). Приготовленные таким образом эритроциты хранят 6 месяцев при температуре +4oC.
При сенсибилизации эритроцитов ацетилхолином глутаризованные эритроциты дважды отмывают изотоническим раствором натрия хлорида pH 6,4 и доводят им же объем взвеси до первоначального (1 мл). Затем соединяют с 10 мл ацетилхолина, предварительно растворенного в 0,1 мл изотонического раствора натрия хлорида pH 6,4. Смесь осторожно встряхивают, затем выдерживают в термостате 30 - 40 мин при температуре +37 - 37,5oC, периодически встряхивая, после чего отмывают дважды забуференным раствором натрия хлорида pH 7,2. Слив надосадочную жидкость, доводят объем до первоначального (5% взвесь). В реакции используют 0,5% взвесь сенсибилизированных эритроцитов, которую готовят из исходной (5%) взвеси путем соединения 1 мл ее с 9 мл среды 199.
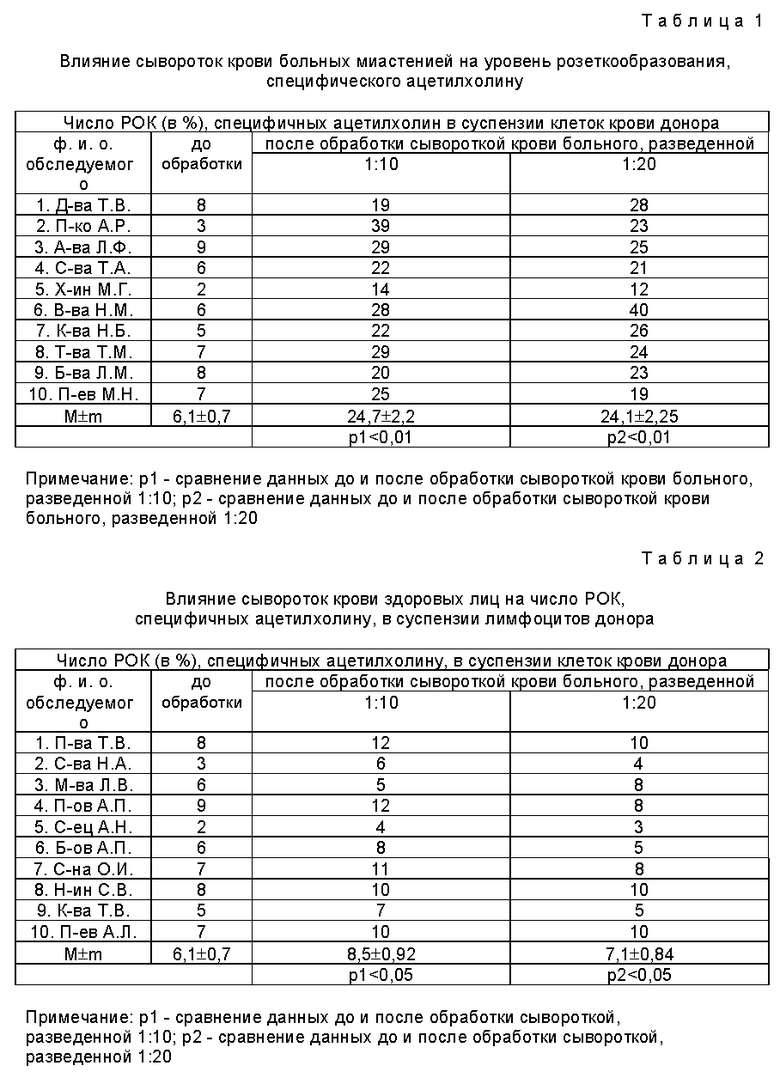
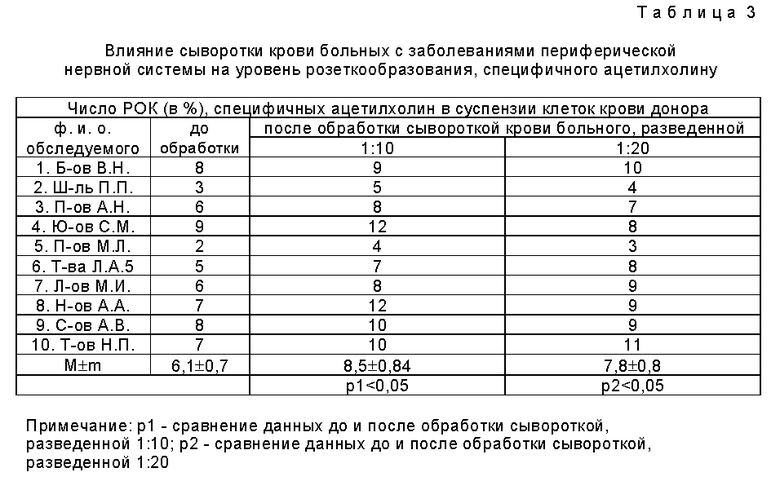
Заявляемым способом исследованы сыворотки крови 10 больных с достоверно установленным диагнозом миастении, 10 больных с заболеваниями периферической нервной системы (группа сравнения) и 10 практически здоровых лиц (контрольная группа). Результаты исследования приведены в таблицах 1-3.
Проведенные исследования показали, что сыворотка крови больных миастенией вызывает экспрессию холинорецепторов на мембране лимфоцитов, увеличивая число розеток в 2,5 раза и более. Обработка тех же лимфоцитов сывороткой крови здоровых лиц (таблица 2) и больных с заболеваниями периферической нервной системы (таблица 3) подобного эффекта не вызывала. Эффект усиления розеткообразования связан с действием антител к холинорецепторам, имеющихся в крови больных миастенией.
Примеры конкретного выполнения.
Пример 1. Больная Д-ва Т.В., 24 года, поступила в клинику в ноябре 1996 года с жалобами на резкую мышечную слабость, быструю утомляемость, двоение при взгляде в стороны, гнусавость голоса, затруднение глотания, опущение левого века, затруднение дыхания при физической нагрузке. Из анамнеза заболевания известно, что впервые мышечная слабость и быстрая утомляемость в ногах и кистях рук появилась в 1990 году в конце первой беременности. После родов симптомы заболевания несколько регрессировали, чувствовала себя относительно удовлетворительно. Ухудшение состояния с 1991 года, когда в конце первой беременности появилась нарастающая слабость в конечностях, присоединились затрудненность и гнусавость голоса. Лечилась антихолинэстеразными препаратами, дозы их постоянно повышала. Дважды получала преднизолон в 1992 г и 1996 г. в дозе 60 мг в первую неделю с последующим снижением дозы до полной отмены. Эффект был незначительным. В настоящее время принимает калимин 1 т. 5-7 раз в день и прозерин 2 мл 4 - 5 раз в день. Прозериновая проба положительная, но компенсация неполная. При осмотре соматической патологии не выявлено. АД = 110/60 мм рт.ст., пульс 64 удара в минуту. В неврологическом статусе двусторонний птоз с преобладанием слева, диплопия при взгляде в стороны, голос дисфоничен, мягкое небо малоподвижно, глоточный рефлекс отсутствует, снижена мышечная сила в конечностях до 4 баллов, сухожильные рекфлекторы равномерно угнетены. Клинический диагноз: Миастения, генерализованная форма, тяжелое течение с бульбарными и дыхательными нарушениями.
Больной проведено иммунологическое исследование заявляемым способом. С этой целью из локтевой вены больной было взято 2 мл крови, путем центрифугирования в течение 5 мин при 1500 об/мин была выделена сыворотка, которая в целях инактивации инкубировалась при температуре +56oC 30 мин, затем 0,1 мл сыворотки смешали с 0,9 мл среды 199 (разведение 1:10) и 0,1 мл сыворотки смешали с 1,9 мл среды 199 (разведение 1:20). В 3 центрифужные пробирки внесли по 0,4 мл взвеси лейкоцитов донора, которую получили после отстаивания смеси 3 мл крови, взятой из локтевой вены, и 0,1 мл 5% раствора цитрата натрия, добавили по 3 мл дистиллированной воды, перемешивали, затем по 3 мл 1,8% раствора натрия хлорида и центрифугировали 5 мин при 1500 об/мин. Оттянув надосадочную жидкость из всех пробирок, оставили в них 0,2 мл, добавили по 1 мл среды 199 в каждую пробирку, встряхнули и инкубировали 15 мин при температуре 37oC. Затем суспензию лимфоцитов центрифугировали 5 мин при 1500 об/мин, надосадочную жидкость оттянули, осадок первой пробирки оставили временно без воздействия, осадок второй пробирки соединили с 0,4 мл сыворотки больного, разведенной в соотношении 1:10 осадок третьей пробирки смешали с 0,4 мл сыворотки больного, разведенной 1:20. Смеси осторожно встряхивали и инкубировали 30 мин при температуре 37oC, затем дважды отмыли изотоническим раствором натрия хлорида (pH 7,2), удалив надосадочную жидкость, добавили по 1 мл среды 199, инкубировали 15 мин при температуре 37oC. Во всех трех пробирках ресуспендировали осадок в 0,1 мл среды 199 и добавили по 0,1 мл 0,5% взвеси эритроцитарного диагностикума, смеси инкубировали 15 мин при температуре 37oC, затем центрифугировали 5 мин при 1500 об/мин и выдерживали 1 час в холодильнике. Затем удалили надосадочную жидкость, добавили по 1 капле 0,5% раствора гютарового альдегида, выдержали 15 мин, отмыли 0,75 мл дистиллированной воды, добавили по 0,5 мл 50% раствора бычьей сыворотки, центрифугировали 5 мин при 1500 об/мин. Из осадка сделали мазки, которые фиксировали этиловым спиртом 30 мин и окрасили по Романовскому-Гимза. Просматривали под микроскопом при 900-кратном увеличении 100 лимфоцитов, отмечая среди них лимфоциты, фиксировавшие на себе 3 и более эритроцитов (РОК).
Результаты исследования показали, что сыворотка крови больной активирует лимфоциты донора с увеличением числа ацетилхолиновых розеток с 6% (фон) до 29% (обработка клеток сывороткой крови больной, разведенной 1:10) и до 21% (обработка клеток сывороткой крови больной, разведенной 1:20). Иммунологический анализ подтвердил клинический диагноз: Миастения.
Пример 2. Больной Б-ов А.А., 55 лет, поступил в клинику в январе 1997 года с жалобами на насильственное мигание, усталость глаз после физической и умственной нагрузок. Считает себя больным с 1993 года, когда появилось опускание левого века, насильственное мигание. Обследован в 1994 году в стационаре с диагнозом: Тимома (?), локальная форма миастении. Отмечал отсутствие диффузной мышечной утомляемости, двусторонний птоз провоцировался зрительной нагрузкой, всегда сопровождался учащенным миганием. Лечение антихолинэстеразными препаратами было неэффективно. При осмотре общее состояние удовлетворительное. Соматический статус без патологии. АД = 130/80 мм рт.ст, пульс 68 уд. в мин. В неврологическом статусе определялся легкий двусторонний птоз с эпизодами учащенного насильственного мигания продолжительностью по 5 - 10 мин несколько раз в день, периодически сопровождавшимися насильственным запрокидыванием головы. Сила во всех мышечных группах была достаточная, сухожильные и периостальные рефлексы живые, симметричные. Диагноз: Локальная мышечная дистония, лицевой блефороспазм.
Заявляемым способом было проведено иммунологическое исследование крови больного, для его исследовались лейкоциты крови донора до и после обработки их сывороткой больного, разведенной 1:10 и 1:20, с последующим добавлением 0,2 мл 0,5% суспензии эритроцитов барана, нагруженных ацетилхолином, и инкубацией смесей 40 мин при температуре 37,5oC. При подсчете в мазке розеткообразующих лимфоцитов их число до обработки сывороткой крови больного составляло 6%, а после обработки - 7% (1:10) и 8% (1:20). Иммунологическое исследование диагноз миастении отвергает.
Пример 3. Больной Д-в, 43 года, поступил в клинику неврологии с жалобами на боли в поясничной области позвоночника, иррадиирующими по задне-боковой поверхности правой ноги до стопы, которые устанавливались в положении сидя, онемение боковой поверхности правой стопы. Болен 4 года, обострения с частотой 1 - 2 раза в год, связаны с подъемом тяжести, переохлаждением. Последнее обострение за 2 недели до поступления в клинику. При объективном обследовании определяется вертебральный синдром в виде сглаженного поясничного лордоза, дефанса мышц поясницы, ограничения движения в поясничном отделе позвоночника, положительные симптомы натяжения (Ласега с двух сторон, больше справа), гипотония и гопотрофия мышц правой голени, гипестезия в дерматомах L5-S1 справа, снижение ахиллова рефлекса справа. При рентгенологическом исследовании поясничного отдела позвоночника в двух проекциях определялось снижение высоты межпозвонковых дисков L4-L5, L5-S1, лестничный спондилолистез. При компьютерной томографии задне-латеральный пролапс межпозвонкового диска L5-S1.
Клинический диагноз: Остеохондроз поясничного отдела позвоночника, грыжа межпозвонкового диска L5-S1, корешковый синдром.
При иммунологическом исследовании крови заявляемым способом число РОК, специфичных ацетилхолину в исходной крови донора, составило 6%, при добавлении сыворотки больного, разведенной 1:10 - 10% и 1:20 - 9%. Иммунная реакция для миастении не характерна.
Пример 4. П-ва Т.В., 29 лет, практически здорова. Заявляемым способом проведено исследование сыворотки крови. Результаты: число розеткообразующих лимфоцитов до обработки суспензии - 8%, после обработки сывороткой, разведенной 1:10, составило 12%, после обработки сывороткой разведенной 1:20 - 10%. Заключение: антител к холинорецепторам в крови П-вой Т.В. не обнаружено.
Преимущества способа заключаются в его высокой специфичности и чувствительности, технической простоте исполнения, необходимости минимальных количеств доступных реактивов и несложного оборудования, что позволяет осуществлять проведение способа в условиях клиники.
Способ имеет большое практическое значение, так как дает возможность ранней диагностики заболевания и его дебютов, стертых, атипичных форм и дифференциального диагноза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1998 |
|
RU2138811C1 |
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1996 |
|
RU2098827C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1996 |
|
RU2104543C1 |
| СПОСОБ ИММУНОДИАГНОСТИКИ МИАСТЕНИИ | 1996 |
|
RU2116650C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1997 |
|
RU2128840C1 |
| СПОСОБ ИММУНОДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1996 |
|
RU2125728C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1994 |
|
RU2081412C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ОСТРОГО РАДИОАКТИВНОГО ЗАРАЖЕНИЯ ОРГАНИЗМА | 1996 |
|
RU2104544C1 |
| ЭРИТРОЦИТАРНЫЙ ДИАГНОСТИКУМ И СПОСОБ ДИАГНОСТИКИ ХРОНИЧЕСКОЙ ИНТОКСИКАЦИИ НЕОРГАНИЧЕСКИМИ СОЕДИНЕНИЯМИ ВАНАДИЯ | 2002 |
|
RU2235326C2 |
| СПОСОБ ИММУНОДИАГНОСТИКИ ИНФЕКЦИЙ | 1996 |
|
RU2136000C1 |
Изобретение может быть использовано в медицине, в частности в неврологии, и обеспечивает упрощение и удешевление способа при высокой точности и специфичности. Определяют розеткообразующие лимфоциты, специфичные ацетилхолину. При этом исследуют исходную кровь донора до и после внесения инактивированной сыворотки крови больного разведенной средой 199 в соотношении 1: 10 и 1: 20, с последующей инкубацией при t 37-37,5oC в течение 30-40 мин и после добавления эритроцитов барана, сенсибилизированных ацетилхолином, подсчитывают в мазке количество розеткообразующих лимфоцитов, при увеличении их количества в 2,5 раза по сравнению с фоном диагностируют миастению. 3 табл.
Способ диагностики миастении, включающий забор крови обследуемого и добавление к лимфоцитам крови суспензии эритроцитов барана, сенсибилизированных ацетилхолином, инкубирование взвеси с последующим подсчетом в мазке резеткообразующих клеток, отличающийся тем, что исследуют кровь здорового человека до и после инкубации с инактивированной сывороткой крови больного, разведенной средой 199 в соотношении 1 : 10 и 1 : 20, при температуре +37 - 37,5oC в течение 30 - 40 мин и добавления к взвеси эритроцитов барана, нагруженных ацетилхолином, подсчитывают в мазках количество розеткообразующих лимфоцитов и при увеличении их количества в 2,5 и более раз по сравнению с фоном определяют миастению.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ диагностики миастении | 1986 |
|
SU1363074A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ диагностики миастении | 1982 |
|
SU1130323A1 |
Авторы
Даты
1999-03-27—Публикация
1997-06-02—Подача