Изобретение относится к липосомным композициям, содержащим в качестве активного ингредиента селегилин (-)-(N-α диметил-N-(2-пропинилфенилэтиламин) и/или его соль. Далее, изобретение относится к их приготовлению, содержащим их фармацевтическим композициям и их терапевтическому использованию.
В настоящее время в области известно огромное число липосомных композиций и процессов их изготовления.
Такими композициями являются, например, "системы доставки лекарств" (DDS), как описано G. Gregoriadis с соавт. (Receptor-mediated targeting of drugs, Plenum Press, New York, 243-266, 1980). Они содержат активный ингредиент, сходный с инкапсулированным положением в одной или более пластинчатой мембране, содержащей липиды, например, в липосомах. На хорошую адсорбцию и биорасположение активного ингредиента(ов) могут влиять, среди прочих, композиция и способ приготовления липосом таким образом, что они могут доставить активный ингредиент в специфичную область. В липосомных композициях активный ингредиент окружен одной или более липидными пластинками, которые также служат в качестве переносчика активного ингредиента.
Мультипластинчатые липидные переносчики (MLV) впервые были приготовлены и описаны Bangham с соавт. (J. Mol. Biol. 13, 238-252, 1965). Когда биологически активные вещества инкапсулированы в малые, однопластинчатые, липидные переносчики, водорастворимые вещества могут быть инкапсулированы с низкой эффективностью вследствие небольшого объема воды, заключенной в малые однопластинчатые липидные везикулы (SUV) (описание к Патенту США N 4,089,801).
Однопластинчатые липидные везикулы были приготовлены другими методами, например путем инъекции этанола [S. Batzri и E.D.Korn: Biochem. Biophys. Acta. 298: 1015-1019, (1973)] или эфира [D.Deamer и A.D.Bangham: Biochem. Biophys. Acta 443, 629-634, (1976)] таким образом, что раствор липидов в органическом растворителе был инъецирован быстро в буферный раствор и, таким образом, однопластинчатые липосомы формировались спонтанно. Метод является быстрым и широко используется, но приводит к получению разведенных липосомных препаратов и плохой инкапсулирующей эффективности.
Однопластинчатые липосомы также могут быть сформированы так называемой детергент-устраняющей системой [H.G.Weder и O.Zumbuehl: Liposome Technology, под редакцией G.Gregoriadis, CRC Press Inc., Boca Raton, Florida, Том 1, Часть 7, стр.79-107, (1984)], при использовании которой липиды и другие вещества растворяют вместе с детергентами и затем детергенты устраняют диализом.
Упаковку в однопластинчатую липосомную капсулу проводят в соответствии с описанием к Патенту США N 4,234,871 (Papahadjopoulos) путем так называемой технологии выпаривания на обращенной фазе (REV) и в соответствии со спецификацией Патента США N 4,016,100 (Suzuki) путем лиофилизации водно-липидной дисперсии липидов и биологически активных веществ.
В опубликованном описании к Патенту N WO 93/20934 раскрыт препарат стабильной, водной, липосомной суспензии, которая может храниться в течение 6 месяцев при 40oC.
В процессе приготовления препарата вышеуказанных липосомных композиций дисперсию липидов и водной фазы проводят в контактных реакциях на инертном твердом материале, в большинстве случаев, на стеклянных шариках [описание к Патенту США N 4,485,054].
В соответствии с описанием к Патенту США N 4,761,288, который специально внесен здесь в ссылки, мультифазные системы готовят для улучшения адсорбции биологически активных веществ, имеющих плохую растворимость в воде, которые содержат активный ингредиент в форме высоко-насыщенного раствора, в твердой форме и инкапсулированы в однопластинчатые липидные везикулы. Везикулы, раствор и твердая форма биологически активного соединения дисперсированы в гидроколлоидном геле. Гидроколлоидный гель готовят, используя способ приготовления мультипластинчатых липидных везикул, описанный в Патенте США No. 4.485.054, специально внесенного здесь в ссылки. Таким образом, могут быть приготовлены липосомные композиции, в которых активный ингредиент присутствует в более высоких концентрациях, чем могло ожидаться на основе их водо- и/или липорастворимости.
В описании к Патенту США N 4,937,078 раскрыты липосомные композиции локально применяемых активных ингредиентов анестетиков и анальгетиков. Было обнаружено, что локально применяемые активные ингредиенты являются более эффективными в липосомном инкапсулированном состоянии, чем обычная мазь, крем или липидные композиции. Образование самой липосомы может быть проведено, как описано в описаниях к Патентам США N 4,485,054 и N 4,761,288.
Приготовление всех липосомных композиций было направлено, прежде всего, на увеличение абсорбирующей способности и локальной концентрации и/или на запланированную абсорбцию активных ингредиентов, имеющих плохую растворимость в воде.
Наше изобретение относится к приготовлению липосомных композиций из селегилина или его солей, которые являются хорошо растворимыми в воде и растворителях (1 г/3 мл в воде, 1 г/5 мл в хлороформе или 1 г/3 мл в этаноле), далее, к оральному, парэнтеральному или местному применению, произвольно в чрескожном, контролируемом высвобождении композиций.
Селегилин является известной фармацевтической композицией, широко продаваемой под названием Jumex, Deprenyl, Eldepryl или L-Deprenyl, будучи очень эффективной, например, при лечении туберкулеза или при иммунной модуляции [A.Dow: The Deprenyl Story, Toronto: Stoddart (1990); Inhibitors of Monoamine Oxidase В, под редакцией I.Szelenyi, Birkhauser Verlag, Basel-Boston- Berlin, 237-358 (1993)] . Одним из его важных эффектов является антидепрессантный и психостимуляторный и MAO-ингибиторный эффект (моноамин оксидазный), более точно их селективный MAO-B ингибиторный эффект. Известны несколько процессов их приготовления, см. , например, описания к Патентам Венгрии N 151,090, 154,655 и 187,775. L-Deprenyl, одобренные FDA в 1989 как агент для лечения болезни Паркинсона.
Липосомная композиция в соответствии с настоящим изобретением содержит предпочтительно от 0.1 до 40% по весу селегина (-)-[N-α-диметил-N-(2-пропинилфенилэтиламин) и или его соли, от 2 до 40% по весу липидов, предпочтительно фосфолипидов, от 0 до 10% по весу холестерола, от 0 до 20% по весу спирта, от 0 до 25% по весу гликоля, от 0 до 3% по весу антиоксиданта, от 0 до 3% по весу презервирующего агента, от 0 до 2% по весу агента, влияющего на вязкость, от 0 до 50% по весу циклодекстрина или производного циклодекстрина и от 30 до 90% по весу воды.
Липосомная композиция в соответствии с настоящим изобретением содержит предпочтительно от 0,1 до 20, наиболее предпочтительно от 0,1 до 10% по весу селегилина и/или его солей и по крайней мере 10% по весу в этом количестве в одно- и/или мультипластинчатой липидной везикуле и в остаточном количестве, необходимом до 100% по весу, в свободном состоянии и/или как насыщенный раствор. Липосомная композиция в соответствии с изобретением содержит в качестве липида предпочтительно фосфолипид, предпочтительно фосфатидил холин и/или лизофосфатидил-холин, и/или фосфатидил серин, и/или фосфатидил этаноламин, и/или фосфатидил инозитол; в качестве спирта предпочтительно этанол или изопропанол; в качестве гликоля предпочтительно пропилен гликоль или полиэтилен гликоль; в качестве антиоксиданта предпочтительно токоферол или BHA (бутилгидро-ксианизол); в качестве презервирующего агента предпочтительно гермабен (International Specialy Product, Vienna, Austria); в качестве агента, влияющего на вязкость, предпочтительно углеводород или производное целлюлозы, предпочтительно карборол (Carbomer, Goodrich, Cleveland); и в качестве циклодекстрина и/или производного циклодекстрина предпочтительно α-, β- или γ-циклодекстрин, водорастворимый полимер циклодекстрина, метилированное, гидроксилированное или сукцинилметилированное производное циклодекстрина или его любые смеси.
Композиции в соответствии с изобретением могут содержать липосомную композицию, если желательно, вместе с широко используемыми наполняющими, разбавляющими или вспомогательными агентами. Композиция может быть введена предпочтительно орально, парэнтерально или в чрескожной форме. При приготовлении чрескожного состава липосомная композиция может быть нанесена на несущую поверхность, предпочтительно на фольгу, пленку или пластик.
Липосомные композиции могут быть приготовлены, как раскрыто в описаниях к Патентам США No. 4,485,054 и 4,761,288, органический растворитель выпаривают из смеси органического растворителя, содержащей липорастворимые компоненты, содержащей по крайней мере один липид и селегилин, затем объединенный с водным раствором водорастворимых компонентов при помешивании. В качестве смеси органического растворителя предпочтительно используют смесь хлороформа и метанола.
Липосомные композиции в соответствии с изобретением могут предпочтительно быть использованы для лечения болезни Алцгеймера, болезни Паркинсона, депрессии, паралича, расстройств движения или миелита.
Липосомная композиция содержит активный ингредиент в многофазной, одно- и/или мультипластинчатой везикуле, в свободном состоянии и в его насыщенном растворе, например, является мультифазной липосомной системой доставки лекарств. Полученная таким образом липосомная система является стабильной и может легко быть разбавлена водой. Ее реологические состояния могут варьировать от разбавленной жидкости до желатинового состояния.
С фармакологической точки зрения мы ставили цель приготовить липосомные композиции, содержащие селегилин, которые являются системами доставки лекарств с контролируемым их высвобождением и, таким образом, способных вводить точные дозы во время чрескожного лечения даже в дозовом режиме "раз в неделю". Метод введения и доза зависят, среди прочего, от заболевания (болезнь Алцгеймера, болезнь Паркинсона, депрессия, паралич, расстройство движения или миелит), от его тяжести, общего состояния пациента и пр.
Фармакологические и фармакокинетические исследования липосомных композиций in vivo проводились на морских свинках-альбиносах с весом от 300 до 350 г (линия Charless-River, SPF: специфичное непатогенное качество) путем местного лечения, на группах, состоящих из трех животных, случайно отобранных как тест-животные.
Вторая фаза экспериментов была проведена на свиньях весом от 20 до 22 кг, путем лечения трех животных единственной дозой одной из формул.
Животных содержали раздельно в вольерах, на подстилке из древесной стружки при средней температуре 23oC, с одинаковым кормом и питьем.
В качестве тестовых композиций были использованы продукты в соответствии с Примерами 1, 2, 3 и 6.
Липосомные препараты Deprenyl были приложены на безволосную часть спины (морcкие свинки) или кожу шеи (свиньи) на поверхность 1.5х1.5 и 3х3 см2 соответственно и после высушивания в течение нескольких минут закреплены Tegaderm (производимым ЗМ, США). В качестве контроля свиньям были введены селегилин-таблетки орально один раз в день.
Во время оценки измеряли MAO-ингибирование в крови, мозге, печени и кишечнике, далее - концентрацию активного ингредиента в крови. Накопление активного ингредиента и его метаболитов в различных органах свиней (крови, мозге, сердце, печени, почках, легких и селезенке) было исследовано после введения липосом с селегилином, меченных 3H-изотопом, методом определения радиоактивности.
Были отобраны пробы крови для определения концентраций сыворотки до обработки и затем 6, 24, 48, 72, 96, 120, 144 и 168 часов после введения. Было измерено количество селегилина и его метаболитов, затем MAO-активность тромбоцитов.
Зажимы Tagederm были удалены спустя 6 часов и оставшееся не адсорбированное количество селегилина было измерено в спиртовом экстракте. После окончания эксперимента также была измерена MAO-активность на изолированном мозге, печени и кишечнике убитых животных. При определении активности ферментов MAO-A и MAO-B также была исследована селективность ингибирования фермента.
Объединенная концентрация Deprenyl и его метаболитов измерялась в крови и изолированном мозге, легких, селезенке, печени, сердце, желудке, тонком и толстом кишечнике и почках убитых животных так же, как на поверхности кожи, где проводилась липосомная обработка. В определенные интервалы пробы крови были отобраны из угла глазной щели морских свинок и из большой шейной вены свиней.
По истечении семнадцатого дня морских свинок забивали и мгновенно отбирали пробы крови прямо из сердца. В случае свиней пробы крови отбирали перед забиванием, как описано выше.
Отобранные органы и ткани промеряли и гомогенизировали в 4-кратном объеме физиологического раствора хлорида натрия. Три аликвоты по 5 мкл вносили пипеткой в кюветы, содержащие 2 мл Solune 350 и 0,5 мл изопропанола. Далее с пробами поступали, как описано выше для проб крови.
Радиоактивность органов определяют подсчетом импульсов в жидкой фазе, полученные данные дают общее количество измеряемого Deprenyl и метаболитов.
Количество лекарства, оставшегося на парафильме и Tegaderm, также определяют радиоактивным методом.
Специфическую радиоактивность определяют из аликвот проб исходных препаратов липосом, которые использовались для подсчета значений, относящихся к органам и тканям.
MAO-активность в мозге определяли методом Вуртмана и Аксельрода [Biochem. Pharmacol. 12, 1414-1419 (1963)] и содержание белка в гомогенизатах определяли методом Лоури с соавт. [J. Biol. Chem. 193, 265-275 (1951)] .
MAO-активность тромбоцитов исследовали методом Уиллберга и Оурленда [Med. Biol. 54, 137-144 (1976)].
Концентрацию селегилина и таких его метаболитов, как амфетамин, метамфетамин и дезметил-селегилин, определяли газовой хроматографией.
Биологические фармакологические результаты разъясняются на следующих фигурах.
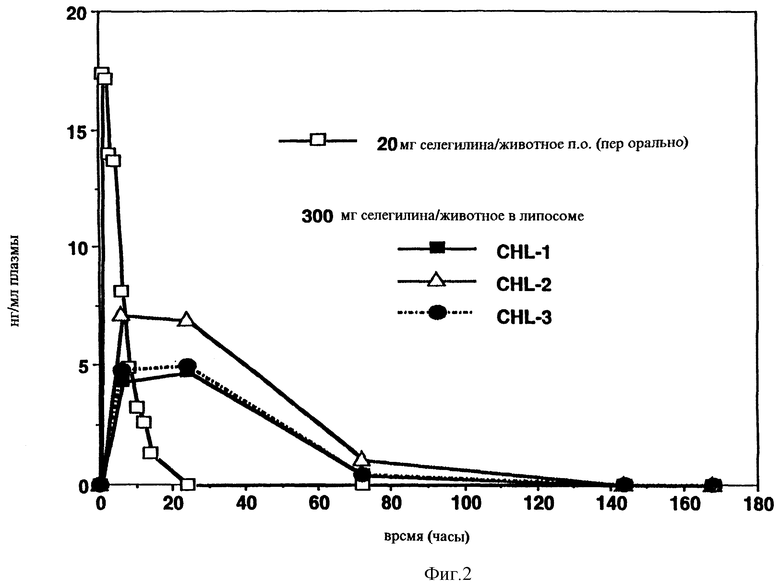
Фигуры 1 и 2 показывают данные уровня метаболитов селегилина, например метамфетамина, в крови после одного чрескожного прикладывания селегилин-липосомной композиции.
Дозо-зависимый уровень крови измеряли в течение 24 часов (Фигура 1), когда прикладывали в основном однопластинчатую липосомную композицию малой везикулы, при этом распределение в соответствии с Примером 6, абсорбция и метаболизм происходят быстро.
В основном мультипластинчатые липосомы понижают уровень распределения из-за большего размера частиц (Примеры с 1 по 3) и продуцируют медленный отстающий уровень крови, компоненты с низким числом пластинок обеспечивают относительно высокий кровяной уровень в течение 72 часов и мультипластинчатая композиция обеспечивает промеряемый кровяной уровень даже после 168 часов (Фигура 2).
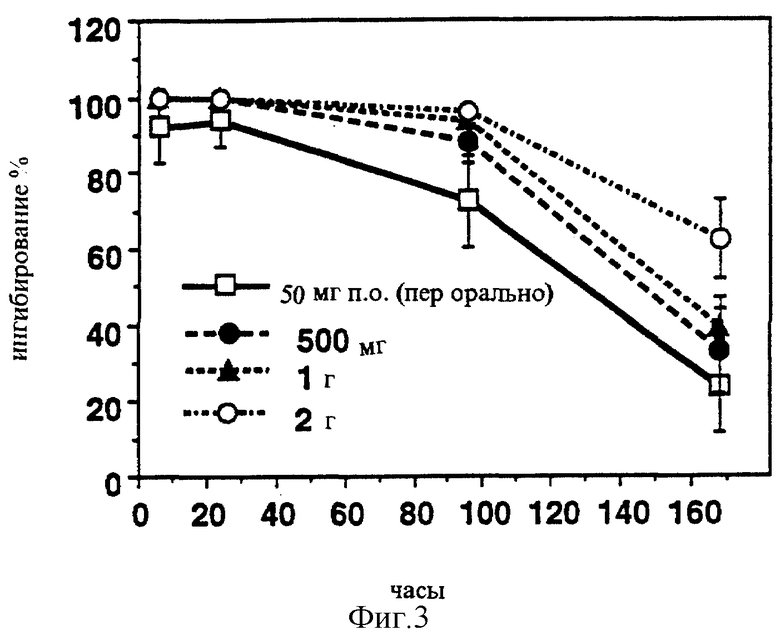
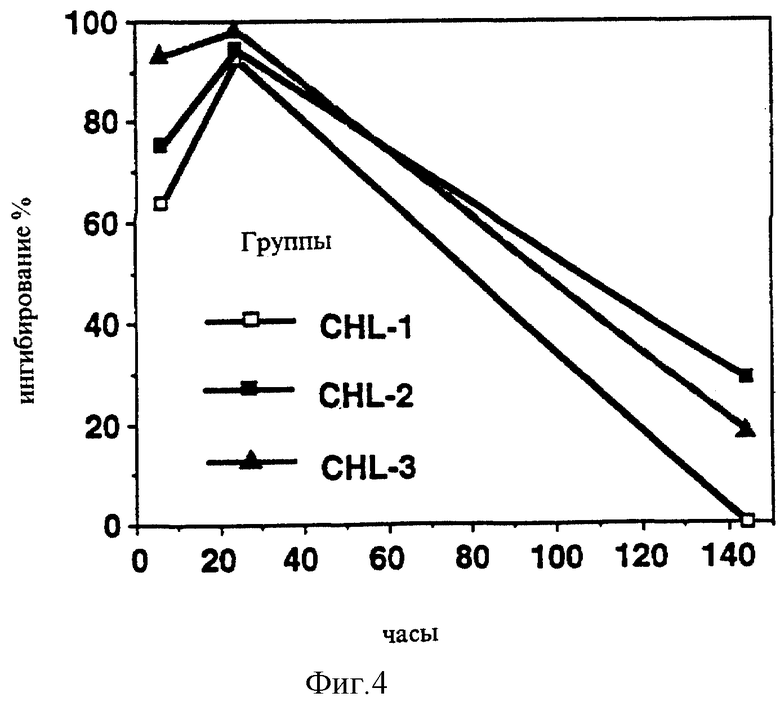
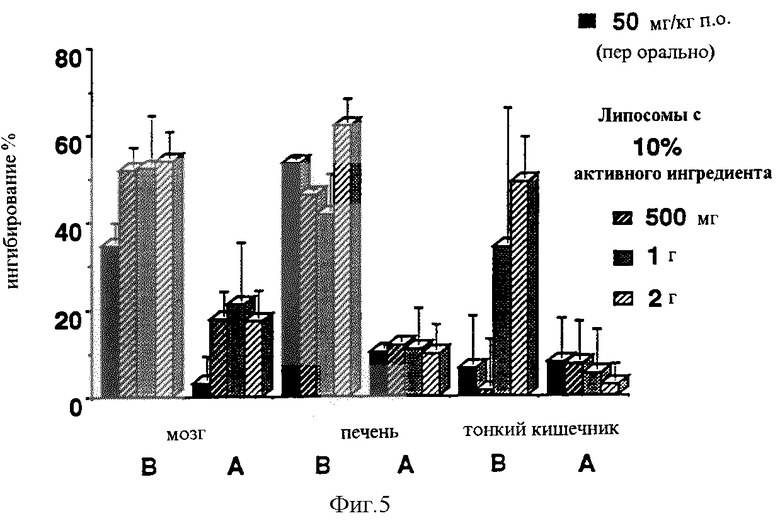
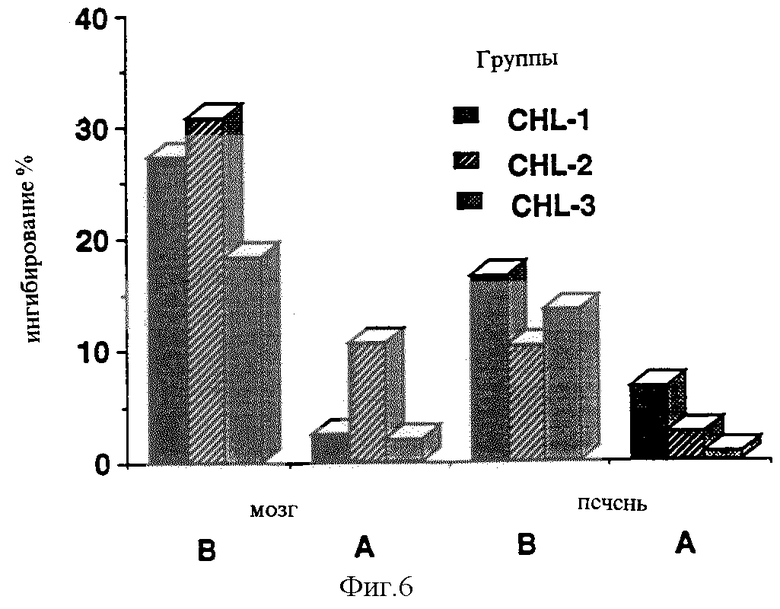
В случае тех же композиций также может быть заявлено, что композиция, обеспечивающая быструю абсорбцию, продуцировала стабильное МАО-ингибирование, в то время как медленная адсорбция ведет к относительно быстро регенерирующему ингибированию в крови (Фигуры 3 и 4). Сходные данные были получены также при измерениях в мозге (Фигуры 5 и 6).
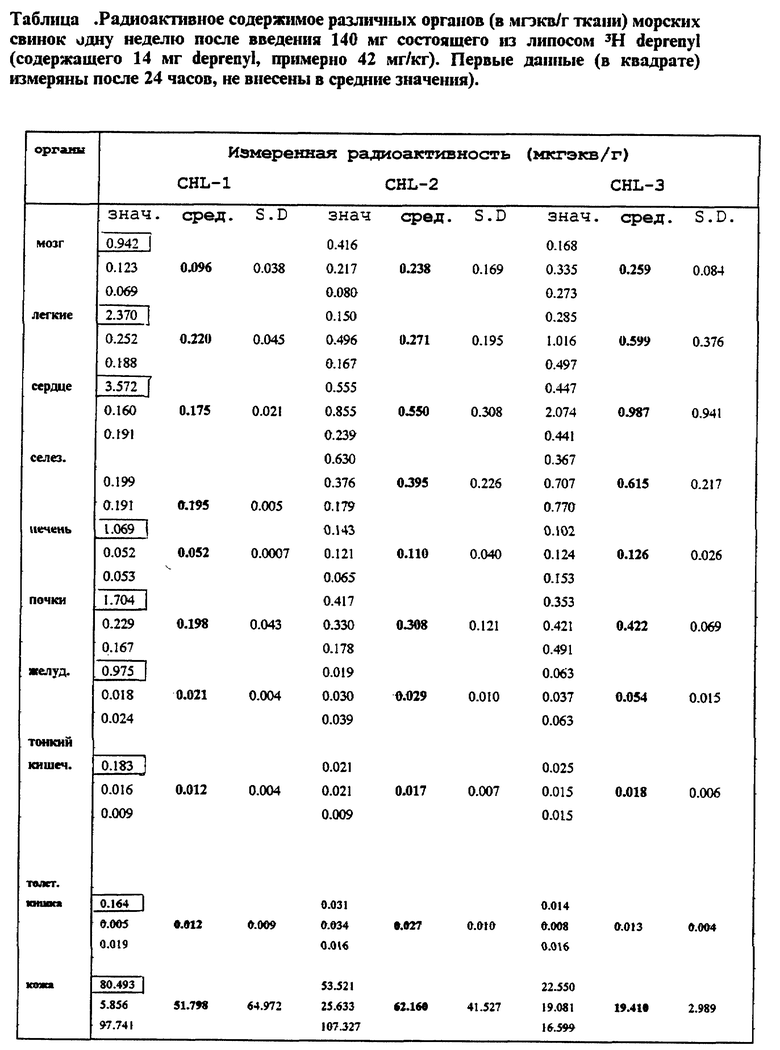
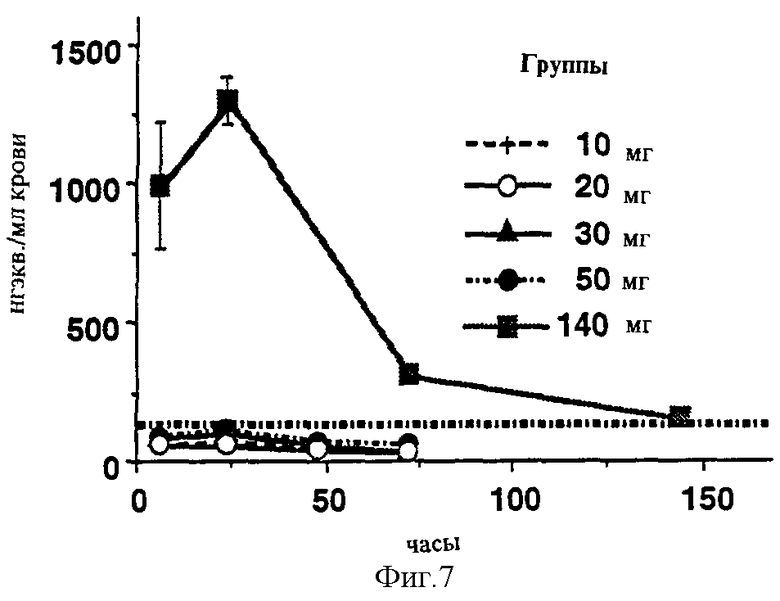
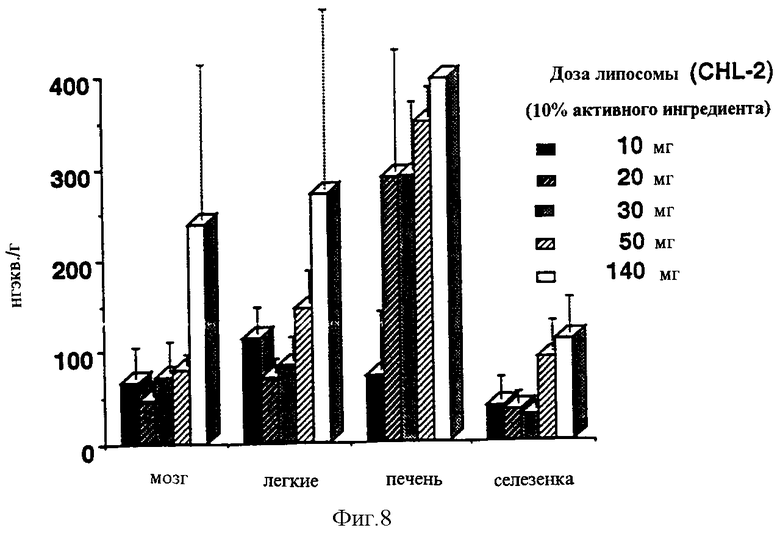
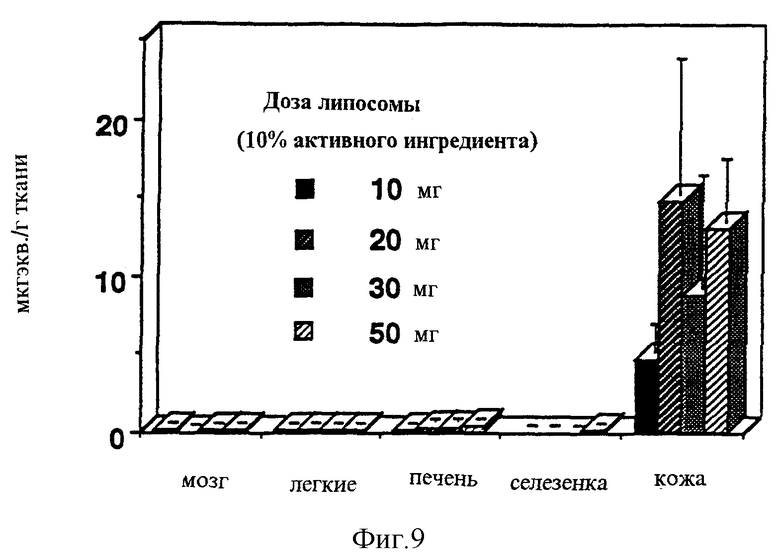
Сходные уровни крови были промерены в радиоактивных тестах на морских свинках (неизмененный селегилин и его метаболиты вместе) (Фигура 7). В случае липосом с медленной адсорбцией значительный уровень мог быть измерен в органах, несмотря на то, что уровень крови понижается на 168 часу, и в мозге, будучи важным из-за эффекта, и в печени, играя важную роль в метаболизме и во всех липофильных органах (Фигура 8 и Таблица). Эти органы могут служить как депо, выпускающее активный ингредиент позднее. Кишечник содержит относительно малое количество субстанции, поддерживая таким образом данные по ингибированию и потере MAO-A ингибирования (Фигура 5). Фигура 9 (Таблица) сравнивает уровни, полученные в органах с количеством субстанций, аккумулированных в коже. Хорошо может быть видно, что хотя значительные, выше 10 нг/г, значения, которые выше известных данных человеческих постсмертных данных, могли быть промерены в органах (прерывистая линия в Фигуре), все же существуют значительные резервы в коже, которые могут обеспечить поставку активного ингредиента в течение длительного времени. Различные дозы, от 10 до 140 мг, приводят к значительно более высокому различию в крови (примерно, в 100 раз выше), чем в мозге (всего от 2 до 3 раз выше) (срав. Фигуры 7 и 8).
Исследования подтверждают следующие преимущества липосомных композиций, содержащих селегилин.
Активный ингредиент избегает желудочно-кишечный тракт, приводя, таким образом, к значительному понижению в ингибировании сконцентрированного там MAO-A фермента, играющего важную роль в метаболизме тирамина, так как он не контактирует с активным ингредиентом.
Будучи введен любыми другими путями введения, кроме орального (внутривенное, внутримышечное, глазными каплями, каплями в нос, эвапоратором и пр. ), активный ингредиент избегает vena portae и, таким образом, первый путь метаболизма. Таким образом, это обеспечивает повышенный уровень селегилина и пониженный уровень метаболита, "MAO-A-ингибирование понижается. Менее возможно, что имеет место эффект "cheese". Более высокие дозы могут быть применены без побочных эффектов и, таким образом, может быть расширено применение в качестве антидепрессанта. Метаболиты являются стимулирующими и вызывают бессонницу, их пониженный уровень означает понижение побочных эффектов.
При чрескожном введении кожа сохраняет количество активного ингредиента, необходимого для продолжительной адсорбции, путем, не лимитирующим его функцию.
Абсорбция липосомной композиции (в зависимости от состава) занимает примерно от 1 до 20 минут, после чего излишне любое зажимание и покрытие (повязка, Tegaderm), композиция не может быть смыта, таким образом, не препятствует умыванию, ее удаление не может быть источником страха даже при слабоумии. При изменении состава (композиции или размера частиц) может быть достигнута оптимальная задержка (1 день, 1 неделя, несколько недель). При изменении отношения инкапсулированного и свободного ингредиента может быть достигнуто стабильное соотношение ингредиент:метаболит, которое оптимально в отношении нейрозащитного и нейроподдерживающего эффектов.
Изобретение разъясняется следующими нелимитированными примерами.
Примеры с 1 по 6
Приготовление липосомной композиции Deprenyl
Пример 1
20 г Фосфолипона 90-G (ненасыщенного фосфолипида) и 10 г гидрохлорида селегилина растворяют в круглодонной колбе в 20 мл смеси 2:1 хлороформа с метанолом при температуре 40oC. К раствору добавляют 100 г маленьких стеклянных горошин. Растворитель выпаривают в вакууме в Rotavapor, и во время этой процедуры на стенке стеклянной колбы и на поверхности стеклянных горошин формируется тонкая пленка. Туда добавляют 70 г смеси 1:3 этанола и воды, нагретой до 40oС. Содержимое колбы хорошо перемешивают и затем перемешивают при средних оборотах, 200 оборотов/минуту в течение 30 минут при 35oC. Стеклянные горошины отфильтровывают через воронку Бюхнера без фильтровальной бумаги. Фильтрат оставляют на один час при комнатной температуре для формирования липосомной системы. Формирование липосом подтверждают исследованием на оптическом микроскопе. Общий вес этого липосомного продукта (CH-L-1) равен 100 г.
Липосомная структура подтверждается микроскопическим исследованием и измерением распределения размера частиц.
Пример 2
Композицию липосомного селегилина готовят, как описано в Примере 1, с той разницей, что в качестве фосфолипида используют Фосфолипон 90-Н. Получают также 100 г продукта (CH-L-2). Его липосомную структуру доказывают микроскопическим исследованием и измерением распределения размера частиц.
Пример 3
Процесс происходит, как описано в Примере 1, с той разницей, что фосфолипид в количестве, меньшем, чем 1 г, и холестерол в количестве 1 г растворяют в смеси органического растворителя. Полученный продукт называют (CH-L-3).
Пример 4
Процесс происходит, как описано в Примере 1, с той разницей, что использовали 20 г селегилина и 30 г фосфолипида. Микроскопическим исследованием и измерением распределения размера частиц 118 г продукта доказано, что продукт является липосомной композицией.
Пример 5
Процесс происходит, как описано в Примере 2, но использовали 30 г селегилина, 40 г фосфолипида и 40 мл смеси хлороформа и метанола.Было получено 135 г продукта и доказано, что он является липосомной композицией путем его микроскопического исследования и измерения распределения размера частиц.
Пример 6
Процесс происходит, как описано в Примере 1, с той разницей, что использовали 16 г Фосфолипона 90-Н, 4 г холестерола, 10 г гидрохлорида селегилина, 50 г дистиллированной воды и 5 г пропилен гликоля и качание проводили при оборотах 250 оборотов/минуту.
Доказано, что полученный продукт (CH-L-10) является липосомной композицией путем его микроскопического исследования и измерения распределения размера частиц. Его средний размер частиц меньше, чем таковой продуктов, полученных в соответствии с Примерами с 1 по 5.
Фигура 1: Средние уровни метамфетамина (±SD, n=3) в плазме свиней после орального или чрескожного лечения (-) Deprenyl (CHL- 10).
Фигура 2: Средние уровни метамфетамина (±SD, n=3) в плазме свиней после чрескожного лечения липосомной композицией, содержащей (-) Deprenyl.
Фигура 3: MAO-B-ингибирование тромбоцитов после чрескожного введения липосомной композиции (CHL-10) и орального введения традиционных таблеток.
Фигура 4: MAO-B-ингибирование у тромбоцитов 168 часов после чрескожного введения мультипластинчатой липосомной композиции.
Фигура 5: MAO-ингибирование в мозге, печени и тонком кишечнике 168 после чрескожного введения липосомной композиции CHL-2.
Фигура 6: MAO-ингибирование в мозге и печени 168 часов после чрескожного введении липосомных композиций.
Фигура 7: Концентрации сыворотки, подсчитанные из радиоактивности (незаряженное вещество и метаболит) после чрескожного введения различных доз композиции CHL-2.
Фигура 8: Концентрация радиоактивного вещества (селегилин+метаболиты) 168 часов после чрескожного введения композиции CHL-2.
Фигура 9: Радиоактивность различных органов морских свинок и таковая в месте приложения 168 часов после чрескожного введения композиции CHL-2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ, РАЗВИВАЮЩИХСЯ ВСЛЕДСТВИЕ НЕЙРОДЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ | 1992 |
|
RU2125448C1 |
| КЛАТРАТ 7-ИЗОПРОПОКСИИЗОФЛАВОНА И ЦИКЛОДЕКСТРИНОВОГО ПОЛИМЕРА, ПРОЯВЛЯЮЩИЙ АКТИВНОСТЬ ПРОТИВ ОСТЕОПОРОЗА И ОСТЕОМАЛЯЦИИ | 1987 |
|
RU2022970C1 |
| ТРАНСДЕРМАЛЬНАЯ БЕЗВОДНАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И НАНЕСЕНИЯ | 1992 |
|
RU2088617C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОПАРГИЛАММОНИЙХЛОРИДА | 1994 |
|
RU2130450C1 |
| АНТИМИКРОБНАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2030913C1 |
| ФУНГИЦИДНАЯ СИНЕРГИТИЧЕСКАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2091025C1 |
| ЛИОТРОПНАЯ ЖИДКОКРИСТАЛЛИЧЕСКАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2045564C1 |
| ФУНГИЦИДНАЯ СИНЕРГИСТИЧЕСКАЯ КОМПОЗИЦИЯ | 1990 |
|
RU2012205C1 |
| ПРОИЗВОДНЫЕ 3,6-ДИЗАМЕЩЕННОГО 1,2,4,5-ТЕТРАЗИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛАРВИЦИДНО- И ОВИЦИДНО-АКТИВНАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ УМЕНЬШЕНИЯ КОЛИЧЕСТВА ЛИЧИНОК И ЯИЦ КЛЕЩЕЙ | 1994 |
|
RU2142949C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛАЛКИЛАМИНОВ ИЛИ СОЛЕЙ ЭТИХ СОЕДИНЕНИЙ | 1990 |
|
RU2015960C1 |
Настоящее изобретение обеспечивает липосомную композицию, содержащую в качестве активного ингредиента (-)-N-(диметил-N-(2-пропилфенилэтиламин) (селегилин) и/или его соли. Эта композиция содержит: 0,1-40% по весу селегилина и/или его солей, от 2 до 40% по весу липидов, предпочтительно фосфолипидов, от 0 до 10% по весу холестерола, от 0 до 20% по весу спирта, от 0 до 25% по весу гликоля, от 0 до 3 % по весу антиоксиданта, от 0 до 3% по весу презервирующего агента, от 0 до 2% по весу агента, влияющего на вязкость, от 0 до 50% по весу циклодекстрина или производного циклодекстрина и от 30 до 90% по весу воды. Это изобретение обеспечивает процесс приготовления липосомных композиций, содержащих селегилин и/или его соли. В соответствии с этим изобретением липосомная композиция может быть введена при лечении болезни Алцгеймера, болезни Паркинсона, депрессии, параличе, расстройстве движения или миелите. Полученная композиция более эффективна. 3 с. и 14 з.п. ф-лы, 9 ил., 1 табл.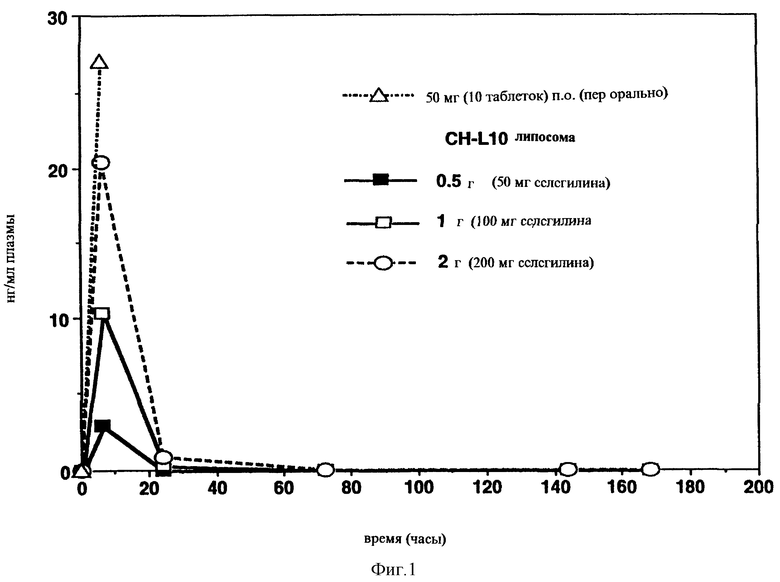
Селегилин и/или его соли - 0,1 - 40
Липиды - 2 - 40
Вода - 30 - 90
3. Липосомная композиция по п.2, характеризующаяся тем, что она содержит в качестве липидов фосфолипиды.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Токосъемное устройство | 1973 |
|
SU473252A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Компенсатор деформаций трубопрово-да | 1974 |
|
SU509761A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 9001928 A1, 08.03.1990 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ получения липосом | 1977 |
|
SU774555A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.1, с.177. | |||
Авторы
Даты
2000-11-20—Публикация
1995-10-20—Подача