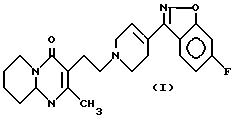
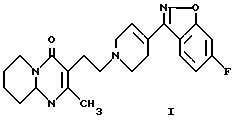
Настоящее изобретение относится к соединению 3-{2-[4-(6-фторбензо[d] изоксазол-3-ил)-3,6-дигидро-2H-пиридин- 1-ил] этил} -2-метил-6,7,8,9-тетрагидропиридо[1,2-а]пиримидин- 4-он формулы (I)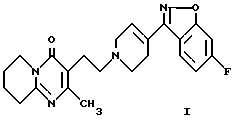
которое применяют в качестве лекарственного средства, активного для центральной нервной системы, и фармацевтически приемлемым солям этого соединения.
Предпосылки к созданию изобретения
В EP-A-0196132 описываются 3-пиперидинил-1,2-бензоизоксазолы формулы (II) как обладающие антипсихотическими свойствами.
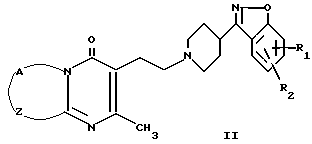
В EP-A-0037265 описываются 3-[1-(пиперидинил)-4H-пиридо[1,2-a]пиримидин-4-оны формулы (III)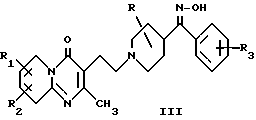
где R представляет собой водород, алкил, OH, RO или CH2OH в положениях 2, 3 или 4 ядра пиперидина, применяемые в качестве сердечно-сосудистых агентов и действующие на центральную нервную систему.
Соединение формулы (I) настоящего изобретения отличается от известных соединений присутствием двойной связи между положениями 3 и 4 ядра пиперидина и фармакологической активностью.
Соединения данного типа обладают нейролептическими свойствами и используются при лечении шизофрении и других типов психозов. Как имеет место в случае других психотропных средств, антипсихозное действие нейролептиков связано с изменениями в центральных нейротрансмиттерах. Есть четкая корреляция между антипсихозным действием данного типа вещества и модификацией работы допаминэргических проводящих путей. Один из постулируемых механизмов антипсихозного эффекта заключается в антагонизме допаминовых рецепторов, которые могут активизировать мезокортикальный и/или мезолимбический проводящий путь, но нейролептики могут также действовать на другие проводящие пути, такие как нигростриатный проводящий путь, который является одним из проводящих путей, ответственных за проявление экстрапирамидальных симптомов, считающихся вредными при данном типе лечения.
Открытие различных подтипов допаминовых рецепторов и разработка особого антагониста подтипа D2 улучшили лечение шизофрении, но не решили проблему. Параллельно, появление 5HT2 - антагонистов, которые, как было показано, являются эффективными для негативных симптомов шизофрении и экстрапирамидальных эффектов, привели к поиску нейролептиков, имеющих объединенную D2/5HT2 антагонистическую активность, как в случае предлагаемого продукта. Таким образом, этот тип соединений как D2-антагонист улучшает положительные симптомы шизофрении (делириозные и параноидальные идеи, галлюцинации, изменения логики и когерентности мысли, манерность и кататоническое или серьезно дезорганизованное поведение), и в качестве 5HT2 - антагонизма они улучшают отрицательные симптомы (бедность содержания языка, отсутствие мотивации и т. д.), а также снижение экстрапирамидальных эффектов. Антипсихозный эффект также наблюдается в снижении враждебности и отсутствия кооперации со стороны пациента. Лекарства этого типа были атипичными, чтобы отличить их от более старых традиционно используемых антипсихозных средств, действующих только на допаминовый рецептор.
Краткое изложение существа изобретения
3-{ 2-[4-(6-фторбензо[d] изоксазол-3-ил)-3,6-дигидро-2H-пиридин-1-ил] этил} - 2- метил-6,7,8,9-тетрагидропиридо[1,2-a] пиримидин-4-он формулы (I) настоящего изобретения обладает интересными фармакологическими свойствами, в частности при лечении психотических нарушений и альтераций, связанных с захватом и/или выделением допамина, и/или серотонина.
Настоящее изобретение предлагает также фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым разбавителем. Эту композицию предпочтительно применяют в форме таблеток, капсул, инъекционных растворов или суспензии для лечения людей. Ее применение при лечении психотических заболеваний, в частности, необычно.
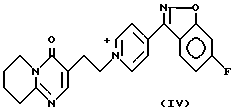
Соединение формулы (I) можно получить способом, заключающимся в восстановлении пиридиниевой соли формулы (IV)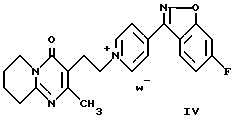
где W- представляет собой органический или неорганический анион, например галогенид- или сульфонат-анион.
Пиридиниевую соль формулы (IV) можно удобно восстановить боргидридом металла, например боргидридом натрия, в адекватном протонном растворителе, например воде, алканолах или карбоновых кислотах (R.E.Lyle and P.S.Anderson, Adv. Heterocycl. Chem. 6, 45-93 (1966)).
Промежуточные продукты и исходные соединения, применяемые в этом способе настоящего изобретения, являются известными продуктами или их можно легко получить из известных продуктов.
Промежуточные продукты формулы (IV) можно легко получить N-алкилированием пиридина формулы (V) реагентом формулы (VI), где W представляет собой соответствующую удаляемую группу, такую как, например, галогенидная или сульфонатная группа.
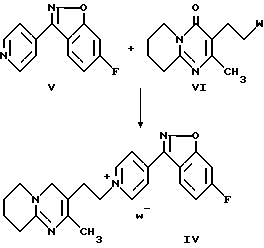
Реакцию N-алкилирования проводят в растворителе, инертном в условиях реакции, например 4-метил-2-пентаноне, ацетонитриле, N-метилпирролидоне или N, N-диметилформамиде, возможно при слегка повышенной температуре и добавлении иодида калия в качестве катализатора.
Пиридин формулы (V) можно получить циклизацией оксима формулы (VII) в инертном растворителе, например тетрагидрофуране, диоксане или N,N-диметилформамиде, в присутствии подходящего основания, например карбоната щелочного металла или гидрида или алкоксида щелочного металла.
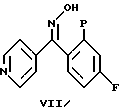
Альтернативно пиридин формулы (V) можно также получить циклизацией ацетилированного производного формулы (VIII) оксима формулы (IX) (L. Davis et al., Drug Design and Discovery, 8, 225-240 (1992)).
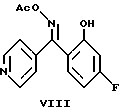
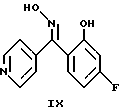
Кетон формулы (X), предшественник соединения формулы (VII), можно получить ацилированием по Фриделю-Крафтсу 1,3-дифторбензола хлористым изоникотиноилом (F.I.Villani et al., I.Org. Chem., 17, 249 (1952)).
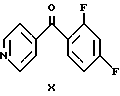
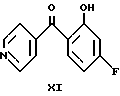
Подобным образом кетон формулы (XI), являющийся предшественником оксима формулы (IX), можно получить реакцией Фриса из 3-фторфенола и хлористого изоникотиноила.
Соединения формулы (VI) описаны (H.Fujita et al., Ann. Rep. Sankyo Res. Lab. 29, 75-98 (1977)).
Предпочтительными фармацевтически приемлемыми солями являются соли присоединения с кислотами. Фармацевтически приемлемыми солями присоединения соединений формулы (I) являются соли, образованные из кислот, образующих нетоксичные соли присоединения, содержащие фармацевтически приемлемые анионы. Эти соли можно получить из неорганических кислот, например соляной, бромистоводородной, серной или азотной кислоты, или органических кислот, например молочной, янтарной, щавелевой, малеиновой или другой кислоты.
Соли можно получить обычными способами, такими как, например, смешивание растворов, содержащих эквимолярные количества свободного основания и желаемой кислоты. Образованную соль выделяют фильтрованием, если она нерастворима, или выпариванием растворителя.
Соединение формулы (I) и его фармацевтически приемлемые соли очень активны в качестве антипсихотических лекарственных средств.
Фармакологические результаты
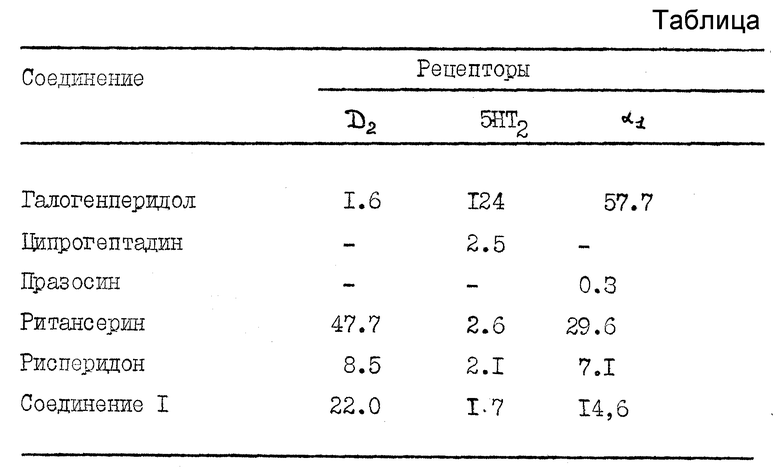
Изучение связывания с D2-рецепторами (D-допамин)
Изучение проводили, как описано Leysen et al. (1978), с некоторыми модификациями. Получали полосатую ткань головного мозга крыс с гомогенизацией в 20 объемах буфера трис-HCl во льду (50 мМ, pH 7,7, 4oC). Гомогенат центрифугировали (40000 г, 10 мин) и осадок суспендировали в 10 объемах немеченого буфера и снова центрифугировали. Конечный осадок суспендировали в 10 объемах буфера 50 мМ трис-HCl с 120 мМ NaCl и 5 мM KCl (pH 7,7). Исследования замещения проводили с 25 мкл 3H-спироперидола (0,2 нМ, NEN), 25 мкл немеченого заменителя и 200 мкл ткани. Инкубирование (37oC, 15 мин) заканчивали быстрым фильтрованием через фильтры Ватмана GF/C. Немеченым стандартным продуктом был галогенперидол.
Изучение связывания с 5-HT2-рецепторами (5HT-серин)
Изучение проводили, как описано Leysen et al. (1978), с некоторыми модификациями. Получали кору фронтальной части головного мозга крыс с гомогенизацией в 20 объемах буфера трис-HCl во льду (50 мМ, pH 7,4, 4oC). Гомогенат центрифугировали (40000 г, 10 мин) и осадок суспендировали в 10 объемах немеченого буфера и снова центрифугировали. Конечный осадок суспендировали в 400 мл буфера 50 мМ трис-HCl. Исследования замещения проводили с 25 мкл 3H-кетансерина (0,5 нМ, NEN), 25 мкл немеченого заменителя и 500 мкл ткани. Инкубирование (37oC, 15 мин) заканчивали быстрым фильтрованием через фильтры Ватмана GF/C. Немеченым стандартным продуктом был ципрогептадин.
Связывание с α1 - адренергеновыми рецепторами
Изучение проводили, как описано Morrtow et al. (1985), с некоторыми модификациями. 3H-празосин связывался с высокой аффинностью с α1 - адренергическими рецепторами коры головного мозга крыс. Кортикальную ткань головного мозга получали с применением гомогенизации в 20 объемах буфера трис-HCl во льду (50 мМ, pH 7,7, 4oC). Гомогенат центрифугировали (25000 об/12 мин при 4oC) и осадок гомогенизировали и в конце ресуспендировали в буфере 50 мМ трис-HCl, pH 7,7 (разбавление 1:200). Для анализа 0,9 мл гомогената инкубировали с 50 мл 3H-празосина (0,5 нМ) и 50 мкл соответствующего немеченого заменителя при различных концентрациях. Инкубирование (37oC, 15 мин) заканчивали быстрым фильтрованием через фильтры Ватмана GF/C, затем промывали два раза 5 мл буфера трис-HCl, 50 мМ. Немеченым стандартным продуктом был празосин.
Leysen, I.E., Goumeren, W. and Laduron, P.M. (1978) Biochem. Pharmacol., 27, 307-316. Morrow et al. (1985), Eur. J. Pharmacol., 109:285-287.
Замена (Ki, нМ) связывания 3H-спироперидопа с D2-рецепторами (полосатой ткани крыс), 3H-кетансерина с 5-HT2-рецепторами и 3H-празосина с α1 - адренергическими рецепторами (коры головного мозга крыс).
Экспериментальная часть
Пример 1
(2,4-Дифторфенил)пиридин-4-илметанон (X)
219 мл (3,00 моля) хлористого тионила добавляли в раствор 246,2 г (2,00 моля) изоникотиновой кислоты в 500 мл 1,2-дихлорэтана и смесь кипятили с обратным холодильником 4 часа. Избыток хлористого тионила и растворитель удаляли выпариванием при пониженном давлении и к твердому остатку добавляли 392 мл (4,00 моля) 1,3-дифторбензола и затем по частям 533 г (4,00 моля) треххлористого алюминия. После окончания экзотермической реакции смесь кипятили с обратным холодильником в течение 5 час. Затем смесь охлаждали и выливали в смесь 3 кг льда и 1 кг воды, перемешивали 0,5 часа и фазы разделяли. Водную фазу промывали 1 л хлористого метилена и затем подщелачивали 2 л 40%-ного раствора NaOH и экстрагировали CH2Cl2 (2 х 1 л). Объединенные органические экстракты сушили (MgSO4) и выпаривали при пониженном давлении, получая 179,4 г (выход 41%) заглавного соединения в форме масла цвета охры.
ИК-спектр (пленка): 1680 см-1.
1H-ЯМР δ (CDCl3): 6,88-7,12 (м, 2H, аромат.), 7,56-7,61 (м, 2H, пирид.), 7,64-7,77 (м, 1H, аромат.), 8,81-8,85 (м, 2H, пирид.).
Пример 2
Оксим (2,4-дифторфенил)пиридин-4-илметанона (VII)
62,6 г (0,900 моля) гидрохлорида гидроксиламина и 133,6 г (0,982 моля) тригидрата ацетата натрия добавляли в суспензию 179,4 г (0,818 моля) соединения примера 1 в 1 л этанола и смесь кипятили с обратным холодильником 1 час. Растворитель удаляли выпариванием при низком давлении. К остатку добавляли 1 л воды и смесь фильтровали. После сушки 3 часа при 45oC получали 181 г (выход 94%) заглавного соединения (смесь син- и анти-изомеров) в виде белого твердого вещества.
Т. пл.: 155-200oC.
ИК-спектр (таблетка KBr): 1580 см-1.
1H-ЯМР δ (d6DMSO): 7,10-7,70 (м, 5H, аромат. и пирид.), 8,50-8,80 (м, 2H, пирид.), 12,40 (с, 1H, -OH).
Пример 3
6-Фтор-3-пиридин-4-илбензо[d]изоксазол (V)
181 г (0,773 моля) смеси оксимов примера 2 добавляли по частям в 19 г (0,4 моля) 50%-ой суспензии NaH в минеральном масле, суспендированном в 900 мл тетрагидрофурана, перемешивали 10 час при 25oC. Смесь выливали в 1 л воды, фазы разделяли и водную фазу экстрагировали этилацетатом (2 х 0,5 л). Объединенные органические фазы сушили (MgSO4) и выпаривали при пониженном давлении. Остаток перекристаллизовали из метанола два раза, получая 53 г (выход 32%) заглавного соединения в виде белого твердого вещества.
Т. пл.: 138-146oC.
ИК-спектр (KBr): 1610, 1595 см-1.
1H-ЯМР δ (CDCl3): 7,15-7,27 (м, 1H, аромат.), 7,35-7,45 (м, 1H, аромат. ), 7,80-7,95 (м, 3H, аромат. и пирид.), 8,80-8,88 (м, 2H, пирид.).
Пример 4
Иодид 1-[2-(2-метил-4-оксо-6,7,8,9-тетрагидро-4H-пиридо[1,2-a] пиримидин-3-ил)этил]-4-(6-фторбензо[d]изоксазол-3-ил)пиридиния (IV)
Суспензию 55 г (0,257 моля) соединения предыдущего примера, 64 г (0,282 моля) 3-(2-хлорэтил)-2-метил-6,7,8,9-тетрагидропиридо[1,2-a] пиримидин-4-она (соединение формулы VI, у которого W = Cl и 42 г (0,282 моля) иодида натрия в 1 л ацетонитрила кипятили с обратным холодильником в течение 10 час. После охлаждения до 10oC продукт фильтровали, получая 135 г (выход 98%) заглавного соединения в виде желтого твердого вещества.
Т. пл.: 160-166oC.
ИК-спектр (KBr): 1630 см-1.
1H-ЯМР δ (DMSO): 1,65-1,90 (м, 4H, H-C(7) и H-C(8)), 2,15 (c, 3H, CH3) 2,70-2,85 (м, 2H, H-C(9)), 3,05-3,25 (м, 2H, CH2-C(3)), 3,55-3,75 (м, 2H, H-C(6)), 4,80-5,00 (м, 2H, N+-CH2), 7,56 (дт, J = 2,3, 9,2, 1H, аромат.), 8,01 (дд, J = 2,3 8,5, 1H, аромат.), 8,41 (дд, J = 5,4 9,2, 1H, аромат.), 8,76 (д, J = 6,9, 2H, пирид.), 9,28 (д, J = 6,9, 2H, пирид.).
Пример 5
3-{2-[4-(6-Фторбензо[d]изоксазол-3-ил)3,6-дигидро-2H-пиридин-1-ил] этил} -2-метил-6,7,8,9-тетрагидропиридо[1,2-a]пиримидин-4-он (I)
6,0 г (0,158 моля) NaBH4 добавляли по частям в суспензию 50 г (0,094 моля) соединения предыдущего примера в метаноле (0,5 л) при поддержании температуры смеси 0oC и 5oC. В конце добавления смесь перемешивали еще 15 мин, добавляли в нее 50 г (0,935 моля) NH4Cl и метанол удаляли выпариванием при пониженном давлении. В остаток добавляли 150 мл H2O и 30 мл концентрированной HCl и смесь нагревали до образования раствора, добавляли 430 мл IPA и затем перемешивали 5 час при 20oC. После фильтрования получали 21 г (выход 53%) заглавного соединения в виде дигидрохлорида.
Т. пл.: (основание, DSC): 179oC.
ИК-спектр (KBr): 1680 см-1.
1H-ЯМР δ (CDCl3): 1,80-2,10 (м, 4H, H-C(7) и H-C(8)), 2,36 (c, 3H, CH3) 2,55-2,75 (м, 1H, H-C(3) пирид.), 2,75-2,95 (м, 9H, H-C (6), H-C(9), H-C(2) пирид. , H-C(3) пирид. , 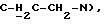 3,35-3,50 (м, 2H, H-C(6) пирид.), 3,90-4,00
3,35-3,50 (м, 2H, H-C(6) пирид.), 3,90-4,00 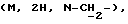 6,65 св. 1H, H-C(5) пирид.), 7,05-7,15 (ддд, 1H, аромат.), 7,20-7,35 (дд, 1H, ароматич.), 7,75-7,90 (дд, 1H, аромат.).
6,65 св. 1H, H-C(5) пирид.), 7,05-7,15 (ддд, 1H, аромат.), 7,20-7,35 (дд, 1H, ароматич.), 7,75-7,90 (дд, 1H, аромат.).
Изобретение относится к соединению формулы I, которое обладает нейролептическими свойствами и используется при лечении шизофрении и других типов психозов. Соединение I получают частичным восстановлением пиридиниевой соли формулы IV, где W- - органический или неорганический ион, при помощи боргидрида металла в протонном растворителе. 4 c. и 5 з.п. ф-лы, 1 табл.
и его фармацевтически приемлемые соли.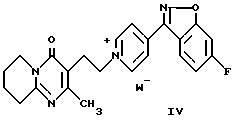
где W- - органический или неорганический ион, при помощи боргидрида металла в протонном растворителе.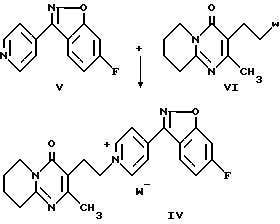
где W- представляет собой органический или неорганический ион,
в инертном растворителе, необязательно при высокой температуре.
| Способ получения производных 4 @ -пиридо(1,2-а)пиримидин-4-она или их фармацевтически приемлемых кислотно-аддитивных солей | 1982 |
|
SU1093251A3 |
| РЕГУЛИРУЕМЫЙ ОТВЕТВИТЕЛЬ ЭЛЕКТРОМАГНИТНОЙ | 0 |
|
SU196132A1 |
| EP 0453042 A1, 1991 | |||
| US 4485107 A, 1984. | |||
Авторы
Даты
1999-02-10—Публикация
1995-02-02—Подача