Изобретение относится к области лечения ретровирусных инфекций, более конкретно к лечению инфекции вируса иммунодефицита человека (ВИЧ) и сопутствующего заболевания, включающего синдром приобретенного иммунодефицита (СПИД).
Ретровирусные агенты причастны к ряду заболеваний, включая рак, аутоиммунное заболевание и СПИД. Вирус иммунодефицита человека (ВИЧ) вызывает хроническое прогрессирующее исчезновение СД4+Т лимфоцитов (СД4+клеток) и инфекцию макрофагов, приводя в результате к синдрому приобретенного иммунодефицит. Общераспространенный зидовудин (АЗТ), аналог тимидина является основным противовирусным лекарством используемым при лечении инфекции ВИЧ, хотя также используют два других агента с подобным механизмом действия дидэзоксиинозин (ддИ) и дидэзоксицитозин (ддЦ), Colley T.P et.at. New Engl. Med. (1990) 322: 1340-45; Fisch, M.A.,et.al. New Engl. J.Med. (1987) 317:185-91. Эти агенты являются эффективными при ингибировании вирусной репликации и могут стабилизировать уровни СД4+клеток, но они не пригодны для уничтожения одного из основных вирусных резервуаров, макрофагов инфицированных ВИЧ, Gartner, S., et.al., Science (1986) 233:215-19. Высокую токсичность, особенно при ВИЧ костного мозга хозяина, также связывают с повышенными дозами АЗТ при лечении и уменьшением благотворного влияния лекарства после продолжительной терапии у пациентов, страдающих СПИД; у пациентов, подвергнутых лечению, наблюдали также ВИЧ штаммы, резистентные к АЗТ. Эти находки побудили к поиску альтернативных лекарств для лечения инфекции ВИЧ, в частности агентов, отличающихся механизмом действия.
Вирус иммунодефицита человека типа 1 (ВИЧ-1), ретровирус, является этиологичной причиной СПИД. Гликопротеиновая оболочка ВИЧ-1, gp120, специфично связывается с СД4 рецептором на Т лимфоцитах и на моноцитах и макрофагах. Хотя инфекция Т лимфоцитов требует клеточной пролифирации и синтеза ДНК, продуктивное заражение моноцитов может иметь место независимо от синтеза клеточной ДНК (Weinberg, J.B., et.al., (1991) J.Exp.Med. 174:1477-82). Если ВИЧ-1 заражает активированные СД4+ лимфоциты, это является летальным, но зараженные моноциты являются относительно резистентными к разрушению вирусом. Следовательно, эти клетки, однажды зараженные ВИЧ-1, служат в качестве долгоживущих резервуаров вируса.
Но не только эти клетки являются источником репликации вируса, но их возникающая за счет вируса дисфункция может вносить вклад в повышенную восприимчивость к условно-патогенным инфекциям, которые являются признаком СПИД.
Так как моноцит-макрофаги служат в качестве резервуаров для ВИЧ-1, введение селективной метки в эту популяцию, дополнительно к Т лимфоцитам, заслуживают дальнейшего рассмотрения (Finberg, R. W. , et.al., Science 252: 1703-05, 1991. Ранние сообщения группы Fox(JADA 118:709-711, 1989) указывают, что компонент слюны человека блокирует репликацию ВИЧ. Недавно Hatttori (FEBS Lett. 248:48-52, 1989) показал, что ингибитор триптазы (трипсинподобного фермента) может ингибировать образование синцитий Т-клеток, индуцируемое ВИЧ.
При исследовании различных потенциальных модуляторов инфекции ВИЧ-1 авторы данного изобретения идентифицировали эндогенный источник ингибирующей активности, который замедляет инфицирование и/или репликацию ВИЧ-1.
Фактором, ответственным за противовирусную активность, является сериновый ингибитор протеазы лейкоцитов (СЛПИ). СЛПИ является сильно действующим инигибитором эластазы лейкоцита человека, и катепсина G, и трипсина человека и был выделен из паротидных секреций (Thompson, R.C. and K.Ohlsson, (1986) Proc. Natl. Acad. Sci. USA, 83:6692-96; и US патент N 4760130). СЛПИ является теперь доступным за счет получения с помощью рекомбинантной ДНК (заявка РСТ, поданная 4 декабря 1985, публикация N WO 86/03519).
Способность СЛПИ и/или его производных блокировать инфицирование и/или репликацию ВИЧ-1 может обеспечить терапевтическое воздействие на инфекцию ВИЧ-1.
На фиг.1. изображено как СЛПИ блокирует репликацию ВИЧ в моноцитах в зависимости от дозы. Выделенные моноциты человека высаживают на чашки и выдерживают с ВИЧ-СЛПИ в течение 1 часа при 37oС, промывают и инкубируют при 37oС, удаляя надосадочные жидкости и добавляя свежую среду каждые четыре дня. ЕС50 для этих экспериментов была менее 0,1 мг/мл (8,5 наномоль) с полным ингибированием при 10 мг/мл (850 Нмоль).
Как показано на фиг. 2, ингибирующий эффект СЛПИ является длительным. На 18 сутки ВИЧ еще ингибирован на 90%.
Ингибиторы протеазы, использованные в данном изобретении, могут быть получены с помощью хорошо известных в этой области способов (смотри патент США N 4760130, Европейскую патентную заявку N 85905 953.7, заявку PСТ WO 86/03519).
Настоящее изобретение относится к ингибиторам протеазы, которые выделены в чистой форме. Предпочтительно сериновые ингибиторы протеазы по настоящему изобретению являются протеинами с однопептидной цепью, которые являются, по существу, гомологами, и более предпочтительно, биологически эквивалентными нативному сериновому ингибитору протеазы, выделенному из паротидных секреций человека. Нативный сериновый ингибитор относится также к нативному паротидному ингибитору. Термином "биологически эквивалентный", как он использован здесь, обозначают, что композиции, способные ингибировать полученную из моноцита протеазу, которая ингибируется СЛПИ, но необязательно в той же самой степени. Термином "производные", как используют повсюду в последующем описании и в формуле изобретения, обозначают степень гомологичности аминокислоты с нативным паротидным ингибитором, предпочтительно превышающую 40%, более предпочтительно 50%, с преимущественно предпочтительными группами протеинов, являющимися более чем на 60% гомологичными с нативным паротидным ингибитором. Процент гомологичности, как описано выше, расчитывают как процент компонентов, найденных в меньшей из двух последовательностей, которые могут быть найдены в большей из двух последовательностей, причем под компонентом понимают последовательность четырех соседних аминокислот.
Одно из полезных СЛПИ производных представляет ЦЛПИ, усеченную молекулу СЛПИ, содержащую только последние 60 аминокислот нативного паротидного ингибитора. Эти 60 аминокислот приведены в конце текста (см. I).
Следующую нуклеотидную последовательность используют для кодирования приведенных выше молекул из 60 аминокислот (см. II в конце текста). ЦЛПИ был построен за счет делеции из сигнальной последовательности СЛПИ гена и нуклеотидов, соответствующих первым 47 аминокислотам зрелого СЛПИ протеина, как описано в патентной заявке США 07/712354. ЦЛПИ может быть также получен по способу примера 8, описанному в заявке РСТ WO 86/03519 и Европейской патентной заявке 85 905 953.7. Хотя пример 8 в этих двух заявках раскрывает способы получения СЛПИ, этот способ может быть также использован для получения ЦЛПИ. ЦЛПИ может быть использован для выработки антител, пригодных для очистки СЛПИ. Антитела могут быть получены, например, способами, описанными в E. Harlow and D. Lane, Antibodies : A Laboratory Manual, pp.92-114 (Cold Springs Harbor Laboratory, 1988).
ЦЛПИ мутеины также включаются в объем изобретения. ЦПЛИ мутеины, которые соответствуют СЛПИ мутеинам Gly 72, Val 25 и Phe 72 здесь называются как Gly 25, Val 25 и Phe 25. Некоторые рассматриваемые ЦЛПИ мутеины имеют следующую аминокислотную последовательность III (в конце текста),
где R7 представляет собой аланин
и R3, R4, R5, R6, R8 и R9 являются одинаковыми или различными аминокислотами и один или более из R3, R4, R5, R6, R8 и R9 могут быть метионином, валином, аланином, фенилаланином, тирозином, триптофаном, лизином, глицином или аргинином. PEG-илированные формы СЛПИ или ЦЛПИ могут иметь улучшенные терапевтические характеристики по сравнению с нативным протеином. Мутеины, которые могут быть пригодны для PEG-илирования, включают мутеины, которые содержат цистеиновый остаток в положениях 13, 23, 52, 58, 68 и/или 75 СЛПИ и при соответствующих сайтах 5, 11, 21 и 28 в ЦЛПИ. Получение цистеиновых мутеинов для PEG-илирования раскрыто в заявке РСТ WO 92/19221, поданной 13 марта, 1992. Полезная стадия при получении мутеина может включать стадию рефолдинга (refolding), в которой цистеин добавляют к раствору, содержащему протеин. Цистеин может добавляться в стадию рефолдинга и может связываться с замещенным свободным цистеином в мутеине. Можно также выделить из моноцитов СЛПИ ингибируемый протеин (СИП) из моноцитных клеток человека, используя стандартные биохимические процедуры, хорошо известные для специалистов в этой области, и выделять протеины с протеолитической активностью, которые ингибируются СЛПИ.
После выделения протеина (и, при необходимости, его секвенирования, клонирования его гена и экспрессирования его в клетки хозяина, т.е. рекомбинантного получения СИП) можно скринировать его по способности ингибировать СИП с помощью приемов, хорошо известных в этой области. Или же можно определять их структуру и конструировать из них ингибиторы также с помощью приемов, хорошо известных специалистам в этой области.
СЛПИ или его производное используют для борьбы с инфекциями ВИЧ у человека, орально или парентерально, в носителе, включающем один или более из фармацевтически приемлемых носителей, количество которого определяют растворимостью и химической природой соединения, выбранного пути введения и стандартной биологической практикой. Для орального введения СЛПИ или его производного могут быть приготовлены в стандартных дозированных формах, таких как капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента, и от около 10 до 1000 мг, более предпочтительно 10 - 200 мг в день для пациента, даже более предпочтительно 20 - 200 мг в день для пациента, в фармацевтически приемлемом носителе.
Для парентерального введения СЛПИ или его производное вводят либо с помощью внутривенной, либо подкожной, или внутримышечной инъекции в композиции с фармацевтически приемлемыми связующими или носителями. Для введения путем инъекции предпочтительно используют соединение в растворе в стерильном водном носителе, которое может также содержать другие сорастворители, такие как буферы, или консерванты, а также достаточные количества фармацевтически приемлемых солей или глюкозы для того, чтобы сделать раствор изотоническим. Подкожные инъекции являются предпочтительным путем введения. Дозы в основном являются тем же, как те, которые определены выше для орального введения.
Подходящие связующие или носители для отмеченных выше композиций могут быть найдены в стандартных фармацевтических руководствах, например в "Remington's Pharmaceutical Sciences", 16th ed., Mack Publishing Company, Easton, PA, 1980.
Дозы соединения будут меняться в зависимости от формы введения и свойства выбранного активного агента. Более того, они будут изменяться в зависимости от особенностей пациента или хозяина (включающего млекопитающих, включающих людей), которые подвергаются лечению. Обычно лечение начинают малыми дозами, существенно меньшими, чем оптимальная доза соединения. После этого увеличивают понемногу до оптимального эффекта, который достигают при данных обстоятельствах. Вообще, наиболее желательно соединение вводить в концентрации, которая будет обычно приводить к эффективным противовирусным результатам без того, чтобы вызывать какие-либо нежелательные или разрушительные побочные эффекты. Желательно поддерживать уровень соединения в крови на уровне, достаточном для ингибирования ретровирусной инфекции клеток хозяина. Это может быть установлено опытным определением количества соединения, которое является эффективным для предотвращения ретровирусной инфекции клеток хозяина, например ВИЧ в моноцитах, in vitro, и затем, используя стандартную фармакокинетическую методику, определяют количество соединения, необходимое для сохранения уровня в плазме при одном и том же уровне ингибирования, или вплоть до более чем в 10 - 100 раз.
Хотя композиции, раскрытые здесь, являются эффективными и относительно безопасными для лечения инфекций ВИЧ, не исключают возможность сопутствующего введения этих композиций с другими противовирусными лекарствами или агентами для получения положительных результатов. Такие другие противовирусные лекарства или агенты включают растворимые СД4, зидовудин, дидэзоксицитидин, фосфонформат рибаварин, противовирусные интерфероны (например, альфа-интерферон или интерлейкин-2) или аэрозоль пентамидина.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Моноциты периферической крови (МПК) выделяют от здорового донора, высевают на чашки с культурой и инкубируют в течение нескольких дней. СЛПИ смешивают с ВИЧ (Bal) и применяют к РВМ в течение 1 часа при 37oС. Клетки промывают и инкубируют в течение дополнительного времени с изменением среды и определением ревертазы в супернатантах каждые три дня. Находят, что СЛПИ эффективно блокируют репликацию ВИЧ при концентрации 1 мгк/мл (фиг. 1). При концентрациях менее или равных 20 мкг/мл ингибирование СЛПИ уменьшается. Эффект ингибирования является продолжительным, с значительным ингибированием, наблюдаемым на 18 день (фиг. 2).
Пример 2.
РВМ высевают на чашки и инкубируют, как в примере 1. СЛПИ выдерживают с клетками в течение около 1 часа, затем клетки промывают и обрабатывают ВИЧ. Меняют среду и анализ проводят, как в примере 1. Находят, что СЛПИ более эффективен при блокировании ВИЧ, если клетки предварительно обрабатывают СЛПИ, чем если клетки обрабатывают смесью СЛПИ и ВИЧ.
Пример 3.
Демонстрируют также в основном те же подходы, как в примере 1, но заменяя Т-клетки на моноциты, так как СЛПИ является эффективным в ингибировании репликации ВИЧ в Т-клетках.
Пример 4.
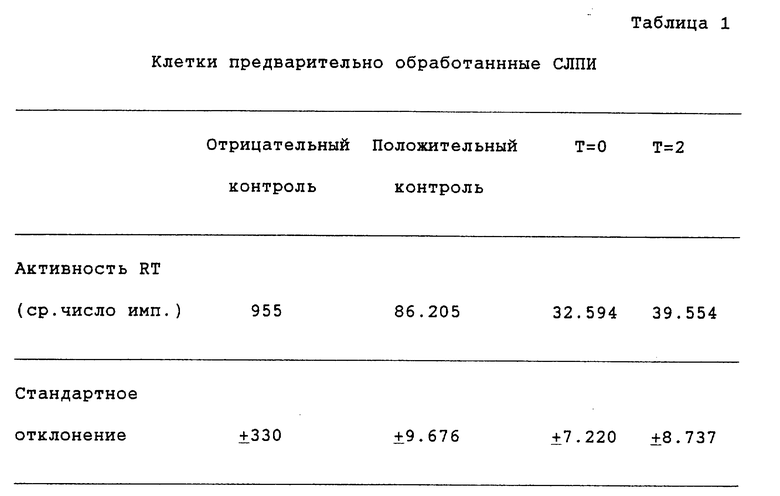
Линию клеток Т-лимфоцитов человека (Н-9) выдерживают в суспензии культуры RPVI 1640 с 10%-ной фетальной телячьей сыворотки (ФТС) и 200 микрограммами на литр гентамицина. СПЛИ добавляют в среду культуры с конечной концентрацией 100 микрограмм на миллилитр. Спустя 24 часа клетки промывают, инокулируют в течение 4 часов ВИЧ штамом 111 В, вновь промывают и ресуспендируют с плотностью 500000 клеток на миллилитр. Добавляют среду и выдерживают с СЛПИ с конечной концентрацией 100 микрограмм на миллилитр тотчас после ресуспендирования (Т=0) или два дня спустя после ресуспендирования (Т=2). Культуру супенатанта собирают и культуры подают каждые два дня. Супернатант собирают 8 дней спустя после инфицирования и анализируют на ривертазную активность измерением поглощения меченного тритием тимидина в поли(rA)-олиго (dT) матрицу.
Как показано в таблице 1, в клетках, предварительно обработанных СЛПИ, ингибированная СЛПИ вирусная репликация составляет приблизительно 62% и 54% при незамедлительном добавлении или спустя два дня после инфицирования соответственно.
Пример 5.
Опыты проводят, как описано в примере 4, за исключением того, что 1000-кратно концентрирвоанный штамм ВИЧ 111В инкубируют 100 микрограммами СЛПИ в течение 6 часов на льду до инокуляции. Эту смесь ВИЧ/СЛПИ 1000-кратно разбавляют до инокуляции в течение 4 часов.
Как показано в таблице 2, при использовании вируса и клеток, предварительно обработанных СЛПИ, СЛПИ ингибирует репликацию вируса приблизительно на 64% и 26% при немедленном добавлении или спустя 2 дня после инфицирования соответственно.
Пример 6.
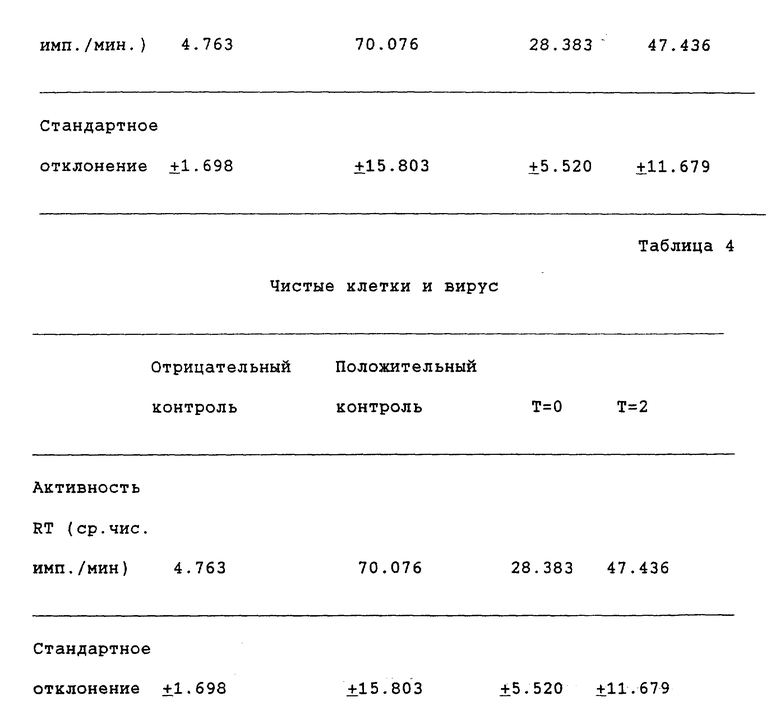
Опыты проводят, как в примере 5, за исключением того, что используют чистые клетки, т.е. клетки, не культивированные СЛПИ до инокуляции. Использование чистых клеток и вируса, предварительно обработанного СЛПИ, дает ингибированную вирусную репликацию приблизительно на 59% и 32% при немедленном добавлении или спустя два дня после инифицирования соответственно (таблица 3).
Пример 7.
Опыты проводят, как в примерах 4 - 6, за исключением того, что ни клетки, ни вирус не выдерживают с СЛПИ до инокуляции. Использование чистых клеток и чистого вируса дает ингибированную СЛПИ репликацию вируса приблизительно на 50% и 42% при немедленном и спустя два дня после инфицирования добавлении соответственно (таблица 4). В таблице 5 показана активность ревертазы, которая присутствует в культуре супернатанта, анализированной на 4, 6 и 8 сутки после инфицирования.
Пример 8.
Изучают также влияние различных СЛПИ мутеинов на вирусную репликацию. Чистые клетки Н-9 инкубируют чистым вирусом в течение 4 часов, как в примере 7. После промывания клетки ресуспендируют с плотностью 500000 клеток на миллилитр в среде, содержащей 30 микрограмм на миллилитр СЛПИ или СЛПИ мутеинов, показанных в таблице 6. Культуру супернатанта анализируют на ревертазную активность спустя 8 дней (таблица 6).
Пример 9.
Опыты проводят, как в примере 8, за исключением того, что после инокуляции клетки ресуспендируют в среду, содержащую 100 микрограмм на миллилитр СЛПИ или мутеина Phe 72. Культуру супернатанта анализируют на ревертазную активность через 2, 4, 6, 8 и 10 дней после инфицирования (таблица 7). Таблицы 6 и 7 показывают, что влияние Phe 72 мутеина было особенно заметным.
Пример 10.
Для определения влияния одного СЛПИ пролифирацию клетки Н-9 оценивают с помощью анализа по вхождению тимидина, используя клетки Н-9 в количестве 200000, культивированные со 100 микрограммами на миллилитр СЛПИ и без СЛПИ. Культуры подвергают импульсной обработке (were hulsed) средой, содержащей 2,5 микрокюри меченного тритием тимидина, и проводят измерения на 1, 2 и 3 сутки. Как показано в таблице 8, СЛПИ не является токсичным для этих клеток.
Пример 11.
Изучают также ингибирование продуцирования вируса из хронически инфицированных клеток, используя линию промоноцитной клетки U1. Суспензию культуры U1 поддерживают в RPMI с 10% FCS и 200 микрограммами на литр гентамицина. Клетки собирают, промывают и суспендируют с плотностью 2,5 миллиона клеток на миллилитр. Суспендированные клетки культивируют в течение ночи в среде, содержащей 100 или 200 микрограмм на миллилитр СЛПИ или одной среды. Вирус индуцируют добавлением 13-форбол-12-миристат ацетата (РМА) с конечной концентрацией 1 микромоль. Спустя 48 часов супернатант культуры клетки анализируют на ревертазную активность, как в примерах 4 - 9. Как показано в таблице 9, СЛПИ значительно ингибирует продуцирование вируса из этих хронически инфицированных клеток.
Приведенное выше описание приводится с целью иллюстрации и объяснения. Должно быть понятно, что могут быть проведены различные модификации в рамках объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |
| T-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ, РАСПОЗНАЮЩИЕ МУТАЦИЮ R175H ИЛИ Y220C В P53 | 2020 |
|
RU2830061C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ B-КЛЕТОК | 2013 |
|
RU2766608C2 |
| ВАКЦИНА И СПОСОБЫ ОБНАРУЖЕНИЯ И ПРОФИЛАКТИКИ ФИЛЯРИОЗА | 2021 |
|
RU2832185C1 |
| ИММУНОГЛОБУЛИН С ОДНИМ ВАРИАБЕЛЬНЫМ ДОМЕНОМ ПРОТИВ F-БЕЛКА PCB | 2016 |
|
RU2730671C2 |
| ЛЕЧЕНИЕ И ФУНКЦИОНАЛЬНОЕ ИЗЛЕЧЕНИЕ ВИЧ-ИНФЕКЦИИ МОНОКЛОНАЛЬНЫМИ АНТИТЕЛАМИ К CD4, ОПОСРЕДУЮЩИМИ КОНКУРЕНТНОЕ ИНГИБИРОВАНИЕ ВХОДА ВИЧ | 2014 |
|
RU2762315C2 |
| ОНКОЛИТИЧЕСКИЙ HSV-ВЕКТОР | 2014 |
|
RU2719190C2 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| НЕДЕСТРУКТИВНАЯ ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ MMA | 2018 |
|
RU2820602C2 |
| НЕ ВСТРЕЧАЮЩИЙСЯ В ПРИРОДЕ ВИРУС РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ (BPPCC) И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2687150C2 |










Изобретение предназначено для лечения ретровирусных инфекций, а именно инфекции вируса иммунодефицита человека. Пациенту вводят сериновый ингибитор протеазы лейкоцитов (СЛПИ) или его производное в количестве, достаточном для блокирования инфекции. Производное СЛПИ выбирают из СЛПИ Phe 72 мутеина, или СЛПИ Gly 20 мутеина, или СЛПИ Gly 72 мутеина, или СЛПИ Val 72 мутеина, или СЛПИ Phe 25 мутеина, или СЛПИ Gly 25 мутеина, или СЛПИ Val 25 мутеина. Блокируют активность сериновой протеазы лейкоцитов. Установлена аминокислотная последовательность выделенного ингибитора протеазы и нуклеотидная последовательность кодирующей его нуклеиновой кислоты. Получают нуклеиновую кислоту, способную направлять организм хозяина на продуцирование протеина с установленной аминокислотной последовательностью. Клонируют нуклеиновую кислоту в вектор, который можно перенести и реплицировать в микроорганизм хозяина. Вектор содержит операционные элементы для нуклеиновой кислоты. Вектор переносят в микроорганизм хозяина, способный экспрессировать сериновый ингибитор протеазы. Культивируют микроорганизм хозяина. Изобретение обеспечивает новые способы для профилактики и лечения ретровирусных инфекций клеток млекопитающих. 5 с. и 7 з.п.ф-лы, 9 табл., 2 ил.
Leu Asp Pro Val Asp Thr Pro Ash Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys R8 R3 R9 Asn Pro Pro Asn Phe Cys Glu R4 Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys R5 Gly R6 Cys Gly Lys Ser Cys Val Ser Pro Val Lys R7
где R7 представляет аланин;
R3, R4, R5, R6, R8 и R9 являются одинаковыми или разными аминокислотами и выбраны из метионина, валина, аланина, фенилаланина, тирозина, триптофана, лизина, глицина и аргинина, причем он ингибирует цизотрипсин и эластазу, но не ингибирует трипсин.
Leu Asp Pro Val Asp Thr Pro Asn Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys Leu Met Leu Asn Pro Pro Asn Phe Cys Glu Met Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys Met Gly Met Cys Gly Lys Ser Cys Val Ser Pro Val Lys Ala.
CTG GAT CCT GTT GAC ACC CCA ACA CCA ACA AGG AGG AAG CCT GGG AAG TGC CCA GTG ACT TAT GGC CAA TGT TTG ATG CCT AAC CCC CCC AAT TTC TGT GAG ATG GAT GGC CAG TGC AAG CGT GAC TTG AAG TGT TGC ATG GGC ATG TGT GGG AAA TCC TGC GTT TCC CCT GTG AAA GCT.
Leu Asp Pro Val Asp Thr Pro Asn Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys Leu Met Leu Asn Pro Pro Asn Phe Cys Glu Met Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys Met Gly Met Cys Gly Lys Ser Cys Val Ser Pro Val Lys Ala.
Leu Asp Pro Val Asp Thr Pro Ash Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys R8 R3 R9 Asn Pro Pro Asn Phe Cys Glu R4 Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys R5 Gly R6 Cys Gly Lys Ser Cys Val Ser Pro Val Lys R7
где R7 представляет аланин;
R3, R4, R5, R6, R8 и R9 являются одинаковыми или разными аминокислотами и выбраны из группы, состоящей из метионина, валина, аланина, фенилаланина, тирозина, триптофана, лизина, глицина и аргинина.
Leu Asp Pro Val Asp Thr Pro Ash Pro Thr Arg Arg Lys Pro Gly Lys Cys Pro Val Thr Tyr Gly Gln Cys R8 R3 R9 Asn Pro Pro Asn Phe Cys Glu R4 Asp Gly Gln Cys Lys Arg Asp Leu Lys Cys Cys R5 Gly R6 Cys Gly Lys Ser Cys Val Ser Pro Val Lys R7,
где R7 представляет аланин;
R3, R4, R5, R6, R8 и R9 являются одинаковыми или разными и выбраны из группы, состоящей из метионина, валина, аланина, фенилаланина, тирозина, триптофана, лизина, глицина и аргинина,
клонирование нуклеиновой кислоты в вектор, который можно перенести и реплицировать в микроорганизм хозяина, причем вектор содержит операционные элементы для нуклеиновой кислоты, перенесение вектора, содержащего нуклеиновую кислоту и операционные элементы, в микроорганизм хозяина, способного экспрессировать сериновый ингибитор протеазы, культивирование микроорганизма хозяина в условиях, соответствующих для амплификации вектора и экспрессии ингибитора, сбор ингибитора и разрешение ингибитору принимать активную третичную структуру, позволяющую обладать активностью серинового ангибитора протеазы.
| US 4760130 A, 1988 | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| EP 0252057 A, 1988 | |||
| ГЕНЕРАТОР АКУСТИЧЕСКИХ ШУМОВ | 0 |
|
SU384559A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| EP 0 346 500 A1, 1989 | |||
| Методы генетической инженерии | |||
| Т.Маниатис и др | |||
| Молекулярное клонирование | |||
| - М.: Мир, 1984, с | |||
| Счетный сектор | 1919 |
|
SU107A1 |
Авторы
Даты
1999-02-20—Публикация
1993-09-09—Подача