Настоящее изобретение относится к новым полипептидам задействованных в биосинтезе кобаламинов и/или кобамидов и, в частности, коэнзима /кофермента/ B12. Оно относится также к генетическому материалу, ответственному за экспрессию этих полипептидов, а также к способу, позволяющему проводить их получение. Наконец, оно относится к способу увеличения производства кобаламинов и, в частности, коэнзима B12 методами рекомбинантной ДНК.
Витамин B12 является одним из витаминов группы B. Речь идет о водорастворимом витамине, который был идентифицирован в качестве фактора, позволяющего лечить больных, страдающих злокачественной анемией. Он обычно предписывается для стимулирования кроветворения у пациентов, подверженных усталости, но он также используется в многочисленных других случаях, к которым относятся нарушения печени, недостаточности нервной системы, или в качестве средства, стимулирующего аппетит, тонизирующего средства, а также в дерматологии /Beck, 1982, Fraser et al., 1983/. В промышленном разведении нежвачных животных, где питание в основном базируется на протеинах растительного происхождения, необходимо вводить в питательный рацион витамин B12 в количествах от 10 до 15 мг на тонну пищи /Barrere et al., 1981/.
Витамин B12 относится к классу молекул, называемых кобаламинами, структура которых представлена на фиг. 1. Кобамиды отличаются от кобаламинов основанием нижнего нуклеотида, которое больше не является 5,6-диметилбензимидазолом, а представляет собой другое основание, например, 5-гидркосибензимидазол для витамина B12-фактора III, синтезированного среди прочих при помощи Clostridium thermoaceticum и Methanosarcina barkeri / Iron et al., 1984/. Это структурное сходство объясняет то, что пути метаболизма при биосинтезе кобаламинов и кобамидов по большей части являются общими.
Кобаламины синтезируются почти исключительно при помощи бактерий в соответствии со сложным и еще плохо изученным способом, который может быть разделен на четыре стадии /фиг. 2/:
I/ синтез уропорфириногена III /или уро'ген III/;
потом
II/ превращение уро'гена III в кобириновую кислоту;
затем
III/ превращение последней в кобинамид;
и
IV/ построение нижнего нуклеотидного витка с введением специфичного основания /5,6-диметилбензимидазола в случае кобаламинов/.
Для кофермента B12 является вероятным то, что присоединение 5'-деокси-5'-аденозильной группировки происходит вскоре после того, как синтезируется корриновое кольцо /Huennekens et al., 1982/.
В случае кобамидов только стадия синтеза и внедрения нижнего основания является отличной.
Первая стадия биосинтеза кобаламинов очень хорошо известна, потому что она является общей как для синтеза гемов, так и для синтеза хлорофиллов /Battersby et al., 1980/. В ней последовательно принимают участие δ -аминолевулинатсинтаза /EC 2.3.137/, δ -аминолевулинатдегидраза /EC 4.2.1.24/, порфобилиногендеаминаза /EC 4.3.1.8/ и уро'ген III-косинтаза /EC 4.2.1.75/, которые трансформируют сукцинил-CoA и глицин в уро'ген III. Однако у некоторых микроорганизмов /например, E. coli (Avissar et al., 1989) и у метаногенных бактерий (Kannangara et al. , 1989), например, первая стадия осуществляется путем превращения, благодаря мультиферментному комплексу глутаминовой кислоты в δ -аминолевулиновую кислоту.
Между уро'геном III и кобириновой кислотой к настоящему времени были получены в чистом виде только три промежуточных производных; речь идет о факторах PI, PII и PIII, которые являются продуктами окисления соответственно трех промежуточных соединений: прекоррина-1, прекоррина-2 и прекоррина-3, которые соответствуют моно-, ди- и триметилированным производным уро'гена III /фиг. 3/; эти промежуточные соединения получаются в результате последовательных переносов метильных группировок от SAM /S-аденозил-L-метионина/ на уро'ген III в положения C2, C7 и C20 соответственно. Другими реакциями, которые имеют место при образовании кобириновой кислоты, помимо пяти других переносов метильных группировок от SAM в положения C17, C12, C1, C15 и C5, являются отщепление углерода в положении C20, декарбоксилирование в положении C12 и внедрение атома кобальта /фиг. 4/. Эти стадии биосинтеза были установлены исходя из экспериментов, осуществленных in vitro на неклеточных экстрактах Propionobacterium shermanii или Clostridium tetanomorphum. В этих экстрактах кобириновая кислота получается в результате превращения уро'гена III после инкубации в соответствующих условиях при анаэробиозе /Batterby et al., 1982/. К настоящему времени у этих микроорганизмов не было выделено никакого промежуточного соединения между прекоррином-3 и кобириновой кислотой, которое может быть превращено в корриноиды путем дальнейших инкубаций с экстрактами бактерий, производящих кобаламины. Трудности выделения и идентификации этих промежуточных соединений связаны с:
- их большой нестабильностью;
- их чувствительностью к кислороду; и
- их небольшим уровнем накопления in vivo.
На этой части процесса был очищен и изучен только фермент из Pseudomonas denitrificaus; речь идет о SAM: уро'ген III-метилтрансферазе /Blanche et al. , 1989/, называемой SYMT.
При переходе от кобириновой кислоты к кобинамиду осуществляются следующие реакции:
- присоединение 5'-дезоксиаденозильной группировки /если речь идет о коферменте B12, который должен быть синтезирован/;
- амидирование шести из семи карбоксильных функций путем присоединения аминогрупп;
- амидирование последней карбоксильной функции /звено пропионовой кислоты пиррольного кольца D/ путем присоединения P-1-амино-2-пропанола /фиг. 2/.
Не было выяснено, существует ли действительно порядок для реакций амидирования /Herbert et al., 1970/. Наконец, не было описано никакого количественного определения активности на этой части процесса, за исключением того, что касается присоединения 5'-дезоксиаденозильной группировки /Huennekens et al., 1982/.
Последняя стадия биосинтеза кобаламина, например кофермента B12, включает четыре последовательные фазы, описанные на фиг. 5 /Huennekens et al., 1982/, а именно:
I/ фосфорилирование гидроксильной группировки аминопропанольного остатка в кобинамиде с образованием кобинамидфосфата, затем
II/ присоединение гуанозиндифосфата в результате реакции с гуанозин-5'-трифосфатом; полученное соединение является ГДФ-кобинамидом /Friedmann, 1975/, который
III/ реагирует с α рибазол-5'-фосфатом, синтезированным, исходя из рибофлавина, с образованием аденозилкобаламин-5'-фосфата /Fiedmann et al., 1968/, который
IV/ в результате дефосфорилирования приводит к образованию кофермента B12 /Schneider et Friedmann, 1972/.
Среди бактерий, способных вырабатывать кобаламины, можно указать, в частности:
Agrobacterium tumefaciens,
Agrobacterium radiobacter
Bacillus megaterium
Clostridium sticklandii
Clostridium tetanomorphum
Clostridium thermoaceticum
Corynebacterium XC
Eubacterium limosum
Methanobacterium arbophilicum
Methanobacterium ivanovii
Methanobacterium ruminantium
Methanobacterium thermoautotrophicum
Methanosarcina barkeri
Propionobacterium shermanii
Protaminobacterium ruber
Pseudomonas denitrificaus
Pseudomonas putida
Rhizobium melitoti
Rhodopseudomonas spaeroides
Salmonella typhimurium
Spirulina platensis
Streptomyces antibioticus
Streptomyces aureofaciens
Streptomyces qriseus
Streptomyces olivaceus
В промышленном масштабе вследствие большой сложности механизмов биосинтеза производство кобаламинов и, в частности, витамина B12 является исключительно микробиологическим. Оно осуществляется путем культивирования в больших масштабах бактерий Pseudomonas denitrificaus, Propionobacterium chermanii и Propionibacterium freudenreichii /Florent, 1986/. Штаммы, используемые для промышленного производства, происходят из диких штаммов; они могут подвергаться многочисленным циклам случайных мутаций с последующей селекцией улучшенных клонов для производства кобаламинов /Florent, 1986/. Мутации получаются в результате мутагенеза с мутагенными агентами или в результате физических воздействий, таких как обработка ультрафиолетовым излучением /Barrere et al., 1981/. В результате этого эмпирического способа получаются случайные мутации, которые улучшают производство кобаламинов. Например, описано, что исходя из оригинального штамма Pseudomonas denitrificaus, первоначально выделенного Миллером и Розенблюмом /1960, патент США 2938822/, производство этого микроорганизма было постепенно увеличено за десять лет при помощи указанных выше способов от 0,6 мг/л до 60 мг/л /Florent, 1986/. Для бактерий вида Propionibacterium/Propionobacterium shermanii (ПАТСС 13673) и frendenreichii (АТСС 6207)/ в литературе, по-видимому, описаны аналогичные значения производительности; например была описана производительность величиной 65 мг/л /европейский патент 87 920/. Однако еще не было описано никакое сито, позволяющее селекционировать или легко улавливать либо мутантов, перепроизводящих кобаламины, либо мутантов, явно улучшенных в отношении их производства кобаламинов.
На генетическом уровне к настоящему времени было осуществлено мало работ, Клонирование генов cob /кодирующих ферменты, задействованные в способе биосинтеза/ было описано у микроорганизмов Bacillus megaterium /Brey et al., 1986/. Одиннадцать групп комплементации было идентифицировано в результате комплементации мутантов cob микроорганизмов Bacillus megaterium с плазмидами, несущими различные фрагменты ДНК Bacillus megaterium. Эти гены группируются на одном и том же локусе, несущем фрагмент величиной 12 ко.
Проводились также исследования на генах cob Salmonella typhimurium. Без описания клонирования последних было показано, что почти все гены для биосинтеза кобаламинов перегруппировываются между минутами 40 и 42 хромосомы /Jeter et Roth, 1987/. Только локус cys G, который должен разрешать превращение уро'гена III в прекоррин-2-, не входит в эту группу генов. Однако активность, кодируемая этим локусом, а также его биохимические свойства не были описаны.
Кроме того, фенотипы были связаны с мутациями cob. У микроорганизмов Salmonella typhimurium и Bacillus megaterium мутанты cob больше не показывают роста на минимальной среде с этаноламином в качестве источника углерода или в качестве источника азота /Roof et Roth, 1988/. Это обусловлено тем, что фермент катаболизма этаноламина, т.е. этаноламин-аммиаколиаза /EC 4.3.1.7/ имеет в качестве кофактора кофермент B12; причем мутанты cob больше не синтезируют кофермент B12, они не могут больше расти с этаноламином в качестве источника углерода и/или в качестве источника азота. Мутанты met E Salmonella typhimurium имеют только гомоцистеинметилтрансферазу /EC 2.1.1.13/, являющуюся метилкобаламинзависящей. Мутанты cob Salmonella typhimurium met E являются ауксотрофами для метионина /Jeter et al., 1984/.
У микроорганизмов Pseudomonas denitrificaus и Agrobacterium tumefaciens фенотипы, связанные с полной дефективностью при синтезе кобаламинов, не были описаны к настоящему времени.
Наконец, работы с микроорганизмами Pseudomonas denitrificaus /Camecon et al., 1989/ привели к клонированию фрагментов ДНК, несущих гены cob этих бактерий. Последние гены разделяются на четыре группы комплементации, имеющих по меньшей мере 30 ко ДНК. По меньшей мере четырнадцать групп комплементации были идентифицированы в результате гетерологической комплементации мутантов cob Agrobacterium tumefaciens и Pseudomonas putida с фрагментами ДНК Pseudomonas denitrificaus несущих гены cob.
Однако до настоящего времени никакой из этих генов не был очищен и никакая нуклеотидная последовательность не была описана. Аналогично, не были описаны никакая идентификация протеинов и никакая каталитическая функция, приписываемая продукту этих генов. Кроме того, не смогли получить никакого улучшения производства кобаламинов методами рекомбинантной ДНК. Увеличение генов cob Bacillus megaterium не обеспечивает у штамма, исходя из которого они были клонированы, улучшения производства кобаламинов /Brey et al., 1986/. Для Salmonella typhimurium были проведены физиологические исследования с целью определить условия, при которых наблюдается большая транскрипция изучаемых генов cob /Escalante et Roth, 1987/. В этих условиях не происходит улучшение производства кобаламинов, хотя гены этого пути биосинтеза являются более выраженными, чем в стандартных условиях культивирования.
Настоящее изобретение исходит из точной идентификации последовательностей ДНК, кодирующих полипептиды, задействованные в биосинтезе кобаламинов и/или кобамидов. Следовательно, предметом настоящего изобретения являются последовательности ДНК, кодирующие полипептиды, задействованные в биосинтезе кобаламинов и/или кобамидов. В частности, предметом изобретения являются гены cobA, cobB, cobD, cobE, cobF, cobG, cobH, cobI, cobJ, cobK, cobL, cobM, cobN, cobO, cobP, cobQ, cobS, cobT, cobU, cobV, cobW, cobX, и corA, причем любая гомологичная последовательность ДНК этих генов обусловлена вырождением генетического кода; а также последовательности ДНК любого происхождения /природного, синтетического, рекомбинантного/, которые гибридизируются и/или которые имеют значительную гомологию с этими последовательностями или с фрагментами последних и которые кодируют полипептиды, задействованные в биосинтезе кобаламинов и/или кобамидов. Предметом изобретения являются также гены, содержащие эти последовательности ДНК.
Последовательности ДНК по настоящему изобретению были выделены, исходя из различных штаммов: промышленного штамма, Pseudomonas denitrificaus SC510, производного штамма МВ580 /патент США 3018225/, путем комплементации мутантов cobA. tumefaciens и P. putiola; и Methanobacterium ivanovii. Полученные клоны удалось точно проанализировать, в частности, путем картографирования при помощи включений производного транспозона тп5. Эти генетические исследования позволили локализовать гены cob и cor на карте рестрикции и провести сборку их последовательностей. Анализ открытых фаз позволил затем выявить кодирующие участки этих фрагментов ДНК.
Предметом настоящего изобретения является также применение этих нуклеотидных последовательностей для клонирования генов cob других бактерий. Действительно, известно, что для протеинов, катализирующих одни и те же процессы, последовательности сохраняются с /в качестве дивергенции/ эволюционной дивергенцией /wein-Hsiung et al., 1985/. В настоящем изобретении показано, что имеется значительная гомология между нуклеотидными последовательностями генов различных микроорганизмов, кодирующих полипептиды, задействованные в биосинтезе кобаламинов и/или кобамидов. Появляющиеся различия обусловлены эволюционным перерождением и перерождением генетического кода, которое связано с содержанием GC в геноме изучаемого микроорганизма /wein-Hsiung et al., 1985/.
В соответствии с настоящим изобретением зонд может быть изготовлен при помощи одной или нескольких последовательностей ДНК, в частности, Pseudomonas denitrificaus или при помощи фрагментов последних или при помощи аналогичных последовательностей, имеющих специфичную степень перерождения, на уровне применения кодонов и содержания CC в ДНК бактерии, которую хотят изучить. В этих условиях возможно осуществить детектирование сигнала специфичной гибридизации между зондом и фрагментами геномной ДНК изучаемой бактерии; этот сигнал специфичной гибдизации соответствует гибридизации зонда с изофункциональными генами cob бактерии. Гены cob, а также их продукты могут затем выделяться, очищаться и описываться. Таким образом, изобретение предоставляет способ, позволяющий путем гибридизации получить доступ к нуклеотидным последовательностям и к полипептидам, задействованным в биосинтезе кобаламинов и/или кобамидов, любого микроорганизма.
Предметом настоящего изобретения является также рекомбинантная ДНК, содержащая по меньшей мере одну последовательность ДНК, кодирующую полипептид, задействованный в биосинтезе кобаламинов и/или кобамидов и, в частности, рекомбинантная ДНК, в которой одна или несколько указанных последовательностей попадают под контроль сигнала экспрессии.
В связи с этим можно, в частности, поместить в положение 5' последовательности ДНК промотирующие участки. Такие участки могут быть гомологичными или гетерологичными по отношению к последовательности ДНК. В частности, сильные бактериальные промоторы, такие как промотор оперона триптофана Ptrp или оперона лактозы Plac микроорганизма E.coli, левый или правый промотор бактериофага лямбда, сильные промоторы фагов бактерий, таких как corynebacteries, функциональные промоторы у грам-отрицательных бактерий, такие как промотор Ptac микроорганизма E.coli, промотор PxyIS генов катаболизма ксилола плазмиды TOL, промотор амилазы Bacillus subtilis Pamy, смогут использоваться. Можно указать также промоторы, производные гликолитических генов дрожжей, такие как промоторы генов, кодирующих фосфоглицераткиназу, глицеральдегид-3-фосфатдегидрогеназу, лактазу или энолазу, которые смогут использоваться, когда рекомбинантная ДНК будет введена эукариоту-хозяину. Сайт связывания рибосом также будет находиться в положении 5' последовательности ДНК, и он будет являться гомологичным или гетерологичным, например, сайт связывания рибосом гена cП бактериофага лямбда.
Сигналы, необходимые для завершения транскрипции, смогут находиться в положении 3' последовательности ДНК.
Рекомбинантная ДНК по настоящему изобретению может затем вводиться непосредственно в клетку-хозяин, совместимую с выбранными сигналами экспрессии, или может клонироваться на плазмидном векторе, чтобы дать возможность ввести стабильным образом рассматриваемую последовательность ДНК в клетку-хозяин.
Другим предметом изобретения являются полученные таким образом плазмиды, содержащие последовательность ДНК, кодирующую полипептид, задействованный в биосинтезе кобаламинов и/или кобамидов. В частности, эти плазмиды содержат также функциональную систему репликации и маркер селекции.
Предметом изобретения являются также клетки-хозяева, в которые были введены одна или несколько последовательностей ДНК, таких как определено перед этим, или плазмида, такая как определено выше.
Другой предмет изобретения относится к способу получения полипептидов, задействованных в биосинтезе кобаламинов и/или кобамидов. В соответствии с этим способом в клетку- хозяин вводит последовательность ДНК, такую как описано перед этим, культивируют эту рекомбинантную клетку в условиях экспрессии указанной последовательности, затем извлекают полипептидные продукты.
Клетки-хозяева, которые смогут использоваться для этой цели, являются как прокариотами, так и эукариотами, клетками животного происхождения или клетками растительного происхождения. Они будут выбираться предпочтительно среди бактерий и, в частности, бактерий вида E.coli, P. denitrifians, A. tumefaciens или R. melitoli.
Другое применение последовательностей ДНК по настоящему изобретению основано на способе увеличения производства колабаламинов и/или кобамидов или их предшественников по биосинтезу методами рекомбинантной ДНК. Действительно, если ограничение метаболического выделения при биосинтезе кобаламинов и/или кобамидов или их предшественников обусловлено ограничением активности фермента в ходе биосинтеза, то увеличение этой активности в результате увеличения экспрессии этого же самого фермента при помощи методов рекомбинантной ДНК /генное увеличение, замена сигналов транскрипции-трансляции на более эффективные сигналы.../приведет к увеличению выхода биосинтеза кобаламинов и/или кобамидов. Возможно также, что ограничение производства кобаламинов и/или кобамидов обусловлено биохимической регуляцией. В этом случае один или несколько генов cob, соответствующих ферменту регуляции, могут подвергаться мутагенезу in vitro специфичным образом с целью получения мутантных генов, продукты которых будут теряться, причем регуляция будет противиться улучшению производства.
Способ по настоящему изобретению заключается во введении в микроорганизм, являющийся производителем кобаламинов и/или кобамидов или только потенциальным производителем этих соединений /т.е. который не прошел одной или нескольких стадий биосинтеза/, последовательности ДНК, такой как определено выше, затем в культивировании этого микроорганизма в условиях экспрессии указанной последовательности и синтеза кобаламинов и/или кобамидов и, наконец, в извлечении полученных кобаламинов и/или кобамидов. Такой способ применим, в частности, для всех производящих микроорганизмов, указанных на странице 6, а в более частном случае для микроорганизмов вида P. denitrificaus, Rhizobium militoti или Agrobacterium tumifaciens. По предпочтительному варианту осуществления микроорганизмом является P. denitrificaus и, в частности, штамм SC510. Что касается микроорганизмов, являющихся потенциальными производителями, то используемыми последовательностями ДНК будут такие, которые соответствуют тем стадиям биосинтеза, которые микроорганизм не может осуществить.
При помощи настоящего изобретения и в результате различных изложенных выше стратегий биосинтеза можно будет получить улучшение производства кобаламинов и/или кобамидов или их предшественников для любого микроорганизма, являющегося производителем или потенциальным производителем кобаламинов и/или кобамидов. Достаточно будет провести культивирование этого рекомбинированного микроорганизма в условиях, подходящих для производства кобаламинов и для экспрессии введенных последовательностей ДНК. Это культивирование можно будет осуществлять периодическии или же непрерывным способом, а очистку кобаламинов можно будет осуществлять уже используемыми в промышленности методами /Florent, 1986/. Эти методы включают, среди прочего:
I/ солюбилизацию кобаламинов и их превращение в их цианоформу /например, путем обработки ферментативного сусла при нагревании цианидом калия в присутствии нитрата натрия/, затем
II/ очистку цианокобаламинов за несколько различных стадий, которыми могут быть, например:
a/ адсорбция на различных субстратах, таких как амберлит IRC50, Дауэкс IХ2 или амберлит XAD 2 с последующим элюированием смесью вода-спирт или вода-фенол, затем
b/ экстракция в органическом растворителе и, наконец,
c/ осаждение или кристаллизация из органической фазы либо в результате прибавления реагентов или разбавления в соответствующем растворителе, либо в результате выпаривания.
Настоящее изобретение, кроме того, показывает, что возможно методами рекомбинантной ДНК улучшить производство кобаламинов бактерий, производящей кобаламины, накапливая улучшения. Это сводится к достижению первого улучшения, как это описано выше, потом к улучшению этого улучшения все время при помощи методов рекомбинантной ДНК, т.е. например, увеличивая гены для биосинтеза кобаламинов.
Другой предмет настоящего изобретения относится к полипептидам, задействованным в биосинтезе кобаламинов и/или кобамидов. В частности, предметом настоящего изобретения являются все полипептиды или производные или фрагменты этих полипептидов, которые кодируются описанными перед последовательностями ДНК и которые являются задействованными в ходе биосинтеза кобаламинов и/или кобамидов. Последовательность из аминокислот этих полипептидов описана, также как и некоторые из их физико-химических характеристик. Ферментативная активность или специфичные свойства также были связаны с каждым из них.
В связи с этим, предметом изобретения являются полипептиды, участвующие в превращении прекоррина-3 в a, c-диамид кобириновой кислоты и, в частности, в переносе метильной группировки от SAM в положения C5, C11, C15 и C17.
Предметом изобретения являются также полипептиды:
- участвующие в превращении кобировой кислоты в кобинамид, или
- обладающие активностью S-аденозил-L-метионин: прекоррин-2-метилтрансферазы /SП2МТ/, или
- обладающие активностью кобириновой кислоты и/или гидробириновой кислоты a, c-диамидсинтазы, или
- обладающие активностью прекоррин-8х-мутазы, или
- обладающие активностью никотинат-нуклеотид:диметилбензимидазолфосфорибозилтрансферазы, или
- обладающие активностью кобаламин-/5'-фосфат/синтазы, или
- обладающие активностью кобировая кислота-синтазы, или
- обладающие активностью коб/1/аламинаденозилтрансферазы, или
- обладающие активностью прекоррин-6х-редуктазы, или
- участвующие в превращении a, c-диамида гидробириновой кислоты в a, c-диамид кобириновой кислоты.
Преимущественно предметом изобретения является полипептид, выбираемый среди протеинов COBA, COBB, COBC, COBD, COBE, COBF,COBG, COBH, COBI, COBJ, COBK, COBL, COBM, COBN, COBO, COBP, COBQ, COBS, COBT, COBU, COBV, COBW, COBX и CORA, представленных на фиг. 15, 16, 40, 41 и 47.
Кроме того, применение описанных выше зондов гибридизации позволяет, исходя из генов, выделенных в других микроорганизмах, охарактеризовать и выделить изофункциональные полипептиды других микроорганизмов. Тем самым, настоящее изобретение показывает, что последовательность протеина COB микроорганизма Pseudomonas denitrificaus является значительно гомологичной с последовательностями протеинов других микроорганизмов, обладающих одним и тем же типом активности. Среди этих протеинов COB, катализирующих одну и ту же реакцию для различных микроорганизмов, только эволюционные промежутки вызвали изменения /Wein - Hsinng et al., 1985/. Предметом настоящего изобретения являются также эти изофункциональные полипептиды.
Приписывание особой ферментативной активности является результатом анализа, который может быть осуществлен в соответствии с различными стратегиями. В частности, исследования сродства in vitro по отношению к SAM/S-аденозил-L-метионину/ позволяют приписать протеину, способному связывать SAM, активность метилтрансферазы и, следовательно, его участие в стадиях переноса метильных группировок, которые происходят между уро'геном III и кобириновой кислотой. Другой способ оценки активности этих полипептидов заключается в количественном определении промежуточных продуктов в ходе биосинтеза кобаламинов, которые накапливаются у мутантов, не способных выражать эти полипептиды /идентифицированные в результате исследований по комплементации/. Эти анализы позволяют сделать вывод, что рассматриваемый полипептид имеет в качестве субстрата накопленный промежуточный продукт, что позволяет классифицировать и определить его активность в ходе биосинтеза. Настоящее изобретение описывает также способ количественного определения ферментативной активности в ходе биосинтеза, применимый для любого штамма, производящего кобаламины и/или кобамиды. Это количественное определение позволяет выделять в чистом виде, исходя из любого штамма, производящего эти соединения, определяемую ферментативную активность. Исходя из этой очищенной активности, может быть осуществлена NH2-оканчивающаяся последовательность рассматриваемого протеина COB или же аналогичная последовательность составных единиц этого протеина, что позволяет идентифицировать один или несколько структурных генов, которые кодируют рассматриваемую активность. Для микроорганизмов Pseudomonas denitrificaus структурные гены, которые кодируют активности в ходе биосинтеза, идентифицированы путем нахождения для каждой NH2-оканчивающейся последовательности протеина COB, имеющего ту же самую NH2-оканчивающуюся последовательность.
Настоящее изобретение описывает также способ, позволяющий провести для штаммов, производящих кобаламины, или для непроизводящих мутантов идентификацию и количественное определение промежуточных продуктов в ходе биосинтеза кобаламинов или других корриноидов. Эти промежуточные продукты могут быть определены как в культивируемых суслах, так и в самих клетках. Промежуточными продуктами, которые могут быть количественно определены, являются все корриноиды, которые встречаются в ходе биосинтеза после кобириновой кислоты, а именно /помимо кобириновой кислоты/: моноамид кобириновой кислоты, диамид кобириновой кислоты, триамидкобириновой кислоты, тетраамидкобириновой кислоты, пентаамид кобириновой кислоты, кобировая кислота, кобинамид, кобинамидфосфат, ГДФ-кобинамид, кофермент B12-фосфат и кофермент B12. Циано- и коферментные формы этих продуктов могут количественно определяться этим методом.
Другие предметы и преимущества настоящего изобретения будут появляться при чтении последующих примеров и фигур, которые должны рассматриваться в качестве иллюстративных, а не ограничивающих.
Определение используемых терминов и аббревиатуры
ДАККС: а,с-диамид кобириновой кислоты-синтаза;
рекомбинантная ДНК: совокупность методов, которые позволяют либо ассоциировать внутри одного и того же микроорганизма последовательности ДНК, которые являются чужеродными для него, либо проводить специфический мутагенез фрагмента ДНК
АТФ: аденозин-5'-трифосфат
БАС: бычья альбуминовая сыворотка
ВЭЖХ: высокоэффективная жидкостная хроматография
кластер: группа генов
cob: соответствует фенотипу уменьшенного уровня /по крайней мере, а 10 раз меньшего, чем контрольный /производства кобиламинов
стоп-кодон: кодон, оканчивающий трансляцию
корриноиды: производные кобириновой кислоты, обладающие корриновым кольцом
ДГТФ: 2'-дезоксигуанозин-5'-трифосфат
ДМБИ: диметилбензимидазол
ДНТФ: 2'-дезоксирибонуклеозид-5'-трифосфаты
ДТТ: дитиотреитол
ген cob: ген, задействованный в биосинтезе кобинамида, исходя из уро'гена III.
ген cor: ген, задействованный в биосинтезе корриноидов, исходя из уро'гена III
ко: тысячоснований
НН: БМБИ-ФРТ
ORF: открытая рамка считывания
по: пары оснований
протеин СОВ: протеин, участвующий либо как катализатор в ходе биосинтеза кобаламинов, либо как регулирующий протеин в сети регуляции генов cob, либо в качестве того и другого
протеин COR: протеин, участвующий либо как катализатор в ходе биосинтеза корриноидов, либо как регулирующий протеин в сети регуляции генов cor, либо в качестве того и другого
SAM: S-аденозил-L-метионин
ДСН: додецилсульфат натрия
SП2MT: SAM-L-метионин: прекоррин-2-метилтрансфераза
SYMT: SAM-уро'ген III-метилтрансфераза
уро'ген III: уропорфириноген III
Описание фигур
Фигура 1:
Структура кофермента B12; 5'-деоксиаденозильная группировка замещается CH3-группировкой для метилкобаламина, цианогруппировкой для цианокобаламина, гидроксильной группировкой для гидроксокобаламина.
Фигура 2:
Биосинтез кобаламинов и различные стадии этого биосинтеза в соответствии с литературными данными. X: аксиальные лиганды кобальта; лиганд в положении "a" может отличаться от лиганда в положении "b". R: лиганд в положении "a" кобальта, который определяет тип кобаламина /смотри фиг. 1/.
Фигура 3:
Структуры уро'генов III, прекоррина-1, прекоррина - 2 и прекоррина-3.
Фигура 4:
Развернутые формулы уро'гена III и кобириновой кислоты. Согласно литературным данным, между уро'геном III и кобириновой кислотой происходит 8 SAM-зависящих переносов метильных группировок последовательно в положении C2, C7, C20, C17, C12, C1, C15 и C5, одно декарбоксилирование в положении C12, отщепление углерода в положении C20 и внедрение атома кобальта. X: аксиальные лиганды кобальта; лиганд в положении "a" может отличаться от лиганда в положении "b".
Фигура 5:
Последние стадии биосинтеза кобаламинов. Для наглядности схемы были опущены детали корринового кольца. Представлены пять ферментативных стадий: 1 - кобинамидкиназа; 2 - кобинамидфосфатгуанилилтрансфераза; 3 - кобаламин-5'-фосфатсинтаза; 4 - кобаламин-5'-фосфатфосфогидролаза; 5 - никотинатнуклеотид: ДМБИ-фосфорибозилтрансфераза.
Фигура 6:
Карты рестрикции фрагментов ClaI-HindIII-HindIII-HindIII личной 5,4 ко /1/; SalI-SalI-SalI-SalI-SalI-BglI величиной 4748 по /2/; EcoRI величиной 8,7 ко /3/ и SstI-SstI-BamHI величиной 3855 по. Фигурируют только 20 ферментов рестрикции, которые реже всего расщепляют ДНК. Сайты расщеплений для каждого фермента указаны вертикальной чертой.
Фигура 7: нуклеотидная последовательность двух цепей фрагмента ClaI-HindIII-HindIII-HindIII величиной 5378 по микроорганизма Pseudomonas denitrificaus. Цепь, расположенную сверху, следует читать от 5' к 3' в направлении слева направо, которое соответствует ориентации слева направо фрагмента на карте рестрикции, приведенной на фиг. 6. Сайт ClaI находится в положении 23 /начало сайта расщепления/, так как на этой последовательности находятся сайты рестрикции PstI, SalI и XbaI, которые появляются в ходе клонирований на мультисайтах, чтобы составить последовательность. Последовательность фрагмента ClaI-HindIII-HindIII-HindIII начинается, следовательно, с положения 23.
Фигура 8:
Нуклеотидная последовательность двух цепей фрагмента EcoPI величиной по микроорганизмов Pseudomonas denitrificaus Цепь, расположенную сверху, следует читать от 5' и 3' в направлении слева направо, которое соответствует ориентации слева направо фрагмента на карте рестрикции, приведенной на фиг. 6.
Фигура 9:
Вероятностный анализ фаз, кодирующих согласно применению кодонов, используя программу Staden et MacLachlan /1982/ чтения последовательности фрагмента ClaI-HindIII-HindIII-HindIII величиной 5378 по для 6 фаз. В случае фаз, которые принадлежат одной и той же кодирующей цепи, наиболее вероятная фаза соответствует той, для которой пунктирная линия, не прерываемая стоп-кодонами, находится ниже линии вероятности этой фазы.
9.1. Последовательность, идущая от нуклеотида 1 до нуклеотида 1200. Благодаря данному анализу идентифицирована открытая фаза 1. Она начинается с ATG в положении 549 и заканчивается на TGA в положении 1011.
9.2. Последовательность, идущая от нуклеотида 1000 до нуклеотида 2200. Благодаря данному анализу идентифицирована открытая фаза 2. Она начинается с ATG в положении 1141 и заканчивается на TGA в положении 1981.
9.3. Последовательность, идущая от нуклеотида 1800 до нуклеотида 3400. Благодаря данному анализу идентифицирована открытая фаза 3. Она начинается с ATG в положении 1980 и заканчивается на TGA в положении 3282.
9.4. Последовательность, идущая от нуклеотида 3000 до нуклеотида 4500. Благодаря данному анализу идентифицирована открытая фаза 4. Она начинается с ATG в положении 3281 и заканчивается на TGA в положении 4280.
9.5. Последовательность, идущая от нуклеотида 3800 до нуклеотида 5378. Благодаря данному анализу идентифицирована открытая фаза 5. Она начинается с GTG в положении 4284 и заканчивается на TGA в положении 5253.
Фигура 10:
Вероятностный анализ фаз, кодирующих согласно применению кодонов, используя для 6 фаз программу Staden et MacLachlan /1982/ чтения последовательности фрагмента EcoRI величиной 8753 по. В случае фаз, которые принадлежат одной и той же кодирующей цепи, наиболее вероятная фаза соответствует той, для которой пунктирная линия, не прерываемая стоп-кодонами, находится ниже линии вероятности этой фазы.
10.1. Последовательность, идущая от нуклеотида 650 до нуклеотида 1650. Благодаря данному анализу идентифицирована открытая фаза 6. Она начинается с ATG в положении 736 и заканчивается на TAG в положении 1519.
10.2. Последовательность, идущая от нуклеотида 1400 до нуклеотида 3100. Благодаря данному анализу идентифицирована открытая фаза 7. Она начинается с ATG в положении 1620 и заканчивается на TGA в положении 1997.
10.3. Последовательность, идущая от нуклеотида 2700 до нуклеотида 3700. Благодаря данному анализу идентифицирована открытая фаза 8. Она начинается с ATG в положении 3002 и заканчивается на TGA в положении 3632.
10.4. Последовательность, идущая от нуклеотида 3500 до нуклеотида 4100. Благодаря данному анализу идентифицирована открытая фаза 9. Она начинается с CTG в положении 3631 и заканчивается на TGA в положении 4366.
10.5. Последовательность, идущая от нуклеотида 4150 до нуклеотида 5150. Благодаря данному анализу идентифицирована открытая фаза 10. Она начинается с ATG в положении 4365 и заканчивается на TGA в положении 5127.
10.6. Последовательность, идущая от нуклеотида 5000 до нуклеотида 6000. Благодаря данному анализу идентифицирована открытая фаза 11. Она начинается с ATG в положении 5893 и заканчивается на TAG в положении 5110.
10.7. Последовательность, идущая от нуклеотида 5700 до нуклеотида 7200. Благодаря данному анализу идентифицирована открытая фаза 12. Она начинается с ATG в положении 5862 и заканчивается на TAA в положении 7101.
10.8. Последовательность, идущая от нуклеотида 7000 до нуклеотида 8000. Благодаря данному анализу идентифицирована открытая фаза 13. Она начинается с ATG в положении 7172 и заканчивается на TTG в положении 7931.
Фигура 11:
Конструирование плазмид pXL556, pXL545 и pXL723. Фрагмент ClaI-EcoRV величиной 2,4 ко, содержащий гены cobA и cobE, отщепляется от фрагмента величиной 5,4 ко, затем очищается. "Связка" EcoRI присоединяется к сайту EcoRV, затем фрагмент внедряется в pXL59 между сайтами ClaI-EcoRI. Построенная таким образом плазмида называется pXL556. Для pXL545 конструирование является похожим: фрагмент -ClaI-HindIII-HindIII величиной 1,9 ко отщепляется от фрагмента величиной 5,4 ко, затем очищается. Этот фрагмент содержит исключительно ген CobE. "Связка" EcoRI присоединяется к сайту HindIII, затем этот фрагмент внедряется в pXL59 между сайтами ClaI-EcoRI.
Плазмида pXL723 конструируется следующим образом: фрагмент EcoRI-HindIII величиной 2,3 ко отщепляется от фрагмента величиной 5,4 ко, очищается, затем концы заполняются большим фрагментом ДНК-полимеразы 1 микроорганизма E. coli. Этот фрагмент клонируется в pRK290 /Ditta et al., 1981/, переваривается посредством EcoRI, затем обрабатывается при помощи большого фрагмента ДНК-полимеразы I микроорганизма E.coli с целью заполнения концов. Сайты рестрикции, которые указаны между скобками, соответствуют сайтам, которые исчезли после обработки большим фрагментом ДНК-полимеразы 1 микроорганизма E. coli.
1 - фрагмент PstI-SstI от RSF1010 /De Graff et al., 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; 3 - фрагмент BamHI-SstI, содержащий оперон лактозы микроорганизма E. coli без его промотора, оператора, сайта начала трансляции и 8 первых несущественных кодонов lacZ /Casadaban et al. , 1983/; 4 - фрагмент микроорганизма Pseudomonas putida /Bagdasarian et al., 1981/; ori - репликативного происхождения; nic - сайт релаксации; mob - локус, существенный для мобилизации; - Kmгген устойчивости к канамицину /Bagdasarian et al., 1981/; B-BamHI; C-ClaI; E-EcoRI; H-HindIII; P-PstI; S-SstI; Sa -SalI; X-XhoI; Xb-XbaI.
Фигура 12:
Исследования включений транспозонов Тп5Spr и Тп5 на фрагменте величиной 5378 по. включения транспозона Тп5 в плазмиду pXL723 соответствуют приведенным на фиг. 14; включения транспозона Тп5Spr для хромосомы штамма SBL27 RifR взяты в рамки; включения для хромосомы SC510 RifR в виде кассет, несущие ген устойчивости к канамицину /1630 и 1631/, представлены стрелкой в соответствии с ориентацией транскрипции гена устойчивости к канамицину /под номером включения/. Идентифицированные открытые фазы этой последовательности приведены на этой фигуре /от cobA до cobE/; знаки "+" и "-" изображаются под каждым включением транспозона или кассеты устойчивости, чтобы указать, что включение является инактивационным /-/ или нет /+/, т.е. для комплементации различных мутантов /случай включений транспозона Тп5/, или что включение отменяет производство кобаламинов из штамма, в котором оно имеется. Имеет место отсутствие комплементации, когда рекомбинированный мутант синтезирует менее чем в три раза меньше кобаламинов по сравнению с уровнем синтеза для штамма, из которого этот мутант выведен. Включения для плазмид pXL545 Ω pXL1500, pXL1397 и pXL302 изображены с сайтами рестрикции, находящимися на концах. Эти включения клонируются в плазмидах с широким спектром хозяев pXL435 и pXL59 /Cameron et al., 1989/.
Плазмида pXL545 Ω соответствует плазмида pXL545, описанной на фиг. 11, с дополнительным фрагментом BamHI величиной 2 ко от pHP45 Ω /Prentki et Krisch/, содержащим ген устойчивости к спектиномицину, клонированный на сайте BamHI от pXL545.
Плазмида pXL1500 соответствует фрагменту BglII-SstI величиной 4,2 ко, изображенному на этой фигуре, клонированному на сайтах BamHI и SstI плазмиды рКТ230 /Bagdasarian et al., 1981/, изображенной на фиг. 30; pXL1397 соответствует фрагменту HindIII-SstI величиной 2,4 ко, изображенному на фигуре включенным между сайтами HindIII и SstI мультисайта плазмиды рXL435 /Cameron et al., 1989/, описанной на фиг. 30; плазмида pXL302 соответствует фрагменту EcoRI - HindIII величиной 2,3 ко, который описан на фигуре включенным между EcoRI и HindIII плазмиды pXL59 /Cameron et al., 1989/, описанной на фиг. 30, причем используемый сайт HindIII является сайтом, находящимся в мультисайте клонирования плазмиды pXL59; плазмида pXL723 описана на фиг. 11 в качестве pXL545.
Знаки "+" и "-" изображаются над каждым из этих включений, чтобы указать имеет ли место комплементация рассматриваемой плазмидой хромосомных включений, представленных выше. C - ClaI; E - EcoRI; H - Hind III; RV - EcoRV; Sаи - Sаи3AI; S - SstI.
Фигура 13:
Конструктирование плазмид pXL253 и pXL367. Фрагмент EcoRI величиной 8,7 ко отщепляется, затем очищается, исходя из плазмиды pXL151. Он клонируется на сайте EcoRI плазмиды рКТ230 с образованием pXL253. Этот же самый фрагмент включается в сайт EcoRI плазмиды pR4290 /Ditta et al., 1981/ с образованием плазмиды pXL367.
1 - фрагмент PstI - SstI от RSF1010 /De Graff et al.,
1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; ori - репликативного происхождения; nic - сайт релаксации; mob - локус, существенный для мобилизации Bagdasarian et al., 1981/; B - BamHI; C - ClaI; E - EcoRI; H - Hind III; P - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI; tetг - ген устойчивости к тетрациклину; Kmг - ген устойчивости к канамицину.
Фигура 14:
Исследования включений транспозонов Тп31асZ и Тп5 на фрагменте EcoRI величиной 8,7 ко, клонированном в pRK290 /Ditta et al., 1980/. Включения транспозонов Тп31ас Z подчеркнуты в отличие от включений транспозонов Тп5. Идентифицированные открытые фазы последовательности /от cobF до cobM/ проводятся на этой фигуре, а также приводятся восемь групп инактивационных включений /пронумерованные от 1 до 8; знаки "+" и "-" изображаются под каждым включением транспозона, чтобы указать, что включение является инактивационным (-) или нет (+) для комплементации различных мутантов/. Имеет место отсутствие комплементации, когда рекомбинированный мутант синтезирует менее чем в три раза меньше витамина B12 по сравнению с уровнем синтеза для штамма, из которого выведен этот мутант. Эти группы инактивационных включений соответствуют следующим мутантам: 1 - G 615; 2 - G 614 и G 616; 3 - G 613 и G 614; 4 - G 620; 5 - G 638; 6 - G 610 и G 609; 7 - G 612; 8 - G 611. Эти мутанты являются мутантами Cob Agrobacterium tumefaciens, которые уже описаны /Cameron et al., 1989/. Карта рестрикции фрагмента величиной 8,7 ко приводится в нижней части этой фигуры .
Фигура 15:
Кодирующие последовательности каждого из генов фрагмента величиной 5,4 ко, соответственно от cobA до cobE, приводятся здесь. Последовательность протеинов от COBA до COBE, кодированных этими последовательностями, фигурирует под их соответствующей кодирующей последовательностью от cobA до cobE. Приводится аминокислотный состав по их числу и по их доле для каждого протеина от COBA до COBE соответственно, а также молекулярный вес, индекс полярности, изоэлектрическая точка, оптическая плотность при 260 нм и при 280 нм раствора с концентрацией 1 мг/мл очищенного продукта. Изображен профиль гидрофильности каждого протеина от COBA до COBE соответственно; он был рассчитан по программе Hoppe et Woods /1981/. Положительные значения соответствуют участкам протеина, которые являются гидрофильными. На абсциссе указано положение аминокислот, тогда как на ординате фигурирует значение коэффициента гидрофильности; когда это значение является, положительным, то это указывает на то, что участок протеина является гидрофильным.
Фигура 16:
Указаны кодирующие последовательности каждого из генов фрагмента величиной 8,7 ко от cobF до cobM соответственно. Последовательности протеинов от COBF до COBM, кодированных этими последовательностями, фигурируют под их последовательностью. Описание фигуры идентично описанию фиг 15. NB: Мы начали протеин COBF с ATG в положении 736; однако возможно, что ATG, находящийся в положении 751, является истинным инициирующим кодоном этого протеина.
Фигура 17:
Реакция, катализируемая a,c-диамидом кобириновой кислоты-синтазой. ДАККС катализирует амидирование функций карбоновых кислот периферических ацетатных звеньев a и c кобириновой кислоты /гидробириновой кислоты/ с образованием диамида кобириновой кислоты /диамида гидробириновой кислоты/; донором аминогруппировки, который используется в ферментативном испытании, является L-глутамин; он образует в результате дезаминирования L-глутаминовую кислоту. X соответствует аксиальным лигандам кобальта, которые могут отличаться один от другого.
Фигура 18:
Реакция, катализируемая посредством SП2МТ. SП2МТ катализирует перенос метила от SAM к дигидрозирогидрохлорину или прекоррину-2 с образованием прекоррина-3. Метильная группировка переносится в положение C20 порфиринового кольца.
Фигура 19:
Структура гидробириновой кислоты и a,c-диамида гидробириновой кислоты.
Фигура 20:
Сродство протеинов COBA и COBF к SAM. Кривые приводятся в произвольных единицах радиоактивности на выходе из колонки с TSK-125 для каждого протеина, применяемого в этой колонке. Времена удерживания указаны в минутах, а пик радиоактивности, соответствующий свободному SAM, наблюдается за время 10 мин 30 с.
Фигура 21:
Сравнение последовательностей COBA и COBI. Представлены только участки 1, 2 и 3 с сильной гомологией. Знаки "=" располагаются между идентичными остатками, а "-" между гомологичными остатками /HKR, LIVM, AGST, YFW, DEQNBZ, PC/.
Фигура 22:
Сравнение первичных последовательностей протеинов COBA микроорганизма Pseudomonas dinitrificans и CYSG микроорганизма E. coli. Выстраивание было проведено по программе kanehisa, 1984. Знаки "=" помещаются между идентичными остатками, а "-" между гомологичными остатками /HKR, LIVM, AGST, YFW, DEQNBZ, PC/. Участки 1, 2, 3 соответствуют области с сильной гомологией между протеинами.
Фигура 23:
Сравнение последовательностей CYSG микроорганизма E. coli с протеинами COB микроорганизма Pseudomonas dinitrificans /COBA, COBF, COBI, COBG, COBL и COBM/. Сравнения относятся к участкам 1, 2 и 3 с большими гомологиями, которые существуют между CYSG, COBA и COBI. Положения на протеиновых последовательностях участков, обладающих гомологиями, представлены на фигуре. Мы рассмотрели следующие группы гомологичных остатков: HKR, LIVM, AGST, YFW, DEQNBZ, PC. Если в одном и том же положении находятся, по меньшей мере, 3 гомологичных остатка, то мы заключали эти аминокислоты в рамку.
Фигура 24:
Конструирование плазмид pXL1148 и pXL1149. Плазмида pXL1148 создается следующим образом: фрагмент BamHI - BamHI - SstI - SstI величиной 1,9 ко от фрагмента величиной 8,7 ко, содержащий гены cobH и cobI, очищается, а "связки" XbaI и EcoRI помещаются соответственно на концах BamHI и SstI. Затем этот фрагмент включается между сайтами XbaI и EcoRI плазмиды с широким спектром хозяев pXL59 /Cameron et al. , 1989/ с образованием плазмиды pXL1148. Плазмида pXL1149 создается как плазмида pXL1148, если только первоначально очищаемый фрагмент является фрагментом BamHI-BamHI-SstI величиной 1,5 ко вместо фрагмента, содержащего дополнительно небольшой фрагмент SstI величиной 400 по, используемый для pXL1148. Затем фрагмент подвергается тем же самым ферментативным операциям и тому же самому клонированию в pX 59.
1 - фрагмент PstI-SstI от PSG1010 /De Graff et al., 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; 3 - фрагмент BamHI-SstI, содержащий оперон лактозы микроорганизма E.coli без промотора, оператора, сайта начала трансляции и 8 первых несущественных кодонов Iac Z/Casadaban et al. , 1983/; 4 - фрагмент Sаи3AI микроорганизма Pseudomonas putida KT2440 /Bagdacarian et al., 1981/; ori - репликативного происхождения; nic - сайт релаксации; Kmг - ген устойчивости к канамицину; mob - локус, существенный для мобилизации /Bagdasarian et al., 1981/; B - BamHI; C - ClaI; E - EcoRI; H - HindIII; P - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI.
Фигура 25:
Все протеины штаммов SC510 RifR, SC510 RifR pKT230, SC510 RifR pXL1148, SC510 RifR pXL1149, проанализированные PAGE-SDS с концентрацией 10%, как это описывается. Бактерии культивировались в течение 4 дней в среде PS4, затем были приготовлены лизаты всех протеинов. След 1 - SC510 RifR; след 2 - SC510 RifR pXL1149; след 3 - SC510 RifR pXL1148; след 4 - SC510 RifR pKT230. Указаны молекулярные массы маркеров молекулярных масс. Указаны положения, куда мигрируют COBI и COBH.
Фигура 26:
Конструирование плазмид pXL1496 и pXL1546. Плазмида pXL1496 обеспечивает сверхэкспрессию протеина COBF у микроорганизма E.coli, а плазмида pXL1546 обеспечивает сверхэкспрессию COBF у микроорганизма Pseudomonas denitificans. Фрагмент EcoRI-XhoI величиной 2,2 ко отщепляется и очищается, исходя из фрагмента величиной 8,7 ко. Он клонируется на сайте EcoRI фага M13mp19 с образованием плазмиды pXL1405. Затем сайт NdeI вводится путем направленного мутагенеза, как это описано выше, в положение 733 этого фрагмента; тем самым сайт NdeI находится прямо на предполагаемом начинающем кодоне гена cobF. Полученная таким образом новая плазмида называется pXL1406. Фрагмент NdeI-SphI-SphI величиной 1,5 ко, содержащий ген cobF, исходя из своего предполагаемого начинающего кодона, очищается после частичного переваривания соответствующими ферментами и связывается с соответствующими фрагментами плазмиды pXL694 /фрагмент EcoRI-NdeI величиной 120 по, содержащий сигналы экспрессии микроорганизма E. coli (смотри текст) и фрагмент EcoRI-SphI величиной 3,1 ко, содержащий ген устойчивости к ампицилину, репликативные функции плазмиды, а также терминаторы оперона rrnВ микроорганизма E.coli, как это описано в тексте/. Построенная таким образом плазмида называется pXL1496. Плазмида pXL1546 создается следующим образом: фрагмент EcoRI-BamHI-BamHI величиной 2 ко плазмиды pXL1496 очищается в результате частичного переваривания соответствующими ферментами; этот фрагмент содержит сигналы экспрессии микроорганизма E. coli, за которыми следует ген cobF, затем часть 5' гена cobG, за которой следуют терминаторы оперона rrnВ микроорганизма E.coli, как это описано в тексте; этот фрагмент клонируется в плазмиде-мультихозяине pKT230 /Bagdasarian et al., 1981/, описанной на фиг. 30.
B - BamHI; C - ClaI; E - EcoRI; H - HindIII; P = PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI; Kmг - генустойчивости к канамицину; Amp - ген устойчивости к ампицилину.
Фигура 27:
Все протеины штаммов SC510 RifR, SC510 RifR pKT230, SC510 RifR pXL1546, проанализированные на PAGE - SDS с концентрацией 10%, как это описано. Бактерии культивировались в течение 4 дней в среде PS4, затем были приготовлены лизаты всех протеинов. След 1 - SC510 RifR; след 2 - SC510 RifR pKT230; след 3 - SC510 RifR pXL1546. Указаны молекулярные массы маркеров молекулярной массы. Указано положение, куда мигрирует протеин COBF.
Фигура 28:
Все протеины штаммов E.coli B и E.coli B pXL1496, проанализированные на PAGE-SDS с концентрацией 10%, как это описывается. След 1 - E.coli pXL1496, культивированный в отсутствие триптофана; след 2 - E.coli pXL1496, культивированный в тех же самых условиях в присутствии триптофана; след 3 - E. coli, культивированный в отсутствие триптофана; след 4 - E.coli, культивированный в тех же самых условиях в присутствии триптофана. Указаны молекулярные массы маркеров. Указано положение миграции протеина COBF.
Фигура 29:
Конструирование плазмид pXL525 и pXL368. Плазмида pXL368 создается следующим образом: фрагмент EcoRI-ClaI величиной 2,4 ко /содержащий гены cobA и cobE/ очищается, исходят из плазмиды pXL556 /Caneron et al., 1989/, что позволяет получить этот фрагмент с сайтом BamHI и с сайтом XbaI на концах; этот фрагмент клонируется в pXL203 на сайтах BamHI и XbaI. Для построения плазмиды pXL525 добавляется "связка" XbaI к сайту EcoRI, расположенному на правом конце фрагмент EcoRI величиной 8,7 ко; этот фрагмент EcoRI-XbaI величиной 8,7 ко затем клонируется совместно с фрагментом EcoRI-XbaI величиной 2,4 ко, происходящим из pXL556 и содержащим cobA и cobE. Сайты рестрикции, которые изображены в скобках, соответствуют сайтам, которые исчезли после обработки большим фрагментом ДНК-полимеразы 1 микроорганизма E.coli.
1 - фрагмент PstI-SstI от RSFT1010 /De Graffe et al, 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; ori - репликативного происхождения; nic - сайт релаксации; mob - локус, существенный для мобилизации; Kmг - ген устойчивости к канамицину /Bagdasarian et al., 1981/; B - BamHI; C - ClaI; E - EcoRI; H - HindIII; P - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI; tet - ген устойчивости к тетрациклину; Ampr и Amp - ген устойчивости к ампицилину.
Фигура 30:
Плазмиды из группы несовместимости Q с широким спектром хозяев у грам-отрицательных бактерий. Эти плазмиды описаны в предыдущей публикации /Cameron et al, 1989/ и используются в настоящем изобретении.
1 - фрагмент PstI-SstI от RSF1010 /De Graff et al., 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; 3 - фрагмент BamHI-SstI, содержащий оперон лактозы микроорганизма E.coli, без промотора, оператора, сайта, начинающего трансляцию, и 8 первых несущественных кодонов Iac Z /Casadaban et al., 1983/; 4 - фрагмент Sau3AI микроорганизма Pseudomonas putide KT2440 /Bagdasarian et al., 1981/; ori - репликативного происхождения; nic - сайт релаксации; Kmг - ген устойчивости к канамицину; Smг - ген устойчивости к стрептомицину; mob - локус, существенный для мобилизации /Bagdasarian et al., 1981/; B - BamHI; C - ClaI; E - EcoRI; H - HindIII; P - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI.
Фигура 31:
Времена удерживания различных эталонных корриноидов (1 мг/эталон) на системе разделения, описанной в примере 9. Используемая колонка является колонкой с Нуклеозилом C-18 /Machery-Nagel/. Приведенный на уровне каждого пика поглощения номер соответствует корриноиду, описанному ниже. Время удерживания отложено по абсциссе, а поглощение при 371 нм дается на ординате.
1 - кобириновая кислота; 2 - a-амид кобириновой кислоты; 3 - g-амид кобириновой кислоты; 4-а, g-диамид кобириновой кислоты; 5 - c-амид кобириновой кислоты; 6 - c, g-диамид кобириновой кислоты; 7 - a,c-диамид кобириновой кислоты; 8 - триамид кобириновой кислоты; 9 - тетраамид кобириновой кислоты; 10 - пентаамид кобириновой кислоты; 11 - кобириновая кислота; 12 - ГДФ-кобинамид; 13 - кобинамидфосфат; 14 - кобинамид; 15 - цианокобаламин-5'-фосфат; 16 - цианокобаламин.
Фигура 32:
Нуклеотидная последовательность двух цепей фрагмента SalI-SalI-SalI-SalI-SalI-BglI величиной 4748 по микроорганизма Pseudomonas denitrificfans. Расположенную сверху цепь следует читать от 5' к 3' в направлении слева направо, которое соответствует ориентации слева направо фрагмента на карте рестрикции, приведенной на фиг. 6.
Фигура 33:
Нуклеотидная последовательность двух цепей фрагмента SstI-SstI-BamHI величиной 3855 микроорганизма Pseudomonas denitrificfans. Расположенную сверху цепь следует читать от 5' к 3' в направлении слева направо, которое соответствует ориентации слева направо фрагмента на карте рестрикции, приведенной на фиг. 6.
Фигура 34:
Анализ вероятностей фаз, кодирующих согласно применению кодонов, используя для 6 фаз программу Staden de MacLachlan /1982/ чтения фрагмента SalI-SalI-SalI-SalI Sall-BglI величиной 4748 по. В случае фаз, которые принадлежат одной и той же кодирующей цепи, наиболее вероятная фаза соответствует той, для которой пунктирная линия, не прерываемая стоп-кодонами, находится ниже линии вероятности этой фазы.
4a. Анализ последовательности, соответствующей нуклеотидам от 200 до 800. Этот анализ позволяет идентифицировать открытую фазу 14. Она начинается с ATG в положении 660 и заканчивается на TGA в положении 379.
4b. Анализ последовательности, соответствующей нуклеотидам от 800 до 1500. Этот анализ позволяет идентифицировать открытую фазу 15. Она начинается с GTG в положении 925 и заканчивается на TAA в положении 1440.
4c. Анализ последовательности, соответствующей нуклеотидам от 1450 до 2600. Этот анализ позволяет идентифицировать открытую фазу 16. Она начинается с ATG в положении 1512 и заканчивается на TGA в положении 2510.
4d. Анализ последовательности, соответствующей нуклеотидам от 2500 до 4650. Этот анализ позволяет идентифицировать открытую фазу 17. Она начинается с GTG в положении 2616 и заканчивается на TGA в положении 4511.
Фигура 35:
Анализ вероятностей фаз, кодирующих согласно применению кодонов, используя для 6 фаз программу Staden de MacLachlan /1982/ чтения фрагмента SstI-SstI-BamHI величиной 3855 по. В случае фаз, которые принадлежат одной и той же кодирующей цепи, наиболее вероятная фаза соответствует той, для которой пунктирная линия, не прерываемая стоп-кодонами, находится ниже линии вероятности этой фазы.
5a. Анализ последовательности, соответствующей нуклеотидам от 1 до 905. Этот анализ позволяет идентифицировать открытую фазу 18. Она начинается в ATG в положении 809 и заканчивается на TGA в положении 108.
5b. Анализ последовательности, соответствующей нуклеотидам от 955 до 2105. Этот анализ позволяет идентифицировать открытую фазу 19. Она начинается с ATG в положении 1971 и заканчивается на TGA в положении 1063.
5c. Анализ последовательности, соответствующей нуклеотидам с 2000 до 3300. Этот анализ позволяет идентифицировать открытую фазу 20. Она начинается с ATG в положении 2099 и заканчивается на TAG в положении 3115.
5d. Анализ последовательности, соответствующей нуклеотидам от 3250 до 3855. Этот анализ позволяет идентифицировать открытую фазу 21. Она начинается с ATG в положении 3344 и заканчивается на TGA в положении 3757.
Фигура 36:
Конструирование плазмид pXL233, pXL843 и pXL1558, исходя из pXL154. Плазмиды создаются следующим образом. Фрагмент EcoRI величиной 3,5 ко, содержащий урезанный ген cob S и указанную наверху последовательность, отщепляется от плазмиды pXL154, затем очищается и клонируется в сайте EcoRI плазмиды pKT230. Образованная таким образом плазмида называется pXL233. Фрагмент EcoRI-XhoI-XhoI величиной 3,5 ко, содержащий ген cobT и указанную внизу последовательность, отщепляется и очищается, исходя из pXL154,в результате частичного переваривания. Фрагмент EcoRI-EcoRI-EcoRI величиной 4,3 ко, содержащий ген cobS и указанную наверху последовательность, отщепляется и очищается, исходя из pXL154, затем связывается с предыдущим фрагментом величиной 3,5 ко. Полученный таким образом фрагмент EcoRI-XhoI величиной примерно 8 ко клонируется в сайтах EcoRI и SalI плазмиды pXL59 с образованием плазмиды pXL843. Плазмида pXL1558 образуется следующим образом: фрагмент HindIII-HindIII величиной 12 ко отщепляется от pXL154 и очищается, затем концы заполняются большим фрагментом ДНК-полимеразы 1 микроорганизма E.coli. Эта вставка клонируется в pRK290 /Ditta et al., 1981/, переваривается посредством EcoRI, затем обрабатывается большим фрагментом ДНК-полимеразы 1 микроорганизма E. coli, чтобы освободить концы. Сайты рестрикции, которые фигурируют в скобках, соответствуют сайтам, которые исчезли в ходе клонирования.
1 - фрагмент PstI-SstI от RSF1010 /De Graff et al., 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; B - BamHI; C - ClaI; E - EcoRI; H - HindIII; P - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI; Tet - ген устойчивости к тетрациклину; Kmг - ген устойчивости к канамицину; Smг - ген устойчивости к стрептомицину.
Фигура 37:
Изучение включений транспозона Тп5Sp на вставке HindIII-HindIII величиной 12 ко плазмиды pXL154.Включения транспозона картографируются на вставке HindIII-HindIII величиной 12 ко, клонированной на pXL1558. Хромосомные включения в штамме SC510 RifR взяты в рамку, другие вводятся в штамм SBL27 RifR. Знак "плюс" или "минус" изображается под каждым включением, чтобы указать фенотип Cob штамма, который имеет это включение. Отсутствие комплементации /или комплементация/ штамма G2035 плазмидами pXL1558::Тп5Sp указывается знаками "минус" /или "плюс"/ под каждым включением. Вставки плазмид, описанных на фиг. 36, представлены здесь. Знаки "плюс" /или "минус"/ для этих плазмид, соответствующие включениям транспозона, схематично указывают комплементацию /или ее отсутствие/ мутированного штамма с транспозоном посредством плазмиды. Идентифицированные открытые фазы последовательности также приводятся на этом фиг. /ORF 14-17/, также как и соответствующие гены cob /cobS и cobT/.
E - EcoRI; H - HindIII; X - XhoI.
Фигура 38:
Конструирование плазмид pXL1286, pXL1324, pXL1303, pXL1490B и pXL1557, исходя из pXL519. Положение составляемого фрагмента последовательности приводится в верхней части фигуры над картой рестрикции кластера; речь идет о фрагменте SstI-SstI-BamHI величиной 3,9 ко. Плазмиды создаются следующим образом. Фрагмент BglII-EcoRI величиной 2 ко, содержащий ген cobU и указанную внизу последовательность, отщепляется от плазмиды pXL519, затем очищается и клонируется на сайтах BamHI и EcoRI плазмиды pKT230 с образованием плазмиды pXL1286. Фрагмент SstI-EcoRI величиной 2,7 ко, содержащий урезанный ген cobV, ген cobU и указанную внизу последовательность, отщепляется от pXL519, затем очищается и клонируется на сайтах SstI и EcoRI плазмиды pKT230 с образованием плазмиды pXL1324. Фрагмент SstI-SstI величиной 1,6 ко, содержащий урезанный ген cobV и указанную наверху последовательность, отщепляется от pXL519, затем очищается и клонируется на сайте SstI плазмиды pKT230 с образованием плазмиды pXL1303. Фрагмент SstI-SstI-BamHI величиной 3,85 ко очищается после полного переваривания плазмиды pXL519 посредством BamHI и частичного переваривания посредством SstI. Этот фрагмент затем клонируется на сайтах BamHI и SstI плазмиды pKT230 с образованием pXL1490B. Плазмида pXL1557 создается следующим образом: фрагмент HindIII-BamHI величиной 9 ко отщепляется от pXL519 и очищается, потом концы заполнятся большим фрагментом ДНК-полимеразы 1 микроорганизма E.coli. Эта вставка клонируется в pRK290 /Ditta et al., 1981/, переваренной посредством EcoRI, затем обрабатывается большим фрагментом ДНК-полимеразы 1 микроорганизма E.coli, чтобы освободить концы. Сайты рестрикции, которые фигурируют в скобках, соответствуют сайтам, которые исчезли в ходе клонирования.
1 - фрагмент PstI-SstI от RSF1010 /De Graff et al., 1978/; 2 - фрагмент PstI-BamHI от pACYC177 /Bagdasarian et al., 1981/; B - BamHI; E - EcoRI; Bg - BglII; C - ClaI; H - HindIII; p - PstI; S - SstI; Sa - SalI; X - XhoI; Xb - XbaI; Tetг - ген устойчивости к тетрациклину; Kmг - ген устойчивости к канамицину; Smг - ген устойчивости к стрептомицину.
Фигура 39:
Изучение включений транспозона Тп5Sp на вставке HindIII-BamHI величиной 9 ко плазмиды pXL519. Включения транспозона картографируются на вставке HinaIII-BamHI величиной 9 ко, клонированной на плазмиде pXL1557. Хромосомные включения в штамме SC510 RifR взяты в рамку, другие вводятся в штамм SBL27 RifR. Знак "плюс" или "минус" изображается под каждым включением, чтобы указать фенотип Cob штамма, который имеет это включение. Отсутствие комплементации /или комплементация/ штамма G2040 плазмидами pXL1557::Тп5Sp указывается знаками "минус" /или "плюс"/ под каждым включением. Вставки плазмид, описанных на фиг. 6, представлены здесь. Знаки "плюс" /или "минус"/ для этих плазмид, соответствующие включениям транспозона, схематично указывают комплементацию /или ее отсутствие/ мутированного штамма с транспозоном посредством плазмиды. Идентифицированные открытые фазы последовательности также приводятся на этом фиг. /ORF 18-21/,также как и соответствующие гены cob /cobU и cobV/.
Фигура 40:
Кодирующие последовательности каждого из генов фрагмента величиной 4,8 ко, соответственно cobX, cobS и cobT, приводятся здесь. Последовательность протеинов COBX, COBS и COBT, кодируемых этими последовательностями, фигурирует под соответствующими кодирующими последовательностями cobX, cobS и cobT. Описание этой фигуры идентично описанию фигуры 15.
Фигура 41:
Кодирующие последовательности каждого из генов фрагмента величиной 3,9 ко, соответственно cob U и cob V, приводятся здесь. Последовательность протеинов COBU и COBV, кодированных этими последовательностями, фигурирует под соответствующими кодирующими последовательностями cobU и cobV. Описание этого фигуры идентично описанию фигуры 15.
Фигура 42:
A. Все протеины штаммов E. coli BL21 pLysS pET3b, E coli BL21 pLysS pXL1937, проанализированные на PAGE-SDS с концентрацией 10%. След 1 - BL21 pLyspET3b; след 2 - E.coli BL21 pLysS pXL1937.
B. Все протеины штаммов: E.coli BL21, E.coli BL21 pXL1874 и E.coli BL21 pXL1875, проанализированные на PAGE-SDS с концентрацией 10%. След 1 - E.coli BL21; след 2 - E.coli BL21 pXL1874; след 3 - E.coli BL21 pXL1875.
Указаны молекулярные массы маркеров. Полоса, соответствующая чрезвычайно выраженному протеину, указана стрелкой.
Фигура 43:
Нуклеотидная последовательность двух цепей фрагмента SstI-SstI-SstI-SstI-BglII-BglII величиной 13144 микроорганизма Pseudomonas denitrificfans. Расположенную сверху цепь следует читать от 5' к 3' в направлении слева направо, которое соответствует ориентации слева направо фрагмента на карте рестрикции, представленной на фиг. 4.
Фигура 44:
Карта рестрикции фрагмента SstI-SstI-SstI-SstI-BglII-SstI-BglII величиной 13144 по микроорганизма Pseudomonas denitrificfans. Одно или несколько положений обычных сайтов рестрикции указываются в порядке возрастания числа разрывов на фрагменте последовательности; положения соответствуют последовательности, приведенной на фиг. 43.
Фигура 45:
Анализ вероятностей фаз, кодирующих согласно применению кодонов, используя для шести фаз программу Stadeu et Maclachlan /1982/ чтения фрагмента SstI-SstI-SstI-SstI-BglII SstI-BglII величиной 13144 по микроорганизма Pseudomonas denitrificfans. В случае фаз, которые принадлежат одной и той же кодирующей цепи, наиболее вероятная фаза соответствует той, для которой пунктирная линия, не прерываемая стоп-кодонами, находится ниже линии вероятности этой фазы.
1. Последовательность, соответствующая нуклеотидам от 1 до 2266. Этот анализ позволяет идентифицировать открытую фазу 22. Она начинается с ATG в положении 429 и заканчивается на TAG в положении 1884.
2. Последовательность, соответствующая нуклеотидам от 2266 до 4000. Этот анализ позволяет идентифицировать открытую фазу 23. Она начинается с ATG в положении 3364 и заканчивается на TGA в положении 3886.
3. Последовательность, соответствующая нуклеотидам от 3800 до 5000. Этот анализ позволяет идентифицировать открытую фазу 24. Она начинается с ATG в положении 3892 и заканчивается на TAG в положении 4954.
4. Последовательность, соответствующая нуклеотидам от 5000 до 9000. Этот анализ позволяет идентифицировать открытую фазу 25. Она начинается с ATG в положении 5060 и заканчивается на TAG в положении 8885.
5. Последовательность, соответствующая нуклеотидам от 9000 до 9700. Этот анализ позволяет идентифицировать открытую фазу 26. Она начинается с ATG в положении 9034 и заканчивается на TGA в положении 9676.
6. Последовательность, соответствующая нуклеотидам от 9600 до 13144. Этот анализ позволяет идентифицировать открытые фазы 27, 28, 29 и 30. Они начинаются с ATG соответственно в положениях 9678, 10895, 11656 и 13059 и заканчиваются на стоп-кодонах в положениях 10101, 10303, 12181 и 12366. Открытые фазы 28 и 30 находятся на цепи, комплементарной для кодирующей цепи, соответствующей всем другим открытым фазам.
Фигура 46:
Фрагмент EcoRI-BglII-EcoRI-BglII величиной 13,4 ко, положения включений транспозонов Тп5Sp на фрагменте EcoRI величиной 9,1 ко, положения включений транспозонов Тп5 на вставке плазмиды pXL189, а также вставки различных плазмид, используемых в ходе экспериментов по комплементации штаммов SC510 Rifr::Тп5Sp. Комплементации мутантов SC510 Rifr::Тп5Sp плазмидами обозначаются: /+/ - между 5% и 100% от уровня родительского штамма SC510 Rifr-; /•/ - частичная комплементация между 0,5 и 5% от уровня штамма SC150 Rifr- или /-/ - отсутствие комплементации, т.е. менее чем в тысячу раз меньше по сравнению с SC510 Rifr-, причем эти знаки располагаются непосредственно над отрезками, схематично обозначающими вставку плазмид, и находятся на одной линии с сайтами включений соответствующих мутантов. Под картографией включений транспозонов Тп5 на вставке плазмиды pXL189 изображается комплементация /+/ или отсутствие комплементации /-/ этих мутантных плазмид для мутантов микроорганизмов Agrobacterium tumefacieus G632 и G633. В правой части фигуры находится таблица, представляющая комплементацию мутантов G 622, G623 и G630 /Cameron et al., 1989/ различными плазмидами; /+/ - полная комплементация, т. е. 100% от уровня родительского штамма C58C9 Rifr-; /•/ - частичная комплементация, т. е. между 10 и 50% от уровня C58C9 Rifr- или /-/ - отсутствие комплементации.
Различные плазмиды, вставка которых изображена, создаются следующим образом /фрагменты отщепляются либо от pXL156, либо от pXL157/:
- pXL618 соответствует фрагменту EcoRI-BamHI величиной 2,5 ко, клонированному на тех же самых сайтах плазмиды pKT230 /Bagdasarian et al., 1981/;
pXL593 соответствует фрагменту BamHI величиной 3,1 ко, клонированному на сайте BamHI плазмиды pKT230 /Bagdasarian et al., 1981/;
pXL623 соответствует фрагменту BamHI-XhoI величиной 1,9 ко, клонированному на сайтах BamHI-SalI плазмиды pXL59 /Cameron et al., 1989/;
pXL1909 соответствует фрагменту BamHI-BamHI-BamHI величиной 8,4 ко, клонированному на сайте BamHI плазмиды pKT230 /Bagdasarian et al., 1981/;
pXL221 соответствует фрагменту EcoRI-ClaI величиной 1,6 ко, клонированному на тех же самых сайтах плазмиды pXL59 /сайт ClaI, в котором клонируется этот фрагмент, является сайтом ClaI мультисайта плазмиды pXL59 (Cameron et al., 1989);
- плазмиды pXL1908 и 1938 соответствуют одной и той же вставке, т.е. фрагменту XhoI-BamHI-BamHI величиной 6,5 ко, к которому были прибавлены связки XbaI; эта вставка клонируется в двух направлениях на сайте XbaI плазмиды pXL435 /Cameron et al. , 1989/; стрелка, расположенная на фиг., указывает положение гена устойчивости к канамицину относительно концов вставки для двух плазмид;
pXL208 соответствует фрагменту BamHI величиной 5,2 ко, клонированному на сайте BamHI плазмиды pKT 230 /Bagdasarian et al., 1981/;
- pXL297 соответствует фрагменту EcoRI величиной 9,1 ко, клонированному на сайте EcoRI плазмиды pKT230 /Bagdasarian et al., 1981/.
Открытые фазы /PO/, определяемые последовательностями фрагмента /PO 22-30/, изображаются, также как и соответствующие гены cob; стрелка указывает полярность транскрипции.
E - EcoRI; B - BamHI; Bg - BglII; CI - ClaI; Sаи - Sаи3AI; X - XhoI.
Фигура 47:
Кодирующие последовательности каждого из генов фрагмента величиной 13,4 ко, соответственно cobQ, cobP, cobW, cobN и cobO, приводятся здесь. Последовательность протеинов COBQ, COBP, COBW, COBN и COBO, кодированных этими последовательностями, фигурирует под их соответствующей кодирующей последовательностью cobO, cobP, cobW, cobN и cobO. Описание этой фигуры идентично описанию фигуры 15.
Фигура 48:
A - NH2 - оканчивающаяся последовательность для SYMT микроорганизма M. ivanovii и последовательность олигонуклеотидов 923, 946, 947; "-" означает, что в этом положении остаток не могли определить; для антинаправленного олигонуклеотида аминокислоты, указанные над последовательностью, соответствуют имеющимся антикодонам.
B - изображение ферментативного увеличения внутреннего фрагмента в структурном гене SYMT микроорганизма M. ivanovii с олигонуклеотидами 946 и 947.
Фигура 49:
Конструирование рекомбинантной репликативной формы pG 10. Полученный в результате увеличения фрагмент величиной 616 по переваривается посредством HindIII и EcoRI, затем очищается, как описано. Потом этот фрагмент связывается с репликативной формой фага M13mp19, переваренной теми же самыми ферментами. Рекомбинантный клон находится, как это описано в тексте.
Фигура 50:
Ауторадиография пятна геномной ДНК микроорганизма M. ivanovii, переваренной различными ферментами, выделенной путем электрофореза на геле агарозы, затем перенесенной на мембрану из найлона, как это описано выше. Мембрана гибридизируется с зондом pG 10, как описано выше.
1 - HindlII-BgII; 2 - KpпI-BglII; 3 - EcoRI-BglII; 4 - BglII-PstI. Размеры различных фрагментов, которые гибридизируются с зондом, приводятся в ко.
Фигура 51:
Нуклеотидная последовательность двух цепей фрагмента величиной 955 по микроорганизма M.ivanovii. Расположенную сверху цепь следует читать от 5' к 3' в направлении слева направо.
Фигура 52:
Кодирующая последовательность гена corA микроорганизма M.ivanovii, полученная, исходя из последовательности величиной 955 по. Представлена также первичная последовательность протеина CORA. Аминокислоты изображаются над их кодоном, а стоп-кодон отмечен звездочкой. Основные физические свойства протеина CORA микроорганизма M.ivanovii, а именно: аминокислотный состав по их числу и по их доле, молекулярный вес, индекс полярности, изоэлектрическая точка, оптическая плотность при 280 нм раствора очищенного протеина с концентрацией 1 мг/л. Профиль гидрофильности протеина CORA микроорганизма M. ivanovii; этот профиль был получен по программе Hopp et Woods /1981/. Положительные значения соответствуют участкам протеина, которые являются гидрофильными. По оси абсцисс откладывается положение аминокислот, а по оси ординат - значение коэффициента гидрофильности; если это значение является положительным, то это указывает на то, что этот участок протеина является гидрофильным.
Фигура 53:
Сравнение первичных последовательностей протеинов COBA микроорганизма P. denitrificfans и CORA микроорганизма M. ivanovii. Протеины были выровнены благодаря программе kanehisa /1984/. "=" - идентичные аминокислоты; "-" - гомологичные аминокислоты согласно критериям, определенным выше /смотри фиг. 22 и 23/.
Фигура 54:
Конструирование плазмид pXL1832 и pXL1841. Надписи, сделанные на фиг., позволяют проследить за конструированием.
Общие методы клонирования, молекулярной биологии и биохимии
Классические методы молекулярной биологии, такие как центрифугирование плазмидной ДНК по градиенту хлорид цезия-бромид этилметаллического соединения, расщепление ферментами рестрикции, электрофорез на геле, электроэлюирование фрагментов ДНК из гелей агарозы, превращение в E.coli и т.д., описаны в литературе /Maniatis et al., 1982; Ausubel et al., 1987/.
Ферменты рестрикции были предоставлены из New-England Biolabs (Biolabs), Bethesda Research Laboratories (BRL) или Amercham Ltd (Amercham). Олигонуклеотидные "связки" были предоставлены из Biolabs. Для связывания фрагменты ДНК разделяются по их размеру на гелях агарозы с концентрацией 0,7% или акриламида с концентрацией 8%, очищаются путем электроэлюирования, экстрагируются фенолом, осаждаются в этаноле, потом инкубируются в буферном растворе Трис-HCl при значении pH 7,4 с концентрацией 50 мМ, MgCl2 - 10 мМ, ДТТ - 10 мМ, АТФ - 2 мМ, в присутствии ДНК-лигазы фага Т4 (Biolabs). Если это необходимо, то фрагменты ДНК, имеющие выступающие 5'-окончания, дефосфорилируются в результате обработки в щелочной фосфатазе из кишечника теленка /CIP, Фармация/ при температуре 37oC в течение 30 минут в следующем буферном растворе: глицин - 100 мМ, MgCl2 - 1 мМ, ZnCl2 - 1 мМ, при значении pH 10,5. Тот же самый метод используется для дефосфорилирования выступающих или свободных 3'-окончаний, но при обработке в течение 15 минут при температуре 37oC, затем в течение 15 минут при температуре 56oC. Фермент инактивируется в результате нагревания реакционной смеси при температуре 68oC в течение 15 минут в присутствии 1% ДСН и 100 мМ NaCl с последующими экстракцией в смеси фенол-хлороформ и осаждением в этаноле. Заполнение выступающих 5'-окончаний производится фрагментом Кленова ДНК-полимеразы 1 микроорганизма E.coli /Biolabs/. Реакция осуществляется при температуре окружающей среды в течение 30 минут в буферном растворе Трис-HCl при значении pH = 7,2 с концентрацией 50 мМ, ДНТФ - 0,4 мМ, MgSO4 - 10 мМ, ДТТ - 0,1 мМ, БАС - 50 мг/мл. Заполнение выступающих 3'-окончаний осуществляется в присутствии ДНК-полимеразы фага Т4 /Biolabs/ в соответствии с рекомендациями производителя. Переваривание выступающих окончаний осуществляется путем ограниченной обработки нуклеазой SI /BRL/ в соответствии с рекомендациями производителя. Олигонуклеотидные "связки" прибавляются к окончаниям фрагментов ДНК по уже описанной методике /Maniatis et al. , 1982/. Мутагенез in vitro под действием олигодеоксинуклеотидов осуществляется вв соответствии с методом, разработанным Taylor et al., 1985, используя оборудование, поставляемое Amersham. Связанные ДНК используются для превращения штамма, ставшего подходящим: E.coli MC1060 [ Δ (lac10PZYA) X74, gal U, gal K, strar, hsdR] для плазмид или E.coli TGI [ Δ (lac proA, B), supE, thi, hsdD5/F' tra D36, proA+, B+, lac I q, lac Z Δ H15] для репликативных форм фагов, производных бактериофага M13. Плазмидные ДНК очищаются по методу Birnboim et Doly, 1979. Минисинтезы плазмидной ДНК проводятся по методике kein et al, 1980. Синтезы хромосомных ДНК грам-отрицательных бактерий осуществляются по уже описанному способу /Cameron et al. , 1989/. Радиоактивные зонды приготавливаются путем трансляции разрывов по уже детализированному методу /Rigby et al., 1977/. Гибридизации между последовательностями ДНК, а также иммобилизация нуклеиновых кислот на мемьранах из нитроцеллюлозы осуществляются по описанному способу /Cameron et al., 1989/. В ходе клонирований, для которых имеется слабая вероятность найти искомый рекомбинантный клон, последние находятся после гибридизации на фильтре по уже описанному способу /Miniatis et al., 1982/. Нуклеотидная последовательность фрагментов ДНК реализуется по методу терминации цепей /Sanger et al, 1977/. В реакционной смеси ДГТФ заменяется на 7-деаза-ДГТФ, для того чтобы избежать сжатий полос в ходе электрофореза на геле акриламида, вызванных высокой долей G C в ДНК. Среды для культивирования, используемые в бактериологической части, уже были предложены /Mahiatis et al., 1982/. Культивирование в среде PS4 осуществляется по уже описанному способу /Cameron et al., 1989/; штаммы Pseudomonas denitrificfans SC150 Rsfг и G 2 RifR культивируются в среде PS4 следующим образом: в колбах Эрленмейера объемом 250 мл, содержащих 25 мл среды PS4 с, если это необходимо, антибиотиком, селективным для плазмиды, носимой каждым штаммом, высеивается с разбавлением 1/100 предкультура, насыщенная в среде L/Miller, 1972/, с, если есть необходимость, антибиотиком, селективным для плазмиды, носимой каждым штаммом; эти культуры инкубируются в течение 6 дней при температуре 30oC, затем сусла анализируются по содержанию в них кобаламинов или же по ферментов из этого процесса. Штаммы Agrobacterium tumefaciens, Pseudomonas putida и Rhizobium meliboti культивируются при температуре 30oC; без детализации они культивируются в среде L. Конъюгации бактерий осуществляются по уже описанному способу /Cameron et al., 1989/. Экстракты всех протеинов получаются по уже описанному способу /Ausubel et al., 1987/. Анализ методом электрофореза /SDS-PAGE/ протеинов на геле акриламида в денатурирующих условиях осуществляется по уже описанному способу /Augubel et al., 1987/. Применяется также устройство Phast System /Фармация/, использующее систему дискретных буферных растворов по Лаемли /Laemli, 1970/; используются различные гели в зависимости от молекулярных масс анализируемых протеинов, а также от их чистоты: фаст-гель с градиентом 8 - 25, гомогенный фаст-гель 12,5. Окрашивание осуществляется либо голубым Коомасси при помощи голубого фаст-гель R /Фармация/, либо нитратом серебра, используя комплект фаст-гель серебряный /Фармация/, в соответствии с инструкциями производителя. NH2-оканчивающиеся последовательности протеинов определяются по методу деградации Эдмана, используя автоматический составитель последовательностей /Applied Biosystems, модель 407A/ в паре с прибором ВЭЖХ для идентификации производных фенилтиогидантоинов.
Пример 1 - Выделение фрагментов ДНК из P.demitrificaus, содержащих гены Cob.
Этот пример описывает выделение фрагментов ДНК из Psendomouas denitrificfans, содержащих гены Cob Эти фрагменты были выявлены в результате экспериментов по комплементации мутантов Cob из A. tumefaciens и P.putida /Caumeron et al. 1989/.
Эти мутанты Cob были получены путем мутагенеза с N-метил-N'-нитро-N-нитрозогуанидином по методу Миллера /Miller et al, 1972/ или путем включений транспозона Тп5. Тем самым, были выявлены штаммы, не способные синтезировать кобаламины, и, в частности, мутант соb G 572 из P.putida и мутанты Cob G 159, G 161, G 164, G 169, G 171, G 258, G 609, G 610, G 611, G 612, G 613, G 614, G 615, G 616, G 620, G 622, G 623, G 630, G 632, G 633, G 634, G 638, G 642, G 643, G 2034, G 2035, G 2037, G 2038, G 2039, G 2040, G 2041, G 2042 и G 2043 из A.tunufacieus.
Параллельно реализуется банк геномной ДНК и P.denitrificfans в мобилизируемом векторе с широким спектром хозяев, pXL59, в результате переваривания в присутствии ферментов рестрикции 5 мкг ДНК /Cameron et al, 1989/.
Путем комплементации смогли выделить несколько плазмид, позволяющих комплементировать мутанты соb из P.putida и A.tumefacieus. Среди них отметим, в частности, плазмиды pXL151, pXL154, pXL156, pXL157 и pXL519.
Выделили эти плазмиды и смогли отщепить, очистить и проанализировать путем рестрикции фрагменты ДНК. Эти фрагменты представлены на фигурах 6 и 44: фрагмент ClaI-HindIII-HindIII- HindIII величиной 5, 4 ко, фрагмент EcoRI-EcoRI величиной 8, 7 ко, фрагмент SalI-SalI-SalI-BglI величиной 4, 8 ко, фрагмент SstI-SstI-BamHI величиной 3,9 ко и фрагмент EcoRI-BI II-EcoRI-Bgl II величиной 13,4 ко.
Пример 2 - Составление последовательностей выделенных фрагментов ДНК
Этот пример иллюстрирует составление последовательностей фрагментов ДНК, несущих гены соb микроорганизма Pseudomonas deuitrificans SC 510.
2.1. Составление последовательности фрагмента ClaI-HindIII-HindIII-HindIII величиной 5,4 ко
Этот фрагмент содержится в плазмиде pXL157, описанной в примере 1. После отщепления составные части фрагмента величиной 5,4 ко клонировались в фагах M13mp18 или M13mp19 /Norrander et al, 1983/ или M13tg130 или M13tg131 /Xieny et al, 1983/ в двух направлениях. Затем in vitro были осуществлены делеции по методу Menikoff /1987/. Потом эти делеции были преобразованы в последовательность при помощи "универсального праймера" в качестве инициатора синтеза для реакций терминации цепей. Перекрывание между этими различными делециями позволило составить полную последовательность /на двух цепях/ фрагмента величиной 5,4 ко /фиг. 7/. Этот фрагмент содержит 5378 по. На последовательности, описанной на фиг. 7, перед сайтом ClaI фигурируют три сайта рестрикции /PstI, SalI и XbaI/, которые появляются в ходе клонирования рассматриваемого фрагмента для формирования последовательности в мультисайтах клонирования. Когда впоследствии мы будем ссылаться в настоящем изобретении на последовательность этого фрагмента ClaI-Hind III-Hind III-Hind III, то будет иметься ввиду последовательность, представленная на фиг. 7, где 22 первых основания не соответствуют ДНК микроорганизма Pseudomonas denitrificfans/ таким образом, все положения сайта рестрикции или начала открытой фазы относятся к последовательности, представленной на фиг. 7/.
2.2. Нуклеотидная последовательность фрагмента EcoRI-EcoRI величиной 8,7 ко
Этот фрагмент находится в плазмиде pXL151, описанной в примере I. Сайт EcoRI, а также прилегающие 70 по, расположенные справа от этого фрагмента, происходят из плазмиды pXL59, которая является вектором, который служил для построения плазмиды pXL151 путем клонирования фрагмента Saи3AI микроорганизма Pseudomonas denitrificfans SC510. После отщепления составные части фрагмента величиной 8,7 ко клонировались в фагах M13mp18 или M13mp19 /Norrander et al, 1983/ или M13tg130 или M13tg131 в двух направлениях /Kieny et al, 1983/. Затем in vitro были осуществлены делеции по методу Hemkolf /1987/. Потом эти делеции были преобразованы в последовательность при помощи "универсального праймера" в качестве инициатора синтеза для реакции терминации цепей. Перекрывание между этими различными делециями позволило составить полную последовательность /на двух цепях/ фрагмента величиной 8,7 ко /фиг. 8/. Этот фрагмент содержит 8753 по.
2.3. Составление последовательности фрагмента
SalI-SalI-SalI-SalI-SalI-Bgl величиной 4,8 ко
Этот фрагмент содержится в плазмиде pXL154, описанной в примере I. Методика идентична той, которая используется в примере 2.2. Полная последовательность /на двух цепях/ фрагмента величиной 4,8 ко представлена на фиг. 32. Этот фрагмент содержит 4749 по.
2.4. Нуклеотидная последовательность фрагмента
SstI-SstI-BamHI величиной 3,9 ко
Этот фрагмент входит в плазмиду pXL519, описанную в примере I. Методика идентичная той, которая используется в примере 2.2. Полная последовательность /на двух цепях/ фрагмента величиной 3,9 ко представлена на фиг. 33. Этот фрагмент содержит 3855 по.
2.4. Нуклеотидная последовательность фрагмента
EcoRI-Bgl II-EcoRI-Bgl II величиной 13,4 ко
Этот фрагмент содержится в плазмидах pXL156 и pXL157,
описанных в примере I. Используемая методика идентична методике из примера 2.2. Последовательность на двух цепях фрагмента величиной 13,15 ко представлена на фиг. 43. Она соответствует полной последовательности фрагмента величиной 13,4 ко, не считая 250 по, соответствующих фрагменту EcoRI-SstI, находящемуся на левом конце рассматриваемого фрагмента.
Исходя из этих нуклеотидных последовательностей, были получены карты рестрикции для ферментов, которые расщепляют реже всего /фиг. 6 и 44/. Доля оснований GC в ДНК из Pseudomonas denitrificoms SC510 является относительно высокой /65,5%/ и проявляется в виде сжатий на гелях для последовательности. Чтобы избежать этих проблем, приводятся два решения:
- использование 7-деаза-ДГТФ вместо ДГТФ в реакциях для последовательности, чтобы уменьшить вторичные структуры, которые образуются в ходе электрофореза в геле для последовательности; и
- составление последовательности из двух цепей.
Пример 3 - Анализ нуклеотидных последовательностей: определение открытых фаз
Нуклеотидные последовательности фрагментов ClaI-Hind III-Hind III- Hind III величиной 5,4 ко /фиг. 7/, EcoRI-EcoRI величиной 8,7 ко /фиг. 8/, SalI-SalI-SalI-SalI-SalI-BglI величиной 4,8 ко /фиг. 32/, SstI-SstI-BamHI величиной 3,9 ко /фиг. 33/ и EcoRI-Bgl II-EcoRI-Bgl II величиной 13,4 ко /фиг. 43/ позволяют определить открытые фазы. Поскольку речь идет о ДНК с высоким содержанием GC, то открытые фазы являются многочисленными, принимая во внимание небольшую частоту кодонов, прекращающих трансляцию. Исследование вероятности фаз, кодирующих согласно применению кодонов, используя метод Stadeu et MacLachlan /1982/, осуществляется при этом. Оно характеризует открытые фазы, которые имеют наилучшую вероятность осуществлять кодирование по сравнению с другими фазами одной и той же цепи ДНК, причем эта вероятность является функцией применения кодонов для уже собранных последователей генов, происходящих из бактерий вида Pseudomonas. Таким образом:
3.1. Охарактеризованы пять открытых фаз для фрагмента ClaI-Hind III-Hind III-Hind III величиной 5,4 ко. Она называются фазами 1-5, а их положение на последовательности фрагмента величиной 5,4 ко является следующим /на последовательности 5' ---> 3' от сайта ClaI к сайтам Hind III/, приведены в табл. 1.
Изображение вероятностей того, что эти открытые фазы являются кодирующими фазами, параллельно с вероятностями, наблюдаемыми на других фазах /всего 5/, приводится на фиг. 9. Эти пять фаз кодируются одной и той же цепью. Четыре из них /открытые фазы 1-4/ имеют характеристики фаз, кодирующих путем трансляционного соединения /Normak et al, 1983/, а именно: когда кодон, инициирующий трансляцию фазы x + 1, сидит на кодоне терминации трансляции фазы x или же когда эти кодоны расположены очень близко.
3.2. Охарактеризованы восемь фаз для фрагмента EcoRI-EcoRI величиной 8,7 ко. Они называются фазами 6-13, а их положение по последовательности фрагмента величиной 8,7 ко приводится в таблице 2.
Изображение вероятностей этих открытых фаз параллельно с вероятностями, наблюдаемыми на других фазах /всего 6 фаз/ приводится на фиг. 10. За исключением фазы 11, эти фазы кодируются одной и той же цепью. Четыре из них /с 7 по 10/ имеют характеристики фаз, кодирующих путем трансляционного соединения /Normak et al, 1983/, а именно: когда кодон, инициирующий трансляцию фазы x + 1, сидит на кодоне терминации трансляции фазы x или же когда эти кодоны расположены очень близко.
3.3. Охарактеризованы четыре открытые фазы для фрагмента SalI- SalI-SalI-SalI-SalI-BglI величиной 4,8 ко. Они называются фазами 14-17, а их положение на последовательности фрагмента величиной 4,8 ко является следующим (на последовательности 5' ---> 3' от сайтов SalI к сайту BglI), табл. 3.
Изображение вероятностей того, что эти открытые фазы являются кодирующими фазами, параллельно с вероятностями, наблюдаемыми на других фазах /всего 4/, приводятся на фиг. 34. Фазы 15, 16 и 17 кодируются одной и той же цепью, а фаза 14 - комплементарной цепью.
3.4. Охарактеризованы четыре фазы для фрагмента SstI-SstI-BamHI величиной 3,9 ко. Она называются фазами 18-21, а их положение на последовательности фрагмента величиной 3,9 ко приводится в таблице 4, помещенной ниже.
Изображение вероятностей того, что эта открытые фазы являются кодирующими, параллельно с вероятностями, наблюдаемыми на других фазах /всего/, проводится на фиг. 35. Фазы 19 и 20 переписываются расходящимся способом.
3.5 Охарактеризованы девять открытых фаз для фрагмента EcoRI-Bgl II-EcoRI-Bgl II величиной 13,1 ко. Они называются фазами 22 - 30, а их положение на последовательности фрагмента величиной 13,1 ко является следующим /на последовательности 5' - 3' от сайта EcoRI к сайту Bgl II/, табл. 5.
Изображение вероятности того, что открытые фазы 22, 23, 24, 25 и 26 являются кодирующими, параллельно с вероятностями наблюдаемыми на других фазах /всего 5 фаз/, проводится на фиг. 45. Эти 5 фаз кодируются одной и той же цепью.
Пример 4 - Генетические исследования с фрагментами ДНК, несущими гены cob.
Этот пример показывает зависимость, которая существует между различными открытыми фазами, идентифицированными выше, и генами, задействованными в биосинтезе кобаламинов и/или кобамидов, которые находятся в этих же самых фрагментах. Эти гены идентифицируются в результате генетического исследования, как описано ниже.
4.1 Генетическое исследование фрагмента величиной 5,4 ко
Плазмида pXL723 представляет собой плазмиду pRK290 /Ditta et al. 1980/, содержащую фрагмент EcoRI-Hind III величиной 2264 по, соответствующий правой части изучаемого фрагмента, клонированного на сайте EcoRI плазмиды pRK290 /фиг. 11/. Конструирование других плазмид, используемых в этом исследовании /pXL302, pXL1397, pXL545, pXL545 Ω , pXL556 и pXL1500/, дается в описании фиг. 11 и 12.
Включения на плазмиде pXL723 были получены, используя метод de Bruijn et Lupski, 1984. Включения транспозона Тп5 на плазмиде pXL723 были селекционированы, потом картографированы на фрагмент величиной 5, 4 ко /фиг. 12/. Плазмида pXL723 дополняет мутант Cob G 572 микроорганизма Pseudomonas putida и мутант Cob G-634 микроорганизма Agrobacterium tumefaciens. Эти включения классифицируются на две группы инактивационных включений: либо те, которые не позволяют больше комплементировать мутант Cob G 572, либо те, которые прекращают комплементацию мутанта Cob G-634 /фиг. 12/. Включения, которые инактивируют комплементацию мутанта G 572, картографированы в открытой фазе 4 /речь идет о включениях 15, 27, 68, 81 и 97/; следовательно, открытая фаза 4 соответствует гену cob. Последний называется cobC. Включения, которые инактивируют комплементацию мутанта G 634, картографированы в фазе 5 /это включения 66 и 107 на фиг. 12/; следовательно, открытая фаза 5 соответствует гену cob. Последний называется cobD. С другой стороны, были реализованы включения с транспозоном Тп5Spr. Транспозон Тп5Spr был создан в лаборатории при клонировании на сайте BamHI транспозона Тп5 /Jorgensen et al, 1979/, причем кассета BamHI содержит ген устойчивости к спектиномицину, происходящий из плазмиды pHP45 Ω /Prentki et Krisch, 1984/. Эти включения были произведены в хромосоме штамма Pseudomonas denitrificans SBL27 RifR. Штамм SBL 27 является штаммом Pseudomonas denitrificans, из которого SC510 выводится в результате нескольких мутагенезов. Штамм SBL27 производит в 10 раз меньше кобаламинов, чем штамм SC510 на среде PS4. На 10 000 клонов штамма SBL27 RifR, каждый из которых несет одно включение транспозона, более 30 из них потеряли способность синтезировать кобаламины. Некоторые их этих клонов имели включение во фрагменте, исследуемом в этом примере. Эти включения были картографированы в результате рестрикционного анализа в соответствии с методом Саутерна /Southern, 1975/. Сайты включений транспозона для этих различий мутантов приведены на фиг. 12. Одно из этих включений под номером 2639 находится в гене cobC; это включение дополняется плазмидой pXL302, которая несет фрагмент, содержащий ген cobC /фиг. 12/. Два включения, обозначенные 2636 и 2638, находятся в открытой фазе 3. Эти мутанты блокируются в биосинтезе кобаламинов, и они дополняются плазмидой pXL1397, которая содержит только открытую фазу 3, но не дополняются плазмидой pXL302, которая содержит гены cobC и cobD /фиг. 12/. Эти два включения, следовательно, находятся в другом гене. С открытой фазой 3 мы ассоциируем ген cobB. Включение 2933 находится в открытой фазе 2; оно дополняется плазмидой pXL1500, которая содержит открытую фазу 2; это включение не дополняется плазмидой pXL1397, которая содержит ген cobB и которая дополняет два включения в cobB. Здесь, следовательно, речь идет о включении в другой ген; с открытой фазой 2 мы ассоциируем ген, называемый cobA.
Кассета устойчивости к канамицину, происходящая из плазмиды pUC4K /Barany et al. 1985/, вводилась в сайт Not I фрагмента ClaI (положение 0 на последовательности)-RsaI (положение 1686 на последовательности), клонированного в плазмиде pUC8 /Viere et Messing, 1982/; речь идет о сайте Not I, расположенном в положении 771 в фазе 1 /смотри последовательность на фиг. 7/; были удержаны два включения, каждое из которых соответствует различной ориентации кассеты устойчивости. Эти фрагменты, каждый из которых несет включение кассеты устойчивости, клонировались в плазмиде pR4KOK (Ditta et al) с образованием плазмид pXL1630 и 1631. Эти плазмиды путем конъюгативного переноса вводились в штамм Pseudomonas denitrificans SC510 RifR, потом в результате серии культивирований-разбавлений в отсутствие антибиотика, селективного для плазмиды /тетрациклина/, были обнаружены двойные рекомбинанты, обменявшие плазмидный фрагмент с хромосомным фрагментом и потерявшие плазмиду. В результате были охарактеризованы два штамма
- один называется SC510:1631 RifR ; в этом штамме находится кассета устойчивости к канамицину, включающая в хромосому на сайте Not I /находящемся в фазе 1/; полярности транскрипций гена устойчивости к канамицину и полярность открытой фазы I являются противоположными;
- другое включение называется SC510:1630 RifR; кассета устойчивости внедрена в тот же самый сайт, но транскрипция гена устойчивости имеет ту же самую полярность, что и полярность всей открытой фазы I.
Оба этих штамма имеют выход синтеза по кобаламинам по крайней мере в 100 раз меньше, чем выход для SC510.
Плазмида pXL545 Ω соответствует плазмиде pXL545, в которой кассета устойчивости к спектиномицину из плазмиды pHL45 Ω была внедрена на уровне сайта BamHI. Эта плазмида /фиг. 12/, которая содержит фрагмент ClaI-Hind III величиной 814 по /где только открытая фаза I является целой/ комплементирует только мутант SC510:1630 RifR. Это достаточно для определения нового гена, потому что этот мутант дополняется плазмидой, которая содержит исключительно целую открытую фазу I. Открытая фаза I соответствует гену из процесса биосинтеза кобаламинов и/или кобамидов. Этот ген называется cobE. Отсутствие комплементации мутанта SC510:1631 RifR плазмидой pXL545 Ω может быть обусловлено тем, что гены cobA, cobB, cobC, cobD и cobE или часть из них принадлежат к одному и тому же оперону и что включение в cobE, которое консервирует транскрипцию в направлении транскрипции оперона, может дополняться только путем экспрессий в trang гена cobE. Напротив, сам мутант SC510:1631 RifR может дополняться только плазмидой, которая разрешает экспрессию в trans генов от cobA до cobE.
Фрагмент ClaI-Hind III-Hind III-Hind величиной 5,4 ко содержит, следовательно, пять генов cob, называемых cobA, cobB, cobC, cobD и cobE.
4.2 - Генетические исследования фрагмента величиной 8,7 ко
Плазмида pXL367 представляет собой плазмиду pR4290 /Ditta et al, 1980/, содержащую фрагмент EcoRI величиной 8,7 ко, клонированный на сайте EcoRI /фиг. 13/.
Включения транспозона Тп5 на плазмиде pXL367 селекционировали, используя уже описанный метод /de Bruijn of Lupski, 1984/. Включения на фрагменте величиной 8,7 ко были картографированы. Аналогичным образом включения транспозона Тп31acZ были получены в соответствии с уже описанным методом /Stachel et al, 1985/ и картографированы. Таким образом были картографированы 29 включений транспозона Тп5 и 13 включений транспозона Тп31acZ. Точное положение этих включений на фрагменте величиной 8,7 ко производится на фиг. 14. Плазмиды, каждая из которых имеет только одно включение в фрагменте величиной 8,7 ко, вводились путем конъюгативных переносов в мутанты Cob Agrobacterium tumefaciens G 164, G 609, G 610, G 611, G 612, G 613, G 614, G 615, G 616, G 620, G 638. Все эти мутанты дополняются плазмидой pXL367. Были исследованы включения, которые больше не разрешают комплементацию различных мутантов. Они соответствуют включению в гене, ответственному за комплементацию соответствующего мутанта. Результаты комплементаций различных мутантов в зависимости от их характера производства кобаламинов /фенотип Cob/ приводятся на фиг. 14. Если рекомбинированный мутант вырабатывает менее чем в три раза меньше кобаламинов по сравнению с тем, что вырабатывает тот же самый мутант с плазмидой pXL367, то он рассматривается как некомплементированный. Среди исследованных мутантов G 164, G 609, G 610, G 611, G 612, G 613, G 614, G 615, G 616, G 620, G 638 наблюдают восемь различных классов инактивационных включений транспозонов, приводящих к мутированному фенотипу. Эти кассеты характеризуют включения по отсутствию комплементации одного или нескольких мутантов плазмидами pXL367, имеющими те же самые включения. Следовательно, каждый класс соответствует одному мутированному гену. Наблюдают, что включения, принадлежащие одному и тому же классу, располагаются рядом друг с другом. Таким образом, наблюдаются восемь классов включений, которые позволяют определить восемь генов. Каждый класс включений определяет один минимальный фрагмент, который должен содержаться в соответствующем гене. Фигура 14 показывает прекрасное соответствие между участками, ограниченными каждым классом, /на уровне карты рестрикции/ и открытыми фазами, описанными выше /пример 3/. Действительно, установлено что для каждого класса включений транспозоны всегда внедряются в ту часть фрагмента величиной 8,7 ко, которая содержится только в одной открытой фазе. Следовательно, с каждым классом включений ассоциируется одна открытая фаза, причем единственная. Таким образом, каждая из указанных выше открытых фаз кодирует протеин, задействованный в процессе биосинтеза кобаламинов и/или кобамидов. Каждая из открытых фаз соответствует генам, задействованным в биосинтезе кобаламинов и/или кобамидов. Эти открытые фазы называются cobF, cobG, cobH, cobI, cobJ, cobK, cobL и cobM для фаз 6 - 13 соответственно. Положение этих генов относительно карты рестрикции изображено на фиг. 14.
4.3 - Генетическое исследование фрагмента величиной 4,8 ко
Плазмида pXL1558 представляет собой плазмиду pR4290 /Ditta et al, 1980/, содержащую фрагмент Hind III-Hind III величиной 12 ко плазмиды pXL154 /Cameron et al, 1989/, клонированный на сайте EcoRI плазмиды pR4290 /фиг. 36/. Конструирование других плазмид используемых в этом исследовании /pXL233 и pXL843/, дается в описании фиг. 36.
Включение Тп5Sp были получены на плазмиде pXL1558. Сначала был создан штамм, содержащий транспозон Тп5Sp; это было осуществлено путем превращения штамма C2110 /Stachel et al. , 1985/, при помощи плазмиды pR42013Тп5Sp /Blanche et al., 1989/; плазмида pR420ITn5Sp, имеющая репликативное происхождение из ColEI, не репликацируется в штамме C2110, который является polA-. Полученные после трансформации колонии, который являются устойчивыми к спетиномицину, содержат, следовательно, транспозон Тп5Sp в своей хромосоме; затем колония повторно выделяется, потом включение транспозона трансдуцируется при помощи фага PI в штамм MC1060, как это описано ранее /Miller, 1972/. Штамм MC1060 трансформируется плазмидой pXL1558; затем плазмида pXL1558 мобилизируется в результате конъюгации при помощи плазмиды pR42013 в C600 RifR. Затем селекционируется конъюганты, устойчивые к тетрациклину /для плазмиды pXL1558/ и к спектиномицину /для транспозона/; такие конъюганты должны содержать плазмиду pXL1558, в которую включается транспозон Тп5Sp. Включения, имеющиеся в плазмиде pXL1558 и, в частности, во фрагменте величиной 12 ко, затем картографируются в результате рестрикционного переваривания; таким образом получается 23 включения и картографируются на фрагменте величиной 12 ко; положение этих различных включений на фрагменте представлено на фиг. 37. Эти 23 включения были введены в хромосому штамма SC510 RifR после конъюгативного переноса pXL1558: : Тп5Sp и введения плазмиды pR751. Плазмида pR751 представляет собой плазмиду, устойчивую к триметоприму, из той же самой группы несовместимости, что и pXL1558 /inc P, Thomas et Smith, 1987/. В результате культивирования, неселективного для pXL1558 /отсутствие тетрациклина/, но селективного для PR751 и транспозона /присутствие триметоприма и спектиномицина/, получаются обмен мутации, имеющейся в pXL1558 :: Тп5Sp, с хромосомой, а также сегрегация pXL1558 при помощи метода обмена маркера путем двойной гомологичной рекомбинации, как это уже описано /Schell et al. , 1988/. Селекционированные таким образом штаммы имеют транспозон в своей хромосоме. Двойная гомологичная рекомбинация подтверждается методом Саутерна /Southern, 1975/. Этим способом были идентифицированы 23 штамма SC510 RifR::Тп5Sp во фрагменте величиной 12 ко.
С другой стороны, другое включение Тп5Sp, полученное в результате случайного мутагенеза транспозона Тп5Sp в штамме SBL27 RifR /Blanche et al, 1989/, было картографировано на фрагменте величиной 12 ко путем рестрикционного анализа по методу Саутерна /Southerna, 1975/ (смотри фиг. 37); этот штамм называется SBL27 RifR::Тп5Sp 1480.
Выход синтеза кобаламинов определяется для этих 24 штаммов, культивируемых в среде PS4, по методике, описанной ранее /Cameron et al, 1989/, а фенотип Cob - приписывается штаммам, вырабатывающим по крайней мере в 1000 раз меньше /соответственно в 100/ витамина B12 по сравнению с родственным штаммом SC510 RifR /соответственно SBL27 RifR/, фиг. 37. Таким образом, наблюдается, что 6 из этих хромосомных включений приводят к фенотипу Cob - у микроорганизма P. denitrificatians; речь идет о включениях 31.1, 41.3, 45, 55: 22.1 и 1480.
Три плазмиды pXL233, pXL837 /Cameron et al/ и pXL843 вводятся путем конъюгативных переносов в три штамма, имеющих фенотип Cob -, т.е. SC510 RifR: : Тп5Sp 31.1, SC510 RifR::Тп5Sp 45, SBL27 RifR ::Тп5Sp 1480. Каждый из этих трех мутантов имеет различный профиль комплементации для синтеза кобаламинов. Действительно, SBL27 RifR : : Тп5Sp 1480 дополняется плазмидами pXL837 и pXL843, но не плазмидой pXL233; мутант SC510 RifR::Тп5Sp 45 комплементируется только плазмидой pXL843; мутант SC510 RifR::Тп5Sp комплементируется плазмидой pXL843, а также плазмидой pXL233 /смотри фиг. 37/. Следовательно, представленные данные позволяют согласно результатам по комплементации трех мутантнов сделать вывод, что три мутанта являются различными и что для каждого из них транспозон Тп5Sp включается в различный ген cob.
С другой стороны, плазмиды pXL1558::Тп5Sp 41.3, pXL1558:: Тп5Sp 45 и pXL1558: : Тп5Sp 22.1 вводятся путем конъюгативных переносов в штамм G 2035 /Cameron et al, 1989/ и не комплементируют его. Плазмида pXL1558 комплементирует этот мутант в отличие от плазмиды pXL1558::Тп5p 31.1.
Данные по фенотипу и комплементации позволяют нам определить 3 класса включений; каждый из этих классов представляется следующими включениями: 31.1 для класса 1; 45, 41.3, 55 и 22.1 для класса 2; 1480 для класса 3.
Для каждого класса включений транспозоны всегда включаются в ту часть фрагмента величиной 4,8 ко, которая содержится только в одной открытой фазе /ORF14, ORF16 и ORF17, которые определены в примере 3/. С каждым классом включений ассоциируется только одна открытая фаза. Указанные выше открытые фазы кодируют, следовательно, протеин, задействованный в процессе биосинтеза кобаламинов и/или кобамидов. Эти открытые фазы называются cobX, cobS и cobT для фаз 14, 16 и 17. Положение этих генов относительно карты рестрикции представлено на фиг. 37. Открытая фаза 15 не является геном, задействованным в биосинтезе кофермента B12.
4.4. - Генетические исследования фрагмента величиной 3.9 ко
Плазмида pXL1557 представляет собой плазмиду pR4290 /Ditta et al, 1980/, содержащую фрагмент Hind III - Bam HI величиной 9 ко плазмиды pXL519, клонированный на сайте EcoRI плазмиды pRK290 /фиг. 38/. Конструирование других плазмид, используемых в этом исследовании /pXL1303, pXL1286, pXL1324/, дается в описании фиг. 38. Вместе с тем, фрагмент Bgl II-XhoI величиной 2 ко /положения на последовательности, представленной на фиг. 33, 251 и 2234/ плазмиды pXL519 клонируется на сайтах BamHI-SalI плазмиды pXL435 (Cameron et al) с образованием плазмиды pXL699.
Включения Тп5Sp были получены на плазмиде pXL1557 в соответствии с методом, описанным в примере 4.3. Включения транспозона Тп5Sp на плазмиде pXL1557, называемые в таком случае pXL1557::Тп5Sp, были селекционированы. Те, которые картографируются на фрагменте величиной 9 ко /фиг. 39/, вводились в хромосому штамма SC510 RifR после конъюгативного переноса pXL1557:: Тп5Sp и обмена маркера путем гомологичной двойной рекомбинации, как это описано в 4,3.
Гомологичная двойная рекомбинация подтверждается методом Саутерна /Southern, 1975/. Этим способом были идентифицированы 20 штаммов SC510 RifR: :Тп5p.
С другой стороны, два других включения Тп5Sp, полученных в результате случайного мутагенеза транспозона Тп5Sp в штамме SBL27 RifR /Blanche et al, 1989/, были картографированы на фрагменте величиной 9 ко путем рестрикционного анализа по методу Саутерна /Southern, 1975/, смотри на фиг. 39 включения 1003 и 1147.
Выход синтеза кобаламинов определяется для этих 22 штаммов, культивируемых в среде PS4 в соответствии с уже описанной методикой /Cameron et al, 1989/, а фенотип Cob - приписывается штаммам, вырабатывающим в 1000 раз меньше /соответственно в 100/ витамина B12 по сравнению с родственным штаммом SC510 /соответственно SBL27 RifR/, фиг. 39. Только 4 включения 1, 1003, 23 и 1147 передаются фенотипом Cob- у P. denitrificans.
Четыре плазмиды pXL699, pXL1286, pXL1303 и pXL1324 вводятся путем конъюгативных переносов в четыре штамма, имеющих фенотип Cob-, т.е. SC510 RifR: : Тп5Sp I, SBL27 RifR::Тп5Sp 1003, SC510 RifR ::Тп5Sp 23 и SBL27 RifR::Тп5Sp 1147. Плазмида pXL699 комплементирует два первых мутанта /SC510 RifR::Тп5Sp I, SBL27 RifR::Тп5Sp 1003/, однако плазмида pXL1303 их не комплементирует; плазмида pXL1324 комплементирует два других мутанта /SC510 RifR:: Тп5Sp 23 и SBL27 RifR::Тп5Sp 1147/, однако плазмида pXL1286 их не комплементирует.
С другой стороны, плазмида pXL1577::Тп5Sp I вводится путем конъюгативного переноса в штамм G 2040 и не комплементирует его, тогда как плазмиды pXL1557, pXL1557::Тп5Sp 6A, pXL1557::Тп5Sp 54, pXL1557::Тп5Sp 48, pXL1557:: Тп5Sp 21, pXL1557::Тп5Sp 8, pXL1557::Тп5Sp 23, также веденные путем конъюгативных переносов, комплементируют его /смотри фиг. 39/. Данные по фенотипу и комплементации позволяют определить 2 класса включений. Для каждого класса включений транспозоны всегда внедряются в ту часть фрагмента величиной 3,9 ко, которая содержится только в одной открытой фазе /ORF 19 и ORF 20, которые определены в примере 3/.
С каждым классом включений ассоциируется только одна открытая фаза. Указанные выше открытые фазы кодируют протеин, задействованный в процессе биосинтеза кобаламинов и/или кобамидов. Эти открытые фазы называются cob V и cob U для фаз 19 и 20. Фазы 18 и 21 не являются генами, задействованными в процессе биосинтеза кофермента B12. Положение этих генов относительно карты рестрикции представлено на фиг. 39. Включения 48, 21 и 8 картографированы между генами cob V и cob U.
4.5. - Генетические исследования фрагмента величиной 13,4 ко
4.5.1. - Исследования на фрагменте EcoRI-Bgl II величиной 4327 по
Плазмида pXL189 /Cameron et al, 1989/, которая содержит, по меньшей мере, один ген cob, имеет вставку величиной 3, 1 ко, которая, за исключением 300 по, соответствует фрагменту EcoRI-ClaI величиной 4,26 ко /смотри фиг. 45/. Плазмида pXL189 была подвергнута мутагенезу с транспозоном Тп5, как это описано ранее /De Bruijn et Lupski, 1984/. Таким образом были картографированы 13 включений в вставке плазмиды pXL189, как это представлено на фиг. 46. Эти 13 мутантных плазмид, а также pXL189 были конъюгированы в двух мутантах A. tumefaciens, G 632 и G 633, которые являются мутантами, комплементируемыми плазмидой pXL189 /Cameron et al., 1989/. Только включение 58, оказалось, является инактивационным включением. Этот результат показывает, что оба мутанта G 632 и G 633 соответствуют мутации в одном и том же гене и что, с другой стороны, только ген P. denitrificans, который мог бы быть ответственным за их комплементацию, соответствует открытой фазе 26 /смотри фиг. 46/, потому что включение 58 картографируется в этой открытой фазе; более того, речь идет о единственном включении среди 13, которое картографируется в этой открытой фазе. Следовательно, ген cob, называемый cobO, ассоциируется с открытой фазой 26.
Для того чтобы знать, соответствуют ли четыре другие открытые фазы /открытые фазы 27 - 30/, идентифицированные на этом фрагменте, генам cob, кассета устойчивости к спектиномицину плазмиды pHP45 Ω /Prentki et Krisch, 1984/ была особым образом включена в каждый из этих генов, потом введена в хромосому P. denitrificans SC510 RifR путем гомологичной рекомбинации так, чтобы получить мутанты включений в каждой из этих открытых фаз. Для этой цели был использован фрагмент EcoRI-ClaI /положения соответственно 8818 и 13082 на последовательности, представленной на фиг. 43/. Этот фрагмент, который несет открытые фазы 27 - 30, был очищен, исходя из плазмиды pXL157 /Cameron et al, 1989/; связка EcoRI была присоединена к концу ClaI после того, как последний был заполнен фрагментом Кленова ДНК-полимеразы микроорганизма E. coli. Затем этот фрагмент клонировался в плазмиде pUC13 /Viera et al. , 1982/ на сайте EcoRI. Полученная таким образом плазмида была названа pXL332. Включения кассеты устойчивости к спектиномицину плазмиды pHP45 Ω /Prentki et Krisch, 1984/ были получены на плазмиде pXL332. Эти включения были осуществлены раздельно на сайтах Sma I /положение 9868, открытая фаза 27/, BamI /положение 10664, открытая фаза 28/, ClaI /положение 11687, открытая фаза 29/ и NcoI /положение 12474, открытая фаза 30/ в результате полного или частичного переваривания плазмиды pXL332 при помощи соответствующих ферментов, потом, если это необходимо, в результате заполнения этих концов фрагментом Кленова ДНК-полимеразы микроорганизма E.coli, потом в результате связывания с фрагментом SmaI величиной 2 ко плазмиды pHP45 Ω /Prentki et Krisch, 1984/, содержащим ген устойчивости к спектиномицину; эти включения называются соответственно Ω2, Ω1, Ω3 и Ω4, как это представлено на фиг. 46. Фрагменты EcoRI, несущие эти различные включения, затем клонировались на плазмиде pRK404 /Ditta et al, 1985/, в одном из двух сайтов EcoRI. Четыре плазмиды, несущие эти различные включения, были затем введены путем конъюгации в SC510 RifR, как это описано ранее. Плазмида pR751 /Thomas et Smith, 1987/ затем вводилась в трансконъюганты. Обмен мутаций, носимых 4 различными производными плазмиды pRK404 и хромосомой SC510 RifR, смогли селекционировать, как это описано /смотри пример 4.3/. Таким образом были получены 4 штамма. Каждый из этих штаммов несет включения кассеты устойчивости в одной из четырех открытых фаз 27 - 30. Эти включения были подтверждены в результате анализа геномной ДНК методом пятна Саутерна /Southern, 1975/. Было изучено производство кобаламинов этими различными штаммами. Все они проявили фенотип Cob+ в результате культивирования в среде PS4. Этот результат показывает, что эти открытые фазы не участвуют в биосинтезе кофермента B12. Однако, возможно, что одна или несколько из этих фаз кодируют протеины, которые участвуют, например, в трансформации кофермента B12 до метилкобаламина, например, т.е. в синтезе другого кобаламина и даже другого корриноида.
4.5.2. Исследование фрагмента EcoRI-EcoRI величиной 9,1 ко
В этом исследовании использовались различные плазмиды; плазмида pX 1560 представляет собой плазмиду pRK290 /Ditta et al., 1980/, содержащую фрагмент EcoRI-EcoRI величиной 9,1 ко плазмиды LpX 156 /пример 1/, клонированный на сайте EcoRI плазмиды pRK290 /смотри фиг. 46/. Конструирование других плазмид, используемых в этом исследовании /pXL618, pXL593, pXL623, pXL1909, pXL1938, pXL1908, pXL221, pXL208, pXL297/ дается в описании фиг. 45.
Включения Тп5Sp были получены на плазмиде pXL1560. Штамм MC1060, трансформированный плазмидой pXL1560, служил для получения включений транспозона Тп5 p во фрагменте pXL1560; таким образом 27 включений были получены и картографированы на фрагменте величиной 9,1 ко; положение этих различных включений на фрагменте представлено на фиг. 4. Эти 27 включений были введены в хромосому штамма SC510 RifR после конъюгативного переноса pXL1560::Тп5Sp с последующим введением в плазмиды pR751. Плазмида pR751 является плазмидой, устойчивой к триметоприму, из одной и той же группы несовместимости, что и плазмида pXL1560 /inc P, Thomas et Smith, 1987/. В результате культивирования, неселективного для pXL1560 /отсутствие тетрациклина/, но селективного для pR751 и транспозона /присутствие триметоприма и спектиномицина/, были получены обмен мутации, находящейся на pXL1560::Тп5Sp, с хромосомой, а также сегрегация плазмиды pXL1560; этот метод обмена маркера путем гомологической двойной рекомбинации эквивалентен методу, уже описанному Schell et al, 1988. Селекционированные таким образом штаммы несут транспозон в своей хромосоме.
Гомологичная двойная рекомбинация подтверждается методом Саутерна /Southern, 1975/. Эти способом были идентифицированы 27 штаммов SC510 RifR:: Тп5Sp, каждый из которых имеет различное включение транспозона Тп5Sp во фрагменте величиной 9,1 ко.
Выход синтеза кобаламинов определяется для этих 27 штаммов, культивируемых в среде PS4, а фенотип Cob- приписывается штаммам, вырабатывающим по крайней мере в 1000 раз меньше витамина B12, чем штамм SC 510 RifR, рисунок 46. Таким образом, наблюдается, что 18 этих хромосомных включений из 27 приводят к фенотипу Cob- у микроорганизмов P.denitrificans, как это показано на фиг. 46.
Включения 19, 32, 24, 27, 37, 39, 26, 11 и 14 картографируются в открытой фазе 22 /смотри фиг. 46/. Все эти включения комплементируются плазмидой pXL618, которая содержит только открытую фазу 22. Отсюда мы делаем вывод, что открытая фаза 22 соответствует гену cob, который мы называем cobO. Никакое включение не было получено в открытой фазе 23; однако плазмида pXL623, которая содержит только эту открытую фазу /смотри фиг. 46/, комплементирует два мутанта Agrobaterium tumefaciens, G642 и G2043, /Cameron et al. , 1989/. Следовательно, открытая фаза 23 соответствует гену cob, называемому cobP, Включения 23, 13, 12, 30, 22, 40, 35, 10 и 17, которые картографируются в открытых фазах 24 и 25, приводят к фенотипу Cob- у SC510 RifR. Оказывается, следовательно, что речь идет о двух открытых фазах, продукт которых задействован с биосинтезе кобаламинов. Однако нельзя исключать, что эти включения имеют полярные эффекты на генах, находящихся в положении 3', таких как cobO. Таким образом, следует изучить комплементацию этих мутантов, чтобы увидеть, не обусловлен ли их фенотип Cob- полярным эффектом.
Мутанты Cob микроорганизма Agrobaterium tumefaciens, G 622, G623 и G630, комплементируемые плазмидой pXL156, были исследованы. Эти мутанты не комплементируются плазмидой pXL189 /Cameron et al., 1989/, которая содержит cobO в качестве единственного гена cob. Напротив, они комплементируются плазмидой pXL1908, которая содержит cobO и открытую фазу 25, помимо открытых фаз 27-30 /смотри фиг. 45/. Эти последние не могут быть ответственными за комплементацию этих мутантов, потому что протеины, которых они кодируют не участвуют в процессе кофермента B12. Наблюдаемые комплементации, следовательно, могут быть обусловлены только открытой фазой 25. Более того, мутанты SC510 RifR Тп5Sp, картографированные в этой же самой открытой фазе /речь идет о мутантах 22, 40, 35, 10 и 17/, комплементируются плазмидой pXL1908 /смотри фиг. 46/, несущей cobO и фазу 25, тогда как по меньшей мере два из них не комплементируются плазмидой pXL189, которая содержит только cobO в качестве гена cob. Эти результаты ясно показывают, что открытая фаза 25 является геном cob; этот ген cob называется cobN.
Мутанты SC510 RifR Тп5Sp 23, 13 и 12, которые имеют фенотип Cob-, картографируются в открытой фазе 24. Эти мутанты не комплементируются плазмидой pXL623, которая содержит только ген cobP. Напротив, эти мутанты комплементируются плазмидой pXL593, которая содержит cobP и открытую фазу 24, что указывает на то, что открытая фаза 24 является ответственной за их комплементацию. Следовательно, открытая фаза 24 является геном cob, который называется cobW.
Пример 5 - гены и протеины
5.1. - Фрагмент величиной 5.4 ко
Таким образом, определены пять генов /cobA, coB, cobC, cobD и cobE/ на фрагменте ClaI-Hind III- Hind III- Hind III величиной 5,4 ко. Они кодируют соответственно следующие протеины: COBA, COBB, COBC, COBD и COBE. Кодирующие части генов /от cobA до cobE/ описаны на фиг. 15, также как и последовательности протеинов от COBA до COBE. Представлены также свойства каждого их этих протеинов /аминокислотный состав, изоэлектрическая точка, индекс полярности и профиль гидрофильности/.
5.2 - Фрагмент величиной 8,7 ко
Таким образом, определены восемь генов на фрагменте величиной 8,7 ко. Эти гены от cobF до cobM кодируют соответственно следующие протеины COB: COBF, COBG, COBH, COBI, COBJ, COBK, COBL, COBM. Кодирующие части генов /от cobF до cobM/ описаны на фиг. 16, также как и последовательности протеинов от COBF до COBM. Представлены также свойства каждого их этих протеинов /аминокислотный состав, молекулярный вес, изоэлектрическая точка, индекс полярности и профиль гидрофильности/.
5.3. - Фрагмент величиной 4,8 ко
Определены три гена /cobX, cobS и cobT/ на фрагменте SalI-SalI-SalI- SalI-SalI-BglI величиной 4,8 ко. Они кодируют соответственно следующие протеины: COBX, COBS и COBT. Кодирующие части этих генов описаны на фиг. 40, также как и последовательности протеинов COBX, COBS и COBT. Произвольным образом ATC в положении 1512 гена cobS был выбран в качестве инициирующего кодона вместо того, который находится в положении 1485 /смотри фиг. 32/. Представлены также свойства каждого из этих протеинов /аминокислотный состав, изоэлектрическая точка, индекс полярности и профиль гидрофильности/. COBT имеет гидрофильный участок, соответствующий аминокислотам от 214 до 305.
5.4. - Фрагмент величиной 3,9 ко
Обращены два гена /cobU и cobV/ на фрагменте SstI-SstI-BamHI величиной 3,9 ко. Они кодируют соответственно следующие протеины: COBU и COBV. Кодирующие части этих генов описаны на фиг. 41, также как и последовательности протеинов COBU и COV. Представлены также свойства каждого из этих протеинов /аминокислотный состав, изоэлектрическая точка, индекс полярности и профиль гидрофильности/.
5.5. - Фрагмент величиной 13,4 ко
Определены пять генов cob на фрагменте величиной 13,4 ko /cobQ, cobQ, cobP, cobW, cobN и cobO и cobV/. Они кодируют соответственно следующие протеины: COBQ, COBP, COBW, COBN и COBO. Кодирующие части этих генов /cobQ, cobP, cobW, cobN и cobO/ описаны на фиг. 46, также как и последовательности протеинов COBQ, COBP, COBW, COBN и COBO. Представлены также свойства каждого из этих протеинов /аминокислотный состав, изоэлектрическая точка, индекс полярности и профиль гидрофильности/.
Согласно профилям гидрофильности, которые были получены в соответствии с программами Hopp et Woods /1981/, все протеины COB, за исключением COBV, являются, очевидно, растворимыми протеинами в отличие от мембранных протеинов, потому что установлено отсутствие больших гидрофобных участков. Протеинов COBV является либо мембранным протеином, потому что установлены 4 длинных гидрофобных участка /смотри фиг. 41/, либо цитоплазматическим протеином, имеющим большие гидрофобные участки.
Для всех аминокислотных последовательностей протеинов COB в качестве первой аминокислоты в NH2-конечном положении указывается метионин. Подразумевается, что последний может быть отщеплен in vivo /Ben Bassat et Bauer, 1984/. Известно, что были предложены /Hirel et al, 1989/ правила, относящиеся к отщеплению in vivo NH2-конечного метионина под действием метионинаминопептидазы.
Вместе с тем, эти протеиновые последовательности сравнивались с протеинами Genpro, который представляет собой протеиновую вытяжку Genbank /версия 59/, увеличенную за счет предполагаемых кодирующих частей, превышающих 200 аминокислот в соответствии с программой Kanehisa /1984/. Не смогли выявить никакой существенной гомологии с параметрами, используемыми для версии 59 Genbank, за исключением случая с COBT. Действительно, протеин COBT имеет "кислотное ядро из аминокислот" между положениями /аминокислот/ 224 и 293 /смотри фиг. 40/; в этой части протеина более одной аминокислоты из 2 приходится на остаток глутаминовой или аспарагиновой кислоты; это ядро из кислых аминокислотных остатков делает протеин гомологичным в этой области в соответствии с программой Kanehisa /1984/ по отношению к другим протеинам, которые также имеют подобное кислотное ядро. Наиболее гомологичными протеинами являются: протеин GARP из Plasmodium falciparium/Triglia et al., 1988/, тропонин T из сердца /Jen et Lin, 1989/, человеческий и крысиный протимозин /Eschenfeldet Berger 1986/, андроген-зависящий протеин из крысы, связывающийся со спермином /Chang et al., 1987/, протеины "mid-size murofilament" человека, крысы и курицы /Myers et al., 1987; Levy et al 1987; Zopf et al., 1987/. Функциональность этих ядер, богатых кислотными остатками, не известна; однако это кислотное ядро должно либо обеспечивать связывание металлических катионов, таких как Co++, что придало бы протеину COBT роль кобальтового металлотионеина, или же разрешать взаимодействие с другими протеинами.
Пример 6 - Ферментативные исследования
6.1 - Идентификация протеинов COB и их генов, исходя из ферментативной активности
Этот пример описывает, как, исходя из очищенного протеина, установив его NH2-оканчивающуюся последовательность, можно найти соответствующий структурный ген среди генов cob с собранными последовательностями.
6.1.1. Идентификация протеина COBA, кодирующего геном cobA
Очистка SYMT из Pseudomonas denitrificans была описана ранее /F.Blanche et al, 1989/. NH2-Оканчивающуюся последовательность очищенного таким образом протеина смогли получить по методу, описанному выше. Были идентифицированы десять первых аминокислот:
NH2 - Оканчивающаяся последовательность протеина COBA /фиг. 15/ точно соответствует этой последовательности. Молекулярный вес очищенного SYMT, оцененный путем электрофореза PAGE-SDSc с концентрацией 15,5%, составляет 30 000. Протеин COBA имеет молекулярный вес, выведенный из его последовательности, величиной 29 234 /фиг. 15/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно показывает, что протеин COBA соответствует SYMT. Ген cobA является структурным геном SYMT.
6.1.2. Идентификация протеина COBB, кодируемого геном CobB.
a/ Количественное определение активности a,c-диамида кобириновой кислоты-синтазы
Этот пример иллюстрирует количественное определение активности в процессе биосинтеза корриноидов, которая еще никогда не была описана. Речь идет об a, c-диамиде кобириновой кислоты-синтезе /ДАККС/, которая катализирует амидирование двух кислотных карбоксильных функций корринового или кобальтокорринового кольца в положениях a и c /фиг. 17/. Донором группировки NH2 является L-глутамин, а в реакции расходуется 1 молекула АТФ на амидирование каждой кислотной карбоксильной функции. Количественное определение, которое описано ниже, применяется для реакции диамидирования кобириновой кислоты; с некоторыми модификациями /в частности, определение методом ВЭЖХ при 330 нм/ оно применяется для реакции диамидирования гидробириновой кислоты.
Смесь для инкубации /250 мкл трис-HCl с концентрацией 0,1 М и pH 7,6/, содержащая АТФ /1 мМ/, MgCl2 /2,5 мМ/, глутамин /1 мМ/, кобириновую кислоту /25 мкМ/ или гидробириновую кислоту /5 мкМ/, a,c-диамид кобириновой кислоты-синтазу /примерно 1 единица активности/, инкубируется в течение 1 часа при температуре 30oC. По окончании инкубации 125 мкл водного раствора KCN (2,6 г/л) и 125 мкл 0,2 М HCl прибавляют к смеси, которая затем нагревается при температуре 80oC в течение 10 минут, потом центрифугируется 5 минут с ускорением
5000 g. Анализируют методом ВЭЖХ 50 мкл всплывшей при центрифугировании фазы. Она вводится в колонку с Нуклеозилом 5-C18 длиной 25 см и элюируется с градиентом от 0 до 100% буферного раствора B в буферном растворе A за 30 минут; буферный раствор A : 0,1 М фосфата калия с pH 6,5, 10 мМ KCN; буферный раствор B : 0,1 М фосфата калия с pH 8, 10 мМ смеси KCN /ацетонитрил (1/1). Корриноиды детектируются за счет УФ-поглощения ими при 371 нм. Единица ферментативной активности определяется как количество фермента, необходимое для синтеза 1 нмоль амидных группировок за час в описанных условиях.
b/ Выделение в чистом виде активности a,c-диамида кобириновой кислоты-синтезы из Pseudomonas denitrificans.
Этот протеин иллюстрирует, как может быть очищен протеин из Pseudomonas denitrificans, участвующий в процессе биосинтеза кобаламинов.
На основании описанного в примере 6.1.2-a количественно определения осуществляют очистку a,c-диамида кобириновой кислоты-синтазы из Pseudomonas denitrificans, как описано ниже.
В типичном эксперименте по очистке 7 г увлажненных клеток штамма SC 510 RifR, в который ввели плазмиду pXL1500 /смотри пример 4.1. для описания плазмиды pXL1500, а также фиг. 12/, суспендируют в 30 мл 0,1 м Трис-HCl с pH 7,7 и обрабатывают ультразвуком в течение 15 минут при температуре 4oC. Затем извлекают неочищенный экстракт путем центрифугирования в течение 1 часа с ускорением 50000 g, потом 10 мл этого экстракта вводят в колонку с Моно-Q HR 10/10, приведенную в равновесие с тем же самым буферным раствором. Протеины элюируются с линейным градиентом KCl /от 0 до 0,5 М/. Фракции, содержащие ферментативную активность, объединяются и концентрируются до объема 2,5 мл. После разбавления при помощи 1 мл 25 мМ Трис-HCl с pH 7,7 протеины фракционируют на Моно-Q HR 5/5, используя предыдущий градиент KCl /от 0 до 0,5 М/. Активные фракции объединяют, 1 мл 0,1 М Трис-HCl с pH 7,7, содержащий 1,7 М сульфата аммония, прибавляют к образцу, который затем хроматографируется на колонке с фенил-Суперозой /Фармация/ с уменьшающимся градиентом сульфата аммония /от 1,0 М до 0 М/. Фракции, содержащие искомую активность, собираются и хроматографируются на колонке с Био-Гель НРНТ /Био-Рад/ с градиентом фосфата калия /от 0 до 0,35 М/.
После этой стадии фермент является чистым на более чем 95%. Он не содержит никакого загрязняющего протеина по данным метода PAGE-SDS. Чистота протеина подтверждается единственностью NH2-оканчивающейся последовательности. Его молекулярный вес по этому методу составляет 45000. Различные стадии очистки DAKKC вместе с коэффициентом их очистки и их выходом указаны в таблице 6.
Этот пример иллюстрирует, как NH2-оканчивающаяся последовательность протеина, который участвует в процессе биосинтеза кобаламинов, позволяет идентифицировать структурный ген, который кодирует этот протеин.
NH2-Оканчивающаяся последовательность a,c-диамида кобириновой кислоты-синтазы из Pseudomonas denitrificans, очищенной, как описано в примере 6.1.2-b, была осуществлена, как описано выше. Были идентифицированы 15 остатков:
NH2-Оканчивающаяся последовательность протеинов COBB /фиг. 15/ точно соответствует этой последовательности, если только в последовательности, представленной на фиг. 15, метионин предшествует пептидной последовательности, определенной путем непосредственного составления последовательности. Отсюда следует, что аминотерминальный метионин действительно отщепляется in vitro по действием метионинаминопептидазы /Ben Bassat et Bauer, 1987/. Молекулярный вес очищенной DAKKC, оцененный методом электрофореза на PAGE-SDS с концентрацией 12,5%, составляет 45000. Протеин COBB имеет молекулярный вес, выведенный из его последовательности, величиной 45676 /фиг. 15/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно указывают, что протеин COBB соответствует DAKKC. Ген cobB является структурным геном DAKKC.
6.1.3. Идентификация протеина COBI, кодируемого геном CobI
a/ Количественное определение активности S-аденозил-L-метионин:прекоррин-2-метилтрансферазы.
Этот пример иллюстрирует количественное определение ферментативной активности в процессе биосинтеза корриноидов, которая еще никогда не была описана. Речь идет о S-аденозил-L-метионин: прекоррин-2- метилтрансферазы /SП2MT/, которая катализирует перенос метильной группировки от S-аденозил-L-метионина /SAM/ к прекоррину-2 с образованием прекоррина-3 /фиг. 18/. Факторы II и III, т.е. продукты окисления соответственно прекоррина-2 и прекоррина-3, уже были очищены, исходя из клеточных экстрактов микроорганизмов Propionibacterium Shermanii /Batteraby et MacDonald, 1982; Scott et all 1984/; прекоррин-2 и прекоррин-3 признаются в качестве предположительных промежуточных продуктов биосинтеза кофермента B12, но они не были очищены. По этой причине соответствующая активность никогда не была количественно определена и очищена до этого момента. Субстрат ферментативной реакции, т.е. прекоррин-02, является очень лабильной молекулой, которую невозможно хранить, так как она спонтанно окисляется в присутствии даже ничтожных следов кислорода /Battersby et MacDonald, 1982/. Принцип этого ферментативного испытания основан, следовательно, на возможности генерировать перед самым использованием при помощи ферментативного экстракта из штамма SC510 RifR, в который была введена плазмида pXL1500, прекоррина-2-, исходя из SAM и δ -аминолевулиновой кислоты. Инкубация должна осуществляться в условиях строгой анаэробии.
Фракции, содержащие SП2MT, инкубируются в 1 мл 0,1 М Трис-HCl с pH 7,7 в присутствии 5 мМ ДДТ, 1 мМ ЭДТА, 100 мкМ /метил-3H/-SAM /1 мкКи/, 0,8 мМ δ -аминолевулиновой кислоты и 6 мг неочищенного ферментативного экстракта из штамма Pseudomonas denitrificans Sc510 RifR pXL1500 в течение 3 часов при температуре 30oC. Штамм SC510 RifR pXL1500 содержит большую активность SYMT /F. Blanche et al., 1989/. Тетрапироральные соединения, вырабатываемые в ходе инкубации, связываются на анионообменной колонке с ДЕАЕ-Сефадексом и этерифицируются в метаноле с 5%-ным содержанием серной кислоты в отсутствие кислорода. Диметилированные и триметилированные производные уро'гена III затем разделяют методом тонкослойной хроматографии на кремнеземе, используя смесь дихлорметан/метанол (98,3/1,7) в качестве элюирующей системы /F.Blanche et al. , 1989/. Активность SП2MT выражается в виде отношения количества триметилированных производных, полученных на приведенную систему /ди- и три-/ метилированных продуктов, к количеству протеина. Экстракт из штамма SC510 RifR pXL1500, введенный в тест, не имеет активности SП2MT, детектируемый в условиях количественного определения /отношение продуктов прекоррина-3 к продуктам прекоррина-2 в ходе испытания составляет менее 0,05/.
b/ Очистка S-аденозил-L-метионин:прекоррин-2-метилтрансферазы из Pseudomonas denitrificans.
Этот эксперимент иллюстрирует, как может быть очищен протеин из Pseudomonas denitrificans, участвующий в процессе биосинтеза кобаламинов, когда имеется количественное определение рассматриваемой активности.
Протеин очищается, исходя из клеток штамма SC510 RifR, содержащего плазмиду pXL253. Речь идет о плазмиде pKT230, в которую был включен фрагмент EcoRI величиной 8,7 ко /фиг. 13/. В типичном эксперименте по очистке 50 г увлажненных клеток штамма SC510 RifR, в которой была введена плазмида PXL253, суспендируются в 250 мл 0,1 М фосфата калия с pH 7,7 и 5 мМ ДТТ и обрабатываются ультразвуком в течение 15 минут при температуре 4oC. После центрифугирования с ускорением 50000 g в течение 1 часа всплывшая фаза пропускается через колонку с ДЕАЕ-Сефадексом /10 мл геля/ для удаления тетрапиррольных соединений. Величина pH полученного таким образом неочищенного экстракта доводится до значения pH 7,7 при помощи 0,1 М KOH. Протеин, осаждающиеся при насыщении между 33% и 45% сульфата аммония, собираются и растворяются в 40 мл 0,1 М Трис-HCl с pH 7,7 и 5 мМ ДТТ. Этот раствор пропускается через колонку с Сефадексом G-25 при элюировании раствором 10 мМ трис-HCl с pH 7,7 и 5 мМ ДТТ, а собранные протеины вводятся в колонку с ДЕАЕ-Трисакрилом-М. Протеины элюируют с линейным градиентом от 0 до 0,25 М KCl, а фракции, содержащие активность SП2MT, собираются и пропускаются второй раз через колонку с Сефадоксом G-25, как указано выше. Протеиновые фракции вводятся в колонку с Ультрогелем HA /IBF/, приведенную в равновесие в 10 мМ Трис-HCl с pH 7,7 и 5 мМ ДТТ. Протеины элюируют с линейным градиентом от 0 до 50 мМ фосфата калия с pH 7,8, содержащего 5 мМ ДТТ. Фракции, содержащие искомую активность, объединяются и вводятся в колонку с Моно-Q HR 5/5 /Франция/, приведенную в равновесие с раствором 50 мМ Трис-HCl с pH 7,7 и 5 мМ ДТТ. SП2MT элюируется с линейным градиентом /от 0 до 0,25 М/ KCl. По окончании стадии с Моно-Q электрофорез методом PAGE-SDS /12,5%/ с окрашиванием солями серебра показывает, что фермент является чистым более чем на 99%. Это подтверждается единственностью NH2-оканчивающейся последовательности протеина. Молекулярный вес, рассчитанный по данным электрофореза в денатурирующих условиях /PAGE-SDS с концентрацией 12,5%/, составляет 26500. Стадии очистки SП2MT вместе с их выходами описаны в таблице 7.
Этот пример иллюстрирует, как NH2-оканчивающаяся последовательность протеина, который участвует в процессе биосинтеза, позволяет идентифицировать структурный ген, который кодирует этот протеин. В настоящем примере речь идет о структурном гене SП2MT.
NH2-Оканчивающаяся последовательность очищенного протеина была реализована, как описано выше. Были идентифицированы 15 первых аминокислот:
NH2-Оканчивающаяся последовательность протеина COBI /фиг. 16/ точно соответствует этой последовательности, если только в последовательности, представленной на фиг. 16, метионин предшествует пептидной последовательности, выведенной из нуклеотидной последовательности. Отсюда следует, что аминотерминальной метионин действительно отщепляется in vivo под действием метионинаминопептидазы (Ben Bassat et Bauer 1987/. Молекулярный вес очищенности SП2МТ, оцененный методом электрофореза PAGE-SDS с концентрацией 12,5%, составляет 26500. Протеин COB1 имеет молекулярный вес, выведенный из его аминокислотной последовательности, величиной 25878 /фиг. 16/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно показывают, что протеин COBI соответствует SП2МТ. Ген cobI является структурным геном SП2MT.
6.1.4. Идентификация протеина COBH, кодирующего геном cobH
a/ Количественное определение активности прекоррин-8х-мутазы
Этот пример иллюстрирует количественное определение ферментативной активности в процессе биосинтеза кобаламинов, которая до настоящего времени никогда не была описана. Речь идет о прекоррин-8х-мутазе. Этот фермент катализирует перенос метильной группировки из положения C-11 в положение C-12 в ходе превращения прекоррина-8х в гидробириновую кислоту /смотри обозначение углеродов на фиг. 19, приложение 68/. В более общем случае, это фермент, катализирующий перенос метильной группировки от C-11 к C-12, что приводит таким образом к корриновому кольцу. Фермент называется здесь мутаза, хотя строго не доказано, что перенос метильной группировки является внутримолекулярным, даже если это очень вероятно.
Ферментативная активность доказывается превращением прекоррина-8х /5 мкМ/ в гидробироновую кислоту в ходе инкубации в присутствии ферментативных фракций в растворе 0,1 М Трио-HCl с pH 7,7 и 1 мМ ЭДТА при температуре 30oC в течение 1 часа. По окончании инкубации реакция останавливается в результате нагревания при температуре 80oC в течение 10 минут и после центрифугирования с ускорением 3000xg в течение 10 минут; образованная гидробириновая кислота, представляющая всплывшую фазу, анализируется методом ВЭЖХ /смотри пример 6.1.2.-а/.
b/ Очистка прекоррин-8x-мутазы
Очистка прекоррин-8x-мутазы из Pseudomonas denitrificans осуществляется, как описано ниже.
В ходе этой очистки все буферные растворы доводятся до pH 7,7.
В типичном эксперименте по очистке 50 г клеток штамма SC510 RifR, несущего плазмиду pXL253 /плазмида pKT230, в которой был клонирован на сайте EcoRI фрагмент величиной 8,7 ко, фиг. 13/, которые получены после культивирования в среде PS4, повторно суспендируются в 200 мл 0,1 М буферного раствора фосфата калия и обрабатываются ультразвуковом в течение 12 минут. После центрифугирования с ускорением 50 000 xg в течение 1 часа всплывшая фаза пропускается через колонку с ДЕАЕ-Сефадексом /10 мл геля/ для удаления тетрапиррольных соединений. Величина pH раствора немедленно доводится до значения 7,7 при помощи 1 М раствора KOH. Протеиновая фракция, осаждающаяся при насыщении между 40 и 60% сульфата аммония, собираются путем центрифугирования и растворяется в 50 мл 0,1 М Трис-HCl. Затем этот образец вводится в колонку с Ультрогелем AcA 54 /IBF, Франция/ (объем геля - 1000 мл), и протеины элюируются с расходом 60 мл/ч раствором 50 мМ Трис-HCl. Фракции, содержащие активность, объединяются и вводятся в колонку с ДЕАЕ-Трисакрилом M /IBF, Франция/, приведенную в равновесие с 50 мМ Трис-HCl, и протеины элюируются с градиентом от 0 до 0,2 м KCl. Фракции, содержащие очищаемой протеин, объединяются, пропускаются через колонку с Сефадексом G 25, приведенную в равновесие с 10 мМ Трис-HCl. Протеиновая фракция вводится в колонку с Ультрогелем HA /IBF, Франция/, приведенную в равновесие с 10 мМ Трис-HCl, и протеины элюируются с градиентом от 0 до 0,1 М фосфата калия, потом активная фракция хроматографируется на колонке с Фенил-Сефарозой CL 4B /Фармация/ в растворе с 10 мМ фосфата калия при элюировании с градиентом от 0,65 до 0 М сульфата аммония. Активные фракции объединяются. Полученный таким образом протеин является чистым более чем на 95% /по результатам электрофореза PAGE-SDS с концентрацией 12,5% и окрашиванием солями серебра/. Чистота протеина подтверждается единственностью N-оканчивающейся последовательности. Его молекулярный вес, рассчитанный при помощи этого метода, составляет 22 000. Стадии очистки прекоррин-8x-мутазы вместе с их выходами по очистке описаны в таблице 8.
Этот пример иллюстрирует, как NH2-оканчивающаяся последовательность протеина, который участвует в процессе биосинтеза, позволяет идентифицировать структурный ген, который кодирует этот протеин.
NH2-Оканчивающаяся последовательность этого протеина была реализована, как описано выше. Были идентифицированы 15 остатков:
NH2-Оканчивающаяся последовательность протеина COBH /фиг. 16/ точно соответствует этой последовательности, если только в последовательности, представленной на фиг. 16, метионин предшествует пептидной последовательности, определенной в результате сборки последовательности, описанной выше. Отсюда следует, что аминотерминальный метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassat et Bauer, 1987/. Поскольку второй остаток является пролином, то это отщепление соответствует уже сформулированным правилам /Hirel et al, 1989/. Молекулярный вес очищенной прекоррин-8x-мутазы, оцененный методом электрофореза PAGE-SDS с концентрацией 12,5%, составляет 22000. Протеин COBH имеет молекулярный вес, выведенный из его последовательности, величиной 22050 /фиг. 16/. Соответствия между NH2-оканчивающимися последователями и молекулярными весами этих протеинов ясно показывают, что протеин COBH соответствует прекоррин-8x-мутазе. Ген cobH является структурным геном прекоррин-8x-мутазы.
d/ Получение, выделение и идентификация прекоррина-8x
В типичном эксперименте по получению прекоррина-8x неочищенный ферментативный экстракт из штамма SC510 RifR pXL253 /1000 мг протеинов/ инкубируется при анаэробиозе в течение 20 часов при температуре 30oC в 100 мл 0,1 М буферного раствора Трис-HCl с pH,7 и 1000 нмоль триметилизобактериохлорина, полученного, как описано ранее /Battersby et al., 1982/, ЭДТА /1 мМ/, АТФ /100 мкмоль/, MgCl2 /250 мкмоль/, НАДН /50 мкмоль/, НАДФР /50 мкмоль/, SAM /50 мкмоль/ и гидробириновой кислотой /20 мкмоль/. По окончании инкубации прекоррин-8x является тетрапиррольным продуктом, который образуется преимущественным образом. Он выделяется и очищается методом ВЭЖА на колонке с μ-Бондарак С18 /Waters/ с использованием линейного градиента для элюирования от 0 до 50% ацетонитрила в буферном растворе фосфата калия с pH 5,8. Масса прекоррина-8x (m/z = 880) и масса его метилсложноэфирного производства (m/z = 987) указывают, что речь идет о соединении, имеющем ту же самую брутто-формулу, что и гидробириновая кислота. Характеристики УФ /видимой спектроскопии и флуоресценции сильно отличаются от аналогичных характеристик для гидробириновой кислоты и указывают, что молекула обладает двумя отдельными хромофорами. Поскольку единственной ферментативной реакцией изомеризации между прекоррином-6x /Thibant et al., 1990/ и гидробириновой кислотой является миграция метила от C-11 и C-12, то прекоррин-8x является последним промежуточным соединением перед гидробириновой кислотой, а соответствующая реакция представляет собой миграцию метила от C-11 к C-12, катализируемую прекоррин-8x-мутазой.
6.1.5. Идентификация протеина COBU, кодируемого геном cobU
a/ Количественное определение активности никотинат-нуклеотид:диметилбензимидазолфосфорибозилтрансферазы /фиг. 5, реакция 5/
Этот пример иллюстрирует количественное определение ферментативной активности, непосредственно связанной с процессом биосинтеза кобаламинов. Речь идет о никотинат-нуклеотид: диметилбензимидазолфосфорибозилтрансферазе /HH: ДМБИ ФРТ/ (EC 2.4.2.21). Фракции, содержащие активность HH: ДМБИ ФРТ /примерно 5 единиц/, инкубируются при температуре 30oC в течение 8 минут в 500 мкл 0,1 М буферного раствора глицин: NaOH с pH 9,7 в присутствии 1 мМ MHHK /мононуклеотидной никотиновой кислоты и 10 мкМ ДМБИ. Затем реакция прекращается в результате нагревания при температуре 80oC в течение 10 минут, реакционная смесь разбавляется 4 объемами воды, и 100 мкл этого раствора вводятся в колонку ВЭЖХ с Нуклеозилом 5-C8 длиной 15 см, элюируемую смесью 0,1 М фосфат калия с pH 2,9:ацетонитрил /93:7/ с расходом 1 мл/мин. α -Рибазол-5'-фосфат детектируется и количественно определяется методом флуориметрии /возбуждение - 260 нм; эмиссия - > 370 нм/. Единица ферментативной активности определяется как количество фермента, необходимое для генерирования 1 нмоль α -рибазол-5'-фосфата за час в этих условиях.
b/ Очистка активности HH:ДМБИ ФРТ из Pseudomonas denitrificans.
Этот эксперимент иллюстрирует, как может быть очищен протеин и P. denitrificans, участвующий в процессе биосинтеза кобаламинов. Исходя из количественного определения, описанного в примере 6.1.5-a, осуществляется очистка HH: ДМБИ ФРТ из Pseudomonas denitrificans, как описано ниже. В типичном эксперименте по очистке используют 10 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL1490B, как это описано выше. Плазмида pXL1490B описана на фиг. 38; эта плазмида была получена путем клонирования фрагмента BamHI-SstI-SstI величиной 3,85 ко из плазмиды pXL519 /смотри фиг. 38/. Эта плазмида, следовательно, несет гены cobU и cobV из P. denitrificans. Клетки, культирируемые в среде PS4, дополненной ливидомицином, как это описано ранее, собираются после культивирования в течение 96 часов в среде PS4. Они повторно суспендируются в 25 мл 0,1 М буферного раствора Трис-HCl с pH 7,2 и обрабатываются ультразвуком в течение 15 минут при температуре 4oC. Затем неочищенный экстракт извлекается путем центрифугирования в течение 1 часа с ускорением 50 000g, потом пропускается через колонку с ДЕАЕ-Трисакрилом М /IBF, Франция/, приведенную в равновесие с тем же самым буферным раствором. 10% Элюата /120 мг протеинов/ фракционируют на колонке с Моно-Q HR 10/10, используя градиент KCl /от 0 до 0,6 М/. Активные фракции объединяются и концентрируются до объема 2 мл путем ультрафильтрации, потом после смешивания с одним объемом 30 мМ буферного раствора Трис-HCl с pH 7,2 образец фракционируется второй раз на Моно-Q HR 5/5, как и ранее. Активные фракции объединяются, потом образец доводится до значения молярности 1 М при помощи сульфата аммония и хроматографируется на колонке с фенил-Суперозой HR 5/5 при элюировании с уменьшающимся градиентом сульфата аммония /от 1 М до 0 М/. Фракции, содержащие искомую активность, собираются, концентрируются путем ультрафильтрации и хроматографируются на гель-проникающей колонке с Био-Сил 250 при элюировании смесью 20 мМ фосфата натрия-50 мМ сульфата натрия при значении pH 6,8.
После этой стадии фермент является чистым более чем на 95%. Он не имеет никакого загрязняющего протеина по данным метода PAGE-SDS. Эта чистота подтверждается единственностью NH2-оканчивающейся последовательности. Его молекулярный вес по этому методу составляет 35 000. Различные стадии очистки HH:ДМБИ ФРТ приводятся в таблице 9.
NH2-Оканчивающаяся последовательность HH: ДМБ ФРЕ из Pseudomonas denitrificans, очищенная, как описано в примере 6.1.5-b, была реализована по методу, описанному выше. Были идентифицированы 15 первых остатков:
MH2-Оканчивающаяся последовательность протеина COBU /фиг. 41/ соответствует этой последовательности, если только в последовательности, приведенной на фиг. 41 метионин предшествует первой аминокислоте пептидной последовательности, определенной в результате непосредственной сборки последовательности. Отсюда следует, что аминотерминальный метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassat et Bauer, 1987/. Молекулярный вес очищенной N-трансглюкозидазы, оцененный методом электрофореза PAGE-SDS с концентрацией 12,5%, составляет 35000. Протеин COBU имеет молекулярный вес, выведенный из его последовательности, величиной 34642 /фиг. 41/. Соответствия между NH2-оканчивающимися последовательности и молекулярными весами ясно показывают, что протеин COBU соответствует HH: ДМБИ ФРТ. Ген cobU является структурным геном HH: ДМБИ ФРТ.
d/ Специфичность HH: ДМБИ ФРТ для ДМБИ
Этот пример иллюстрирует, как исследование специфичности HH: ДМБИ ФРТ из P. denitrificans позволяет провести биосинтез при помощи P. denitrificans различных кобамидов, используя каталитические свойства HH: ДМБИ ФРТ из P. denitrificans для осуществления синтеза рассматриваемого нуклеотидного основания.
Субстратом фермента для синтеза кобаламинов является 5,6-диметилбензимидазол. Бензимидазол и 5-метилбензимидазол соответственно являются субстратами для реакции со скоростями реакций 157% и 92% соответственно по сравнению с натуральным субстратом /5,6-диметилбензимидазолом/, причем концентрация МННК устанавливается при значении 2 мМ. Следовательно, специфичность HH: ДМБИ ФРГ из P. denitrificans является слабой для субстратов с бензимидазольным кольцом. Таким образом, можно использовать штамм P. denitrificans SC510 RifR /Cameron et al, 1989/, культивировать его в среде PS4, где 5,6-диметилбензимидазол заменен бензимидазолом или 5-диметибензимидазолом соответственно с целью проведения микробиологического синтеза Co α-/бензимидазолил/-Co β-цианокобамида или Co α-/5-метилбензимидазолил/-Co β-цианокобамида соответственно. Конечно и другие кобамиды могли бы быть синтезированы этим способом.
6.1.6. Идентификации протеина COBU, кодируемого геном CobV
Этот пример иллюстрирует, как количественное определение активности в процессе биосинтеза кофермента B12 при помощи P. denitrificans с последующей частичной очисткой этой активности может дать возможность идентифицировать структурный ген этого фермента в P. denitrificans
a/ Количественное определение активности ГДФ-кобинамид:
α- рибазол-/5'-фосфат/-кобинамидфосфотрансферазы (или кобаламин-/5'-фосфат/-синтазы)
Этот пример иллюстрирует количественное определение активности, непосредственно связанной с процессом биосинтеза кобаламинов. Речь идет о кабаламин-/5-фосфат/-синтазе. Фракции, содержащие активность /примерно 5-10 единиц/, инкубируются в темноте при температуре 30oC в 500 мкл 0,3 М буферного раствора Трис-HCl с pH 9,0 в присутствии 1 мМ ЭДТА. 12,5 мМ MgCl2, 50 мкМ α -рибазол-5'-фосфата и 20 мкМ ГДФ-кобамида /в виде 5'-деокси-5'-аденозил (Ado) или кофермента/. После инкубации в течение 15 минут прибавляют 500 мкл 20 мМ цианида калия и нагревают раствор при температуре 80oC в течение 10 минут. После центрифугирования для удаления осажденного вещества, 5'-фосфат витамина B12, находящийся во всплывшей фазе, определяется количественно, как это описано в примере 9. Единица активности кобаламин-/5'-фосфат/-синтазы определяется как количество фермента, необходимое для генерирования 1 нмоль кобаламин-5'-фосфата за час в описанных выше условиях.
Ado-ГДФ-кобинамид получается в результате инкубации Ado-кобинамидфосфата /Blanche et al., 1989/ с экстрактом из штамма SC510 RifR pXL623 в условиях количественного определения кобинамидфосфатгуанилилтрансферазы /смотри пример 6.1.11-b/. Выделяют α -рибазол и α -рибазол-5'-фосфат, исходя из культур SC510 RifR, и очищают методом ВЭЖХ в условиях количественного определения, описанных в примере 6.1.5-a.
b/ Частичная очистка кобаламин-/5'-фосфат/-синтазы
Этот эксперимент иллюстрирует, как ферментативная активность P. denitreficans, участвующая в процессе биосинтеза кобаламинов из P. denitrificans, может быть частично очищена. Исходя из описанного выше количественного определения, осуществляется очистка кобаламин-/5'-фосфат/-синтазы. Для этой цели в типичном эксперименте по очистка используют 10 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL490B, как это описано ранее. Плазмида pXL490B описана на фиг. 38; эта плазмида соответствует фрагменту SstI-SstI-BamHI величиной 3,85 ко, клонированному в pKT230. Эта плазмида несет гены cobU и cobU P. denitrificans. Присутствие этой плазмиды в P. denitrificans SC510 RifR приводит к увеличению активности кобаламин-/5'-фосфат/-синтазы с коэффициентом примерно 100; следовательно, является вероятным, что вставка, находящаяся в плазмиде pXL1490B, содержит структурный ген этого фермента; следовательно, этот ген может быть только cobU или cobV. Клетки SC510 RifR pXL1490B получаются в результате культивирования в среде PS4, дополненной ливидомицином, как это описано выше. Клетки центрифугируются, потом снова суспендируются в 25 мл 0,1 М буферного раствора Трис-HCl /c pH 8,3/ в присутствии 1 мМ ЭДТА (буферный раствор A) и обрабатывается ультразвуком в течение 15 минут при температуре 4oC. Неочищенный экстракт затем извлекается путем центрифугированиия в течение 1 часа с ускорением 50000g и пропускается через колонку с Сефадексом G-25, приведенную в равновесие с буферным раствором A. Протеиновая фракция извлекается и вводится частями по 300 мкл /7,5 мг протеинов/ в колонку с Суперозой 12HR 10/30, элюируемую при помощи буферного раствора A. Вытесненная фракция извлекается, смешивается с равным объемом буферного раствора A в присутствии 1,0 М сульфата аммония и хроматографируется на колонке с фенил-Суперозой HR 5/5. Протеины элюируются с уменьшающимся градиентом сульфата аммония /от 0,5 М до 0 М/ в буферном растворе A с последующим плато при 0 М сульфата аммония с целью элюирования активности кобаламин-/5'-фосфат/-синтазы. Частичная очистка этого фермента описана в приведенной ниже таблице 10, исходя из 75 мг протеинов, введенных в первоначальный момент в процесс очистки.
Значение Km для /Ado/ГДФ-кобинамида составляет 0,9 мкМ. Однако фермент имеет то же самое сродство и практически идентичную скорость реакции, что и /CN, aq/-форма субстрата. Значение Km фермента для α -рибазол-5'-фосфата составляет приблизительно 2,7 мкМ. Более того, наиболее чистые препараты кобаламин-/5'-фосфат/-синтазы катализируют реакцию Ado-ГДФ-кобинамида с α -рибазолом, что приводит к образованию кофермента B12, причем в этих условиях не наблюдается никакого накопления кобаламин-5'-фосфата. Значение Km фермента для α -рибазола составляет 7,8 мкМ. Внутриклеточные концентрации α -рибазол-5'-фосфата и α -рибазола величиной 30 и 700 мкМ соответственно были измерены методом ВЭЖХ в ходе производства кобаламинов из штамма SC510 RifR в среде PS4 при условиях культивирования, описанных в примере 6.1.5-a. Это показывает, что кофермент B12 может быть генерирован непосредственно, исходя из Ado-ГДФ-кобинамида под действием кобаламин-/5'-фосфат/-синтазы без участия кобаламин-5'-фосфатазы.
Отсутствие накопления или присутствие следов кобаламин-5'-фосфата в культурах P. denitrificans SC510 RifR подтверждает, что кофермент B12 получается в результате прямой реакции Ado-ГДФ-кобинамида с α -рибезолом in vivo.
Эта прямая реакция уже наблюдалась и была описана in vitro y Propionibacterium shermanii /Rongio et al., 1967; Renz, 1968/. Структурным геном кобаламин-/5'-фосфат/-синтазы может быть только cobU или cobV, потому что увеличение Y P. denitreficans фрагмента, несущего эти два гена cob из P. denitrificans, приводит к увеличению с коэффициентом 100 активности кобаламин-/5'-фосфат/-синтазы и потому что ген cobU является структурным геном HH: ДМБИ ФРТ, следовательно, ген cobV является структурным геном кобаламин-/5'-фосфат/-синтазы.
6.1.7. Идентификация протеина COBK, кодируемого геном cobK
a/ Количественное определение активности прекоррин-6x-редуктазы
Этот пример иллюстрирует количественное определение новой ферментативной активности, непосредственно связанной с процессом биосинтеза кобаламинов. Речь идет о прекоррин-6x-редуктазе.
Фракции, содержащие активность прекоррин-6x-редуктазы /приблизительно 0,05 единицы, Ед/, инкубируются при температуре 30oC в течение 60 минут в 250 мкл 0,1 М буферного раствора Трис-HCl с pH 7,7 в присутствии 1 мМ ЭДТА, 500 мкМ НАДФН, 25 мкМ [метил-3H]-SAM (80 мкКи/мкмоль), 4 мкМ прекоррина-6x /Tribaut et al. , 1990/ и 0,5 Ед дигидропрекоррин-6x-метилазы, частично очищенной /смотри ниже получение/. Затем реакция останавливается в результате нагревания при температуре 80oC в течение 5 минут, а после центрифугирования с ускорением 5000xg в течение 5 минут всплывшая фаза вводится в колонку с ДЕАЕ-Сефадексом /содержащую 200 мкл геля/. Затем колонка экстенсивно промывается буферным раствором Трис-HCl, а связываемые соединения элюируются при помощи 4 мл 1 М HCl. Радиоактивность этого элюата подсчитывается в жидкостном сцинтилляционном счетчике. Единица ферментативной активности определяется как количество фермента, необходимое для восстановления 1 нмоль прекоррина-6x за час в этих условиях.
Дигидропрекоррнин-6x-метилаза частично очищается, исходя из неочищенного экстракта из SC510 RifR pXL253 на анионообменной колонке с Моно-Q HR 5/5 /Фармация/. Колонка элюируется с линейным градиентом от 0 до 0,4 М KCl в 0,1 М буферном растворе Трис-HCl с pH 7,7. Ферментативная активность элюируется в 0,35 М KCl. Эта активность детектируется и количественно определяется при помощи теста на активность прекоррин-6x-редуктазы, определенного выше /в присутствии 0,5 Ед прекоррин-6x-редуктазы в среде для инкубации/. По окончании стадии с участием Моно-Q фракции, содержащие активность дигидропрекоррин-6x-метилазы, становятся полностью свободными от активности прекоррин-6x-редуктазы. Единица активности метилазы определяется как количество фермента, необходимое для переноса 1 нмоль метильных группировок на дигидропрекоррин-6x за час в описанных выше условиях.
b/ Очистка активности прекоррин-6x-редуктазы
Исходя из описанного выше количественного определения осуществляется очистка прекоррин-6x-редуктазы из Pseudomonas denitrificans, как описано ниже.
В типичном эксперименте по очистке 100 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL253 /плазмида pKT230, в которой был клонирован на сайте EcoRI фрагмент величиной 8,7 ко, фиг. 13/, суспендируются в 200 мл 0,1 М буферного раствора Трис-HCl с pH 7,7 в присутствии 1 мМ ЭДТА /буферный раствор A/ и обрабатываются ультразвуком в течение 15 минут при температуре 4oC. Затем неочищенный экстракт извлекается путем центрифугирования в течение 1 часа с ускорением 50000 xg и пропускается за три раза через колонку с Сефадексом G 25, приведенную в равновесие с буферным раствором A. Три вытесненные с геля фракции объединяются и доводятся до объема 1 л буферным раствором A. Протеины, осаждающиеся при насыщении между 25 и 40% сульфата аммония, собираются путем центрифугирования и снова суспендируются в 50 мл буферного раствора A, затем полученный раствор освобождается от солей при пропускании через колонку с Сефадексом G 25, приведенную в равновесие с буферным раствором B /25 мМ Трис-HCl - 500 мкМ ДТТ - 15% глицерина/. Затем раствор с протеинами вводится с расходом 2,5 мл/мин в колонку с Q-Сефаразой Fast Flow /фармация/, приведенную в равновесие с буферным раствором B, и протеины элюируются смесью буферный раствор B - 0,2 М KCl. Эта фракция освобождается от солей на колонке с Сефадексом G 25, приведенной в равновесие с буферным раствором C /50 мМ Трис-HCl - 500 мКМ ДТТ - 15% глицерина/. Затем протеиновый раствор фракционируется /100 мг протеинов в каждой хроматографической фракции/ на колонке с Моно-Q HR 10/10 /Фармация/ с градиентом от 0 до 0,4 М KCl в буферном растворе C, затем фракция, содержащая активность, хроматографируется на колонке с фенил-Суперозой HR10/10 /Фармация/ при линейном уменьшающемся градиенте сульфата аммония /от 1 до 0 М/. Активная фракция освобождается от солей, и прекоррин-6x-редуктаза очищается на колонке с Моно-Q HR 5/5. Она элюируется в 50 мМ буферном растворе Трис-HCl с pH 8,1 в присутствии 500 мкМ ДТТ и 15% глицерина с градиентом от 0 до 0,2 М KCl. Для улучшения очистки протеин окончательно хроматографируется на колонке с Био-Сил 250 /Био-Рад/, элюируемой смесью: 20 мМ фосфата калия - 50 мМ сульфата натрия с pH 6,8 - 500 мкМ ДТТ - 15% глицерина. По окончании этой стадии фермент является чистым более чем на 95%. Он не содержит никакого загрязняющего протеина по данным метода PAGE-SDS, причем протеины обнаруживаются с нитратом серебра. Эта степень очистки подтверждается единственностью NH2-оканчивающейся последовательности. Его молекулярный вес по этому методу составляет 31000. Различные стадии очистки прекоррин-6x-редуктазы вместе с их коэффициентом очистки и их выходом приводятся в таблице 11.
NH2-Оканчивающаяся последовательность прекоррин-6x-редуктазы из Pseudomonas denitrificans, очищенной, как описано выше, была определена, как описано ранее. Были идентифицированы шесть остатков:
Ala-Gly-Ser-Leu-Phe-Asp
Кроме того, после трипсинового переваривания и разделения фрагментов методом ВЭЖХ на колонке с обратимой фазой C-18, были получены три внутренних последовательности:
NH2-Оканчивающаяся последовательность протеина COBK /фиг. 16/ точно соответствует NH2-оканчивающейся последовательности прекоррни-6x-редуктазы, если только в последовательности, представленной на фиг. 16, метионин предшествует пептидной последовательности, определенной в результате прямой сборки последовательности. Отсюда следует, что аминотермальный метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassat et Bauer, 1987/. Кроме того, три внутренних последовательности соответствуют трем последовательностям 60-69, 112-122 и 143-148 протеина COBK. Молекулярный вес очищенной прекоррин-6x-редуктазы оценивается методом электрофореза PAGE-SDS как 31000. Протеин COBK имеет молекулярный вес, выведенный из его последовательности, величиной 28000 /фиг. 16/. Соответствия между NH2-оканчивающимися и внутренними последовательностями и молекулярными весами ясно показывают, что протеин COBK соответствует прекоррин-6x-редуктазы. Ген cobK является структурным геном прекоррин-6x-редуктазы.
d/ Реакция, катализируемая прекоррин-6x-редуктазой
Ферментативная реакция восстановления прекоррина-6x-является строго НАДФН-зависящей для P. denitreficans, НАДФН не может быть заменен на НАДН. Когда очищенный фермент /или активная фракция в ходе очистки, или даже неочищенный ферментативный экстракт/ инкубируется в условиях количественного определения активности, но в отсутствие SAM и дигидропрекоррин-6x-метилазы, то в таком случае продукт реакции может быть очищен методом ВЭЖХ в системе, описанной для очистки прекоррина-6x /смотри пример 6.1.4.-d/. После освобождения от солей и этерификации /4%-й раствор серной кислоты в метаноле, 20oC, 24 часа, атмосфера аргона/ соответствующей сложный эфир имеет массу m/z 1008. Следовательно, продуктом реакции, катализируемой прекоррин-6x-редуктазой, является дигидропрекоррин-6x-называемый также прекоррин-6y.
6.1.8. Идентификация протеина COBQ, кодируемого геном CobQ
a/ Количественное определение активности кобировой кислоты-синтазы
Этот пример иллюстрирует количественное определение ферментативной активности в процессе биосинтеза кобаламинов, которая до настоящего времени никогда не была описана. Речь идет о кобировой кислоте-синтазе. Этот фермент катализирует амидирование периферийных кислотных карбоксильных функций в положениях b, d, e и g на корриновом кольце /смотри фиг. 19, приложение 68/. Донором NH2-группировок является L-глутамин, а каждая реакция амидирования сопровождается расходованием одной молекулы АТФ.
Подлежащая количественному определению фракции инкубируется в темноте при температуре 30oC в течение 60 минут в 250 мкл 0,1 М буферного раствора Трис-гидрохлорида с pH 7,5, содержащего 1 мМ ДТТ, 1 мМ ЭДТА, 1 мМ АТФ, 2,5 мМ MgCl2, 1 мМ глутамина, 10 мкМ ди- или пентаамида Ado-кобириновой кислоты. Реакция прекращается путем прибавления 25 мкл 0,1 М водного раствора цианида калия. После нагревания при температуре 80oC в течение 10 минут и центрифугирования с ускорением 3000 xg в течение 10 минут образованные соединения, находящиеся во всплывшей фазе, анализируются методом ВЭЖХ. Единица активности определяется как количество фермента, необходимое для генерирования 1 нмоль амидных функций за час в этих условиях.
Диамид и пентаамид 5'-деокси-5'-аденозил/Ado/-кобириновых кислот выделяют из культур штамма SC510 в среде PS4, используя метод, принцип которого описан в примере 9.
b/ Очистка кобировой кислоты-синтазы
Исходя из описанного в примере 6.1.8-a количественного определения, осуществляется очистка кобировой кислоты-синтазы из Pseudomonas denitrificans, как описывается ниже.
В типичном эксперименте по очистке 6 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL618 /смотри примере 4.5.2/, обрабатываются ультразвуком в 15 мл 0,1 М буферного раствора Трис-HCl с pH 7,7, содержащего 1 мМ ДТТ, 1 мМ ЭДТА. После центрифугирования /ускорение 50000 xg, продолжительность 1 час/ экстракт доводится до 20%-й концентрации глицерина (объем/объем). К 8,5 мл неочищенного экстракта /203,5 мг протеинов/ прибавляют 24 мл 10 мМ буферного раствора Трис-HCl, содержащего 1 мМ ДТТ, 20% глицерина. Раствор вводится в колонку с Моно-Q HR 10/10 /Фармация/ с расходом 2 мл/мин, приведенную в равновесие с 50 мМ буферного раствора Трис-HCl при pH 7,7, содержащего 1 мМ ДТТ, 20% глицерина. Протеины элюируется с линейным градиентом 0,5 М NaCl, затем активные фракции объединяются и доводятся до концентрации 1 мМ ЭДТА. Раствор доводится до концентрации 0,85 М сульфата аммония и вводится в колонку с Фенил-Суперозой HR 5/5 /Фармация/, приведенную в равновесие с буферным раствором Трис-HCl при pH 7,7, содержащим 1 мМ ДТТ, 0,85 М сульфата аммония, затем протеины элюируются с линейным уменьшающимся градиентом от 0,85 М до 0 М сульфата аммония. Фракции немедленно доводятся до концентрации 20% глицерина. Активная фракции концентрируется до объема 2,5 мл путем ультрафильтрации и хроматографируется на колонке с РД 10 /Фармация/, приведенной в равновесие и элюируемой при помощи 50 мМ буферного раствора Трис-HCl с pH 8,3, содержащего 1 мМ ДТТ, 20% глицерина (объем/объем). Протеиновая фракция собирается и вводится в колонку с Моно-Q HR 5/5, приведенную в равновесие с тем же самым буферным раствором, затем протеины элюируются с линейным градиентом 0,5 М NaCl. Гель-проникающая хроматография на Био-Сил 250 /Био-Рад/ в среде 50 мМ буферного раствора Трис-HCl с pH 7,5, содержащего 1 мМ ДТТ, 20% глицерина, 0,1 М NaCl, позволяет окончательно получить протеин, чистый более чем на 97%. Он не имеет никакого загрязняющего протеина по данным метода PAGE-SDS. Эта чистота подтверждается единственность NH2-оканчивающейся последовательности. Его молекулярный вес по этому методу составляет 57000. Различные стадии очистки кобировой кислоты-синтазы вместе с их фактором очистки и их выходом приведены в таблице 12.
Очень высокая степень чистоты очищенного протеина, а также постоянство отношения активностей амидирования диамида и пентаамида кобириновых кислот на протяжении всего способа очистки протеина /смотри таблицу 12/ недвусмысленно показывают, что один и тот же протеин ответственен за четыре активности амидирования корринового кольца в положениях b, d, e и g.
NH2-Оканчивающаяся последовательность кобировой кислоты-синтазы из Pseudomonas denitreficans была определена, как описано ранее. Были идентифицированы шестнадцать остатков:
Thr-Arg-Arg-Ile-Met-Leu-Gly-Thr-Gly-Ser-Asp-Val-Gly-Lys-Ser
NH2-Оканчивающаяся последовательность протеина COBQ /фиг. 47/ точно соответствует этой последовательности, если только в последовательности, представленной на фиг. 47, метионин предшествует пептидной последовательности, определенной в результате непосредственного составления последовательности. Отсюда следует, что аминотермальный метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassat et Bauer 1987/. Молекулярный вес очищенной кобировой кислоты-синтазы оценивается методом электрофореза PAGE-SDS как 57000. Протеин COBQ имеет молекулярный вес, выведенный из его последовательности, величиной 52000 /фиг. 47/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно показывают, что протеин COBQ соответствует кобировой кислоте-синтазе. Ген cobQ является структурным геном кобировой кислоты-синтазы.
6.1.9. Идентификация протеина COBO, кодируемого геном cobO
a/ Количественное определение активности коб/1/аламинаденозилтрансферазы /ЕС 2.5.1.17/.
Этот пример иллюстрирует количественное определение ферментативной активности, непосредственно связанной с процессом биосинтеза кобаламинов. Речь идет о коб/1/аламинаденозилтрансферазе /ЕС 2.5.1.17/. Этот фермент был обнаружен в клетках бактерий /Ohta et al., 1976; Brady et al. 1962/ и животных /Fenton et al., 1978/. Он был очищен, исходя из Clostridium tetranomorphum/ Vifols et al. 1966/. Фракции, содержащие активность коб/1/аламинаденозилтрансферазы /приблизительно 20 единиц/, инкубируются в анаэробных условиях при температуре 30oC в течение 15 минут с защитой от света в 1 мл 0,2 М буферного раствора Трис-HCl с pH 8,0 в присутствии 5 мМ ДТТ, 400 мкМ /8-14C/ АТФ (2,5 мкКи/мкмоль), 800 мкМ MnCl2, 50 мкМ гидроксокобаламина или диаквокобинамида и 3 мг KBH4. Затем реакция прекращается в результате нагревания при температуре 80oC в течение 10 минут, в после центрифугирования с ускорением 15000 xg в течение 5 минут анализируют 200 мкл всплывшей фазы методом ВЭЖХ /Gimsing et al. 1986; Jacobsen et al. 1986/.
Единица ферментативной активности определяется как количество фермента, необходимое для генерирования 1 нмоль аденозилкорриноида за минуту в этих условиях.
b/ Очистка активности коб/1/аламинаденозилтрансферазы
Исходя из описанного в примере 6.1.9-a количественное определения, осуществляется очистка коб/1/аламинаденозилтрансферазы из Pseudomonas denitrificans, как описывается ниже.
В типичном эксперименте по очистке 10 г увлажненных клеток штамма SC510 RifR, в котором был увеличен ген cobO, суспендируются в 20 мл 0,2 М буферного раствора Трис-HCl с pH 8 и обрабатываются ультразвуком в течение 40 минут при температуре 4oC. Затем неочищенный экстракт извлекается путем центрифугирования в течение 1 часа с ускорением 50000 xg и освобождается от солей на колонках РД10 /Фармация/, приведенных в равновесие с 50 мМ буферным раствором Трис-HCl с pH 8,0, содержащим 5 мМ ДТТ /буферный раствор A/. Затем протеиновый раствор фракционируется /280 мг протеинов в каждой хроматографической фракции/ на колонке с Моно-Q HR 10/10 /Фармация/ с градиентом от 0 до 0,5 М KCl в буферном растворе A, потом фракции, содержащие активность, объединяются, концентрируются путем ультрафильтрации и хроматографируются на колонке с фенил-Суперозой HR 10/10 /Фармация/ с линейным уменьшающимся градиентом сульфата аммония /от 1,7 до 0 М/, причем колонка приводится в равновесие с 0,1 М буферным раствором Трис-HCl при pH 8,0, содержащим 5 мМ ДТТ. Для улучшения очистки протеин окончательно хроматографируется /после концентрирования путем ультрафильтрации/ на колонке с Био-Сил 250 /Био-Рад/, элюируемой при помощи 50 мМ буферного раствора Трис-HCl с pH 7,5, содержащего 0,1 М NaCl, 5 мМ ДТТ.
По окончании этой стадии фермент является чистым более чем на 95%. Он не имеет никакого загрязняющего протеина по данным метода PAGE-SDS. Его молекулярный вес по этому методу составляет 28000. Эта степень чистоты подтверждается единственностью NH2-оканчивающейся последовательности. Различные стадии очистки коб/1/аламинаденозилтрансферазы вместе с их коэффициентом очистки и их выходом приводятся в таблице 13, для двух следующих субстратов: диаквокобинамида /a/ и гидроксокобаламина /b/. Эти результаты подтверждают отсутствие специфичности этого фермента по отношению к природе корриноидного субстрата. С другой стороны, все корриноиды в процессе биосинтеза между диамидом кобириновой кислоты и B12 были выделены /Blanche et al., неопубликованные результаты/ в их природной форме и обнаружены находящимся в виде кофермента. Это показывает, что природный субстрат коб/1/аламинаденозилтрансферазы представляет собой a,c-диамид кобириновой кислоты.
NH2-Оканчивающаяся последовательность коб/1/аламинаденозилтрансферазы из Pseudomanas denitrificans, очищенной, как описано в примере 6.1.9-b, была определена, как описано ранее. Были идентифицированы 13 остатков:
Ser-Asp-Glu-Thr- ? -Val-Gly-Gly-Glu-Ala-Pro-Ala-Lys-Lys
NH2-Оканчивающаяся последовательность протеина COBO /фиг. 47/ точно соответствует NH2-оканчивающейся последовательности коб/1/аламинаденозилтрансферазы, если только в последовательности, представленной на фиг. 47, метионин предшествует пептидной последовательности, определенной в результате непосредственного составления последовательности. Отсюда следует, что аминотермальный метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassat et Bauer, 1987/. Молекулярный вес очищенной коб/1/аламинаденозилтрансферазы оценивается методом электрофореза PAGE-SDS как 28000. Протеин COBO имеет молекулярный вес, выведенный из его последовательности, величиной 24000 /фиг. 47/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно показывают, что протеин COBO соответствует коб/1/аламинаденозилтрансферазе. Ген cobO является структурным геном коб/1/аламинаденозилтрансферазы.
6.1.10. Идентификация протеина COBN, кодируемого геном cobN
a/ Выявление активности по превращению, a, c-диамида гидробириновой кислоты в a,c-диамид кобириновой кислоты
Этот пример иллюстрирует выявление ферментативной активности, непосредственно связанной с процессом биосинтеза кобаламинов, которая до настоящего времени никогда не была описана. Речь идет об активности по превращению a, c-диамида гидробириновой кислоты в a,c-диамид кобириновой кислоты.
Эта активность выявляется, помимо прочего, в результате следующего типичного эксперимента. Неочищенный экстракт штамма SC510 RifR получается путем обработки ультразвуком 10 г увлажненных клеток в 20 мл 0,2 М буферного раствора Трис-HCl с pH 8,0 с последующим удалением клеточных остатков в результате центрифугирования в течение 1 часа с ускорением 50000 xg. Инкубируют 1000 мг протеинов из этого экстракта в течение 1 часа при температуре 30oC с диамидом гидробириновой кислоты, меченным углеродом-14 (32 нмоль; 50 мкКи/мкмоль), в 40 мл 0,2 М буферного раствора Трис-HCl с pH 8,0, содержащего 7 мМ АТФ, 200 мкМ CoCl2. Реакция останавливается в результате прибавления 7,5 мл 1 М KH2PO4 и 6 мл 0,3 М KCN с последующим нагреванием в течение 10 минут при температуре 80oC. После центрифугирования с ускорением 15000 xg в течение 15 минут анализ методом ВЭЖХ всплывшей фазы показывает: /1/ - образование в ходе инкубации 19,2 нмоль a,c-диамида кобириновой кислоты, имеющего ту же самую удельную радиоактивность, что и исходный a,c-диамид гидробириновой кислоты, и /2/ - исчезновение соответствующего количества последнего. Для подтверждения того, что речь идет именно об a,c-диамиде кобириновой кислоты, продукт очищается методом ВЭЖХ, потом этерифицируется в метаноле, содержащем 5% серной кислоты /18 часов, 20oC/. Аутеничность полученного пентаметилового сложного эфира a,c-диамида кобириновой кислоты доказывается методом TLC /относительно эталонного образца/ и методом масс-спектрометрии. Отметим, что в аналогичных условиях инкубации, когда радиоактивную метку вводят не в a,c-диамид гидробириновой кислоты, а в кобальт /используя кобальт-57/, то в процессе биосинтеза получается a,c-диамид кобириновой кислоты меченный кобальтом-57, и могут быть сделаны те же самые выводы.
a, c-Диамид гидробириновой кислоты, меченный углеродом-14, получается следующим образом: гидробириновую кислоту получают в процессе биосинтеза in vitro, используя /метил-14C/ SAM, потом превращают в a,c-диамид гидробириновой кислоты и очищают методом ВЭЖХ, как описано в примере 6.1.2.
Это исследование показывает, что внедрение кобальта происходит на уровне a, c-диамида гидробириновой кислоты в P. denitrificans. В описанных условиях гидробириновая кислота не является субстратом ферментативной хелатизации посредством кобальта.
b/ Количественное определение и очистка протеина из штамма SC510 RifR, задействованного в превращении a,c-диамида гидробириновой кислоты в a,c-диамид кобириновой кислоты
Фракция, подлежащая количественному определению /от 0,5 до 2 единиц/, инкубируется в течение 60 минут при температуре 30oC с 50 мкл неочищенного экстракта штамма SC510 RifR, полученного, как описано выше, 7 мМ АТФ, 200 мкМ CoCl2, 7 мкМ a,c-диамида гидробириновой кислоты, меченного углеродом-14 (50 мкКи/мкмоль) в 400 мкл 0,1 М буферного раствора Трис-HCl с pH 8,0. Реакция прекращается в результате прибавления 75 мкл 1 М KH2PO4 и 60 мкл 0,3 М KCN с последующим нагреванием в течение 10 минут при температуре 80oC. После центрифугирования с ускорением 15000 xg в течение 15 минут всплывшая фаза анализируется методом ВЭЖХ для количественного определения образованного a, c-диамида кобириновой кислоты /смотри пример 9/. Единица ферментативной активности определяется как количество фермента, необходимое для генерирования 1 нмоль a,c-диамида кобириновой кислоты за час в этих условиях. В этих условиях оказывается, что экстракты штамма SC510 RifR, в который была введена плазмида pXL1909 /смотри пример 4.5.2/, имеют активность между значениями в 20 и 50 раз более высокими, чем экстракты штамма SC510 RifR. Именно на этой основе очищается протеин, единственный ответственный за это увеличение активности.
В типичном эксперименте по очистке 10 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL 1909, суспендируются в 20 мл 0,2 М буферного раствора Трис-HCl с pH 8,0 и обрабатываются ультразвуком в течение 30 минут при температуре 4oC. Затем неочищенный экстракт извлекается путем центрифугирования в течение 1 часа с ускорением 50000 xg и освобождается от солей на колонках PD10 /Фармация/, приведенных в равновесие с 0,1 М буферным раствором Трис-HCl при pH 8,0 /буферный раствор A/. Затем протеиновый раствор фракционируется /213 мг протеинов в каждой хроматографической фракции/ на колонке Моно-Q HR 10/10 /Фармация/ с градиентом от 0 до 0,5 М KCl в буферном растворе A, потом фракции, содержащие активность объединяются, концентрируются путем ультрафильтрации, обессоливаются на колонках PD10 /Фармация/, приведенных в равновесие с 0,1 М буферным раствором Трис-HCl при pH 7,2 /буферный раствор B/, и хроматографируются на колонке Моно-Q HR 10/10 /Фармация/ с градиентом от 0 до 0,5 М KCl в буферном растворе B. Фракции, содержащие активность, объединяются, концентрируются путем ультрафильтрации, обессоливаются на колонках PD10 /Фармация/, приведенных в равновесие с буферным раствором B, и хроматографируются на колонке Моно-Q HR 5/5 /Фармация/ с градиентом от 0 до 0,5 М KCl в буферном растворе B. Для улучшения очистки протеин окончательно хроматографируется на колонке Био-Сил 250 /Био-Рад/, элюируемой смесью: 20 мМ фосфата калия - 50 мМ сульфата натрия, pH 6,8.
После этой стадии фермент является чистым более чем на 95%. Он не содержит никакого загрязняющего протеина по данным метода PAGE-SDS Его молекулярный вес по этому методу составляет 135000. Эта степень чистоты подтверждается единственностью NH2-оканчивающейся последовательности. Различные стадии очистки протеина штамма SC510 RifR, задействованного в превращении a, c-диамида гидробириновой кислоты в a,c-диамид кобириновой кислоты вместе с их коэффициентом очистки и их выходом приводятся в таблице 14.
NH2-Оканчивающаяся последовательность этого протеина, очищенного, как описано в примере 6.1.10-b, была определена, как описано ранее. Были идентифицированы шесть остатков:
His-Leu-Leu-Leu-Ala-Gln
NH2-Оканчивающаяся последовательность протеина COBN /фиг. 47/ точно соответствует NH2-оканчивающейся последовательности очищенного протеина, если только в последовательности, представленной на фиг. 47, метионин предшествует пептидной последовательности, определенной в результате непосредственного составления последовательности. Отсюда следует, что аминотермальный метионин действительно отщепляется in vivo под действием метионинаминопептидаза /Ben Bassat et Bauer, 1987/. Молекулярный вес очищенного протеина оценивается методом электрофореза PAGE-SDS как 135000. Протеин COBN имеет молекулярный вес, выведенный из его последовательности, величиной 138000 /фиг. 47/. Соответствия между NH2-оканчиващимися последовательностями и молекулярными весами ясно показывает, что протеин COBN соответствует протеину, задействованному в превращении a,c-диамида гидробириновой кислоты в a,c-диамид кобириновой кислоты. Ген cobN является, следовательно, структурным геном этого протеина.
6.1.11. Идентификация протеина COBP, кодируемого геном CobP
a/ Количество определение активности кобинамидкиназы
Этот пример иллюстрирует количественное определение ферментативной активности в процесс биосинтеза кобаламинов, которая до настоящего времени никогда не была исследована. Речь идет от активности кобинамидканизы. Она катализирует АТФ-зависящее фосфорилирование гидроксильной группировки /R/-1-амино-2-пропанольного остатка Ado-кобинамида с образованием кобинамидофосфата.
Фракция, подлежащая количественному определению, инкубируется в темноте при температуре 30oC в течение 60 минут в 500 мкл 0,1 М буферного раствора Трис-HCl с pH 8,8, содержащего 1 мМ ЭДТА, 1 мМ АТФ, 2,5 мМ MgCl2. и 16 мкМ Ado-кобинамида /Blanche et al., 1989/. Реакция прекращается при добавлении 500 мкл 20 мМ водного раствора цианида калия. После нагревания при температуре 80oC в течение 10 минут и центрифугирования с ускорением 500 xg в течение 10 минут образовавшийся кобинамидфосфат, находящийся во всплывшей фазе, количественно определяется методом ВЭЖХ /смотри пример 9/ при использовании следующего упрощенного линейного градиента: от 25% до 30% буферного раствора B в буферном растворе A за 15 минут, потом от 30% до 100% буферного раствора B за 12 минут и 3 минуты при 100% буферного раствора B.
Единица активности определяется как количество фермента, необходимое для генерирования 1 нмоль кобинамидофосфата, исходя из кобинамида за час в этих условиях.
b/ Количественное определение активности кобинамидфосфатгуанилилтрансферазы
Этот пример иллюстрирует количественное определение ферментативной активности в процессе биосинтеза кобаламинов, которая до настоящего времени никогда не была исследована. Речь идет об активности кобинамидфосфатгуанилилтрансферазы. Она катализирует присоединение GMP-части молекулы GTP к Ado-комбинамидосфату, генерируя таким образом молекулу GDP-кобинамида и высвобождая молекулу пирофосфата.
Эта активность количественно определяется в тех же самых условиях, то и комбинамидкиназа, если только Ado-кобинамидфосат /16 мкМ/ /Blanche et al., 1989/ и GTP /2 мМ/ заменяют соответственно Ado-кобинамид и АТФ в ходе инкубации.
Единица активности определяется как количество фермента, необходимое для генерирования 1 нмоль GDP-кобинамида, исходя из кобинамидофосфата за час в этих условиях.
c/ Очистка кобинамидкиназы
Исходя из количественного определения, описанного в примере 6.1.11-а, осуществляется очистка кобинамидкиназы из Pseudomonas denitrificans, как описано ниже.
В типичном эксперименте оп очистке 5 г увлажненных клеток штамма SC510 RifR, в который была введена плазмида pXL623 /смотри пример 4.5.2/, обрабатываются ультразвуком в 20 мл 0,1 М буферного раствора Трис с pH 7,6 /буферный раствор A/. После центрифугирования /50000 xg в течение 1 часа/ и диализа в течение 4 часов относительно буферного раствора A вводят 4,5 мл удержанного вещества в колонку Моно-Q HR 10/10 /Фармация/, приведенную в равновесие с буферным раствором A. Протеины элюируются с линейным градиентом 0,4 М NaCl, затем объединенные активные фракции пропускаются через колонку с РД-10 /Фармация/, приведенную в равновесие со смесью: 30 мМ Трис-HCl - 5 мМ фосфата калия - 5 мкМ хлорида кальция, с pH 7,6 /буферный раствор B/. Протеиновый раствор фракционируется на колонке Био-Гель HPHT /Био-Рад/, приведенной в равновесие с буферным раствором B и элюируемой с градиентом от 5 до 350 мМ фосфата калия. Активные фракции объединяются и доводятся до концентрации 500 мМ сульфата аммония, потом фракционируются на колонке с Фенил-Суперозой HR 5/5 /Фармация/, элюируемой с уменьшающимся градиентом сульфата аммония. Фракция, содержащая активность, окончательное очищается на колонке Моно-Q HR 5/5 в буферном растворе Трис-HCl с pH 7,3. По окончании этой стадии протеин является чистым более чем на 97%. Он не содержит никакого загрязняющего протеина по данным метода PAGE-SDS. Эта чистота подтверждается единственностью NH2-оканчивающейся последовательности. Его молекулярный вес по этому методу составляет 20000. Различные стадии очистки кобинамидкиназы вместе с их коэффициентом очистки и их выходом приводятся к таблице A.
Фракции, содержащие активность кобинамидкиназы, проявляют также активность кобинамидфосфатгуанилилтрансферазы. С другой стороны, как это показывают результаты, представленные в указанной выше таблице, отношение этих двух активностей остается постоянным на протяжении всей очистки. Наконец, очищенный протеин имеет очень высокую степень очистки, превышающую 97%. Совокупность этих результатов, следовательно, показывает недвусмысленно, что один и тот же протеин является ответственным за две последовательные активности, представляющие собой кобинамидкиназу и кобинамидфосфатгуанилилтрансферазу, в процессе биосинтеза кобаламинов в Pseudomonas denifrificans.
d/ NH2-Оканчивающая последовательность кобинамидкиназы-кобинамидфосфатгуанилилтрансферазы Psendomonas denitrificans и идентификация структурного гена Psendomonas denitrificans, кодирующего эту активность.
NH2-Оканчивающая последовательность кобинамидкиназы-кобинамидфосфатгуанилилтрансферазы Psendomonas denitrificans была определена, как описано ранее. Были идентифицированы десять остатков:
Ser-Ser-Leu-Ser-Ala-Gly-Pro-Val-Leu-Val
NH2-Оканчивающаяся последовательность протеина COBP / фиг. 47/ точно соответствует этой последовательности, если только в последовательности, представленной на фиг. 47, метионин предшествует пептидной последовательности, определенной в результате непосредственного составления последовательности. Отсюда следует, что аминотермальной метионин действительно отщепляется in vivo под действием метионинаминопептидазы /Ben Bassad et Bauer, 1987/. Молекулярный вес очищенной кобинамидкиназы-кобинамидфосфатгуанилилтрансферазы, оцененный методом электрофореза PAGE-SDS, составляет 20000. Протеин COBP имеет молекулярный вес, выведенный из его последовательности, величиной 19500 /фиг. 47/. Соответствия между NH2-оканчивающимися последовательностями и молекулярными весами ясно показывают, что протеин COBP соответствует кобинамидкиназе-кобинамидфосфатгуанилилтрансферазе. Ген cobP является структурным геном кобинамидкиназы-кобинамидфосфатгуанилилтрансферазы.
6.2. - Определение свойств протеинов COB в результате измерения накопленных промежуточных соединений биосинтеза
Этот пример иллюстрирует, каким образом возможно приписать протеину COB из Pseudomonas denitrificans ферментативную активность. Эта активность приписывается согласно полученным данным, относящимся к накопленным промежуточным продуктам биосинтеза у одного или нескольких мутантов Cob, блокированных на рассматриваемой стадии. Действительно, если мутант накапливает промежуточный продукт биосинтеза, то очень вероятно, что этот мутант блокируется на стадии, которая имеет в качестве субстрата рассматриваемое промежуточное соединение.
6.2.1. Свойства протеинов COBC и COBD
Мутанты Cob G 643 /Agrobacterium tumefaciens/ и G 572 Pseudomonas pufida/, уже описанные в примерах 1 и 4, блокируются на стадии, соответствующей протеину COBC. Действительно, эти два мутанта не комплементируются инактивирующими включениями транспозонов Тп5, которые находятся в гене cobC. Два штамма G 643 и G 572, а также немутированные родственные штаммы /C58-C59 RifR и KT 2440 RifR (Cameron et al., 1989) /культивировались в среде PS4' для A. tumefaciens и PS4'' для P.putida /PS4' и PS4'' соответствуют среде PS4, содержащей соответственно в 100 и 1000 раз меньше кобальта, чем описанная ранее среда PS4/ в течение 3 дней, как это описано выше. К культурам прибавляли 57CoCl2 (2,5 мкКи/0,1 мкмоль для культуры объемом 25 мл). Внутриклеточные корриноиды выделялись в их природной форме и идентифицировались по их поведению в ВЭЖХ. Родственные штаммы не накапливают корриноиды, отличающиеся от кофермента B12. Оба мутанта, G 643 и G 572, накапливают аденозилкобировую кислоту в отношениях, соответствующих 11% и 6%, Эти доли в % рассчитываются относительно уровня кофермента B12, синтезированного родственным штаммом. Помимо кобириновой кислоты, мутант G 643 накапливает пентаамид кобировой кислоты в отношении 2%; пентаамид кобириновой кислоты является промежуточным соединением, которое предшествует кобировой кислоте. Исследование этих мутантов показывает, что они блокируются после кобировой кислоты. Все эти мутанты Cob блокируются либо между уро'геном III и кобинамидом, либо между кобинамидом и кобаламинами. Мутанты G 643 и G 572 блокируются между уро'геном III и кобинамидом. Однако, если эти мутанты блокируются перед кобинамидом и накапливают оба кобировую кислоту, то протеины, которых они кодируют, могут участвовать только на ферментативной стадии /называемой кобинамидсинтазой/, которая катализирует амидирование кобировой кислоты аминопропанольным остатком с образованием кобинамида; они могут также, при случае, участвовать в синтезе субстрата реакции, которая дает аминопропанол, если только это не сам аминопропанол. Ген cobC кодирует протеин, который является либо кобамидсинтазой, либо одной из ее составных частей.
Мутант Cob G 634 Agrobacterium tumefaciens, который блокируется на стадии, соответствующей гену cobD, анализировался тем же самым образом. Этот мутант не комплементируется инактивационными включениями в гене cobD /пример 4.1/. Единственным внутриклеточным корриноидом, найденным у этого мутанта, является аденозилкобировая кислота. Как и предыдущие мутанты, этот мутант кодирует протеин, участвующий в превращении кобировой кислоты в кобинамид или же, при случае, в синтезе другого субстрата реакции.
Эти два различных гена /cobC и cobD/ кодируют два протеина, которые участвуют на одной и той же стадии.
6.2.2. Свойства протеинов COBF - COBM
Были изучены уже описанные мутанты Agrobacterium tumefaciens, для которых известно, согласно описанному в примере 4.2 исследование, в каких генах каждый из них блокируется. Это следующие мутанты: G 612 /cobF/, G 615 /cobG/, G 616 /cobH/, G 613 /cobI/, G 611 /cobJ/, G 620 /cobK/, G 638 /cobL/ и G 609 /cobM/; в скобках мы указали ген Pseudomonas denitrificans, ответственный за комплектацию этих мутантов /пример 5/, который следовательно, соответствует гену, мутируемому в этом мутанте. Эти мутанты культивировались в среде PS4, как это описано ранее с меченным кобальтом. После инкубации в течение четырех дней мутанты анализировались по их внутриклеточному содержанию корриноидов и кобальтокорриноидов (смотри примеры 6.1.2 и 9 и табл. 15).
Эти результаты показывают, что все мутанты не накапливают никакого корриноида /за исключением инактивированного в гене cobF мутанта G 612, который сам накапливает кобинамид, но в небольшом масштабе, эквивалентном 2,2% кобаламинов, синтезируемых немутированным штаммом/. Однако некоторые мутанты /G 612, G 615 и G 616/ имеют уровень кобаламинов, который составляет более 10% от уровня кобаламинов родственного штамма. Вероятно, что все эти мутанты блокируются по крайне мере до диамида кобириновой кислоты. Все эти мутанты накапливают гидробириновую кислоту и диамид гидробириновой кислоты в количествах, меньших чем для немутированного штамма; следовательно, они с большей вероятностью блокируются до гидробириновой кислоты. Мы можем сделать вывод, что все гены cobF - cobG кодируют протеины, которые участвуют в синтезе до гидробириновой кислоты. Известно, что мутант G 613 мутируется в гене cobI, который кодирует SП2MT, участвующий в синтезе именно до гидробириновой кислоты. Для этого мутанта результаты настоящего примера, относящиеся к накоплению промежуточных продуктов, находятся в хорошем согласии с инактивированной стадий для этого мутанта, а именно в том, что этот мутант не накапливает никакого промежуточного соединения после гидробириновой кислоты в масштабе, превышающем то, что наблюдают с немутированным штаммом. Этот результат для генов cobF, cobJ, cobL и cobM связан с результатами примера 6.4, где предполагается, что эти гены кодируют протеины, которые катализируют SAM-зависящие переносы метила и, следовательно, которые участвуют до гидробириновой кислоты. За исключением гена cobI, который является структурным геном SП2MT, эти гены участвуют после прекоррина-3. Действительно, поскольку это не структурные гены для SYMT и SП2MT, то они обязательно участвуют потом, т.е. после прекоррина-3 /все гены cob, описанные в настоящем изобретении, участвуют между уро'геном III и кобаламинами/. Эти гены cobF - cobH и cobJ - cobM кодируют ферменты, которые участвуют между прекоррином-3 и гидробириновой кислотой.
6.2.3. Свойства протеинов COBS и COBT
Мутант G 2035, описанный в примерах 1 и 4.3, блокируется на стадии, соответствующей протеину COBS. Мутант G 2037, описанный в примере 1, блокируется на стадии, соответствующей протеину COBT. Эти штаммы, а также родственный штамм /Agrobacterium tumefaciens C 58C9 RifR/ культивируются в среде PS4' /речь идет о среде PS4, где концентрация хлорида кобальта является в 100 раз меньшей, чем в среде PS4/ в присутствии радиоактивного кобальта в виде 57COCl2 в течение 3 дней, их внутриклеточное содержание кобальтокорриноидов подвергается анализу, также как и содержания корриноидов, как это уже было описано выше /смотри пример 6.2.2/. Штаммы G 2035 и G 2037 не накапливают корриноиды, а большие концентрации /превышающие концентрации, наблюдаемые с родственным штаммом/ гидробириновой кислоты и моно- и диамидов гидробириновой кислоты имеются только в случае штамма G 2035. Этот мутант, вероятно, блокируется на стадии, расположенной после диамида гидробириновой кислоты и до диамида кобириновой кислоты. Следовательно, ген cobS будет колировать ферменты, задействованные в превращении диамида гидробириновой кислоты в диамид кобириновой кислоты; этот протеин, следовательно, может принимать участие либо в процессе внедрения кобальта, либо в реакции восстановления кобальта, находящегося в a,c-диамиде неаденозилированной кобириновой кислоты. Напротив, мутант G 2037 будет блокироваться на стадии, распложенной выше гидробириновой кислоты. Ген cobT будет кодировать протеин, задействованный на ферментативной стадии выше гидробириновой кислоты и ниже прекоррина-3 /другие структурные гены, кодирующие ферменты, задействованные ниже прекоррина-3, уже были идентифицированы/. Другая возможность для протеина COBT заключается в том, что он участвует, как это предложено в примере 5, в качестве протеина, связывающего кобальт, и/или в качестве протеина, который взаимодействует с другим/и, протеином /протеинами/ за счет своей кислотной части.
6.2.4. Свойства протеина COBV
Мутанты G 2039 и G 2040, описанные в примерах 1 и 4.4, блокируются на стадии, соответствующей протеину COBV. Эти штаммы, а также родственный штамм культивируется в среде PS4' в течение 3 дней в присутствии радиоактивного кобальта в виде 57CoCl2, затем их внутриклеточное содержание кобальтокорриноидов анализируется и определяется содержание корриноидов, как это описано в примере 9. Штаммы G 2039 и G 2040 накапливают кобировую кислоту, кобинамидфосфат и GDP-кобинамид. Эти мутанты, вероятно, блокируются на ферментативной стадии ниже GDP-кобинамида. Ген cobV будет кодировать фермент, задействованный в превращении GDP-кобинамида в кобаламин, смотри фиг. 5. Этот результат находится в хорошем согласии с активностью кобаламин-/5'-фосфат/-синтазы протеина COBV с Ado-GDP-кобинамидом в качестве субстрата.
6.3. - Определение активности протеинов COB в результате исследований сродства по отношению к SAM
Этот пример иллюстрирует, каким образом возможно, исходя из очищенных протеинов COB Pseudomonas denitrificans выявить in vitro активностью связывания SAM. Если протеин COB обладает такой активностью, то это означает, что этот протеин COB является метилтрансферазой из процесса биосинтеза и что он участвует в одном из переносов восьми метильных группировок, которые происходят между уро'геном III и кобириновой кислотой.
6.3.1. Тест на сродство в SAM для очищенного протеина
Этот тест основан на принципе, в соответствии с которым метилтрансферазы из процесса биостинтеза кобаламинов обязательно имеют сайт связывания SAM. Этот сайт должен выявляться за счет родства к SAM, более высокого, чем для любого протеина, который не связывает специфически SAM. После инкубации исследуемого протеина в присутствии избытка радиоактивного SAM, этот протеин отделяется от свободного SAM методом гельпроникающей хроматографии. Радиоактивность, обнаруженная во фракции с молекулярным весом протеина, соответствует SAM, связанному в ходе инкубации. Хроматография осуществляется при температуре 2oC, чтобы максимально огранивать высвобождение связанного SAM в ходе разделения.
Протеин /приблизительно 10 мкг/ инкубируется в течение 10 минут при температуре 30oC в 200 мкл 0,1 М буферного раствора Трис-HCl с pH 7,7, содержащего 5 нмоль /метил-3H/-SAM /1 мкКи/. После инкубации 100 мкл смеси немедленно вводят в колонку с TSK-125 /Био-Рад/, элюируемого с расходом 1 мл/мин смесью 50 мМ сульфата натрия /20 мМ дигидрофосфата натрия при pH 6,8, рекомендуемой поставщиком для этой колонки. Фракции по 0,5 мл собираются и обсчитываются на жидкостном сцинтилляционном счетчике. Времена удержания протеина и SAM получаются непосредственно после регистрации поглощения элюата при 280 нм.
6.3.2. Изучение in vitro связывания SAM на протеинах COBA и COBF Pseudomonas denitrificans.
а/ Очистка протеинов COBF и COBA
Протеин COBF из Pseudomonas denitrificans очищается, как описано ниже. В типичном эксперименте по очистке 5 г увлажненных клеток штамма SC150 RifR, в который была введена плазмида pXL 1546 /смотри пример 7.3./, полученных после культивирования в среде PS4, снова суспендируются в 30 мл 0,1 М буферного раствора Трис-HCl с pH 7,7 и обрабатываются ультразвуком в течение 15 минут при температуре 4oC. Неочищенный экстракт затем извлекается путем центрифугирования в течение 1 часа с ускорением 50000 g, а всплывшая фаза пропускается через колонку с ДЕАЕ-Сефадексом /1 мл геля/ для удаления присутствующих тетрапиррольных соединений. Затем 10 мг протеинов /0,7 мл/ этого экстракта вводятся в колонку с Моно-Q HR 5/5, приведенную в равновесие с тем же самым буферным раствором. Протеины элюируются с линейным градиентом KCl/от 0 до 0,25 М/. Протеин COBF элюируется с 0,20 М KCl. Он разбавляется в два раза буферным раствором 0,1 М Трис-HCl с pH 7,7 и очищается второй раз на Моно-Q HR 5/5. Электрофорез при использовании PAGE-SDS с обнаружением при помощи голубого Комасси применяется для визуального наблюдения за протеином. Этот метод, с другой стороны, показывает, что протеин COBF имеет чистоту примерно 95% после этой стадии очистки. NH2-оканчивающаяся последовательность очищенного протеина была реализована, как это описано ранее. Две NH2-Оканчивающиеся последовательности появляются в одно и то же время на каждый цикл деградации; это следующие последовательности /в указанных соотношениях/:
Последовательность I соответствует NH2-оканчивающейся последовательности протеина COBF, которая приводится на фиг. 16, если только именно аминотерминальный метионин отщепляется в соответствии с уже сформулированными правилами /Hirel et al., 1989/ под действием метионинаминопептидазы /Ben Bassat et Bauer, 1989/. Последовательность 2, присутствующая в наибольшем количестве, соответствует тому же самому протеину, но у которого начало трансляции будет происходить не с кодона ATG, инициирующего трансляцию, как мы предполагали, а с кодона, расположенного на 5 кодонов ниже на кодирующей фазе /фиг. 16/. Действительно, аминокислоты этой последовательности являются точно такими, которые находят на последовательности протеина COBF, начиная со второго метионина /аминокислота N 6/ этой последовательности /фиг. 16/. В этом случае аминотермальный метионин не отщепляется, что подтверждает уже сформулированные правила /Hirel et al., 1989/. У штамма SC510 RifR, несущего плазмиду pXL1546, имеются два начала трансляции: с одной стороны, начало, соответствующее колодцу метионина, расположенному на хорошем расстоянии /на нашей конструкции/ от последовательности Shine et Delgaino, и, с другой стороны, начало, которое соответствует второму кодону метионина, находящемуся на последовательности гена cobF, представленного на фиг. 16. Отсюда следует, что, вероятно, протеин COBF начинается не на метионине, указанном на фиг. 16, а на том, который находится на 5 аминокислот дальше.
Во всяком случае, этот результат показывает, что речь идет именно о протеине COBF, который выражается, и что последний выражается в виде, удлиненном на 4 аминокислоты. В ходе очистки очищаются обе протеиновые формы. В этом примере мы будем называть очищенным протеином COBF смесь этих двух очищенных протеинов.
Протеин COBA из Pseudomonas denitrificans очищается, как это описано ранее /Blanche et al., 1989/.
b/ Связывание SAM
Связывание SAM на этих двух протеинах изучается, как это описано ранее в примере 6.3.1-а. Сыворотка бычьего альбумина (СБА) и очищенный протеин COBH используются в качестве отрицательного контроля. Для протеинов COBA и COBF наблюдают пик радиоактивности на выходе из колонки с TSK-125, соответствующий времени выхода этих протеинов /фиг. 20/. В этом тесте протеин COBI имеет ту же самую способность связывания SAM. Напротив, в случае СБА и протеина COBH такие пики радиоактивности отсутствуют. Этот тест выявляет связывание in vitro SAM на протиенах COBA, COBI и COBF. Эти результаты показывают, что COBA, COBI и COBF представляют собой SAM-метилтрансферазы. Этот результат находится в полном согласии с активностями COBA и COBI, потому что речь идет соответственно о SYMT и SП2MT Pseudomonas denitrificans. Протеин COBF, следовательно, является, вероятно, SAM-метилтрансферазой процесса биосинтеза кобаламинов. Этот тест подтверждает, что COBF является метилтрансферазой.
6.4. - Определение активности протеинов COB в результате исследований гомологий последовательностей
Этот пример иллюстрирует, каким образом путем сравнений между последовательностями различных протеинов COB Pseudomonas denitrificans возможно обнаружить протеины COB, которые являются SAM-метилтроансферазами процесса биостинтеза кобаламинов.
Протеины COBI и COBA являются оба SAM-метилтрансферазами процесса биосинтеза. Эти два протеина сравнивались в соответствии с программной kanehisa, 1984. Это сравнение выявляет три участка с большой гомологией /фиг. 21/. В каждом из этих участков имеется более 45% строгой гомологии между этими двумя протеинами. Приводятся также три участка с большой гомологией между COBA CYSG /фиг. 22/; это те же самые участки COBA, которые имеют большую гомологию с COBI. Эти участки с большими гомологиями между COBA, CYSG и COBI имеют гомологию с другими протеинами COB. Речь идет о протеинах COBF, COBJ, COBL и COBM /фиг. 23/. Что касается участка 1, то протеины COBF, COBL и COBM имеют значительные гомологии по отношению ко всем протеинам Genpro, который представляет собой протеиновую вытяжку Genbank /версия 59/, увеличенную предполагаемыми кодирующими частями, превышающими 200 аминокислот, в соответствии с программой kanehisa /1984/. Что касается участка 2, то протеины COBJ, COBL COBM имеют значительные гомологии по отношению ко всем протеинам Genpro /версия 59/. Что касается третьего участка гомологии, то COBJ, COBL COBM имеют значительные гомологии по отношению ко всем протеинам Genpro /версия 59/. Сравнения последовательностей позволяют, следовательно, выявить, что четыре протеина COBF, COBJ, COBL и COBM имеют значительные гомологии с участками, сохранившими последовательности трех типов метилтрансфераз COBA, COBI и COBF. Протеины COBG, COBH и COBK не имеют значительных гомологий с сохранившимися участками метилаз. Протеин COBF имеет значительную гомологию с другими протеинами только на участке 1. Эти гомологии, вероятно, должны соответствовать тому, что все эти протеины являются метилтрансферазами. Этот результат проверяет факты путем сопоставления биохимических данных, описанных для COBF по поводу способности, которую имеет этот протеин, связывать SAM in vitro /пример 6.3/. Эти гомологии, с одной стороны, позволяют подтвердить, что COBF является SAM-метилтрансферазой процесса биосинтеза кобаламинов, и, с другой стороны, выявляют, что COBJ, COBL и COBM могли бы быть SAM-метилтрансферазами процесса биосинтеза кобаламинов. Эти результаты также показывают гомологию, которая существует между протеинами COB P.denitrificans и изофункциональными протеинами других микроорганизмов.
Пример 6 /B/ - Очистка и клонирование структурного гена SYMT
Этот пример иллюстрирует, каким образом возможно получить в других микроорганизмах ферменты COB и гены cob, соответствующие тем, которые идентифицированы у P.denitrificans.
6 /B/1. Очистка SYMT Methanobacterium ivanovii.
Этот пример описывает очистку SYMT Methanobacterium ivanovii и изучение ее каталитических свойств.
Штамм Methanobacterium ivanovii DSM2611 культивируется, как это уже описано /Sonillard et al., 1988/. Получают 12 г увлаженных клеток. Последние повторно суспендируются в 80 мл 0,1 М буферного раствора Трис-HCl с pH 7,6, содержащего 5 мМ ДТТ и 1 мМ ЭДТА, и обрабатываются ультразвуком в течение 1,5 часа при температуре 4oC, потом центрифугируются в течение 1 часа с ускорением 50000 g. Затем экстракт освобождается от свободных тетрапиррольных соединений путем пропускания через небольшую колонку с ДЕАЕ-Сефадексом A25 в том же самом буферном растворе. Протеины, осаждаются при насыщении между 55 и 75% сульфата аммония, солюбилизируются в 0,1 М буферном растворе Трис-HCl с pH 7,5, содержащем 0,5 мМ ДТТ, 1,7 М сульфата аммония, и вводятся в колонку с фенил-Суперозой HR 10/10 (Фармация, Франция/SA), элюируемую с уменьшающимся градиентом /от 1,7 М до 0 М сульфата аммония/. Активные фракции пропускаются через колонку с Сефадексом G-25, приведенную в равновесие с буферным раствором 0,1 М Трис-HCl с pH 7,5, содержащим 0,5 мМ ДТТ, 25% глицерина /буферный раствор A/, потом вводятся в колонку Моно-Q HR 5/5 /Фармация, Франция SA/, приведенную в равновесие с буферным раствором A и элюируемую с градиентом KCl от 0 до 0,3 М; эта стадия повторяется второй раз в тех же самых условиях. Гель-проникающая хроматография на Био-Сил TSK-250 /Био-Рад, Франция SA/ активной фракции с предыдущей стадии позволяет получать гомогенный протеин по данным метода PAGe-SDS и метода RP-ВЭЖХ /C-18 μ-Бондапак/. Различные стадии очистки вместе с их выходом, а также их коэффициент очистки описаны в таблице 16, приведенной ниже.
Как показывается в этой таблице, общий коэффициент очистки составляет более 4500. Свойства чистого фермента были изучены в соответствии с уже описанными методами /Blanche et al., 1989/. Этот фермент имеет активность SYMT, т.е. он катализирует SAM-завсящий перенос двух метильных группировок в положения C-2 и C-7 уро'гена III. Молекулярный вес фермента, оцененный методом гель-проникающей хроматографии, составляет 60000 ± 1500, тогда как по данным метода PAGE-SDS он составляет 29000, что ясно показывает, что речь идет о гомодимерном ферменте. В уже описанных условиях /Blanche et al., 1989/ фермент имеет Km для уро'гена III величиной 52 ± 8 нМ. Кроме того, этот эффект не ингибируется своим субстратом при концентрациях, меньших 20 мкМ, тогда как SYMT Pseudomonas denitrificans ингибируется уро'геном III при концентрациях, превышающих 2 мкМ /Blanche et al., 1989/.
Было определено значение Vmax для SYMT M. ivanovii. Оно составляет 1537 Ед/мг протеинов. Это значение превышает найденное для SYMT P.denitrificans, которое уже было определено в оптимальных условиях реакции /с учетом ее ингибирования уро'геном III/: 489 Ед/мг протеинов /Blanche et al., 1989/.
6. /B/.2. Клонирование структурного гена SYMT M. ivanovii в E.coli
6. /B/.2.1. Клонирование внутреннего фрагмента на структурном гене SYMT M. ivanovii
Для этой цели поступают следующим образом: используют 200 пикомоль SYMT M. ivanovii для составления NH2-оканчивающейся последовательности протеина, как это описано ранее. Кроме того, пептидный фрагмент, полученный в результате трипсинового расщепления протеина, сам также подвергается последовательному составлению его NH2-оканчивающейся части. Полученные последовательности представлены на фиг. 48. Олигонуклеотиды прямого и обратного направления соответственно 946, 923 и 947 /сотри фиг. 48/ синтезируются, как это уже описано ранее; эти олигонуклеотиды содержат на своем конце 5' сайт рестрикции, который является либо EcoRI для олигонуклеотидов прямого направления, либо Hind III для олигонуклеотида обратного направления. Эти олигонуклеотиды используются для эксперимента по ферментативному увеличению ДНК /Saiki et al 1988/, как это схематично изображено на фиг. 48.B/
Геномная ДНК M. vianovii получается следующим образом: промывают 0,4 г клеток M. vianovii /DSM 2611/ 0,15 М раствором NACl. Затем клетки инкубируются в 4 мл раствора, содержащего 25% сахарозы, 50 мМ Трис-HCl с pH 8,40 мг лизозима, потом в течение 2-3 часов при температуре 50oC после прибавления 40 мг протеиназы K и 5 мл раствора, содержащего 0,2% ДСН, 0,1 ЭДТА, с pH 8. Затем ДНК экстрагируется смесью фенол-хлороформ /50% - 50%/ 2 раза, потом 2 раза хлороформом, а затем осаждаются изопропанолом и извлекается в 3 мл TNE /10 мМ Трис-HCl с pH 8,1 мМ ЭДЕА, 100 мМ NaCl/.
Ферментативное увеличение ДНК M.vianovii осуществляется в соответствии с методикой Saiei et al., 1988, в объеме 0,1 мл с 600 нг геномной ДНК M.vianovii, используя инициаторы 946 и 947 /реакция 1/ или 923 и 947 /реакция 2/. Буферный раствор, используемый для этой реакции, представляет собой смесь: 1 мМ MgCl2, 50 мМ KCl, 0,001% желатины и в каждом случае ДНТФ с концентрацией 0,2 мМ; для каждой реакции увеличения используют 10 мг каждого олигонуклеотида, а также 2,5 единицы Tag-ДНК-полимеразы (Cetus Corporation). Увеличение осуществляется при 30 циклах в системе: Perkin-Elmer Cetus DNA Amplification system; в ходе каждого цикла ДНК денатурируется в течение 1 минуты при температуре 95oC, олигонуклеотидные инициаторы гибридизируются с простыми цепями ДНК в течение 2 минут при температуре 38oC и неоцепи полимеризуются в течение 3 минут при температуре 72oC. Затем продукты увеличения экстрагируются в хлороформе и подвергаются потом этанольному осаждению; затем они могут сделаться визуально наблюдаемыми после миграции на акриламидном геле, потом могут расщепляться ферментами рестриктазы, такими как EcoRI и Hind III.
В случае реакции 1 наблюдаются два фрагмента: величиной 615 по, а также величиной 240 по. Что касается реакции 2, то также наблюдаются два фрагмента: величиной 630 и 170 по. Все продукты реакции ферментативного увеличения между олигонуклеотидами 946-947 разделяются в результате миграции на акриламидном геле; фрагмент величиной 615 по очищается, как это описано ранее. Затем этот фрагмент расщепляется под действием EcoRI Hind III, чтобы сделать концы фрагмента связующими. Затем этот фрагмент связывается с ДНК репликативной формы фага M13mp19. Эта ассоциация трансформируется в E.coli TGI. Шесть рекомбинантных клонов, содержащих вставку величиной 615 по, анализируются в результате составления последовательности с универсальным праймером - 20 /Фармация SA, Франция/. Как показывается на фиг. 49, когда составляют последовательность простой цепи ДНК рекомбинантных фагов, которые содержат вставку величиной 615 по, то ниже сайта EcoRI должна наблюдаться невырожденная последовательность, соответствующая последовательности олигонуклеотида 946, за которой в той же самой фазе следует последовательность, которая кодирует аминокислоты LITLKAVNVLK? ADWL /? - означает, что в этом положении остаток не смогли определить/; эта последовательность соответствует той, которая в NH2-оканчивающейся последовательности SYMT следует за аминокислотами, соответствующими олигонуклеотиду 946 /смотри фиг. 48/. Для двух клонов эффективно наблюдалась после сайта EcoRI последовательность, которая может кодировать NH2-оканчивающийся участок SYMT из Methanobacterium ivanovii, причем последний начинается с цепочки звеньев Pro-Gly-Asp-Pro-Glu-Leu, которые являются аминокислотами, кодируемыми последовательностью, содержащей олигонуклеотид 946. Это наблюдение показывает, что эти две рекомбинантные репликативные формы содержат вставку, которая соответствует внутреннему фрагменту структурного гена SYMT из Methanobacterium ivanovii. Репликативная форма, несущая этот внутренний фрагмент в структурном гене M. ivanovii, называется pG10.
6. /B/. 2.2. Клонирование структурного гена SYMT из Methanobacterium ivanovii.
Геномная ДНК Methanobacterium ivanovii расщепляется многими ферментами рестрикции /простое ил двойное расщепление/. После расщепления фрагменты разделяются методом электрофореза на геле агарозы, потом переносятся на мембрану из найлона, как это описано ранее. После денатурации перенесенных таким образом фрагментов и предварительной гибридизации проводят гибридизацию с репликативной формой pG 10 в качестве зонда, меченного изотопом 32P, как это описано ранее. Таким образом обнаружено, что полученный после расщепления фрагмент EcoRI-Bgl II величиной 3,2 из Methanobacterium ivanovii гибридизируется с зондом /смотри фиг. 50/. Затем 40 мкг геномной ДНК из M. ivauovii расщепляются посредством EcoRI и Bg I II, потом разделяются путем миграции на геле агарозы. Фрагменты, имеющие размер, заключенный между 3 и 3,5 ко, электроэлюируются, как это описано ранее. Очищенные таким образом фрагменты подвергаются связыванию с векторном pBKS+ /Stratagene Cloning Systems, La Jolla/, расщепленным посредством BamHI-EcoRI. Ассоциация трансформируется в E.coIi ДН5 α /Gibco BRL/. Трансформанты селектируются в среде LB, дополненной ампицилином и X-gal. Пересаживаются на фильтр 800 колоний белого цвета: после роста с последующим разложением лизинами бактерий проводят гибридизацию на колониях в соответствие с методом Grunstein et Hogness /1975/. Используемый зонд представляет собой репликативную форму pG 10, меченную изотопом 32P. Обнаружен единственный положительный клон после этого теста гибридизации с зондом. Плазмидная ДНК этого клона называется pXL1809 /смотри фиг. 56/. Расщепление этой ДНК посредством EcoRI-XbaI позволяет сделать визуальным, как ожидалось, включение величиной 3,2 ко. Последовательность плазмиды pXL1809 составляется на двух цепях по методу Chen et Seeburg /1985/. Получается последовательность из 955 оснований /фиг. 51/. Анализ открытых фаз приводит нас к идентификации открытой фазы от основания 34 /ATG/ до основания 729 /TGA/. Эта открытая фаза кодирует протеин, последовательность которого представлена на фиг. 52. Этот протеин имеет молекулярный вес величиной 24900 /смотри фиг. 53/, что близко к молекулярному весу очищенного протеина, исходя из M.ivanovii. NH2-Оканчивающаяся последовательность этого протеина является точно той, которая определена для очищенной SYMT M. ivanovii /смотри фиг. 48 и фиг. 52/. Эти замечания недвусмысленно обосновывают, что клонированный и составленный в виде последовательности ген является структурным геном SYMT M. ivanovii. Поскольку предполагается, что эта активность участвует в биосинтезе корриноидов у всех бактерий, то этот ген обозначается как ген corA, а протеин, кодируемый этим же самым геном, обозначается протеин CORA. профиль гидрофильности протеина CORA из M. ivanovii, полученный, исходя из программы Hopp et Woods /1981/, показывает, то речь идет, как это ожидалось, о гидрофильном протеине, как это представлено на фиг. 54. Протеин CORA из M. ivanovii показывает степень строгой гомологии более 40% относительно COBA из P.denitrificans /фиг. 53/. Эта гомология распространяется почти целиком на оба протеина, потому что она относится к остаткам 3-227 протеина CORA из M. ivanovii и к остаткам 17-251 протеина COBA из P. denitrificans. Эта гомология отражает структурные гомологии, которые существуют между двумя протеинами, катализирующими одну и ту же реакцию. Эта те же самые участки, которые являются наиболее сохранившимися между CORA и COBA из P. denitrificans, что и те, которые сохраняются между COBA из P.denitrificans и CYSG из E.coli /фиг. 22/.
Пример 7 - Экспрессия протеинов COB
7.1. - Экспрессия в Pseudomonas denitrificans.
Этот пример иллюстрирует то, что увеличение структурного гена протеина COB из Pseudomonas denitrificans в Pseudomonas denitrificans приводит к увеличению активности протеина COB.
7.1.1. - Экспрессия протеина COBA
Плазмида pXL557 соответствует плазмиде pXL59, в которой был клонирован фрагмент Bgl II-EcoRI /соответственно в положениях 80 и 2394 на последовательности фиг. 7/ величиной 2,4 ко из фрагмента величиной 5,45 ко. Этот фрагмент содержит гены cobA и cobE.
Плазмида pXL575 содержит исключительно ген cobE. Ее конструирование было описано в примере 4.1.
Эти две плазмиды вводились путем конъюгативного переноса в штамм SC510 RifR. Штаммы SC510 RifR, SC510 RifR pXL59, SC510 RifR pXL557 и SC510 RifR pXL545 культивировались в среде PS4. На 4-й день культивирование прекращалось, и активности SYMT количественно определялись в соответствии с уже описанной стандартной методикой /F. Blanche et al., 1989/. Активности приводятся ниже в табл. 17.
Из этих результатов явно следует, что только плазмида pXL557 вызывает в SC510 RifR заметное увеличение активности SYMT / с коэффициентом 50/. Это повышение обусловлено увеличением cobA, а не cobE, потому что плазмида pXL545, которая обеспечивает только увеличение cobE, не вызывает повышение активности SYMT. Этот результат подтверждает, что cobA является структурным геном SYMT из Pseudomonas denitrificans. Этот результат показывает, что можно получить увеличение активности SYMT в Pseudomonas denitrificans в результате увеличения структурного гена SYMT из Pseudomonas denitrificans.
Фрагмент, полученный из фрагмента величиной 8,7 ко, содержащей структурный ген SП2MT /cobI/, клонируется на плазмиде с широким спектром хозяев в грам-отрицательных бактериях, затем эта плазмида вводится путем конъюгации в Pseudomonas denitrificans SC510 RifR. Потом активность S-аденозил-L-метонин: прекоррин-2-метилтрансферазы этого штамма измеряется относительно активности штамма, несущего вектор.
Фрагмент BamHI-BanHI-SstI-SstI величиной 1,9 ко, содержащей гены cobH и coBI, очищается, исходя из фрагмента величиной 8,7 ко, "Связки" XbaI и EcoRI помещаются соответственно на концах BamHI и SstI после того, как последние были заполнены ДНК-полимеразой бактериофага Т4. Затем фрагмент внедряется между сайтами XbaI и EcoRI плазмиды с широким спектром хозяев pXL59. Она имеет устойчивость к канамицину. Полученную таким образом плазмида называется pXL1148 /фиг. 24/.
С другой стороны, была сконструирована соседняя плазмида: фрагмент BamHI-BamHI-SstI величиной 1,5 ко, содержащей только целиком ген cobH и часть 5' гена cobI, очищался, исходя из фрагмента величиной 8,7 ко. "Связки" XbaI и EcoRI были прибавлены к сайтам BamHI и SstI соответственно после того, как последние были заполнены или расщеплены ДНК-полимеразой фага Т4. Затем этот фрагмент внедряется между сайтами EcoRI и XbaI плазмиды pXL59 с образованием плазмиды pXL1149. Плазмиды pXL1148 и pXL1149 разливаются только присутствием на pXL1148 фрагмента SstI-SstI величиной 0,3 ко, который содержит конец 3' гена cobI. Плазмида pXL1148 содержит целый структурный ген cobI в отличие от pXL1149. Обе плазмиды содержат ген cobH.
Эти две плазмиды были введены путем конъюгации в штамм SC510 RifR. Штаммы SC510 RifR, SC510 RifR pXL59, SC510 RifR pXL1148 и SC510 RifR pXL1149 культивируются в среде PS4. После культивирования в течение 4 дней клетки собираются, и количественно определяются активности SП2MT, как это описано в примере 6.13-a.
Результат этих количественных определений приводится ниже в табл. 18 вместе с активностями SП2MT, определенными как в примере 6.1.3-a.
Активность выражается в %, как это определено в примере 6.1.3-a.
Только плазмида pXL1148 приводит к значительному повышению активности SП2MT. Напротив, плазмида pXL1149 не дает результатов, отличающихся от тех, которые наблюдаются с контрольными штаммами SC510 RifR и SC510 RifR pXL59. Плазмида pXL1148 является единственной плазмидой, содержащей ген cobI, и она является единственной плазмидой, увеличивающей активность SП2MT; этот результат подтверждает, что структурный ген SП2MT из Pseudamonas denitrificans является геном cobI. Кроме того, если все протеины этих различных штаммов разделяются методом электрофореза в денатурирующих условиях /PAGE-SDS с 10% акриламида/, то наблюдают специфично в случае плазмиды pXL1148 присутствие полосы, которая соответствует протеину, имеющему молекулярный вес приблизительно 25 000 /фиг. 25/. Молекулярный вес этого протеина соответствует молекулярному весу протеина COBI. Плазмида pXL1148 позволяет получить у Pseudomonas denitrificans перепроизводство протеина COBI.
7.1.3. - Экспрессия COBF
Экспрессию получают, размещая в вершине гена cobF промотор Ptгр для E. coli и сайт связывания рибосом гена cП бактериофага лямбда. полученная таким образом экспрессия намного превышает ту, которая наблюдается в результате простого генного увеличения благодаря той же самой плазмидной мультикопии.
Очищают фрагмент EcoRI-BamHI-BamHI величиной приблизительно 2 ко плазмиды pXL1496 /фиг. 26/. Этот фрагмент содержит промотор Ptгр для E.coli и сайт связывания рибосом гена cП бактериофага лямбда в вершине гена cobF. В нижней части гена cobF находится терминатор оперона rrnB для E.coli. Этот фрагмент клонируется на сайтах EcoRI-BamHI плазмиды pKT230 с образованием плазмиды pXL1546 /фиг. 26/. Плазмида pKT230 является плазмидой из группы несовместимости Q, которая реплицируется почти у всех грам-отрицательных бактерий /Bagdasarian et al. , 1981/; эта плазмида имеет устойчивость к канамицину. Плазмиды pXL1546 и pKT230 вводятся путем конъюгации в штамм SC510 RifR. Штаммы SC510 RifR, SC510 RifR pKT230 и SC510 RifR pXL1546 культивируются в течение 4 дней все протеины различных штаммов анализируются методом PAGE-SDS с концентрацией 10%. Как это показано на фиг. 27, в экстракте штамма SC510 RifR pXL1546 наблюдают протеин с молекулярным весом приблизительно 32 000, который является сверхвыраженным; этот протеин мигрирует совместно с протеином, который является сверхвыраженным посредство E.coli B pXL1496 /пример 7.2.1/. Кроме того, этот протеин специфически выражается в штамме SC510 RifR, содержащем плазмиду pXL1546, где этот протеин составляет по меньшей мере 20% всех протеинов. Напротив, этот протеин не наблюдается среди всех протеинов штаммов SC510 RifR и SC510 RifR pKT230. Следовательно, этот сверхвыраженный протеин является протеином COBF.
7.1.4 - Экспрессия COBH
Этот пример описывает увеличение фрагмента ДНК из Pseudomonas denitrificans, содержащего ген cobH. Очищают протеин, который кодируется этим геном; речь идет о протеине COBH. Плазмида pXL1149, описанная в примере 7.1.2, на вставке ДНК, полученной из фрагмента величиной 8,7 ко, содержит только ген cobH целиком. В штамме SC510 RifR эта плазмида /в отличие от вектора/ вызывает сверхэкспрессию протеина с молекулярным весом 22 000 /фиг. 25/.
7.1.5 - Экспрессия COBV
Этот пример описывает увеличение активности кобаламин-/5'-фосфат/-синтазы за счет плазмиды, несущей только cobV /pXL699, смотри фиг. 38/. Активность кобаламин-/5'-фосфат/-синтазы увеличивается в штамме SC877 RifR за счет плазмиды pXL699 с коэффициентом 50 относительно того же самого штамма с вектором pXL435, pXL1303, pXL1324 или pKT230. Эта плазмида на своей вставке содержит только ген cobV целиком, а также 5'-терминальные части ORF и cobU. Установлено, что в таком штамме /SC877 RifR/ протеин COBV является сверхвыраженным; эта сверхэкспрессия в 50 раз превышает экспрессию штамма SC877 RifR.
7.1.6 Экспрессия протеина CORA
Фрагмент EcoRI-BamHI-BamHI величиной 1,5 ко плазмиды pXL1832 /смотри пример 7.2.4/, содержащий промотор Ptrp, далее RBS cП бактериофага λ , структурный ген SYMT из M. ivanovii и терминирующий участок оперона rrnB для E. coli, клонируется на сайтах EcoRI-BamHI плазмиды pKT230 /Bagdasarian et al., 1981/. Таким способом получается плазмида pXL1841 /смотри фиг. 56/. Эта плазмида мобилизируется в P.denitrificans SC510 RifR, как это описано ранее. Трансконъюгант исследуется более подробно. Этот штамм культивируется в среде PS4, а активность SYMT из бактериальных экстрактов количественно определяется одновременно с той же активностью контрольного штамма SC510 RifR pXL435 /Cameron et al. , 1989/. Активности этих штаммов представлены ниже в табл. 19.
Этот результат ясно показывает, что имеет место экспрессия активности SYMT из M.ivanovii в P.denitrificans благодаря плазмиде pXL1841, поэтому что активность SYMT штамма SC510 RifR pXL1841 явно превышает ту же активность штамма SC510 RifR pXL 435.
7.2 - Экспрессия в E.coli
Этот пример иллюстрирует, каким образом протеин COB из Pseudomonas denitrificans может перепроизводиться в E.coli.
7.2.1. - Экспрессия COBF
Перепроизводство получают, размещая в вершине гена cob промотор Ptгр для E.coli и сайт связывания рибосом гена сП бактериофага лямбда. Фрагмент EcoRI - XhoI величиной 2250 по из фрагмента EcoRI величиной 8,7 ко/в положениях соответственно 0 и 2250 на последовательности, представленной на фиг. 8/ клонировался в фаге M13mp19 /Norrander et al., 1983/ между сайтами EcoRI и SalI. Сконструированная таким образом плазмида называется pXL1405. Сайт NdeI был введен в результате мутагенеза, направляемого таким образом, чтобы три последних основания /ATG/ этого сайта рестрикции составляли бы сайт, инициирующий трансляцию гена cobF. Это сводится к модификации трех оснований, которые предшествуют ATG-гена cobF., GAA/G находится в положении 733 на последовательности, приведенной на фиг. 8/ в CAT. Затем очищается фрагмент NdeI-SphI-SphI /фиг. 26/, содержащий ген cobF; этот фрагмент величиной 1,5 ко затем клонируется между сайтами NdeI-SphI плазмиды pXL694 /Denefle et al., 1987/. Сконструированная таким образом плазмида называется pXL1496/ фиг. 26/. На фрагменте EcoRI-NdeI величиной 120 по /который происходит из плазмиды pXL694/, который предшествует гену cobF, находятся сигналы, регулирующие генетическую экспрессию E. coli. Эти сигналы образуются участком /-40 +1/ промотора Ptгр для E.colI, потом посредством 73 по, которые содержат сайт связывания рибосом гена cП бактериофага λ /Denefle et al., 1987/. В нижней части гена cobF находятся терминаторы оперона rrnB E.coLi /на фрагменте Hind III-BamHI/. Плазмида pXL 1496 вводилась в результате трансформации в штамм E.coli /Monod et Wollman, 1947/. Экспрессия гена cobF изучалась, как это уже описано/ Denefle et al, 1987/, в условиях, когда промотор Ptгр является либо подавленным /в присутствии триптофана/, либо неподавленным /в отсутствие триптофана/. Среда, где была реализована экспрессия, является минимальной средой M9 /Miller, 1972/, дополненной 0,4 %-ми глюкозы, 0,4%-ми казаминокислот, 10 mM тиамина и 40 мкг/мл триптофана, в том случае, когда хотят подавить промотор Ptгр. Штамм E.colI в pXL1496 культивировался при температуре 37oC в среде, описанной выше, со 100 мкг ампицилина. Как показывается на фиг. 28, отсутствие триптофана вызывает экспрессию протеина с молекулярным весом 32000. Действительно в экстракте всех протеинов из E.coli B pXL1496, проанализированном методом PAGE-SDS /фиг. 28/, ясно наблюдают протеин с молекулярным весом 32000, который составляет от 1 до 4% всех протеинов. Этот протеин присутствует в количествах, явно менее значительных, в экстракте всех протеинов из штамма E.coli B pXL1496, культивируемого в тех же самых условиях, но в присутствии триптофана. Молекулярный вес протеина, который выражается в этих условиях, близок к молекулярному весу протеина COBF, выведенному из аминокислотной последовательности протеина, который составляет 28927 /фиг. 16/. Протеин, который выражается таим образом в E.coli, является протеином COBF.
7.2.2. - Экспрессия COBT
Получают перепроизводство, объединяя на конце 5' гена cob промотор lac и три первых кодона lacZ E.coli
Сайт EcoRI, расположенный в положении 2624 последовательности, представленной на фиг. 32, фрагмента величиной 4,8 ко, содержит четвертый кодон гена cobT. Фрагмент EcoRI-XbaI величиной 3,5 ко плазмиды pXL837 /смотри фиг. 36/ клонируется на сайтах EcoRI и XbaI плазмиды pTZ18R или pTZ19R /Фармация/ с образованием плазмид pXL1874 или pXL1875 соответственно; эти две плазмиды различаются ориентацией урезанного гена cobT относительно промотора оперона лактозы из E. coli /Plac находится в верхней части гена cobT на плазмиде pXLI874, тогда как плазмиды pXL1875 эти - обратный случай. Клонирование на сайтах EcoRI-XbaI плазмиды pTZ18R фрагмента EcoRI-XbaI плазмиды pXL837 позволяет осуществить объединение протеинов между 4 первыми аминокислотами β - галактозидазы из E. coli и геном cobT, начиная с его 4-го кодона. Экспрессия этого гена lacZ' 'cobT контролируется сигналами экспрессии lac. Плазмиды pXL1874, pXL1875, pTZ18R вводятся путем трансформации в штамм E.coli BL21. Экспрессия гена cobT изучается, как это уже описано /Maniatis et al., 1989/.
Как это показывает фиг. 42-b, протеин с молекулярным весом 72000 выражается только с плазмидой pXL1874 и составляет в экстракте всех протеинов из BL21, pXL1874, проанализированном методом PAGE-SDS, от 1 до 4% от всех протеинов. Молекулярный вес протеина, который выражается в этих условиях, близок к молекулярному весу протеина COBT, выведенному из аминокислотной последовательности, который составляет 70335 на фиг. 40. Этот эксперимент ясно показывает, что, начиная с сайта EcoRI, расположенного на четвертом кодоне гена cobT, может выражаться открытая фаза, совместимая с фазой, найденной для гена cobT.
7.2.3.- Экспрессия урезанного протеина COBS
Сайт BamHI располагается на уровне 45-го кодона гена COBS. Фрагмент BamHI-BamHI величиной 1,2 ко, содержащий часть 3' гена cobS и последовательности из нижней части этого гена, отщепляется от плазмиды pXL843 для клонирования на сайте BamHI плазмиды pET-3b /Rosenberg et al., 1987/ с образованием плазмиды pXL1937. Фрагмент BanHI ориентируется таким образом, чтобы урезанная часть гена cobS объединялась в фазе с 12 первыми кодонами основного протеина капсиды бактериофага T7 или гена 10 /Rosenberg et al., 1987/. Этот гибридный ген контролируется промотором Ф10 бактериофага Т7. плазмиды pXL1937, а также плазмида pET-3b вводятся в результате трансформации в E.coli BL21 pLys S /W.Studier, частное сообщение/. После повторного выделения на селективной среде 2 штамма культивируются в жидкой среде L до ОП /оптической плотности/ при 610 нм величиной 1; именно на этой стадии среда доводится до концентрации по ИПГ /изопропил- -β-галактозид/ величиной 1 мМ, чтобы вызвать экспрессию полимеразы бактериофага Т7 /Rosenberg et al, 1987/. Затем культура инкубируется в течение 3 часов при температуре 37oC, потом получают бактериальные лизаты. Все протеины культивируемых таким образом бактерий разделяют методом PSGE в денатурирующих условиях. Как это видно на фиг. 42-А, специфично имеет место сверхэкспрессия протеина с молекулярным весом 33000 с культурой BL21 pLys S pXL1937. Этот молекулярный вес полностью совместим с молекулярным весом, ожидаемым для протеина после объединения /33 кД/. Этот эксперимент ясно показывает, что, начиная с сайта BamHI, расположенного на уровне 45-го кодона гена cobS, может сверхвыражаться открытая фаза, совместимая с фазой, найденной для гена cobS.
7.2.4. Экспрессия протеина CORA
Были синтезированы следующие олигонуклеотиды /как это описано ранее/:
/= последовательность, фигурирующая на фиг. 51, положения 926-915 на цепи, комплементарной для кодирующей цепи/
Олигонуклеотид 1277 имеет последовательности для опознавания ферментов рестрикции EcoRI и NdeI. Три последних основания сайта NdeI /ATG/, которые соответствуют кодону, инициирующему трансляцию, непосредственно предшествуют кодонам 2-5 структурного гена SYMT из M.ivanovii, которые фигурируют на последовательности, представленной на фиг. 52. Олигонуклеотид 1278 содержит последовательность для опознавания SstI, за которой непосредственно следует последовательность TATTACATAATT, которая соответствует последовательности, имеющейся на фрагменте величиной 955 по, содержащем ген corA, который представлен на фиг. 51; эта последовательность находится в положении 926-915 /смотри фиг. 51/ на цепи, комплементарной для цепи, кодирующей протеин CORA. Оба олигонуклеотида 1277 и 1278 содержат, следовательно, в своей части 3' последовательности, соответствующие кодирующей цепи гена corA и комплементарной цепи в нижней части этого гена соответственно. Эти два олигонуклеотида могут использоваться для осуществления эксперимента ферментативного увеличения с плазмидой pXL1809 в качестве матрицы. Этот эксперимент позволяет получить фрагмент величиной 910 по, содержащий ген corA M. ivanovii, имеющий сайт NdeI на уровне ATG гена corA и сайт SstI на другом конце фрагмента после окончания гена corA. Ферментативное увеличение осуществляется, как описано ранее для ферментативного увеличения, проведенного на геномной ДНК из M. ivanovii, если только матрица состоит из 10 нг ДНК плазмиды pXL1809; используемые температуры являются теми же самыми, однако реализуются только 20 циклов увеличения. Как это описано ранее, продукты увеличения расщепляются посредством NdeI и SstI перед разделением путем миграции на геле агарозы. Как и ожидалось, фрагмент размером 910 по эффективно наблюдается визуально. Этот фрагмент очищается, как это уже описано. Этот фрагмент клонируется на сайтах NdeI и SstI плазмиды pXL694 /Denefli et al., 1987/. Получающаяся плазмиды, называемая pXL1832, описана на фиг. 56. На этой плазмиде тем же самым образом, как описано в примере 7.2, структурному гену SYMT из M.ivanovii предшествует сайт связывания рибосом гена сП бактериофага λ В верхней части этого RBS находится промотор Ptгр. Плазмида pXL1832 вводится в E. coli B5548, который представляет собой штамм E.coli, несущий мутацию цис-G44 /Cossart et Sanzey, 1982/ в результате трансформации. Активности SYMT штаммов E.coli B5548 pUC14 и E.coli B5548 pXL1832 количественно определяются на экстрактах, полученных, исходя из клеток, культивируемых в среде LB, дополненной ампицилином. Количественное определение активности SYMT осуществляется, как это уже было описано /Blanche et al., 1989/. Результаты этого количественного определения даются ниже в табл.20.
Результаты, представленные в приведенной выше таблице, ясно показывают, что имеет место экспрессия активности SYMT в штамме E.coli B5548, когда последний содержит плазмиду pXL1832, которая выражает SYMT из M.ivanovii. Следовательно, SYMT из M.ivanovii может выражаться в E.coli.
Пример 8 - Увеличение производства кобаламинов методами рекомбинантной ДНК
8.1. - Увеличение в P.denitieficans
Этот пример иллюстрирует, каким образом улучшение производства кобаламинов получается в Pseudomonas denitrificans SC510 RifR при увеличении генов cob Pseudomonas denitrificans SC510.
8.1.1. Улучшение производства кобаламинов в Pseudomonas denitrificans в результате управления лимитирующей стадии в биосинтезе кобаламинов
Этот пример иллюстрирует, каким образом производительность по кобаламинам штаммов Pseudomonas denitrificans может быть улучшена при увеличении генов cob Pseudomonas denitrificans. Это улучшение обусловлено упразднением лимитирующей стадии процесса биосинтеза.
Плазмида pXL367 описана в примере 4.2 /фиг. 13/. Эта плазмида соответствует плазмиде pRK290 /Ditla et al.,1981/, в которую был внедрен фрагмент EcoRI величиной 8,7 ко. Эта плазмида pXL367 обеспечивает улучшение биосинтеза кобаламинов в штамме SC510 RifR. Штаммы SC510 RifR, SC510 RifR, pR4290 и SC510 RifR pXL367 культивируются в колбах Эрленмейера в среде pS4 в соответствии с условиями, описанными в экспериментальных методиках. Наблюдают улучшение выхода продукции, обусловленное присутствием плазмиды pXL367. Действительно, штамм SC510 RifR XL367производит дополнительно 30% кобаламинов по сравнению со штаммами SC510 RifR и SC510 RifR pRK290. Это улучшение обусловлено не увеличением любого из генов Pseudomonas denitrificans, а специфическим увеличением генов, носимых фрагментом EcoRI величиной 8,7 ко. Действительно, плазмида pXL723, описанная на фиг. 11, не дает никакого улучшения, причем с этой плазмидой наблюдается тот же самым выход продукции, что и со штаммами SC510 RifR и SC510 RifR pRK290.
8.1.2. Улучшение производства кофермента B12 в Pseudomonas denitrificans в результате упразднения двух лимитирующих стадий биосинтеза кобаламинов
Этот пример иллюстрирует, каким образом производительность по кобаламинам штаммов Pseudomonas denitrificans может быть улучшена при увеличении генов cob Pseudomonas denitrificans. Это улучшение обусловлено упразднением двух лимитирующих стадий процесса биосинтеза.
Фрагмент ClaI-EcoRV величиной 2,4 ко, полученный из фрагмента величиной 5,4 ко /который содержит гены cobA и cobE/, клонируется совместно с фрагментов EcoRI величиной 8,7 ко на плазмиде с широким спектром хозяев pXL203. Сконструированная таким образом плазмида называется pXL525 /фиг. 29/. Эта плазмида вводится в штамм SC510 RifR путем конъюгации. Штамм SC510 RifR pXL525 производится на 20% кобаламинов больше, чем штамм SC510 RifR pXL367. Увеличение генов cobA и cobE позволяет устранить новую лимитирующую стадию для штамма SC510 RifR в биосинтезе кобаламинов. Штамм SC510 RifR Pseudomonas denitrificans улучшается в настоящем примере в результате последовательно упразднения двух лимитирующих стадий. Это пример показывает, что упразднение двух лимитирующих стадий в биосинтезе кобаламинов может привести к дополнительным улучшениями производства.
8.2. - Улучшение производительности по кобаламинам в Agrobacterium tumefaciens.
Этот пример иллюстрирует улучшение производства кобаламинов штаммов, вырабатывающим кобаламины, в результате увеличение генов cob Pseudomonas denitrificans SC510.
Используемый штамм представляет собой штамм грамм-отрицательной бактерии; речь идет о штамме Agrobacterium tumefaciens.
Плазмиды, описанные в примерах 4.2 и 8.1 т.е. pXL367 и pXL525, а также вектор pRK290/Ditta et al. , 1981/ и плазмида pXL368 /фиг. 29/ вводятся в результате конъюгативного переноса в штамм Agrobacterium tumefaciens C58-C9 RifR /Cameron et al., 1989/. Штаммы C58-C9 RifR, C58-C9 RifR pRK290, C58-C9 RifR pXL367, C58-C9 RifR pXL368 и C58-C9 RifR pXL525 культивируются в среде PS4 при температуре 30oC, как это описано ранее. Полученные кобаламины количественно определяются, как это описано ранее. Титры продукции даются в таблице, приведенной ниже.
Как ясно видно из приведенной таблицы 21, производство кобаламинов улучшается в используемом штамме Agrobacterium tumefaciens. Две различные плазмиды улучшают производство кобаламинов используемым штаммом Agrobacterium tumefaciens: pXL367 и pXL368. Эти плазмиды содержат соответственно фрагмент EcoRI величиной 8,7 ко /гены cobF - cobM/ и фрагмент ClaI-EcoRI величиной 2,4 ко/ген cobE и сobA/. По отдельности, они улучшают производство кобаламинов штаммом Agrobacterium tumefaciens C58-C9 RifR с коэффициентом 2; этот результат показывает, что возможно улучшить производство кобаламинов штаммом Agrobacterium tumefaciens увеличивая фрагменты, несущие гены cob Pseudomonas denitrificans. В данном случае можно говорить о гетерологичном улучшении, т.е. об улучшении производства кобаламинов одним штаммом посредством увеличения генов cob другого штамма.
Улучшения производства кобаламинов, вызванные различными фрагментами Pseudomonas denitrificans, содержащими гены cob, являются аккумулируемыми, т. е. накладывая на одну и ту же плазмиду два фрагмента, которые раздельно клонируются на pXL367 и pXL368, наблюдают аддитивные улучшения. Плазмида pXL525 вызывает в Agrobacterium tumefaciens C58-C9 RifR улучшение производительности, превышающее улучшение, вызываемое каждым из фрагментов, клонируемых раздельно на одном и том же векторе.
8.3. - Улучшение производительности по кобаламинам в Rhizobium meliloti
Этот пример описывает улучшение производства кобаламинов другим штаммом, вырабатывающим кобаламины.
Плазмида, описанная в примере 8.2., т.е. pXL368, а также вектор pRK290 /Ditta et al., 1981/ вводятся путем конъюгативного переноса в штамм Rhizobium meliloti 102F34 RifR /Leong et al., 1982/. Трансконъюганты: 102F34 RifR, 102F34 RifR pRK290 и 102F34 RifR pXL368 - культивируются в среде PS4 при температуре 30oC, как это описано ранее. Полученные кобаламины количественно определяются, как это описано ранее. Титры продуктов приводятся в таблице 22.
Как ясно видно из приведенной выше таблицы, производство кобаламинов улучшается в используемом штамме Rhizobium Meliloti. Плазмида pXL368 улучшает производство кобаламинов из используемого штамма Rhizobium Meliloti. Эта плазмида содержит фрагмент ClaI-EcoRV величиной 2,4 ко /гены cobA и cobE/; она улучшает производство кобаламинов из штамма Rhizobium Meliloti 102F34 RifR с коэффициентом 2. Этот результат показывает, что можно улучшить производство кобаламинов из штамма Rhizobium Meliloti, увеличивая фрагменты, несущие гены cob Pseudomonas denitrificans. В данном случае можно говорить о гетерологичном улучшении, т.е. об улучшении производства кобаламинов из одного штамма посредством увеличения генов cob другого штамма.
Пример 9 - Количественное определение корриноидов и кобальтокорриноидов в суслах и клетках штаммов, вырабатывающих корриноиды.
Этот пример иллюстрирует, каким образом можно идентифицировать и количественно определять различные корриноиды и кобальтокорриноиды, производимые различными штаммами, вырабатывающими кобаламины. Это количественное определение позволяет, среди прочего, определять кофермент B12.
Сусла /или только клетки/ цианируются, как это уже было описано /Renz, 1971/. После центрифугирования аликвотная часть всплывшей фазы пропускается через колонку с ДЕАЕ-Сефадексом, которая затем экстенсивно промывается 1 М дигидрофосфатом калия. Собранные фракции объединяются и обессоливаются на фильтрующем элементе Сеп-Пак С-18 /Waters/. После выпаривания и повторного суспендирования в воде /от 100 мкл до 1 мл в зависимости от количества присутствующих корриноидов/ корриноиды идентифицируются и количественно определяются методом ВЭЖХ на колонке с Нуклеозилом С-18 (Macherey-Nagel). Колонка элюируется с расходом 1 мл/мин и с градиентом ацетонитрила /от 0% до 100%/ в 0,1 М буферном растворе фосфата калия, содержащем 10 мМ KCN.
Корриноиды визуально наблюдаются путем УФ-детектирования при 371 нм и/или путем специфического детектирования 56Co /если культивирование осуществлялось в присутствии 57CoCl2/ при помощи детектора Бертольда LB 505. Они также идентифицируются и путем сравнения их времени удерживания с эталонами. Кроме того, кобальтокорриноиды /гидробириновая кислота, моноамид гидробириновой кислоты и диамид гидробириновой кислоты/ визуально наблюдаются путем УФ-детектирования при 330 нм. Этим методом разделяются следующие промежуточные соединения: кобириновая кислота, моноамид кобириновой кислоты, диамид кобириновой кислоты, диамид кобириновой кислоты, триамид кобириновой кислоты, тетраамид кобириновой кислоты, пентаамид кобириновой кислоты, кобириновая кислота, кобинамид, кобинамидфосфат, ГДФ-кобинамид, витамин B12-фосфат и витамин B12. Аденозилсодержащие формы этих продуктов также разделяются и количественно определяются этим методом. Для этой цели первоначальная стадия цианирования опускается и колонка ВЭЖХ элюируется буферным раствором, не содержащим KCN. На фиг. 31 мы приводит времена удерживания различных эталонов, разделенных на этой системе и идентифицированных на выходе из колонки в результате УФ-поглощения.
Образец штамма SC510 RifR см. табл. 23 был заявлен 30 января 1990 г. в Central Bureau voor Schimmelcultures a Baarn /Нидерланды/, где он был зарегистрирован в виде стандарта CBS 103.90.
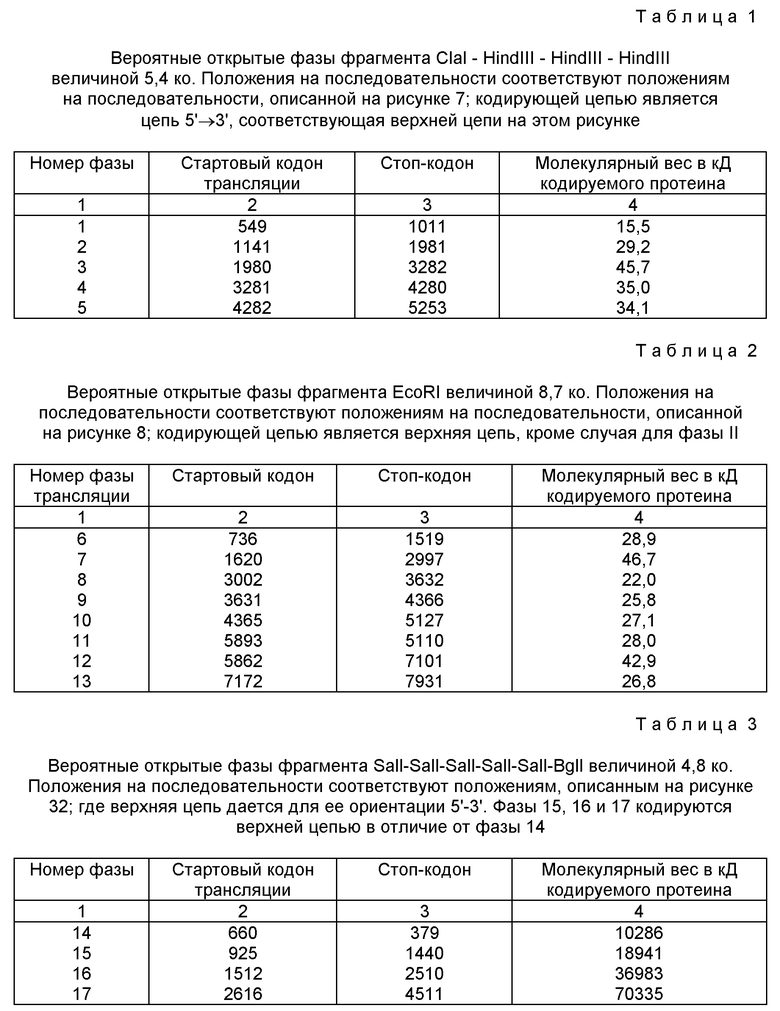
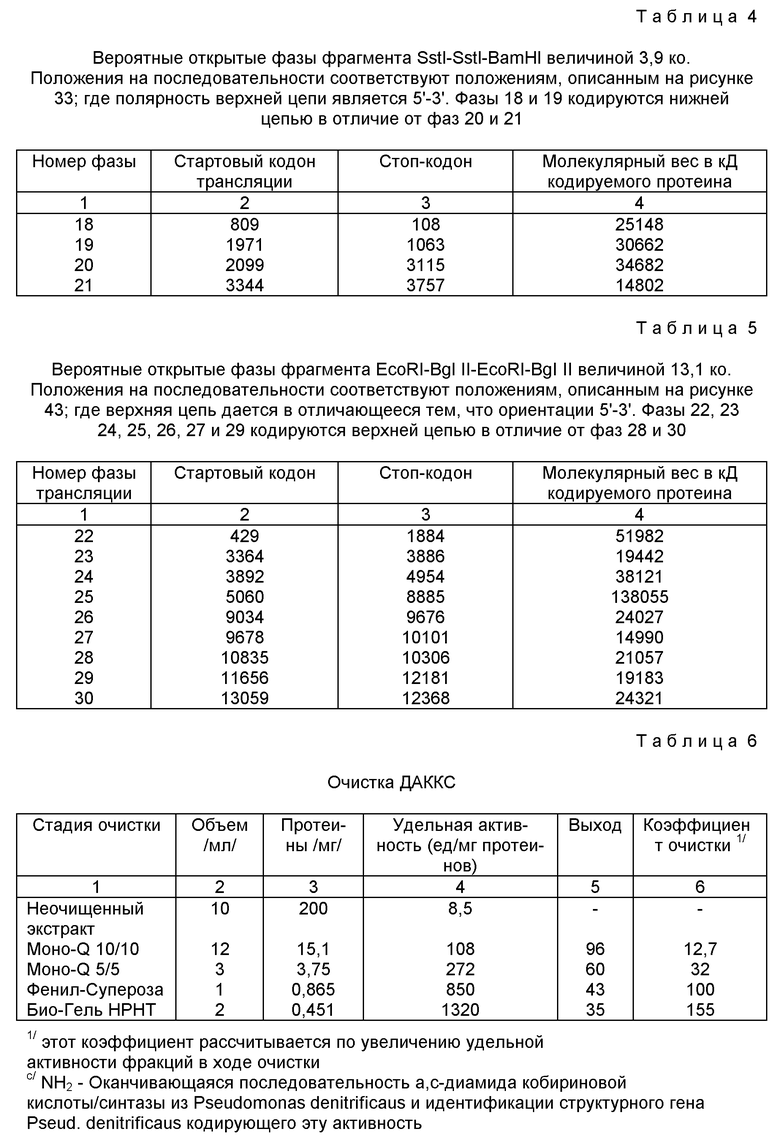


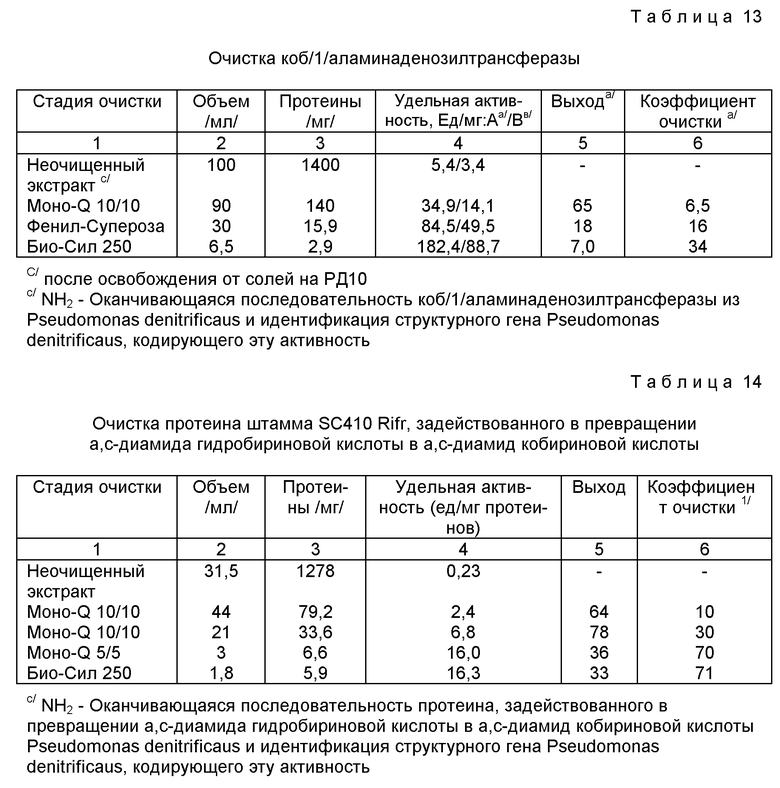
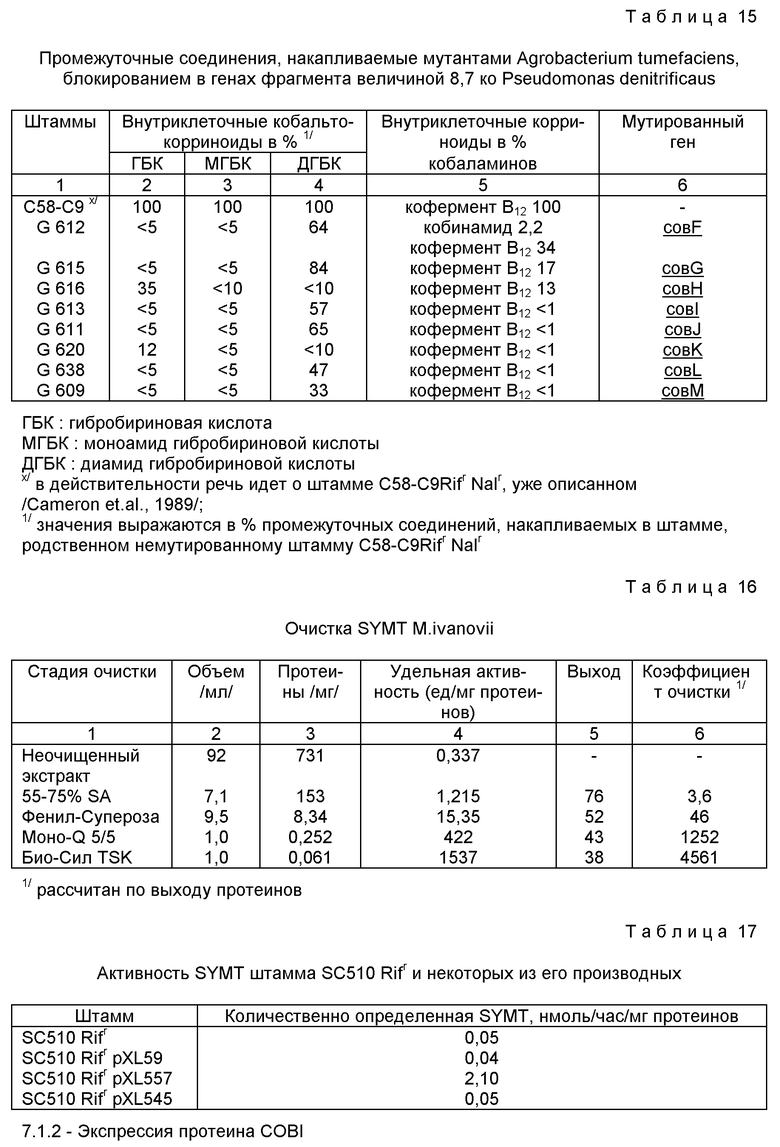
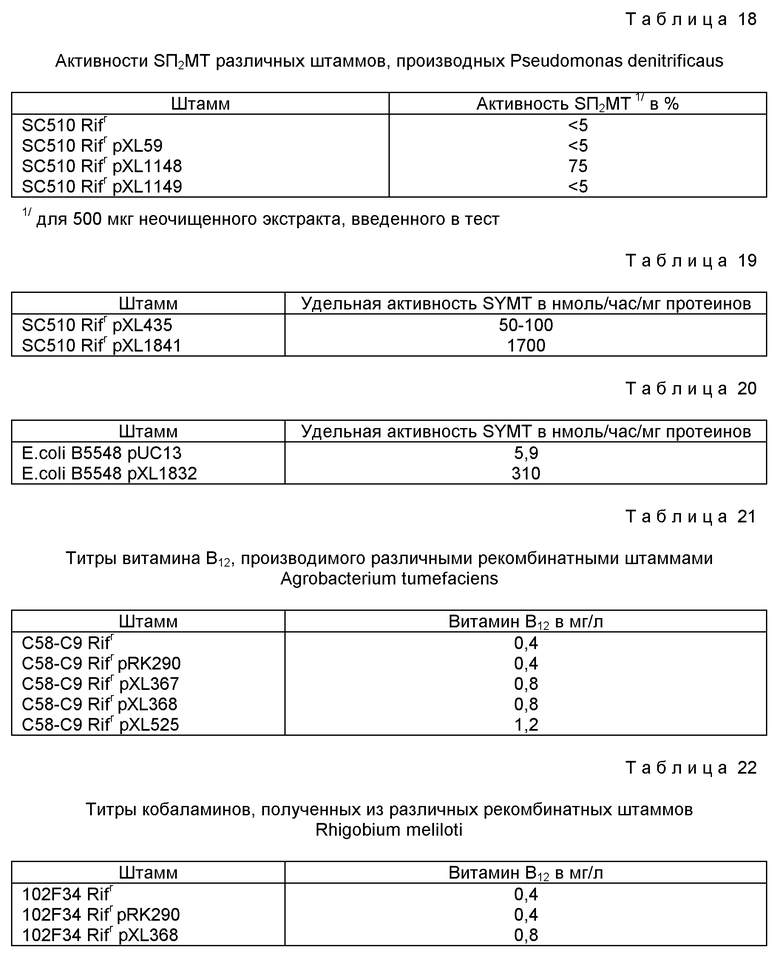
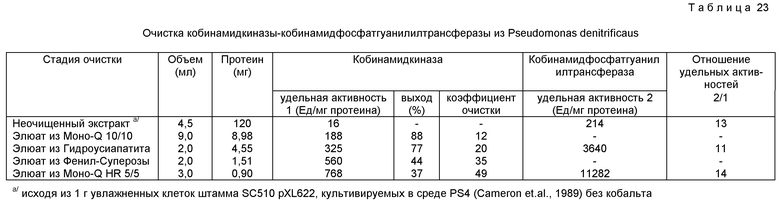






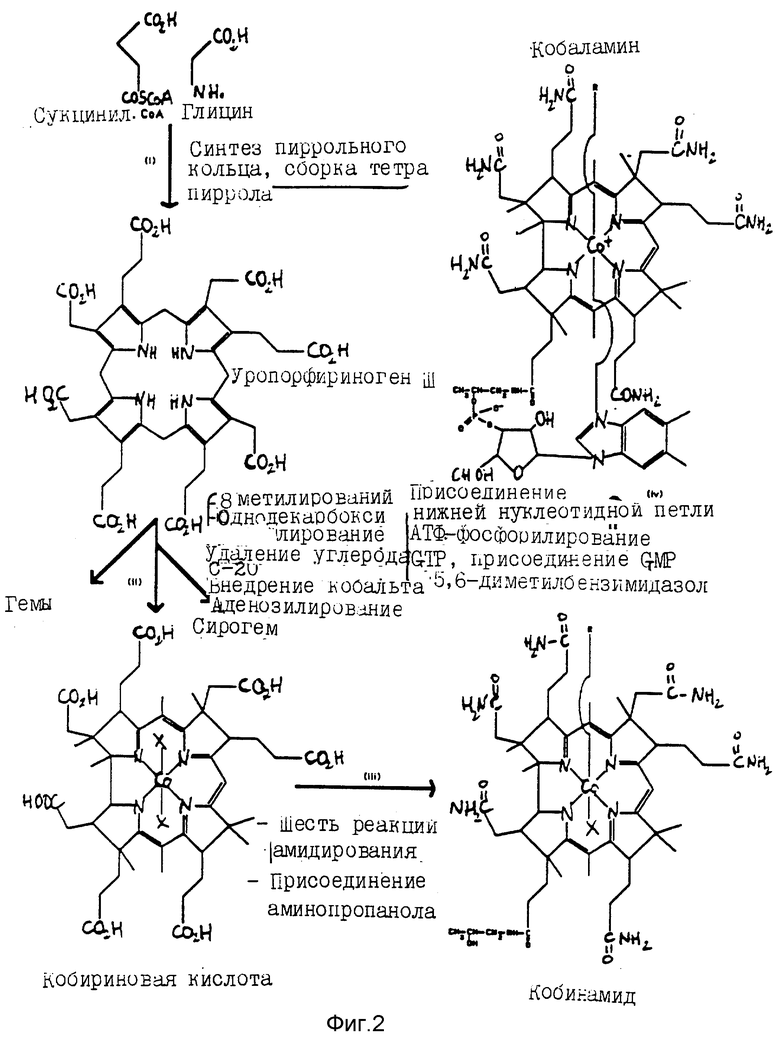









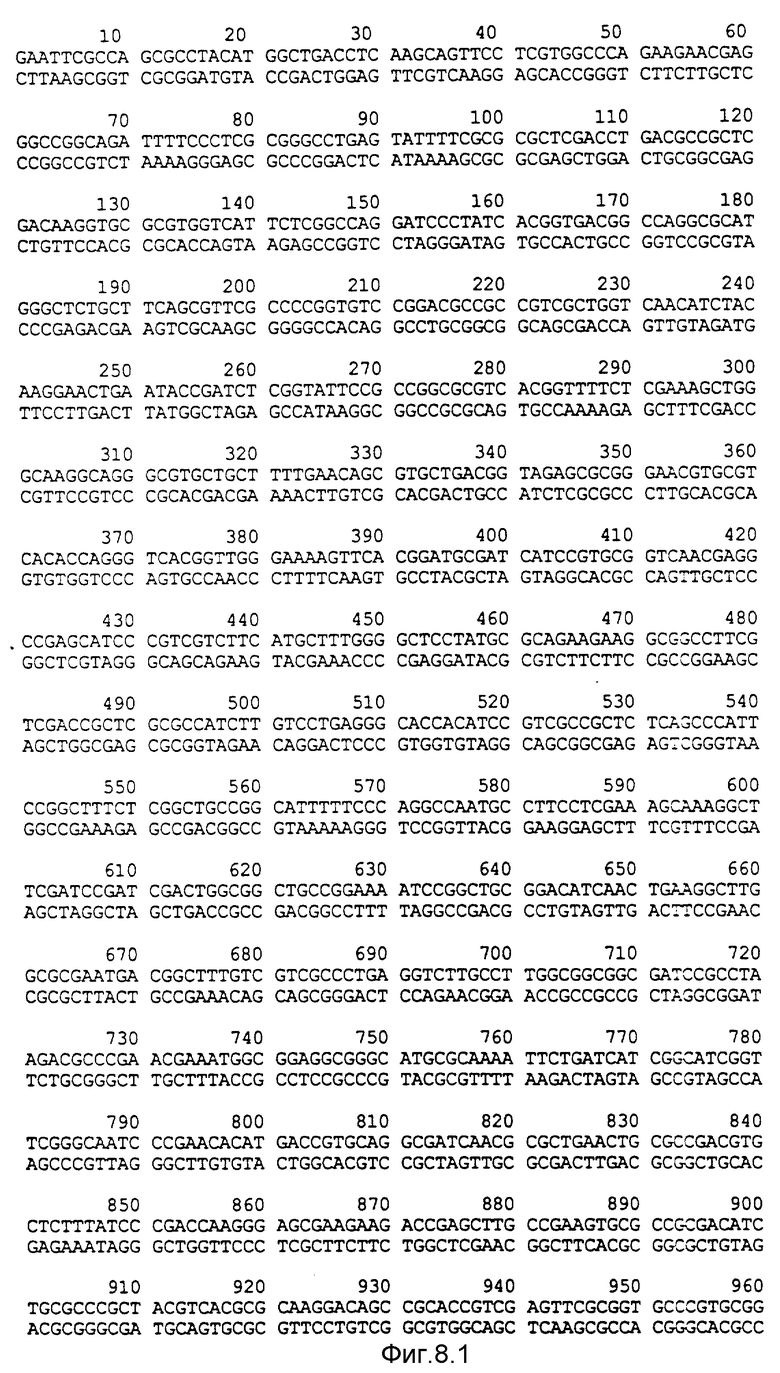
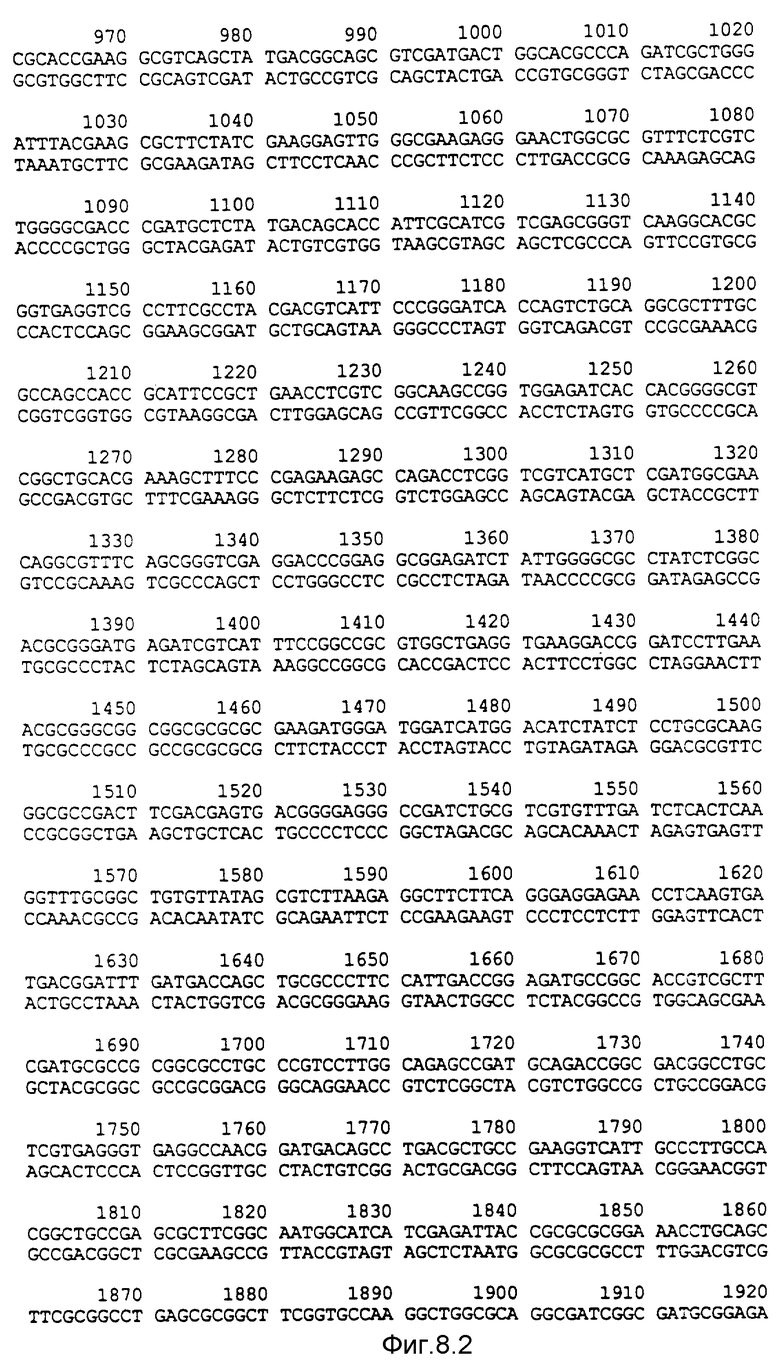
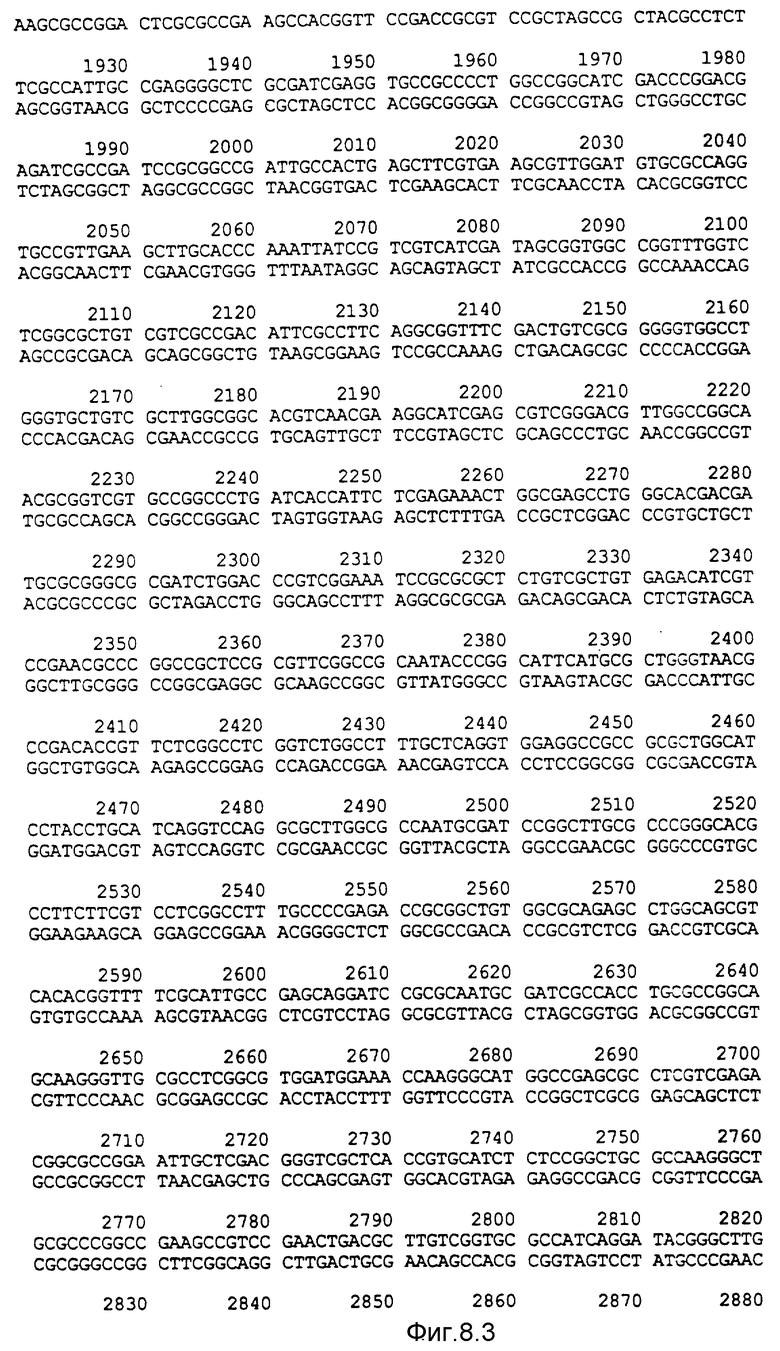
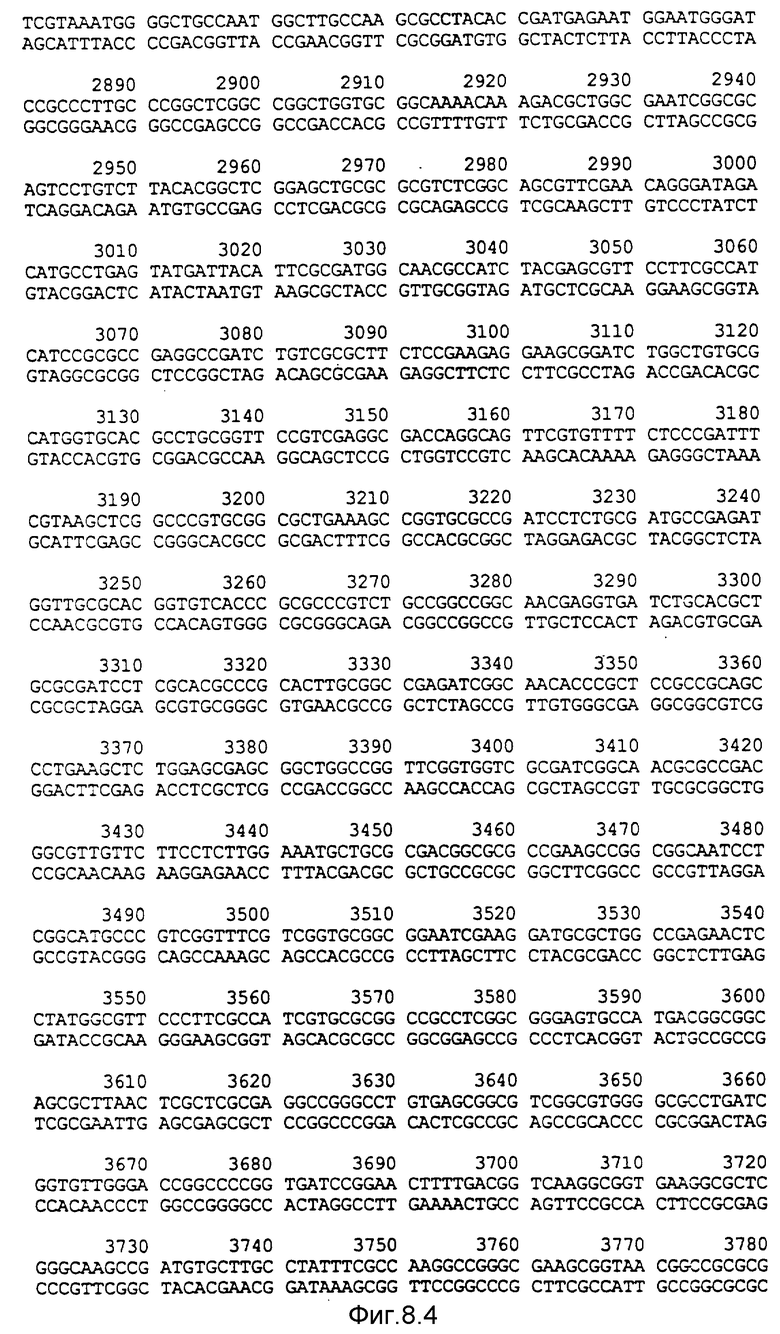




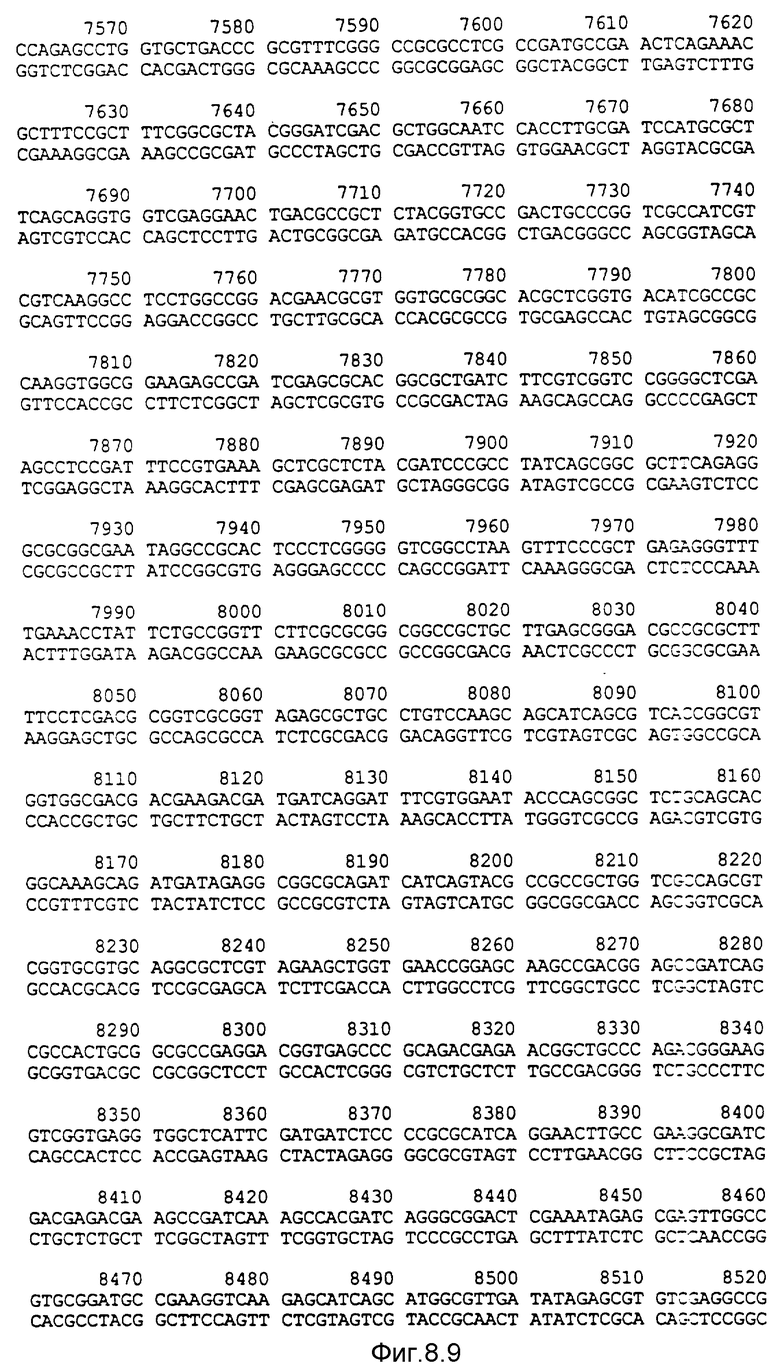


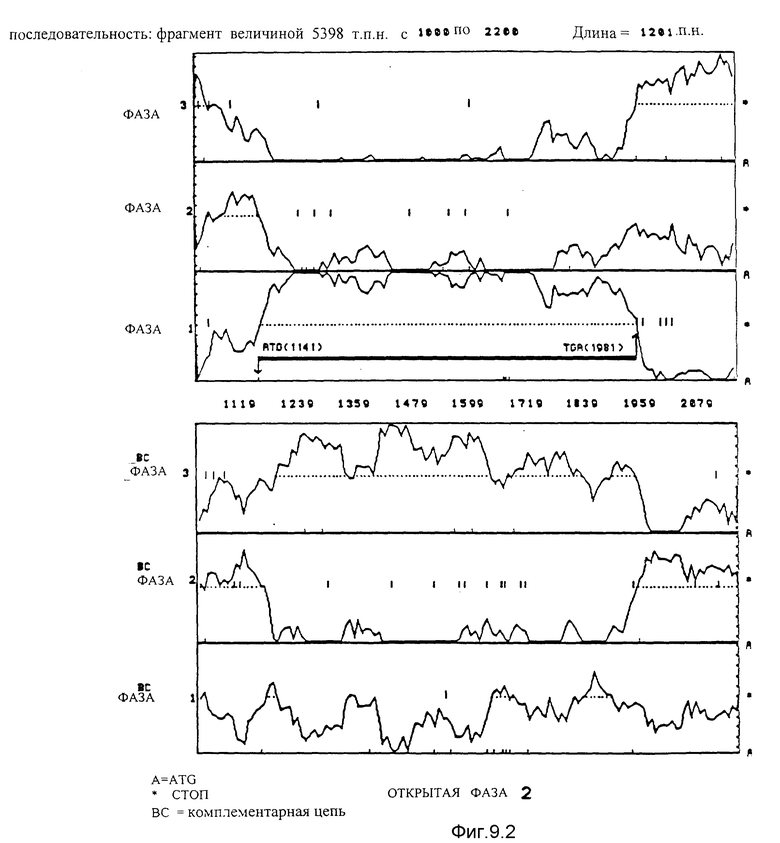

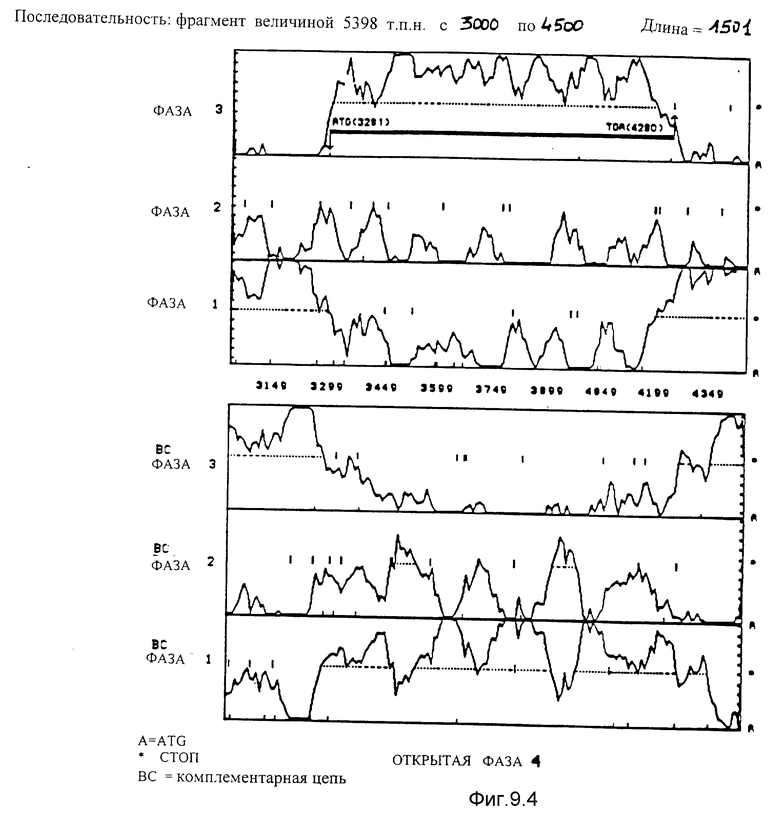
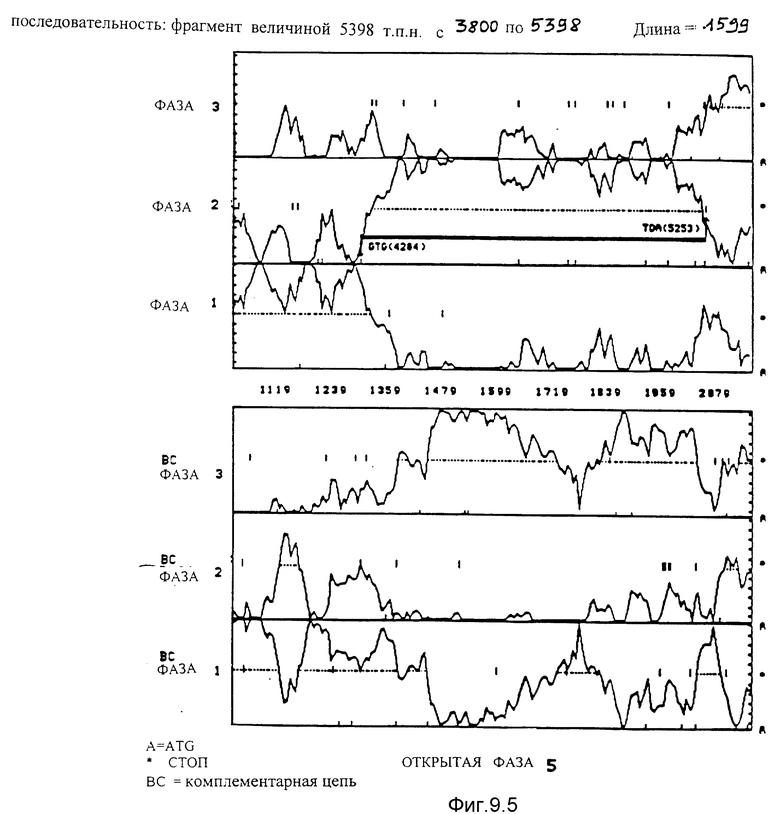


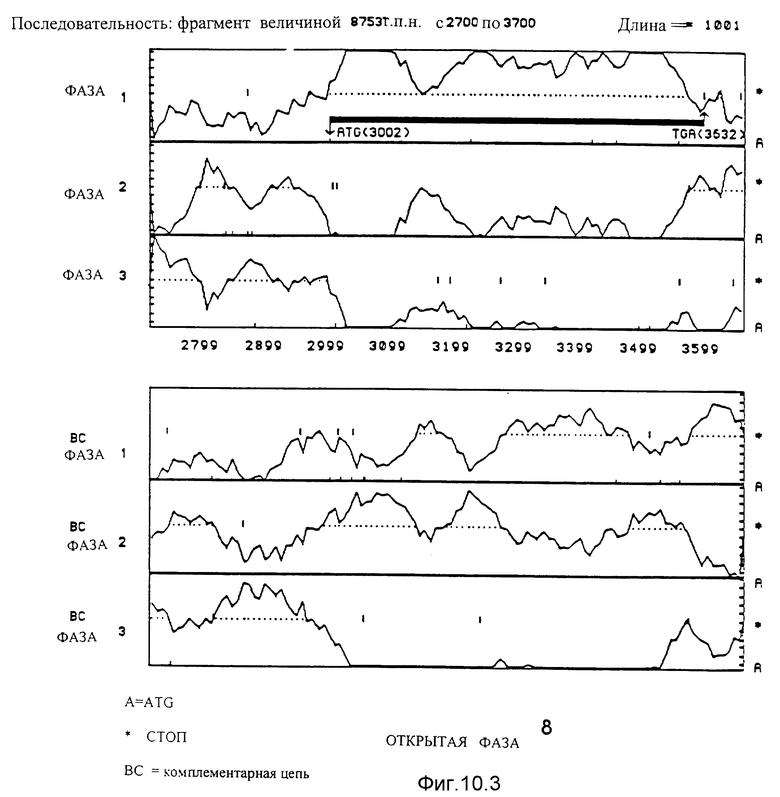

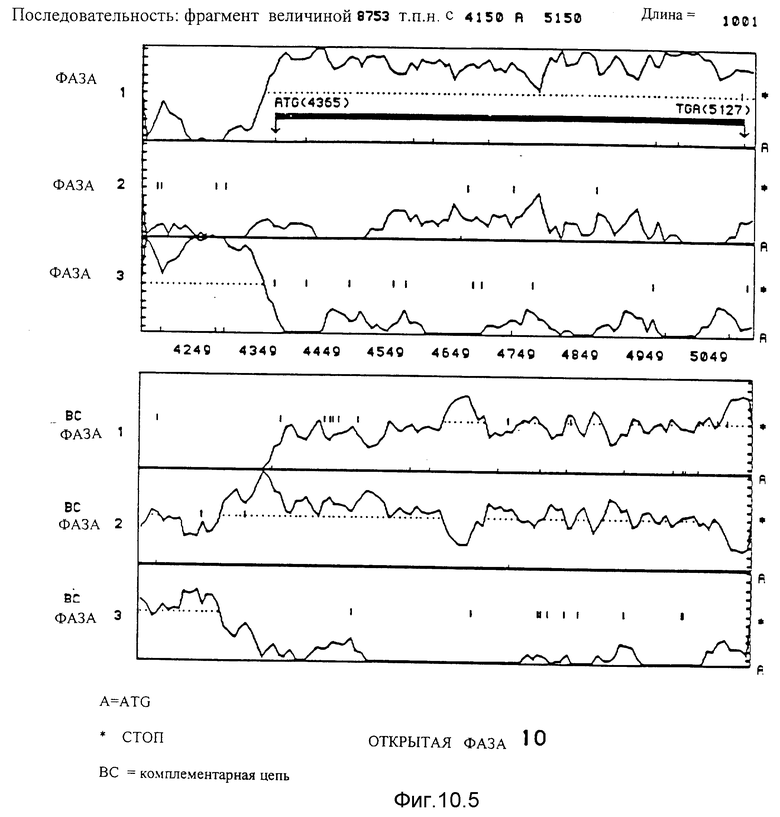

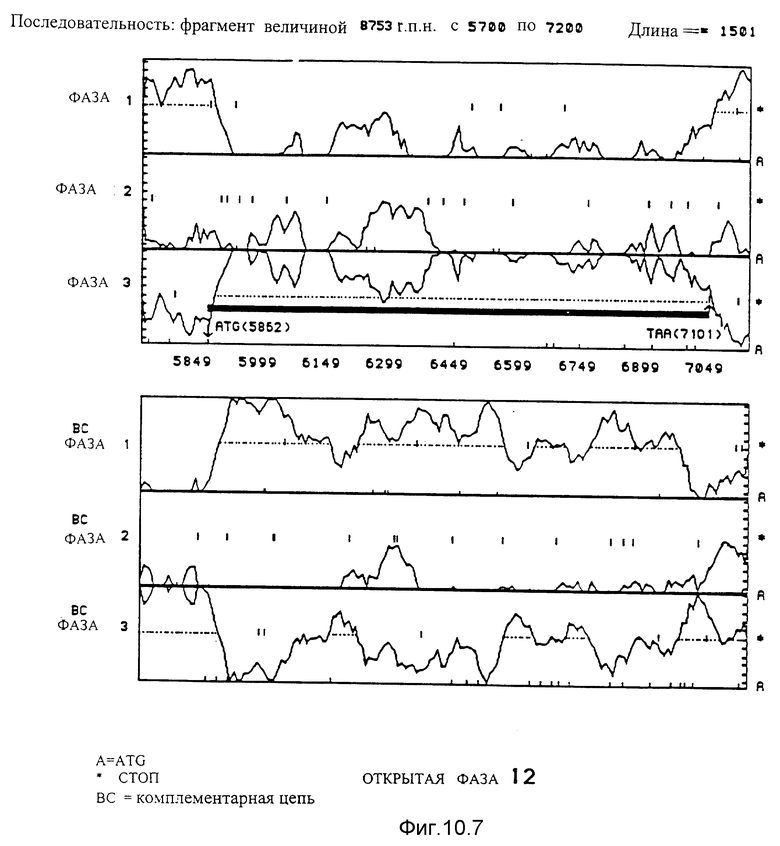
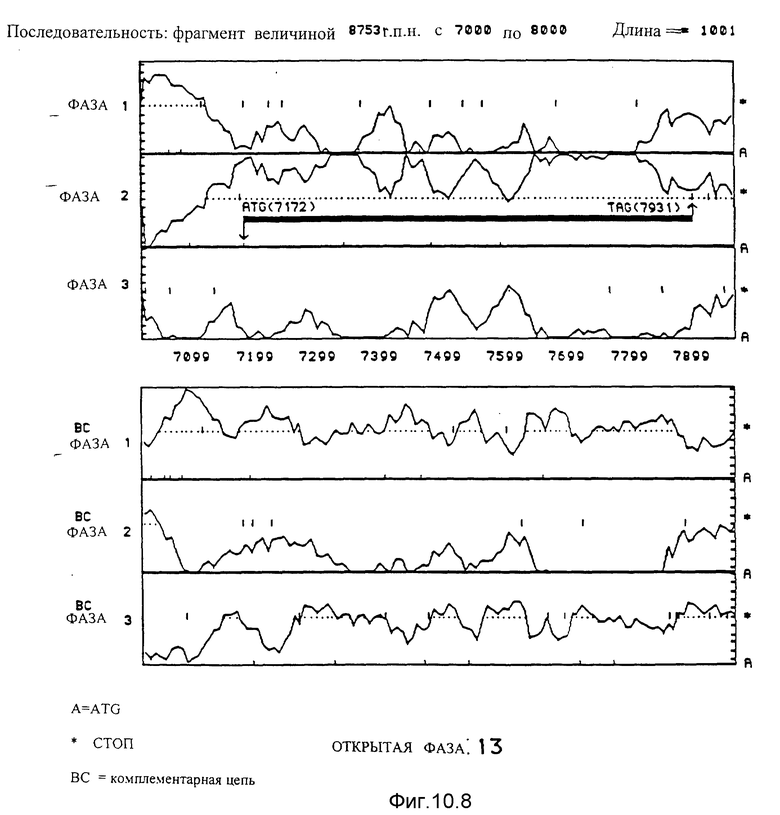

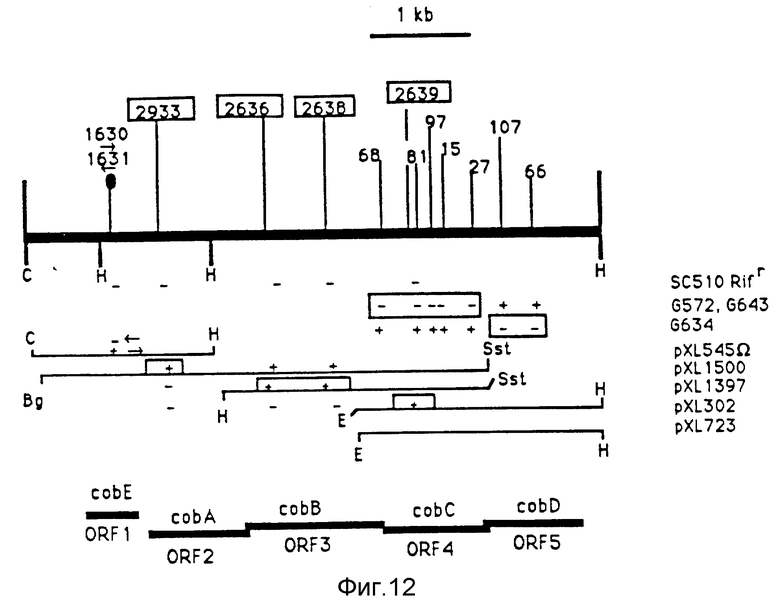
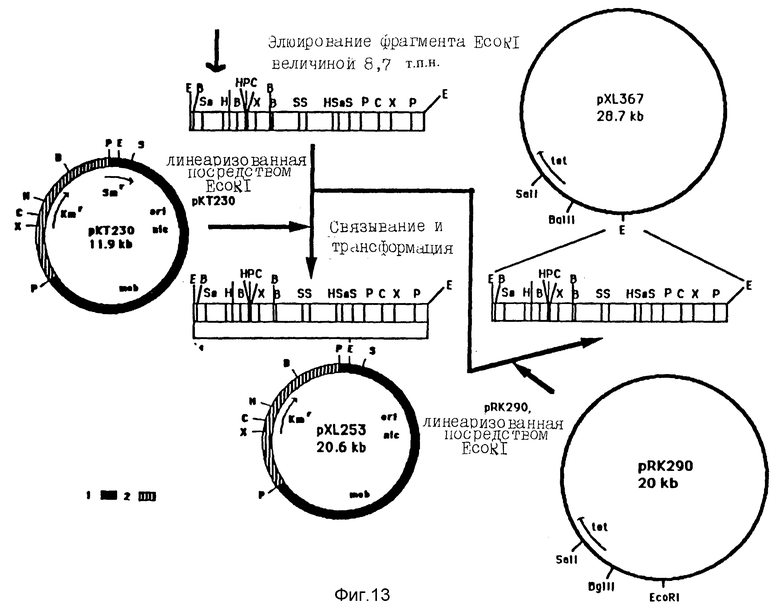


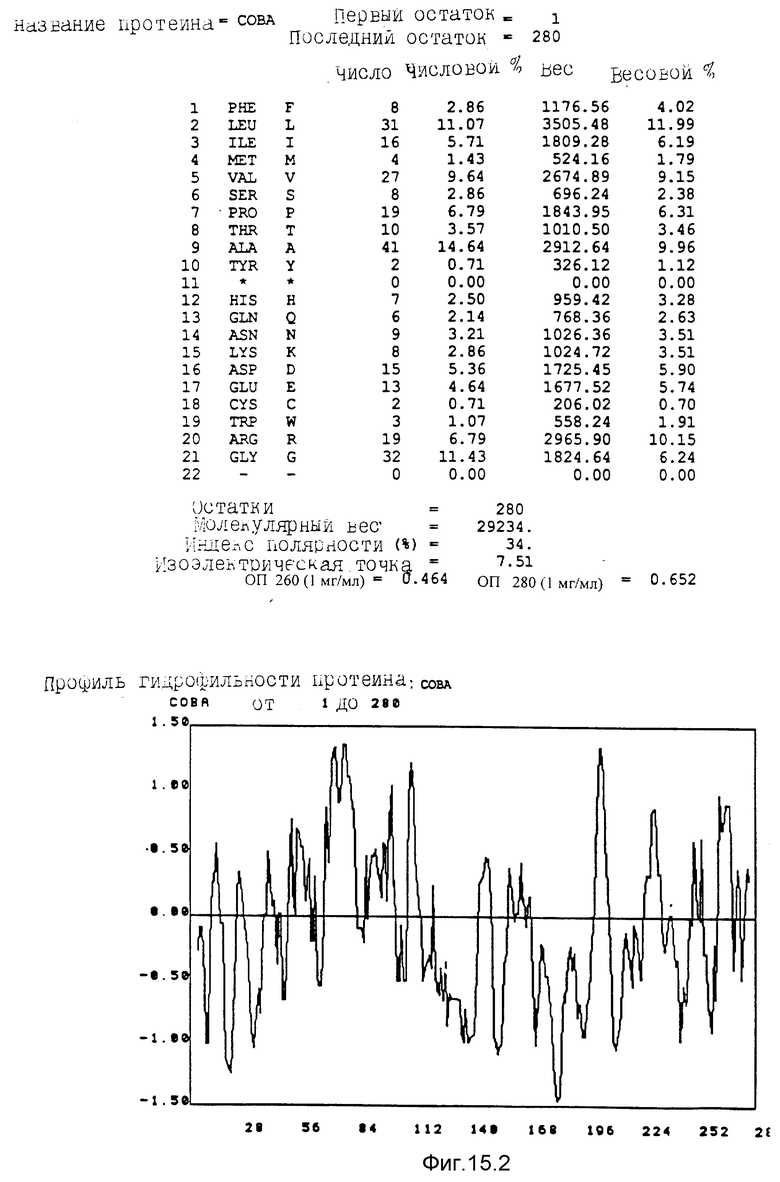

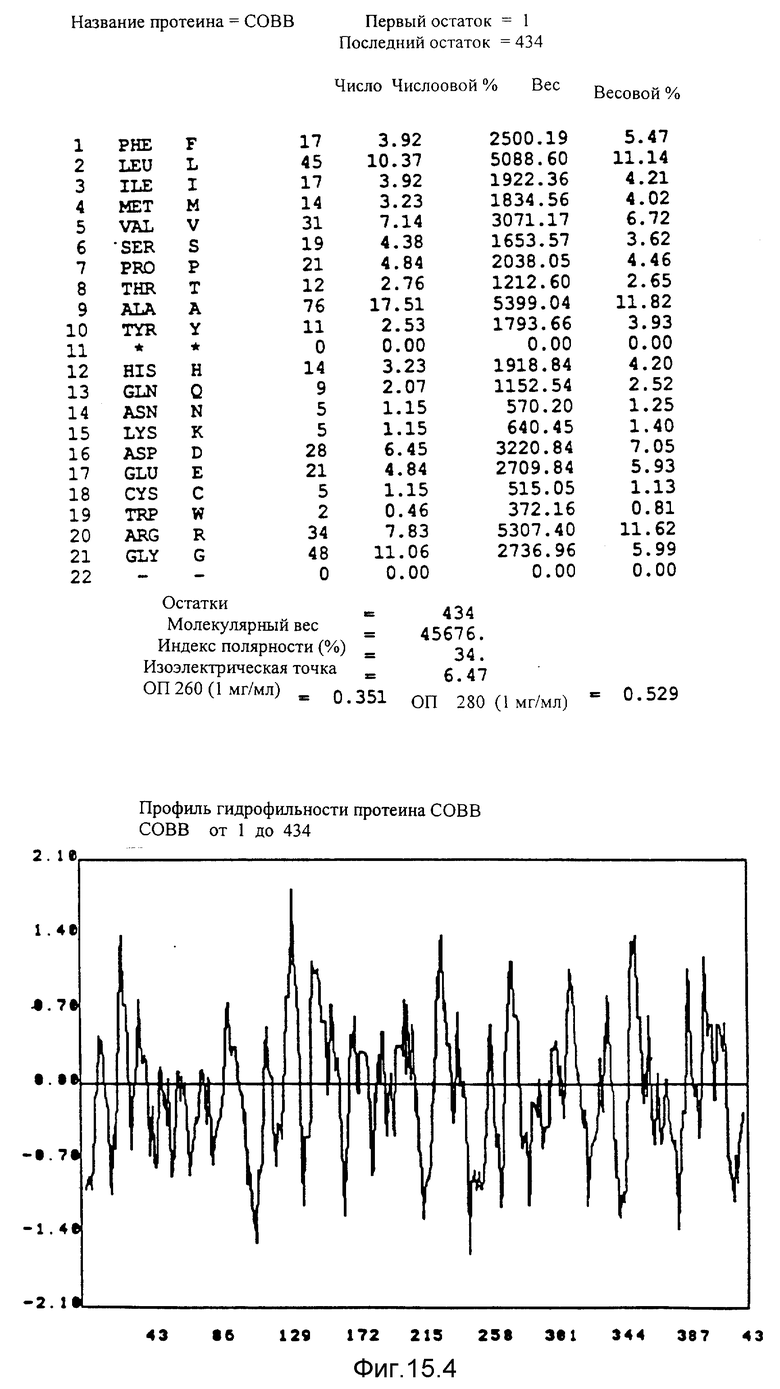

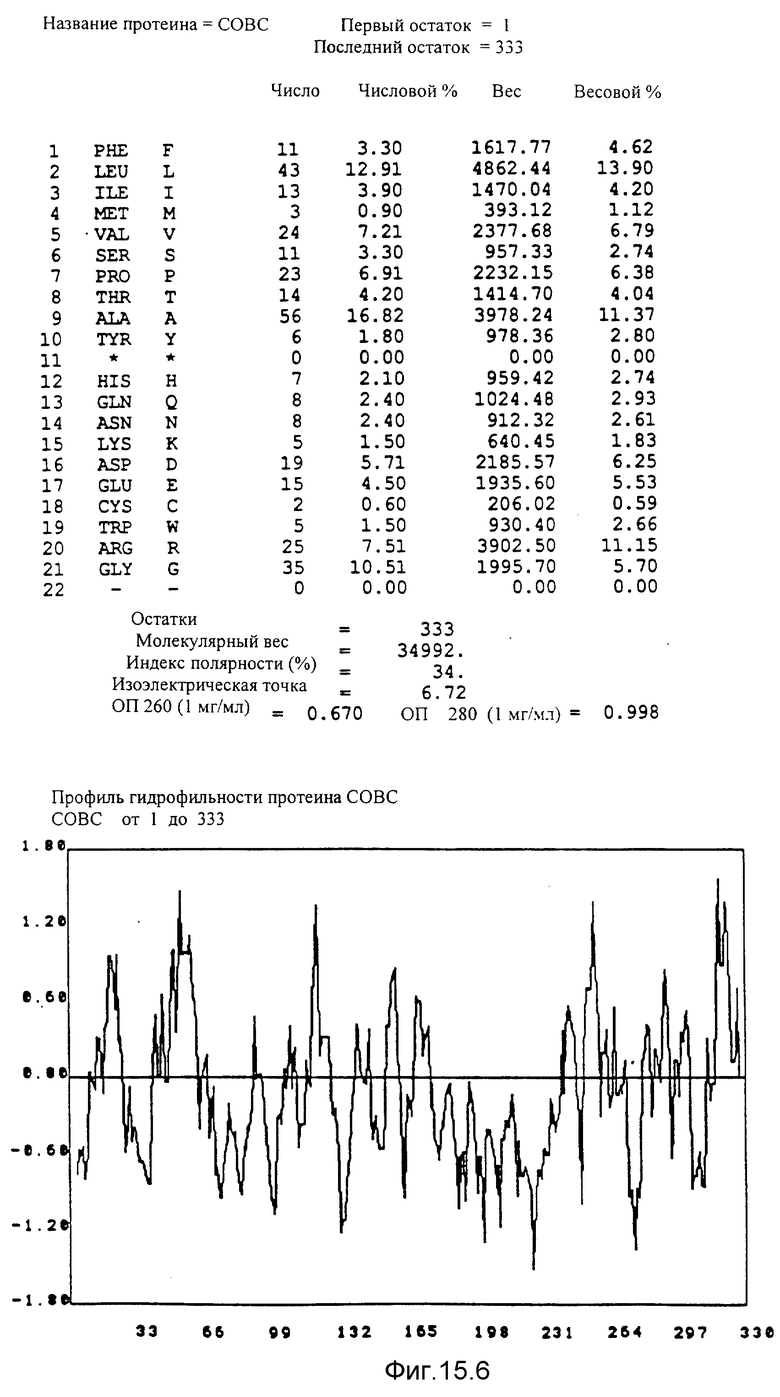





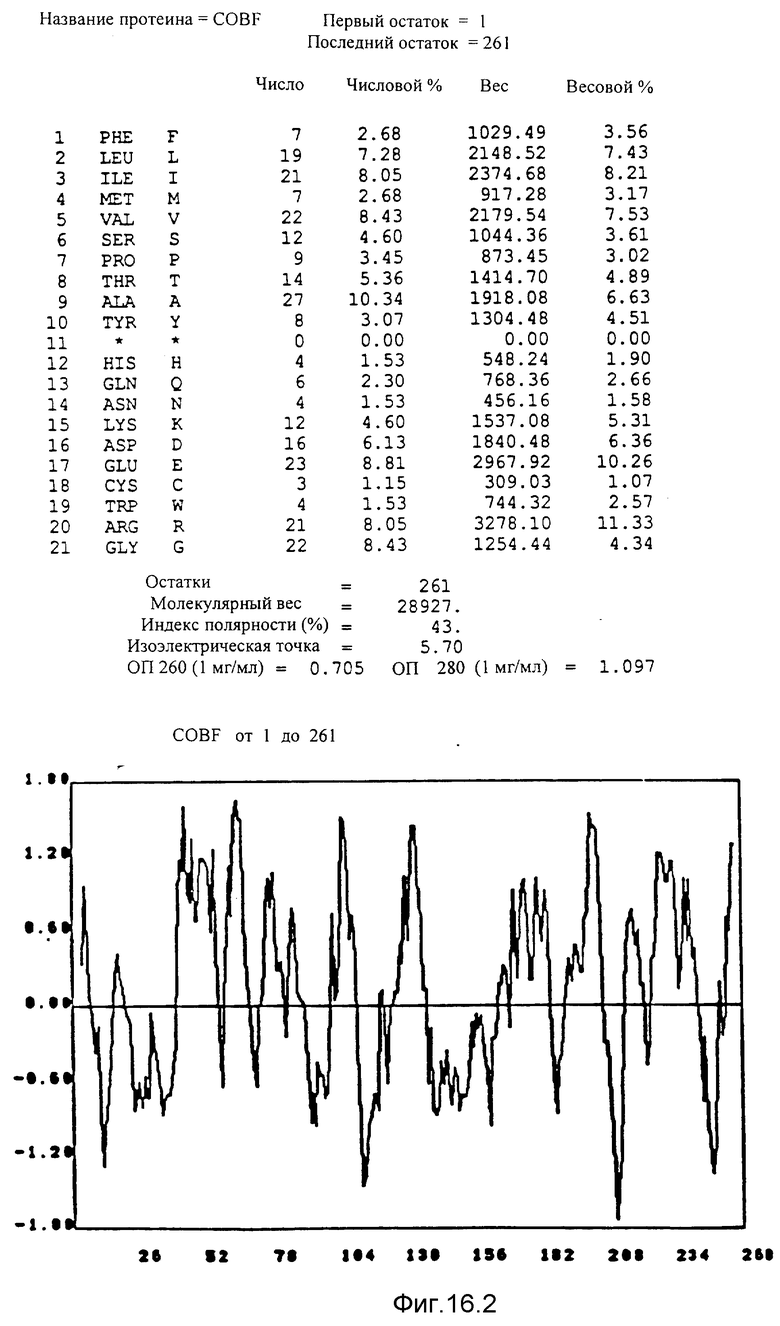

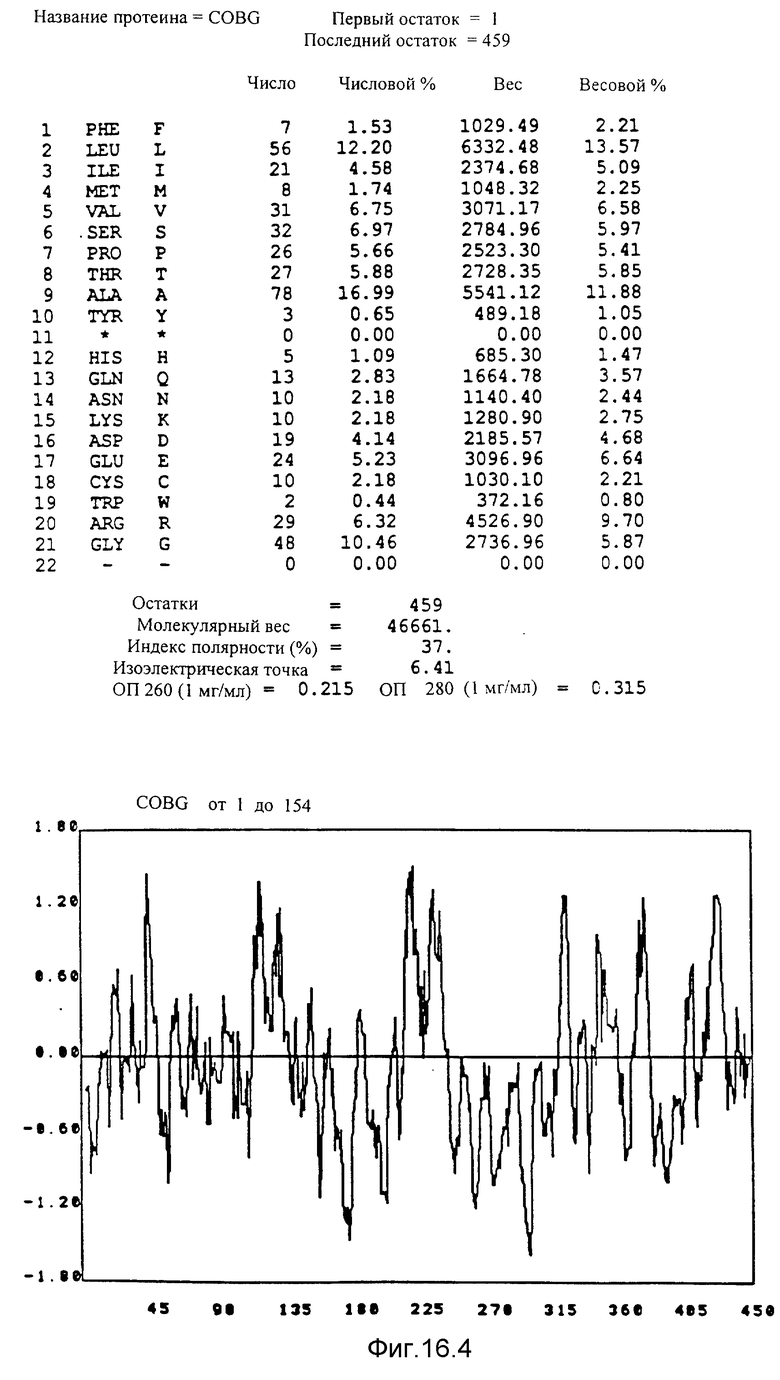



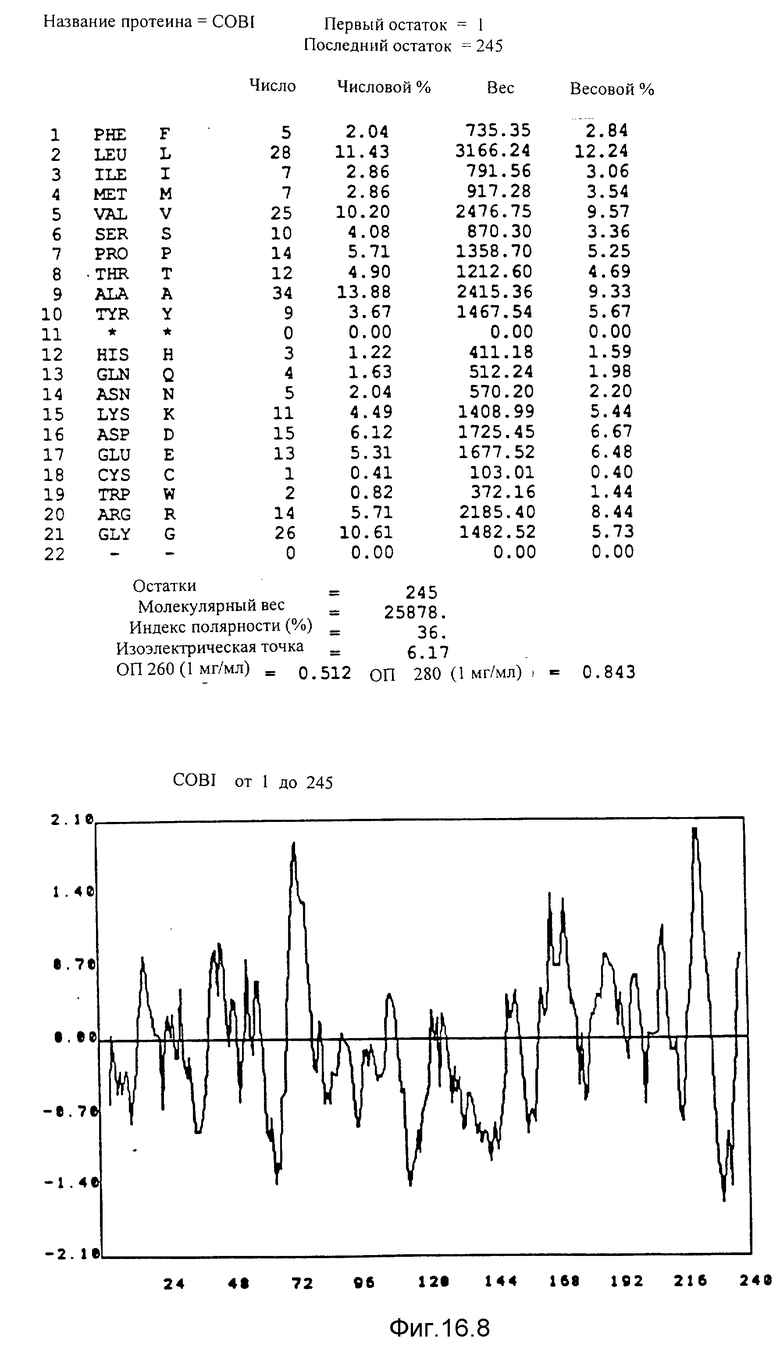



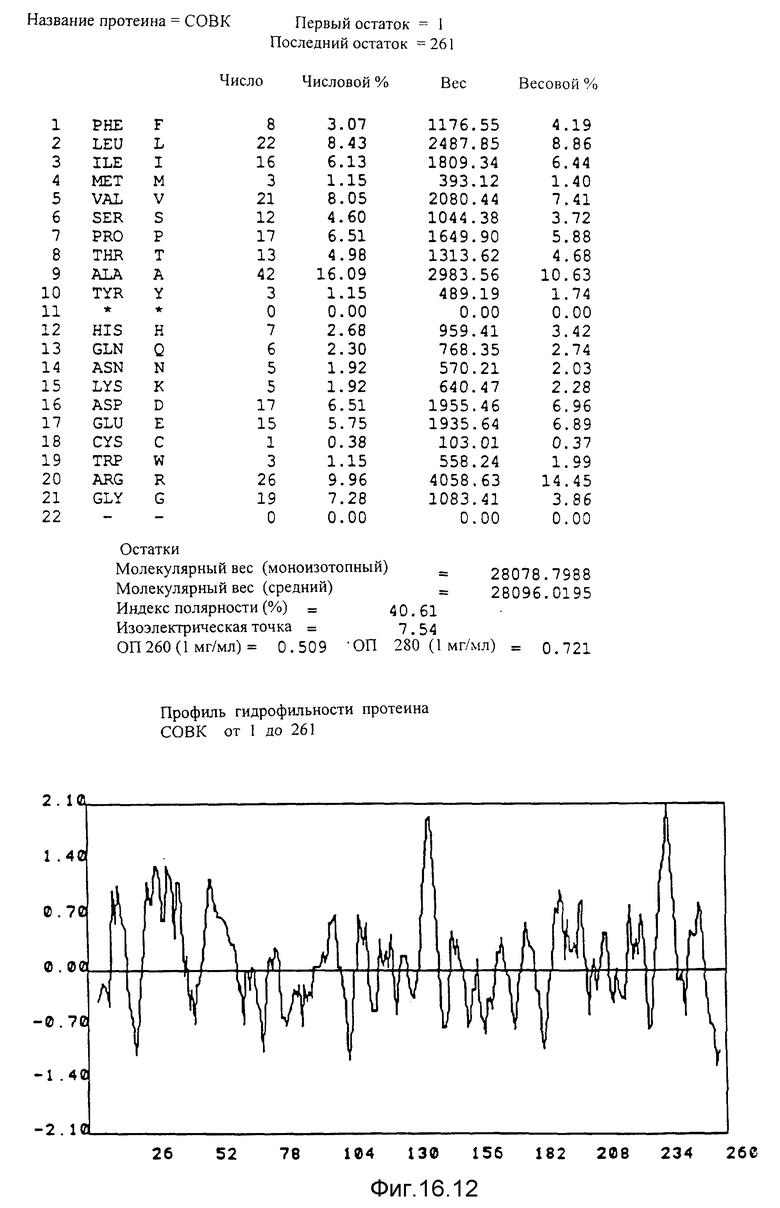

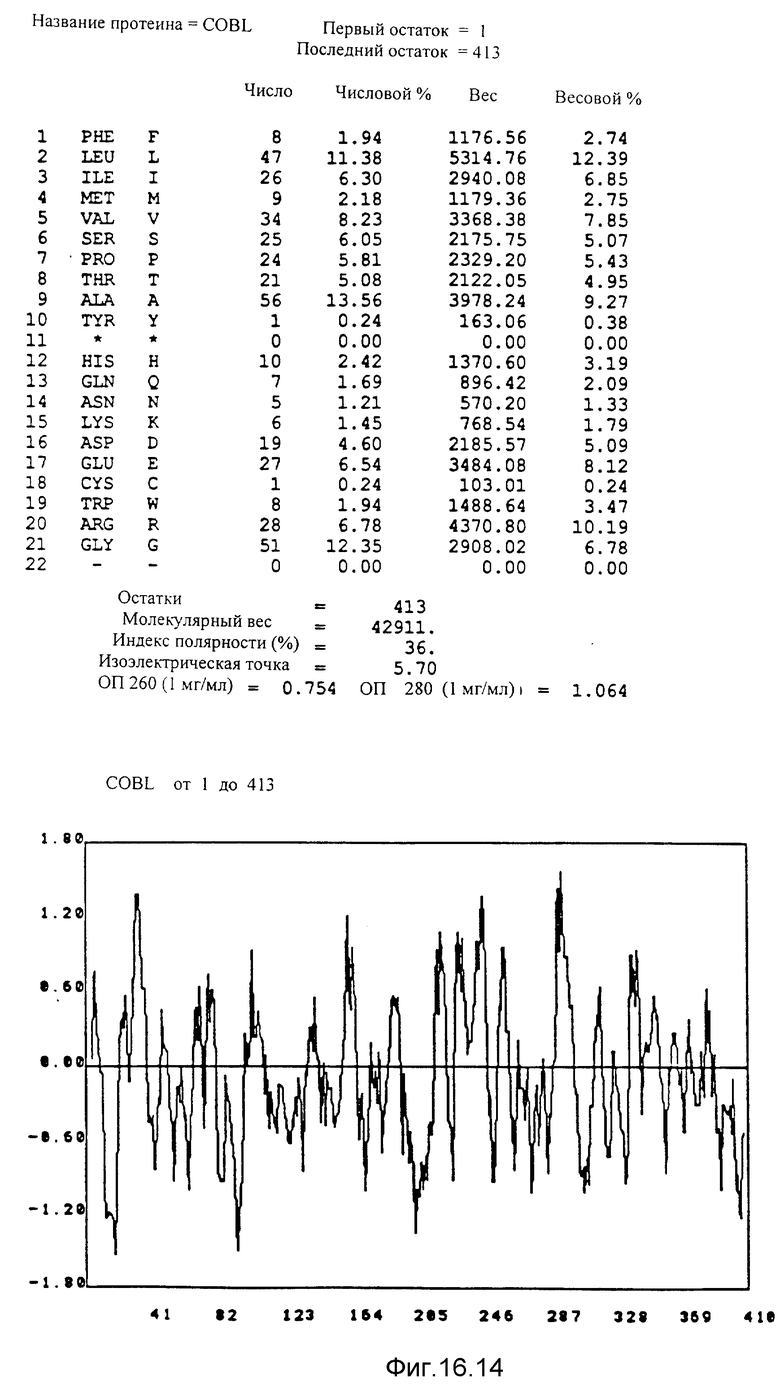


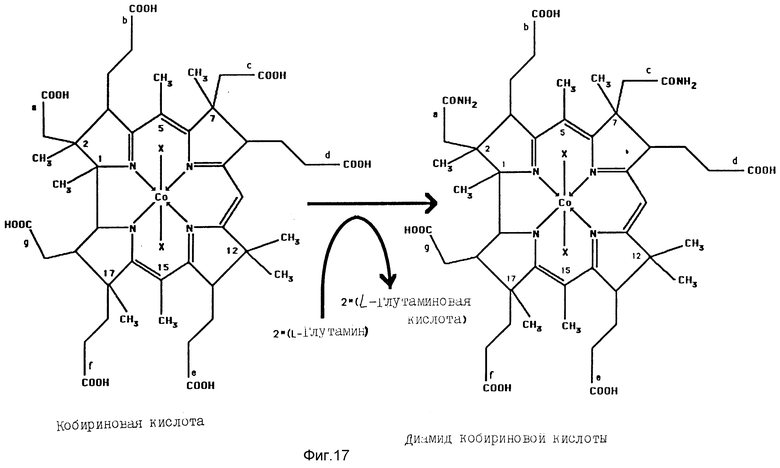
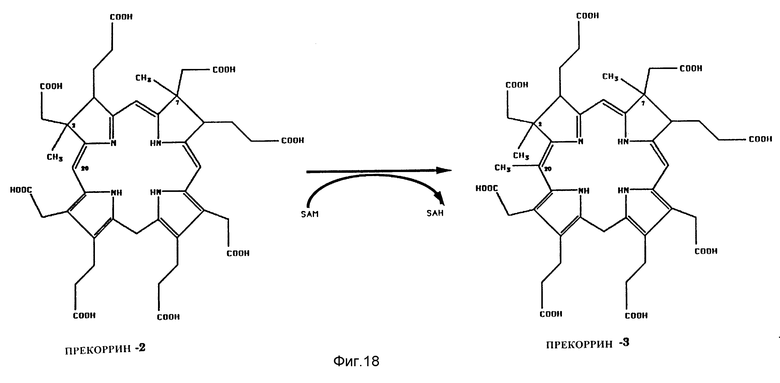


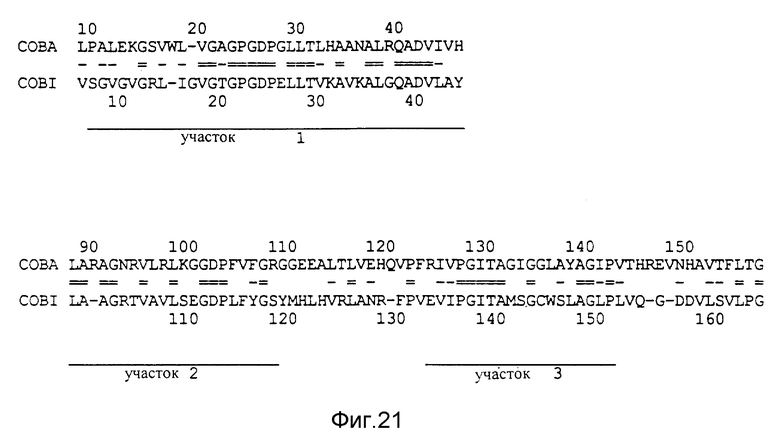




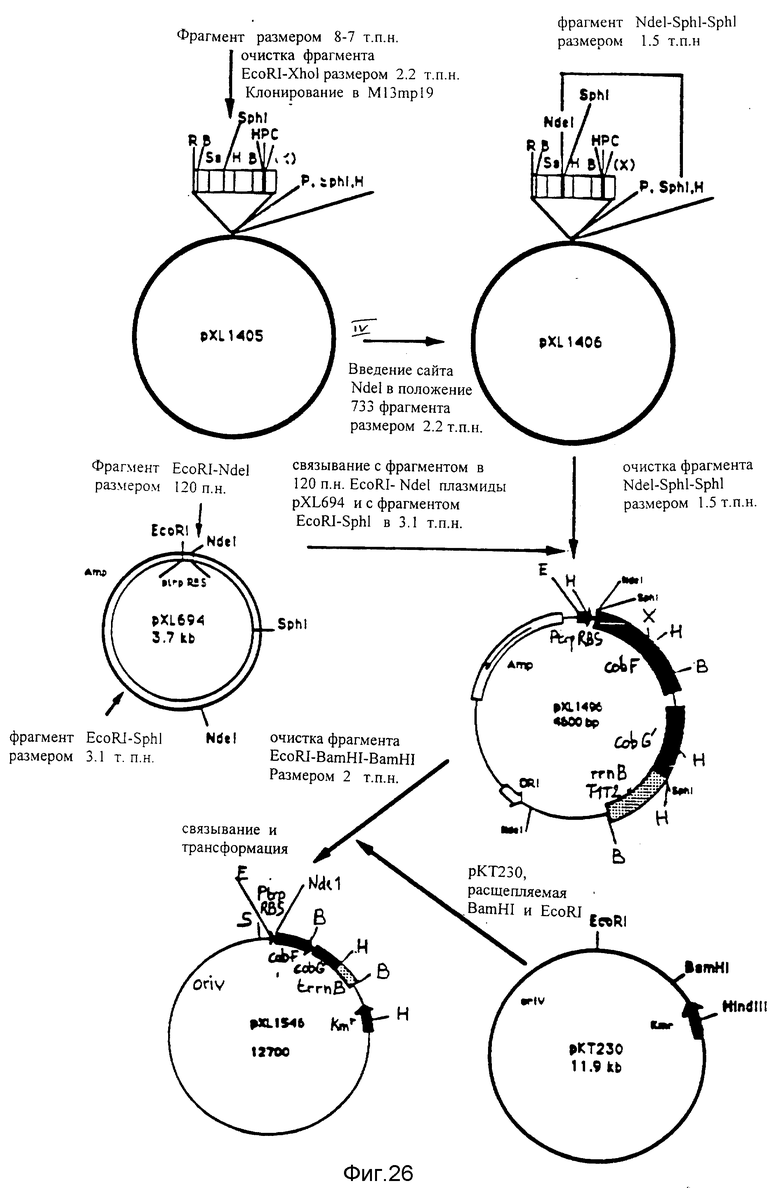
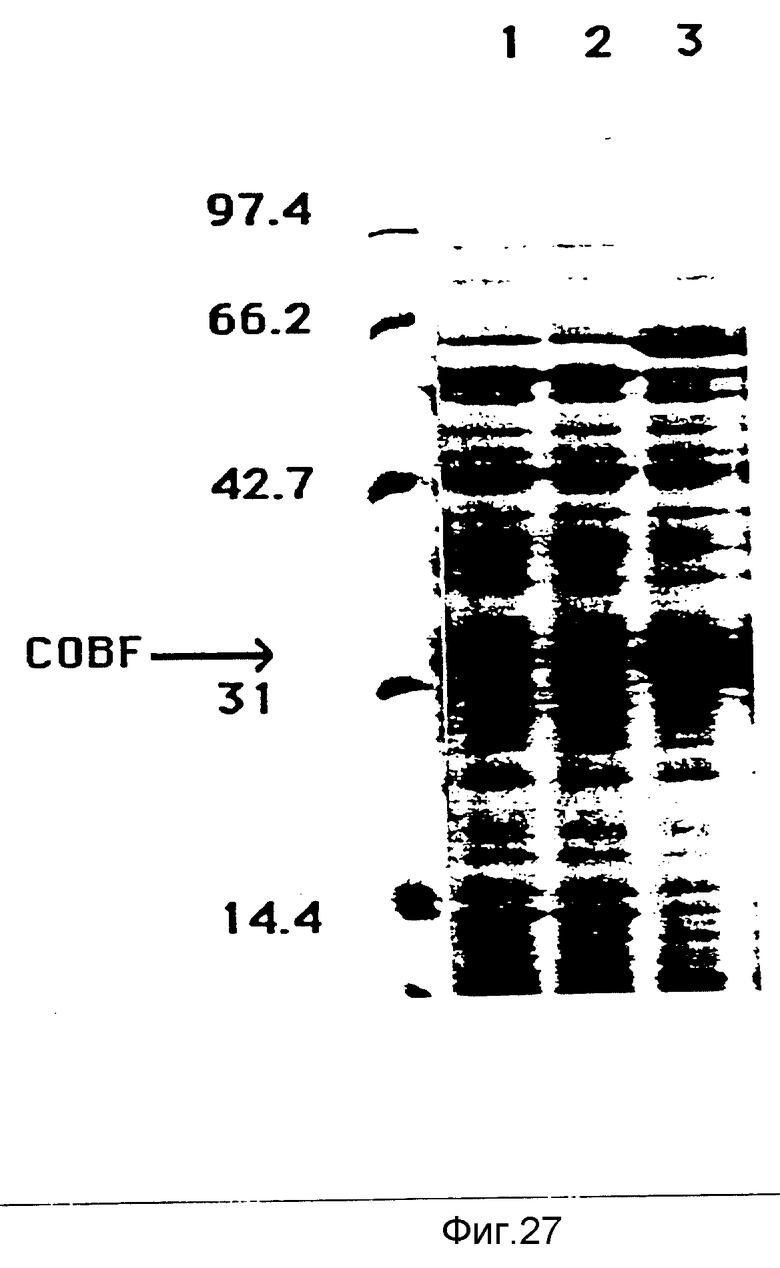


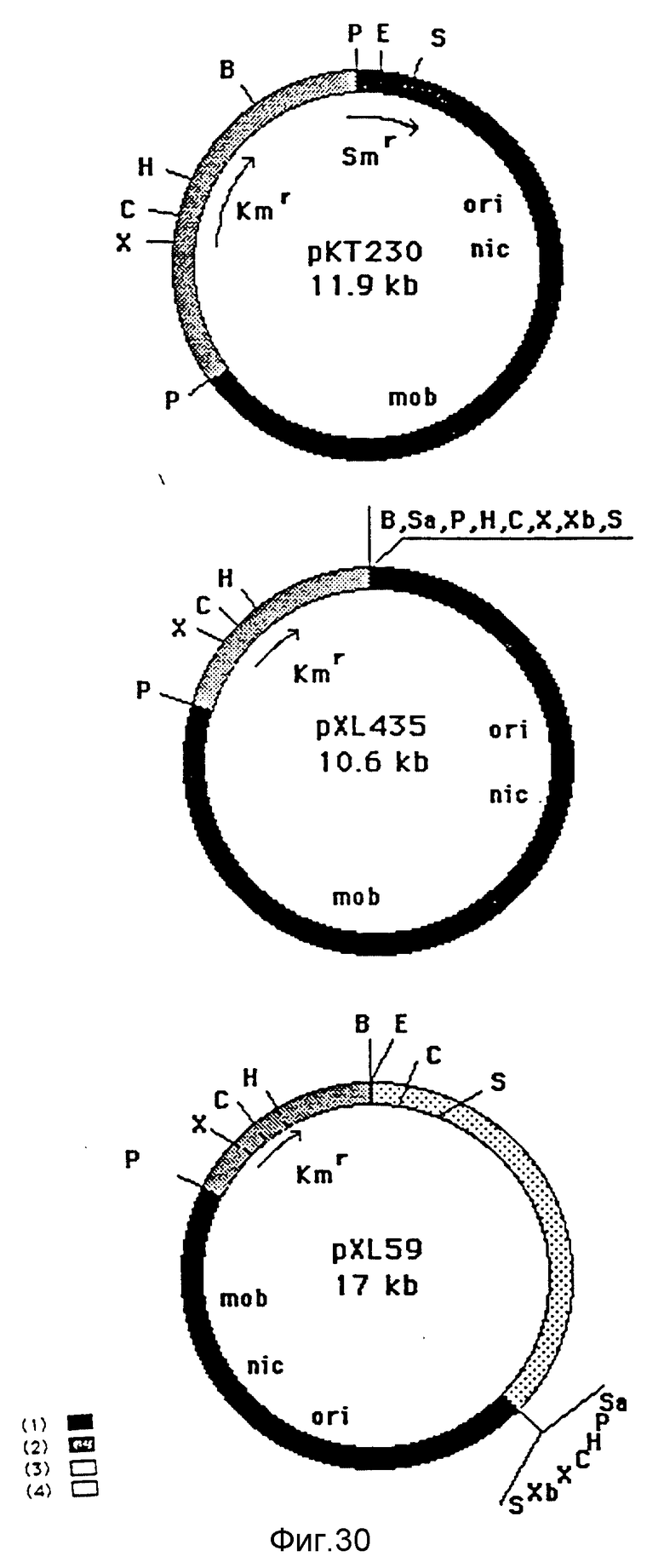













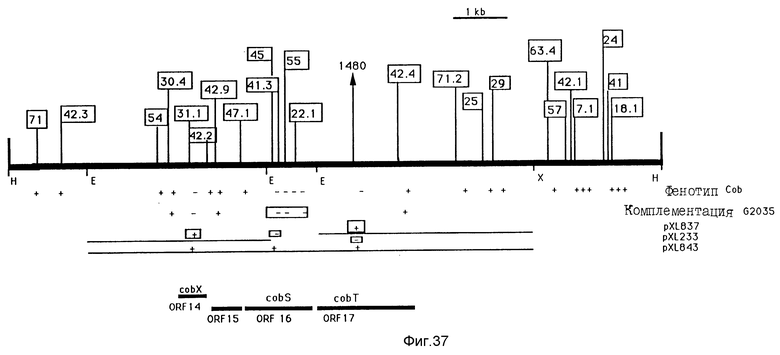
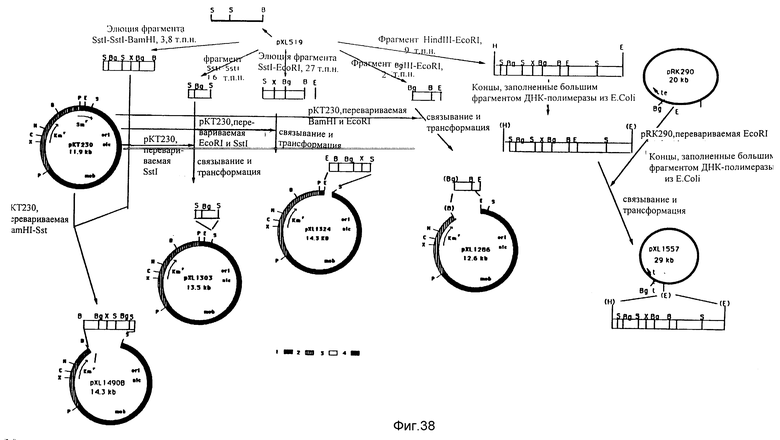
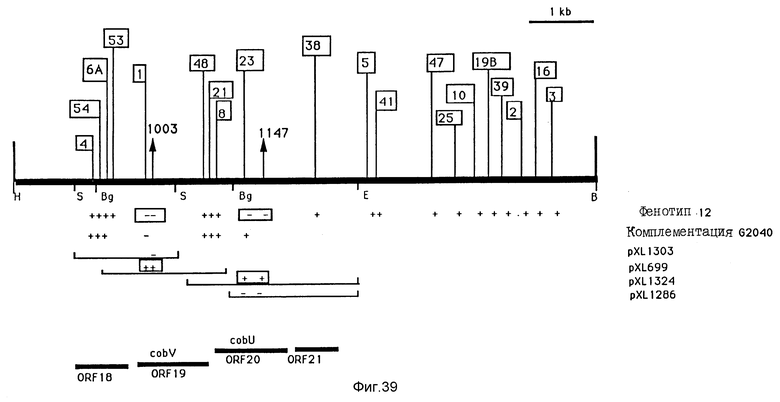
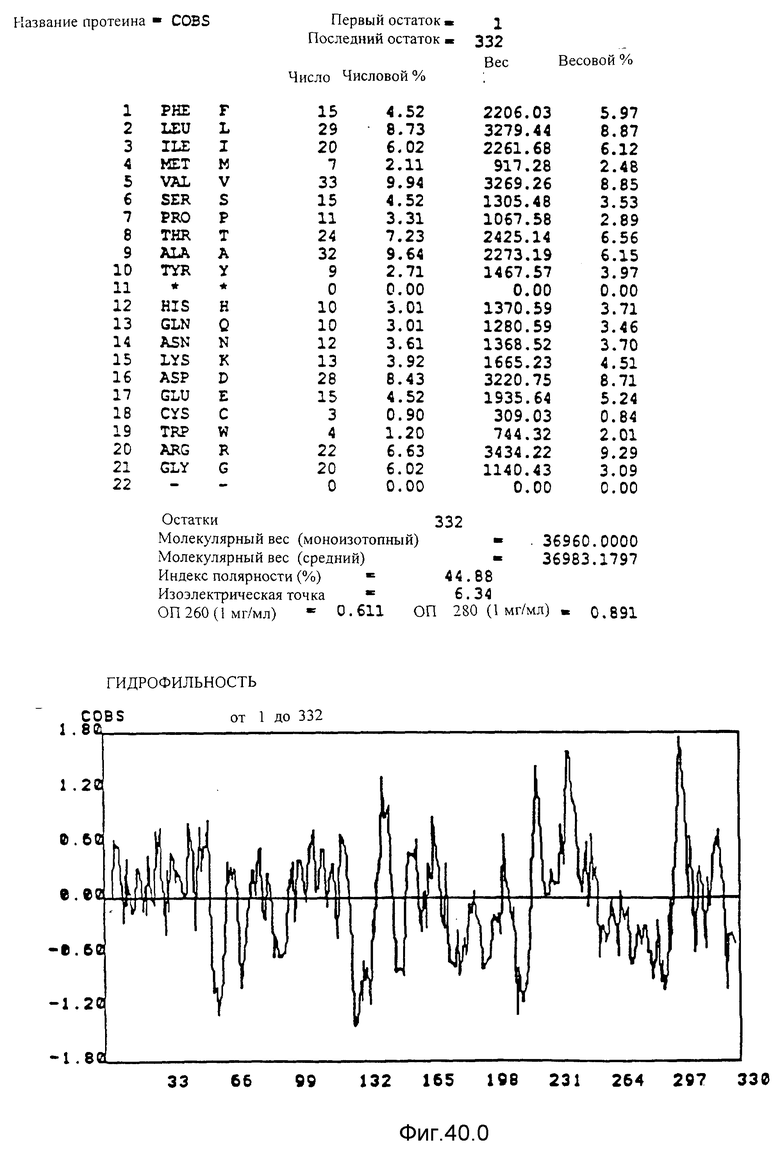






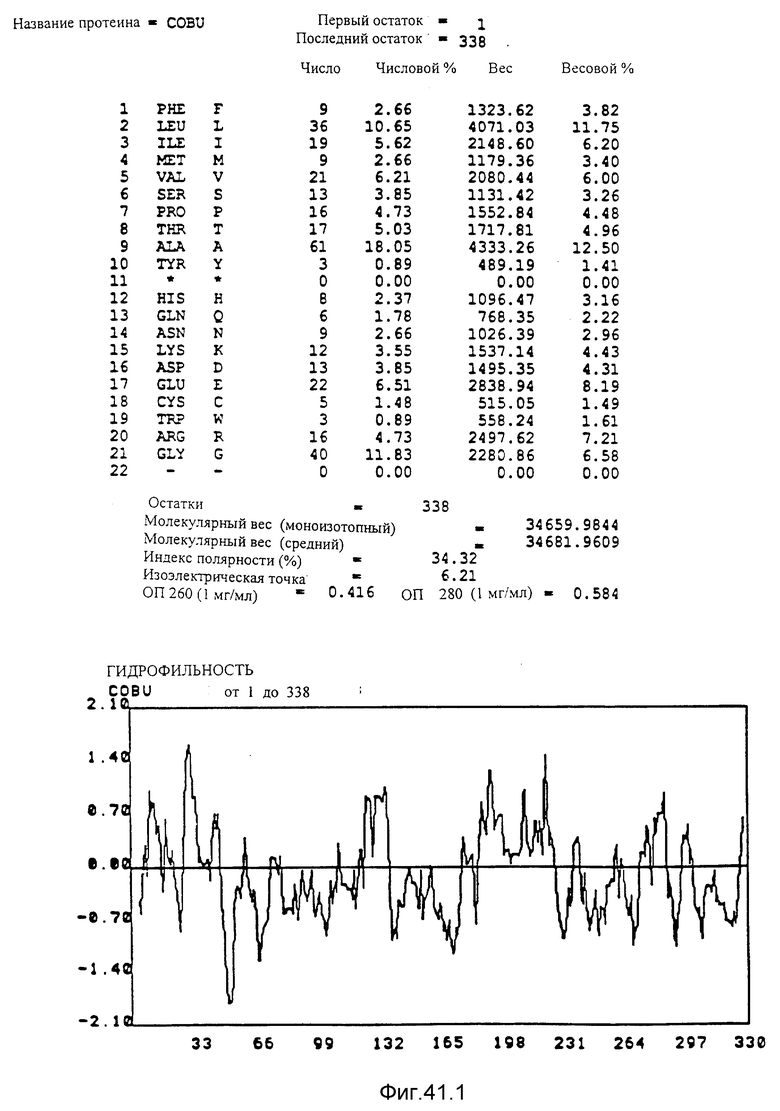



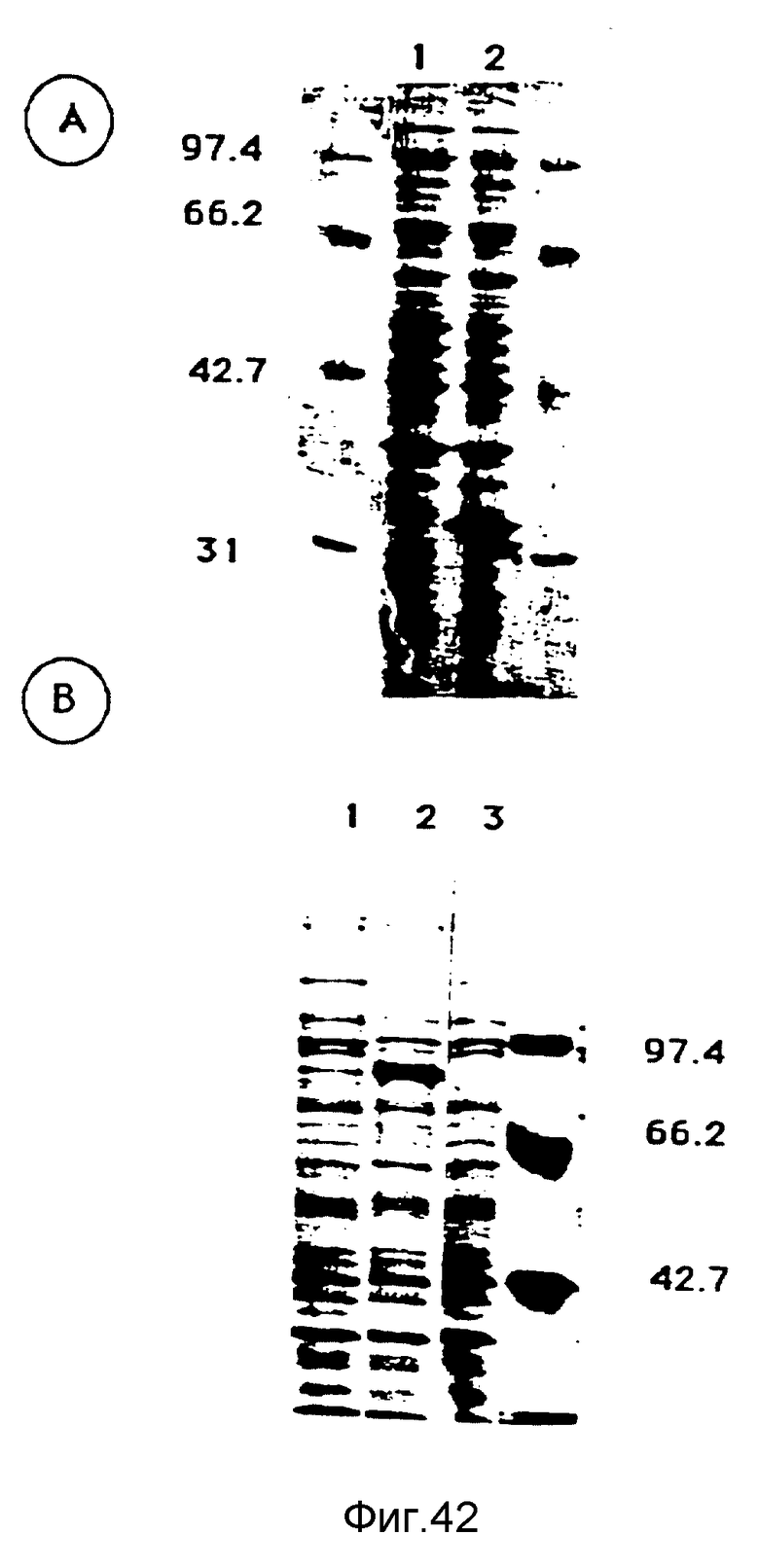




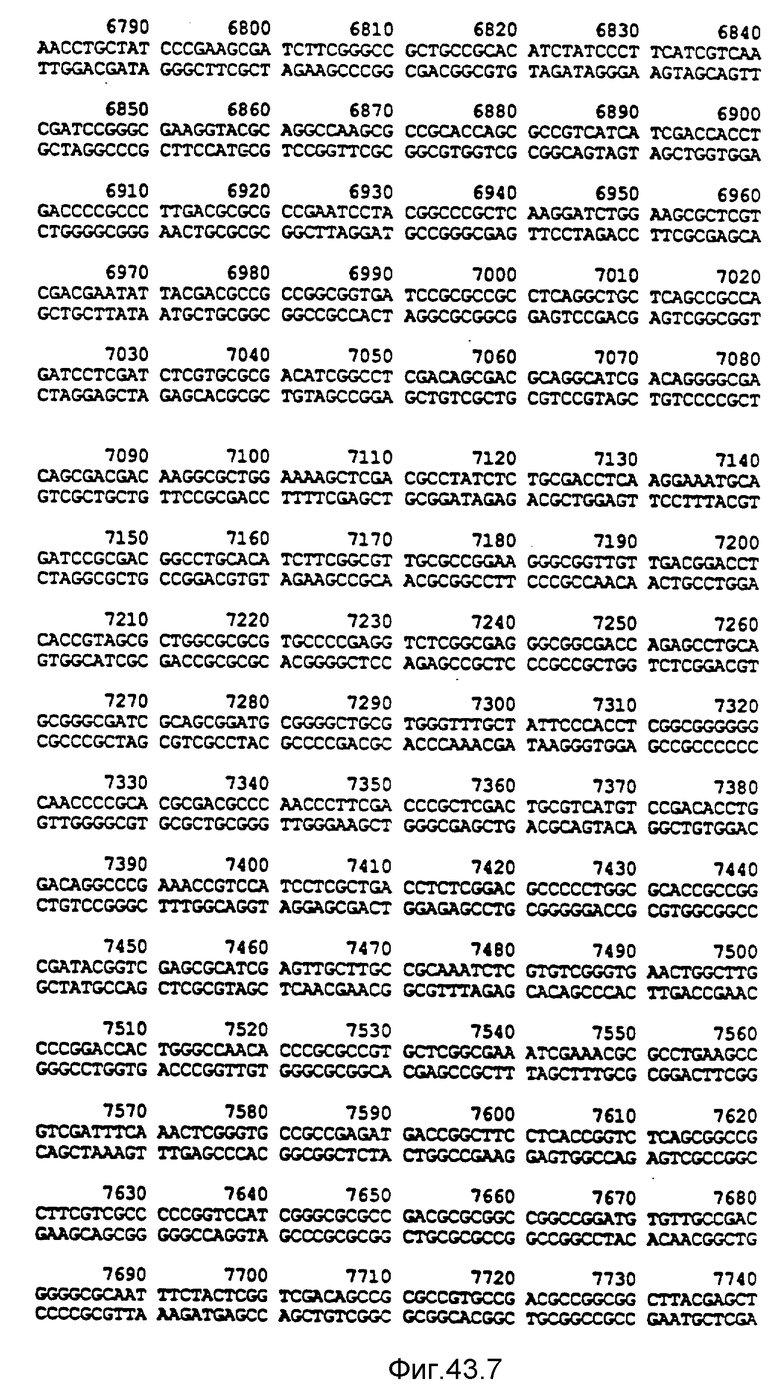
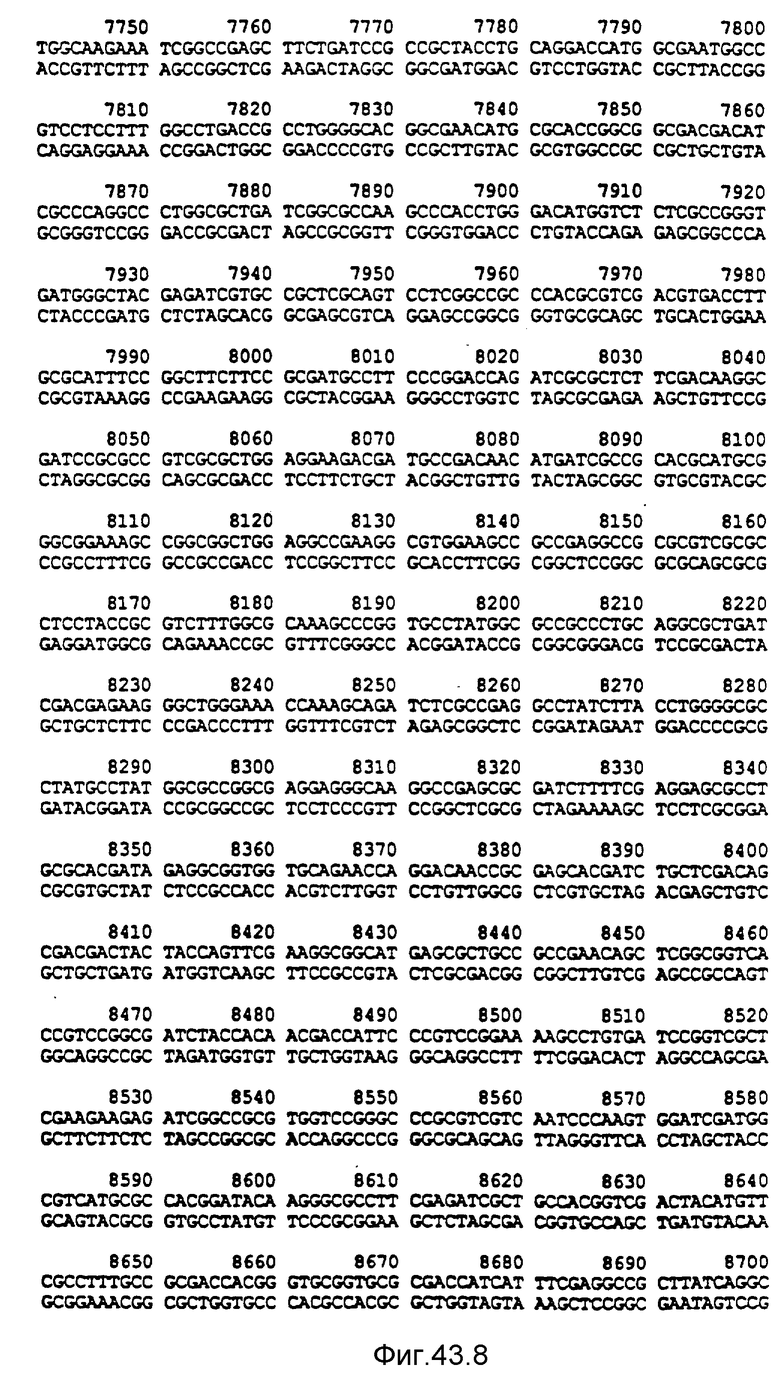

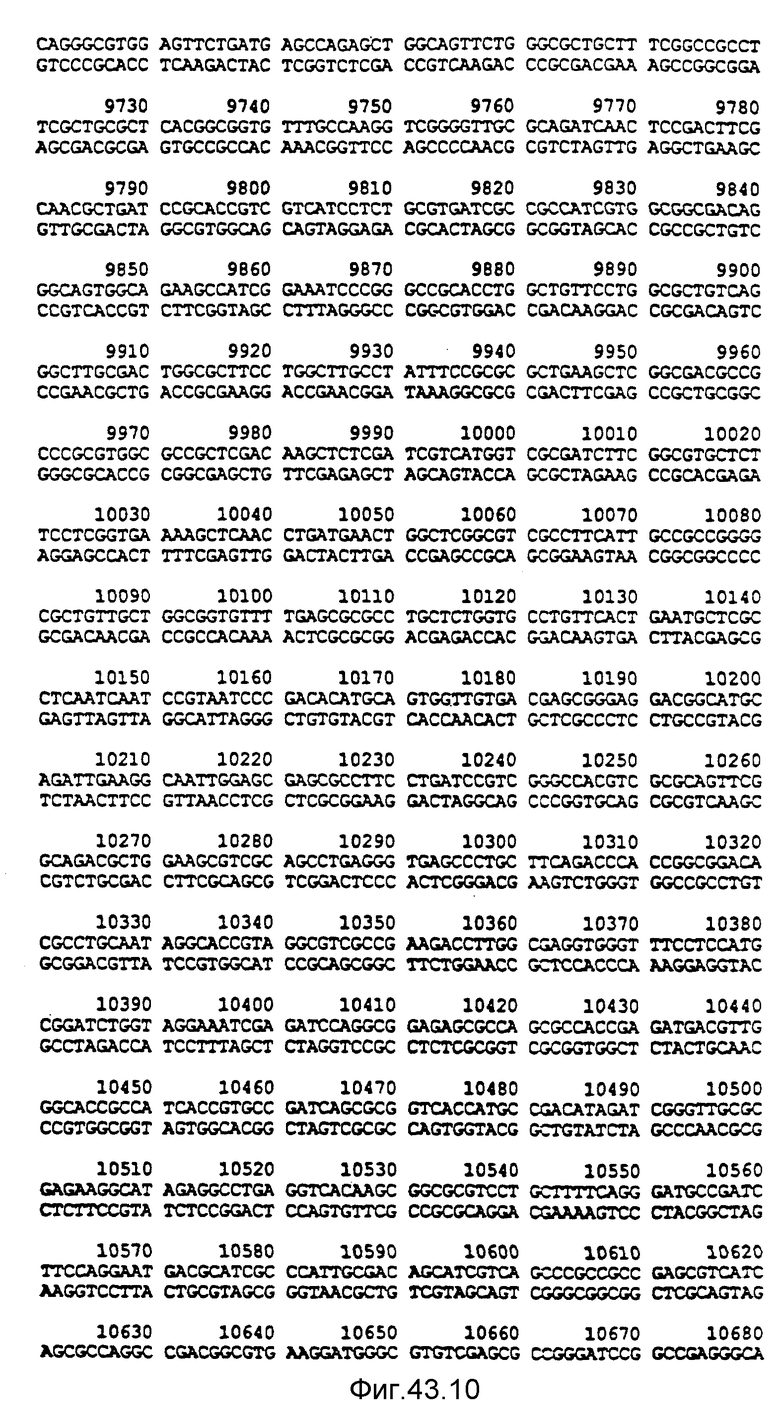


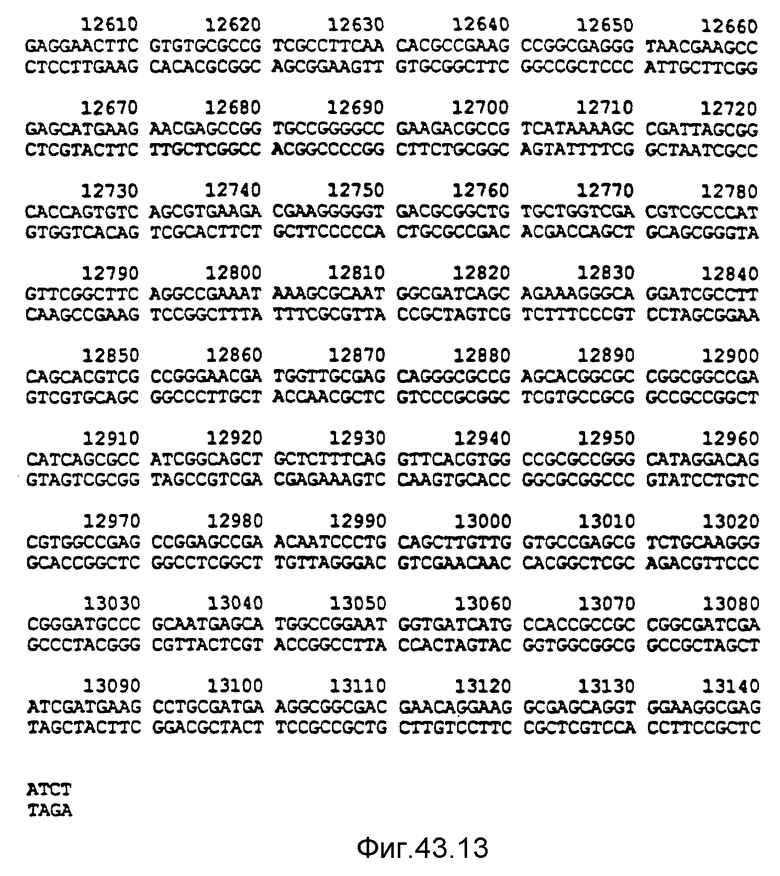



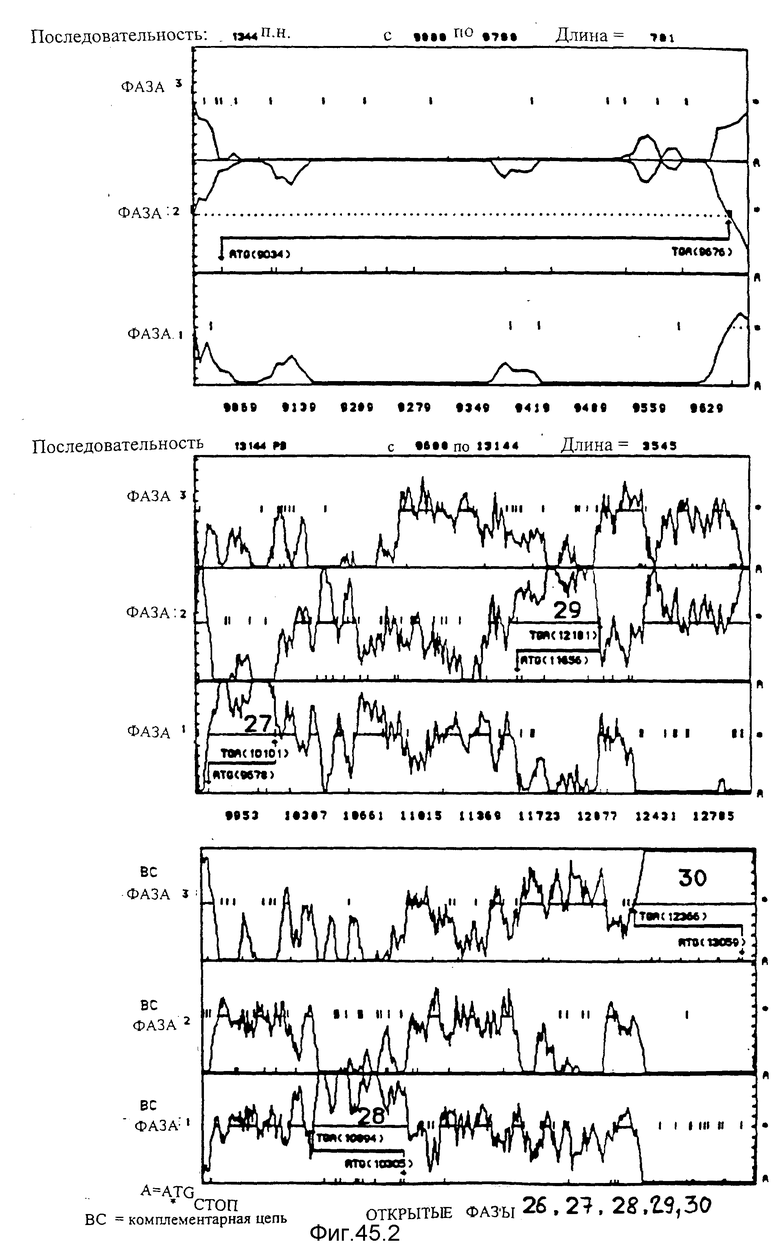


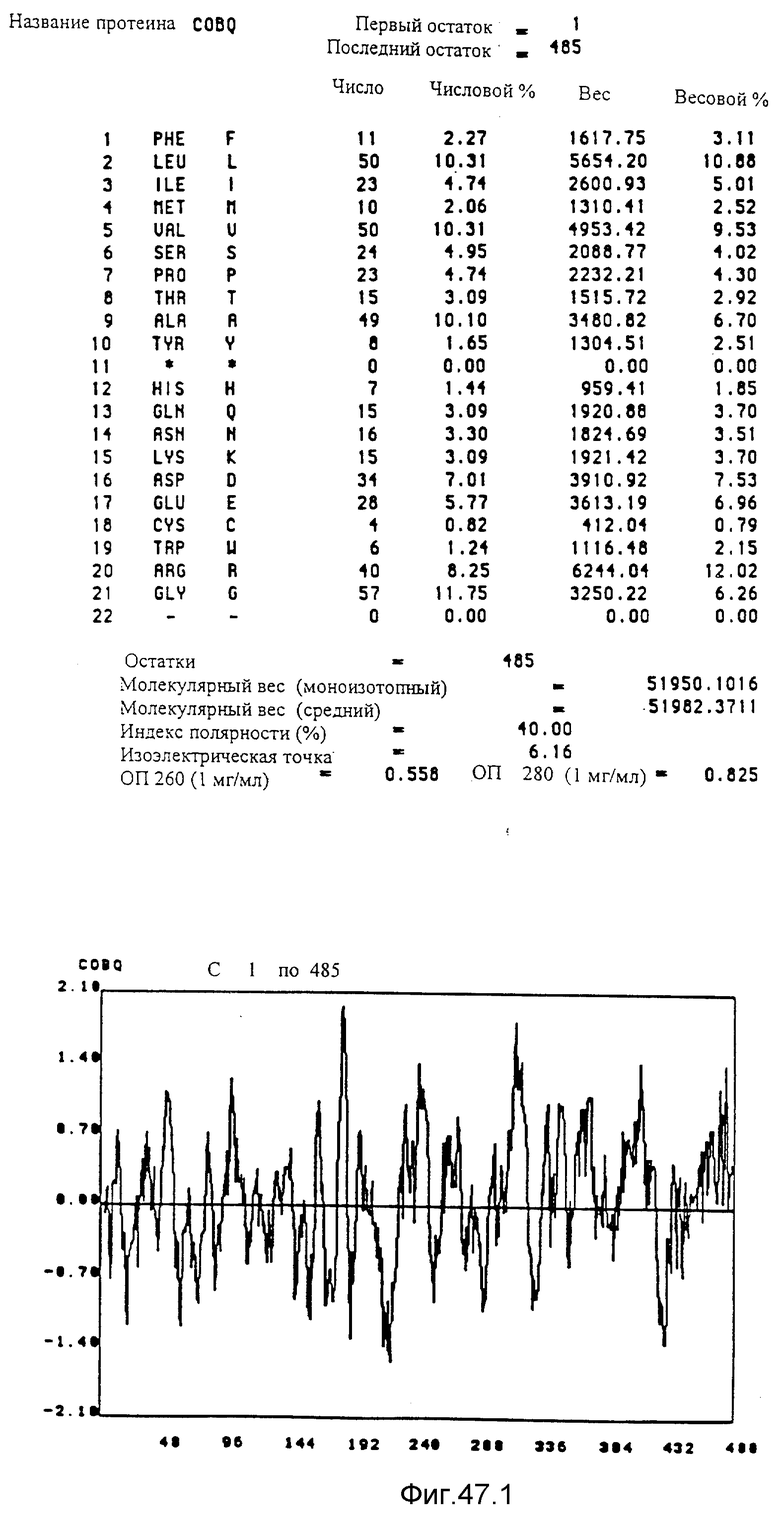

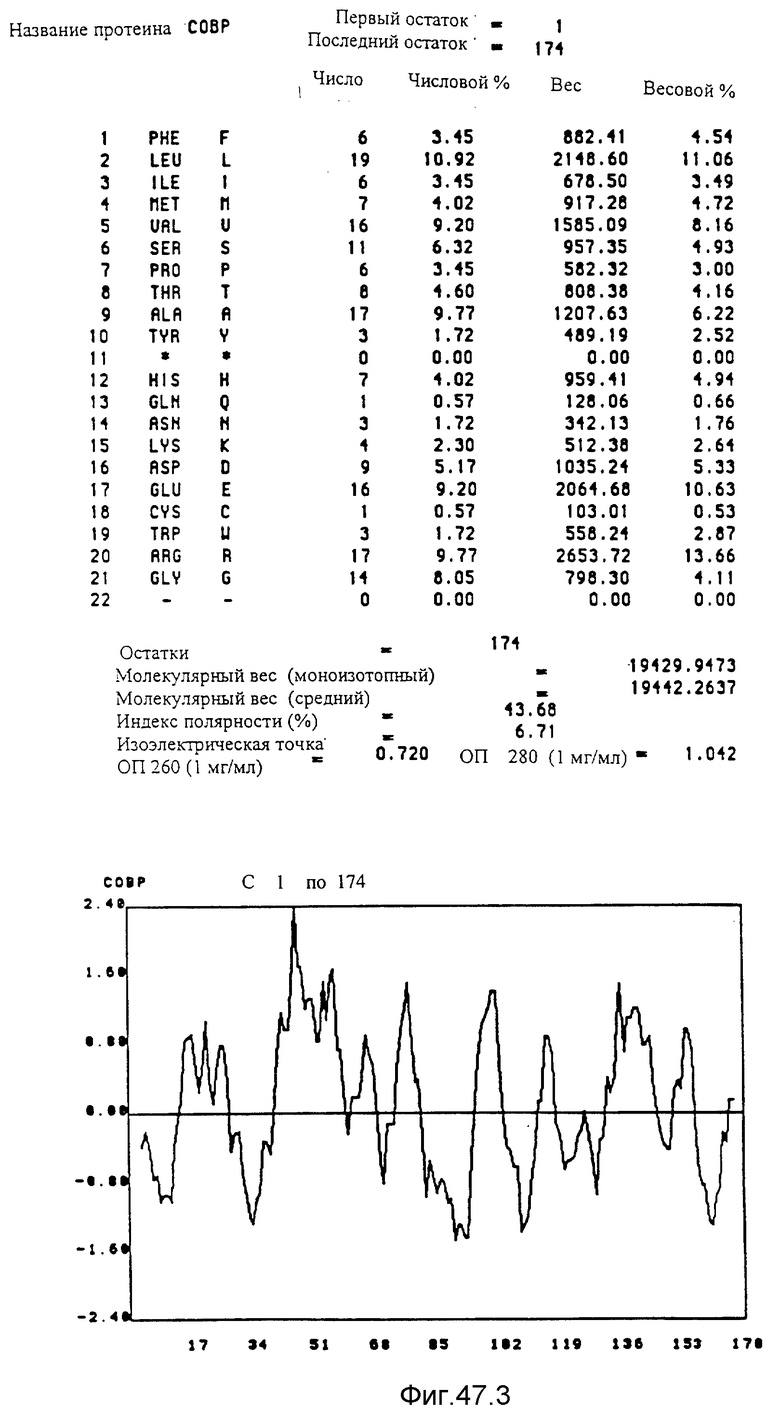

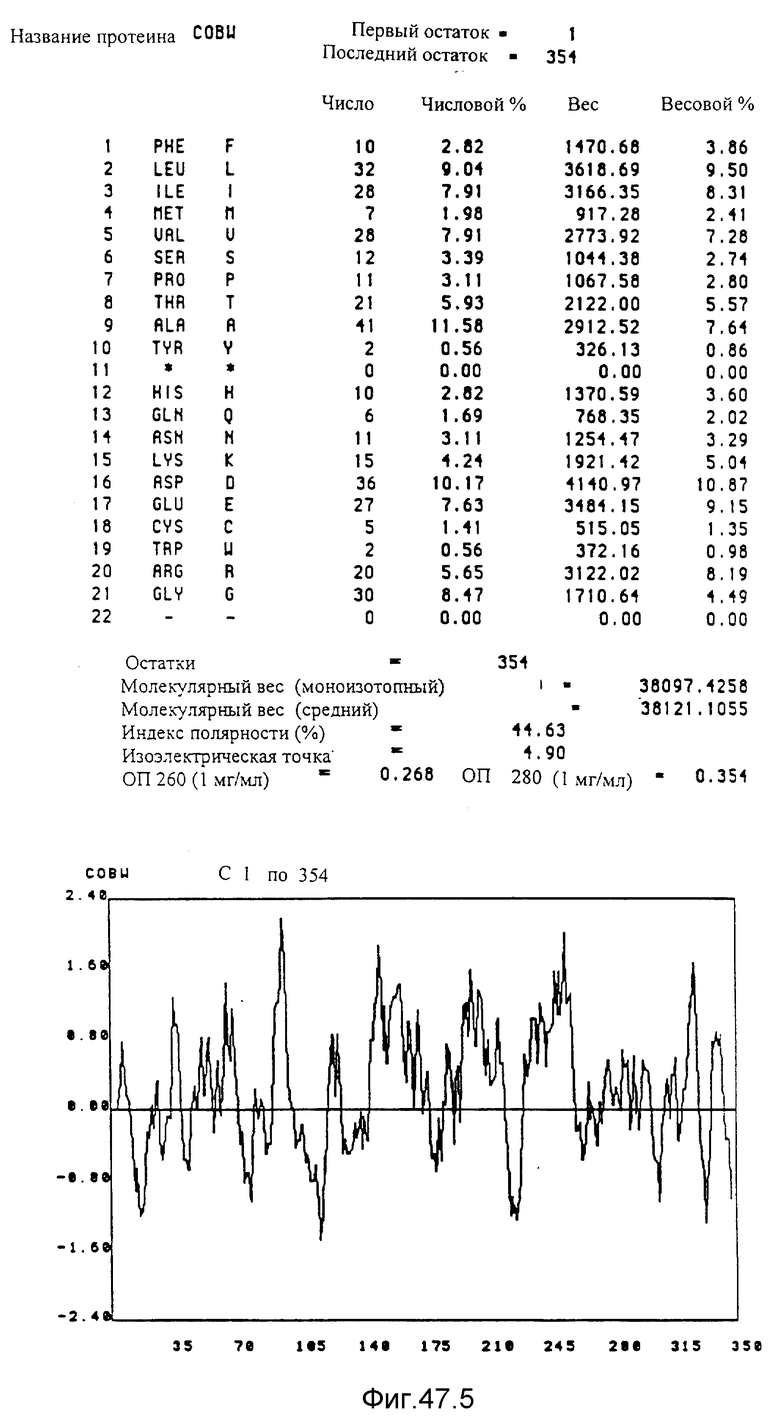



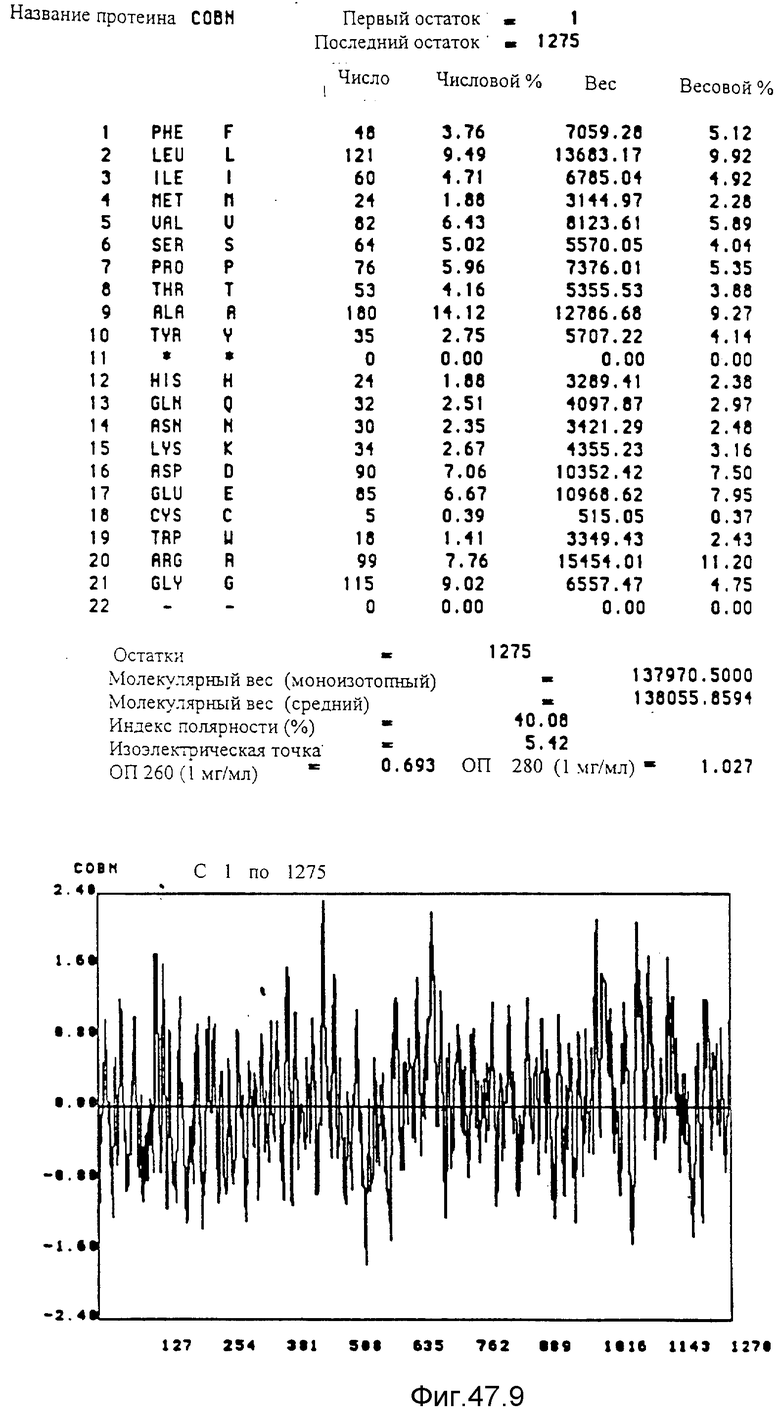

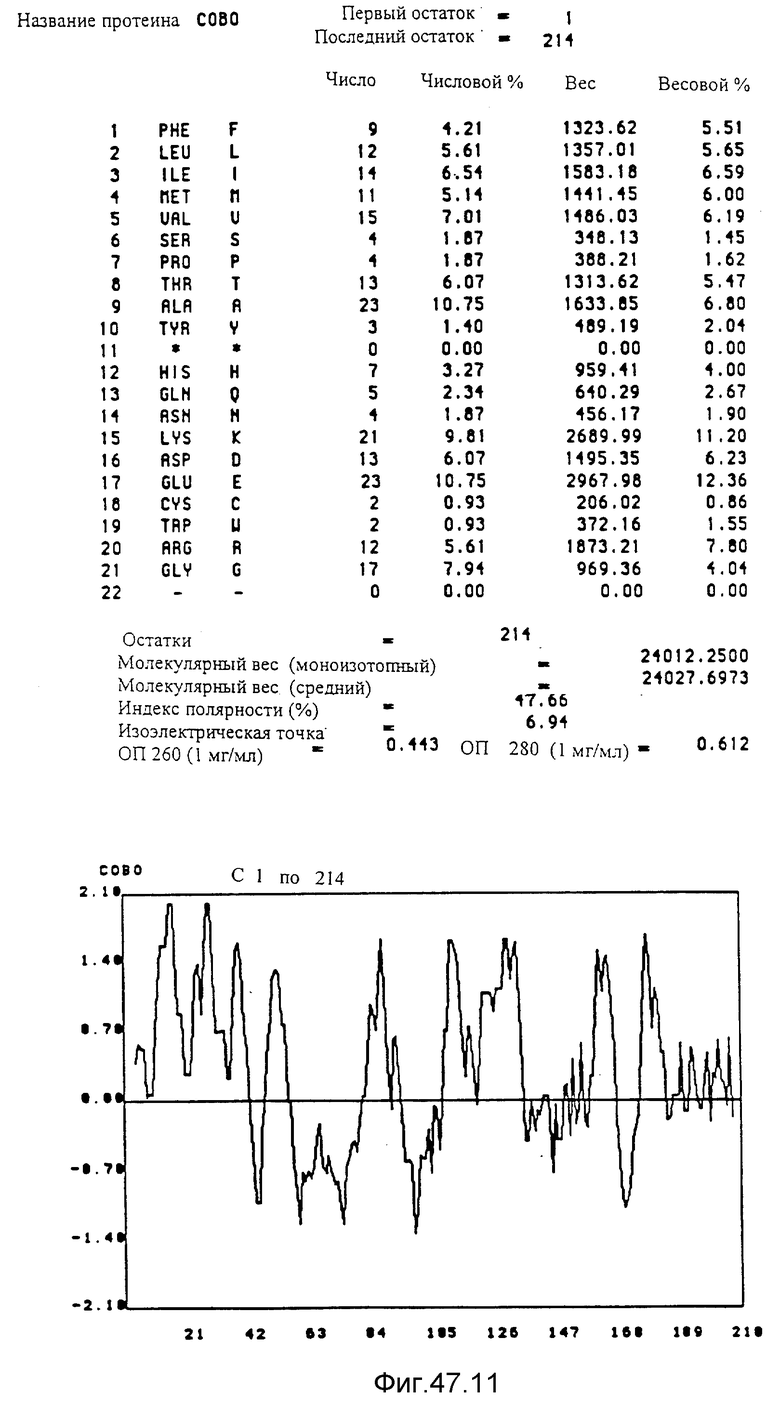




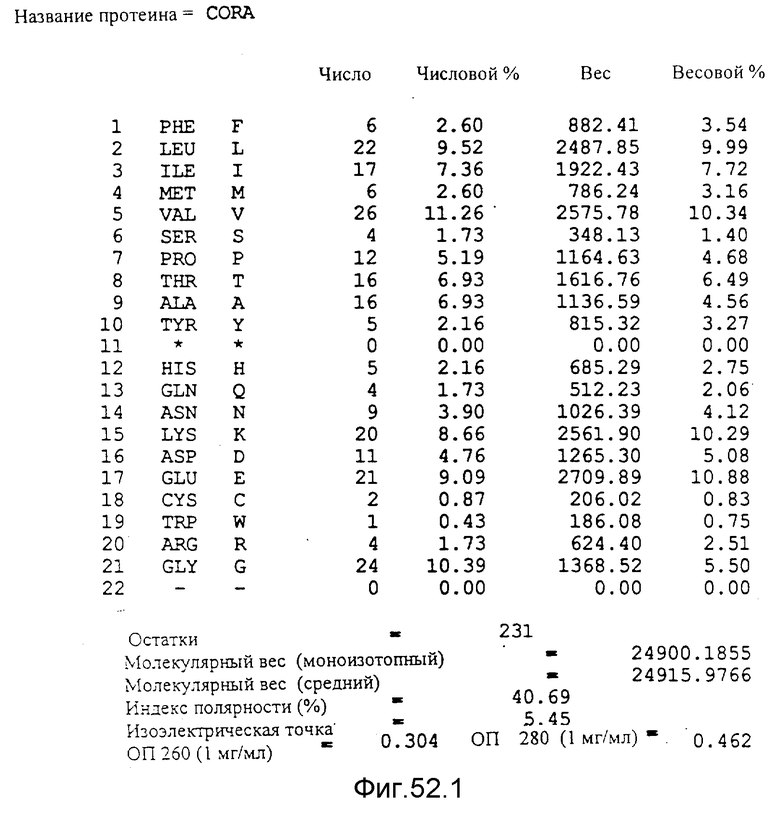



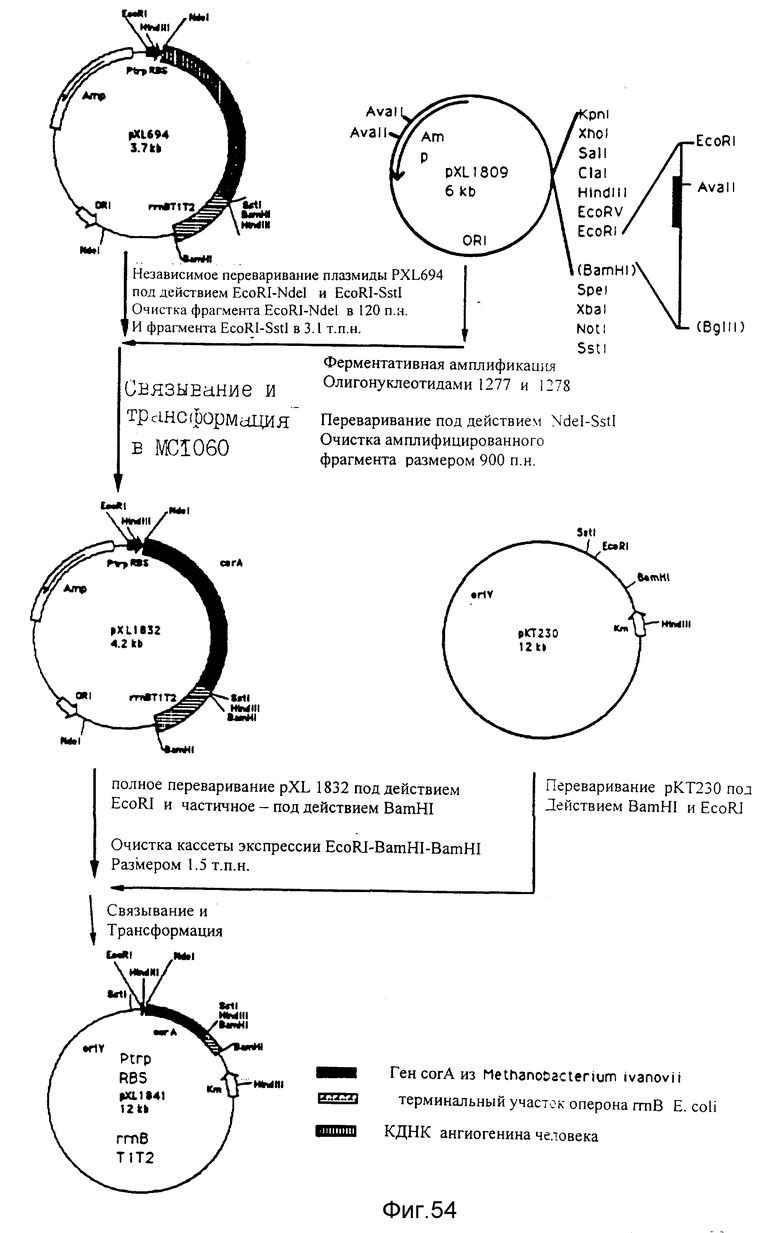
Изобретение относится к получению новых полипептидов, задействованных в биосинтезе кобаламинов. Клетки штамма продуцента кобаламинов трансформируют плазмидой, содержащей либо гены cob F - cob M оперона биосинтеза кобаламинов Pseudomonas, либо гены cob A и cob E названного оперона, либо комбинацию этих генов. Клетки культивируют в условиях, обеспечивающих биосинтез кобаламинов. Выделяют целевой продукт. Плазмида pXL 368 содержит гены cob A и cob E оперона биосинтеза кобаламинов. Плазмида pXL 367 содержит гены cob F - cob M. Плазмида pXL 525 содержит гены cob A и cob E и гены cob F - cob M. Микроорганизм Pseudomonas denitrificans SC 510 RifR несет плазмиду pXL 525 и продуцирует кобаламины. Способ позволяет повысить продуктивность штамма, осуществляющего биосинтез кобаламинов. 5 с. и 9 з.п. ф-лы, 23 табл., 54 ил.
| Brey R.N., Banner C.D.B., Wolf J.D., 1986, Cloning of Multiple Genes Involved with Cobalamin (Vitamin B12) Biosynthesis in Bacillus megaterium | |||
| J | |||
| Bacteriol., 167, 623-630 | |||
| Barrere G., Geneste B., Sabatier A., 1981, Fabrication de la vitamine B12 : l'amelioration d'un procede | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Cameron B., K | |||
| Briggs, S, Pridmore, G | |||
| Brefort and J | |||
| Crouzet, 1989 | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| J | |||
| Bacteriol., 171, 547-557 | |||
| Щелкунов С.Н | |||
| Конструирование гибридных молекул ДНК, Новосибирск: Наука, 1987, с.164. | |||
Авторы
Даты
1999-09-10—Публикация
1991-01-30—Подача