Изобретение относится к медицине и может быть использовано в хирургической гастроэнтерологии при лечении ахалазии пищевода.
Ахалазия пищевода - хроническое нейтромышечное заболевание всей гладкой мускулатуры пищевода, вызываемое целым рядом причин, имеющее стадийное рецидивирующее течение, проявляющееся отсутствием рефлекторного раскрытия кардии при глотании, а также расширением, изменением формы вышерасположенных отделов пищевода, нарушением его тонуса и перистальтической деятельности.
До последнего времени этиология и патогенез этого заболевания во многом остаются неясными, диагностика требует специальных исследований, нет единой точки зрения на способ лечения.
В обширной литературе данное заболевание обозначается как кардиоспазм, френоспазм, хиатоспазм, идиопатическое (картиотоническое) расширение пищевода, мегоэзофагус и др. Впервые эту патологию описал Томас Виллис (1636), Hoffman (1733) дал ей название disphagia spasmodica, в отечественной литературе она известна по описанию Экка В.Е. (1854).
В литературе существует представление, что больные ахалазией пищевода составляют 1% всех больных отделения хирургической гастроэнтерологии, 4,5% больных с нарушениями глотания, 17% всех обследованных с различными болезнями пищевода, в среднем от 3,1 до 20%.
Способы лечения ахалазии пищевода вызывают широкую дискуссию в литературе. Это связано в основном с тем, что отсутствует патогенетическая терапия. Современное лечение данного заболевания направлено главным образом на устранение функционального барьера в виде нерасслабившегося нижнего пищеводного сфинктера и может осуществляться дилятаторами хирургическим путем, а в отдельных случаях - с помощью лекарственных средств. Если фармакотерапия настоящего заболевания имеет сугубо вспомогательное значение, то вопрос о преимуществе двух первых методов до настоящего времени не решен.
Следует отметить, что эффективность всех оперативных вмешательств, несмотря на множество предложенных модификаций (около 50), оказалась недостаточно высокой в плане развития осложнений в послеоперационном периоде (рефлюкс-эзофагит, пептические язвы пищевода, стриктуры), а, также рецидива заболевания. Все эти осложнения грубо нарушают качество жизни оперированных больных, приводят к потере трудоспособности, частой инвалидизации, требуют повторных сложных операций. Неудовлетворенность результатами хирургического лечения ахалазии пищевода является причиной продолжающегося поиска новых способов оперативного лечения ахалазии пищевода.
Таким образом, разработка и повсеместное внедрение новых способов хирургического лечения ахалазии пищевода является актуальной проблемой современной гастроэнтерологии.
Известен способ хирургического лечения ахалазии пищевода. Heller E. (1913) (Mitt. Grenzgeb.med. Chir., 1913, 27, 141) впервые произвел внеслизистую эзофагокардиомиотомию. Сущность операции заключается в том, что абдоминальным доступом мобилизуют суженный участок пищевода и низводят его в брюшную полость. После этого мышечную оболочку в суженном сегменте пищевода продольно рассекают по передней и задней стенке до слизистой оболочки.
Голландский хирург De Bruin-Groeneveldt (1918), несколько видоизменив операцию Геллера, предложил рассекать только переднюю стенку пищевода и кардии. В этом виде она стала применяться хирургами различных стран, причем не только абдоминальным доступом, но и трансторакально. Операция Геллера предусматривает расхождение краев рассеченных мышц пищевода, пролабирование слизистой оболочки и расширение суженного просвета пищевода. Для эффективности необходимо полное пересечение всех циркулярных мышечных волокон. Эффективность операции достаточно высока - хорошие и отличные результаты достигаются в 79 - 91%. Летальность, по сводным данным, составляет 0.7 - 1.5%. Множество рецидивов (36 - 50%) и отсутствие эффекта в 9 - 14%, разнообразные осложнения в ближайшем и отдаленном периоде после операции Геллера связывают с неполным рассечением мышц кардии из-за боязни повредить слизистую оболочку пищевода. Рецидив возникает из-за развития рубца между краями пересеченных мышц с восстановлением их тонуса.
Нередко после операции возникает недостаточность кардии с последующим развитием рефлюкс-эзофагита и пептических стриктур пищевода. Некоторые авторы считают рефлюкс-эзофагит частым и тяжелым осложнением операции Геллера и находят его у 14 - 37% больных. Возможны и другие осложнения - перитонит из-за просмотра повреждения слизистой оболочки пищевода, образование дивертикулов, кровотечения из пептических язв пищевода и его рубцовый стеноз.
Прототипом послужила операция, предложенная Черноусовым А.Ф. и соавт. (Хирургия, 1986, N 12, с. 14 - 19). Авторами была разработана антирефлюксная кардиопластическая операция: кардиомиотомия в сочетании с СПВ и коррекцией кардии. При этом осуществляют послойное скелетирование малой кривизны желудка, начиная чуть проксимальнее места вхождения в антральный отдел последней ветви переднего нерва Латерже. После взятия на держалку пищевода мобилизуют его абдоминальный и внутрихиатусный сегменты. Затем мобилизуют кардию и дно желудка до селезенки. При этом блуждающие нервы осторожно отделяют от пищевода. В отдельных случаях для создания большей подвижности дна желудка перевязывают 1 - 2 короткие артерии. После выполнения СПВ и кардиомиотомии мышечный дефект пищевода на всем протяжении прикрывают передней стенкой дна желудка отдельными узловыми швами. Перитонизируют малую кривизну желудка. Затем наложением 2 - 3 швов между передней и задней стенкой желудка с захватом мышечной оболочки пищевода формируют фундопликационную манжетку на протяжении 2 см (не более) абдоминального отдела пищевода. Заднюю стенку дна желудка дополнительно фиксируют двумя узловыми швами к задне-правой стенке пищевода так, чтобы весь мобилизованный отдел пищевода оказался наполовину окружности "укутан" расходящимися в виде конуса стенками дна желудка. Целесообразность такой неполной фундопликации авторы объясняют тем, что различные виды эзофагофундоррафии (простой продольной или в 1/2 окружности пищевода), выполненные на уровне эзофагокардиомиотомии, не гарантируют от возникновения желудочно-пищеводного рефлюкса. В то же время классическая фундопликация по Ниссену, получившая широкое распространением при хирургическом лечении рефлюкс-эзофагита, создает слишком сильный клапанный затвор, преодоление которого затруднительно для функционально неполноценной при ахалазии моторики пищевода. При 4-й стадии ахалазии пищевода с удлинением и S-образным искривлением дистального отдела пищевода для достижения хорошего опорожнения авторы предлагают выпрямить деформированный сегмент пищевода путем чрезбрюшинной мобилизации наддиафрагмального его изгиба с низведением в брюшную полость и фиксацией кардии к круглой связке печени. При гиперацидности, которая, по мнению Черноусова А.Ф., встречается у 80% пациентов, автор выполняет СПВ, при отсутствии показаний к СПВ послойно скелетирует желудок только в области его кардиального отдела.
Преимущества прототипа: при данном способе вследствие скелетирования малой кривизны, кардии, дна желудка и мобилизации абдоминального и внутрихиатусного сегмента пищевода, а также вследствие выведения интактных (неповрежденных) стволов и основных ветвей блуждающих нервов из зоны операции создаются благоприятные условия для более тщательного (прецизионного) выполнения эзофагокардиомиотомии и формирования арефлюксной кардии. Недостатки: не восстанавливается связочный аппарат пищевода и кардии, что влечет за собой смещение пищевода и кардиального отдела желудка в средостение с образованием недостаточности кардии и скользящих грыж ПОД; в 25% случаев отмечается рецидив заболевания вследствие отсутствия расширяющего механизма при эзофагокардиогастропластике; из-за неполной фундопликации в 16,7% случаев развивается рефлюкс-эзофагит (Грудная и сердечно-сосуд. хир., 1994, N 6, с. 73).
Цель: сохранение естественных и максимальное восстановление нарушенных функций пищевода и кардии. Улучшение непосредственных и отдаленных функциональных результатов оперативного лечения ахалазии пищевода.
Задачи:
1) разработать прецизионную методику мобилизации пищеводного отверстия диафрагмы, диафрагмальных ножек, стенозированного сегмента прекардиального отдела пищевода, дна желудка с гарантирующим сохранением не только стволов, но и основных ветвей блуждающих нервов (главных желудочных, печеночной, чревной), не нарушая тем самым, парасимпатическую иннервацию ни желудка, ни органов брюшной полости;
2) разработать прецизионную технологию выполнения продольной расширяющей эзофагокардиомиотомии с дилатацией и трансиллюминацией;
3) разработать прецизионную технологию пластики дефекта в мышечном слое пищевода и кардии передней стенкой дна желудка при боковой инвагинации низведенного пищевода и кардии между передней и задней стенками дна желудка, т. е. восстановления угла Гиса и создания эзофагокардиогастрального клапана-жома;
4) pазработать технологию восстановления связочного аппарата вновь создаваемой кардии: эзофагодиафрагмальных, диафрагмальнофундальных и кардиодиафрагмальных связок;
5) pазработать комплексную технологию восстановления всех арефлюксных компонентов вновь создаваемой кардии;
6) исключить возможность развития рецидива заболевания;
7) предотвратить возникновение осложнений в раннем и отдаленном послеоперационном периоде;
8) улучшить качество жизни оперированных больных.
Сущность. После высокой мобилизации абдоминального и внутрихиатусного сегментов пищевода, кардии, малой кривизны и дна желудка с сохранением стволов и основных ветвей блуждающих нервов создают пищеводно-диафрагмальные связки, формируют эзофагокардиогастральный клапан, выполняют продольную эзофагокардиомиотомию. Затем к краям миотомного разреза подшивают переднюю и заднюю стенки дна желудка и укрывают дефект в мышечном слое пищевода передней стенкой дна желудка.
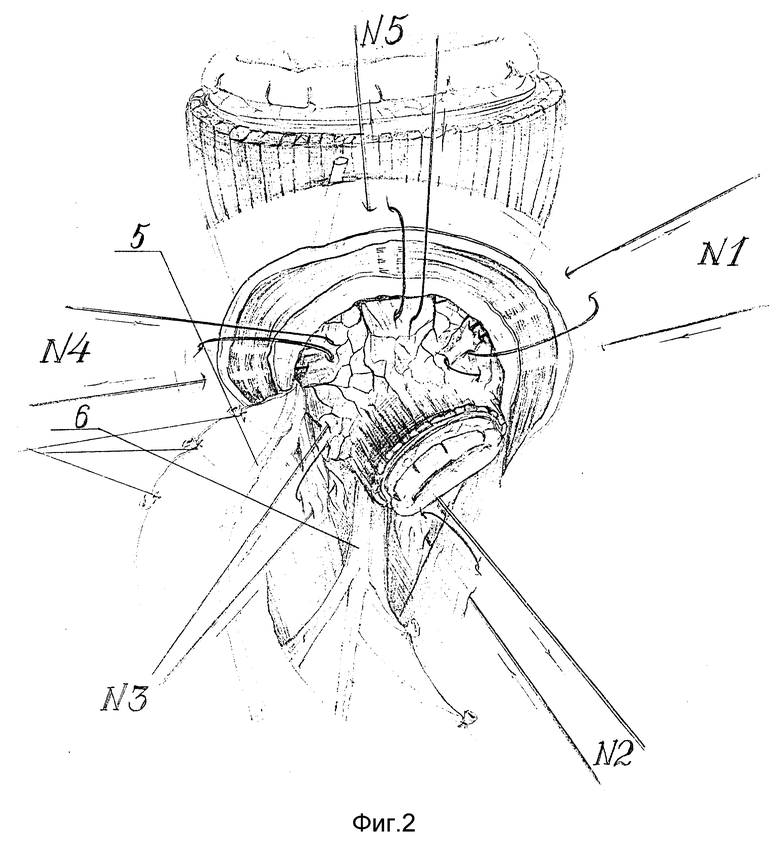
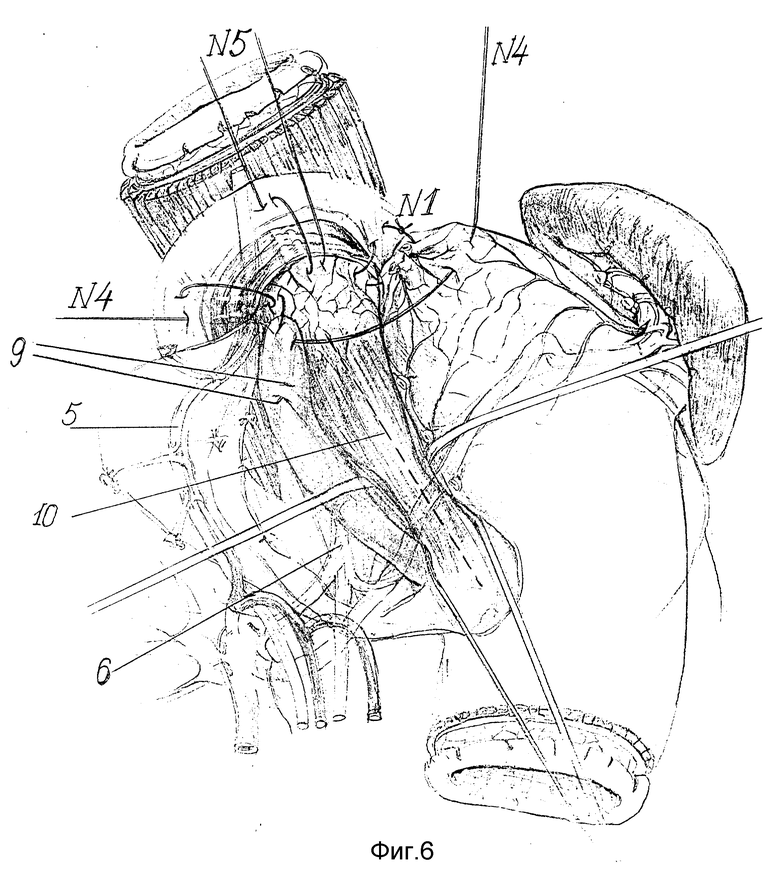
Осуществление способа в динамике продемонстрировано на фиг. 1 - 9. Выполняют вархне-срединную лапаротомию. Для лучшего доступа осуществляют аппаратную коррекцию раневой апертуры с помощью РСК-10. Операцию начинают с рассечения левой треугольной связки печени, отводят левую долю печени медиально, что резко улучшает доступ к абдоминальному отделу пищевода и кардии. Затем осуществляют скелетирование пищеводного отверстия диафрагмы и ее обеих ножек путем пересечения пищеводно-диафрагмальных 1, лиафрагмально-кардиальных 2 и диафрагмальнофундальных 3 связок. Низводят кардию ит абдоминальный отдел пищевода 4 вместе с клетчаткой, связочным аппаратом, стволами блуждающих нервов 5,6 и их основными ветвями. Далее пересекают проксимальную часть желудочно-селезеночной связки с 1 - 2 короткими желудочными сосудами 7 (фиг. 1). Мобилизованное дно желудка отворачивают кпереди и вниз, открывают заднюю стенку дна желудка, что дает широкий доступ к левой ножке диафрагмы и желудочно-поджелудочной связке, которую поэтапно отделяют от стенок два желудка от ворот селезенки до кардии. Сзади мобилизуют стенки пищевода, кардию и проксимальный участок тела желудка с пересечением первой задней поперечной сосудистой ветви. На протяжении 5 - 6 см мобилизуют абдоминальный и внутрихиатусный сегменты пищевода. При этом рассекают соединительно-тканые перемычки, располагающиеся между блуждающими нервами и пищеводом, что придает нервам наибольшую подвижность. Скелетируют проксимальный участок малой кривизны тела желудка с пересечением 1 - 2 поперечных сосудов 8 (фиг. 1). В пищевод вводят толстый желудочный зонд, который, как правило, не удается провести через зону сужения. Извлекая из средостения, пищевод максимально низводят в брюшную полость. Затем приступают к восстановлению разрушенного при мобилизации связочного аппарата пищевода. К краям пищеводного отверстия диафрагмы фиксируют стенки пищевода за остатки пищеводно-диафрагмальной мембраны, параэзофагеальную клетчатку и сосудисто-нервные пучки, входящие в стенку пищевода. При этом применяются 5 вшивных лавсановых 8-образных швов-связок (фиг. 2).
Швом-связкой N 1 фиксируют левую боковую стенку пищевода к левой ножке диафрагмы на 3 часах по циферблату.
Швом-связкой N 2 фиксируют левую задне-боковую стенку пищевода к левой ножке диафрагмы на 5 часах.
Швом-связкой N 3 фиксируют к правой ножке диафрагмы на 9 часах ниже основного ствола переднего вагуса правую боковую поверхность пищевода.
Швом-связкой N 4 фиксируют к правой ножке диафрагмы на 11 часах выше основного ствола переднего блуждающего нерва правую передне-боковую поверхность пищевода.
Швом-связкой N 5 фиксируют переднюю стенку пищевода к верхнему краю ПОД на 12 часах по циферблату.
После наложения фиксирующих пищеводно-диафрагмальных швов-связок пищевод теряет способность к смещению в средостение.
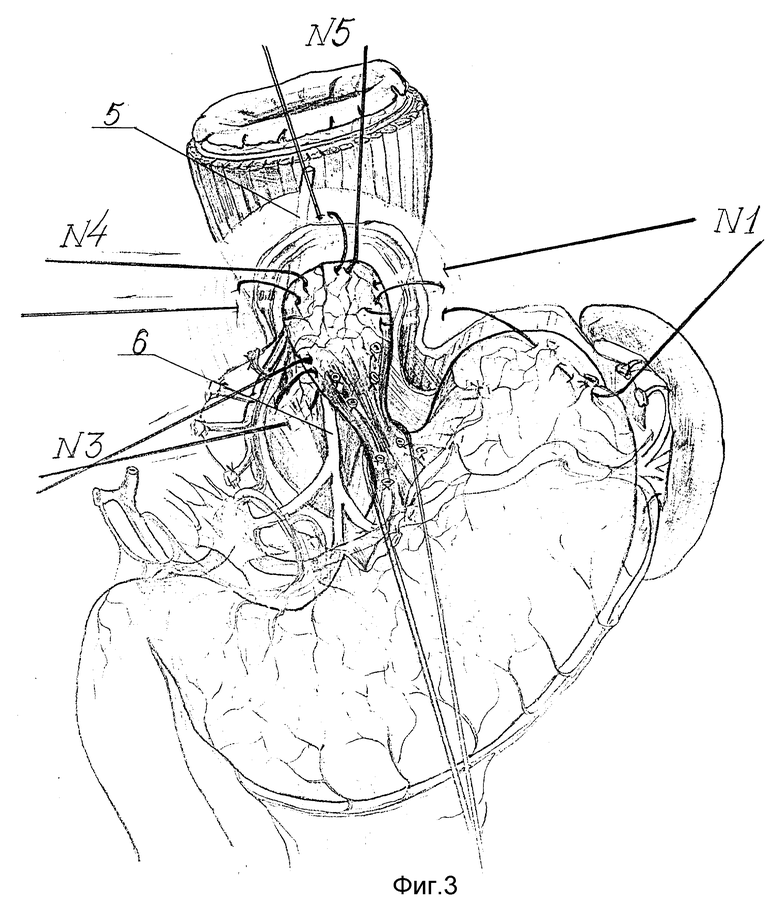
Для восстановления замыкательной функции кардии создают новые анатомические взаимоотношения между пищеводом, кардией и желудком в форме эзофагокардиогастрального клапана.
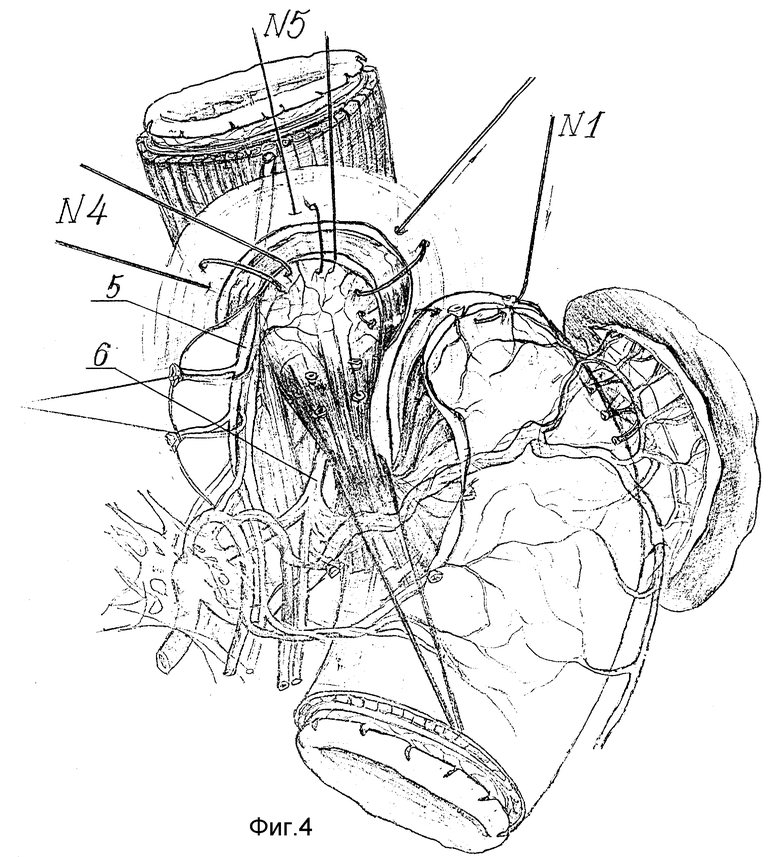
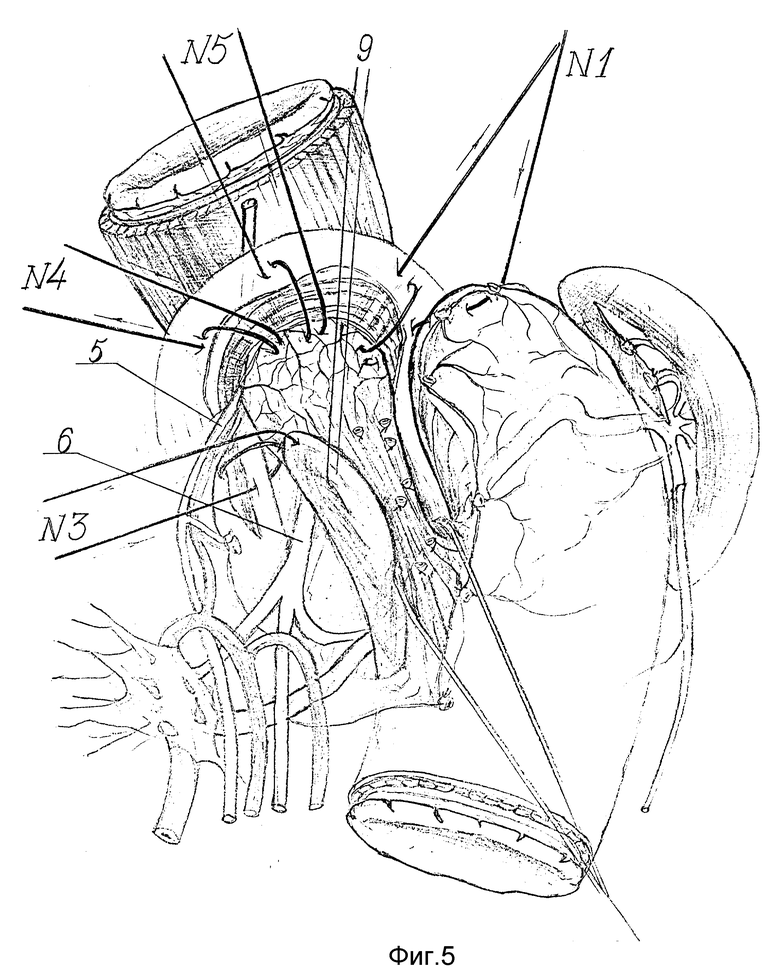
Сначала восстанавливают угол Гиса. Для этого в шов-связку N 1 захватывают дно желудка по большой кривизне на уровне пересеченных коротких желудочных артерий за основание их культей (фиг. 3 - 4). В швы-связки N2, 3 и 4 поэтапно захватывают заднюю стенку дна желудка, предварительно вытягивая ее с помощью держалки 9 (фиг. 5 - 6). Затем в шов-связку N4 после предварительного примеривания захватывают и переднюю стенку дна желудка с таким расчетом, чтобы она свободно легла на переднюю поверхность пищевода, не задавливая его, и нити берут на держалку (фиг. 6).
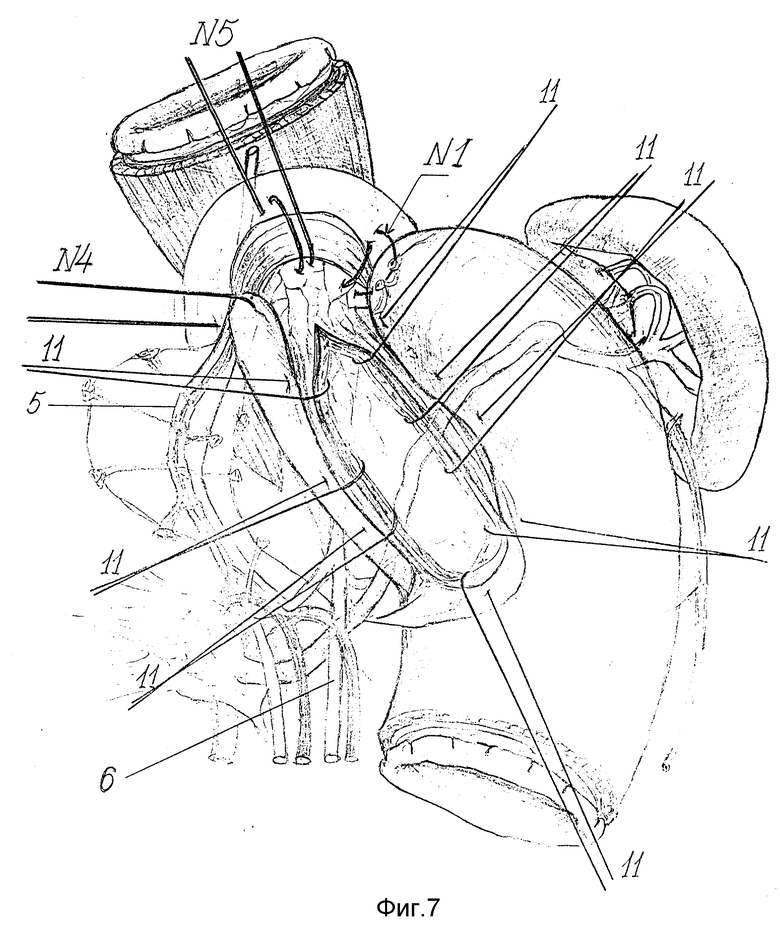
Только после создания связочного аппарата пищевода и кардии, а также формирования эзофагокардиогастрального клапана выполняют продольную эзофагокардиомиотомию. Для этого по передней поверхности пищевода острым скальпелем и препаровочными ножницами производят миотомный разрез 10 длиной 5 - 7 см, проходящий через всю зону сужения с переходом на кардиальный отдел желудка на 1 - 1.5 см (фиг. 6 - 7). При этом рассекают циркулярные мышечные волокна нижнего пищеводного сфинктера до подслизистого слоя и препаровочным тупфером разводят их в стороны, образуя дефект в мышечном слое до 1/3 окружности пищевода (фиг. 7). При этом нужно тщательно следить за полнотой выполнения миотомии, четко дифференцировать высвобождающийся подслизистый слой, который имеет розовый цвет с видимой мелкопетлистой сетью сосудов. Для этого миотомию выполняют под контролем трансиллюминации. Прецизионное слой за слоем рассечение мышечных волокон, тщательная препаровка подслизистого слоя позволяют избежать ранения слизистой оболочки пищевода со вскрытием его просвета. После полного рассечения и разведения в стороны краев разреза мышечной оболочки толстый желудочный зонд свободно проводят в желудок.
Затем монолитной нитью 4/0 атравматической иглой узловыми швами 11 к левому краю миотомного разреза подшивают переднюю стенку дна желудка, а к правому - заднюю (фиг. 7).
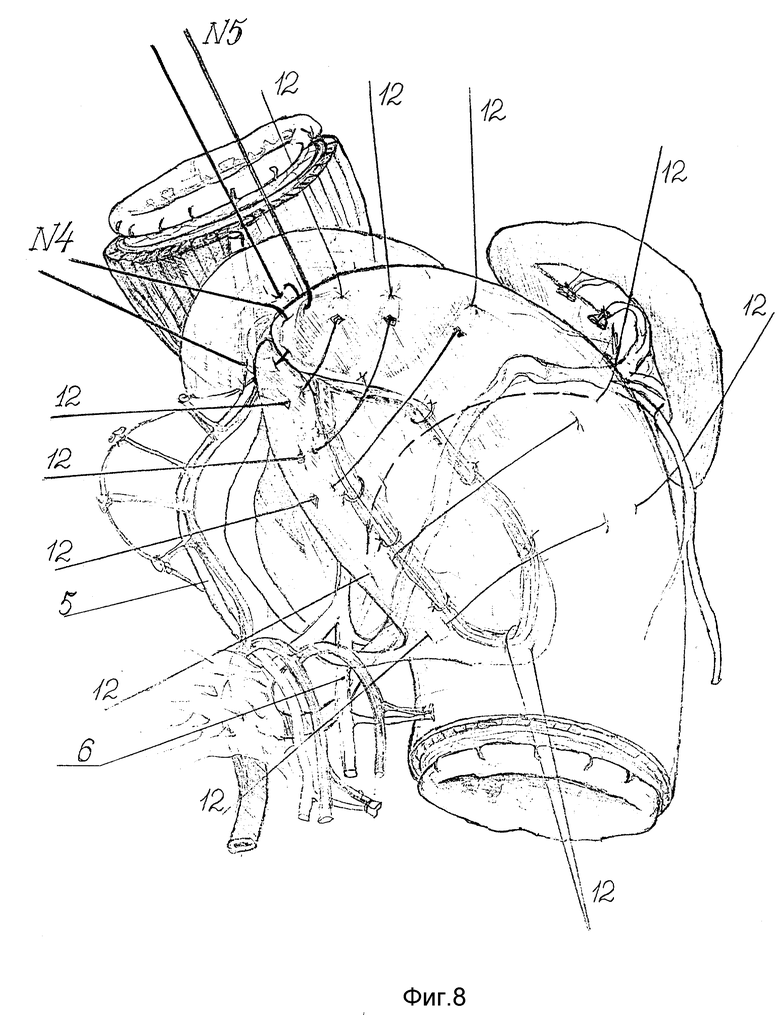
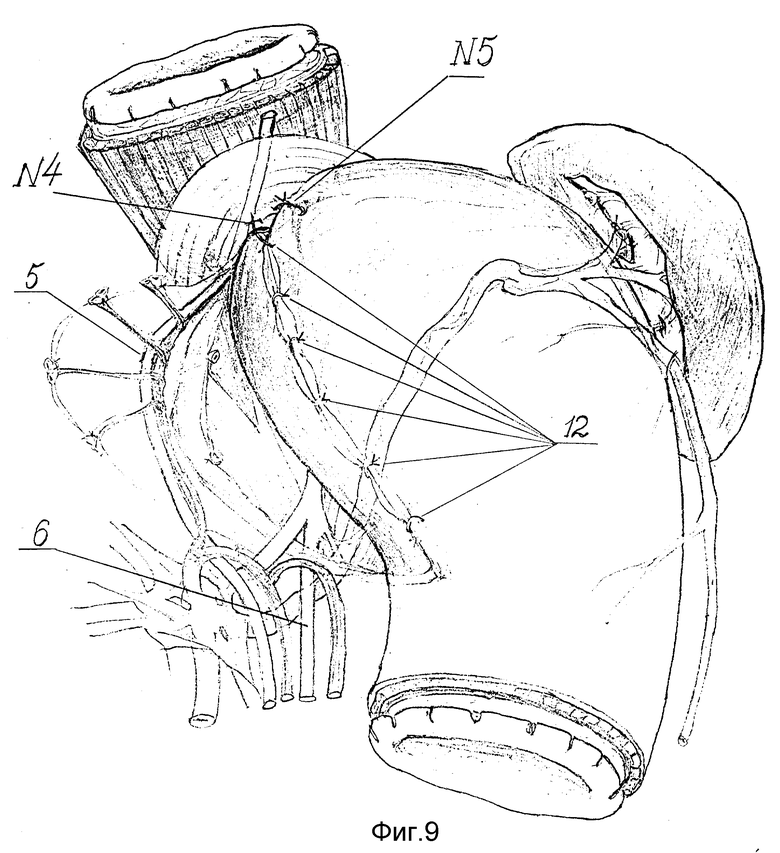
Такая конструкция способствует постоянному нахождению рассеченных мышечных краев в соостоянии диастаза вследствие эластической тяги обеих стенок дна желудка, направленной в противоположные стороны. Это обстоятельство препятствует контакту, сращению и рубцеванию краев миотомного разреза. Завязывают шов-связку N4 (фиг. 8). Дефект в мышечном слое пищевода укрывают очень подвижной передней стенкой дна желудка, наворачивая ее на образовавшийся дефект. Для этого после предварительного примеривания, убедившись в отсутствии натяжения, сверху вниз накладывают несколько узловых серозномышечных швов 12, захватывающих с одной стороны переднюю стенку дна желудка, а с другой - заднюю (фиг. 8 - 9). В шов-связку N5 захватывают переднюю стенку дна желудка, дополнительно фиксируя ее к верхнему краю ПОД (фиг. 9). Затем 2 - 3 швами ушивают малую кривизну желудка. Зону оперативного вмешательства во избежание развития спаечного процесса перитонизируют большим сальником, фиксируя его несколькими швами к кардиальному отделу желудка и к краю ПОД. Таким образом, создают арефлюксный эзофагокардиогастральный клапан. При этом восстанавливают все компоненты физиологической кардии и, что особенно важно, нижний пищеводный мышечный жом за счет широкой желудочной мышечной петли, замыкающей швами переднюю и заднюю стенки дна желудка над абдоминальным пищеводом. Вследствие восстановления связочного аппарата созданная конструкция становится устойчивой против дезинвагинации.
Способ апробирован на 57 больных в клинических условиях Республиканского Центра функциональной хирургической гастроэнтерологии (РЦФХГ), г. Краснодар.
Больная Б., 46 лет, N истории болезни 1063.
Дата поступления: 17.10.96.
Диагноз: ахалазия пищевода 2-й степени.
Жалобы на затруднение прохождения твердой и даже жидкой пищи в желудок, боли и чувство распирания за грудиной, сердцебиение, похудание на 10 кг за последний год, общую слабость, отрыжку и рвоту недавно съеденной пищей.
Anamnes morbi. Болеет около 10 лет, когда после перенесенного нервного стресса впервые почувствовала затруднение при глотании. Неоднократно лечилась в хирургическом отделении по месту жительства, проводились курсы кардиодилятаций без видимого улучшения. В последнее время почувствовала резкое нарушение прохождения даже жидкой пищи в желудок, появились сильные загрудинные боли, общая слабость. Направлена в РЦФХГ для оперативного лечения.
Anamnes vitae. Туберкулез, болезнь Боткина, вен; болезни отрицает. Аллергический анамнез не отягощен.
Объективно. Больная правильного телосложения, умеренного питания, состояние удовлетворительное. Кожные покровы чистые, периферические лимфоузлы не увеличены, безболезненны. В легких дыхание везикулярное, хрипов нет. Тоны сердца ясные, ритмичные. Пульс 80 ударов в минуту, А/Д 120/80 мм рт.ст. Язык влажный, живот мягкий, безболезненный во всех отделах. Печень и селезенка не увеличены. Симптом Щеткина отрицателен. Физиологические отправления в норме.
Результаты инструментальных исследований.
ФГДС-содержимое пищевода натощак - слизь и жидкость с примесью пищи в большом количестве. Просвет пищевода значительно расширен, диаметр до 4 - 5 см, извитой, форма S-образная. Слизистая отечная, имеются единичные эрозии. Кардия не раскрывается воздухом, с трудом проходима эндоскопом, находится на расстоянии 42 см от резцов, на уровне диафрагмы. Линия Z размыта. Слизистая желудка с явлениями поверхностного воспаления на фоне очаговой атрофии.
Заключение. Ахалазия пищевода 2-й ст. Эрозивный эзофагит. Очаговый атрофический гастрит.
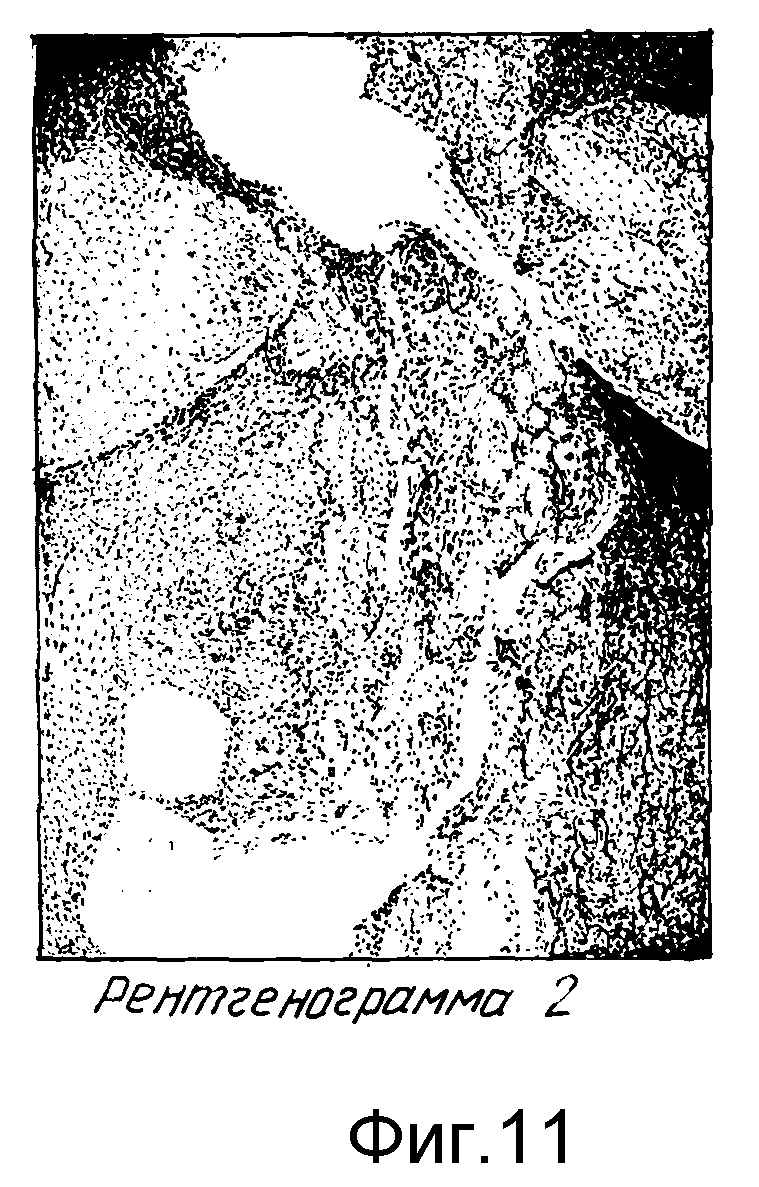
Рентгенография пищевода: форма пищевода S-образная. Диаметр составляет 4 - 5 см, контуры нечеткие, неровные, с дефектами наполнения вследствие наличия большого количества пищевых масс, перистальтика отсутствует. Форма сужения дистального отдела в виде мышиного хвоста. Диаметр кардии составляет 0.3 - 0.4 см, протяженность сужения до 3 см, во время акта глотания кардия не раскрывается. Бариевая взвесь проходит в желудок прерывисто, опорожнение на 1/3 происходит за 10 мин при наполнении пищевода до входа. Наддиафрагмальная ампула и газовый пузырь желудка отсутствуют, водно-сифонная проба отрицательна (см. фиг. 10, рентгенограмма 1).
Заключение. Ахалазия пищевода 2-й ст.
Результаты лабораторных исследований.
Общий анализ крови: эритроциты-5,3 Т/л; Нв-176.1 г/л; ЦП- 1.0; лейкоциты-5,9 Г/л; Б-1%; Э-2%; П-8%; С-65%; Л-20%; М-4%. Ht-0/53, СОЭ-20 мм/ч.
Oбщий анализ мочи: цвет-с/ж, удельный вес-1021, pH-5.0, белок-0.25 г/л, глюкоза-abs, эритроциты-abs, лейкоциты-0-1-2в п/з.
Биохимия: глюкоза-5.5 ммоль/л, билирубин-16.7 ммоль/л, мочевина-5.3 ммоль/л, креатинин-87.7 мкмоль/л, средние молекулы-205 у.е., Алт-0.07 ммоль/(ч•л), Аст-0.35 ммоль/(ч•л), амилаза-12.0 г/(л•ч), общий белок-85 г/л. HBsAg-не обнаружен, МОР-отр., группа крови-2(A) Rh-полож.
25.10.96 операция: лапаротомия, суперселективная проксимальная ваготомия, продольная эзофагокардиомиотомия, расширяющая эзофагокардиогастропластика, создание связочного аппарата пищевода и кардии.
Доступ - верхне-срединная лапаротомия с аппаратной коррекцией раневой апертуры с помощью РСК-10. Рассечена левая треугольная связка печени, левая доля печени отведена медиально. Осуществлено скелетирование пищеводного отверстия диафрагмы и ее обеих ножек путем пересечения пищеводно-диафрагмальных, диафрагмально-кардиальных и диафрагмально-фундальных связок. Низведены кардия и абдоминальный отдел пищевода вместе с клетчаткой, связочным аппаратом, стволами блуждающих нервов и их основными ветвями. Далее пересечена желудочно-диафрагмальная связка, проксимальная часть желудочно-селезеночной связки с двумя короткими желудочными сосудами. Мобилизованное дно желудка отвернуто кпереди и вниз. Желудочно-поджелудочная связка поэтапно отделена от стенок дна желудка от ворот селезенки до кардии. Мобилизованы стенки пищевода, кардия и проксимальный участок тела желудка с пересечением первой задней поперечной сосудистой ветви. Произведена мобилизация стенозированного участка с абдоминальным и внутрихиатусным отделом пищевода на протяжении 6 см и проксимального участка тела желудка с пересечением 1 поперечного сосуда малой кривизны желудка. В пищевод введен толстый желудочный зонд, который не удалось провести через зону сужения. Пищевод максимально низведен в брюшную полость. Восстановлен разрушенный при мобилизации связочный аппарат пищевода. К краям пищеводного отверстия диафрагмы фиксированы стенки пищевода за остатки пищеводно-диафрагмальной мембраны, параэзофагеальную клетчатку и сосудисто-нервные пучки, входящие в стенку пищевода. При этом применено 5 вшивных лавсановых 8-образных швов-связок.
Швом-связкой N1 фиксирована левая боковая стенка пищевода к левой ножке диафрагмы на 3 часах по циферблату.
Швом-связкой N2 фиксирована левая передне-боковая стенка пищевода к левой ножке диафрагмы на 5 часах.
Швом-связкой N3 фиксирована к правой ножке диафрагмы на 9 часах ниже основного ствола переднего вагуса правая боковая поверхность пищевода.
Швом-связкой N4 фиксирована к правой ножке диафрагмы на 11 часах выше основного ствола переднего блуждающего нерва правая передне-боковая поверхность пищевода.
Швом-связкой N5 фиксирована передняя стенка пищевода к верхнему краю ПОД на 12 часах по циферблату.
Восстановлен угол Гиса. Для этого в шов-связку N1 захвачено дно желудка по большой кривизне на уровне пересеченных коротких желудочных артерий за основание их культей. В швы-связки N2, 3 и 4, поэтапно захвачена задняя стенка дна желудка. Затем в шов-связку N4 после предварительного примеривания захвачена и передняя стенка дна желудка с таким расчетом, чтобы она свободно легла на переднюю поверхность пищевода, не задавливая его, нити взяты на держалку.
По передней поверхности пищевода острым скальпелем и препаровочными ножницами выполнен миотомный разрез длиной 7 см, проходящий чрез всю зону сужения с переходом на кардиальный отдел желудка на 1 см. При этом рассечены циркулярные мышечные волокна нижнего пищеводного сфинктера до подслизистого слоя под контролем трансиллюминации препаровочным тупфером разведены в стороны. Края рассеченного мышечного слоя с обеих сторон взяты на монолитные держалки. После полного рассечения и разведения в стороны краев разреза мышечной оболочки толстый желудочный зонд проведен в желудок. Затем монолитной нитью 4/0 атравматической иглой к левому краю миотомного разреза подшита передняя стенка дна желудка, а к правому - задняя. Дефект в мышечном слое пищевода укрыт очень подвижной передней стенкой дна желудка. Для этого, убедившись в отсутствии натяжения, сверху вниз наложено несколько узловых серозно-мышечных швов, захватывающих с одной стороны переднюю стенку дна желудка, а с другой - заднюю. Завязан шов-связка N4. В шов-связку N5 захвачена передняя стенка дна желудка. Затем тремя швами ушита малая кривизна желудка. Зона оперативного вмешательства во избежание развития спаечного процесса перитонизирована большим сальником, который фиксирован несколькими швами к кардии и к краю ПОД.
Контроль гемостаза - сухо. Счет салфеток - все. Брюшная полость послойно ушита наглухо.
Послеоперационный период протекал без осложнений. Заживление первичное. Швы сняты на 10-е сутки. Больная выписана в удовлетворительном состоянии 5.11.96 г.
Через 1 мес проведено контрольное обследование.
Состояние больной удовлетворительное. Жалоб на момент осмотра не предъявляет. Прохождение жидкой и твердой пищи по пищеводу в желудок свободное. Загрудинных болей нет
При ФГДС: пищевод натощак не содержит остатков жидкости и пищи. Слизистая розовая, застойного эзофагита нет. Линия Z четкая, ниже диафрагмы. Признаков желудочно-пищеводного рефлюкса нет.
Рентгенография пищевода: диаметр значительно уменьшился (2.5 - 3 см), рельеф складок не изменен, имеется выраженная пропульсивная первичная перистальтика пищевода. Кардия раскрывается во время акта глотания, диаметр ее при этом составляет 1.5 - 2 см. Бариевая взвесь струйно проходит в желудок, полная ее эвакуация происходит за 0.5 мин. Имеется наддиафрагмальная ампула, которая опорожняется на выдохе. Гастроэзофагеального рефлюкса нет даже при положении Тренделенбурга и натуживании мышц передней брюшной стенки. Угол Гиса острый, имеется газовый пузырь желудка (см. фиг. 11, рентгенограмма 2).
Данный способ лечения ахалазии пищевода может быть применен на ранних стадиях заболевания при отсутствии рубцово-склеротических изменений слизистой оболочки прекардиального сегмента пищевода, позволяет сохранить стволы и основные ветви блуждающих нервов, не нарушает секреторную и моторно-эвакуаторную функции желудка, препятствует возникновению рефлюкса кислого желудочного содержимого в пищеводе и связанных с этим осложнений, предупреждает развитие рецидива заболевания, уменьшает сроки реабилитациии и значительно улучшает качество жизни оперированных больных.

Изобретение относится к медицине, хирургической гастроэнтерологии, может быть использовано при лечении ахалазии кардии. Мобилизуют абдоминальный и внутрихиатусный отделы пищевода, кардии, малой кривизны и дна желудка с сохранением стволов и основных ветвей блуждающих нервов. Формируют анатомически целостную кардию. Выполняют продольную эзофагокардиомиотомию. Замещают дефект в мышечном слое пищевода передней стенкой дна желудка. К краям миотомного разреза подшивают переднюю и заднюю стенки дна желудка. Способ позволяет сохранить функции пищевода и кардии. 11 ил.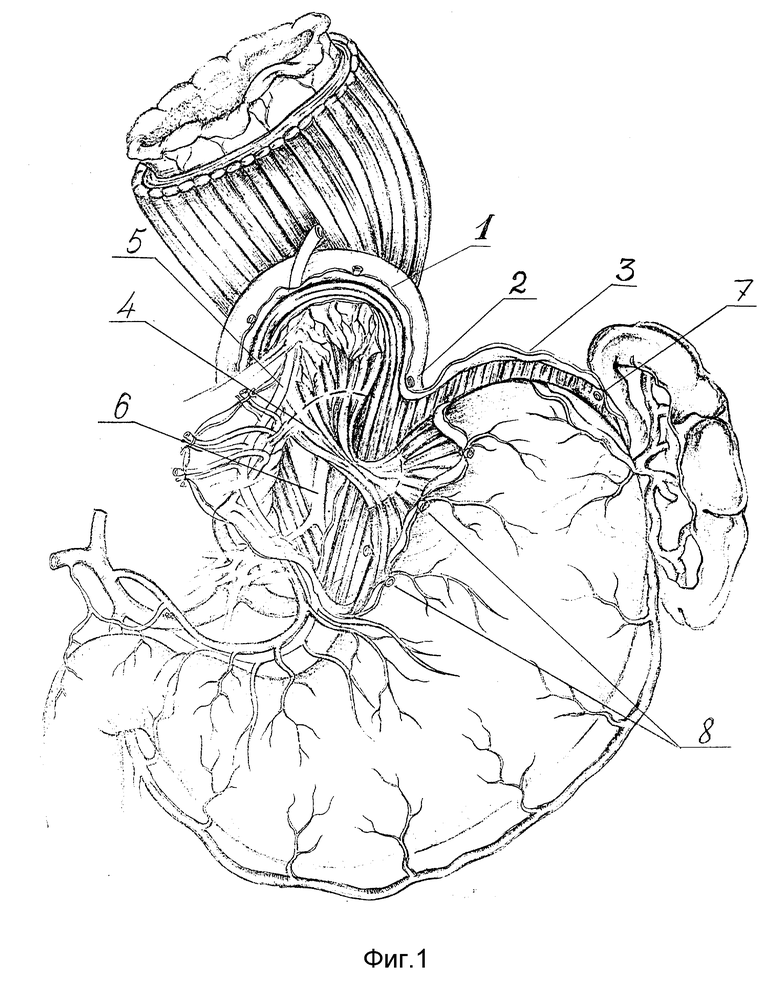
Способ хирургического лечения ахалазии пищевода, включающий мобилизацию абдоминального и внутрихиатусного отделов пищевода, кардии, малой кривизны и два желудка с сохранением стволов и основных ветвей блуждающих нервов, выполнение продольной эзофагокардиомиотомии и эзофагокардиогастропластики с пластическим замещением дефекта в мышечном слое пищевода передней стенкой дна желудка, отличающийся тем, что перед выполнением эзофагокардиомиотомии формируют анатомически целостную кардию, а после выполнения эзофагокардиомиотомии к краям миотомного разреза подшивают переднюю и заднюю стенки дна желудка.
| Хирургия | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
Авторы
Даты
1999-04-20—Публикация
1997-06-17—Подача