В широком смысле настоящее изобретение относится к лечению или профилактике воспаления, вызванного бактериями, вирусами и/или другими инфекционными агентами, условно-патогенными микроорганизмами (инфекции, которых могут быть результатом иммунодепрессионного состояния, например, вызванного раковым заболеванием или лечением, в особенности, лечением цитотоксическим лекарством или радиотерапией), аутоиммунной реакцией или другим образом. Отдельные варианты изобретения касаются профилактики или лечения нейродегенеративных или демиелинизационных заболеваний, таких как миелопатия, вызванная HTLV-I (HAM), рассеянный склероз (MS) и симптомов или заболеваний человека, вызванных хроническими иммунным возбуждением. Изобретение также относится к фармацевтическим композициям, полезным при таком лечении и/или профилактике, и к самим определенным активным пептидам.
Иллюстрацией заболевания, включающего воспаления, является септический шок. Многие клинические признаки грамотрицатиельного септического шока можно воспроизвести у животных путем введения липополисахаридов (LPS). Введение животным LPS может вызывать тяжелые метаболические и физиологические изменения, которые могут привести к смерти. С введением LPS связано обширное производство альфа-фактора некроза опухолей (tumor necrosis factor alpha-TNF-α). У мышей, получивших инъекцию рекомбинантного человеческого TNF развивается полиэкреция волос (ундуляция), понос и отталкивающая и неопрятная внешность, сопровождающиеся смертью при получении достаточного количества. У крыс, обработанных TNF снижается давление, учащается дыхание, и они погибают от внезапной остановки дыхания (Traceg и др., 1986 Science 234, 470). Наблюдается также тяжелый ацидоз, заметная гемоконцентрация (haemoconcentration) и бифазные изменения в концентрации глюкозы крови.
Гистопатология таких крыс обнаруживает лейкозы в легких, геморрагический некроз в надпочечниках, поджелудочной железе и других органах и тубулярный некроз почек. Все эти изменения предотвращают, предварительно вводя животным нейтрализующие моноклональные антитела против TNF.
Значительная аккумуляция нейтрофилов в легких животных, обработанных TNF, отражает TNF активацию нейрофилов, TNF вызывает дегрануляцию нейтрофилов, респираторный импульс наряду с увеличением бактерицидной и противоопухолевой активности нейрофилов (Klebanoff и др., 1986, J.Immunol., 136, 4220; Tsujimoto и др. , 1986, Biochem. Biophys. Res. Commun. 137, 1094). Важной мишенью для проявления TNF токсичности являются также эндотелиальные клетки. TNF снижает антикоагулирующий потенциал эндотелия, стимулируя прокоагулянтную активность и регулируя экспрессию тромбомодулина по типу обратной связи (Stern и Nawroth, 1986, Exp. Med 163, 740).
TNF является продуктом активированных макрофагов и производится в ответ на инфицирование и развитие злокачественного заболевания. Впервые он был обнаружен у мышей, обработанных LPS, как сывороточный фактор, вызывающий геморрагический некроз трансплантированных опухолей у крыс и являющийся цитотоксическим для клеток опухолей в культуре (Carswell и др., 1975 PNAS 72, 3666; Helson и др., 1975, Nature 258, 731). Кахексия, характерный признак хронического воздействия для TNF, является общим симптомом развития злокачественного заболевания и тяжелой инфекционной болезни. Она характеризуется аномальным липидным метаболизмом с гипертриглицериданемией (hypertriglyceridaemia), аномальным метаболизмом белков и глюкозы и истощением. Продолжительное введение TNF и IL-I мышам, крысам и/или людям вызывает анорексию, потерю веса и липидное и белковое истощение тела в течение 7-10 дней (Gerami и др., 1985, Immuhol. Lett 11, 173, Fong и др., 1989, J.Exp. Med. 170, 1967, Moldawer и др. Am. J. Physiol, 254, G450-G456, 1988; Fong и др. , Am. J. Physiol. 256, R659-R665 (1989); Mc Carthy и др., Am. J. Clin. Nutr. 42, 1179-1182, 1982. У пациентов с раковыми и хроническими заболеваниями, связанными с кахексией, измеряли уровень TNF. Результаты неубедительны, так как получены большие различия в уровнях TNF. Это можно объяснить коротким временем полураспада TNF (6 минут), различиями в связывающих белках THF сыворотки или действительными различиями уровней TNF хронических заболеваний.
TNF-α и IL-I с их общими функциональными активностями, такими как пирогенность, сонливость и действием в качестве медиаторов воспалений, вовлечены в патологию других заболеваний, связанных с хроническим воспалением, кроме токсического шока и кахексии при раковых заболеваниях. TNF обнаруживают в синовиальной жидкости пациентов с ревматоидным и реактивным артритом и в сыворотке пациентов с ревматоидным артритом (Saxne и др.. 1988; Arthrit Rhemat. 31, 1041). Повышенный уровень TNF детектируют у пациентов с трансплантированной почкой в случаях острого отторжения (Maury и Терро 1987, J. Exp. Med. 166, 1132). Показано, что у животных TNF включен в патогенез заболеваний типа трансплантат - против-хозяина на коже и кишечнике после аллогенной трансплантации костного мозга.
Показано, что введение противокрысиных TNF антител кролику (Anti-murine TNF antibody) предотвращает гистологические изменения, связанные с заболеваниями при трансплантации органов организму-хозяину, и снижает смертность (Piguet и др. 1987, J.Exp.Med. 166, 1220). Показано также, что TNF вносит значительный вклад в патологию малярии Clark и др. 1987, Am. J. Pathol 129, 192-199). Кроме того, приводят повышенные значения уровня TNF сыворотки у пациентов, страдающих малярией (Scuderi и др., 1986, Lancet 2, 1364-1365).
Многие специалисты обычно считают рассеянный склероз (MZ) хроническим воспалительным заболеванием.
ИМS, и связанная с HTLV-I миелопатия (HAM) действуют на центральную и периферическую нервные системы, с клинической точки зрения обе болезни можно представить как миелопатию, действующую на спинные нервы и спинные миелинизированные нервные волокна (Spinal myelinated nerve fibres).
Рассеянный склероз (MS) является хроническим димиелинизирующим заболеванием центральной нервной системы и является наиболее общим хроническим неврологическим заболеванием молодых людей. Заболеваемость MS и особенности его распространения не изменялись в течение десятилетий. Заболевание остается в основном неизлечимым.
MS всегда считали заболеванием средней полосы, он имеет широкое распространение в северных Соединенных Штатах, Канаде и Европе 1:1000. Заболеваемость у пациентов разного пола составляет 1,5:1 (женщины: мужчины).
Обычно MS действует на многие области белого вещества в центральной нервной системе (CNS), наиболее часто на перивентрикулярное белое вещество, ствол головного мозга, спинной мозг и глазные нервы. Первичный процесс разрушает миелиновые оболочки и в конечном счете убивает олигодендроциты, образуя характеристические бляшки MS.
Раннее развитие бляшек характеризуется развитием периваскулярного воспаления с последующей миграцией лимфоцитов, клеток плазмы и макрофагов в очаг поражения. За этим следует глиоз астроцитов и попытки ремиелинизации олигодендроцитами. Бляшку окружают лимфоциты.
Хотя этиология MS до сих пор неизвестна, в фокусе исследований, ведущих к правдоподобным гипотезам, находятся работы по изучению иммунной диспергуляции, включая аутоиммунную реакцию и генетическое предрасположение, которые могут играть роль в действительном развитии болезни.
У пациентов с острой формой заболевания обнаружены множественные репродуцированные иммунологические нарушения. Синтез иммуноглобулинов, будучи нормальным на периферии, увеличен в центральной нервной системе, и продуцированные антитела имеют характеристическую связанную структуру. Антигенная специфичность таких антител не известна, и не ясно, играют ли они роль в прогрессировании заболевания.
Известны различные стресс-факторы, активирующие иммунную систему, такие как вирусная инфекция, или обострение MS может быть вызвано хирургической операцией. Аналогичные эффекты производит прием других активаторов, таких как γ интерферон. Кроме того, например, иммуносупрессивная противовоспалительная терапия кортикостероидами может давать умеренную ремиссию или, по крайней мере, временное облегчение на короткий период времени, хотя такое лечение является спорным.
Продемонстрирована реактивность лимфоцитов против нейтронных антигенов, миелинового основного белка (myelin-basic protein) и протеолипида. Эта активность должна давать основу для аутоиммунной реакции против нейронной ткани, хотя это и не доказано.
Открытие нейротропной способности HTLV-I у пациентов с Мартиники с тропическим спастическим парапарезом (TSP) и у пациентов из Японии с хронической миелопатией представляет HTLV-I в качестве общего этиологического агента таких заболеваний. Позже было показано, что неврологические проявления HTLV-I инфекции одинаковы, несмотря на различные географические регионы, в которых они описаны.
Неврологические признаки этой хронической ретровирусной инфекции, включая слабо прогрессирующий спастический парапарез со спастическим мочевым пузырем и минимальным сенсорным дефицитом получают в результате поражения пирамидальных трактов двусторонним и симметричным образом преимущественно на грудном уровне спинного мозга.
Показано, что периферическая нервная система включена, давая в результате снижение скорости проводимости нервов нижних конечностей. Общие проявления HTLV-I у пациентов с HTLV-I миелопатией описаны и включают воспалительное поражение легких, кожи, глаз и поперечно-полосатой мышцы, дающее миозит. Кроме того, пациенты испытывают глубокую усталость, подобно ситуации с MS. Клинические проявления заболевания очень похожи на MS, и его часто путают с последним.
Возможны, по крайней мере, четыре патогенных механизма, когда HTLV-I может включать CNS, производя HAM. Они могут включать слабое вирусное инфицирование, иммунную реакцию через промежуточные клетки (cell-mediated immune response) и преимущественно гуморальный иммуно-опосредованный механизм (humoral immune mediated mechanism) и развитие аутоиммунных явлений. Слабо прогрессирующее течение болезни подтверждает гипотезу слабого вирусного инфицирования. Обнаружение периваскулярного скопления лейкоцитов вокруг кровеносных сосудов в препаратах, приготовленных после летального исхода, наряду с временно благоприятной реакцией на стероиды, подтверждает гипотезу, что воспалительная иммунная реакция, возможный результат вирусной инфекции, ответственна за развитие HAM.
Эти два заболевания имеют много сходства и различий, как клинических, так и неврологических. Обе болезни являются формами демиелинирующих заболеваний, при которых миелиновая оболочка нервной системы разрушается через один или много механизмов, общих для двух заболеваний, а также специфический механизм для каждого заболевания. MS является многопрофильным заболеванием, при котором возможно заболевание центральной нервной системы, которое может включать миелопатию. HTLV-I миелопатия наоборот является преимущественно миелопатией, которая может изредка оказывать влияние на центральную нервную систему. MS, кроме того, может действовать на периферическую нервную систему способом, общим с HTLV-I. Как уже упоминалось, миелопатия, будучи заболеванием спинного мозга, может иметь много различных этиологий MS и HAM. Различные формы миелопатии, большинство из которых осуществляются через воспаление, включают следующие:
нейросифилис: недостаточность B12 или фолатов; саркоидоз; поперечный миелит; арахноидит; цервикальный спондилит; заболевание двигательного нейрона; нейрофиброматоз; сжатие спинного мозга от опухоли, диска или артрита; дюпозный эритематоз спинного мозга и вирусный энцефаломиелит.
Хроническое воспаление, чаще известное как хроническое активирование или возбуждение иммунной системы, происходит в ответ на устойчивый антиген, происхождение которого может быть экзогенным или эндогенным или может быть результатом аутоиммунного состояния. В результате таких хронических воспалений происходит локальное разрушение тканей, и в зависимости от типа воспаления может наблюдаться воздействие на весь организм вследствие производства медиаторов воспаления. Такие медиаторы воспаления включают цитокины, растворимые медиаторы, продуцируемые активированными лимфоцитами и макрофагами, и действуют на взаимодействие клеток и физиологическую реакцию. Хроническое иммунное возбуждение может происходить в результате инфекционных заболеваний, таких как синдром хронического утомления или синдром токсического шока, или через аутоиммунные механизмы, дающие в результате такие симптомы, как ревматоидный артрит, воспалительные заболевания кишечника и варианты, связанные с взаимодействием трансплантат против организма-хозяина.
Иммунную реакцию на антиген можно разделить на четыре перекрывающиеся фазы: инициирование (представление антигена), увеличение (активация клеток), эффектор и регуляция (Roitt и др. "Immunology", Gower Medical Rubl. London, EK, 1989, : Basic and Clinical Immunology, Stites и др. Eds, Appleton and Lange, Norwalk CT, 1991). Коротко говоря, происходит фагоцитоз антигена клетками, представляющими антиген (АРС), которые должны выражать главную гистосовместимость (MHC) молекул класса II (Class II molecules) на своей поверхности. В этом отношении клетки линии макрофаг/моноцит (CD4 положительный) и клетки B (CD4 отрицательный) могут действовать как APC. После фагоцитоза антиген обрабатывается внутри цитоплазмы и выделяется на поверхность антигенных фрагментов в ассоциации с молекулами MHC-II. Комбинация антиген/MHC-II включает активацию T-клеток-помощников (CD4 положительный) антиген-специфическим образом и заставляет их принимать второй антиген-неспецифический сигнал активации. Затем активированные T-клетки-помощники вызывают активацию T-клеток-эффекторов (цитотоксические лимфоциты, CD4 отрицательный) и B-клеток, продуцирующих антитела. Клетки-эффекторы и молекулы способствуют выделению антигена через разнообразные механизмы, антиген-специфические и неспецифические, в результате чего может происходить повреждение тканей организма-носителя, если эффекторные механизмы выражаются неблагоприятным образом при отложении антигена или иммунных комплексов на тканях организма-носителя, реагируя на аутоантигены, или в результате пролонгированной (хронической) иммунной реакции. Регуляция иммунной реакции посредством удаления антигена, эффективное подавление или идиотипическая регуляция ограничивает нормальную иммунную реакцию до одной-трех недель.
Синдром хронического утомления (CFS) или синдром иммунной дисфункции хронического утомления (chronic fatigue immune dysfunction syndrome) (De Fritas и др., Proc. Natl. Acad. Sci. 88. 2922-2926 (1991) является условием неизвестной этиологии, характеризующейся отличным набором симптомов и признаков, которые включают сильную утомляемость, недомогание после физической нагрузки, головные боли, потливость ночью, миалгию, атаксию, субфебрильную температуру и лимфаденопатию (CDWP 1-3: Joncas, JH, Приветствия и Введение в: Proceedings of a Workshop: Chronic Fatigue Syndrome, Can. Dis. Weekly Report vol. 17S1 E. January 1991. 1-3).
Хотя происхождение CFS неизвестно, его симптомы совпадают с избыточным продуцированием цитокинов (Landay и др., Lancet 338. 707-712 (1991). Симптомы, подобные CFS, наблюдали после терапевтического применения интерферонов (IFN) (Lloyd и др., Med. J. Aust 151. 122-124 (1989); Lever и др., Lancet 2.101 (1988): Mowbray и др., Br. Med. Bull 47. 886-894 (1991) и интерлейкина-2 (IL-2) (Cheney и др., Annal. Inter. Med. 110, 321 (1989)). В испытаниях IFN- α на пациентах с CFS лекарство обостряет симптомы, способствуя патогенезу через цитокины (Mc Bride и др., Br. Med. Bull. 47, 895-907 (1991). Показано, что сыворотка и цереброспинальная жидкость пациентов с CFS содержит повышенный уровень IL-2, IFN и IL-1 (Wallace и др., Ar th. Rheum. 32. 1334-1335 (1989); Shepperd The Practitioner 233. 41-46 (1989) так же, как и IL-6 (Chao и др., J. Infect. Dis/ 162. 1412 (1990). Кроме того, неоптерин (neopterin), маркер активации макрофага (Chao и др. J. Infect. Dis. 162, 1412 (1990), и IFN-ассоциированный фермент 2'-5'-олигоаденилатсинтетаза (Klimas и др., J. Clin. Microbiol. 28. 1403-1410 (1990) оба увеличены в CFS, как и другие маркеры активации макрофагов, такие как ICAM-I и LFA-I (Gupta и др., Scand. J. Immunol. 33. 319-327 (1991). Ассоциированная с CFS энергия на тестовые антигены кожи (Johnson и др. FASEB J. 5. 2706-2712 (1991), ослабление реакции лимфоцитов на митогены (Klimas и др., J. Clin. Microbiol. 28. 1403-1410 (1990)) и растворимые антигены (Gupta и др., Scand. J. Immunоl. 33. 319-327 (1991) совпадают с дисфункцией макрофагов (Prieto и др., Scand. J. Immunol. 30. 13-20 (1989)) и могут быть объяснены аутокринным истощением иммунокомпетентных клеток при хроническом возбуждении, в результате которого происходит иммунодисрегуляция (CDWR 1-3; Joncas J H, Приветствие и Введение в: Proceedings of a Workshop: Chronic Fatigue Syndrome, Can. Dis. Weekly Report 17SIE. January 1991, 49 - 50).
CFS и синдром приобретенного иммунодефицита (AIDS, см. ниже) имеют много общих симптомов (Miller и др., Neurology 41, 1603 - 1607 (1991)) и лабораторных показателей (Gupta и др., Scand. J. Immunol. 33, 319 - 327 (1991)); и одно исследование демонстрирует связь инфекции с ретровирусом HTLV-II, имеющим отношение к HIV, и CFS (Gupta и др. Scand. J. Immunol. 33, 319 - 327 (1991)).
Для CFS не существует общепринятого способа лечения лекарствами. Существуют анекдотические сообщения о благотворном действии амандидина, ингибиторов моноаминоксидазы (т.е. фенелзина - phenelzine), жирно-кислотных добавок (Mc Bride и др., Br. Med. Bull. 47, 895 - 907 (1991)) и окситриптофана (Caruso и др. , J. Int. Med. Res. 18, 201 - 209 (1991)), среди прочего, но контрольные проверки не показали эффективности этих препаратов.
Энтеротоксин Staphylococcus aureus, токсин-1 синдрома токсического шока (TSST-1) вызывает синдром токсического шока (TSS). TSST-1 принадлдежит семейству стафилококковых энтеротоксинов, митогенных для T-клеток, экспрессирующих специфические Vβ гены (Kappler и др., Scince 244, 811 - 813 (1989)). В результате своей неспецифической митогенности стафилококковые энтеротоксины могут вызывать пролиферацию до 20% T-клеток и называются "суперантигенами" (Johnson и др., Sci. Am. 266, 92 - 101 (1992)). Необходимо, чтобы макрофаги предоставляли TSST-1 T-клеткам (Poindexter ,и др., J. Infect. Dis. 151, 65 - 72 (1985)); однако, как и другие стафилококковые энтеротоксины, TSST-1 не требует обработки антигенами для активации T-клеток (Pontzer и др., Proc. Natl. Acad. 88, 125 - 128 (1991)). Нативная молекула присоединяется с внешней стороны антигена, связывая полость молекул МНС класса II с неполиморфным участком β- цепи (Fraser Nature 339, 221 - 223 (1989); Johnson и др., FASEB J. 5, 2706 - 2712 (1991)).
Симптомы TSS (такие как лихорадка, сыпь, гипотензия, тошнота, рвота и понос) совпадают с перевозбуждением иммунной системы (Johnson и др., Sci. Am. 266, 92 - 101 (1992)) и избыточным продуцированием цитокинов (Ikejima и др. , J. Clin. Invest. 73, 1312 - 1320 (1984); Micussan и др. Immunology 58, 203 - 208 (1986)). Эти симптомы воспроизводят на моделях животных путем введения фактора некроза опухолей (TNF) (Miethke и др., J. Exp. Med. 175, 91 - 98 (1992)). Массивное иммунное возбуждение такого рода может вести к истощению иммунокомпетентных клеток и может объяснить подавление иммунитета, связанное с энтеротоксиновым шоком (Langford и др., Infect, Immun. 22, 62 - 68 (1978)) и энергией T-клеток, индуцированных энтеротоксином in vitro (O'Hehir и др.. Immunol. Lett. 30, 165 - 170 (1991)).
Терапия TSS включает немедленное замещение потерянной жидкости для противодействия гиповолемии. Если пациент не реагирует на антистафилококковые антибиотики, тогда может понадобиться терапия стероидами (т.е. метилпреднизоном) при тяжелом шоке Todd, Drugs, 39, 856 - 861 (1990)).
Ревматоидный артрит (Marrow и др., Autoimmune Rheumatic Disease", Black well Scientific Publ., Oxford, UK, гл. 4, сс. 148 - 207 (1987)) является заболеванием, характеризующимся хроническим воспалением и эрозией суставов, которое может поражать до 3% населения, включая детей. Симптомы ревматоидного артрита включают утреннюю тугоподвижность суставов, припухлость и боли при движении по крайней мере одного сустава и опухание суставов. Неспецифические симптомы, включая летаргию, анорексию и слабость, наряду с лихорадкой и лимфаденопатией (характеристикой иммунного возбуждения), могут предшествовать заболеванию суставов. Внесуставные проявления ревматоидного артрита включают васкулит, катаракты, увеит, интерстициальный фиброз, перикардит и миокардит, периферическую невропатию, миелоидные отложения, хроническую анемию и подкожные и легочные узелки.
С развитием ревматоидного артрита связывают генетические факторы и инфекционные агенты, включая бактерии, грибки, микоплазмы и вирусы. Легкий ревматоидный артрит можно лечить нестероидными противовоспалительными лекарствами, в то время как тяжелые случаи требуют системного применения кортикостероидов, анти-метаболитов или цитотоксических агентов. Экспериментально использовали для лечения ревматоидного артрита анти-CD4 моноклональные антитела (Horneff и др., Cytokine 3, 266 - 267 (1991); Horneff и др., Arth. Rheum. 34, 129 - 140 (1991) и Shoenfeld и др., Clin. Exp. Rheum. 9, 663 - 673 (1991)). Воспалительное заболевание кишечника (IBD) является хроническим воспалительным симптомом, одним из симптомов аутоиммунного заболевания (Snook. Gut. 31, 961 - 963 (1990)). Воспаление и повреждение ткани включает восстановление и активацию нейрофилов, макрофагов и лимфоцитов (Mac Dermott и др. Adv. Immunol. 42, 285 - 328 (1988)), которые генерируют цитокины и про-воспалительные молекулы, такие как простагландины и лейкотриены (Mac Dermott, Mt. Sinai J. Med. 57, 273 - 278 (1990)). В результате хронической активации иммунокомпетентных клеток повышают IL-1, IL-6 (Starter, Immunol. Res. 10, 465 - 471 (1991); Fiocchi, Immunol, Res. 10, 239 - 246 (1991)) и TNF-α (Mac Dermott, Mt. Sinai J. Med. 57, 273 - 278 (1990)) у IBD-пациентов.
Лекарства, используемые для лечения IBD, включают противовоспалительные агенты, такие как сульфазалазин (5-ASA), кортикостероиды, циклоспорин A и азатиоприн (Hanauer, Scand. J. Castroenterol. 25 (Suppl. 175) 97 - 106 (1990); Peppercorn, Annol. Intern. Med. 112, 50 - 60 (1990)). Экспериментально для успешного лечения неспецифического язвенного колита применяли анти-CD4 моноклональные антитела (Emmrich и др. , Lancet 338, 570 - 571 (1991)).
Тогда как организм-хозяин может реагировать против генетически несовместимого трансплантата, давая ответную реакцию хозяин-против-трансплантата, иммунокомпетентный трансплантат (такой как костный мозг или ткань кишечника) может давать реакцию против организма-хозяина, давая в результате заболевание трансплантат-против-хозяина. Эти реакции являются промежуточными как аллогенных реакциях, направленных против инородных МНС молекул, и in vitro подражением им является смешанная реакция лимфоцитов (MLR). Взаимодействия трансплантат/организм-хозяин дают хроническое воспаление вокруг пересаженной ткани при увеличении маркеров иммунного возбуждения, таких как наблюдают при СПИД (Grant, Immunol. Today 12, 171 - 172 (1991)). Общепринятое лечение взаимодействий трансплантат/организм-хозяин включает обработку азатиоприном, циклоспорином A или метилпреднизоном, а по последним данным - рапамицином (rapamycin) (Stepkowski и др. Transplantation 53, 258 - 264 (1992); Huber и др. Bibliotheca Cardiologica 43, 103 - 110 (1988)). Для ингибирования реакции трансплантат/организм-хозяин экспериментально применяли моноклональные антитела, специфические для CD3 (Wissing и др., Clin. Exp. Immunol. 83, 333 - 337 (1991)) и CD4 (Reinke и др., Lancet 338, 702 - 703 (1991)).
Настоящее изобретение касается идентификации группы пептидов, которые облегчают воспалительную реакцию при многих заболеваниях. Эти заболевания включают: аутоиммунные заболевания, трансплантацию органов, неоплазию, вирусные, бактериальные, грибковые и другие инфекции и, в частности, некоторые заболевания, при которых инфекция может проявляться условно-патогенным образом, например, при терапии цитотоксинами или радиационной терапии или в ситуации при иммунодепрессивном состоянии. Нет необходимости, чтобы пептиды, полезные в настоящем изобретении, напрямую препятствовали патогенным механизмам компонентов, вызывающих заболевание. Как будет описано ниже в экспериментальных данных, механизма, при котором эти пептиды могут облегчать симптомы таких заболеваний, зависит от их способности модулировать производство и действие цитокинов, продуцированных активированными клетками иммунной системы. Модулирование цитокинов не может иметь ограничений для TNF, но может быть действенным для целого ряда интерлейкинов, например, от интерлейкина-1, до интерлейкина-10. Представленные данные не являются в настоящее время прямым доказательством, но мощной косвенной моделью. Таким образом, модель использует одно из наиболее сильных из известных воспалительных соединений, LPS, которое присоединяется к рецепторам на нейтрофилах, моноцитах и макрофагах; в результате эти клетки становятся активированными и начинают продуцировать IL-1 и TNF среди прочих цитокинов, начиная, таким образом, воспалительный каскад. Параметром, используемым для измерения этого эффекта LPS, является концентрация глюкозы в крови, которая обычно уменьшается под действием TNF или LPS. Из сведений, известных из литературы о механизме пептида T на клеточном уровне, очень удивительным является то, что пептид T и его аналоги способны значительно уменьшать отрицательное действие LPS. Обычно LPS комбинируется с LPS-связывающим протеином (LBP) и усиливает свое действие через CD14 рецептор. В современной литературе пептиды, полезные в настоящем изобретении, связывают только с CD4 рецептором, который, как считают, не включен в первичную воспалительную реакцию, связанную с цитокинами, такими как TNF или LPS.
Более подробно, обнаружено, что специфические группы пептидов, особенно тех, которые имеют по крайней мере 5 аминокислотных остатков, являются очень эффективными агентами, полезными при лечении (среди прочего) MS и HAM и, вероятно, являются полезными при лечении других типов миелопатии, большинство из которых имеют аналогичный механизм заболевания.
Из приведенного выше обсуждения очевидно, что многие симптомы и заболевания связаны с хроническим воспалением; однако, кажется, что некоторые из этих заболеваний включают различные механизмы. Следовательно, важно найти специфические соединения, полезные для лечения симптомов и заболеваний, связанных с хроническим воспалением, при этом оказывается, что эти соединения взаимодействуют определенным образом с CD4 рецепторами клеток иммунной системы. Эти соединения, как указано выше, относятся к пептиду T и различным его производным. Первоначально думали, что такие соединения не оказывают на иммунную систему другого действия, а только очень полезны при блокировании присоединения HIV вируса к клеткам CD4 рецепторов (Ruff и др., IV International Conference on AIDS, Stockholm June, 1988).
Первоначально многие пептиды, полезные в настоящем изобретении, были описаны как эффективные в профилактике инфекции и репликации HIV in vitro; смотри Европейский патент EP-A-0249394 и WO-A-8809338, все они включены максимально возможным по закону цитированием, как и все другие документы, цитированные в данном описании. Все соединения, раскрытые в данном описании, полезны для настоящего изобретения. Основой исходного пептида является октапептид Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr. Его называют пептид T, так как, 50% аминокислотных остатков являются треонинами. Этот пептид идентифицируют из подобласти молекулы gp120, внешнего гликопротеина вируса иммунодефицита человека (HIV), ответственной за присоединение к клетке, несущей CD4 молекулы и, в частности, лимфоциты-помощники, микроглийные клетки в CNS, моноциты и дендритные клетки. Связывание происходит посредством специфического присоединения gp120 к CD4 молекуле. Обрабатывая пациентов, зараженных HIV, этим пептидом и его производными, описанными ниже, получают в результате эффект потенциального ингибирования связывания всего вируса или нейротоксичной молекулы gp120 с CD4 рецептором клетки. Таким образом, клетку защищают от инфекции, и разрушают вирус, неспособный к репликации, путем иммунной защиты.
Согласно первому аспекту настоящего изобретения предоставляется использование линейных или циклических пептидов общей формулы:
I-A-D-C-D-E-F-G-H-II (Общая формула I)
где A - Ala, Gly, Val, Ser, Thr или отсутствует,
B - Ala, Gly, Val, Ser, Thr или отсутствует,
C - Ser, Thr или отсутствует,
D - Ser, Thr, Asn, Glu, Arg, Ile, Leu или отсутствует;
E - Ser, The, Asp или отсутствует;
F - Thr, Ser, Asn, Arg, Gln, Lys, Trp или отсутствует;
G - Tyr или отсутствует;
H - Thr, Arg, Gly, Met, Met(O), Cys, Thr, Gly или отсутствует;
I - Gly или отсутствует,
II - Cys или отсутствует.
По крайней мере одна из аминокислот необязательно замещена мономерным или полимерным углеводом или его производным, такое замещение происходит через гидроксил, и/или аминогруппу, и/или амидогруппу аминокислот;
при этом пептид включает по крайней мере четыре аминокислотных остатка,
или их фармацевтически приемлемых солей в производстве лекарств для лечения или профилактики воспаления.
Каждая из аминокислот, включенных в общую формулу I, может находиться в L- или D-стереоизомерной конфигурации, и кандидаты, обозначенные через H, могут быть этерифицированы или амидированы. Пептид включает по крайней мере 4 аминокислоты.
Тетра-, пента-, гекса-, гепта-, окта- и нона-пептиды, полезные в настоящем изобретении, все являются пептидами, выбранными из последовательности:
I-A-B-C-D-E-F-G-H-II
при исключении остатков, например, по одному, либо с карбоксильного, либо с аминоконца, либо из середины последовательности.
Понятно, что имея основную последовательность Twr-Thr-Asn-Tyr-Thr, пептиды могут иметь на обоих концах дополнительные аминокислотные остатки, некоторые из которых представлены общей формулой 2:
X-Ser-Thr-Thr-Thr-Asn-Tyr-Y (Общая формула 2)
где X является терминальным аминокислотным остатком, выбранным из Ala и D-Ala, а Y является карбоксильным терминальным остатком, выбранным из Thr и Thr-амида.
Особо предпочтительный пептид группы пептидов имеет упомянутую выше основную центральную последовательность - Thr-Thr-Asn-Tyr-Thr. Обнаружено, что эти пептиды указанной выше общей формулы 2 и, в частности, вариант пептида T формулы - Ser-Thr-Thr-Thr-Asn-Tyr, является очень полезным в ингибировании связывания вируса иммунодефицита человека (HIV) с клетками человека путем блокирования рецепторных сайтов на поверхностях клеток. Термин пептид T используют в описании для обозначения пептидов общей формулы 2, все из которых включают основную центральную последовательность, если не обозначено по-другому. Следовательно, имеется в виду, что обозначение пептид T включает все соединения общей формулы 2, при этом понятно, что все такие соединения являются вариантами октапептида T, обозначенного также как пептид T - прототип, формулы D-Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr-амид.
Изобретение может быть полезно как в клинической медицине (для человека), так и в ветеринарии. Следовательно, изобретение включает способ лечения или профилактики воспаления, при этом способ включает введение человеку или животному, например, многократное введение пептида общей формулы I. Обычно вводят эффективное нетоксическое количество пептида или такое количество, которое устанавливает подходящий баланс между эффективностью и токсичностью в зависимости от обстоятельств конкретного случая.
В качестве активной части предпочтительные пептиды, применяемые в изобретении, имеют аминокислотную последовательность формулы: -Thr-Thr-Asn-Tyr-Thr-.
В рамках изобретения эти пептиды полезны для всех профилактических и терапевтических применений и являются особо предпочтительными для профилактики и лечения симптомов или заболеваний у человека и других животных, связанных с хроническим аутоиммунным заболеванием.
Наиболее предпочтительными пептидами, полезными в данном изобретении, являются следующие:
1. D-Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr-NH2
2. Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr.
3. D-Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr.
4. D-Ala-Ala-Ser-Ser-Ser-Asn-Tyr-Met
5. Thr-Asp-Asn-Tyr-Thr
6. Thr-Thr-Ser-Tyr-Thr
7. Thr-Thr-Asn-Tyr-Thr
8. D-Thr-Thr-Tyr-D-Thr
9. D-Ala-Ser-D-Thr-Thr-D-Thr-Asn-Tyr-D-Thr-NH2
10. D-Ser-Ser-D-Thr-Thr-D-Thr-Thr-Tyr-D-Thr-NH2
Часто преимущественным может быть наличие на аминном конце D-стереоизомера аминокислоты для защиты молекулы от разрушения аминопептидазой; в другом случае или кроме этого на карбоксильном конце может находиться амид аминокислоты для защиты молекулы от разрушения карбоксипептидазой. В связи с этим соединениям 5, 6 и 7, перечисленным выше, включают аналоги CD-Thr аминотерминальным остатком и/или аминное производное на карбоксильном конце.
Кроме того, надо понимать, что еще одна из аминокислот в пептидах может быть замещенной N-алкил (например, C1-C4) аминокислотой вместо первоначальной аминокислоты; примеры включают метил и этил. Гидроксильные группы боковых цепей одной или более аминокислот (Ser, Thr, Tyr) могут быть преобразованы в эфирные или сложноэфирные группы. Могут быть образованы любые (обычно замещенные) алкильные простые или сложные эфиры, такие как (C1-C4) алкильные, арильные или арил (C1-C4) алкильные сложные эфиры, простые эфиры, тиоэфиры (сложные и простые), например, сложный эфир фенила, простой эфир бензила или тиофенола. Предпочтительными простыми эфирами и в настоящее время являются эфиры метила, этила и пропила, и предпочтительными сложными эфирами в настоящее время являются эфиры метила, этила и пропила.
Гидроксильные группы боковых цепей аминокислот Ser, Thr и/или Tyr и амидогруппы аминокислот Asn и/или Gln можно заместить различными углеводами или производными углеводов. Производные углеводов могут быть такими, как указано выше.
Линейные пептиды, применяемые в данном изобретении, можно получить любым подходящим способом, таким как обычные способы твердофазного синтеза пептидов; смотри "Solid Phase Peptide Synthetic Technique", издание 2. J.M.Stewart, J.D.Joung, Pierce Chemical Company 1984, ISBN: 0-935940-03-0. Часто используемым твердофазным способом является способ Меррифилда (Merrifield). Возможен и другой способ - синтез в растворе. Предпочтительный пептид прототип пептида T, легко получить от Carlbiotech A/S Копенгаген, Дания.
Циклические пептиды, полезные в настоящем изобретении, можно получить известными способами, такими как, например, описанный J.Hamada в Tetrahedron Letters, 26, 5155 (1985). Циклические пептиды можно получить в форме с дисульфидным мостиком между двумя Cys остатками и/или посредством реакции карбокси-терминальной аминокислоты с аминотерминальным остатком и/или посредством реакции аминотерминального остатка, например, с γ- карбоксильной группой Glu, когда Glu находится в положении D. Производные углеводов можно получить известными специалистам способами.
Некоторые производные пептидов, полезные в настоящем изобретении, являются новыми соединениями и образуют еще один аспект данного изобретения, в соответствии с которым обеспечены линейные или циклические пептиды общей формулы I:
I-A-B-C-D-E-F-G-H-II (общая формулы I)
где A - Ala, Gly, Val, Ser, Thr или отсутствует:
B - Ala, Gly, Val, Ser, Thr или отсутствует:
C - Ser, Thr или отсутствует:
D - Ser, Thr, Asn, Glu, Arg, Ile, Leu или отсутствует:
E - Ser, Thr, Asp или отсутствует:
F - Thr, Ser, Asn, Arg, Gln, Lys, Trp или отсутствует:
C - Tyr или отсутствует:
H - Thr, Arg, Gly, Met, Met(O), Cys, Thr, Gly или отсутствует:
I - Cys или отсутствует:
II - Cys или отсутствует.
По крайней мере, одна аминокислота замещена мономерным или полимерным углеводом или его производным, причем такое замещение осуществляют через гидроксильные, и/или аминогруппы, и/или амидогруппы аминокислот; при этом пептид включает по крайней мере четыре аминокислотных остатка, за исключением гликозилированного пептида T-прототипа или его фармацевтически пригодной соли.
Гликозилированный пептид T раскрыт в работе Urge и др., Biochem. Biophys. Res. Comms. 184(2), 1125-1132 (1992), опубликованной 30 апреля 1992, но полезность настоящего изобретения не была раскрыта и предложена.
Предпочтительные отличительные признаки данного аспекта изобретения такие же, как и для первого аспекта.
Пептиды, полезные в данном изобретении, можно принимать в виде композиций в сочетании с фармацевтически пригодным носителем. Таким образом, пептиды можно использовать в фармацевтических композициях и композициях веществ для лечения и профилактики любых заболеваний или симптомов, вызванных дисфункцией организма, соединением или иммунным расстройством, которые дают воспалительную реакцию иммунной системы.
Пептиды или композиции пептидов можно использовать отдельно или в комбинации с другим фармацевтически активным соединением, таким как противоинфекционный агент, например, антибиотик, и/или противовирусный агент, и/или противогрибковый агент, или другим фармацевтически активным соединением, таким как противоопухолевый агент.
Пептиды можно принимать орально, трансбуккально, парентерально, локально, ректально, вагинально, путем ингаляции в нос, путем легочной ингаляции или другими способами.
В частности, композиции пептидов согласно настоящему изобретению можно составить в виде готовой формы для локального применения, для ингаляции в виде спрея или порошка, для инъекции (например, подкожной, внутримышечной, внутривенной, внутрисуставной или внутриполостной), для вливания или для орального приема, или можно приготовить в форме разовых доз в ампулах или таблетках, или приготовить в сосудах на несколько доз или других контейнерах с добавлением консервантов. Композиции могут находиться в таких формах, как суспензии, растворы, эмульсии и гели в масляных или водных носителях или могут содержать формулирующие агенты для приготовления данных композиций, такие как суспендирующие агенты, стабилизаторы и/или диспергирующие агенты. По-другому, активный ингредиент может быть в форме порошка и/или лиофилизованной форме для прямого применения или для составления композиции с подходящим наполнителем (например, стерильная, апирогенная вода, обычный физиологический раствор или 5% декстроза) перед применением. Фармацевтические композиции, содержащие пептиды, могут также содержать другие активные ингредиенты, такие как противомикробные агенты или консерванты.
Композиции могут содержать от 0,001 до 99% (вес/объем или, предпочтительно, вес/вес) активного вещества. Пептид T, получаемый от Carlbiotech A/S обычно готовят в 5% растворе декстрозы и разливают стерильным образом по многодозовым пробиркам. Подходит и вариант приготовления препарата в других носителях, таких как в каждой дозе составляет порядка 8,5 мг/мл для подкожных инъекций при дозе 1 мл.
Композиции вводят дозами, эффективными для лечения или профилактики, например, 0,05 - 10000 мг пептида в день, в частности 5-1000 мг в день. Если пептид, соответствующий изобретению, не является токсичным, можно применять очень большие дозы. Однако, обычно это не является необходимым. Доза, принимаемая ежедневно в течение курса лечения, зависит от степени воспаления или воспалительной реакции.
Для введения инъекций или вливаний композиции дневная доза, применяемая для лечения взрослых пациентов, составляет примерно от 0,2 до 20 кг активного вещества на вес тела около 70 мг, это количество можно вводить за 1-4 раза в течение дня; такая дозировка зависит от курса приема и симптомов пациента.
Описанные выше композиции можно готовить смешиванием или соединяя ингредиенты другим образом.
Изобретение может быть полезным для профилактики или лечения заболеваний или медицинских симптомов, особенно, таких, которые включают воспаление, таких как вирусный, бактериальный или вызванный лекарствами гепатит или менингит; ревматоидный, псориатический, реактивный артрит, остеоартрит или другие артриты; сепсис/септический шок; кожные воспаления; респираторный дистресс-синдром у взрослых (ARDS), отторжение трансплантата; вторичные воспаления после хемотерапии или радиотерапии опухолевых заболеваний.
Особое применение изобретение находит при профилактике и лечении MS, HAM и других воспалительных миелопатий (особенно тех, которые отдельно упомянуты выше) и/или симптомов или заболеваний человека, связанных с хроническим иммунным возбуждением. Более подробно, изобретение полезно при лечении синдрома хронического утомления, синдрома токсического шока, вызванного инфекцией Staphylococcus aureus, артрита, воспалительных заболеваний кишечника и реакции организма на трансплантат (host-versus-grasf) у пациентов с пересаженными органами. Таких эффективных результатов достигают (не ограничиваясь какой-либо отдельной теорией) вследствие иммуносупрессивной активности этих соединений при хронических воспалениях.
Для того, чтобы обеспечить руководство по приему и понимание использования пептидов согласно изобретению, особенно при MS, миелопатиях, таких как HAM и хроническое воспаление, а также составление композиций, в качестве показателя, основанного на большой работе, уже проведенной, по использованию пептида T для лечения HIV-инфекции, выбирают следующее.
Пептид T является октапептидом, гомологичным области gp120, гликопротеину оболочки HIV и человеческому вазоактивному кишечному пептиду (VIP). Первоначально Pert и др. (EP-A-0249394) обнаружили, что он блокирует связывание gp120 (гликопротеина оболочки HIV) и, таким образом, блокирует связывание HIV с CD4, специфическим рецептором на границе мембраны, блокируя при этом интернализацию вируса в клетку - процесс, необходимый для репликации вируса. CD4 молекула, необходимая для вхождения HIV в клетки, локализована на поверхности лимфоцитов, макрофагов, микроглиальных клеток, нейронов и многих других клеток. Показано, что связанный HIV с CD4 рецептором влияет на вхождение вируса; и связывание свободного (не связанного с вирусом) gp120 дает в результате нейронную токсичность при исследовании и in vitro, и in vivo.
Продемонстрирована эффективность пептида T в устранении симптомов вызванного HIV слабоумия при клинической проверке фазы I (Peptide T Phase 1 clinical trial) в Университете Южной Калифорнии в Лос-Анжелесе и фазы II в клинике Fenway в Бостоне. Оба исследования продемонстрировали улучшения при вызванной HIV нейропознавательной (neurocognitive) недостаточности у пациентов с AIDS.
В настоящее время для объяснения по крайней мере двух возможных механизмов действия пептида Е используют гомологию пептида T/gp120/VIP. Во-первых, он конкурентно присоединяется к C4 (известному рецептору для HIV) на поверхности клеток человека и конкурирует за места связывания и с HIV, и с gp120.
Связывание пептида T и его аналогов общей формулы I (или в более частном случае общей формулы 2) с CD4 может вызывать блокирующий эффект, предотвращая связывание каких-либо других молекул, способных присоединяться к этому рецептору; по-другому или кроме того, связывание пептида T с CD4 может вызывать реакцию, аналогичную реакции, вызванной эндогенным лигандом.
CD4 является антигеном дифференцировки, который определяет подгруппу T-лимфоцитов клеток помощник/индуктор, а также присутствует в различных клетках, включая нейроны, активированные макрофаги и B-клетки. C4 является доминирующим рецептором для HIV, и первоначально считали, что он является необходимым для клеточной инфекции. Используя моноклональное антитело OKT4, Pert и др. (Proc. Natl. Sci/=. USA 83, 9254-9258 (1986); Pert и др.(Clin Neuropharmacol, 9(4), S198(1986)) показали, что этот антиген присутствует повсюду в центральной нервной системе (CNS) человека и что в наибольшей концентрации он присутствует в зубчатой извилине, гиппокампе, миндалевидном теле и околокорковом веществе. Обнаружено, что такое же распределение существует и у других высших млекопитающих. Обнаружено, что пептид T и аналоги ингибируют связывание радиоактивного меченого gp120 с мембранами гиппокампа крыс при концентрации 0,1 нМ.
Используя пептид T и его аналоги, Pert и др. (Proc. Natl. Sci, USA. 83, 9254-9258 (1986); Pert и др. (Clin. Neuropharmacol. 9(4) S198 (1986)) имели возможность продемонстрировать снижение детектируемого уровня HIV - обратной транскриптазы, когда в исследованиях HIV - инфекционности присутствуют такие пептиды. При концентрации пептида T 100 нМ имеет место снижение уровня обратной транскриптазы в девять раз.
Так как, во всех выделенных штаммах HIV gp120 не является идентичным, проведено сравнение девяти различных культур HIV. Pert и др. (Clin. Neuropharmacol. 9(4) S198 (1986)). Обнаружена существенная гомология проверенных изолятов и пептида T при сравнении центрального пентапептида (Ruff и др., FEBS Lett. 211, 17-22 (1987); Brenneman и др., Nature 335, 639-642 (1988); Brenneman и др., Drug. Dev. Res. 15, 361-369 (1988); Komisaruk и др., Annals of the NY Acad. Sci. 527, 650-654 (1988); Buzy и др., The Lancet 22 july, 226-227 (1989)). Сейчас такое сравнение расширено до двадцати изолятов.
Ингибирование связывания gp120 и HIV с CD4, так же как и демонстрация снижения инфекционности HIV в присутствии пептида T и его аналогов, обеспечивают один возможный механизм действия для объяснения клинических эффектов пептида T. В этом смысле пептид T при достаточной концентрации может предупреждать новое клеточное инфицирование HIV. Начальные исследования в этой области были сфокусированы на CNS по двум причинам: в нейронах была обнаружена высокая концентрация CD4 молекул, и одним из основных эффектов HIV инфицирования является развитие нейропознавательной дисфункции. Эти факты особенно важны, так как показывают, что пептид T транспортируется из крови к головному мозгу посредством активной, насыщаемой транспортной системы, причем его выход осуществляется только диффузией (Barrera и др., Brain Res. Bull. 19, 629-633 91987)).
Хотя общеизвестно, что HIV может инфицировать не только лимфоциты, но также нейроны, трудно приписать неврологическую дисфункцию, наблюдаемую у HIV - пациентов, активному CNS HIV инфицированию, так как, активно инфицированным является только небольшое количество нейронов. Предполагают, что неврологический дефицит, наблюдаемый при HIV инфицировании, может происходить не только в результате инфекции, но и в результате действия вирусного "токсина", такого как gp120. Brenneman и др. (Nature 335, 639-642 (1988)) обнаружили, что очищенный gp120 от двух изолятов, так же, как рекомбинантный gp120, вызывает значительную гибель нейронных клеток в культурах нейронов гиппокампа зародышей мыши. Нейротоксичность можно снизить путем предварительной обработки антителами для CD4 и полностью устранить при помощи VIP. Так как нейроны мыши нельзя инфицировать HIV, очевидно, что нейротоксичность вызвана gp120 и не является результатом проникновения вируса или репликации.
VIP (66, 67, 68, 69: TDNYT) и центральный пептид (61-65: TTNYT) участвуют в гомологической последовательности, которая связывает CD4, и которая также обнаружена в изолятах значительно большего gp120. Пептид T при использовании в системах таких же культур нейронов гиппокампа мыши полностью противодействует нейротоксичности, вызванной gp120, Brenneman и др., Drug. Dev. Res. 15, 361-369 (1988)). Кроме того, CSF от пациента с ATDS-слабоумием вызывает существенную нейротоксичность в этой системе (44-49% смертность при 1: 1000.000 разбавлении). Этот эффект ингибируют пептидом T, Buzy и др., The Lancet, july 22, стр. 226-227 (1989)). Обычно gp120 продуцируется в большом избытке относительно количества, необходимого для вирусной репликации; этот избыток может оказывать нейротоксичное действие при количестве, далеком от соразмерности с числом микроглиальных клеток или нейронов, активно инфицированных HI.
Пептид T может действовать как агонист в дополнение или наряду с отсутствием нейрозащитного действия против вирусного инфицирования и нейротоксичности. Непосредственную агонистическую активность демонстрируют двумя способами. Ruff и др. (FEBS Lett. 211, 17-22 (1987)) показали, что пептид T и два аналога являются потенциальными агонистами хемотаксиса моноцитов человека. Их потенция как хемотактических агентов соответствует их относительной способности ингибировать gp120 связывание и инфекционность T-клеток HIV.
В качестве дополнительной демонстрации агонистической активности пептида T, пептид T и VIP оказывают свое клеточное действие посредством регуляции протеинкиназы C: Zorn и др., The Endoc. Society. Abstract. (1989)). Следовательно, агонистическая активность пептида T заключается в продуцировании трансмембранного сигнала, который может влиять на регуляцию протеинкиназы C. В шести индивидуальных экспериментах, являющихся частью изобретения, также продемонстрировано, что пептид T может понижающе регулировать фермент p56lck, тирозинкиназу, связанную с цитоплазматической частью связанного с мембраной CD4, подразумевая, таким образом, что соединение пептида T с CD4 молекулой может продуцировать трансмембранный сигнал.
Дополнительное подтверждение потенциальной агонистической активности (подобно VIP) пептида T обеспечивают результаты экспериментальной проверки гипотезы (Komisaruk и др., Annals of the NY Acad. Sci. 527, 650-654 (1988)), что VIP, выделенный от тазовых нервных окончаний в спинной мозг может давать аналгезию. Показано, что налоксон-независимую (naloxone-independent) аналгезию вызывает введение VIP в серое вещество периферийных каналов крыс, исследователи вводили VIP прямо в спинной мозг крыс и измеряли порог болевой чувствительности к периферическим вредным раздражителям для проверки гипотезы. Введение VIP в спинной мозг вызывает аналгезию, как определяли по скрытой реакции - легкие удары хвоста и в голосовом тесте в ответ на удар по хвосту при воздействии двумя способами, модулируя боль наркотиком или без наркотика, Komisaruk и др. , Annals of the NY Acad. Sci. 527, 650-654 (1988)).
На сегодняшний день считают, что введение пептида T человеку приносит пользу с клинической точки зрения, что установлено во всех опытах: при HIV заболевании, при проведении экспериментов (Pilot Swedish Study) при исследовании USC Phase I и Fenway/CRI, при исследовании по программе Toronto Western Hospital Compassionate Use Program, включающей 51 пациент; в случае псориаза и других медицинских симптомов, в докладах из Швеции (Marcusson, Lazega и др. , 1989-9 и Marcusson and Wetterberg, 186-10) и для 8 пациентов с псориазом и другими медицинскими симптомами из Торонто.
Нейропознавательные улучшения обнаружены у HIV-позитивных пациентов, а улучшения общих симптомов обнаружены и у HIV-позитивных, и у HIV-негативных пациентов, причем указанные улучшения зависят, во-первых, от подобного VIP нейротропного и агонистического действия пептида T, а также от противовоспалительного и анти-TNF действия, обсуждаемого ниже.
Ни одна частная теория не дала никаких рекомендаций в отношении использования этих пептидов при лечении MS и HAM и с точки зрения приведенных выше рекомендаций и дискуссии в отношении использования различных пептидов общей формулы 2 и их аналогов при лечении HIV, высказана гипотеза, что существуют многочисленные схожие черты выражения заболевания и потенциальные аналоги этиологии болезни. Оказывается, что пептид T действует как агонист и как блокатор иммунной функции, медиатором которой является CD4, в большей степени, чем противовирусным лекарством. В исследованиях, относящихся к настоящему изобретению, пептид T применяли пациенты с заболеваниями без HIV, такими как рассеянный склероз, HTLV-1 милопатия и псориаз.
К настоящему времени показана эффективность пептидов общей формулы 1 и, в частности, пептидов общей формулы 2, в качестве гипотезы, почему работают данные соединения, предложено следующее:
1) Оба заболевания HAM и MS являются воспалительными и демиелинизирующими заболеваниями, как HIV-заболевание.
2) Оба заболевания, возможно, имеют вирусную этиологию; в настоящее время признано, что EAM вызывается ретровирусом HTLV-1, вирусом того же семейства, что и HIV; предложено, что MS также является проявлением HTV-1 инфекции; синдром хронической утомляемости также присоединяют к ряду возможных вирусных инфекций с ретровирусной и DNA (например, HHV-6) этиологиями.
3) Оба заболевания объединяет большое количество общих симптомов, например, утомляемость, потеря равновесия и симптомы аутоиммунных явлений; стоит отметить, что HTLV-1 заболевание демонстрирует многочисленные признаки аутоиммунности, такие выражения аутоиммунных явлений, которые сопутствуют, как можно ожидать, ретровирусным заболеваниям. Одним общим предметом среди этих заболеваний может быть периферическая невропатия, основанная на процессе демиелинирования.
4) По-видимому, основанием является общее действующее вещество для димиелинирования и центральной, и периферической нервных систем и общие аутоиммунные проявления при HAM, MS и HIV заболеваниях.
5) Димиелинирование связано с воспалением любой этиологии и, по-видимому, опосредовано, по крайней мере, частично, TNF.
Ни одна частная теория не дала рекомендаций относительно использования пептидов при лечении симптомов и заболеваний, связанных с хроническим иммунным возбуждением, и с точки зрения приведенных выше рекомендаций и дискуссии в отношении использования различных пептидов общей формулы 2 и их аналогов при лечении HIV предложено, что существует иммуномодуляторный эффект пептида T, связанного с CD4. Такой эффект показан в следующих примерах, где обнаружено, что пептид T ингибирует вызванную митогеном пролиферацию периферических моноядерных клеток крови (PBMC) при пикомолярной концентрации и меньшей. Авторы обнаружили, что пептид T разрешает пролиферацию PBMC в ответ на митоген, но в меньшей степени по сравнению с ростом PBMC в его отсутствие. Предварительная инкубация PBMC с пептидом T в течение периода менее 30 минут не оказывает воздействия на стимулирование митогена. Однако, выдерживание PBMC с пептидом T в течение 2 часов с последующим промыванием клеток перед выдерживанием с митогеном дает в результате ингибирование пролиферации, аналогичное тому, когда клетки инкубируют в присутствии и пептида T, и митогена. Обнаружено также, что пептид T незначительно влияет на рост PBMC, культивированных в отсутствие митогена. Следовательно, считают, что пептид T способен подавлять нормальную пролиферацию PBMC в ответ на пролиферационные сигналы, не связанные с CD4.
В настоящее время раскрыта эффективность пептидов общей формулы 1 и, в частности, пептидов общей формулы 2 в течении симптомов и заболеваний, связанных с хроническим иммунным возбуждением или хроническим воспалением, в качестве гипотезы механизма действия пептида T и, следовательно, причины, по которой соединения, полезные в изобретении, являются эффективными, предлагают следующее.
Пептид T связывает CD4. Следующими далее тестами установлено, что пептид T ингибирует митоген и вызываемую MLR пролиферацию лимфоцитов. Следовательно, считают, что пептид T может служить в качестве иммуномодуляторного лекарства, которое бы регулировало с понижением усиленную иммунную реакцию, происходящую в хроническом присутствии антигена или по другим упомянутым причинам, и, следовательно, снижало хроническое воспаление.
Выделение всех этих применений дает общую основу воспаления. В соответствии с различными вариантами настоящего изобретения и с точки зрения приведенных выше рекомендаций, полученных из применения пептидов общей формулы 1 и, в частности, пептидов общей формулы 2, при лечении HIV человек или другие животные могут получать одинаковые дозы пептида T и его аналогов с целью лечения воспаления.
Теперь проиллюстрируем изобретение следующими не ограничивающими его примерами. Примеры ссылаются на приложенные рисунки, в которых:
Фиг. 1 соответствует примеру 6 и показывает действие пептида T на фактор экспрессии ткани (индуцированный TNF) на клетках эндотелия умбиликальной вены человека.
Фиг. 2a, 2b и 2c относится к примеру 17 и показывают, что пептид T способен ингибировать лимфо-пролиферацию в ответ на митогены. 105 PBMC культивируют в присутствии PWM (2a), Con A (2b) или PHA (2c) со следующим разбавлением пептида T: A: без пептида T, B: 10-5 М, C: 10-7 М, D: 10-9 М, E: 10-11 М, F: 10-13 М, G: 10-15 М, H: 10-17 М. Культуры инкубируют в течение 5 дней, дают импульс 3H-тимидином и количество включенной радиоактивности переводят в индекс пролиферации, как описано в примере 17. Звездочка (*) указывает различие в пролиферации: ± является статистически незначительным (P > 0.05).
Фиг. 3 относится к примеру 17 и показывает, что пролиферация лимфоцитов, индуцированная Con A, в присутствии пептида T соответствует (но с пониженной скоростью) росту в отсутствие Con A. 105 РВМС культивируют в присутствии Con A в течение 8 дней. Культуры облучают и ежедневно собирают клетки, степень лимфопролиферации выражают как количество включенного 3H-тимидина в минуту (СРМ). Параллельно с Con A добавляют пептид T (PT, 10-9 М).
Фиг. 4 относится к примеру 18. В присутствии немитогенных стимулов, таких как антигены ткани донора, способные вызвать иммунную реакцию со стороны реципиента (вакцина кори, эпидемического паротита, краснухи: MMR), суперантигены, такие как Staphylococcal, энтеротоксины SEB и TSST-1, и антитела к CD3 (анти-CD3). РВМС будет пролиферировать, как указано индексом пролиферации более 1 (-пептид Т). Присутствие пептида Т (+пептид Т), добавленного в первый день к этой культивируемой в течение шести дней культуре, не оказывает действия на рост РВМС в ответ на эти стимулы.
Фиг. 5 также относится к примеру 18. Когда РВМС одного пациента (A) культивируют в присутствии РВМС от другого пациента (B), они будут пролиферировать [(A + B(P-PT)] как результат распознавания посторонних антигенов (аллоантигенов) на поверхности клеток. В присутствии пептида Т [A + B(+PT)] аллоиммунные клетки еще способны пролиферировать.
Фиг. 6 также относится к примеру 18. Molt-4 является линией самопроизвольно растущих злокачественных Т-клеток человека. В присутствии РВМС ингибируется рост РВМС вследствие поражения Molt-4 клетками РВМС (РВМС/Molt-4-PT). В присутствии пептида Т, добавленного на первый день четырехдневного культивирования, поражение Molt-4 опосредованное РВМС, остается без изменений (РВМС/Molt-4+PT).
Фиг. 7 относится к примеру 19, в котором приведена последовательность стадий, включенных в этот цитотоксический эксперимент. Активированные макрофаги способны поражать меченные К562 клетки в отсутствие пептида Т (по PT). Если к культуре макрофага конкурентно с активатором (PT стадия 1) добавлен пептид Т на цитотоксичность воздействовать невозможно. Если пептид Т добавляют к активированным культурам макрофагов параллельно с мечеными клетками (PT стадия 2), ингибируют цитотоксичность. Варьирование времени добавления пептида N не изменяет опосредованного пептида Т ингибирования цитотоксичности, опосредованной макрофагом.
Фиг. 8, который также относится к примеру 19, показывает, что супернатант культур макрофагов, стимулированных LPS, содержит цитолитические вещества, способные убивать клетки, меченные К562. Меченые клетки содержат внутриклеточную радиоактивность, выделяющуюся при гибели клетки. Большее выделение радиоактивности (измеренное как показания счетчика в минуту, cpm) указывает на большую гибель. В отсутствие Т (A) происходит больше поражений, чем в его присутствии (B-F). Когда концентрацию пептида Т снижают ниже 1 • 10-15 М цитолитической активности, степень цитотоксичности возвращается к уровню контроля (A). Концентрации пептида Т были следующими:
A: пептид Т отсутствует
B: пептид Т, 10-5 М
C: пептид Т, 10-7 М
D: пептид Т, 10-9 М
E: пептид Т, 10-11 М
F: пептид Т, 10-13 М
G: пептид Т, 10-15 М
Фиг. 9 относится к примеру 20 и показывает, что пептид Т оказывает аналогичное действие на анти-TNF при ингибировании эффектов TNF.
Фиг. 10 относится к примеру 21 и показывает, что пептид Т снижает уровни TNF сыворотки у HIV-пациентов.
Фиг. 11 относится к примеру 23 и показывает, что аналог пептида Т 623 удлиняет продолжительность жизни мышей с повышенной чувствительностью при введении летальной дозы LPS.
Фиг. 12 относится к примеру 24 и показывает, что пептид Т ингибирует активацию нейрофилов TNF человека.
Фиг. 13 относится к примеру 24 и показывает, что аналог 505 пептида Т ингибирует действие TNF в качестве праймера активацию нейрофилов человека.
Фиг. 14 относится к примеру 24 и показывает, что аналог 505 пептида Т ингибирует LPS активацию нейрофилов человека.
Фиг. 15 относится к примеру 26 и показывает, что пептид Т снижает вызванную TNF экспрессию фактора ткани в HUVEC.
Примеры с 1 по 4 демонстрируют существенное клиническое действие, которое пептиды, полезные в данном изобретении, оказывают на MS и HAM. Пептид, используемый в каждом из примеров с 1 по 4 является вариантом пептида T общей формулы 2 с последовательностью D-Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr-амид.
Пример 1.
HTLV-1 миелопатия
Женщине 45 лет поставлен диагноз HTVL-1, сероположительный, после физической нагрузки она испытывает дизестезию ступней, боль в ногах и ступнях, слабость ног и частое мочеиспускание. Неврологическое обследование подтвердило увеличение степени сухожильных рефлексов, мышечную спастичность нижних конечностей и пирамидальную слабость ног. Диагноз подтверждается соматосенсорным и слуховым потенциалами и HTLV-1 сероположительностью. Лечение состояло в ежедневном подкожном введении 8,5 мг пептида Т по утрам. Через два месяца введения пептида Т пациентка утверждала, что состояние ее существенно улучшилось, и она способна поднимать обе ноги, а не волочить их по полу. Кроме того, она способна работать без палки, может стоять без поддержки помощника или палки, может подниматься по ступенькам впервые за два года и отмечала уменьшение частоты мочеиспускания и никтурии. Наиболее изнуряющие функциональные симптомы у нее были связаны с болезненной периферической невропатией, которая сильно ограничивала ее подвижность и социальные контакты и нарушали ее сон; она описывала боль как сильную до непереносимой. Боль, ранее не поддающаяся лечению известными способами, стала меньше, переносимой и не влияющей на повседневную активность.
После двух месяцев лечения пептидом Т, который был для пациентки новым препаратом, она сообщила о непрерывном уменьшении симптомов и улучшении подвижности. Результаты ее неврологического обследования остались без изменения в отличие от двигательной способности, например ходьбы.
Ранее она не выходила из своей квартиры, наступившее после лечения улучшение двигательной способности позволило ей путешествовать в ее дом на Карибском море. В течение этого путешествия она принимала лекарства без добавок и за пять дней заметила прогрессирующую усталость и слегла от утомления, слабости и боли. После двух недель прекращения приема пептида Т симптомы существенно уменьшились через один месяц после повторного курса. После двух последовательных курсов лечения она закончила прием препарата с аналогичным рецидивом симптомов и аналогичным их устранением после повторного лечения пептидом Т.
Пример 2.
Рассеянный склероз
Женщина 40 лет поставлен диагноз MS с симптомами: слабость, потеря равновесия, двоение в глазах и нечувствительность правой руки с 23 лет. Ее лечили преднизоном, и позднее физиотерапевтически с малым эффектом. Она оставалась неспособной ходить без палки или помощника, проявляла депрессию, горизонтальный нистагм и слабость мышц-сгибателей бедра с двух сторон, слабость мышц-сгибателей колена и задних мышц-сгибателей стопы. Отмечали повышенный тонус двух нижних конечностей и клонус обоих голеностопных суставов. Глубокие сухожильные рефлексы 2+ в руках, 3+ обоих колен и голеностопов и подошвенная чувствительность. Ее лечили препаратом LIORESALTM (баклофен - baclofen) с некоторым улучшением: однако, она чувствовала прогрессирующее ухудшение до тех пор, пока не оказалась прикованной к креслу-каталке и начала жаловаться на слабость, мышечную спастичность, клонус, недержание мочи и повторяющееся инфицирование мочевого тракта. При ее обследовании MRI сканирование головного мозга показало картину, соответствующую рассеянному склерозу.
Ее начали лечить пептидом Т, ежедневное введение 8,5 мг подкожно. Она сообщила, что значительно ослабились симптомы болезни, включая мышечную спастичность, точную двигательную координацию никтурию и частоту мочеиспускания, улучшилась концентрация, память и эмоциональная лабильность. Ее обследовали через пять недель после начала лечения, были сообщены и продемонстрированы функциональные улучшения. Через шесть месяцев пациентка продемонстрировала подтверждение улучшения этих симптомов. Уменьшилась частота никтурии, улучшился двигательный контроль, уменьшилось заикание, ее ноги стали менее спастическими, и она могла стоять с минимальной поддержкой. Она продемонстрировала заметные улучшения симптомов в области интеллектуальных и двигательных функций через несколько недель после начала лечения пептидом Т, эти улучшения подтвердились через шесть месяцев. Симптомы ухудшились, когда пациентка преостановила прием пептида Т на 3 недели, но снова улучшились, когда она снова начала принимать лекарство. Ее состояние оставалось стабильным по сравнению с обычным прогрессирующим ухудшением болезни, в течение месяцев она продолжала принимать пептид Т.
Пример 3.
Рассеянный склероз
Женщине 28 лет поставлен диагноз оптический неврит, вторичное проявление рассеянного склероза с симптомами: нечувствительность, сниженная двигательная функция и затемнение зрения (20/300 с двух сторон). Результаты соматической неврологической проверки находились в пределах нормы. Незначительные случаи нечувствительности и нарушений речи, равновесия и координации происходили в течение 6 часов, наряду с головной болью и потерей зрения.
Начали применять лечение пептидом Т. Через шесть дней повторное обследование показало значительное улучшение зрения (21/30 с двух сторон). В течение следующей недели пациентка отмечала функциональные улучшения. В предыдущем случае оптического неврита потребовалось шесть месяцев для восстановления (сравнимо с естественным течением MS) по сравнению с данным случаем, когда восстановление произошло значительно быстрее, чем ожидалось для случая оптического неврита, вызванного MS.
Пример 4.
Рассеянный склероз.
Женщина 34 лет, страдающая рассеянным склерозом, проявляющимся оптическим невритом и полной потерей зрения на правый глаз в течение 2 недель, нечувствительностью правой, а затем обеих ног. Симптомы ухудшались, ей прописали преднизон, и наступило некоторое улучшение. У нее ухудшилась атаксия с затемнением зрения и осциллопсией, ей давали преднизон 30 мг в день. MRI сканирование показало многочисленные сигналы высокой интенсивности, перивентрикулярные и ствола головного мозга, согласующиеся с MS. Прием стероидов улучшил атаксию и проблемы со зрением. Следующее MRI сканирование примерно через 16 месяцев показало обширное перивентрикулярное заболевание белого вещества с включением corpus collosum. Обнаруженная картина типична для демиелинирования, согласующегося с MS. В это время пациент демонстрирует остающийся осциляторный горизонтальный пульсирующий нистагм и горизонтальный нистагм с двусторонним пристальным взглядом (gaze), атактическая походка, небольшое ухудшение теста "пятка-голень", но хороший тест "палец-нос". Тонус нижних конечностей увеличен, и пациентка имела невыносимый двусторонний клонус голеностопа. Ее коленный рефлекс усилен на правой ноге по сравнению с левой. Подошвенные реакции усилены для двух ног. На ногах по сравнению с пуками она имела ухудшенную фиксацию, вибрацию, слабое осязательное ощущение и ощущение холода.
Приблизительно через два месяца пациентке начали вводить пептид Т, подкожно, 8,5 мг ежедневно. За 1 - 2 недели она почувствовала существенное улучшение. Она почувствовала улучшение чувствительности пальцев, легкое движение рук и улучшение познавательной функции. Когда она прекратила прием пептида Т, она отмечала усиление утомляемости и атаксии. От употребления преднизона по 150 мг в день она получила минимальное улучшение симптомов. После возобновления применения пептида Т она отметила заметное улучшение в отношении утомляемости и атаксии и точную двигательную функцию.
Пример 5.
Рассеянный склероз.
Женщину 56 лет с развитием головокружения, атаксии, случаями головокружения, нарушениями двигательной функции и распространяющейся слабостью ног лечили дилантином и поместили в госпиталь. Последующее исследование показало вертикальный нистагм, некоторые смазанные последствия и нарушение. Она была повторно обследована примерно через два года после случаев с головокружением и жалоб на спазмы ног. Медицинское обследование показало уменьшение поля зрения с частичной горизонтальной гемианопсией левого глаза в горизонтальной области и сужением поля левого глаза. Она показала ухудшение походки (tandem gait) снижение сгибания правого бедра и снижение сухожильных плечелучевых рефлексов в правой руке по сравнению с левой и в правом колене по сравнению с левым. Подошвенная реакция снижена, и пациентка имеет вертикальный нистагм с направленным вверх взглядом, как отмечалось выше. Пациентка начала применять пептид Т по 8,5 мг ежедневно подкожно и за 10 дней отметила приток энергии и улучшение интеллектуальной функции и улучшение зрения. При прекращении лечения пептидом Т симптомы ухудшились до такого состояния, как перед приемом лекарства. Проведенное в это время обследование показало отсутствие изменений по сравнению с результатами обследования до начала лечения пептидом Т.
Примеры 5 - 7 экспериментально показывают значительные эффекты, продемонстрированные пептидами, полезными в данном изобретении.
Пример 6
Воспаление, вызванное LPS.
В нулевой момент времени обычным мышам balb/c (самки, 12 недель) вводили LPS (250 μг E. coli E-235, Sigma cat. no. L-2018). Затем одну группу мышей (50 животных) обрабатывали с интервалами в 30 минут, делая внутрибрюшинные инъекции бычьего сывороточного альбумина (BSA) (Sigma cat. no. 6793), растворенного в изотонической стерильной воде без пирогена (2,5 мг BSA на одну инъекцию для каждого животного, каждая инъекция содержала 100 μл. ).
Вторую группу мышей (60 животных) обрабатывали с интервалами в 30 минут, делая внутрибрюшинные инъекции пептида Т (Carlbiotech A/S, партия 109401), растворенного в стерильной изотонической воде без пирогена (2,5 мг пептида Т на одну инъекцию каждому животному, одна инъекция составляла 100 μл).
Определяли уровень глюкозы в образцах крови через 3 часа. Субъективные параметры, такие как секреция из глаз, диарея и общее состояние оценивали по шкале от (-) до (+++).
Как можно видеть из табл. 1 (табл. 1-16 см. в конце описания), наблюдается существенная разница в уровнях глюкозы для животных, обработанных пептидом Т и животных, обработанных BSA (плацебо). Субъективные параметры также указывают на значительно более высокий индекс состояния животных, обработанных пептидом Т.
Пример 7.
Пептид Т как антагонист TNF.
Стимулирование эндотелиальных клеток TNF дает в результате индуцирование прокоагулянтной активности посредством экспрессии активности фактора ткани и сопутствующего снижения антикоагулянтного потенциала клеток через снижение экспрессии тромбомодулина (Bevilacqua и др., Nawroth и Stern, J. Exp. Med. 163, 740 (1986)). Септический шок часто сопровождается распространяющейся внутрисосудистой коагуляцией (DIC, Semeraro Acta Clinica Belgica 31, 377 (1976)), таким образом, очевидно, что фактор ткани является существенным требованием для DIC, вызванной эндотоксином (LPS). Показано, что моноклональное антитело против фактора ткани ингибирует DIC, вызванную введением эндотоксина (Warr и др., Blood 75, 1481 (1990)).
Клетки эндотелия пупочной вены человека культивируют в среде М199, снабженной 10% сывороткой плода теленка, фактором роста эндотелиальных клеток, пенициллином, стрептомицином и L-глутамином, на поддоне с 96 ячейками, используя модифицированную процедуру Bevilaqua и др., Proc. Natl. Acad. Sci. США, 83, 4533 (1986)). TNF обработку культур (100 ед. мл) проводят в течение 4 часов при 37oC в присутствии среды для роста, после чего клетки промывают и фиксируют. Культуры также обрабатывают смесью пептид Т и TNF или самим пептидом Т. В этих культурах пептид Т находится с концентрацией от 0.5 до 100 г/мл. Определяют экспрессию фактора ткани эндотелиальными клетками, обработанными TNF в присутствии или в отсутствие пептида Т, в ELISA, используя моноклональное антитело, которое нейтрализует активность фактора ткани человека (Carlbiochem A/S). Антитело, связанное с анти-фактором ткани (anti-tissue factor antibody), определяют, используя соединенный с пероксидазой противомышиный Ig кролика и субстрат ABST. По оптической плотности определяют интенсивность цвета для каждой ячейки при 405 нм.
Данные, полученные в трех экспериментах по культивированию, показывают, что пептид Т ингибирует экспрессию фактора ткани на клетках эндотелия, стимулированных 100 ед/мл человеческого рекомбинантного TNF, что показано на фиг. 1.
Пример 8.
Пептид Т провоцирует вызываемую LPS смертность
Мышам, имеющим Meth A асцитные опухоли, дают 100 μг LPS, вводя его подкожно вместе с бычьим сывороточным альбумином (BSA) или с аналогом пептида T (504 или 505, 1 мг). Через 19, 24, 41 час после инъекции регистрировали количество животных, проявляющих признаки LPS-токсичности (диарея, экссудат из глаз и общий уровень активности), в каждой группе. По окончании эксперимента регистрировали количество выживших животных (см. табл. 2 ниже), у оставшихся в живых брали кровь для дальнейшего определения TNF, IL-1, IL-6 и RNI-уровня.
Наиболее эффективный аналог (505) имеет последовательность:
H-D-Ser-Ser-D-Thr-Thr-D-Thr-Thr-Tyr-D-Thr-NH2
а аналог 504 - последовательность:
H-D-Ala-Ser-D-Thr-Thr-D-Thr-Asn-Tyr-D-Thr-NH2
Влияние аналогов пептида Т на выживание мышей, имеющих опухоли и обработанных LPS, и обработанных LPS, показано в табл. 2.
Примеры с 9 по 13 иллюстрируют эффективность пептидов настоящего изобретения в отношении различных заболеваний и/или симптомов, связанных с хроническим воспалением.
Пример 9
Ингибирование митогена, вызывающего пролиферацию РВМС
РВМС (105) культивируют в 200 μл RPMI, содержащего 10% инактивированной нагреванием сыворотки зародыша теленка. 2 мМ - глутамина и гентамицин (100 г/мл) с митогеном и пептидом Т, добавленным на первый день культивирования. За ростом следят по росту 3H-тимидина в трех параллельных экспериментах через шесть дней инкубации и выражают рост в виде индекса пролиферации (cpm в присутствии митогена ± пептид Т - cpm в отсутствие стимулирования). Индекс пролиферации > 1.00 соответствует росту, который превышает рост в самой среде. При физиологически приемлемых концентрациях пептид Т ингибирует пролиферацию нормальных (HIV серонегативных) периферических моноядерных клеток крови (РВМС), не вызывая значительной цитотоксичности, как показано в табл. 3. Этот эффект является долгодействующим, пептид Т, данный на первый день культивирования, на шестой день культивирования ингибирует пролиферацию, вызванную митогеном.
Пример 10
Ингибирование MLR.
MLR осуществляли двумя способами, используя 105 аллогенные РВМС (cpm для A = 142 ± 86, для B = 148 ± 84), культивируемые совместно в 200 μл среды, описанной в табл. 3.
Пептид Т, добавленный на первый день MLR, ингибирует аллогенно индуцируемую пролиферацию РВМС (табл. 4).
Пример 11.
Действие пептида Т на активность p56lck в PBL бластах.
BBL (периферические лейкоциты крови) - бласты получают инкубацией PBMC при 37oC с PHA (10 μг /мл) в RPMI + 10% FRS в течение 48 часов с последующим добавлением интерлейкина-2 и последующей инкубацией в течение 96 часов. Клетки промывают от IL-2 и инкубируют в течение 24 часов, затем промывают от FBS и инкубируют в течение 24 часов, PBL-бласты оставляют либо стимулированными, либо обрабатывают ОКТ4А (анти-CD4) при 10 μг /мл в течение 1 часа, затем крысиным анти-мышиным Igпри 5 μг /мл в течение 5 минут для усиления lck-активности. PBL-бласты предварительно обрабатывают пептидом Т (10-9М) в течение 2 часов, затем промывают тщательно перед анти-CD4 стимулированием. После иммунопреципитации с анти- lck-протеин А-конъюгатами и инкубирования (30oC, 10 минут) с 32P-ATP определяют аутофосфорилирование p56lck путем ауторадиографии, результаты используют в качестве меры p56lck активности.
Пептид Т ингибирует PHA-индуцируемую активацию и возрастание p56lck -активности, зависящей от анти-CD4, что определяют (табл. 5) lck -специфическим исследованием с использованием тирозинкиназы, p56lck является CD4-ассоциированной тирозинкиназой, включенной в активацию Т-клеток и трансмембранный сигнал (Janeway C.A. Ann. Rev. Jmmunol. 10, 645-674 (1992)). Вместо сигнала, обусловленного рецепторами Т-клеток кросс-связывание CD4 моноклональными анти-CD4 ингибирует активацию Т-клеток (Burgess и др., Eur j.Immunol. 21, 1663-1668 (1991)), возможно, путем активирования p56lck включая аутофосфорилирование ингибиторного Tyr 505 (Abraham и др. Nature 350, 62-66 (1991)). Abraham и др. Cancer Invest 9. 455-463 (1991)). Пептид Т способен ингибировать активацию p56lck (табл. 5), достигая, таким образом тех же результатов, что и анти-CD4( ингибирование активации Т-клеток), хотя и отличающимся механизмом.
Известно, что анти-CD4 антитела ингибируют пролиферацию PBMC, вызванную митогеном так же, как и вызванную антигеном, in vitro выделение лимфокина, функцию Т-помощника и MLK (Bank и др., J. Exp Med. 162, 1294-1303 (1985)). Возможны два механизма анти-CD4-ингибирования функции Т-клеток.
1) Анти-CD4 антитела вызывают стерические препятствия CD4/MH C II взаимодействию, которое происходит через активацию Т-клетки. Пептид Т, по-видимому, не участвует в этом эффекте, так как он является производным последовательности gp120, известной тем, что присоединяется к CD4, и место присоединения gp120 к CD4-молекуле удалено от места присоединения MHC II (Fleury и др. (1991)).
2) Кросс-связывание CD4 многовалентным анти-CD4-антителом вместо TcR/CD3 стимуляции посылает отрицательный сигнал к Т-клетке (Bank и др., J.Exp. Med 162, 1294-1303 1985)). Пептид Т моновалентен, следовательно, не может кросс-связывать CD4-рецепторы; следовательно, его механизм ингибирования активации Т-клеток должен отличаться от механизма анти-CD4. Обработка воспалительных признаков мышиным анти-CD4 дает в результате множество нежелательных побочных эффектов, включая крапивницу, лихорадки, жар и тремор, которые могут требовать медицинского вмешательства. Кроме того, сообщается о снижении количества CD4-клеток, уменьшении профилерации на митогены и антигены и уменьшение остаточных гиперчувствительных реакций после введения анти-CD4, измерении опосредованной клетками иммунной функции (Horneff и др., Cytokine 3, 266-267 (1991); Horneff и др. Arth. Rheum. 34, 129-140 (1991); Wofsey и др. Semin. Immunol. 2, 419-425 (1990)). Введение анти-CD4 конкурентно с антигеном может ингибировать и первичную, и вторичную иммунную реакцию (Waldor N.K. Immunol. Ser. 45, 573-586 (1990)). Кроме того, применение в качестве терапевтических агентов ксеногенных (нечеловеческих) протеинов ограничено вследствие потенциальной возможности образования антител, направленных против инородных протеинов, которые могут опосредовать шок и реакции гиперчувствительности типа III после повторного введения.
Пример 12.
Влияние пептида Т на индуцированную антигеном пролиферацию PBMC (см. табл. 6).
PBMC инкубируют, как описано в тексте к табл. 3 в примере 9, в присутствии живой разбавленной вакцины кори, паротита и краснухи (Merck Sharp и Dohme, Канада) с финальным разбавлением 1:20. Пептид Т добавляют либо на первый день инкубации, или ежедневно. Результаты выражают в виде индексов пролиферации ± стандартное отклонение.
Хотя пептид Т может ингибировать индуцированную антигеном пролиферацию PBMC при ежедневном введении in vitro, авторы не уверены, что это оказывает существенный эффект на нормальную иммунную реакцию, когда введение происходит in vivo (как показано Goodwin и др., J. International.Conf. Aids, Монреаль, июль 1989, Abstract # W BP286). Возможны два объяснения, которые не являются взаимоисключающими.
1. Макрофаги могут быть более чувствительными к пептиду Т, чем T-клетки, так как Т-клетки принимают значительно больше сигналов потенциального активирования, чем CD4/MHC II взаимодействия. Таким образом, введение пептида Т может понижающе регулировать макрофаги при добавлении его в первый день культивирования in vitro, ингибируя способность макрофагов к присутствующим митогенам и антигенам Т-клеток. В-клетки могут действовать как APC на месте макрофагов в присутствии антигенов, но не в присутствии митогенов, которые неспецифичны относительно антигенов (объяснение результатов табл. 3). Оставшиеся В-клетки устойчивы к пептиду Т, так как они являются CD4-отрицательными. В присутствии разовой дозы пептида Т они могут представлять антиген к Т-клеткам, позволяя пролиферацию PBMC в ответ на антиген. Когда пептид Т добавляют ежедневно к культивируемым Т-клеткам, которые могут быть менее чувствительны к действию пептида Т, то могут ингибироваться макрофаги. Это может объяснить результаты, представленные в табл. 4. Ежедневное введение пептида T in vivo может действовать не так, как при ежедневном введении in vivo , так как период полураспада пептида T in vivo короче, чем in vitro. In vitro сывороточные добавки инактивируют нагреванием для разрушения протеолитических ферментов, которые активно разрушают пептид Т In vivo. Таким образом, ежедневное введение пептида Т in vivo будет давать в результате ингибирование активности макрофагов, но не активности Т-клеток, и будет позволять дальнейшую экспрессию антигена, управляющего иммунной реакцией. Это должно объяснять эффективность пептида Т в случае хронических воспалительных симптомов, таких как ревматоидный артрит (см. ниже), где характеристические воспалительные клетки являются макрофагами. Острое воспаление характеризуется нейрофильными (CD4 отрицательными) инфильтратами и не должно поддаваться действию пептида Т. Требование представления антигена (фагоцитоз, разрушение и представление) к управляемой антигеном иммунной реакции дает в результате задержку сигнала Т-клеток. Следовательно, пептид Т, добавленный к культуре in vitro в первый день культивирования, не будет влиять на сигнал Т-клеток в последующие дни. Стимуляция митогеном пролиферации PBMC (табл. 3) является промежуточным событием, не требующим действия антигена, и может быть ингибирована долгосрочным действием при конкурентном введении пептида Т. Необходимо, чтобы пептид Т был представлен конкурентно с сигналом активации для проявления его иммунодепрессивного действия. При хроническом воспалении или иммунном возбуждении все отвечающие клетки будут принимать сигналы пролиферации все время. Ежедневное введение пептида Т in vivo ингибирует хроническое иммунное возбуждение. Так как время полураспада пептида Т составляет менее 1 часа (Ruff и др., Prog. Neuro - Psychopharmacol & Biol. Psychiat т. 15, сс. 791-801 (1991)), будут ингибированы те сигналы пролиферации, которые возникнут в течение часа после введения пептида Т. Так как все отвечающие на сигнал хронического возбуждения клетки отвечают постоянно, они будут регулироваться с понижением в течение этого 1 часа и останутся регулируемыми с понижением в течение длительного времени. Вследствие дискретного расписания представления антигенов и того факта, что не все эпитопы антигена представлены в одно и то же время (следовательно, не все T-клетки, способные отвечать, активируются одновременно), проходит 23 часа до следующей инъекции пептида Т, в которые исследуют антиген-специфические иммунные реакции. Хотя некоторые антиген-специфические иммунные реакции можно ингибировать в течение 60 минут после введения пептида Т, большинство из них, которые происходят в дискретные моменты времени, будут продолжаться.
Таким образом, пептид Т способен ингибировать хроническое иммунное возбуждение и воспаление, размещая в то же время экспрессию антиген-специфических иммунных реакций.
Пример 13.
Артрит
Мужчину 67 лет лечили ежедневным введением пептида Т (8,5 мг подкожно) от сильного псориаза, не поддающегося лечению всеми известными способами. Кроме того, сопутствующим заболеванием был болезненный артрит колен, который хотя и присутствовал в течение более 10 лет, прогрессировал до такой степени, что не позволял пациенту заниматься нормальной ежедневной деятельностью в течение шести месяцев до его первого визита. Псориаз был только временно улучшен введением пептида Т, а боль в коленах начала проходить через три недели после начала приема лекарства. Пациент не испытывал боли в течение трех месяцев, когда он продолжал лечение пептидом Т. У него не было боли еще в течение двух месяцев после прекращения применения пептида Т, и он был способен вернуться к своей повседневной деятельности. В течение восьми месяцев у него не было боли. Серьезность артрита (до применения пептида T) была такова, что ему посоветовали провести замену коленного сустава. Такое драматическое избавления от боли является экстраординарно редким у пациентов с эрозивным ревматоидным артритом даже при оперативном лечении общепринятыми способами. В течение этого времени он принимал только нестероидные противовоcпалительные лекарства, которыми он пользовался в предыдущие два года.
Пример 14.
Артрит
Женщине 47 лет поставили диагноз артрит поверхности сустава в 1977, в течение следующего года она многократно обращалась за помощью. Программа по разработке спины и упражнения дали в результате ремиссию до 1992. Сдавливающее повреждение позвоночника в мае 1992, повторяющийся артрит поверхности суставов проявились в виде интенсивной гиперэстении левого бедра и тазобедренного сустава, прогрессируя за 8 часов и включив верхнюю часть ноги, что характерно для предыдущих случаев, которые обычно продолжались 3-4 недели, облегчение приносил постельный режим и нестероидные противовоспалительные препараты. На следующий день боль усилилась и характеризовалась ощущением сильного жжения с острой болью в области поясницы, которую не облегчали препараты Toradol® или Naprosyn® (полная доза). Пациентка была прикована к постели в течение следующего дня, нарушения сна продолжались в течение 48 часов. Через пять дней после этого случая пациентка получила MOS анкету для хронического заболевания и хронических болей спины в диапазоне 40.77 из 100. После этого дня ей дали пептид T (10 мг подкожно), что снизило гиперэстению и дало возможность сделать в течение 12 часов. Оральный прием лекарств прекратили. За следующий день прекратилась гиперэстения, сон был нормальный и только присутствовала очень мягкая боль в параспинальных мышцах. В течение следующих 2 дней пациентке давали пептид T, боль полностью прекратилась, и улучшились показатели MOS до 71 и 87,4 (эти значения сравнимы с показателями людей без острых или хронических заболеваний). Введение пептида T продолжали в течение 10 дней. После прекращения введения возобновилась гиперэстения, и в течение 2 дней пациентка принимала Toradol без заметного эффекта. В течение следующих четырех дней из медицинских препаратов пациентка принимала только пептид T, последовало полное освобождение от боли и гиперэстении и восстановление нормального сна. Через 5 дней после прекращения введения пептида T не произошло рецидива симптомов болезни, орального приема лекарств больше не потребовалось.
Пример 15.
Синдром хронической утомляемости
Женщина 45 лет с GFS выраженным сильной утомляемостью, требующей частого сна, головной болью, шумом в ушах, случаями диареи, депрессией, непереносимостью света (light headedness) и ослаблением слуховой памяти. Она начала ежедневный прием пептида T (8,5 мг подкожно) и отметила улучшения, произошедшие в течение недели. Через два месяца она сообщила, что 50% ее проходят нормально. Ее утомляемость снизилась, а оставшаяся усталость связана только с увеличением активности, которое стало возможным только после начала приема пептида T. Ее память улучшилась, а головные боли стали менее частыми. Через три месяца после начала применения лекарства она стала себя чувствовать еще лучше. Она могла гулять в течение продолжительного времени впервые за два года, частота головных болей снизилась почти до нуля. Через пять месяцев приема лекарства ее утомляемость исчезла, она не испытывала головокружения и работала в саду, присматривала за детьми и снова ездила на машине на большие расстояния.
Пример 16.
Синдром утомляемости
Женщине 32 лет с EBV+, выраженным сильной утомляемостью в течение пяти месяцев, что не позволяет ей работать более 1 1/2 часа в день. Предлагаемый диагноз, пост-инфекционная невромиастения, сделан на основании утомляемости, сниженной концентрированности, слабость мышления, миалгия и фарингит. За пять дней применения пептида T (8,5 мг ежедневно подкожно) ее утомляемость значительно ослабла и полностью исчезла через месяц до такой степени, что она могла возобновить работу с полным рабочим днем и заниматься три раза в неделю гимнастикой. Она принимала пептид T в течение 35 дней и в течение шести месяцев симптомов не проявлялось. Перед началом курса приема пептида T и через 30 дней лечения состояние пациентки определили при помощи прибора Patient Symptom Inventory (устройство для самооценки, которое измеряет глубину симптомов по шкале от 0 до 4), отмечены заметные улучшения всех симптомов, см. табл. 6а.
Оказалось, что пептид T действует как противовоспалительный агент. Следовательно, пептид T должен быть новым нестероидным противовоспалительным лекарством (NSAID). Такие традиционные противовоспалительные лекарства, как аспирин и ибупрофен, имеют два потенциальных механизма действия: ингибирование циклооксигеназы, снижающей производство простагландина, и ингибирование функции нейрофилов (Altman R.D. Arth. Rheum. 19 (Suppl. 2) 1-5 (1990); Vane и др. Postgrag. Meg. J. 566 (Syppl. 4) 2-17 (1990)). Сообщают, что ингибирование циклооксигеназы усиливает (более, чем подавляет) пролиферацию PBMC, управляемую митогеном (Vane и др., Int. J. Immunopharmacol 5, 107-114 (1983)), а нейрофилы (CD4 отрицательный) должны быть устойчивы к пептиду T, следовательно, пептид T может иметь уникальный механизм противовоспалительного действия.
Противовоспалительный азатиоприн ингибирует пролиферацию лимфоцитов, ингибируя синтез ДНК и РНК. Пролиферацию обоих лимфоцитов, B и T, ингибируют, действуя азатиопорином (Briggs, J.D. Immunol. Lett. 29, 89-94 (1991). Так как, клетки B являются CDA отрицательными и могут действовать как APC в присутствии пептида T (см. выше), пептид T должен иметь механизм действия, отличающийся от механизма азатиоприна.
Циклоспорин является противовоспалительным лекарством, которое ингибирует пролиферацию лимфоцитов посредством ингибирования транскрипции IL-2 и IFN- γ гена путем его связывания с циклоспорином и инактивации последнего, который является изомеразой, необходимой для транскрипции сигнала (Halloran и др., Clin. Biochem. 24, 3-7 (1991)). Так как, пептид T может также действовать на трансдукцию сигнала (табл. 3), он не имеет сильных побочных действий, связанных с терапией циклоспоринами. Побочные эффекты, вызванные циклоспорином, включают почечную тубулярную атрофию, нефротоксичность, гипертонию, гирсутизм, гипертрофию десны, треморы, конвульсии и парестезию (Briggs, J.D. Immunol. Lett 29, 89-94 (1991)). В практике применения настоящего изобретения не отмечено существенных побочных действий, присущих применению пептида T.
Пример 17.
Пептид T ингибирует пролиферацию лимфоцитов, индуцированную митогеном. Конканавалин A (Con A), митоген лаконоса (PWM) и фитогемагглютин-P (PHA-P) получают от Sigma Chemical Co. (St. Louis, MO, USA) Пептид T синтезируют в Carlbiotech Ltd (Копенгаген, Дания) и поставляют в виде хлорида (раствора соли при 8.5 мг/мл в бензиловом спирте в качестве консерванта) и хранят при 4oC. Пептид T разбавляют до концентрации рабочего раствора в культуральной среде (RPMI). Разбавленный раствор пептида T готовят свежим для каждого эксперимента из исходного пептида T. 3H-Тимидин (5 Ci/ммоль) получают из Amersham.
Выделением PBMC: цельную кровь от здорового взрослого донора погружают в гепарин и выделяют периферические моноядерные клетки крови (PBMC) посредством центрифугирования с градиентом плотности на HistopagueTM (Sigma Chemical Co.) PBMC удаляют с поверхности раздела, промывают три раза в RPMI, содержащей гентамицин (100 μг/мл) и повторно суспендируют с концентрацией 1 • 106 PBMC/мл в PPMI, содержащей 10% сыворотку зародыша теленка и гентамицин. 105 PBMC культивируют в присутствии 10 μл суспензии митогена в кювете с 96 ячейками. Финальная концентрация митогена составляет: PWM 25 μг/мл; PHA 12,5 μг/мл и Con A 6,25 μг/мл. 10 μл рабочего раствора пептида T (или RPMI в качестве отрицательного контроля) добавляют к суспензии и инкубируют культуры клеток всего 5 дней во влажной атмосфере, 5% CO2, 37oC. Затем на культуры воздействуют 3H-тимидином (в RPMI) за 18-24 часа до сбора. Количество включенного 3H-тимидином определяют, используя BeckmanTM LS 8000 жидкостной сцинтилляционный счетчик, пролиферацию выражают как количество сцинтилляций в минуту (ср) или индекс пролиферации (PI).
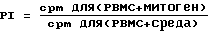
PI, равный 2, указывает на то, что количество клеток выросло в два раза по сравнению с оставшимся (нестимулированным) количеством. Все эксперименты повторяли трижды. Сообщенные результаты характеристичны для экспериментов по репликации. Продуцирование фактора α некроза опухолей (TNFα): 5 • 106 PBMC/мл инкубируют в присутствии Con A (6.25 г/мл) в течение 48 часов во влажной атмосфере, 5% CO2, 37oC. Добавляют пептид T (10-9 М) в момент времени t = 0 и 24 часам. В конце инкубации добавляют SephadexTM 625 (Pharmacia), 10 μг/мл, и инкубируют в течение 10 минут для удаления митогена. PBMC и Sephadex центрифугируют, а супернатант проверяют на уровень TNFα, используя прибор для радиоиммунного исследования TNFα из Amersham. Образцы анализируют дважды.
Статистический анализ: данные анализируют, применяя ANOVA-тест для двух образцов с 95% доверительным интервалом, таким, что p ≤ 0,005 считают существенной разницей.
Результаты.
Когда пептид T добавляют в первый день культивирования, он способен ингибировать пролиферацию лимфоцитов в ответ на PWM (фиг.2a), Co A (фиг. 2b) и PHA (фиг. 2c). Пептид T способен ингибировать PHA-стимулированные PBMC-культуры при концентрации 1 • 10-13м. Культуры, стимулированные Con A или PMM, пептид T ингибирует при концентрации менее 1 • 10-13 М. После введения in vivo пептид T достигает максимальной концентрации плазмы 5.5 • 10 -8 М; следовательно, опосредованная пептидом T иммуномодуляция должна быть активной при концентрациях лекарства, легко достижимых в плазме и CSF. Культуральная среда, которой разбавляют пептид T, не оказывает воздействия на пролиферацию. При наиболее эффективной концентрации используемого пептида пролиферацию лимфоцитов в ответ на PHA ингибируют на 26%, PWM - 38% и Con A - 36%.
Ингибирование пролиферации лимфоцитов может быть результатом цитотоксичности, задержкой инициирования пролиферации, снижением скорости роста или любой комбинацией указанных факторов. Когда пролиферацию PBMC измеряют ежедневно в течение периода роста (2-4 дня), пролиферация лимфоцитов в присутствии пептида T изменяется параллельно с ростом в отсутствие лекарства, но с меньшей скоростью (фиг. 3). В отсутствие митогена пептид T оказывает отрицательное действие на PBMC. Следовательно, пептид T не является цитотоксичным для реагирующих лимфоцитов, а также не дает задержки начала пролиферации. Пептид T позволяет клеткам расти, но с уменьшенной скоростью.
Пептид T способен ингибировать пролиферацию лимфоцитов, индуцированную митогеном, будучи добавленным к PBMC после того, как они подверглись действию митогенов (табл. 7). Этот эффект присутствует даже тогда, когда пептид T добавляют через три дня после воздействия митогена. Ингибирование лимфопролиферации пептидом T наиболее ясно, когда его добавляют к культурам, стимулированным Con A.
В дополнение к лимфопролиферации присутствие пептида T снижает количество TNFα, выделяемого в супернатант (SN) PBMC-культуры, стимулированной в течение 48 часов Con A (табл. 8). Ни пептид T, ни RPMI не проявляют какой-либо активности в RIA относительно TNFα. В отсутствие ConA в супернатанте культуры не детектируют TNFα.
Пример 18.
Пептид T ингибирует лимфопролиферацию, индуцированную не митогеном.
В противоположность митогенам, которые индуцируют сигналы пролиферации лимфоцитов путем лигирования MO/MAC и T-клеток через половинки углеводородов на разнообразные рецепторы поверхности клеток, стимулированная не митогенами лимфопролиферация опосредована "воскресшими" антигенами, суперантигенами, антителами к CD3 (анти-CD3) и аллогенными MHC молекулами и медленно взаимодействует с комплексом рецептор антигена T-клетки/CD3 (TcR/CD3). В этом отношении немитогенные стимулы более специфичны, чем митогены.
На "воскресшие" антигены отвечают только те лимфоциты, которые комплементарны эпитопам возбужденных антигенов. Обычно, они составляют небольшую фракцию общей совокупности лимфоцитов. Реакции на аллогенные MHC, характеризующиеся смешанной реакцией лимфоцитов (MLP), опосредованы узнаванием инородных молекул MHC класса II рецепторами TCR отвечающих клеток (Adv. Immunol. 31, 271 (1981)). Приблизительно 10% T-клеток является аллореактивными (Lancet. 339, 824 (1992)). Суперантигены, такие как Staphylococcal. (энтеротоксины A и B (SEA и SEB) и токсин-I синдрома токсического шока (TSST-I) стимулируют рост приблизительно 20% от общего набора клеток (Sci. Am. 266, 92 (1992)) путем взаимодействия с определенными Vβ сегментами TcR (Science 244, 811 (1989)). Анти-CD3 способен стимулировать рост 100% T-клеток, независимо от дополнительной функции клетки, путем прямого образования комплексов TcR/CD3.
Так как, митогены представляют искусственную неспецифическую форму активации лимфоцитов, оценивают действие пептида T на лимфопролиферацию в ответ на "воскресшие" антигены, анти-CD3, суперантигены и MLR. Кроме того, исследовали функции эффекторов T-клеток и рост самопроизвольно пролиферирующих линий злокачественных клеток в присутствии пептида T.
Кроме отдельно указанных случаев условия экспериментов обычно были такими, как указано в примере 17.
Пептид T не ингибирует лимфопролиферацию, вызванную не митогенами.
При добавлении в первый день шестидневного культивирования пептид T способен ингибировать лимфопролиферацию, индуцированную Con A, но не оказывает никакого действия на лимфоциты, отвечающие на "воскресший" антиген (вакцины кори, паротита, краснухи, MMR), антитела к CD3 или суперантигены SEB и TSST-I (фиг. 4). Аналогично, пептид T не действует на рост лимфоцитов в смешанной реакции лимфоцитов (фиг. 5).
Molt-4 - это клеточная линия T-лимфомы человека, p56lck отрицательная, и Jurkat - это линия T-клеток человека, p56lck положительная, которая растет самопроизвольно в отсутствие экзогенного стимула. Результаты, представленные в табл. 9, показывают, что пептид T незначительно влияет на рост Molt-4 или Jurkat клеточных линий.
Пептид T не ингибирует опосредованное PBMC поражение Molt-4 клеток. Когда PBMC смешивают с аллогенными клетками Molt-4, рост Molt-4 ингибируется (фиг. 6). Аллореактивные PBMC распознают Molt-4 в качестве инородных клеток и генерируют цитотоксичные эффекторные клетки, которые поражают Molt-4. Molt-4 не является цитотоксичной линией клеток и не может генерировать аллореактивные эффекторные клетки. Когда к этой реакции добавляют пептид T, на PBMC-опосредованное ингибирование Molt-4 пролиферации не оказывается никакого воздействия (фиг. 6), предполагают, что пептид T не действует на генерацию функций цитотоксичных эффекторов. Различить рост аллореактивных T-клеток от роста выживших Molt-4 невозможно, так как пептид T не влияет ни на рост аллореактивных T-клеток (фиг. 5), ни на рост Molt-4 (табл. 9).
Пример 19.
Клетки линии дифференцировки моноцит/макрофаг (MO/MAC) являются долго живущими непролиферирующими клетками, которые характеризуют реакции хронических воспалений. MO/NAC действуют как неспецифические фагоциты, клетки, представляющие антиген (инициирующие антиген-специфические иммунные реакции), как иммунорегуляторные клетки и цитотоксичные эффекторные клетки. MO/MAC генерируют разнообразные внутриклеточные и внеклеточные цитотоксичные эффекторные молекулы, включая реактивные кислородные интермедиаты, лизосомные ферменты и альфа-фактор некроза опухолей (TNF).
MO/MAC вовлечен в патогенез HIV-заболеваний. Все MO/MAC экспрессируют CD4 (J. Immunol. Meth. 135, 59 (1990)), и, следовательно, могут быть инфицированы HIV. Предполагают даже, что MO/MAC может быть первой клеткой, которую инфицирует HIV в процессе инфицирования (Annal. N.Y.Acad. Sci. 616, 1 (1990)). MO/MAC не так восприимчивы к инфицированию HI, так CD4 положительные T-клетки (TIPS 12, 28 (1991)) и могут быть ответственны за основание устойчивой или скрытой HIV-инфекции. MO/MAC может быть ответственным за трансмиссию HIV в CNS, где он включает основной тип клеток, инфицированных HIV (Compr. Ther. 17, 57 (1991)). В CNS MO/MAC может опосредовать неврологическое нарушение, выделял нейротоксический gp120 (Science 248, 364 (1990)), tat (J. Virol. 65, 961 (1991)) или производимые MO/MAC нейротоксины (Scince 250, 1593 (1990)). Интересно отметить, что активированный MO/MAC включен в патогенез других неврологических заболеваний, таких как рассеянный склероз (Acta Neuropathol. 80, 208 (1990); Pathol. Immunopathol. Res. 6, 241 (1987); Ann. Rev. Jmmunol. 10, 153 (1992) и болезни Альцгеймера (Eur. Neurol. 28, 30 (1988)).
Инфицированный HIV MO/MAC демонстрирует дополнительную дисфункцию клеток (Clin, Immunol. Immunopathol. 59, 436 (1991); J. Immunol. 146, 2297 (1991)). Кроме того, HIV индуцирует активацию MO/MAC, как показывает пониженные уровни неоптерина, маркера зависящей от T-клеток активации MO/MAC, и пониженные уровни монокинов (TNF, IL-1 или IL-6).
In vitro MO/MAC можно активировать IFN- γ и липополисахаридами (LPS), которые инициируют по крайней мере четыре различных межклеточных сигнала, включая избыточное выделение кальция (Immunol. Today 10, 33 (1989)).
Производство TNF можно инициировать IFN - активацией MO/MAC, но оно требует LPS для начала выделения (J. E[p. Med. 175, 405 (1992)).
Предполагают, что роль TNF в HIV-заболеваниях основана на наблюдении, какие макрофаги пациентов с AIDS выделяют TNF в большем количестве, чем у нормального пациента (Am. Rev. Respir. Dis. 144, 195 (1991)), и повышенные уровни TNF связывают с движением от скрытой HI-инфекции к AIDS (Am. J. Med. 85, 289 (1988)). Потенциальные эффекты TNF, вносящие вклад в HIV патогенез, включают TNF-опосредованную кахексию (New Eng, J. Med. 327, 329 (1992); J. Nutr. 122, 749 (1992)), аутокринное/паракринное уменьшение репликации HIV (Immunol. Today. 11, 176 (1990)), гиперактивацию иммунной системы (Biotherapy 3, 127 (1991)), ингибирование Zidvudiue (AZT = азидодезокситимидина), ddI и ddC (VIII Int. Conf. AIDS Abst. # PoA 2326 (1992); J. Intern. Med. 228, 549 (1990)), распространение аутореактивного CD4-специфического CTL (VIII Int. Conf. AIDS Abst. # PoA 2365 (1992)), поражение миелина и олигодендроцитов (AIDS 5, 1405 (1991)), цитопению (Am. Rev. Respir. Dis. 144, 195 (1991)) и апоптоз (Immunol. Ser. 56, 315 (1992)).
TNF так вовлечен в патогенез рассеянного склероза. TNF является цитотоксичным для производящих миелин олигодендроцитов (Ann. Rev. Jmmunol. 10, 153 (1992)) и может вызывать повреждение миелина прямо давая волдыри и опухание миелинового слоя (Annal. Neurol. 23, 339 (1988)).
Методы исследования
Исследование цитотоксичности макрофагов. Определение MO/MAC цитотоксичности является двухстадийным исследованием. После выделения сросшихся клеток (в основном, MO/MAC) от PBMC MO/MAC активируют лимфокинами (включая IFN-гамма и LPS). После промывания, которое удаляет активаторы, к активированным MO/MAC добавляют меченные 3H тимидином K562-клетки и инкубируют в течение 3 дней. Степень цитотоксичности пропорциональна количеству радиоактивных меток, выделившихся в супернатант культуры, и представлена следующей схемой.
PBMC
Сросшиеся клетки ( 1 час, 37oC на пластике)
Стадия 1: активация (8 часов): цитокины LPS (I μг/мл)
Стадия 2: Эффектор (3 дня): 3H-T K562
Выделение 3H-T
Цитотоксичность супернатанта MO/МАС. Супернатант (SN) активированных MO/MAC собирают с монослоев сросшихся клеток, производных PBMC, которые подвергаются действию LPS в течение 23 часов. Этот супернатант проверяют на цитотоксическую активность против 3H-тимидин-меченных клеток K562 в 48 часовом эксперименте, проводимом при 37oC. SN выдерживают при 4oC в течение ночи или хранят в замороженном виде -20oC в течение более долгого периода перед использованием.
Результаты
Пептид T ингибирует MO/MAC-опосредованную цитотоксичность. Присутствие пептида T на различных стадиях эксперимента по проверке цитотоксичности демонстрирует, что, так как пептид T не действует на способность оставшихся MO/MAC активироваться, он способен ингибировать цитотоксичность активированного MO/MAC (фиг. 7) Пептид T не влияет на активность лекарства, будет ли он добавлен одновременно с мечеными клетками или ежедневно при культивировании.
Лечение пептидом T снижает уровень неоптерина, но зависящее от пептида T уменьшение неоптерина сыворотки не связано с уменьшением IL-I сыворотки.
Когда проверяют сыворотки пациентов с зависимыми от пептида T сниженными уровнями неоптерина (уровень которого изначально был повышенным) на IL-I не находят корреляции между двумя значениями (табл. 10). Однако уровни неоптерина до введения пептида T являются повышенными, в то время, как уровни IL-I сыворотки нормальные.
Пептид T ингибирует цитотоксичность супернатантов MO/MAC-культур. Способность супернатантов MO/MAC-культур лизировать меченые K562-клетки определяют в присутствии пептида T, SN культур MO/MAC используют с финальным разбавлением 1: 6 в ячейках культивирования. Как показано на фиг. 8, пептид T способен блокировать лизис K562, опосредованный SN MO/MAC, даже при концентрации 1•10-13 M.
Пример 20.
Пептид T оказывает аналогичное действие на анти-скарификатор в ингибировании действия TNF•105. PBMC культивируют в присутствии PWM, Con A или PHA (см. пример 17). Параллельно с митогеном к культурам добавляют пептид T (10-9 M), анти-TNF MoAb # 47 при разбавлении 1:200 (антиTNF) или их комбинацию. После пяти дней инкубации на культуры воздействуют 3H-тимидином за 18 - 24 часа до сбора. Количество включенного 3H-тимидина переводят в индекс пролиферации (см. пример 17).
Данные анализируют методом ANOVA для двух образцов, используя 95% доверительные интервалы.
Пример 21.
Пептид T снижает уровни TNF сыворотки у HIV-пациентов у пациентов с IV стадией HIV-заболевания определяют уровни TNF сыворотки до и после лечения пептидом T. Пациенты принимают лекарство от 2 недель до 11 месяцев. Результаты представлены на фиг. 10. Повышение уровня TNF сыворотки у пациента BC связано с развитием условно-патогенной инфекции.
Пример 22.
Пептид T пролонгирует жизнь мышам с чувствительностью, повышенной действием D-галактозамина, модель септического шока. Пятьдесят мышей BALB/c/Swiss (самки, I-ое скрещивание) приблизительно 8-недельного возраста разбили на пять групп и давали им следующие дозы:
1. 16 мг D-галактозамина+20 μг TNF+H2O
2. 16 мг D-галактозамина+20 μг TNF+MAb 47
3. 16 мг D-галактозамина+20 μг TNF+100 μг пептида T
4. 16 мг D-галактозамина+20 μг TNF+10 μг пептида T
5. 16 г D-галактозамина+20 μг TNF+1 μ г пептида T
D-Галактозамин повышает чувствительность мышей к действию TNF в этих экспериментальных моделях септического шока. Mab 47 является анти-TNF моноклональным антителом широкого действия, получаемым от Peptide Technology Limited.
Через 12 часов оценивали защитное действие пептида T. Полученные результаты приведены в табл. 11.
Пример 23.
D-Thr-Thr-Tyr-D-Thr-NH2 продлевает жизнь мышам с повышенной чувствительностью с введенной летальной дозой LPS. Мышам вводят клетки Meth A асцитных опухолей (106 клеток, внутрибрюшинно) и дают им возможность расти. Затем повышают чувствительность мышек, несущих Meth A-опухоли, к действию TNF/LPS. Мышам вводят 50 μг LPS, растворенного в физиологическом растворе с фосфатным буфером (PBS), путем внутрибрюшинной инъекции и делят их на три группы по десять животных в каждой. Каждую группу обрабатывают следующим образом:
1. Положительный контроль. Вводят внутрибрюшинно 1 мг полимиксина B (PMB) в PBS (PMB является ингибитором LPS-активности).
2. Отрицательный контроль. Вводят внутрибрюшинно PBS.
3. Проверяемое соединение. Вводят внутрибрюшинно 1 мг аналога 623 пептида T (D-Thr-Thr-Tyr-D-Thr-NH2) в PBS. Результаты представлены на фиг. 11. Выживаемость мышей, обработанных аналогом 623 по крайней мере лучше, чем выживаемость мышей, обработанных PMB.
Пример 24.
Пептид T ингибирует активацию человеческих нейрофилов действием TNF и LPS.
Нейрофилы. Нейрофилы выделяют из цельной крови здоровых доноров. Выделение осуществляют быстрым одностадийным способом (rapid-single-step metnod) центрифугирования цельной крови на Ficoll-Hypagueтм. Получают более 99% жизнеспособных нейрофилов со степенью чистоты более 98%. Пептиды и TNF. TNF является рекомбинантным продуктом, продуцируемым в E.coli. Пептид T и аналог 505 (D-Ser-Ser-D-Thr-Thr-D-Thr-Thr-Tyr-D-Thr) повторно суспендируют в растворе Hank's Balanced Salt Solution (HBSS).
Проверка действия пептида T и аналога 505 на стимулированные нейрофилы (100 μмг) методом хемилюминесценции. К 100 μл TNF с концентрацией 500 - 1000 ед/мл добавляют 10 μл пептида и через 5 минут 100 μл 1•107 нейрофилов/мл. Клетки инкубируют далее при 37oC в течение 20 минут и затем проверяют на хемилюминесцентную активность. В некоторых случаях добавляют агонист, такой как fMLP (10-7 M). Хемилюминесценцию измеряют на приборе LKB. Результаты для пептида T представлены на фиг. 12 в виде максимумов люминесценции. Измеряют хемилюминесценции, зависящую от люцигенина (lucigenin), что означает определение перекиси. В другой серии экспериментов определяют влияние аналога 505 на LPS-индуцированную хемилюминесценцию нейрофилов. В этом случае LPS в основном замещен TNF. Концентрация LPS составляет 0.005 μг/мл. Результаты представлены на фиг. 13 и 14, которые показывают, что аналог 505 (a) ингибируют TNF-инициацию и активацию человеческих нейрофилов и (b) ингибируют LPS-активацию человеческих нейрофилов, соответственно.
Пример 25.
Пептид T понижает TNF-опосредованное разложение гликопротеида и снижает способность TNF стимулировать нейрофил-опосредованное разложение хряща.
(a) В одной группе экспериментов различные концентрации пептида T смешивают c TNF и затем добавляют к 35S-меченому хрящу. Хрящ культивируют в течение 3 дней при температуре 37oC и каждый день удаляют супернатант для определения степени разложения. Ежедневно культуру хряща пополняют TNF или смесью пептид T-ТNF.
(b) В другой группе экспериментов нейрофил человека обрабатывают TNF или смесью пептид T-TNF и затем добавляют к хрящу. Определяют опосредованное нейрофилами разложение хряща.
Результаты
1. Действие пептида T на TNF-индуцированное разложение хряща
2. Действия пептида T на TNF-инициированные нейрофилы для разложения гликопротеидов. Пептид Е снижает способность TNF стимулировать нейрофил-опосредованное разложение хряща (табл. 13).
Этот пример дает убедительное подтверждение in vitro клинического поведения, представленного в примерах 13 и 14.
Пример 26.
Пептид T снижает экспрессию фактора ткани, индуцированную TNF.
В случае острого общего воспаления, например у пациента с септическим шоком, можно наблюдать распространенную внутрисосудистую коагуляцию. В течение реакции коагуляции клетки эндотелия включаются в качестве медиаторов адгезии клеток. Одним фактором, который продуцируется и который вовлечен в коагуляционный каскад, является фактор ткани, известный так же, как прокоагулянтная активность эндотелиальных клеток; его индуцирует TNF. В этом примере показано, что пептид T ингибирует экспрессию фактора ткани клетками эндотелия, при этом показано, что пептид T ингибирует некоторую патологию, ассоциированную с острым воспалительными реакциями.
Методология. Клетки эндотелия пупочной вены человека культивируют в основном способом Bevilacgua и др. Proc.Natl. Acad. Sci. UCA 83, 4533 - 4537 (1986). Культуры клеток обрабатывают TNF при концентрации 3 μг/мл в течение 4 часов при температуре 37oC в присутствии и в отсутствие пептида T. Экспрессию фактора ткани измеряют методом ELISA с последующим определением оптического поглощения при 450 н. Результаты показаны на фиг. 15, из которого можно видеть, что повышение концентрации пептида T пропорционально снижает экспрессию фактора ткани.
Пример 27.
Оценки "качества жизни", связанного с состоянием здоровья, симптомов у MS-пациентов.
Для оценки влияния изменений, вызванных приемом лекарства, на общее состояние здоровья и тяжесть симптомов пациенты с MS постоянно имеют при себе два устройства для определения "качества жизни", связанного с состоянием здоровья, это общепризнанные приборы и вновь разработанный: MS-модифицирвоанная версия Medicol Outcomes Study - HIV Survey (MOS-HIV) на 30 пунктов, впервые разработанная доктором Dr. Albert Wu, Psychological General Well - Being Schedule (PGWB) на 22 пункта, разработанный Dr. Harold Dupuy, и MS Symptom Checklist, разработанный для этого исследования. Эти инструменты, первые два из которых утверждены и, как показано, реагируют на изменения других болезненных состояний, позволяют количественно выражать изменение симптомов по оценке самого пациента (см. Brook et al., Medical Cave 17 (7 Suppl. ) 1-54 (1979), Fazio "A Concurrent validation Sarvey of the NCHS General Well-Being Schedule", us Dept of Health, Education and Welfare, National Center for Health Statistics, Hyattsville, Maryland, USA, 1977, Mc Dowell and Newell "Measuring Health: A Guide to Rating Scales and Questionnaires", Oxford University Press 1987, Stewart et al., Medicak Cave 26 724-35 (1988), JAMA 262 907-13 (1989), and "Measuring Functioning and Well-Being of Patients wiht Chronic Conditions: The Medicul Outcomes Stidy Approach", Duke University Press 1992, Wachtel et al., Ann. Int. Med. 116 129-137 (1992), Ware et al., "Conceptualization and Measurement of Health fer Adults in the Health Insurance Survey, Vol. 111: Mental Health", Rand Corporation 1979, and Wu et al., Medical Cave 29(8) 786-98 (1991)).
Так как небольшое количество пациентов было включено в данное сообщение (некоторые из пациентов принимали пептид Т по схеме прием-нет-прием), нельзя ожидать получения статистических данных. Для оценки оснований некоторых тенденций три пациента, кто прекратил прием пептида Т и затем снова начал принимать лекарство через несколько недель после периода с новой линией отсчета, дважды появляются в следующем исследовании. Таким образом, было определено 8 линий отсчета и повторных измерений (недели 0, 4, 8 и 12), которые анализировали, применяя t-тест (two-tailed paired t-тест):
см. табл. 14-16.
BMS-модифицованном MOS-HIV наблюдают либо отклонение, либо существенное со статистической точки зрения улучшение на 4, 8 и 12 недели даже в таком малом образце и по таким показателям здоровья, как физический дискомфорт, психическое здоровье и расстройство здоровья. Улучшения являются статистически значимыми по всем трем точкам измерения: активность, общее качество жизни, благополучие и суммарному значению в ненагруженном состоянии. Общее улучшение подтверждается суммарным значением PGWB.
Значительное повышение активности подтверждается подпунктом жизнеспособности PGWB и оценки воздействия усталости на ежедневную активность.
Снижение недомогания становится статистически значимым на 4 и 8 недели. В отношении нейропознавательных проявлений MS существует направленность на улучшение в смысле снижения забывчивости и замедлений мышления.
В исследовании качества жизни, имеющего отношение к здоровью, в качестве показателя умеренного клинически значимого изменения принимают статистически существенные изменения, большие, чем 0,5 стандартного отклонения (смотри Testa, J. Hypertension 5, 9-13 (1987)). Все отмеченные выше улучшения легко превысили этот тест, причем многие улучшения больше одного стандартного отклонения. Средние улучшения при измерении активности на 12 неделе по всем трем инструментам превышают два стандартных отклонения, индикация очень большого клинического изменения общего состояния и синдрома истощения MS.
Эти исследования, поддающиеся количественному определению во времени, поддерживают клинические наблюдения существенного улучшения.
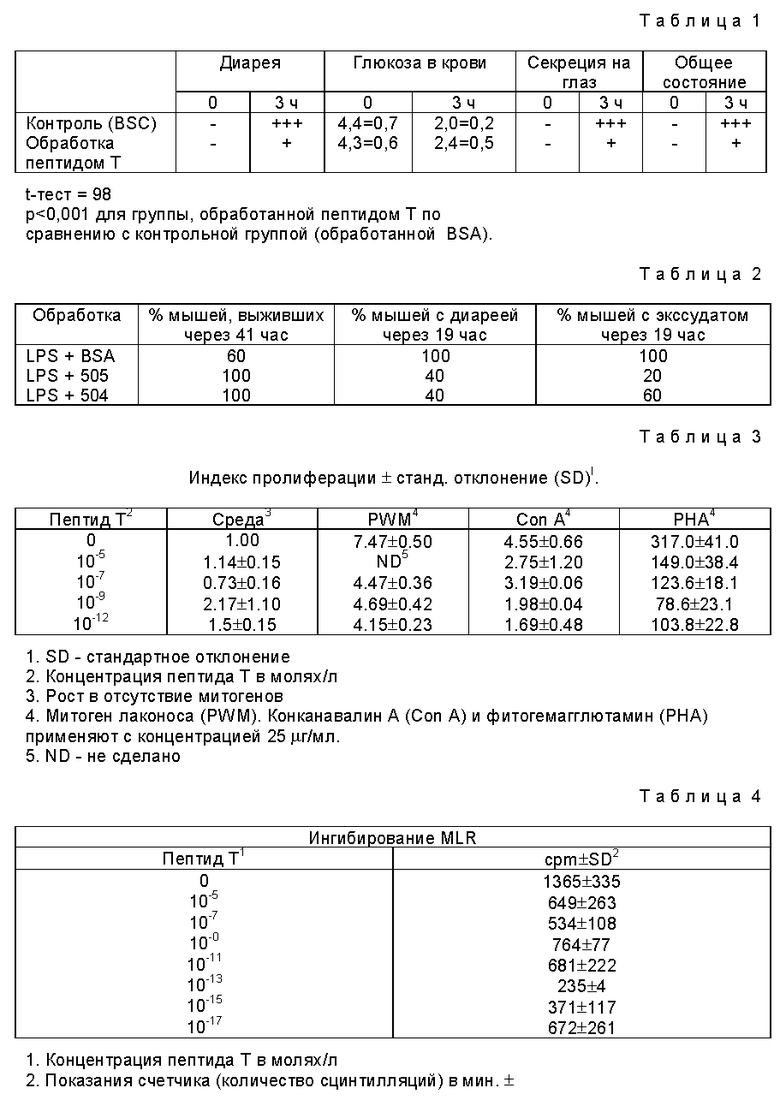
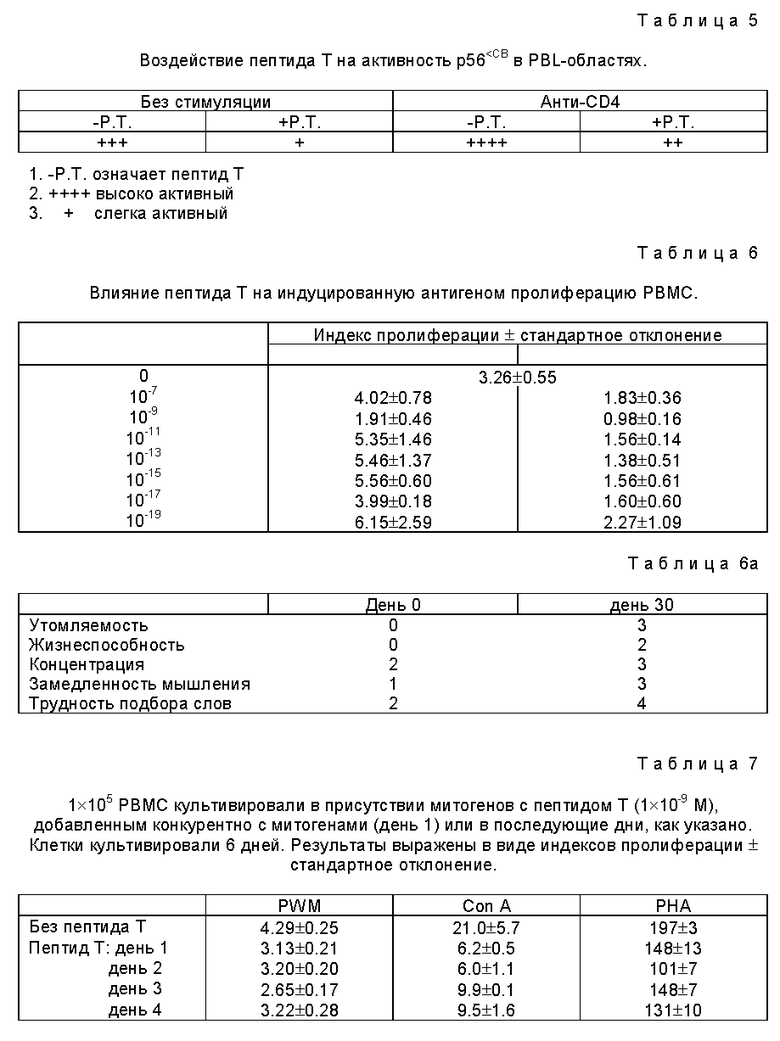

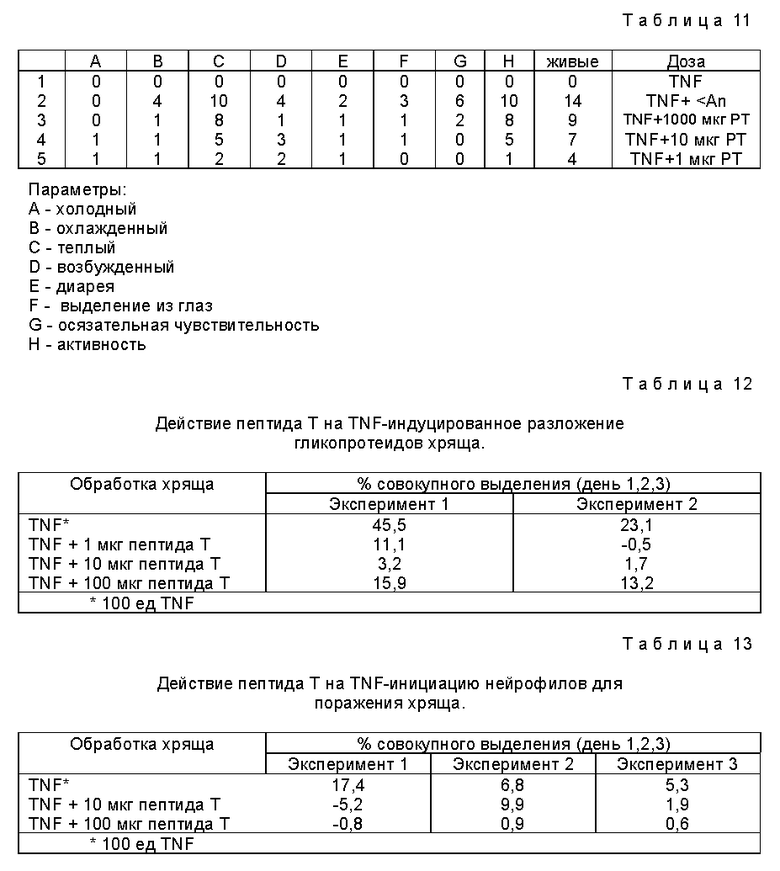
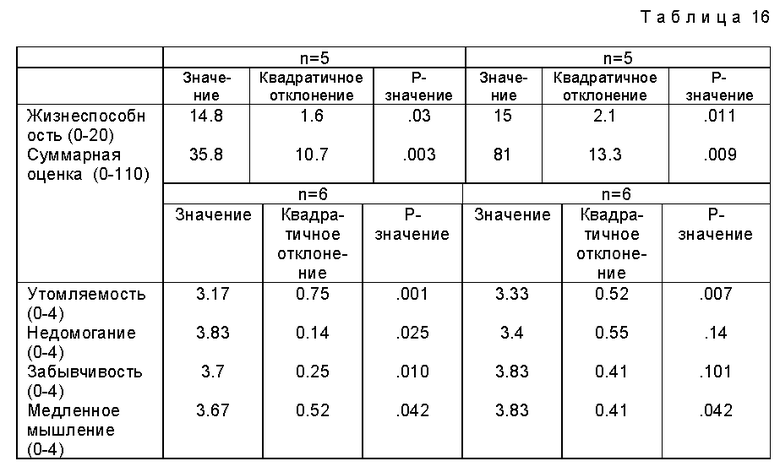
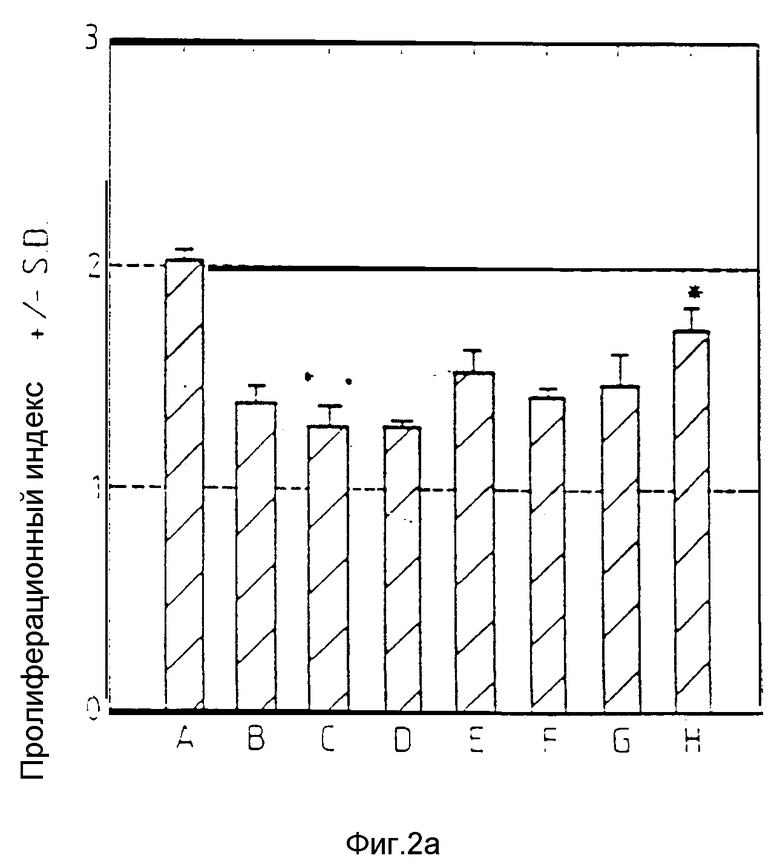
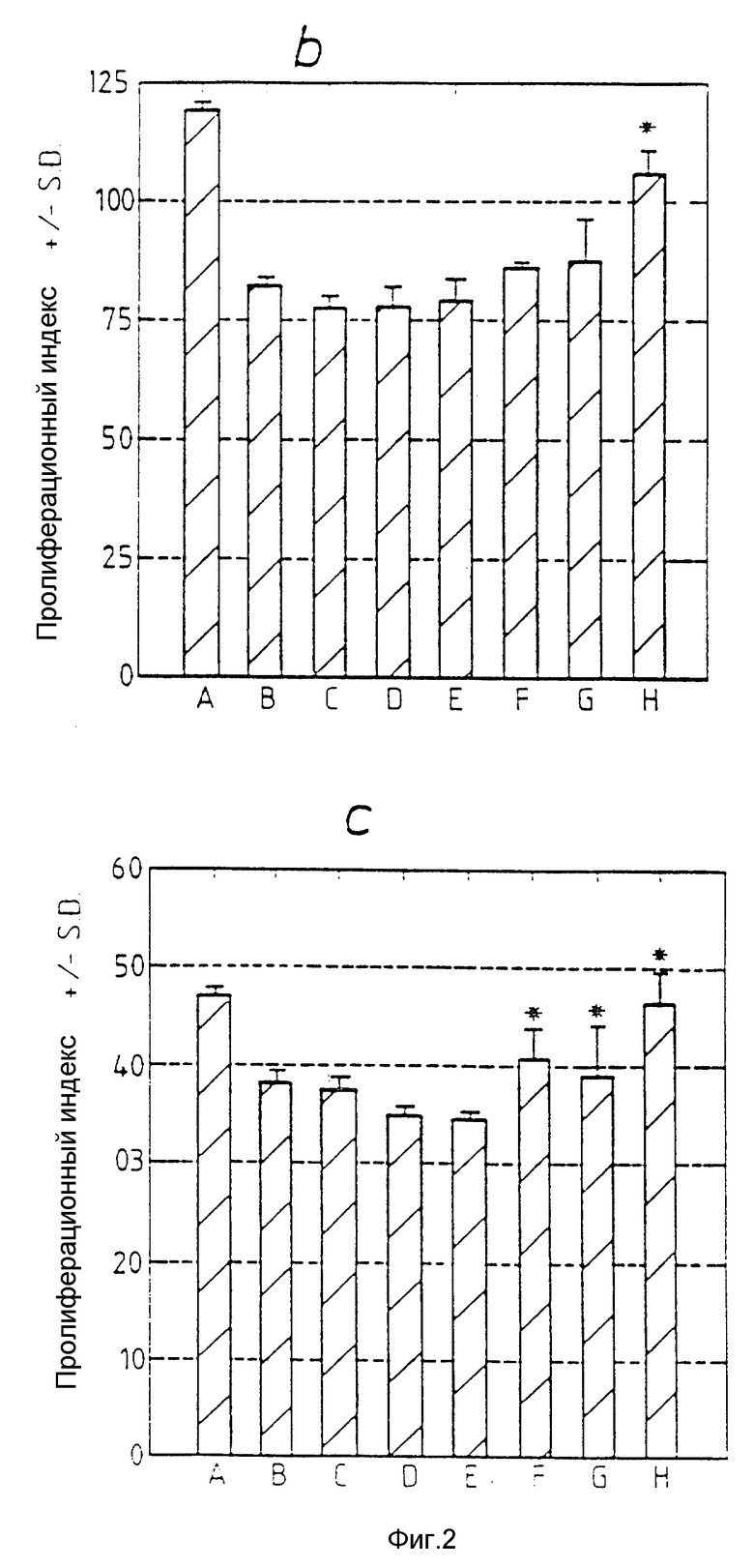
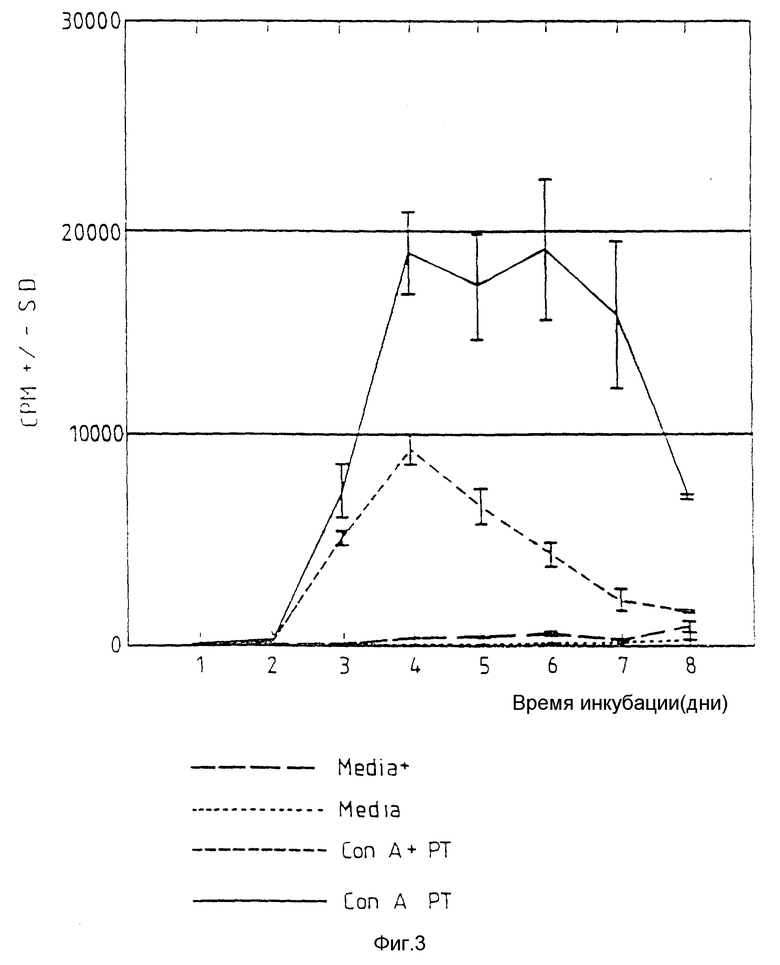
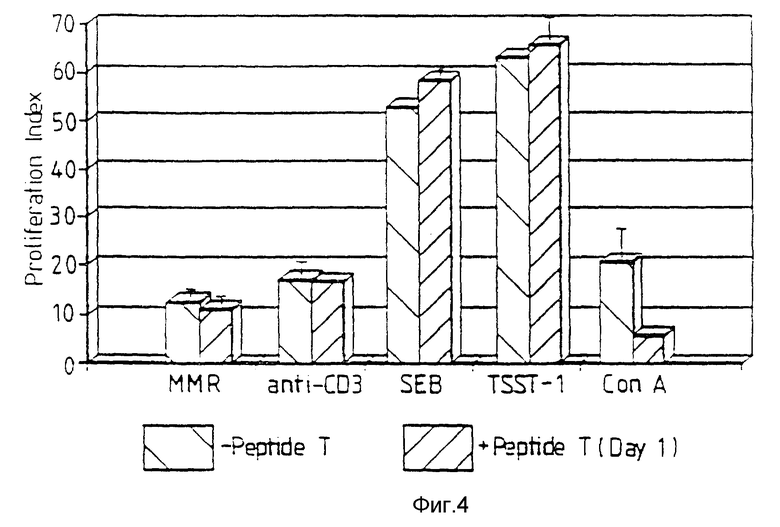

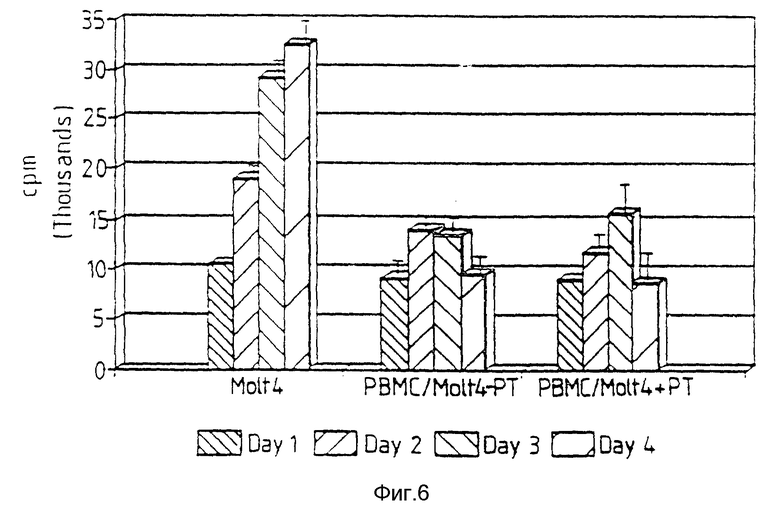
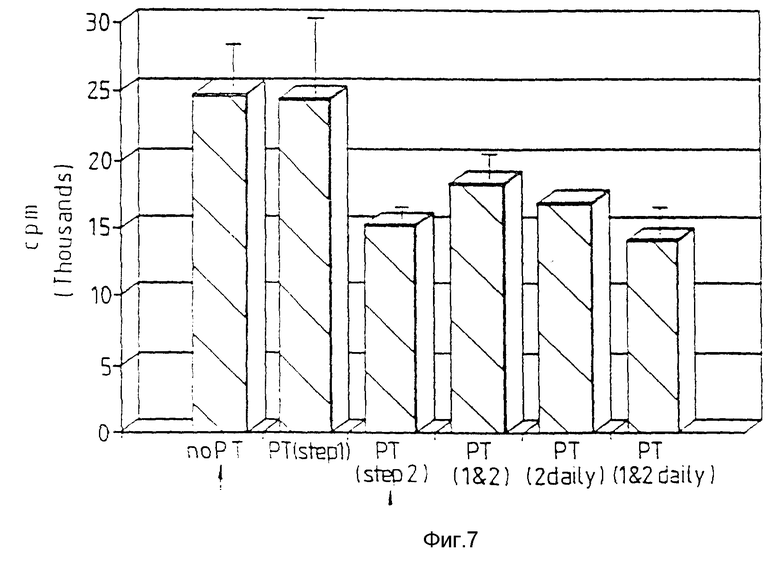



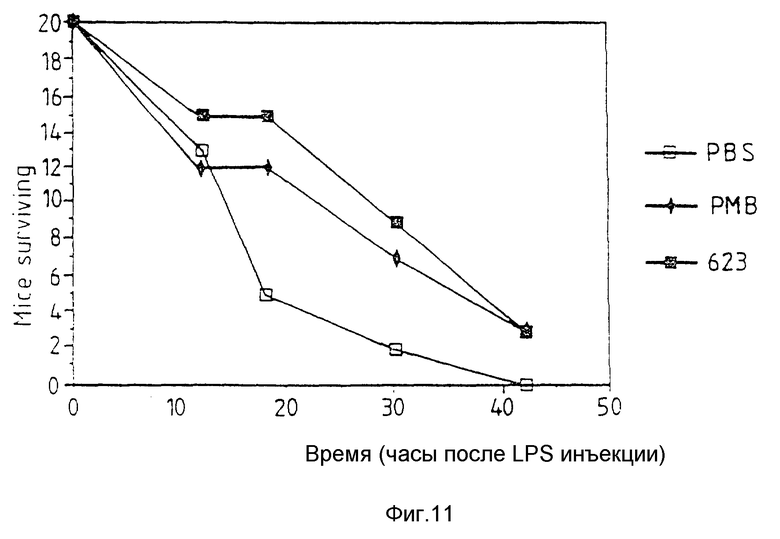
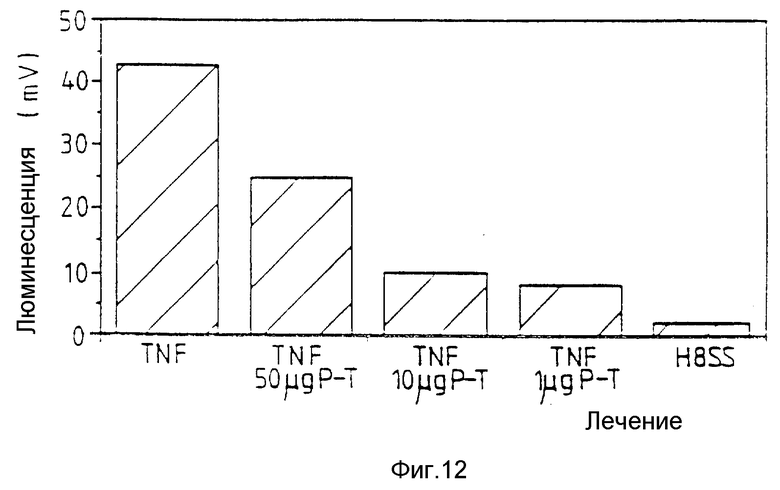
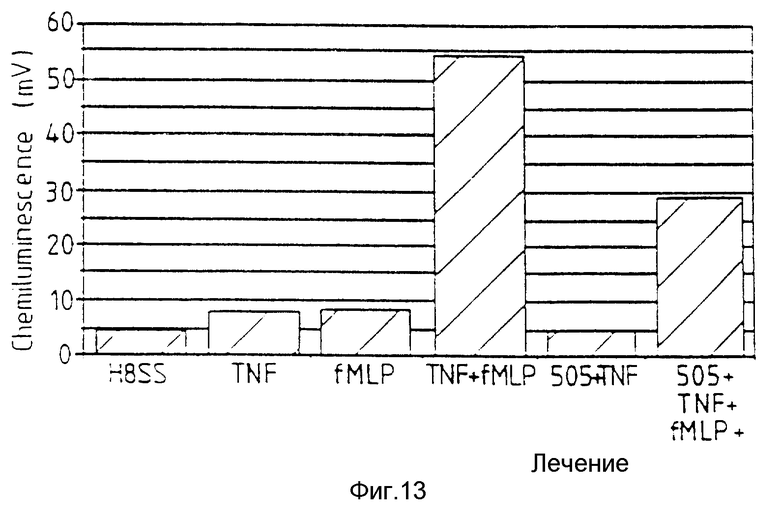
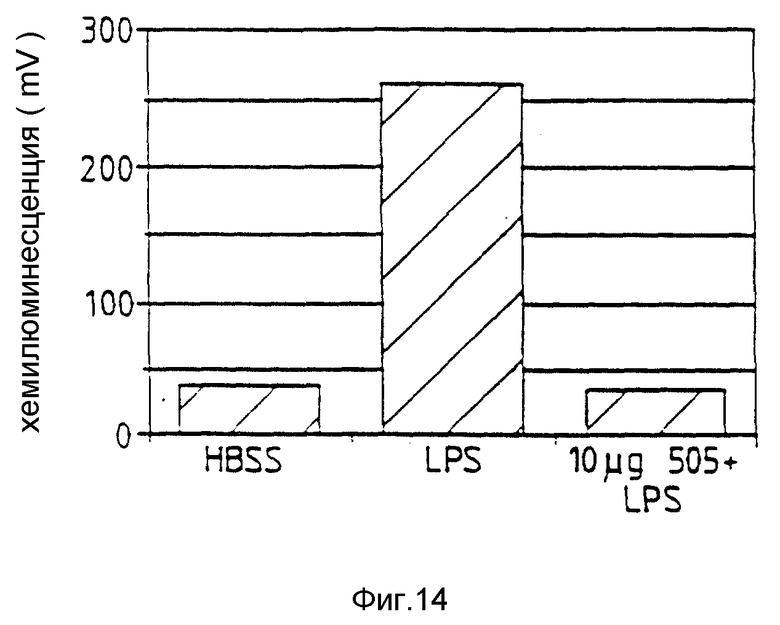
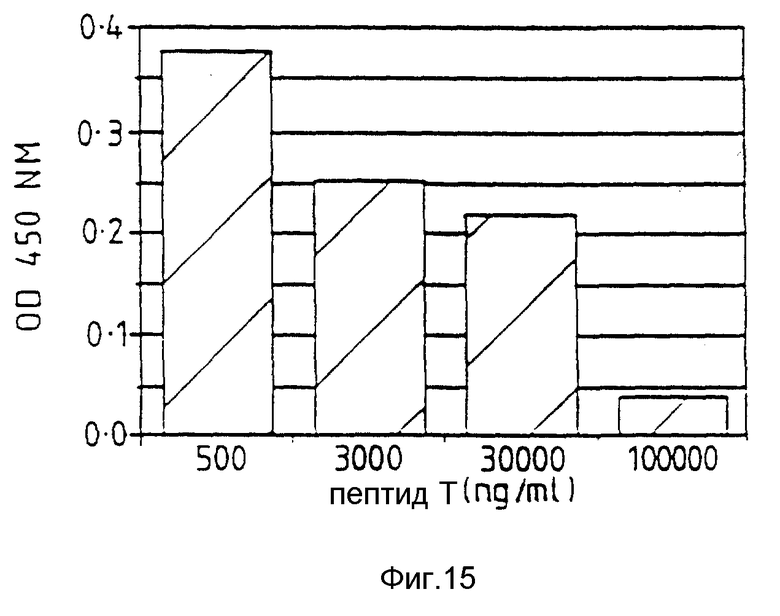
Линейный или циклический пептид общей формулы D-Ala-Ser-Thr-Thr-Thr-Asn-Tyr-Thr-NH2, или его производное или его соль применяют для производства медикамента, предназначенного для лечения или профилактики воспалительных заболеваний кишечника. Способ лечения или профилактики воспалительных заболеваний кишечника включает введение пациенту эффективного количества пептида. Эффективное количество составляет 0,05 - 10000 мг пептида в день. Пептид вводят в виде фармацевтической композиции совместно с фармацевтически приемлемым носителем. Фармацевтически приемлемые носители выбирают из носителей, которые делают композицию приемлемой для введения через нос, перорального, буккального, парентерального, местного или ректального введения или для ингаляции. Использование изобретения обеспечивает эффективность лечения. 2 c. и 11 з.п. ф-лы, 17 ил., 16 табл.
| Peppercorn, Annol | |||
| Intern | |||
| Med, 112, 50 - 60, 1990. |
Авторы
Даты
1999-05-20—Публикация
1993-03-29—Подача