Изобретение относится к новым 1-гидрокси-6-замещенным пиридин-2-онам и 2-тионам, к способу их получения и к их применению в качестве биоцидов. Эти соединения проявляют хорошее биоцидное действие, в частности фунгицидное действие.
Соединения, проявляющие биоцидное действие, хорошо известны в технике. Так, например, известно, что такие пиритионовые соли, как цинкпиритион, обладают превосходным биоцидным действием, включающим широкий спектр бактерицидного и фунгицидного действия. Существует множество областей применения таких пиритионов. В качестве иллюстрации сказанного, в американском патенте N 4818436 описано применение пиритионов в жидкостях, используемых при металлообработке, в американском патенте N 4401770 описаны полиуретановые вставки для обуви с противомикробным действием, а в американском патенте N 4935061 описано их применение в красках.
Несмотря на превосходное биоцидное (в частности, фунгицидное) действие, свойственное пиритионовым солям, в определенных областях применения эти соединения проявляют недостатки, самым заметным из которых является ограниченная растворимость в некоторых органических растворителях и водной среде. Таким образом, в технике производства биоцидов могли бы найти применение новые соединения, проявляющие не только превосходное биоцидное действие, но также и хорошую растворимость в органических растворителях.
Одно соединение, которое обладает хорошими биоцидной эффективностью и растворимостью в композициях шампуней, представляет собой 1-гидрокси-4-метил-6-(2,4,4-триметилпентил)-2-пиридон. К сожалению, это соединение в производстве оказывается более дорогостоящим, чем этого можно было бы желать. Это соединение и родственные ему соединения описаны в американском патенте 3883545; их применение против перхоти описано в американском патенте 4185106, а их применение в устраняющем перхоть шампуне описано в американском патенте 4711775. В американском патенте 4916228 описано получение 1-гидрокси-2-пиридонов обширного класса по способу, в котором предусмотрена реакция пирона, отвечающего точно определенной структурной формуле, с гидроксиламмониевой солью в присутствии по меньшей мере одного карбоната и/или бикарбоната щелочного металла.
В публикации технического журнала, озаглавленной "Quantitative Structure-Activity Analysis in a Series of Antimycotically Active N-Hydroxypyridones", Journal of Medicinal Chemistry, 1974, том 17, N 7, с. 753, описаны различные 1-гидроксизамещенные 2-пиридоны, включая те, что содержат пара-заместители - SCH2C6H4Cl (соединение 15 в табл. 11 этой публикации) и -OCH2C6H4Cl (соединение 16 в табл. 11 публикации), как проявляющие противогрибковое действие. Однако в этой технической публикации не описан способ получения таких соединений, полагают, что эти соединения были получены из 6-хлор-2-пирона, который промышленностью не выпускается.
В технике производств биоцидов были бы весьма желательны другие, новые биоциды, проявляющие желаемые характеристики растворимости, а также новые способы их получения.
В одном из аспектов настоящее изобретение относится к соединению формулы I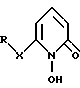
где X - атом кислорода или серы;
R - замещенный или незамещенный углеводородный радикал, содержащий 1 - 20 углеродных атомов, при условии, что R отличен от хлорбензила.
В другом аспекте настоящее изобретение относится к соединению формулы II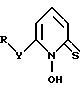
где Y - атом кислорода или серы или группа NR', где N - атом азота;
R и R' каждый независимо замещенный или незамещенный углеводородный радикал, содержащий 1 - 20 углеродных атомов.
В еще одном аспекте настоящее изобретения относится к соединению формулы III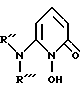
где R'' и R''' каждый независимо - либо водородный атом, либо замещенный или незамещенный углеводородный радикал, содержащий от 1 - 20 углеродных атомов при условии, что либо R'', либо R''' - углеводородный радикал.
Предпочтительными углеводородными радикалами для R группы в вышеприведенных формулах (I), (II) и (III) являются алифатические углеводородные остатки, содержащие от 3 до 15 углеродных атомов, предпочтительнее углеводородные остатки, с прямой цепью содержащие от 5 до 10 углеродных атомов каждый. Термин "замещенный углеводород" использован как охватывающий такие заместители, как атомы галогена, в частности хлора, иода, фтора и брома, алкоксигруппы, в частности метокси-, этокси-, пропокси- и бутоксигруппы, нитро-, тио-, аминогруппы, их сочетания и тому подобное. Примеры углеводородных групп включают в себя н-октил, 2,4,4-триметилпентил, 3,5,5-триметилгексил, их сочетания и тому подобное.
Тем не менее в другом аспекте настоящее изобретение относится к способу получения соединения формулы (I) или (II), где X или Y обозначает атом кислорода, при осуществлении которого предусмотрены стадии: а) реакции 2,6-дихлорпиридин-N-оксида, гидроксисоединения, содержащего от 1 до 20 углеродных атомов (в частности, такого спирта, как н-октанол, или такого фенольного соединения, как 4-метилфенил, предпочтительнее выбранного из класса, охватывающего соединения с алкильными, арилалкильными и арильными радикалами, содержащие по меньшей мере по одной гидроксильной группе, и их сочетания), и основания (такие как гидроокись натрия и гидроокись калия) необязательно в воде или органическом растворителе при повышенной температуре с получением соответствующего 2-хлор-6-замещенного пиридин-N-оксида и б) реакции упомянутого 2-хлор-6-замещенного пиридин-N-оксида с основанием с получением соответствующего 1-гидрокси-6-замещенного пиридин-2-она.
В еще одном аспекте настоящее изобретение относится к способу получения соединения формулы (II), где Y обозначает атом азота, или соединения формулы (III), при осуществлении которого предусмотрены стадии: а) реакции 2,6-дихлорпиридин-N-оксида, первичного или вторичного амина, содержащего 1 - 20 углеродных атомов (в частности, диметаноламина или триэтаноламина), и основания (такого как гидроокись натрия и гидроокись калия) необязательно в воде или органическом растворителе при повышенной температуре с получением соответствующего 2-хлор-6-замещенного пиридин-N-оксида и б) реакции упомянутого 2-хлор-6-замещенного пиридин-N-оксида и серусодержащего основания с получением соответствующего 1-гидрокси-6-замещенного пиридин-2-тиона.
В другом аспекте настоящее изобретение относится к способу получения соединения формулы (I) или (II), где X или Y - атом серы, при осуществлении которого предусмотрены стадии: а) реакции 2,6-дихлорпиридин-N-оксида, тиолового соединения, содержащего 1 - 20 углеродных атомов (например, алкил-, аралкил-, и арилтиоловых соединений и их сочетаний), и основания (такого как гидроокись натрия или гидроокись калия) в органическом растворителе при повышенной температуре с получением соответствующего 2-хлор-6-замещенного пиридин-N-оксида и б) реакции упомянутого 2-хлор-6-замещенного пиридин-N-оксида и основания с получением соответствующего 1-гидрокси-6-замещенного пиридин-2-она (то есть соединения формулы (I)) или 1-гидрокси-6-замещенного пиридин-2-тиона (то есть соединения формулы (II)).
Вышеописанные способы можно осуществлять проведением реакций последовательно или одновременно в одну стадию. С целью упростить проведение реакции стадии (а) возможно использование поверхностно-активных веществ и/или межфазных катализаторов.
В еще одном аспекте настоящее изобретение относится к противомикробной композиции, включающей в себя функциональный компонент, выбранный из класса, охватывающего краски, клеи, материалы для покрытий, эластомеры, герметики, шампуни, медицинские средства для ухода за кожей и жидкости, используемые при металлообработке, и противомикробно эффективное количество соединения, отвечающего вышеприведенной формуле (I), или соли соединения формулы (I). К примерам солей относятся аминовые соли, соли щелочных металлов и щелочноземельных металлов и тому подобное.
В еще одном аспекте изобретение относится к способу подавления роста микроорганизмов путем контактирования указанных микроорганизмов с композицией, включающей противомикробно эффективное количество одного из вышеописанных 1-гидрокси-6-замещенных пиридин-2-онов, 1-гидрокси-6-замещенных пиридин-2-тионов, их солей или их сочетания по настоящему изобретению и по меньшей мере один компонент, выбранный из класса, охватывающего мыла, шампуни, медицинские средства ухода за кожей, косметику и другие полимерные композиции, такие как клеи, материалы для покрытий, эластомеры, герметики и краски.
Эти и другие аспекты очевидны из изучения нижеследующего подробного описания изобретения.
Теперь совершенно неожиданно установлено, что для получения 1-гидрокси-6-замещенных 2-пиридонов или 1-гидрокси-6-замещенных 2-тионов можно применять простой способ с использованием легко доступных исходных материалов. Указанные соединения проявляют превосходное противомикробное действие и оказываются недорогими при получении.
Новые 1-гидрокси-6-замещенные пиридин-2-оновые и 1-гидрокси-6-замещенные пиридин-2-тионовые соединения настоящего изобретения представлены вышеприведенными формулами (I), (II) и (III).
Реакции по способам настоящего изобретения хорошо протекают под атмосферным давлением, хотя при необходимости можно создавать повышенное или пониженное давление. Подходящая реакционная температура для стадий (а) и (б) находится в интервале между температурами приблизительно 25oC и примерно 150oC, предпочтительнее поддерживать температуру кипения от примерно 70 до примерно 90oC. Общую продолжительность реакции при осуществлении способа настоящего изобретения можно варьировать в широком диапазоне, но предпочтительнее от 30 мин до 5 ч для стадии (а) и от тридцати минут до 5 ч для стадии (б).
Реакции при осуществлении способов настоящего изобретения удобно проводить в присутствии основания и в органическом растворителе. Подходящие основания охватывают такие гидроокиси щелочных металлов, как гидроокись натрия и гидроокись калия, такие гидроокиси щелочноземельных металлов, как гидроокиси кальция и магния, пиридин, триэтиламин и другие третичные аминовые основания, карбонат калия, аминовый катализатор ДАБЦО [1,4-диазабицикло (2.2.2)октан] , ДБУ [1,8-диазабицикло (5.4.0)унден-7-ен] и дБН [1,5-диазабицикло(4.3.0)-нон-5-ен] , трет-бутилтетраметилгуанидин, их сочетания и тому подобное. Предпочтительными основаниями для стадии (а) являются безводные гранулированные и порошкообразные гидроокиси натрия и калия, а предпочтительными основаниями для стадии (б) служат концентрированные водные растворы гидроокисей натрия и калия, в которых концентрация основания составляет от примерно 10 до примерно 90% от веса раствора. В предпочтительном варианте основание используют по меньшей мере в количестве, равном числу молей каждого из реагентов, а при желании можно использовать молярный избыток основания относительно количества каждого реагента.
Реакции по способам настоящего изобретения удобно проводить в среде растворителя. Класс подходящих органических растворителей включает в себя, например, диэтиловый эфир и ацетон, хлористый метилен, бензол, толуол, пиридин, тетрагидрофуран (ТГФ), ацетонитрил, диметилсульфоксид (ДМСО), диметилформамид (ДМФ) и их сочетания. Хотя предпочтительным растворителем является ацетонитрил, более предпочтительно проводить реакции в неразбавленном виде. В качестве другого варианта при желании можно использовать реакционноспособный растворитель, в частности использовать органический растворитель, например изопропанол или н-октанол, в количестве, достаточном для проявления им желаемых характеристик как реагента растворителя.
Молярное соотношение между реагентами при осуществлении способов настоящего изобретения можно варьировать в широком интервале, но предпочтительнее от 10:1 до 1:10, более предпочтительно от 2:1 до 1:2, а наиболее предпочтительно оно составляет приблизительно 1:1.
Противомикробные композиции настоящего изобретения соответственно включают в себя противомикробно эффективное количество соединения, определяемого с помощью вышеприведенных структурных формул, и сочетаний таких соединений, и по меньшей мере один продукт, выбранный из класса, который охватывает мыла, шампуни, медицинские средства ухода за кожей, косметические средства и краски. Это противомикробное соединение можно применять как таковое или в форме его соли, в частности такой аминовой соли, как моноэтаноламиновая (МЭА) соль, причем предпочтительнее использовать солевую форму. Термин "противомикробно эффективное количество" служит для обозначения количества, достаточного для придания композициям стойкости к воздействию таких микроорганизмов, как грибки и/или бактерии. В предпочтительном варианте противомикробные соединения используют в составе композиции в общем количестве, находящемся в интервале от примерно 0,01 до примерно 10 вес.%, более предпочтительно от примерно 0,01 до примерно 5 вес.%, в пересчете на общий вес композиции. Биоцидные соединения настоящего изобретения особенно предпочтительно использовать в таких средствах личной гигиены, как шампуни и прочие средства ухода за волосами, а также в красках, связующем красок и таких полимерных композициях, как клеи, материалы для покрытий, герметики, эластомеры, в кислотах и тому подобном.
Что касается красок, то, как полагают, повышенные растворимость в органических веществах и биоцидное действие, характерные для соединений настоящего изобретения, обуславливают их достоинства при использовании этих соединений в самых разнообразных красках, включая бытовые краски для внутренних и наружных работ, промышленные и технические краски, а также особые краски для морских судов, применяемые, например, для корпусов судов.
Как правило, в состав краски входят смола, пигмент и различные необязательные добавки, такие как загуститель (загустители), смачивающие агенты и тому подобное, как это хорошо известно в данной области техники. Смолу предпочтительнее выбирать из класса, который охватывает виниловые, алкиловые, эпоксидные, акриловые, полиуретановые, полиэфирные смолы и их сочетания. Такую смолу предпочтительнее использовать в количестве от примерно 20 до примерно 80% от веса краски или основы краски.
Кроме того, композиция краски по настоящему изобретению включает в себя необязательные добавки, которые оказывают благоприятное влияние на вязкость, смачивающую способность и диспергируемость, а также на стойкость к замерзанию и электролитам и на свойства пенообразования. Если готовят краску для морских судов, в предпочтительном варианте эта краска содержит такой совместный биоцид, как окись одновалентной меди или тиоцианат меди, вызывающий набухание агент, который обуславливает постепенное "сползание" краски в морской окружающей среде, благодаря чему возобновляется первоначальное биоцидное действие свежеобнаженного биоцида на поверхности контактирования краски с морской водной средой. Примерами вызывающих набухание агентов служат встречающиеся в природе или синтетические глины, такие как каолин, монтмориллонит (бентонит), clay слюда (мусковит), хлорит (гектонит) и тому подобное. Было установлено, что для приготовления композиций настоящего изобретения с целью придать желаемый эффект "сползания" полезными кроме глин являются другие вызывающие набухание агенты, включая такие природные и синтетические полимеры, которые технически доступны под названием POLYMERGEL. Вызывающие набухание агенты могут быть использованы индивидуально или в сочетании. Предпочтительное общее количество необязательных добавок не превышает 20 вес. %, более предпочтительно от примерно 1 до примерно 5 вес.% от общего веса композиции краски.
К примерам загущающих агентов относятся производные целлюлозы, например метил-, гидроксиэтил-, гидроксипропил- и карбоксиметилцеллюлоза, поливиниловый спирт, поливинилпирролидон, полиэтиленгликоль, соли полиакриловой кислоты и соли сополимеров акриловая кислота/акриламид.
К подходящим смачивающим и диспергирующим агентам относятся полифосфат натрия, соли низкомолекулярной полиакриловой кислоты, соли полиэтансульфокислоты, соли поливинилфосфоновой кислоты, соли полималеиновой кислоты и соли сополимеров малеиновой кислоты с этиленом, 1-олефины, содержащие от 3 до 18 углеродных атомов, и/или стирол.
С целью повысить стойкость к замерзанию и электролитам в состав краски можно добавлять различные мономерные 1,2-диолы, например гликоль, 1,2-пропиленгликоль и 1,2-бутиленгликоль, их полимеры или оксиэтилированные соединения, например продукты реакции окиси этилена с длинноцепочечными алканолами, амины, карбоновые кислоты, амиды карбоновых кислот, алкидные фенолы, полипропиленгликоль при полибутиленгликоль. Минимальную температуру пленкообразования (точку побеления) композиции краски можно снизить добавлением таких растворителей, как этиленгликоль, бутилгликоль, этилгликоль, этилгликольацетат, бутилдигликольацетат, бензол и алкилированные ароматические углеводороды. В качестве пеногасителей приемлемы, например, полипропиленгликоль и полисилоксаны.
Соединения настоящего изобретения обладают многими желаемыми свойствами. Они обладают хорошим противомикробным действием и совместимы с компонентами обычных мыл, шампуней, медицинских средств ухода за кожей, пластических масс, других полимерных композиций и тому подобного. Эти полимеры также нелетучи, гидролитически стойки, термостойки и могут быть растворимы в воде и органических растворителях. Более того, они не придают никакой нежелательной окраски типичным средствам личной гигиены. Тем не менее полагают, кроме того, что по своей стоимости они более конкурентоспособны, чем известные противомикробные добавки, используемые в обычных средствах ухода за кожей.
Существо настоящего изобретения проиллюстрировано без каких-либо ограничений его рамок с помощью нижеследующих примеров. В этих примерах аббревиатура "г" служит для обозначения граммов, "моль" - для обозначения молей, а процентные количества материалов во всех случаях, за исключением специально оговоренных, являются весовыми.
Пример 1. Получение 1-гидрокси-6-изопропилоксипиридин-2(1H)-онов.
При 80oC в течение ночи проводили реакцию 0,82 г (0,0050 моль) 2,6-дихлорпиридин-N-оксида и 0,78 г (0,013 моль) изопропанола с 0,210 г (0,0050 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-изопропилоксипиридин-N-оксида. Избыток изопропанола удаляли в вакууме и в течение 3 ч при 100oC проводили реакцию 0,800 г (0,020 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-изопропилоксипиридин-2(1H)-он. После охлаждения к нему добавляли 74 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 5. Массу экстрагировали 3 порциями по 25 мл этилацетата. Этилацетатный экстракт промывали 2 порциями по 10 мл воды и сушили над сульфатом натрия. Раствор насыщали хлоридом натрия и экстрагировали 3 порциями по 25 мл этилацетата. Этилацетатный экстракт промывали 2 порциями по 10 мл воды и сушили над сульфатом натрия. Объединенные этилацетатные экстракты фильтровали и отпаривали в вакууме с получением 0,50 г продукта (59%). Его перекристаллизовывали из смеси 5 мл этилацетата с 5 мл гексанов и активированным углем. Температура плавления: 119-120oC.
Пример 2. Получение 1-гидрокси-6-(2,4,4-триметилпентилокси)-пиридин-2(1H)-она.
При 100oC в течение ночи проводили реакцию 0,82 г (0,0050 моль) 2,6-дихлорпиридин-N-оксида и 0,664 г (98%-ного) (0,0050 моль) 2,4,4-триметил-1-пентанола с 0,211 г (0,0050 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-(2,4,4-триметилпентилокси)-пиридин-N-оксида. В течение 4,5 ч при 100oC проводили его реакцию с 0,600 г (0,015 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-(2,4,4-триметилпентилокси)-пиридин-2-(1H)-он. После охлаждения к нему добавляли 74 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Массу экстрагировали 3 порциями по 25 этилацетата. Объединенный этилацетатный экстракт промывали 2 порциями по 10 мл насыщенного раствора хлорида натрия и сушили над сульфатом натрия. Этилацетатный экстракт фильтровали и отпаривали в вакууме с получением 1,08 г продукта (90%). Его перекристаллизовывали из смеси этилацетата с гексанами. Температура плавления: 133,5-134oC.
Пример 3. Получение 1-гидрокси-6-(3,5,5-триметилгексилокси)-пиридин-2(1H)-она.
При 80oC в течение 8,5 ч проводили реакцию 0,82 г (0,0050 моль) 2,6-дихлорпиридин-N-оксида и 0,80 г (90%-ного) (0,0050 моль) 3,5,5-триметил-1-гексанола с 0,206 г (0,0050 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-(3,5,5-триметилгексилокси)-пиридин-N-оксида. В течение 4 ч при 80oC проводили его реакцию с 0,600 г (0,015 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-(3,5,5-триметилгексилокси)-пиридин-2(1H)-он. После охлаждения к нему добавляли 74 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Осадок отфильтровывали и промывали водой, получая 0,577 г продукта (45%). Его перекристаллизовывали из смеси этилацетата с гексанами. Температура плавления: 130,5-131oC.
Пример 4. Получение 1-гидрокси-6-октилоксипиридин-2(1H)-она.
При 80oC в течение 4,5 ч проводили реакцию 0,82 г (0,0050 моль) 2,6-дихлорпиридин-N-оксида и 0,658 г (99%-ного) (0,0050 моль) 1-окатанола с 0,200 г (0,0050 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-октилокси-пиридин-N-оксида. В течение 2,5 ч при 80oC проводили его реакцию с 0,600 г (0,015 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-октилоксипиридин-2-(1H)-он. После охлаждения к нему добавляли 74 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Осадок отфильтровывали и промывали водой, получая 0,577 г продукта (48%). Его перекристаллизовывали из смеси этилацетата с гексанами. Температура плавления: 119-120oC.
Пример 5. Получение 1-гидрокси-6-октилтиопиридин-2(1H)-она.
При 80oC в течение 6 ч проводили реакцию 2,01 г (0,0122 моль) 2,6-дихлорпиридин-N-оксида и 2,10 г (85%-ного) (0,0122 моль) 1-октилмеркаптана с 0,488 г (0,0122 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-октилтиопиридин-N-оксида. В течение 3 ч при 80oC проводили его реакцию с 1,47 г (0,0367 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-октилтиопиридин-2(1H)-он. После охлаждения к нему добавляли 180 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Осадок отфильтровывали, промывали водой и промывали 150 мл петролейного эфира, получая 1,34 г продукта (43%).
Пример 6. Получение 1-гидрокси-6-октилсульфонилпиридин-2(1H)-она.
При комнатной температуре в течение ночи проводили реакцию 0,204 г (0,00080 моль) 1-гидрокси-6-октилтиопиридин-2(1H)-она с 0,36 мл (0,0032 моль) 30%-ной перекиси водорода в 2,0 мл ледяной уксусной кислоты, получая 1-гидрокси-6-октилсульфонилпиридин-2(1H)-она. Его отпаривали в вакууме и затем растворяли в этаноле и трижды отпаривали в вакууме с получением 0,22 г продукта. Его перекристаллизовывали из смеси ацетона с петролейным эфиром.
Пример 7. Получение 1-гидрокси-6-тиофенилпиридин-2(1H)-она.
При 80oC в течение 5 ч проводили реакцию 1,64 г (0,010 моль) 2,6-дихлорпиридин-N-оксида и 1,11 г (99%-ного) (0,010 моль) тиофенола с 0,400 г (0,010 моль) измельченной гидроокиси натрия в 16,4 мл ДМСО с получением 2-хлор-6-тиофенилпиридин-N-оксида. В течение 2,5 ч при 80oC проводили его реакцию с 1,20 г (0,030 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-тиофенилпиридин-2(1H)-он. После охлаждения к нему добавляли 148 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Осадок отфильтровывали, промывали водой и промывали гексанами, получая 1,64 г (75%) продукта. Его перекристаллизовывали из этанола. Температура плавления: 180 - 181oC.
Пример 8. Получение 1-гидрокси-6-тиофенилсульфонилпиридин-2(1H)-она.
При комнатной температуре в течение ночи проводили реакцию 1,00 г (0,00456 моль) 1-гидрокси-6-тиофенилпиридин-2(1H)-она с 1,30 мл (0,0114 моль) 30%-ной перекиси водорода в 5 мл ледяной уксусной кислоты. Осадок растворяли в более 5 мл ледяной уксусной кислоты и затем с вечера пятницы до понедельника к нему при комнатной температуре добавляли 1,30 мл (0,0114 моль) 30%-ной перекиси водорода. Осадок отфильтровывали и промывали гексанами, получая 0,624 г продукта. В вакууме отпаривали уксусную кислоту и гексаны, получая 0,45 г продукта. Количество объединенного продукта составляло 1,14 г (93%).
Пример 9. Получение 1-гидрокси-6-фенилоксипиридин-2(1H)-она.
При 80oC в течение 6 ч проводили реакцию 0,82 г (0,0050 моль) 2,6-дихлорпиридин-N-оксида и 0,47 г (0,0050 моль) фенола с 0,200 г (0,0050 моль) измельченной гидроокиси натрия в 8,2 мл ДМСО с получением 2-хлор-6-фенилоксипиридин-N-оксида. В течение 3,5 ч при 80oC проводили его реакцию с 0,600 г (0,015 моль) измельченной гидроокиси натрия, получая 1-гидрокси-6-фенилоксипиридин-2(1H)-он. После охлаждения к нему добавляли 74 мл воды и величину pH добавлением 6 н. соляной кислоты доводили до 3. Водный раствор экстрагировали 2 порциями по 25 мл дихлорметана и сушили над сульфатом натрия. Дихлорметановый раствор отпаривали в вакууме, получая 1,29 г продукта, который очищали флэш-хроматографией (этилацетат:метанол в соотношении 9:1): 0,82 г (65%).
Пример 10. Получение 1-гидрокси-6-октиламинопиридин-2(1H)-онов.
К 1,53 г (0,008 моль) 2,6-дихлорпиридина в 13,3 мл толуола добавляли 1,26 г (0,0162 моль) 1-октиламина и кипятили с обратным холодильником в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и промывали несколько раз водой, получая в виде желтой жидкости 2,02 г 2-хлор-6-октиламинопиридин-N-оксида.
Эту желтую жидкость кипятили в течение ночи с обратным холодильником вместе с 2,7 г трет-бутоксида калия в трет.бутиловом спирте. В реакционную колбу добавляли воды, и при доведении величины pH до 3 получали осадок. Этот осадок отфильтровывали и промывали, получая 1,36 г продукта.
Пример 11. Получение 1-гидрокси-6-октилоксипиридин-2(1H)-тионов.
2-Хлор-6-октилоксипиридин-N-оксид готовили в соответствии с методикой примера 4 с последующей реакцией NaSH в ацетонитриле и экстракцией хлористым метиленом с получением продукта в виде белого порошка.
Пример 12. Получение 1-гидрокси-6-октиламинопиридин-2(1H)-тионов.
Реакционную смесь 0,52 г 2-хлор-6-октиламинопиридин-N-оксида (полученного по методике примера 10) с 5 мл ДМСО и 0,55 мл 46%-ного раствора NaSH выдерживали при 80oC в течение двух часов. Затем реакционную смесь разбавляли водой, величину pH доводили до трех и продукт экстрагировали хлористым метиленом.
Пример 13. Предложенный пример получения 1-гидрокси-6-октилтиопиридин-2(1H)-тионов.
2-Хлор-6-октилтиопиридин-N-оксид готовят в соответствии с методикой, описанной в примере 5, а последующая реакция с водным раствором NaSH позволяет получать продукт, указанный в заголовке примера.
Определение минимальной ингибирующей концентрации (МИК) для противомикробных соединений настоящего изобретения.
Растворы экспериментальных соединений в диметилсульфоксиде разбавляли в питательном бульоне (соевый бульон Триптика для бактерий и декстрозный бульон Сабуро для грибков) в микролитровых чашках Петри. Равные объемы каждого разбавления добавляли в суспензию бактерий (106 колониеобразующих единиц/мл) или грибков (105 клеток или спор/мл) в бульоне и чашки Петри инкубировали при 37oC (бактерии и дрожжи) или 28oC (плесневые грибки). До определения максимальной степени разбавления, обеспечивающего ингибирование, бактерии, дрожжи и плесневые грибки инкубировали в течение двух, пяти и семи дней (см. таблицу).
Результаты, сведенные в таблицу, показывают, что соединения настоящего изобретения характеризуются МИК, которая в ряде случаев лучше, чем тот же показатель для технического биоцида, биоцида OCTOPIROXR, продукта, выпускаемого фирмой "Хехст компани". Следует отметить, что соединения примеров 3, 4 и 11 характеризуются, в частности, превосходными величинами МИК.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения простых пиридин-2-эфиров или пиридин-2-тиоэфиров, или их кислотно-аддитивных солей, или пиридин-N-оксидов (его варианты) | 1984 |
|
SU1417796A3 |
| ТИОПРОИЗВОДНОЕ ПИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, КОТОРАЯ ЕГО СОДЕРЖИТ И ИМЕЕТ СПОСОБНОСТЬ ДЕЙСТВОВАТЬ ПРОТИВ HELICOBACTER PYLORI | 2010 |
|
RU2484089C1 |
| СОСТАВ КРАСКИ ИЛИ ОСНОВЫ КРАСКИ, СПОСОБ ПОВЫШЕНИЯ БИОЦИДНОЙ ЭФФЕКТИВНОСТИ СОСТАВА КРАСКИ ИЛИ ОСНОВЫ КРАСКИ | 1991 |
|
RU2111993C1 |
| 2-[(4-ГЕТЕРОЦИКЛ-ФЕНОКСИМЕТИЛ)ФЕНОКСИ]-АЛКАНОАТЫ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ ПОДАВЛЕНИЯ НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТИ | 1993 |
|
RU2113434C1 |
| N - ОКСИДЫ 4-ФЕНИЛПИПЕРАЗИНОВ И 4-ФЕНИЛПИПЕРИДИНОВ, КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ИНГИБИРОВАНИЯ ДОПАМИН-2 РЕЦЕПТОРОВ | 1994 |
|
RU2123001C1 |
| Способ получения производных 3-хлор-2-(дихлорметил)пиридина | 1987 |
|
SU1598871A3 |
| ПРОИЗВОДНЫЕ ПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2083562C1 |
| ПИРИДИН-N-ОКСИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2628339C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНА | 1992 |
|
RU2035461C1 |
| ЗАМЕЩЕННЫЕ БИАРИЛЬНЫЕ СОЕДИНЕНИЯ ИЛИ ЗАМЕЩЕННЫЕ ПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1997 |
|
RU2195443C2 |

Изобретение относится к производным пиридин-2-она или пиридин-2-тиона ф-лы (I), где Y - O, -S- или -NН; R - С1-С20-алкил, А - кислород или сера при условии, что R отличен от хлорбензила, которые проявляют противомикробную активность. Соединения (I), в которых Y - кислород, А - сера, получают реакцией 2,6-дихлорпиридин-N-оксида с гидроксисоединением, таким как фенол или С1-С20-спирт, и основанием с последующей обработкой образующегося соединения серусодержащим основанием. Соединение (I), в которых Y - NН-группа, А - сера, получают реакцией 2,6-дихлорпиридин-N-оксида с первичным амином и основанием с последующей обработкой образующегося продукта гидросульфидной солью. Соединения (I), в которых Y и А - сера, получают реакцией 2,6-ди-хлорпиридин-N-оксида с тиоловым соединением, таким как алкилмеркаптан, и основанием с последующей обработкой образующегося продукта гидросульфидной солью. Cоединения (I), в которых А - кислород и Y - NН-группа, получают реакцией 2,6-дихлорпиридин-N-оксида с первичным амином и основанием с последующей обработкой образующегося продукта основанием. Соединения (I), в которых А и Y - кислород или сера получают реакцией 2,6-дихлорпиридин-N-оксида с гидроксисоединением или тиоловым соединением и основанием с последующей обработкой образующегося продукта основанием. Изобретение относится также к антимикробной композиции, включающей в качестве активного соединения соединение ф-лы (I) в эффективном количестве. Изобретение относится к способу подавления роста микроорганизмов, включающему введение микроорганизмов в контакт с эффективным количеством антимикробной композиции. 9 с. и 9 з.п. ф-лы, 1 табл.
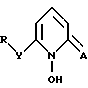 (I)
(I)
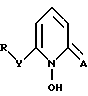
где Y - O, S или NH;
R - возможно замещенный алкильный радикал, содержащий 1 - 20 атомов углерода, или фенил;
А - кислород или сера при условии, что R отличен от хлорбензола.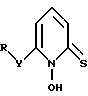
где Y и R имеют указанные в п.1 значения.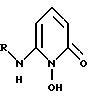
где R имеет указанное в п.1 значение.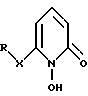
где X - атом кислорода или серы;
R - возможно замещенный алкильный радикал, содержащий 1 - 20 углеродных атомов, или фенил при условии, что R отличен от хлорбензила.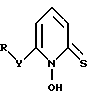
где Y - атом кислорода или серы или группа NH;
R имеет указанные в п.1 значения.
Приоритет по пунктам:
18.10.93 по пп.1, 4 - 7, 9 - 11 и 13;
30.09.94 по пп.2, 3, 8 и 12, уточнение признаков.
| Способ получения 1-окси-2-пиридонов | 1973 |
|
SU468418A3 |
| US 4916228 A, 1990 | |||
| US 4818436 A, 1989 | |||
| US 4401770 A, 1983 | |||
| Journal of Medicinal Chemistry | |||
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
Авторы
Даты
1999-06-10—Публикация
1994-10-11—Подача