Данное изобретение относится к процессу стереоселективного гликозилирования для получения 2'-дезоксифторнуклеозидов и к промежуточным продуктам данного процесса.
Непрерывный интерес, проявляемый к синтезу 2'-дезоксифторнуклеозидов и их аналогов, основывается на их успешном использовании в качестве терапевтических агентов для лечения вирусных и раковых заболеваний. Соединением, представляющим особый интерес, является гемцитабин; см. европейское патентное описание N 211354 и патент США 4526988. Поскольку эти соединения являются бета-нуклеозидами, существует потребность в предоставлении таких соединений с высоким выходом.
Существенной стадией в процессе синтеза 2'-дезоксифторнуклеозидов является конденсация или гликозилирование нуклеооснования и карбогидрата (углевода) с образованием N-гликозидной связи.
Однако процессы синтеза 2'-дезоксинуклеозидов, как правило, являются нестереоселективными и приводят к образованию смесей альфа- и бета-нуклеозидов. Например, процесс по патенту США 4526988 не приводил к стереоселективному получению 2-дезокси-2,2-дифтор-бета-нуклеозидов, а вместо этого давал 4:1 аномерное отношение α к β 2-дезокси-2,2-дифторнуклеозида. Даже оптимизация защитных групп не смогла увеличить соотношение альфа и бета за пределы 1: 1; см. патент США 4965374, по которому использовались карбогидрат с бензоильными защитными или блокирующими группами.
Согласно настоящему изобретению предлагается стереоселективный процесс глюкозилирования для получения обогащенного бета-аномером нуклеозида формулы: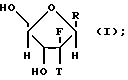
где T выбран из водорода или фтора, и R представляет нуклеозид, выбранный из группы, состоящей из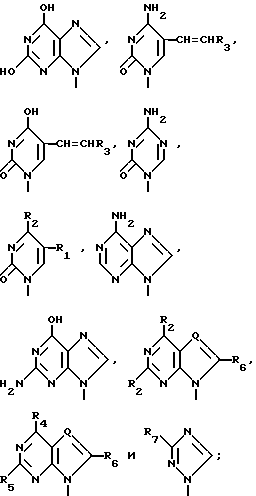
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
R2 выбран из группы, состоящей из гидрокси, галоида, азидо, первичного амино и вторичного амино;
R3 выбран из группы, состоящей из водорода, алкила и галоида;
R4, R5 и R6 независимо выбраны из группы, состоящей из водорода, -OH, -NH2, N (алкила), галоида, алкокси и тиоалкила;
R7 выбран из группы, состоящей из водорода, галоида, циано, алкила, алкокси, алкоксикарбонила, тиоалкила, тиокарбоксамида и карбоксамида;
Q выбран из группы, состоящей из CH, CR8 и N;
где R8 выбран из группы, состоящей из галоида, карбоксамида, тиокарбоксамида, алкоксикарбонила и нитрила, включающий SA2 нуклеофильное замещение сульфонилокси группы (Y) обогащенного альфа-аномером карбогидрата формулы: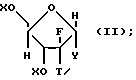
где X независимо выбран из гидроксизащитных групп, и
T имеет значения, определенные выше; по крайней мере молярным эквивалентом нуклеооснования (R''), выбранного из группы, состоящей из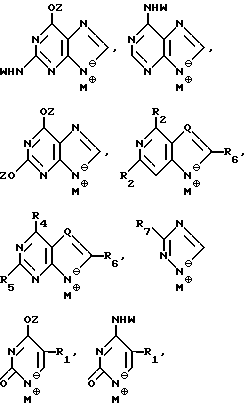
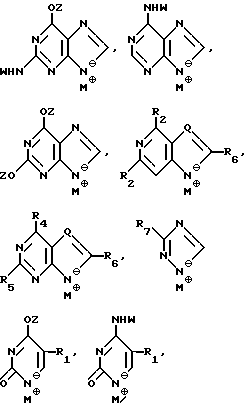
где R1-R7 и Q имеют значения, определенные выше;
Z представляет гидроксизащитную группу (т.е. группу, защищающую гидроксигруппу);
W представляет аминозащитную группу; и
M⊕ представляет катион;
деблокирование с образованием соединения формулы (I).
На протяжении данного описания все температуры представлены в градусах Цельсия, все пропорции, процентные содержания и аналогичные выражены в весовых единицах, а все смеси - в объемных единицах, если же указано иное. Аномерные смеси выражены в виде соотношения вес/вес или в процентах.
Термин "лактол" один или в сочетании с другими относится к 2-дезокси-2,2-дифтор-D-рибофуранозе или 2-дезокси-2-фтор-D-рибофуранозе. Термин "ксилолы" сам по себе или в сочетании относится ко всем изомерам ксилола и их смесям. Термин "карбогидрат" один или в сочетании относится к активированному лактолу, в котором гидроксигруппа в C-1 положении замещена желаемой удаляемой или уходящей группой. Термин "галоид" сам по себе или в сочетании относится к хлору, иоду, фтору или брому. Термин "алкил" сам по себе в сочетании относится к алифатическим углеводородным группам с прямой, циклической и разветвленной цепью, которые содержат от 1 до 7 атомов углерода, и предпочтительно, содержат до 4 атомов углерода, таким как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил, н-гексил, 3-метилцентил, и аналогичные группы, или к замещенным алифатическим углеводородным группам с прямой, циклической или разветвленной цепью, таким как хлорэтил, 1,2-дихлорэтил и аналогично. Термин "алкокси" один или в сочетании относится к соединениям общей формулы АО; где A представляет алкил. Термин "арил" один или в сочетании относится к карбоциклическим или гетероциклическим группам, таким как фенил, нафтил, тиенил и их замещенные производные. Термин "тиоалкил" один или в сочетании относится к общей формуле BS: где B представляет алкил или водород. Термин "сложный эфир" один или в сочетании относится к общей формуле EOOC, где E представляет алкил или арил. Термин "ароматический" один или в сочетании относится к бензольно/подобным структурам, содержащим (4n+2) делокализованных π электронов. Термины "сульфонат" или "сульфонилокси" сами по себе или в сочетании относится к соединениям общей формулы BSO3, где B представляет алкил, замещенный алкил, арил или замещенный арил. Термин "замещенный" один или в сочетании относится к замещению одной или большим числом групп, выбранных из циано, галоида, карбоалкокси, толуоила, нитро, алкокси, алкила и диалкиламино. Фраза "обогащенный аномером" одна или в сочетании относится к аномерной смеси, в которой соотношение конкретных аномеров составляет выше чем 1:1 и включает по существу чистый аномер. Термин "концентрированный" один или в сочетании относится к раствору, в котором весовое содержание карбогидрата, растворенного в растворителе, составляет выше чем 20% по весу на единицу объема растворителя. Например, растворение 100 грамм карбогидрата в 200 миллилитрах растворителя даст 50-процентный раствор карбогидрата. Термин "сопряженный анион" относится к аниону общей формулы BSO3-, где B имеет значения, определенные выше. Термин "аномеризация" один или в сочетании относится к эпимеризации в C-1 положении рибофуранолильного производного.
В соответствии с настоящим процессом гликозилирования обогащенные бета-аномером 2'-дезокси-2', 2'-дифторнуклеозиды и 2'-дезокси-2'-фторнуклеозиды формулы (I) получаются с помощью взаимодействия обогащенного альфа-аномером карбогидрата формулы (II) с по крайней мере молярным эквивалентом нуклеооснования (R'') и деблокирования получающегося в результате нуклеозида, как показано ниже
где Y, X, T, R'' и R имеют значения, определенные выше.
Считывается, что реакция гликозилирования протекает через SN2 замещенные (вытеснение). Следовательно, обогащенные бета-аномером нуклеозидные продукты настоящего изобретения получаются стереоселективно в результате реакции нуклеооснования c обогащенным альфа-аномером карбогидратом.
Лактольные исходные материалы, подходящие для использования при получении обогащенного альфа-аномерном карбогидрата формулы (II), используемого в настоящем процессе гликозилирования, являются известными и свободно синтезируются с помощью стандартных процедур, обычно применяемых специалистами в данной области техники.
Например, в патенте США 4562988, упомянутом здесь для сведения, раскрывается синтез 2,2-дифтор-2-дезокси-D-рибофуранозных промежуточных соединений формулы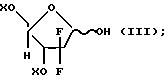
где X представляет гидроксизащитную группу.
Кроме того, авторы Reichman и др. , Cornohydr. Res., 42, 233 (1975) раскрывают синтез 2-дезокси-2-фтор-D-гибофураноз формулы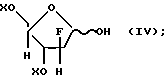
где X представляет гидроксизащитную группу.
В предпочтительном воплощении настоящего процесса применяется обогащенное альфа-аномером 2,2-дифтор-2-дезокси-D-рибофуранозо-3,5-дибензоатное промежуточное соединение формулы (III).
Ключевой основной настоящего изобретения является обнаружение того, что новое обогащенное альфа-аномером карбогидратное промежуточное соединение формулы (III) или (IV) может вводиться в реакцию в условиях нуклеофильного замещения, которые благоприятствуют инверсии (т.к. SN2), давая обогащенные бета-аномером нуклеозиды формулы (I).
Для достижения эффективной реакции между нуклеооснованием и обогащенным альфа-аномером карбогидроматом формулы (II) к лактолу должна быть присоединена стереоселективно соответствующая удаляемая группа (V) для активации лактола и генерирования обогащенного альфа-аномером карбогидрата формулы (II). Однако конкретная выбранная удаляемая группа зависит от выбранного нуклеооснования и выбранных условий реакции гликозилирования.
Получение обогащенного альфа-аномером карбогидратного промежуточного соединения формулы (II) предпочтительно осуществляется по методике, описанной в двух находящихся совместно на рассмотрении заявках США 07/902301 и 07/902305.
В заявке N 07/902301 описывается стереоселективный процесс получения обогащенного α- аномером промежуточного соединения формулы (II), где T представляет фтор, с помощью взаимодействия лактола формулы (III) с аминовым основанием, имеющим показатель рКа от 8 до 20, в низкозамерзающем инертном растворителе; доведения температуры реакционной смеси до примерно -40 ... -120oC; и добавления сульфонирующего реагента.
Аминовое основание предпочтительно выбирается из группы, состоящей из триэтиламина, трибутиламина, дибутиламина, диэтилметиламина, диметилэтиламина, бензилметиламина, N - метилморфолина, трипропиламина, дипропилэтиламина, N, N - диметилбензиламина, диизорпропилэтиламина, диэтиламина, 1,8 - диазабицикло (5.4.0) ундец-7-ена, и 1,5-диазабицикло-(4.3.0)нон-5-ена. Количество основания, предпочтительно применяемое, изменяется в пределах примерно от 1 молярного эквивалента до 2 молярных эквивалентов и более, предпочтительно примерно от 1.2 молярного эквивалента до 1.5 молярных эквивалентов.
Реакция осуществляется в инертном растворителе имеющем точку замерзания предпочтительно ниже -78oC. Предпочтительно растворители выбираются из группы, состоящей из дихлорметана, 1,2-дихлорэтана, дихорфторметана, ацетона, толуола, анизола, хлорбензола, и их смесей.
Температура смеси растворителей составляет предпочтительно примерно ниже -78oC. Например, соединение формулы III, в которой X представляет бензоил, добавлялось к дихлорметану и триэтиламину при комнатной температуре в течение 30 минут. Затем температура реакции понижалась. Данные 19F ЯМР снимались при различных температурах и показали, что по мере того как температура понижалась, происходило увеличение α:β аномерного отношения ионизированного лактола:
Температура - Соотношение альфа/бета
19oC - 2.0:1
-3oC - 2.3:1
-23oC - 2.5:1
-43oC - 3.0:1
-63oC - 3.6:1
-83oC - 3.4:1
Ионизированный лактол затем захватывается в растворе при более низкой температуре и более высоком отношении альфа-аномера добавлением сульфонирующего (сульфирующего) агента, образуя обогащенный α- аномером карбогидрат формулы (II).
Таким образом, с помощью соответствующего подбора температуры можно варьировать соотношение α к β карбогидратного промежуточного исходного материала.
Удаляемая группа (Y) присоединяется в лактолу с помощью сульфирования. Сульфирующие реагенты предпочтительно выбираются из группы, состоящей из замещенных и незамещенных сульфирующих алкилгалогенидов, замещенных и незамещенных арил-сульфирующих галогенидов и ангидридов алкилсульфокислот и ангидридов арилсульфокислот, таких как метансульфонилгалогенид, этансульфониогалогенид, 2-хлор-1-этансульфонилгалогенид, п-нитробензолсульфонилгалогенид, 2,4-динитробензолсульфонилгалогенид, бромбензолсульфонилгалогенид, дибромбензолсульфонилгалогенид, ангидрид бензолсульфокислоты, ангидрид п-бромбензолсульфокислоты и ангидрид метансульфокислоты, и замещенных и незамещенных фторалкил- и фторарил сульфирующих галогенидов и ангидридов фторалкил- и фторарил-сульфокислот, таких как трифторметансульфонилангидрид, трифторметансульфонилгалогенид, 1,1,1-трифторэтансульфонилгалогенид, 1,1,1-трифторэтансульфонил ангидрид, галоидангидрид октафторзамещенной кислоты, ангидрид октафторзамещенной кислоты, галоидангидрид и ангидрид нонафторзамещенной кислоты, в зависимости от желаемой удаляемой группы; более предпочтительным является метансульфонилгалогенид. Обогащенные α- аномером карбогидратные промежуточные продукты, полученные из ионизированных лактолов, особенно карбогидраты, содержащие трифторметансульфонилокси, являются нестабильными при комнатной температуре и поэтому предпочтительно подвергаются реакции с нуклеооснованием на месте.
Вследствие реакционноспособности сульфирующих реагентов может быть также желательным осуществлять реакцию гликозилирования периодическим или непрерывным способом для операций в крупном масштабе.
Обогащенные α- аномером промежуточные соединения формулы (II), в которой T представляет водород, могут получаться аналогичным образом, за исключением того, что в качестве исходного материала используется лактол формулы (IV).
В заявке США 07/902305 описывается еще один стереоселективный процесс получения обогащенных α- аномером промежуточных соединений формулы (II), где T представляет фтор, с помощью обработки бета-аномера рибофуранозилсульфоната формулы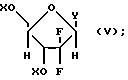
где Y представляет сульфонат и каждый X независимо выбран из гидроксизащитных групп, источником сопряженного аниона сульфокислоты, при повышенных температурах, в инертном растворителе.
Сопряженный анион сульфокислоты может получаться с помощью ряда приемов, известных специалистам в данной области. Они включают:
(a) нейтрализацию алкил- или арилсульфокислоты, такой как 1-метансульфокислота, п-метилбензолсульфокислота, этансульфокислота, п-толуолсульфокислота, бензолсульфокислота, п-бромбензолсульфокислота и камфорсульфокислота, щелочнометаллическим основанием, таким как гидроокись натрия, гидрид натрия, гидроокись калия, трет-бутилат калия, метилат натрия и аналогичные;
(b) нейтрализацию алкил или арил-сульфокислот аминовым основанием, таким как триэтиламин, триметиламин, N,N-диметилбензиламин или N-метилморфолин, или ароматическим азотным основанием, таким как пиридин.
Примеры сопряженных анионов сульфокислот, получаемых с помощью данного метода, включают триэтиламмоний-метансульфонат, метансульфонат триметиламмония, метансульфонат N, N-диметилбензиламмония, пиридинийметансульфонат, триэтиламмоний (п-бромбензол)сульфонат, тетраэтиламмоний (п-бромбензол)сульфонат, тетраэтиламмоний (п-толуол)сульфонат, пиридиний(п-толуол)сульфонат и пиридиий-3-нитробензолсульфонат; более предпочтительным является метансульфонат триэтиламмония; и наконец
(c) сопряженный анион сульфокислоты может получаться на месте по реакции 2-дезокси-2,2-дифтор-D-рибофуранозы с сульфоновым ангидридом, таким как бензолсульфоновый ангидрид, п-бромбензолсульфоновый ангидрид или метансульфоангидрид, ва основании, таком как триэтиламин. Продукты реакции представляют собой, например, 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-ди-O-бензил-1-метансульфонат и триэтиламмонийметансульфонат.
Бета-аномерный рибофуранозилсульфонат и сопряженный анион сульфокислоты нагреваются при температуре примерно от 50 до 130oC и более, предпочтительно до температуры дефлегмации смеси растворителей.
Растворители, подходящие для использования в процессе аномеризации должны быть инертными по отношению к условиям реакции; предпочтительными являются ацетонитрил, 1,2- дихлорэтен, 1,1,2-трихлорэтан, хлорбензол, бромбензол, дихлорбромметан, анизол, глим, диглим, метил трет-бутиловый эфир, тетрагидрофуран, диоксан, этилацетат, толуол, ксилолы, пиридин, N-метилпирролидиноно, N,N-диметилформамид, 1,3-диметил-2-имидазолидинон, N,N-диметилацетамид, и их смеси; наиболее предпочтительными являются анизол, толуол, глим, ацетонитрил и их смеси.
Для увеличения растворимости и нуклеофильности металлический солей, используемых в качестве источника сопряженного аниона сульфокислоты может добавляться катализатор, выбранный из кроун-эфиров или катализаторов переноса фаз; предпочтительные катализаторы выбираются из 18-Кроун-6, 15-Кроун-5, 12-Кроун-4 и трис[2-(2-метоксиэтокси)-этил]амина.
Данный процесс осуществляется в атмосферных условиях и предпочтительно безводных и по существу завершается за период примерно от 15 минут до 24 часов. Получающиеся в результате обогащенные α- аномером карбогидраты формулы (II) получаются с аномерным отношением примерно от 2.3:1 до 3.0:1 альфа к бета.
Обогащенные α- аномером промежуточные соединения формулы (II), где T представляет водород, могут получаться аналогичным образом, за исключением того, что в качестве исходного материала используется лактол формулы (IV).
Реакции гликозилирования обычно требуют защиты гидроксигрупп лактола перед их использованием для того, чтобы воспрепятствовать реакции их гидроксигрупп с нуклеооснованием, или разложению каким-либо образом. Гидроксизащитными группами (X), подходящими для использования в настоящем процессе гликозилирования являются группы, независимо выбранные из известных защитных групп, используемых в синтетической органической химии. Каждая выбранная гидроксизащитная группа предпочтительно способна эффективно вводиться в лактол и легко удаляется из него после того, как реакция гликозилирования завершается. Гидроксизащитные группы, известные в технике, описываются в Главе 3 работы Protective Groups in Organic Chemistry, Mc Omie изд. Пленум Пресс; Нью-Йорк (1973) и Главе 2 работы Protective Groups in Organic Synthesis, Green, John, J.Wiley and Sons, Нью-Йорк (1981); предпочтительными являются сложный эфирообразующие группы, такие как формил, ацетил, замещенный ацетил, пропионил, бутинил, пиваламидо, 2-хлорацетил, бензоил, замещенный бензоил, феноксикарбонил, метоксиацетил; карбонатные производные, такие как феноксикарбонил, этоксикарбонил, трет-бутоксикарбонил, винилоксикарбонил, 2,2,2-трихлорэтоксикарбонил и бензилоксикарбонил; алкильные простой эфиробразующие группы, такие как бензил, дифенилметил, трифенилметил, трет-бутил, метоксиметил, тетрагидропиранил, аллил, тетрагидротиенил, 2-метоксиэтилоксиметил; и силильные простой эфирообразующие группы, такие как триалкилсилил, триметилсилил, изопропилдиалкилсилил, алкилдиизопропилоилил, триизопропилсилил, трет-бутилдиалкилсилил и 1,1,3,3-тетраизопропилдисилоксанил; карбаматы, такие как N-фенилкарбамат и N-имидазоил-карбамат; однако более предпочтительными являются бензоил, монозамещенный бензоил и дизамещенный бензоил, ацетил, пивалоил, трифенилметиловые эфиры, и силильные простой эфиробразующие группы, особенно, трет-бутилметилсилил; причем наиболее предпочтительной является бензоил.
При присоединении гидроксизащитных групп к лактолу применяются обычные условия реакции и зависят от характера выбранной конкретно гидроксизащитной группы. Типичные реакционный условия описаны в патенте США 4526988.
В соответствии с настоящим процессом применяется по крайней мере эквимолярное количество нуклеооснования (R'') относительно количества применяемого карбогидрата. Однако более предпочтительно использовать избыток нуклеооснования в пределах примерно от 1 молярного эквивалента до 30 молярных эквивалентов; более предпочтительно примерно от 10 молярных эквивалентов до 20 молярных эквивалентов и наиболее предпочтительно примерно от 15 до 20 молярных эквивалентов.
Применяемые здесь нуклеооснования (R'') обычно известны химикам-органикам и нет необходимости в обсуждении их синтеза. Однако для того, чтобы быть полезными в настоящем процессе гликозилирования, нуклеооснования или их таутомерные эквиваленты, которые несут амино или гидрокси группы, должны предпочтительно содержать защитные группы, такие как первичные аминозащитные группы (W) и/или гидроксизащитные группы (Z), в зависимости от характера нуклеооснования. Защищающие группы препятствуют гидрокси или аминогруппам давать возможность конкурентных реакционных участков для обогащенного α- аномером карбогидрата. Защитные группы присоединяются к нуклеооснованию (R") перед тем, как оно подвергается реакции с обогащенными альфа-аномером карбогидратом формулы II, и после этого они удаляются. Процедура присоединения защитных групп к нуклеооснованиям описывается в патенте США 4526988.
Предпочтительные аминозащитные группы (W) для пиримидиновых нуклеооснований выбираются из группы, состоящей из силильных образующих простой эфир групп, таких как триалкилсилил, трет-бутилдиалкилсилил и трет-бутилдиарилсилил; карбаматов, таких как трет-бутоксикарбонил, бензилоксикарбонил, 4-метоксибензилоксикарбонил и 4-нитробензилоксикарбонил; формила, ацетила, бензоила и пиваламидо; образующих простой эфир групп, таких как метокси-метил; трет-бутил, бензил, аллил и тетрагидропиранил; более предпочтительной группой является триметилсилил. Предпочтительные аминозащитные группы (W) для пуриновых нуклеооснований выбираются из группы, состоящей из алкилкарбоксамидов, галоидалкилкарбоксамидов и арилкарбоксамидов, таких как 2-триалкилсилилэтоксиметил, 4-метоксибензил, 3,4-диметоксибензил, трет-бутил, фталамидо, тетрагидропиранил, тетрагидрофуранил, метоксиметиловый эфир, метокситиометил, тритил, пиваламидо, трет-бутилдиметилсилил, трет-гексилдиметилсилил, триизопропилсилил, трихлорэтоксикарбонил, трифторацетил, нафтоил, формил, ацетил; сульфонамидов, таких как сульфонамидо и арилсульфонамидо, и более предпочтительной является пиваламидо. Помимо того, что она служит в качестве группы, защищающей аминогруппу, пиваламидозащитная группа увеличивает растворимость заведомо нерастворимых производных пуриновых нуклеооснований и направляет реакцию N-гликозидного сочетания пуриновых оснований в сторону 9 региоизомера, в противоположность 7 региоизомеру.
Предпочтительные гидроксизащитные группы (Z) для пиримидиновых нуклеооснований выбираются из силильных образующих простой эфир групп, таких как триалкилсилил; карбаматов, каких как трет-бутоксикарбонил, бензилоксикарбонил, 4-метоксибензилоксикарбонил и 4-нитробензилоксикарбонил; карбоциклических сложных эфиров, таких как формил, ацетил и пиваламидо; предпочтительной является триметилсилил. Предпочтительные гидроксизащитные группы (Z) для пуриновых нуклеооснований выбираются из группы, состоящей из образующих простой эфир групп, таких как бензил, трет-бутил, тритил, тетрагидропиранил, тетрагидрофуранил, метоксиметил, тритил; сложных эфиров, таких как формил, ацетилпропионил, пиваламидо, бензоил, замещенный бензоил; карбонатов, таких как карбобензокси, трет-бутоксикарбонил, карбэтокси, винилоксикарбонил; карбаматов, таких как N, N-диалкилкарбоамоил; триалкилсилиловых эфиров, таких как трет-бутилтриметилсилил, трет-гексилдиметилсилил, триизопропил-силил; более предпочтительной является пиваламидо.
Давая защитные группы нуклеооснованиям настоящего процесса, данные защитные группы сами по себе могут быть защищены. Например, N-ацетилцитозин может защищаться триметилсилилом, давая бис-триметилсилил-N-ацетилцитозин.
В дополнение к изложенному, часто целесообразно превращать любые кето-кислородные атомы нуклеооснования в энольную форму. Это делает нуклеооснование более ароматическим и усиливает реакционноспособность нуклеооснования по отношению к обогащенному альфа-аномером карбогидрату формулы (II). Наиболее удобно анализировать кето-кислородные атомы и обеспечивать их силильными защитными группами.
Хотя и несущественно, целесообразно, чтобы реакция между обогащенным α-/ аномером карбогидратом формулы (II) и нуклеооснованием осуществлялась в сухой атмосфере, например в сухом воздухе, азоте или аргоне. Это объясняется тем, что некоторые производные нуклеооснований, такие как силилированные производные нуклеооснований являются чувствительными к влаге.
Любые растворители, используемые для получения нуклеооснования, могут перед реакцией гликозилирования удаляться или смешиваться с реакционным растворителем при условии, что данная смесь является инертной по отношению к реакции гликозилирования.
В случае, когда реакция гликозилирования осуществляется в реакционном растворителе, растворитель должен быть инертным по отношению к реакции гликозилирования.
Однако, как упоминалось ранее, конкретный применяемый растворитель для реакции будет зависеть от условий реакции гликозилирования (например, температуры реакции, растворителя), удаляемой группы и применяемого нуклеооснования.
Реакция гликозилирования может осуществляться при температуре в пределах примерно от 170oC до -120oC в атмосферных условиях и обычно в основном завершается примерно через 5 минут - 20 часов.
За ходом настоящего процесса можно следить с помощью процедур, хорошо известных специалистам в данной области техники, таких как жидкостная хроматография высокого давления (HPLC) или тонкослойная хроматография, которые могут использоваться для обнаружения образования нуклеозидного продукта.
Когда реакция проводится в растворе, предпочитается, чтобы использовался высококипящий инертный растворитель и раствор, имеющий концентрацию карбогидрата по крайней мере 20 процентов карбогидрата. Предпочитается концентрация карбогидрата примерно от 20 до 70%; и наиболее предпочтительно примерно от 30 до 50%. Подходящий интервал реакционных температур составляет примерно от 70 до 170oC.
Высококипящий растворитель имеет предпочтительно точку кипения выше примерно 70oC и выбирается из группы, состоящей из ненуклеофильных, ароматических, галоидалкильных, алкокси- и галоидзамещенных ароматических растворителей, и их смесей. Предпочтительными растворителями являются 1,2-дихлорэтан, 1,1,2-трихлорэтан, глим, диглим, толуол, ксилолы, анизол, дихлорбромметан, хлорбензол, дибромхлорметан, трибромметан, дибромметан, ацетонитрил, пропионитрил, диоксан и их смеси; причем более предпочтительным является анизол.
Обогащенный альфа-аномером карбогидрат формулы (II), используемый с высококипящим растворителем, содержит сульфонилоксигруппу, выбранную из алкилсульфонилокси, арилсульфонилокси, замещенных алкилсульфонилокси и замещенных арилсульфонилоксигрупп, такую как метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси.
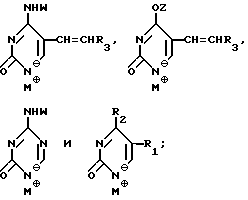
Нуклеооснование (R''), предпочитаемое для использования с высококипящими растворителями, представляет собой соединение, выбранное из группы, состоящей из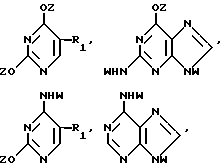
где R1, R3, Z и N имеют значения, определенные выше.
Когда обогащенный α- аномером карбогидрат формулы (II) содержит фторсульфонилоксигруппу, он является нестабильным при температурах выше комнатной температуры. Поэтому реакции гликозилирования с применением этих сульфонилоксигрупп должны осуществляться при температуре, равной или ниже комнатной температуры. Когда реакция гликозилирования проходит в этих условиях, растворитель должен быть низкозамерзающим. Предпочтительный интервал температур для реакции составляет от 25 до -120oC. В этом случае предпочтительные растворители выбираются из группы, состоящей из дихлорметана, 1,2-дихлорэтана, дихлорфторметана, ацетона, толуола, анизола, хлорбензола, и их смесей; более предпочтительным является дихлорметан. Однако оптимальная температура реакции гликозилирования, проводимой при низких температурах, зависит от удаляемой группы (V).
Например, когда удаляемой группой является трифторметансульфонилокси, предпочтительный интервал температуры реакции составляет примерно от -50 до 25oC; причем более предпочтительной является температура примерно от -20 до 25oC. Однако, когда удаляемой группой является 1,1,1-трифторэтансульфонилокси, октафторбутаносульфонилокси или нанофторбутансульфонилокси, предпочтительная температура реакции варьирует примерно от -20 до 25oC и более предпочтительной является температура примерно от 0 до 25oC.
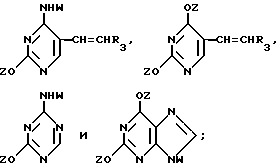
Нуклеооснования (R''), предпочтительные для использования в условиях низких температур, являются соединениями, выбранными из группы, состоящей из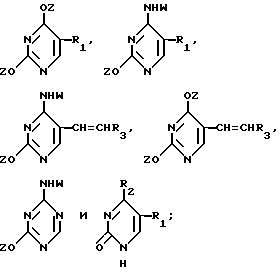
где R1, R2, R3, Z и W имеют значения, определенные выше.
Нуклеооснование (R'') может необязательно превращаться в соль катиона металла для усиления его нуклеофильной реакционноспособности с обогащенным α-/ аномером карбогидратом формулы (II) (т.е. анионное гликозилирование). Эти катионные соли нуклеооснований приготавливаются с помощью добавления к нуклеооснованию в растворителе основания.
Основание может выбираться из группы, состоящей из трет-бутилата натрия, гидрида натрия, метилата натрия, этилата натрия, гидрида лития, гидрида калия, гидроокиси калия, метилата калия, этилата калия и т-бутилата калия. Альтернативно, основание может выбираться из триалкиламина или тетраалкиламмония. Подходящие инертные растворители для реакции могут выбираться из группы, состоящей из ацетонитрила, диметилформамида, диметилацетамида, 1,3-диметил-2-имидазолидинона, тетрагидрофурана, сульфолана, N-метилпирролидинона, диметилсульфоксида и их смесей. Растворитель может удаляться перед реакцией гликозилирования или смешиваться с растворителем для реакции гликозилирования при условии, что смесь является по существу инертной по отношению к реакции гликозилирования. Подходящие температуры реакции варьируют примерно от 23oC до 130oC.
Нуклеооснование (R'') предпочтительно выбирается из группы, состоящей из следующих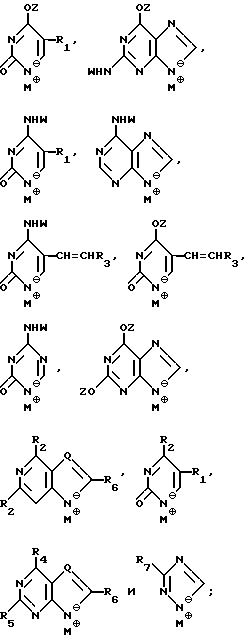
где R1 - R7, Q, Z, W и M+ имеют значения, определенные выше.
Обогащенный альфа-аномером карбогидрат формулы (II) в этих условиях содержит сульфонилокси группу, выбранную из алксилсульфонилокси, арисульфонилокси, замещенный алкил - сульфонилокси, замещенной арилсульфонилокси, фтор-алкилсульфонилокси и фтор-арилсульфонилокси, такую как трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, откафторбутансульфонилокси, нанофторбутансульфонилокси, метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, n-нитробензолсульфонилокси и п-бромбензолсульфонилокси.
Как отмечалось ранее, фтор-сульфонилокси группы формулы (II) имеют тенденцию быть нестабильными при более высоких температурах, и указанная выше реакция с солью нуклеооснования с катионом металла должна проводиться с использованием низкозамерзающего инертного растворителя с такими группами. Предпочтительные температуры для реакции варьируют примерно от 25 до -120oC.
Реакция гликозилирования может также проводиться в отсутствие растворителя (т. е. гликозилирование в расплаве). Очевидно, применяемая температура должна быть достаточной для превращения обогащенного α- аномером карбогидратного промежуточного соединения формулы (II) и нуклеооснования в фазу расплава. Предпочтительные температуры реакции варьируют примерно от 100 до 160oC; однако более предпочтительной является температура примерно от 110 до 160oC; и наиболее предпочтительной является температура примерно от 130 до 150oC.
Обогащенный α-/ аномером карбогидрат формулы (II) в условиях конденсации содержит сульфонилокси группу, выбранную из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси и замещенной арилсульфонилокси, такую как метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензол - сульфонилокси.
Нуклеооснование (R''), подходящее для использования в условиях сплавления, предпочтительно выбирается из группы, состоящей из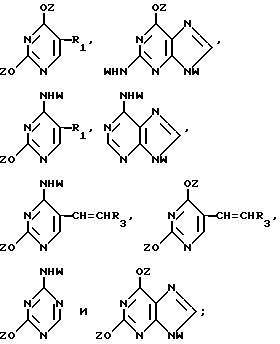
где R1, R3, Z и W имеют значения, определенные выше.
Настоящий процесс может также промотироваться катализатором. Когда применяется катализатор, он существенно снижает количество требуемого нуклеооснования, увеличивает стереоселективность, снижает стоимость переработки, увеличивает производительность, упрощает выделение продукта и уменьшает необходимую температуру реакции, давая возможность использовать менее термостойкие карбогидраты. Поэтому в настоящем процессе желательно применяется катализатор, которым является соль, содержащая нунеклеофильный анион. Предпочтительными являются соли металлов группы IA, IIA или четвертичные аммониевые соли. Катализатор должен быть растворимым в реакционном растворителе и высокоионизированным.
Предпочтительными являются солевые катализаторы, выбранные из группы, состоящей из калиевой, бариевой, цезиевой и триалкиламмониевой солей трифторметансульфокислоты, нанофторбутаносульфокислоты, серной кислоты, хлорной, азотной и трифторуксусной кислоты; более предпочтительными являются калиевая или цезиевая соли трифторметансульфокислоты. Подходящая температура реакции находится в интервале примерно от 50 до 100oC.
Растворитель предпочтительно выбирается из полярных ненуклеофильных растворителей, таких как глим, диглим, анизол, ацетонитрил, пропионитрил, диоксан и их смеси; при этом более предпочтительным является ацетонитрил.
Обогащенный α- аномером карбогидрат формулы (II) в каталитических условиях предпочтительно содержит сульфонилоксигруппу, выбранную из алкилсульфонилокси- и арилсульфонилоксигрупп, такую как метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси.
Нуклеооснование (R'') для использования в каталитических условиях, предпочтительно выбирается из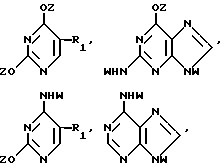
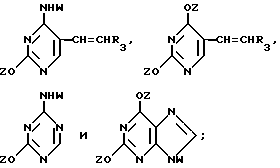
где R1, R2, R3, Z и W имеют значения, определенные выше.
Конечной фазой реакционной последовательности является удаление защитных групп X, Z и/или W (т.е. деблокирование) из блокированного нуклеозида формулы (I). После удаления защитных групп получается то же самое аномерное соотношение нуклеозидов.
Большинство силил- и силиламинозащитных групп легко отщепляется с помощью использования протонного растворителя, такого как вода или спирт. Ацильные защитные группы, такие как бензоил и ациламинозащитные группы удаляются с помощью гидролиза сильным основанием при температуре примерно от 0 до 100oC.
Сильными или умеренно сильными основаниями для использования в данной реакции являются основания, которые имеют рКа (при 25oC) примерно от 8.5 до 20. Такие основания включают гидроокиси щелочных металлов, такие как гидроокись натрия или калия; алкоголяты щелочных металлов, такие как метилат натрия или трет-бутилат калия; амиды щелочных металлов; амины, такие как диэтиламин, глиоксиламин, аммиак и аналогичные; и другие обычные основания, такие как гидразин и аналогичные. Для каждой защитной группы требуется по крайней мере один эквивалент основания.
Ацильные защитные группы могут также удаляться с помощью кислотных катализаторов, таких как метансульфокислота, соляная, бромистоводородная, серная кислоты или с помощью кислотных ионообменных смол. Предпочтительно осуществлять такой гидролиз при относительно высоких температурах, таких как температура дефлегмации смеси, но могут использоваться и такие низкие температуры, как температура окружающей среды, когда применяются особенно сильные кислоты.
Удаление простых эфирных защитных групп осуществляется с помощью известных методов, например, с помощью этантиола и хлористого алюминия.
Трет-бутилдиметилсилильная защитная группа требует кислотных условий, таких как контакт с газообразным галоидоводородом, для ее удаления.
Удаление защитных групп может удобно осуществляться в спиртовых растворителях, особенно водных спиртах, таких как метанол. Однако реакция деблокирования может также осуществляться в любом удобном растворителе, таком как полиолы, включающие этиленгликоль, простые эфиры, такие как тетрагидрофуран, кетоны, такие как ацетон и метилэтилкетон или диметилсульфоксид.
В предпочтительном воплощении реакция деблокирования применяет аммиак для удаления бензоильной защитной группы гидроксигруппы при температуре примерно 10oC. Предпочтительно однако использовать избыток основания в данной реакции, хотя количество избытка основания не является существенным.
В соответствии с настоящим процессом обогащенные бета-аномером нуклеозиды получаются при аномерном соотношении α к β выше, чем от 1:1 до 1:9.
Получающийся в результате обогащенный β- аномером нуклеозид формулы (I) может экстрагироваться и/или выделяться из реакционной смеси, как описано в патенте США 4965374, который включен сюда для сведения.
Следующие примеры иллюстрируют конкретные аспекты настоящего изобретения, но они не предназначены для ограничения его объема в каком-либо отношении, и не должны пониматься как ограничительные.
Пример 1.
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор-3'-, 5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 10 эквивалентами бис-триметилсилилцитозина.
Био-триметилсилилцитозин получался с помощью объединения 2.44 цитозина, 5.15 мл гексаметилдисилазана и 580 мг сульфата аммония с 5 мл ксилолов и нагревания раствора с обратным холодильником при 120oC в течение 1 часа. Добавлялись дополнительно 5 мл гексаметилдисилазана для образования гомогенного раствора, который нагревался с обратным холодильником в течение 30 минут. Ксилолы и избыток гексаметилдисилазана удалялись, и образовывался желатинообразный био-триметилсилилцитозин. 5.6 г бис-триметилсилилцитозина помещалось в 20 мл ксилолов. Ксилолы удалялись, и бис-триметилсилилцитозин снова помещался в 20 мл ксилолов. Бис-триметилсилилцитозин выпаривался досуха и помещался в 5 мл ксилолов. 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метаносульфоната подвергался реакции с бис-триметилсилилцитозиновым раствором при 127oC в течение 3,5 часов.
Анализ жидкостной хроматографии высокой разрешающей способности (HPLC) подтверждал завершение реакции.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 60oC, разбавлялась в 100 мл этилацетата и промывалась 200 мл 1 н. соляной кислоты. Образовывалась эмульсия, и два слоя, которые образовались, разделились. Органический слой промывался последовательно 100 мл 5% бикарбоната натрия и 100 мл насыщенного раствора хлорида натрия, затем сушились над сульфатом магния. Количественный анализ HPLC этилацетатного слоя показал, что выход блокированного бета-аномерного нуклеозида составил 50%.
Аномерное отношение бета к альфа блокированного нуклеозида было 2,2:1.
Пример 2
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3'5'-ди-O- бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 5 эквивалентами бис-триметилсилилцитозина.
К 2.8 г бис-триметилсилилцитозина добавлялось 3 мл ксилолов, и раствор нагревался до 120oC до тех пор, пока бис-триметилсилилцитозин не солюбилизировался. 1 г 2-дезокси-2,2-дифтор-D-рибофуранзил-3,5-дибензоил-1 -α- метан- сульфоната, растворенного в 2 мл ксилолов, нагревался и подвергался реакции с бис-триметилсилилцитозиновым раствором при 130oC в течение 16 часов. Анализ HPLC подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида было 1.1:1.
Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 15 мл этилацетата и промывалась 150 мл 1 н. соляной кислоты. Имела место эмульсия, и два слоя, которые образовались, разделялись. Органический слой промывался последовательно 100 мл воды и 100 мл 5% бикарбоната натрия, затем сушился над сульфатом магния. Для более точного анализа HPLC 1 мл органического слоя выпаривался досуха и помещался в 1 мл ацетонитрила. Количественный анализ HPLC органического слоя в ацетонитриле указал на то, что выход блокированного бета-аномерного нуклеозида составил 36%.
Пример 3
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она в виде хлоргидратной соли в 15 эквивалентами бис-триметилсилилцитозина.
Бис-триметилсилилцитозин приготавливался с помощью объединения 18.33 г цитозина и 10 мл анизола с 64,3 мл N-метил-N-цитозина-(триметилсилил)-трифторацетамида и нагревания раствора при 80oC в течение 30 минут.
5.0 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната, растворенного в 10 мл анизола, подвергались взаимодействию с раствором бис-триметилсилилцитозина при 105oC в течение 5 часов. Аномерное отношение бета к альфа блокированного нуклеозида составляло 5.4:1.
Для выделения нуклеозидного продукта реакционная смесь охлаждалась до 60oC, разбавлялась 75 мл этилацетата и промывалась 200 мл 1 н. соляной кислоты. Образовался полупрозрачный раствор, содержащий твердые частицы. Раствор подогревался до 60 - 70oC в течение 15 минут, фильтровался, и выделенное твердое вещество промывалось последовательно 20 мл этилацетата, затем сушилось в вакуумной печи при 40oC в течение 16 часов. Получающийся в результате нуклеозидный продукт весил 4.0 г, т.пл. 252 - 256oC. Количественный анализ HPLC подтвердил, что продукт представлял хлоргидратную соль блокированного бета-аномерного нуклеозида с выходом 75 процентов.
Пример 4
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 10 эквивалентами бис-триметилсилилцитозина.
Бис-триметилсилилцитозин приготавливался с помощью процедуры, описанной в примере 1, за исключением того, что использовалось 20 г цитозина, 380 мл гексаметилдисилазана, 1,18 г сульфата аммония и 48 мл ксилолов. Бис-триметилсилилцитозин растворялся в 24 мл ксилола. 9.6 г 2-дезокси-2,2-дифтор-D- рибуфуранозин-3,5-дибензоил-1-толуолсульфоната в соотношении альфа к бета 70: 30 растворялось в 24 мл ксилолов и подвергалось реакции с раствором бис-триметилсилилцитозина в течение 1 часа. Анализ HPLC подтверждал завершение реакции.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 65oC и добавлялось 100 мл этилацетата. Раствор выдерживался при 65oC и промывался 200 мл 1 н. соляной кислоты. Получалась эмульсия, и два слоя, которые образовались, разделялись. Органический слой промывался 200 мл 5% бикарбоната натрия, затем сушился над сульфатом магния. Аномерное отношение бета к альфа блокированного нуклеозида составляло 1,1:1. Количественный анализ HPLC указал на то, что выход блокированного бета-аномера нуклеозида составил 27 процентов.
Пример 5.
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами триметилсилилцитозина.
Бис-триметилсилилцитозин приготавливался с помощью смешения 10 г цитозина с 175 мл гексаметилдисилазана и 25 мг сульфата аммония в атмосфере азота и нагревания раствора при 120oC в течение 2 часов. Смесь охлаждалась до 80oC и разбавлялась 100 мл этилацетата. Гексаметилдисилазан и этилацетат впоследствии атмосферно отгонялись при температуре 145oC. Данная процедура повторялась дважды, затем получающийся в результате бис-триметилсилилцитозан добавлялся к 15 мл анизола и охлаждался до 100-115oC.
5.75 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- -метансульфоната, растворенного в 10 мл анизола, перемешивалось при 45oC до тех пор, пока не образовывался гомогенный раствор, и подвергалось реакции с раствором бис-триметилсилилцитозина при 115 - 120oC в течение 7 часов.
Анализ HPLC подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида составило 7,3 : 1.
Для выделения нуклеозидного продукта реакционная смесь охлаждалась до 88oC, разбавлялась 34 мл этилацетата и промывалась 125 мл 4 н. соляной кислоты. Образовалась суспензия, содержащая твердые частицы, перемешивалась в течение 1,5 часа при 80oC и фильтровалась. Фильтрат промывался 50 мл 4 н. соляной кислоты и сушился в вакуумной печи при 45oC. Получающийся в результате нуклеозидный продукт весил 4,6 кг. Количественный анализ HPLC показал, что выход блокированного бета-аномера нуклеозида составил 79,5 процентов.
Пример 6.
Получение обогащенной бета-аномером хлоргидратной соли 1-/2'-дезокси-2', 2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил/ -4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
Бис-триметилсилилцитозин приготавливался с помощью процедуры, описанной в примере 5. Раствор охлаждался до 100oC.
5,75 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната, растворенного в 10 мл анизола, перемешивалось при 45oC до тех пор, пока не образовывался гомогенный раствор, и подвергалось взаимодействию с бис-триметилсилилцитозиновым раствором при 110 - 115oC в течение 16 часов. Анализ HPLC подтвердил, что оставалось только 3,9% непрореагировавшего 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната. Аномерное отношение бета к альфа блокированного нуклеозида составляло 7,2 : 1.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась и разбавлялась 69 мл этилацетата при 65oC. Реакционная смесь затем объединялась с 185 мл 4 н. соляной кислоты. Смесь нагревалась с обратным холодильником в течение 1 часа при 78oC для образования суспензии. Суспензия фильтровалась, и твердое вещество промывалось 60 мл 4 н. соляной кислоты и сушилось в вакуумной печи при 45oC. Нуклеозидный продукт весил 3.62 г. Количественный анализ HPLC подтвердил, что продукт представлял хлоргидратную соль блокированного бета-аномера нуклеозида с выходом 64.2%.
Пример 7.
Получение обогащенного бета-аномером 9-/2'-дезокси-2',2'-дифтор- 3',5-ди-O-бензоил-D-рибофуранозил/-5-аминопурина с 15 эквивалентами бистриметилсилиладенина.
Бис-триметилсилиладенин приготавливался с помощью объединения 7 г аденина и 109 мл гексаметилдисилазана с 250 мг сульфата аммония и нагревания смеси при 100-115oC в течение 8 часов. Раствор нагревался с обратным холодильником в течение дополнительных 30 минут, и избыток гексаметилдисилазана впоследствии удалялся, а 14.5 г бис-триметилсилиладенина растворялось в 3 мл анизола. 1.58 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната подвергалось реакции с раствором бис-триметилсилиладенина при 105-110oC в течение 24 часов.
Анализ HPLC подтвердил завершение реакции.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 30oC, разбавлялась 50 мл этилацетата и промывалась 75-мл 4 н. соляной кислоты. Образовалась эмульсия, и органический слой отделялся и промывался последовательно 75 мл 5% бикарбоната натрия и 75 мл насыщенного раствора хлористого натрия, затем сушился над сульфатом магния.
Аномерное отношение бета к альфа блокированного нуклеозида составило 6: 1.
В табл. 1, приведенной в конце описания, показано, как концентрация карбогидрата и выбранный карбогидрат влияют на аномерное соотношение нуклеозидного продукта.
/N/D/ обозначает не определялся. Карбогидраты (карбо) являются гидрозащищенными и включают ...α- или β- OMS представляет альфа- или бета-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1-метансульфонат; β/ или α- OTs представляет бета- или альфа-2,2-дифтор-2-дез-окси-D-рибофуранозил-3,5-дибензоил-1- толуолсульфонат; и α- или β- -OBs представляет альфа- или бета-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1-бром- бензолсульфонат. 70: 30 α : β- -OTs карбогидраты получались путем аномеризации β- -OTs солью п-толуолсульфокислоты. Выходы даны в расчете на количество карбогидрата и вычислялись в результате количественного анализа HPLC с обратной фазой, где соответствующий пик раствора продукта сравнивался со стандартом, 1-(2'-дезокси- 2', 2'-дифтор-3'-,5'-ди-O-бензоил -β- -D-рибофуранозил)-4-аминопиримидин-2-оном, за исключением в случае (a), который дает выход выделенного продукта. (Ж) Концентрация карбогидрата (Карбо.Конц.) выражена в процентах карбогидрата по весу (граммы) на единицу объема растворителя (миллилитры). Группой, защищающей нуклеооснование, в каждом примере является триметилсилил.
Пример 8.
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентными бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 112 мл гексаметилдисилазана и 100 мг сульфата аммония. Раствор нагревался до 115- 120oC в течение 1.5 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Смесь охлаждалась до 60oC и растворялась в 40 мл 1,2-дихлорметана, образуя гомогенный раствор бис-триметилсилилцитозина.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-N-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.54 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида, в 0.50 мл дихлорметана, образуя обогащенное альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5- дибензоил-1-трифторметансульфонатное промежуточное соединение в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Анализ 19F ядерномагнитного резонанса (ЯМР) обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D- рибофуранозил-3,5-дибензоил-1-трифторметансульфонатного промежуточного соединения при 65oC дал следующие данные:
19F ЯМР (300 МГц, CDCl3), δ -77 (с., 3F, CF3SO2-)-III (д., J=257 Гц, 1F, альфа-аномер), -122 (д., J=242 Гц, 1F, бета-аномер), -124 (д., J=257 Гц, 1F, альфа-аномер), -126 млн.дол., (д., J=242 Гц, 1F, бета-аномер). Следует заметить, что все сдвиги 19F ЯМР пиков даны относительно гексафторбензола, которому предписана частота -162,9 млн.дол. Спектр 19F ЯМР также указал на фтор-протон сочетания, однако характер этих сочетаний не определялся.
Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор- D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при -65oC, и реакционной температуре давали возможность подниматься до 23oC, и образовывался названный в заголовке блокированный нуклеозид, что подтверждалось анализом HRLC. Аномерное отношение бета к альфа блокированного нуклеозида было 1.9:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 100 мл дихлорметана и 200 мл 1 н. соляной кислоты. Органический слой отделялся и промывался 200 мл 5% бикарбоната натрия. Органический слой снова отделялся и промывался 200 мл насыщенного хлористого натрия. Целевой нуклеозидный продукт выпадал в осадок из органического слоя. Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 42 процента. 1H ЯМР (ДМСО); δ = 4.74 (4'H), 4.79 (5'H), 5.84 (5H), 5.88 (3'H), 6.44 (1'H), 7.56 (NH2), 7.68 (6H). 13C ЯМР (ДМСО): δ = 63,46 (5'C), 71.80 (3'C), 75.71 (4'C), 84.64 (1'C), 95.12 (5'C), 121.86 (2'C), 141.93 (6'C), 154.48 (2C), 165.87 (4C).
Пример 9
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)- 4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
Раствор бис-триметилсилилцитозина приготавливался суспендированием 5.78 г цитозина в 75 мл дихлорметана и добавлением 20.57 мл N-метил-N-триметилсилилтрифторацетамида и охлаждением получающегося раствора до -30oC.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.55 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоил-1-трифторметансульфонат в виде раствора подвергался реакции с раствором бис-триметилсилилцитозина при -30oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2.3:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 200 мл 1 н. соляной кислоты. Органический слой отделялся и промывался 5% карбонатом натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 45%.
Пример 10
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-бензоил-D-рибофуранозил)- 4-аминопиримидин-2-она с 20 эквивалентами бис-триметилцитозина.
Раствор бис-триметилсилилцитозина приготавливался с помощью процедуры, описанной в примере 8, и охлаждался до -15oC.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.54 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 0.5 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоил-1-трифторметансульфонатный раствор подвергался реакции с раствором бис-триметилсилилцитозина при -15oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2.3:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси дихлорметан удалялся, и получающийся остаток растворялся в 21 мл анизола, а затем 40 мл воды, а затем нагревался до 90oC. Твердые вещества, которые образовывались, удалялись из раствора. Органический и водный слои отделялись, и органический слой впоследствии промывался дополнительным количеством 10 мл воды. Из органического слоя выпадал в осадок бета-аномерный нуклеозидный продукт. Количественный анализ HPLC обнаружил выход блокированного бета-аномера нуклеозида 58%.
Пример 11
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)- 4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
Раствор бис-триметилсилилцитозина приготавливался путем суспендирования 5.78 г цитозина в 20 мл дихлорметана и добавления 20.57 мл N-метил-N-триметилсилилтрифторацетамида в 10 мл дихлорметана и охлаждения получающегося раствора до 0oC.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.55 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-/дибензоил-1-трифторметансульфонамид в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоил-1-трифторметансульфонат в растворе подвергался реакции с раствором бдис-триметилсилилцитозина при 0oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 2.5:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавляют 250 мл 1 н. соляной кислоты. Органический слой отделялся и промывался 200 мл 5% карбоната натрия. Количественный анализ HPLC органического слоя обнаруживал выход блокированного бета-аномерного нуклеозида 49 процентов.
Пример 12
Получение обогащенного бета-аномером 1(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- ацетамидопиримидин-2-она с 10 эквивалентами бис-триметилсилил-N- ацетилцитозина.
К 4 г N-ацетилцитозина добавлялось 56 мл гексаметилдисилазана и 698 мг сульфата аммония. Данный раствор нагревался до 115-120oC в течение 4 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Смесь охлаждалась до -50oC и растворялась в 50 мл 1,2-дихлорэтана. 1,2-дихлорэтан удалялся и получающийся твердый остаток растворялся снова в 50 мл 1,2-дихлорэтана. 1,2-дихлорэтан снова удалялся, и образовывался маслянистый остаток. Маслянистый остаток брался в 2.5 мл 1,2-дихлорэтана, образуя гомогенный раствор бис-триметилсилил-N-ацетилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 2 мл сухого дихлорметана. Данный раствор охлаждался до -78oC и подвергался реакции с 0.55 мл триэтиламина и 0.58 мл трифторметансульфонил-ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната подвергался реакции с раствором бис-триметилсилил-N-ацетилцитозина при 23oC.
Реакционная смесь перемешивалась при -60oC в течение полутора часов, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 50 мл дихлорметана. Органический слой отделялся и промывался последовательно 50 мл 5% бикарбоната натрия, затем 50 мл 1 н. соляной кислоты и 50 мл насыщенного хлорида натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 15 процентов.
Пример 13
Получение обогащенного бета-аномером 1-(2'- дезокси-2',2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 112 мл гексаметилдисилазана в 50 мг сульфата аммония. Смесь нагревалась до 115-120oC в течение 3 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Данный раствор затем охлаждался до 27oC, и образовывался твердый остаток, который помещался в 35 мл дихлорметана, образуя гомогенный раствор бис-триметилсилилцитозина.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.54 мл триэтиламина. Раствор охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC.
Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 27oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC и указывало на то, что оставалось 11 процентов непрореагировавшего обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната.
Аномерное отношение бета к альфа блокированного нуклеозида было 2.2:1. Количественный анализ HPLC показал выход блокированного бета-аномерного нуклеозида 54%.
Пример 14
Получение обогащенного бета-аномером 1-(2'- дезокси-2',2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Данный раствор нагревался до 115-120oC в течение 2 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающееся в результате масло охлаждалось до 23oC, образуя твердый остаток, который помещался в 35 мл дихлорметана, образуя гомогенный раствор бис-триметилсилилцитозина, и охлаждался до 0oC.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 9 мл дихлорметана и 0.54 мл триэтиламина. Раствор охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC.
Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 23oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2.2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси смесь промывалась дважды 150 мл 1 н. соляной кислоты. Органический слой отделялся, промывался 150 мл 5% бикарбоната натрия и промывался снова 150 мл насыщенного хлористого натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 49 процентов.
Пример 15
Получение обогащенного бета-аномером 1-(2'-дезокси-2','2-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 30 эквивалентами бис-триметилсилилцитозина.
К 5.9 г цитозина добавлялось 112 мл гексаметилдисилазана и 25 мг сульфата аммония. Раствор нагревался до 120-125oC в течение 3 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающееся в результате твердый остаток помещался в 35 мл дихлорметана и охлаждался до 10oC, образуя гомогенный раствор бис-триметилсилилцитозина.
К 655 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 0.55 мл дихлорметана и 0.36 мл триэтиламина. Раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.35 мл трифторметансульфонил-ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC.
Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 10oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2.7:1. Количественный анализ HPLC показал выход блокированного бета-аномерного нуклеозида 60 процентов.
Пример 16
Получение обогащенного бета-аномером 1-(2'-дезокси-2','2-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Раствор нагревался до -115-120oC в течение полутора часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающийся в результате твердый остаток помещался в 40 мл 1,2-дихлорметана при 23oC, образуя гомогенный раствор бис-триметилсилилцитозина.
К 1 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана с 1.2 мл триэтиламина. Раствор охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе.
Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 23oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида составило 2.8: 1. Количественный анализ HPLC показал выход блокированного бета-аномерного нуклеозида 50%.
Пример 17
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Смесь нагревалась до 115-120oC в течение 1.5 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающееся в результате твердый остаток помещался в 40 мл дихлорметана при 23oC, образуя гомогенный раствор бис-триметилсилилцитозина.
К 1 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.54 мл триэтиламина. Раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался взаимодействию с 0.57 мл трифторметансульфонил-ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC.
Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозином в растворе при 23oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида составило 2.5: 1. Количественный анализ HPLC показал выход блокированного бета-аномерного нуклеозида 68 процентов.
Пример 18
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
К 5.78 г цитозина добавлялось 5 мл дихлорметана, 20.6 мл N-метил-N-триметилсилилтрифторацетамида и 5 мл дихлорметана, образуя гомогенный раствор бис-триметилсилилцитозина.
К 1 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 3 мл дихлорметана и 0.55 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 30 минут, охлаждался до -78oC и подвергался реакции с 0.57 мл трифторметансульфонил-ангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил- 1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 25oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составляло 2.5:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 250 мл 1 н. соляной кислоты. Органический слой отделялся и промывался 250 мл 5% карбоната натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 50 процентов.
В табл. 2 (см. в конце описания) показано, каким образом растворитель, число молярных эквивалентов пиримидин-нуклеозидных производных влияют на аномерное отношение и выход нуклеозидного продукта.
Карбогидратом, используемым для получения блокированных нуклеозидов, в таблице был обогащенный альфа-аномером 2-дезокси-2,2- дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат. (N/D) означает не определялся. Данные выхода представлены в расчете на количество карбогидрата и вычислялись по результатам количественного анализа HPLC с обратной фазой, при котором пик соответствующего раствора продукта сравнивался со стандартом. Защитной группой для указанного выше нуклеозидного основания является триметилсилил
Пример 19
Получение обогащенного бета-аномером 1-(2-'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она.
Цитозин (12.0 г), гексаметилдисилазин (60 мл) и сульфат аммония (10 мг) нагревались с обратным холодильником при 125oC в течение 30 минут, образуя гомогенный раствор. Гексаметилдисилазан удалялся с помощью перегонки, образуя бис-триметилсилилцитозин. 2-дезокси-2',2'-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался реакции с бис-триметилсилилцитозином (6.89 г, 10 экв.) в анизоле (2 мл) и ацетонитриле (3 мл) при 80oC в присутствии калиевой соли нанофтор-1-бутансульфоновой кислоты (0.5 г) в течение 16 часов.
Анализ HPLC подтвердил завершение реакции и указывал на выход in situ 33 процента. Аномерное отношение бета к альфа целевого соединения составило 3: 1.
Пример 20
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом калия.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался реакции с бис-триметилсилицитозином (6.89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (2.0 мл) при 80oC в присутствии сульфата калия (0.5 г) в течение 72 часов.
Анализ HPLC подтвердил завершение реакции и показал выход in situ 65 процентов. Аномерное отношение бета к альфа целевого соединения составило 4.7:1.
Пример 21
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с тетрабутиламмониевой солью трифторметансульфокислоты.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (0.29 мл) подвергался реакции с био-триметилсилилцитозином (6.89 г, 10 экв. ), полученным, как описано в примере 19, в ацетонитриле (3.0 мл) при 80oC в присутствии тетрабутиламмониевой соли трифторметансульфокислоты (1.5 ммоля) (полученной in situ с помощью обработки тетрабутиламмонийгидроксида (1.5 мл 1 молярного раствора в метаноле) трифторметансульфокислотой (0.13 мл)), затем перегонки для удаления метанола в течение 4 часов.
Анализ HPLC подтвердил завершение реакции и показал выход in situ 45 процентов. Аномерное отношение бета к альфа целевого соединения было 7.1:1.
Пример 22
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом бария.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался взаимодействию с бис-триметилсилилцитозином (6.89 г, 10 экв. ), полученным, как описано в примере 19, в ацетонитриле (3.0 мл) при 75oC в присутствии сульфата бария (1.0 г) в течение 20.5 часов. Анализ HPLC показал выход in situ 36 процентов, Аномерное отношение бета к альфа целевого соединения было 11.2:1.
Пример 23
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом цезия.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался реакции с бис-триметилсилилцитозином (6.89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (3.0 мл) при 75oC в присутствии сульфата цезия (1.0 г) в течение 21 часа.
Анализ HPLC показал выход in situ 24 процента. Аномерное отношение бета к альфа целевого соединения было 17.9:1.
Пример 24
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с цезиевой солью трифторметансульфоновой кислоты.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался взаимодействию с бис-триметилсилилцитозином (6.89 г, 10 экв. ), полученным, как описано в Примере 19, в ацетонитриле (3.0 мл) при 75oC в присутствии цезиевой соли трифторметансульфоновой кислоты (полученной in situ с помощью обработки 0.13 мл трифторметансульфоновой кислоты избытком карбоната цезия) в течение 20.5 часов.
Анализ HPLC подтвердил завершение реакции и показал выход in situ 65 процентов. Аномерное отношение бета к альфа целевого соединения составило 7.2:1.
Пример 25
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с бариевой солью трифторметансульфоновой кислоты.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался взаимодействию с бис-триметилсилилцитозином (6.89 г, 10 экв. ), полученным, как описано в примере 19, в ацетонитриле (3.0 мл) при 75oC в присутствии бариевой соли трифторметансульфокислоты (полученной in situ с помощью обработки 0.13 мл трифторметансульфокислоты избытком карбоната бария) в течение 20.5 часов.
Анализ HPLC показал выход in situ 25 процентов. Аномерное отношение бета к альфа целевого соединения 14,4:1.
Пример 26
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с калиевой солью трифторметансульфокислоты.
2-деокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (2,3 г, 12,6 экв.) подвергают реакции с бистриметилсилилцитозином (16,1 г), полученным как описано в примере 19, в ацетонитриле (8,0 мл) при 75oC и в присутствии калиевой соли трифторметансульфоновой кислоты (0,26 мл) с карбонатом калия (1,0 г) в течение 45 часов. Анализ HPLC указывает на выход 69,8% in situ. Соотношение бета к альфа изомеров в целевом продукте составляет 7,2:1.
Экстракт нуклеозида, реакционную смесь охлаждают до 70-80o и соединяют с 40 мл 4N соляной кислоты. Количественный HPLC анализ указывает, что выход выделенного продукта составляет около 62,4%
Пример 27
Получение бета-аномера, обогащенного 1-(2-деокси-2,2-дифтор-3,5-O- бензоил-D-рибофуранозил)-4-амино-пиримидин-2-он с калиевой солью трифторметансульфоновой кислоты.
2-деокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (2,3 г) подвергают реакции с бис-триметилсилилцитозином (16,1 г, 12,6 экв.), полученным по примеру 19, в пропионитриле (8 мл) при 90oC и в присутствии калиевой соли трифторметансульфокислоты (полученной in situ путем обработки трифторметансульфокислоты (0.26 мл) карбонатом калия (1.0 г) в течение 21 часа.
Анализ HPLC подтвердил завершение реакции. Аномерное отношение бета к альфа целевого соединения было 6.7:1.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до температуры между 70 и 80oC и объединялась с 40 мл 4 н. соляной кислоты. Продукт выпадал в осадок, фильтровался и сушился. Количественный анализ HPLC показал выход выделенного продукта 59.3%.
Сравнительный пример 28
Получение обогащенного 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O- бензоил-D-рибофуранозил)-4-аминопиримидин-2-она без катализатора.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался реакции с бистриметилсилилцитозином (6.09 г, 10 экв.), полученным, как описано в примере 19, в анизоле (4 мл) при 110oC в течение 20 часов.
Анализ HPLC подтвердил завершение реакции и показал выход in situ 77 процентов. Аномерное отношение бета к альфа целевого соединения было 3.4:1.
Сравнительный пример 39
Получение обогащенного 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O- бензоил-D-рибофуранозил)-4-аминопиримидин-2-она без катализатора.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфонат (1.15 г) подвергался реакции с бистриметилсилилцитозином (6.08 г, 10 экв.), полученным, как описано в примере 19, в пропионитриле (4 мл) при 85oC в присутствии цезиевой соли трифторметансульфокислоты (полученной in situ с помощью обработки трифторметансульфокислоты (0.13 мл) с избытком карбоната цезия) в течение 20 часов.
Анализ HPLC подтвердил завершение реакции и показал выход in situ 70 процентов. Аномерное отношение бета к альфа целевого продукта составило 6.7: 1.
Пример 30
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)] -2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина.
К 100 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 1 мл дихлорметана и 0.036 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.045 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D- рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе.
185 мг суспензии 2,6-дипиваламидоаминопурина приготавливалось в 1.5 мл ацетонитрила и поддерживалось безводной в атмосфере азона. К суспензии добавлялось 65 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 2,6-дипиваламидоаминопурина. Соль охлаждалась до 0oC и подвергалась реакции с обогащенным альфа-аномером раствором 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал объединенный выход блокированного бета- и альфа-аномера нуклеозида 42 процента.
Пример 31
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)] -2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 0.55 мл триэтиламина и 8.33 мл дихлорметана при 23oC. Смесь охлаждалась до -78oC и подвергалась реакции с 0.53 мл трифторметансульфонового ангидрида в 0.50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-дибензоат-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65oC.
1.85 г суспензии 2,6-дипиваламидоаминопурина приготавливалось в 30 мл ацетонитрила и содержалось безводной в атмосфере азота. К данной суспензии добавлялось 651 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23oC в течение 15 минут, образуя калиевую соль 2,6-дипиваламидоаминопурина. Суспензия соли добавлялась к 20 мл сухого дихлорметана, охлаждалась до 0oC и подвергалась реакции с обогащенным альфа-аномером раствором 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоат-1- трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 23oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 50 мл этилацетата и 50 мл 1 н. соляной кислоты. Органический слой отделялся и промывался 50 мл 5% бикарбоната натрия. Органический слой отделялся и промывался 50 мл насыщенного водного хлористого натрия и сушился над сульфатом магния.
Пример 32
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2,2-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)] -6-хлорпурина с 2 эквивалентами калиевой соли 6-хлорпурина.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D- рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе.
155 мг суспензии 6-хлорпурина приготавливалось в 3 мл ацетонитрила и поддерживалось безводной в атмосфере азота. К суспензии добавлялось 130 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 6-хлорпурина. Суспензия соли охлаждалась до 0oC и подвергалась реакции с 2 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагированного нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия и 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 27%.
Пример 33
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)]-2,6-дихлор-3-деазапурина с 2 эквивалентами калиевой соли 2,6-дихлор-3-деазапурина.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D- рибофуранозил-3,5-дибензоил-2,2-трифторметансульфонат в растворе.
82 мг суспензии 2,6-дихлор-3-деазапурина получалось в 1.5 мл ацетонитрила и содержалось в безводных условиях в атмосфере азота. 49 мг трет-бутилата калия добавлялось к суспензии, и получающаяся в результате смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 2,6-дихлор-3-деазапурина. Суспензия соли охлаждалась до 0oC и подвергалась взаимодействию с обогащенным альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонатом в растворе, перемешивалась в течение 1 часа и подогревалась до 20oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида составило 2.5:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия и 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал объединенный выход блокированного бета-аномерного нуклеозида 21 процент, т.пл. 127-129oC.
Пример 34
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)] -2,6-дихлорпурина с 2 эквивалентами калиевой соли 2,6-дихлорпурина.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, затем охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 220 мг 2,6-дихлорпурина в 3 мл ацетонитрила и содержалась безводной в атмосфере азота. Добавлялось 130 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 2,6-дихлорпурина. Суспензия соли охлаждалась до 0oC и подвергалась реакции с обогащенным альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонатным раствором, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2.5:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал выход блокированного бета-аномерного нуклеозида 22 процента.
Пример 35
Получение обогащенного бета-аномером 1-[1-(2'-дезокси-2',2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)] -3-карбоэтокси-1,2,4-триазола с 2 эквивалентами калиевой соли 3-карбоэтокси-1,2,4-триазола.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 164 мг сложного эфира триазола в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 131 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 3-карбоэтокси-1,2,4-триазола. Суспензия соли охлаждалась до 0oC и подвергалась реакции с 2 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, перемешивалась в течение 40 минут и подогревалась до 15oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2,5:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 14 процентов.
Пример 36
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор-3', 5'-ди-O-бензоил-D-риофуранозил)] -2- амино-6- хлорпурина с 2 эквивалентами калиевой соли 2-амино-6-хлорпурина.
К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 197 мг 2-амино-6-хлорпурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 130 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 2-амино-6-хлорпурина.
Суспензия соли охлаждалась до 0oC и подвергалась реакции с 2 мл раствора, обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоал-1-трифторметан- сульфоната, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида составило 2: 1.
Для экстракции нуклеозидного продукта из реакционной смеси добавлялось 100 мл этилацетата, 10 мл воды, и образовывался осадок. Осадок отфильтровывался, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 14 процентов.
Пример 37
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор-3', 5'-ди-O-бензоли-D-рибофуранозил)] -2,6- дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина.
К 3,78 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 30 мл дихлорметана и 1.39 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 1.68 мл трифторметансульфоного ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе.
Суспензия 6.99 г 2,6-дипиваламидоаминопурина приготавливалась в 100 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 2.46 г трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут и сушилась до постоянного веса в вакууме при 40oC, образуя калиевую соль 2,6-дипиваламидоаминопурина. Суспензия соли добавлялась к 100 мл дихлорметана, охлаждалась до 0oC и подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 500 мл этилацетата, 20 мл льда, 20 мл 1 н. соляной кислоты и 35 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 25 мл насыщенного водного раствора бикарбоната натрия, 25 мл солевого раствора и сушился над сульфатом магния. Аномерное отношение бета к альфа блокированного нуклеозида составило 1,8 : 1.
Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 28 процентов, т.пл. 138-239oC.
Пример 38
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)]-6- пиваламидоаминопурина с 2 эквивалентами калиевой соли 6-пиваламидоаминопурина.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 255 мг 6-пиваламидоаминопурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялся 131 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 6-пиваламидоаминопурина. Суспензия соли охлаждалась до 0oC и подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22oC, образуя конечный блокированный нуклеодиз, что подтверждалось данными анализа HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал объединенный выход блокированного бета- и альфа-аномера нуклеозида 28 процентов.
Пример 39
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2',2'-дифтор-3'-, 5'-ди-O-бензоил-D-рибофуранозил)]- 8-бром-7-циано-деаза-6-пиваламидопурина с 2 эквивалентами калиевой соли 8-бром-7-циано-7-деаза-6-пиваламидопурина.
К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-бибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфоного ангидрида образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 187 мл 8-бром-7-циано-7-деаза-6-пиваламинодопурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 65 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут, образуя калиевую соль 8-бром-7-циано-7-деаза-6-пивалоиламидопурина. Суспензия соли охлаждалась до 0oC и подвергалась реакции с 1 мл раствора, обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 20oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC.
Аномерное отношение бета к альфа блокированного нуклеозида было 2:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 2 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал объединенный выход блокированного бета- и альфа-аномера нуклеозида 24 процента.
Пример 40
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2','2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)] -2,6- дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина в различных реакционных растворителях.
К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 10 мл дихлорметана и 0.36 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.45 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 1.85 г 2,6-дипиваламидоаминопурина в 30 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 0.65 г трет-бутилата калия, и получающаяся смесь перемешивалась при 25oC в течение 10 минут, образуя калиевую соль 2,6-дипиваламидоаминопурина. Суспензия соли сушилась в вакууме при 40oC, образуя белое твердое вещество с постоянным весом. 207 мг пуриновой соли суспендировалось в 1.5 растворителя, показанного в опытах A-F в табл. 3, представленной в конце описания, в атмосфере азота при 0oC и подвергалось реакции с 1 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, смесь перемешивалась в течение 1 часа и подогревалась до 0oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC.
Аномерные отношения бета к альфа блокированного нуклеозида показаны ниже.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 2 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида, приведенный в табл. 3 (см. в конце описания).
Пример 41
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2','2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)] -2-ацетамидо-6- дифенилкарбамоилоксипурина с 2 эквивалентами калиевой соли 2-ацетамидо-6-дифенилкарбамоилоксипурина.
К 1.4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0.515 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -40oC и подвергался реакции с 0.621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливался раствор 2.56 г 2-ацетамидо-6-дифенилкарбамоилоксипурина в 50 мл горячего диметилформамида и поддерживался безводным в атмосфере азота. Раствор охлаждался до 25oC, и добавлялось 0.74 г трет-бутилата калия. Получающаяся смесь перемешивалась при 23oC в течение 10 минут и выпаривалась до масла, которое растиралось с эфиром, собиралось на фильтре и сушилось в вакууме при 40oC, давая калиевую соль 2-ацетамидо-6-дифенилкарбамоилоксипурина. 496 мг пуриновой соли суспендировалось в 3 мл дихлорметана, суспензия охлаждалась до 5oC и подвергалась реакции с раствором обогащенного альфа-аномера 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 25oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC.
Аномерные отношения бета к альфа блокированного нуклеозида было 1.8:1.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Выход блокированного бета-аномера нуклеозида был 5.8%.
Пример 42
Получение обогащенного бета-аномером 9-[1-(2'-дезокси-2','2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)] -2,6- дипиваламидоаминопурина с 7 эквивалентами 2,6-калиевой соли 2,6-дипиваламидоаминопурина.
К 100 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 3 мл дихлорметана и 0.036 мл триэтиламина. Данный раствор перемешивался при 23oC в течение 15 минут, охлаждался до -78oC и подвергался реакции с 0.045 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфонат в растворе.
Приготавливалась суспензия 1.85 г 2,6-дипиваламидоаминопурина в 30 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 0.65 г трет-бутилата калия, и получающаяся смесь перемешивалась при 23oC в течение 10 минут и сушилась в вакууме при 40oC, образуя калиевую соль 2,6-дипиваламидоаминопурина, которая охлаждалась до -78oC. Пуриновая соль подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- трифторметансульфоната при 23oC, перемешивалась в течение 1.5 часов и подогревалась до 22oC, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC.
Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл льда, 1 мл 1 н. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия.
Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния.
Аномерное отношение бета к альфа блокированного нуклеозида составило 2.7:1.
Пример 43
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 3 эквивалентами бис-триметилсилилцитозина.
Бис-триметилсилицитозин приготавливался путем объединения 292 мг цитозина с 2 мл гексаметилдисилазана, 11 мг сульфата аммония и 5 мл ксилолов и нагревания раствора с обратным холодильником в течение одного часа с образованием гомогенного раствора. Избыток ксилолов и гексаметилдисилазана удалялся, оставляя расплавленный остаток бис-триметилсилилцитозина. К расплавленному бис-триметилсилилцитозину добавлялось 400 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната, растворенного в 2 мл ксилолов, и ксилолы удалялись. Температура реакционной смеси поддерживалась при 160oC в течение 15 минут.
Анализ HPLC подтвердил завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида составляло 1:1.3.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 50 мл этилацетата и промывалась 50 мл 1 н. соляной кислоты.
Пример 44
Получение обогащенного бета-аномером 9-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-кетопиримидин-2-она с 3 эквивалентами бис-триметилсилилурацила.
Бис-триметилсилилурацил приготавливался с помощью объединения 295 мг урацила с 5 мл гексаметилдисилазана, 11 мг сульфата аммония и 10 мл 1,2-дихлорэтана. Раствор нагревался до 110oC в течение одного часа, образуя гомогенный раствор, и избыток ксилолов и гексаметилдисилазана удалялся, давая расплавленный бис-триметилсилилурацил.
К расплавленному бис-триметилсилилурацилу добавлялось 200 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната. Температура реакционной смеси поддерживалась при 150oC в течение 2 часов.
Анализ HPLC подтверждал завершение реакции. Аномерное отношение альфа к бета блокированного нуклеозида составило 1:1.8.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 50 мл этилацетата и промывалась 50 мл 1 н. соляной кислоты.
Пример 45
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 10 эквивалентами бис-триметилсилилцитозина.
К 1.12 г расплавленного бис-триметилсилицитозина добавлялось 200 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната. Температура реакционной смеси поддерживалась при 130oC в течение 1 часов.
Анализ HPLC подтверждал завершение реакции. Аномерное отношение блокированного нуклеозидного продукта бета к альфа блокированного нуклеозида составило 1.7:1.
Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 100 мл этилацетата и промывалась 100 мл 1 н. соляной кислоты. Количественный анализ HPLC органического слоя показал, что выход блокированного бета-аномера нуклеозида был 50%.
Пример 46
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-ацетамидопиримидин-2-она с 3 эквивалентами бис-триметилсилил-N-ацетилцитозина.
К 500 мл бис-триметилсилил-N-ацетилцитозина добавлялось 980 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната. Температура реакционной смеси поддерживалась при 100oC в течение 3 часов.
Анализ HPLC подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида составило 1.4:1.
Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 25 мл этилацетата и промывалась 25 мл 1 н. соляной кислоты. Водный слой промывался 30 мл этилацетата. Количественный анализ HPLC органического слоя показал, что выход блокированного бета-аномера нуклеозида был 34 процента.
Пример 47
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'- дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-4-ацетамидопиридин-2-она с 3 эквивалентами бис-триметилсилил-N-ацетилцитозина.
К 393 мл бис-триметилсилил-N-ацетилцитозина добавлялось 200 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- метансульфоната. Температура реакционной смеси поддерживалась при 100oC в течение 1 часа.
Аномерное отношение бета к альфа блокированного нуклеозидного продукта составил 2.3:1.
Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 40 мл этилацетата и промывалась 25 мл 1 н. соляной кислоты. Количественный анализ HPLC органического слоя показал, что выход бета-аномера нуклеозида составил 27 процентов.
Пример 48
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4- аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина.
Бис-триметилсилилцитозин получался с помощью объединения 4.9 г цитозина с 90 мл гексаметилдисилазана, 581 мг сульфата аммония и 2 мл ксилолов и нагревания раствора в течение двух часов с образованием гомогенного раствора. Избыток гексаметилдисилазана удалялся, и образовывался белый остаток. К раствору бис-триметилсилилцитозина добавлялся 1 г 2-дезокси-2,2-дифтор-D-рибофуранозид-3,5-дибензоил- 1 -α- метаносульфоната, растворенного в 5 мл ацетонитрила, а ацетонитрил удалялся. Температура реакционной смесь поддерживалась при 130oC под вакуумом в течение 1 часа.
Анализ HPLC показал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозидного продукта составило 3.9:1.
Для экстрагирования нуклеозидного продукта, реакционная смесь разбавлялась 100 мл дихлорметана и промывалась последовательно 100 мл 1 н. соляной кислоты и 200 мл 5% бикарбоната натрия, а затем 200 мл насыщенного хлористого натрия. Органический слой сушился над сульфатом магния, фильтровался и выпаривался до 1.03 г желтого твердого вещества.
Количественный анализ HPLC показал, что выход бета-аномера нуклеозида составил 43 процента.
В табл. 4 (см. в конце описания) показано, как выбранный карбогидрат, температура реакции и количество молярных эквивалентное нуклеозида влияют на выход и аномерное отношение нуклеозидного продукта.
(N/D)означает не определялся. Карбогидраты (карбо.) являются гидроксизащищенными. Обозначения α или β- OMs представляют альфа- или бета-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1- метансульфонат и β- или α- OTs представляют бета- или альфа-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1- толуолсульфонат. Данные выхода представлены в расчете на общее количество карбогидрата и вычислены с помощью количественного HPLC анализа в обратной фазе, при котором пик соответствующего раствора продукта сравнивался со стандартом, 1-(2'-дезокси-2',2'- дифтор-3',5'-ди-O-бензоил-бета-D-рибофуранозил)-4- аминопиримидин-2-оном. Защитной группой нуклеозидного основания в каждом примере является триметилсилил.
Пример 49
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-пиваламидопиримид-2-она в ацетонитриле.
N-пиваламидоцитозин (1.0 г, 5.5 ммолей) суспензировался в ацетонитриле (15.0 мл) и обрабатывался третбутилатом калия (0.062 г, 5.5 ммоля) и перемешивался в атмосфере азота при 25oC, образуя калиевую соль N-пивалоилцитозина.
2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- (п-бромбензолсульфонат (2.99 г, 5.0 ммолей) в ацетонитриле (10.0 мл) добавлялся к указанной выше соли, и вся смесь подвергалась реакция в течение 5.5 часов при 65oC, образуя блокированный нуклеозид.
Анализ HPLC подтверждал завершение реакции и показал аномерное отношение бета к альфа 3.9:1.
Для выделения нуклеозидного продукта, реакционная смесь распределялась между этилацетатом и водой, и органический слой промывался бикарбонатом натрия и сушился над сульфатом магния. Хроматография на колонке (силикагель, толуол этилацетат 6:4) дала 0.700 г целевого продукта с выходом 20 процентов, т.пл. 191 - 193oC.
Пример 50
Получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-4-(N-пиваламидо)аминопиримид -2-она в ацетонитриле.
N-пиваламидоцитозин (0.098 г, 0.5 ммоля) суспендировался в ацетонитриле (1.5 мл) и обрабатывался трет-бутилатом калия (0.062 г, 0.55 ммоля) и перемешивался в атмосфере азота при 25oC, давая калиевую соль N-пивалоилцитозина.
К вышеуказанной соли добавлялся 2-дезокси-2,2-дифтор-D- рибофуранозоил-3,5-дибензоил-1 -α- иодид (0.244 г, 0.5 ммоля) в ацетонитриле (1.5 мл), и вся смесь подверглась взаимодействию в течение 24 часов при 60oC, давая блокированный нуклеизид.
Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 1.13:1.
Пример 51
получение обогащенного бета-аномером 1-(2'-дезокси-2', 2'-дифтор- 3', 5'-ди-O-бензоил-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила а цетонитриле.
1,2,4-триазол-3-карбонитрил (0,101 г, 1.03 ммоля) суспендировался в ацетонитриле (10 мл и обрабатывался гидридом натрия) (0.445 г, 1.12 ммоля) и перемешивался в атмосфере азота при 25oC с образованием соответствующей натриевой соли триазола. К указанной выше соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- бромид (0.451 г, 1.02 ммоля) а ацетонитриле (10 мл), и вся смесь подвергалась реакции в течение 78 часов при 82oC, образуя блокированный нуклеозид.
Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 1.2:1.
Для выделения нуклеозидного продукта реакционная смесь выпаривалась, образуя маслянистое твердое вещество, разбавлялась этилацетатом, промывалась бикарбонатом натрия и сушилась над сульфатом магния и концентрировалась. Остаток кристаллизовался из эталона, давая 30 мг целевого продукта с выходом 6%, т.пл. 225 - 226oC. MC (FD) M/Z 455 (M+I).
Элементный анализ для C22H16F2N4O5: (Теоретический) C 58.15, H 3.55, N 12.33. (Эмпирический) C 58.36, H 3.79, N 12.10.
Пример 52
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-1,2,4- триазол-3-карбонитрила в ацетонитриле.
1,2,4-триазол-3-карбонитрил (0.272 г, 2.89 ммоля) суспендировался в ацетонитриле 20 мл), обрабатывался гидридом натрия (0.094 г, 2.7 ммоля) и перемешивался в атмосфере азота при 25oC, образуя натриевую соль триазола.
К указанной соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- иодид (0.941 г, 1.9 ммоля) в ацетонитриле (20 мл), и вся смесь подвергалась реакции в течение 48 часов при 82oC, образуя блокированный нуклеозид.
Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 3.5:1.
Для выделения нуклеозидного продукта реакционная смесь выпаривалась, образуя маслянистое твердое вещество, разбавлялась этилацетатом, промывалась бикарбонатом натрия, сушилась над сульфатом магния и концентрировалась. Остаток кристаллизовался из этанола, давая 0.421 г целевого продукта; т.пл. 225-226oC с выходом 48%.
MC/FD/M/Z455/M+1/.
Элементный анализ для C22H16F2N4O5: (Теоретический) C 58.15. H 3.55, N 12.33. (Эмпирический) C 58.35, H 3.65 , N 12.33.
Пример 53
Получение обогащенного (9) региоизомер-бета-аномером 1-(2'-дезокси-2'2, 2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил)-6-цианопурина в N,N-диметилацетамиде.
6-цианопурин (0.92 г, 6.35 ммолей) суспендировался в N,N-диметилацетамиде (12 мл) и обрабатывался гидратом натрия (0.396 г, 8.25 ммолей) и перемешивался в атмосфере азота при 25oC, давая натриевую соль 6-цианопурина.
К указанной выше соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α- иодид (3.09 г, 6,35 мл) в N,N-диметилацетамиде (4 мл), вся смесь подвергалась реакции в течение 5 часов при 70oC, образуя блокированный нуклеозид.
Анализ HPLC подтверждал завершение реакции и показывал аномерное отношение бета к альфа 1.2:1.
Анализ HPLC подтверждал завершение реакции и показывал аномерное отношение бета к альфа 1.2:1.
Для выделения нуклеозидного продукта реакционная смесь охлаждалась, растворитель удалялся в вакууме, остаток растворялся в этилацетате, промывался 0.2 M раствором хлористого лития, сушился над сульфатом магния и концентрировался. Хроматография на колонке (силикагель, толуол/этилацетат 9:1/ давала 0.21 г целевого продукта с выходом 6.5% MC (FD) 506 (M+1). Элементный анализ для C25H17F2N5O5: (Теоретический) C 59.41, H 3.39, N 13.86. (Эмпирический) C 59.85, H 3.49 , N 13.48.
Пример 54
Получение обогащенного (9) региоизомер-бета-аномером 1-(2'-дезиокси-2, '2' -дифтор-3',5'-ди-O-бензоил-D-рифуранозил)-2,6-(дипиваламидо)диаминопурина в N,N-диметилацетамиде.
2,6-(дипиваламидо/диаминопурин) 0.159 г 0.5 ммоля) суспендировался в N, N-диметилацетамиде (1.0 мл) и обрабатывался трет-бутилатом калия (0.062 г, 0.55 ммолей) и перемешивался в атмосфере азота при 25oC, образуя калиевую соль 2,6-(дипивалоид)диаминопурина.
К указанной выше соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α- (п-бромбензол)сульфонат (0.299 г, 0.5 ммоля) в N,N-диметилацетамиде (0.5 мл), и вся смесь подвергалась реакции в течение 6 часов при 60oC, образуя блокированный нуклеозид.
Анализ HPLC подтверждал завершение реакции и указал на аномерное отношение бета к альфа 1.9:1 целевого продукта.
Для выделения нуклеозидного продукта реакционная смесь охлаждалась, и растворитель удалялся под вакуумом. Остаток разбавлялся этилацетатом, промывался бикарбонатом натрия, сушился над сульфатом магния и концентрировался до масла. Хроматография на колонке (силикагельтолуол/этилацетат 1:1) давала 0.141 г как альфа, так и бета нуклеозидных продуктов с выходом 28%. MC (FD) 679 (M+1).
Пример 55
Получение обогащенного (9)-региоизомер-бета-аномером 1-(2'-дезокси-2', 2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-2,6 -(дипиваламидо)диаминопурина в ацетонитриле
2,6-(дипиваламидо/диаминопурин/0.159 г, 0.5 ммоля/ суспендировался в ацетонитриле /1.5 мл и обрабатывался трет-бутилатом калия (0.062 г, 0.55 ммоля) и перемешивался в атмосфере азота при 25oC с образованием калиевой соли 2,6-(дипиваламидо)диаминопурина.
К указанной соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1- -α- иодид (0.244 г, 0.5 ммоля) в ацетонитриле (1.5 мл), и вся смесь подвергалась реакции в течение 16 часов при 60oC, образуя блокированный нуклеозид.
Анализ HPLC подтвердил завершение реакции и указал на аномерное отношение бета к альфа 2.2:1.
Для выделения нуклеозидного продукта реакционная смесь разбавлялась этилацетатом, органический слой промывался бикарбонатом натрия, сушился над сульфатом магния, отделялся и концентрировался до масла. Хроматография на колонке (силикагель, толуол/этилацетат 1:1) с последующей перекристаллизацией давала 0.085 г целевого продукта с выходом 25%. MC (FD) 679 (M+1).
Пример 56
Получение обогащенного бета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди-O-бензоил-D-рибофуранозил)-4-(бензиламино) пиримид-2-она в N,N-диметилацетамиде.
N-бензиолцитозин (0.099 г, 0.493 ммоля) суспендировался в N,N-диметилацетамиде (2.0 мл) и обрабатывался гидридом натрия (0.0256 г, 0.534 ммоля) перемешивался в атмосфере азота при 25oC с образованием натриевой соли N-бензилцитозина.
К указанной соли добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- иодид (0.201 г, 0.411 ммоля) в N,N-диметилацетамиде (1.5 мл), и вся смесь подвергалась реакции в течение 5 часов при 23oC с образованием блокированного нуклеозида.
Анализ HPLC подтверждал завершение реакции и указывал на аномерное отношение бета к альфа 1.9:1.
Реакционные растворители удалялись под вакуумом, и остаток растворялся в этилацетате, промывался бикарбонатом натрия, сушился над сульфатом магния и концентрировался до масла. Хроматография на колонке (силикагель, толуол/этилацетат 9: 1) давала 0.015 мг целевого продукта с выходом 6.5 процентов. MC (FD) 562 (M+2).
Пример 57
Получение обогащенного бета-аномером этил-1-(2'-дезокси-2',2'-дифтор-3', 5'-ди-O-бензоил-D-рибофуранозил-1,2,4 -триазол-3-карбосилата в N,N-диметилацетамиде.
Этил 1,2,4-триазол-3-карбоксилат (0.723 г, 5.13 ммолей) суспендировался в N, N-диметилацетамиде (2.5 мл), обрабатывался гидридом натрия (0.123 г, 5.13 ммолей) и перемешивался в атмосфере азота при 25oC с образованием натриевой соли триазола.
К указанной соли добавлялся 2-дезокси-2,22-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- иодид (2.0 г, 4.11 ммоля) в N,N-диметилацетамиде (2.5 мл), и вся смесь подвергалась реакции в течение 24 часов при 23oC, образуя блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 3:1.
Сырая реакционная смесь очищалась с помощью удаления растворителя при пониженном давлении и применении хроматографии на колонке (силикагель, толуол/этилацетат 9:1). Объединенный теоретический выход альфа и бета региоизомеров (A и B ниже) блокированных нуклеозидов составил 67 процентов.
A.
Этил 1-(2'-дезокси-2,2'-дифтор-3', 5'-ди-O-бензоил -β- D-рибофуранозил)-1,2,4-триазол-3-карбоксилат (436 мг, 21.2% выход).
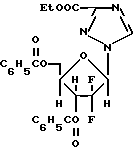
Перекристаллизация "A" из смеси этилацетат : изооктан давала 267 мг чистого бета-аномера с выходом 13%.
B.
Этил 1-(2'-дезокси-2', 2'-дифтор-3', 5'-ди-O-бензоил -β- D-рибофуранозил)-1,2,4-триазол-5-карбоксилат (855 мг, 41.5% выход).
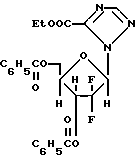
Пример 58
Получение обогащенного бета-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-1 -β- (2-амино-6-хлорпурина) в диметилацетамиде.
К суспензии 2-амино-6-хлорпурина (82.6 ммоля, 14.0 г) в диметил-ацетамиде (900 мл) при 0oC в атмосфере азота добавлялся порошкообразный гидроксид калия (99.12 ммоля, 5.5 г). Смесь перемешивалась в течение 30 минут, образуя раствор. Добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1 -α- иодид (82.6 ммоля, 40.31 г) в диметилацетамиде (450 мл). Реакционная смесь оставалась подогреваться до комнатной температуры и перемешивалась в атмосфере азота на протяжении ночи.
Продукт экстрагировался добавлением этилацетата и солевого раствора. Органический слой промывался последовательно 1 н. HCl, насыщенным раствором бикарбоната натрия, водой и солевым раствором. Органический слой затем сушился над сульфатом натрия и выпаривался в вакууме.
Сырой продукт очищался с помощью хроматографии на силикагеле, давая 3:1 аномерное отношение бета к альфа 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-(2-амино- 6-хлорпурин).
1H ЯМР (300 МГц, CD3CD), δ 4.68 (м., 2H), 4'-H, 5'- a-H), 4.90 (м., 1H, 5' b-H), 6.02 (м., 1H, 3'-H), 6.29 (м., 1H, 1'-H), 7.53 (м., 6H, Bz), 7.92 (с., 1H, 8'-H), 8.05 (м., 4H, Bz).
Дибензоильное промежуточное соединение (0.49 ммоля, 260 мг) деблокировалось суспендированием его в метаноле при 0oC и насыщением смеси безводным аммиаком. Получающийся раствор подогревался до комнатной температуры и перемешивался на протяжении ночи. Раствор затем продувался азотом и выпаривался. Целевой продукт затем очищался с помощью промывки неполярным растворителем, таким как метиленхлорид, для удаления бензоатных продуктов. Бета-аномер отделялся с помощью HPLC в обратной фазе.
1H ЯМР (300 МГц, CD3CD), δ 3.90 (м., 3H, 4'-H, 5'-H), 4,58 (м., 1H, 3'-H), 6.27 (дд., 1H, 1'-H), 8.31 с., 1H, 8-H).
Получение 1
Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-ди-O-бензоил-1- метаносульфонат.
К раствору 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата (40 мг) в метиленхлориде (0.5 мг) добавлялся триэтиламин (0.025 мл). После перемешивания при комнатной температуре в течение 30 минут вся смесь охлаждалась до -78oC, затем добавлялся метансульфонилхлорид (0.01 мл). Температура реакции поддерживалась между -78oC и -80oC в течение 30 минут, затем подогревалась до комнатной температуры.
Анализ HPLC показал, что реакция завершилась. Аномерное отношение целевого соединения альфа к бета по данным определения с помощью 19F ЯМР анализа: было 4:1.
Получение 2
Альфа-аномер 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-ди-O-бензоил-1-метансульфоната.
К раствору 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата (60 г, 95% чистоты) в дихлорметане (600 мл) добавлялся триэтиламин (31.5 мл, 1.5 эквивалента). После перемешивания при комнатной температуре в течение 30 минут смесь охлаждалась до -78oC. Спустя 5 минут к смеси добавлялся метансульфонилхлорид (14 мл, 1.2 экв.) в дихлорметане (140 мл). Температура реакции поддерживалась между -78oC и -80oC в атмосфере азота в течение одного часа.
Анализ HPLC показал, что реакция завершалась. Аномерное отношение целевого соединения по данным анализа HPLC было 3.53:1 альфа к бета.
Для выделения целевого соединения реакционная смесь промывалась водой, 1 н. раствором HCl и 5% раствором бикарбоната натрия (30 мл каждого). Органический слой отделялся и сушился над безводным сульфатом магния. Целевое соединение (31.5 г) получалось с выходом 46 процентов, т.пл. 88-89oC; [α]D (с 1.01, CHCl3) + 84.2; [α]365aм+ 302.0o. Элементный анализ: C20H18O8SF2:
Вычислено: C 52.63, H 3.98, F 8.33, S 7.02 (456.4).
Найдено: C 52.92, H 3.82, F 8.33, S 7.30;
1H ЯМР (CDCl3), δ = 3.17 (CH3), 4.66 и 4.76 (C-5H), 4.84 (C-4H), 5.57 (C-3H), 6.13 (C-1H), 13C ЯМР (CDCl3), δ = 40.22 (CH3), 62.51 (C-5H), 71.03 (C-3H), JC,F = 18.3, 38,5 Гц), 82.75 (C-4H), 99.59 (C-1H, JC,F = 25.5, 48.3 Гц), 122.24 (C-2H, JC,F = 259, 286 Гц).
Получение 3
Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-ди-O-бензоил- 1-метансульфонат.
К аномерной смеси 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-O-бензоил-1-метансульфоната (1,0 г, 97% бета-аномера) в ацетонитриле (10 мл) добавлялся N,N-диметилбензиламмоний-метансульфонат (100 мг). Смесь перемешивалась и нагревалась до температуры дефлегмации. Анализ HPLC использовался для определения отношения альфа к бета целевого продукта и показал следующее:
Время/часы - Альфа/бета
0 - 1:32
16 - 1.0:1.4
24 - 2.3:1.0
Получение 4
Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-ди-O-бензоил-1-метансульсонат.
К аномерной смеси 2-дезокси-2,2-дифтор-D-рибофуранозил- 3,5-ди-O-бензоил-1-метансульфоната (29.1 г, 50% бета-аномер) в дихлорметане и н-пропилацетате ... нагревалась до 90oC для удаления дихлорметана. Смесь охлаждалась до 50-60oC, и добавлялась смесь триэтиламина (5.33 мл, 0.55 экв.) и метансульфокислота (2.04 мл, 0.55 экв.). Получающаяся в результате смесь нагревалась до 95-97oC и перемешивалась. Смесь содержала 23.2 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5- ди-O-бензоил-1-метаносульфоната. Для определения отношения альфа к бета целевого продукта использовался анализ HPLC и показал следующее:
Время (часы) - Альфа/бета
4 - 3:1г
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ И ВЫДЕЛЕНИЯ 2'-ДЕЗОКСИ-2',2'-ДИФТОРНУКЛЕОЗИДОВ | 1995 |
|
RU2161622C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕМЦИТАБИН ГИДРОХЛОРИДА | 1995 |
|
RU2154648C2 |
| Способ получения нуклеозида или его фармацевтически приемлемых солей | 1984 |
|
SU1442076A3 |
| СПОСОБ ПОЛУЧЕНИЯ 2'-ДЕЗОКСИ-2', 2'-ДИФТОРЦИТИДИНА | 2005 |
|
RU2360919C2 |
| ПРОИЗВОДНЫЕ 1-α-ГАЛОГЕН-2,2-ДИФТОР-2-ДЕЗОКСИ-D-РИБОФУРАНОЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2346948C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ОЧИСТКИ ГЕМЦИТАБИНА ГИДРОХЛОРИДА | 2006 |
|
RU2345087C2 |
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2104280C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ДЕЗОКСИ-2-ФТОР-D-РИБОФУРАНОЗИЛ-ПИРИМИДИНОВ И ПУРИНОВ И ИХ ПРОИЗВОДНЫХ | 2005 |
|
RU2407747C2 |
| СИНТЕЗ β-L-2'-ДЕЗОКСИНУКЛЕОЗИДОВ | 2004 |
|
RU2361875C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЕННЫХ ПИРРОЛО (2,3-α)ПИРИМИДИНОВ | 1993 |
|
RU2127274C1 |
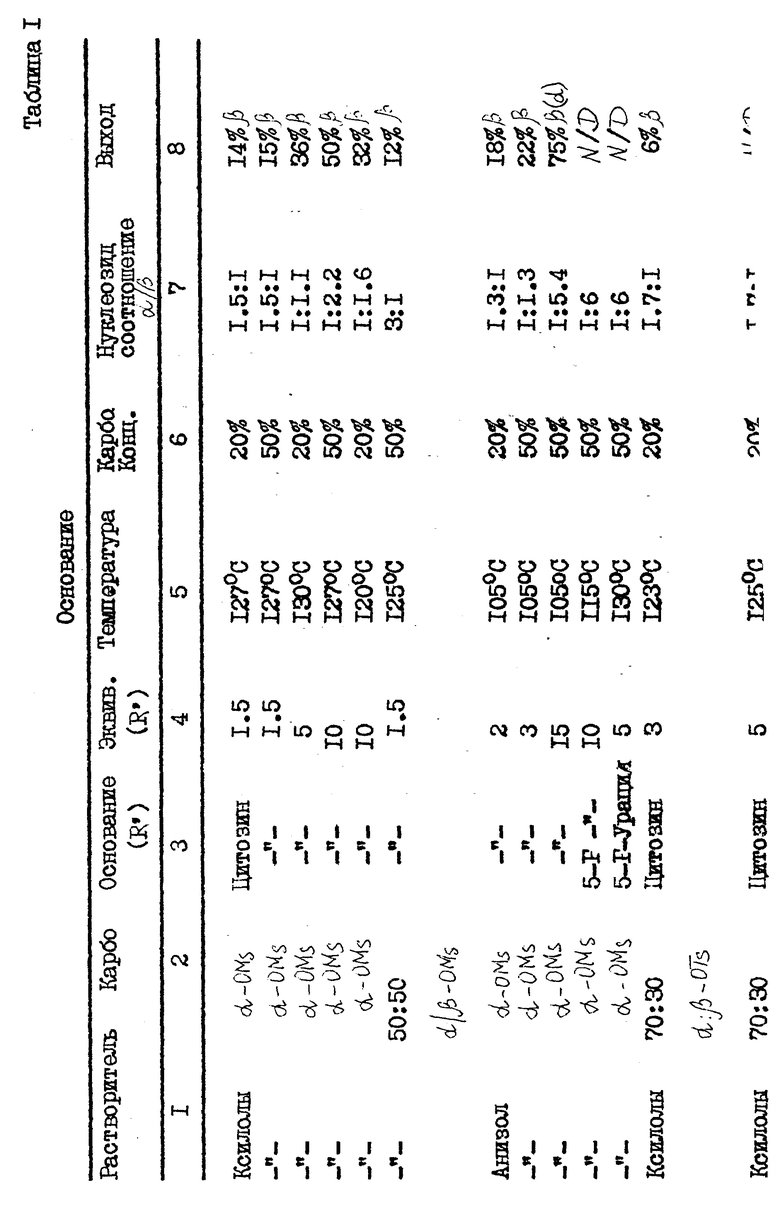
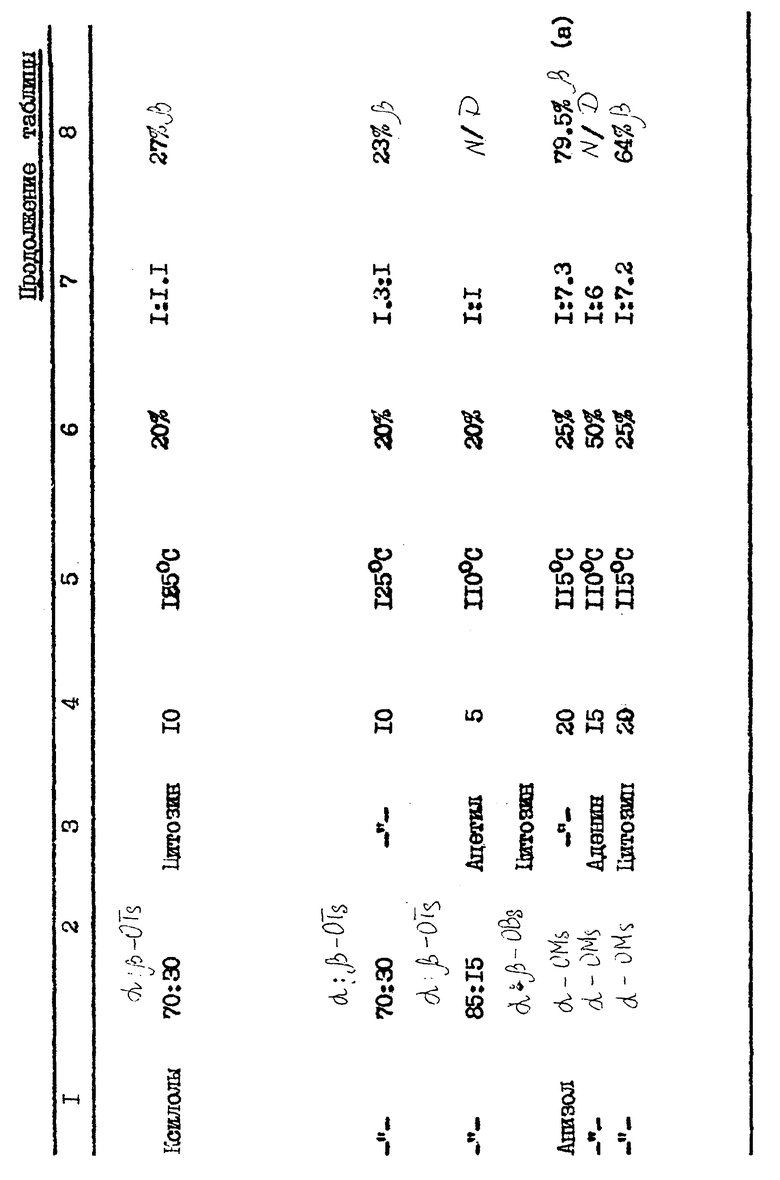
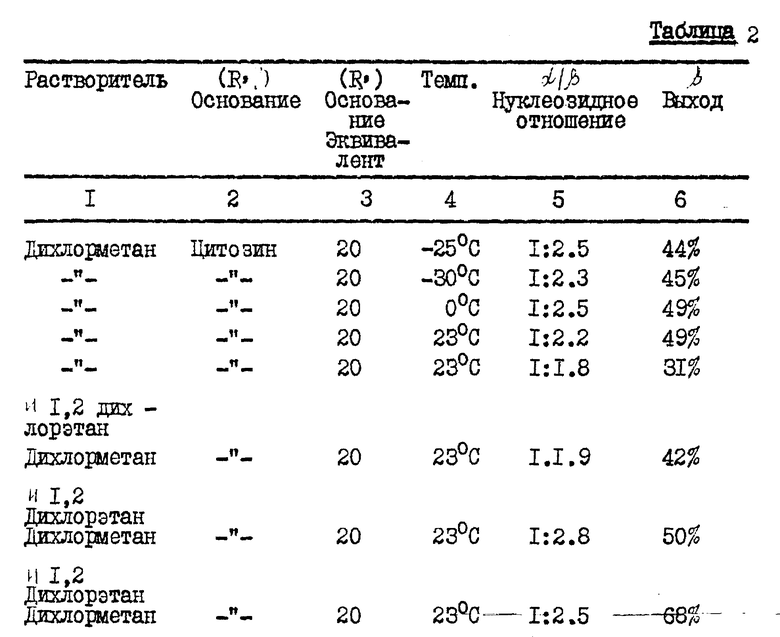
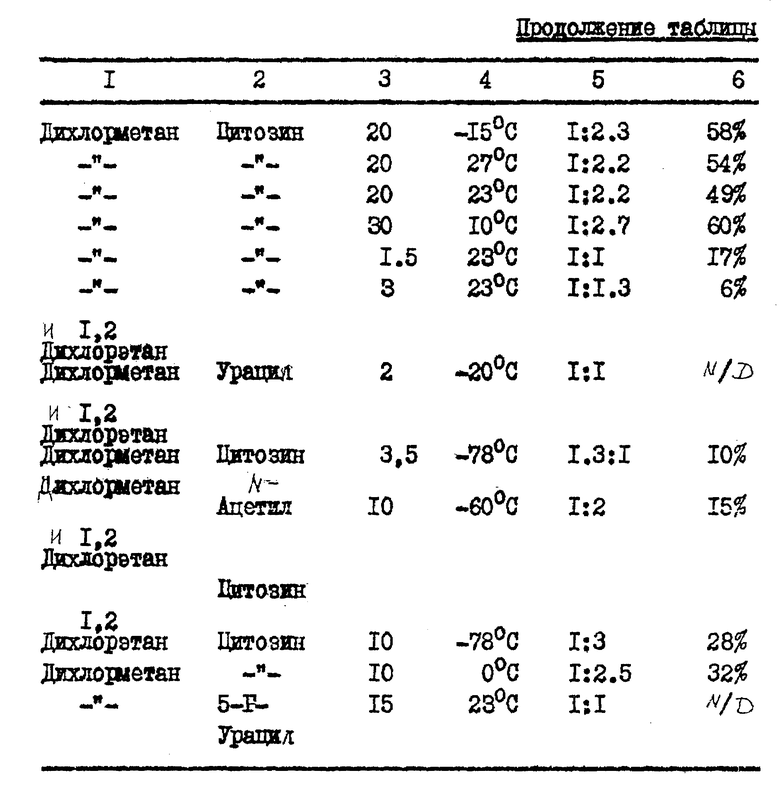
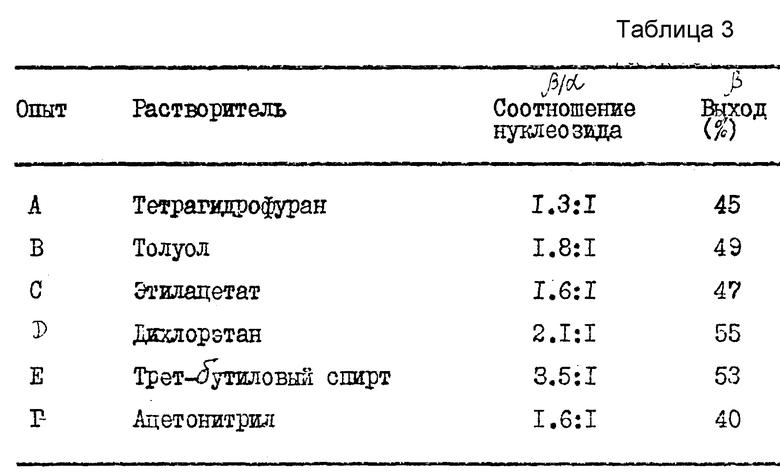
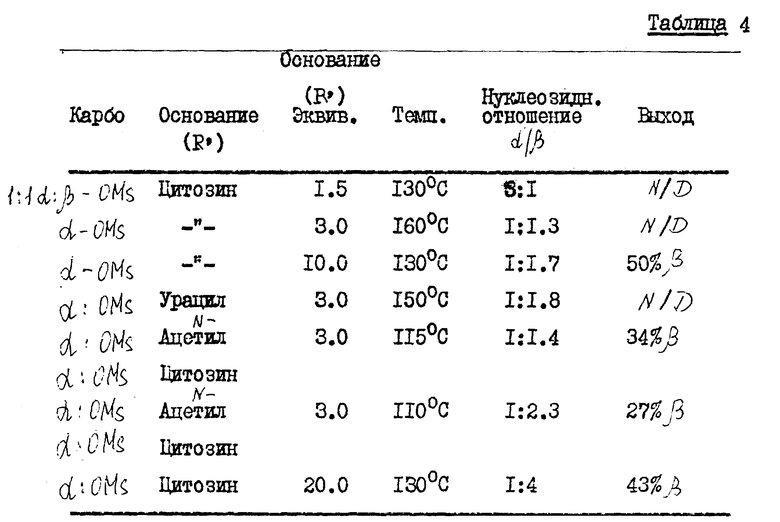
Изобретение относится к способу получения обогащенных бета-аномером нуклеозидов формулы I, где Т - фтор и R представляет соответственный нуклеозид, описанный в п.1 формулы. Способ заключается в том, что осуществляют SN2 замещение необязательно в подходящем растворителе сульфонилоксигрупп (У) из обогащенного мономером карбогидрата формулы II, где Х независимо выбран из гидроксизащитных групп, Т имеет указанное значение, по крайней мере мономерным эквивалентом соответствующего нуклеоснования при температуре 17-120oС и деблокирование с образованием соединения формулы I. Описываемый способ является стереоселективным. 19 з. п.ф-лы, 4 табл.
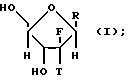
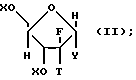
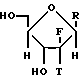
где T - фтор;
R представляет нуклеозид, выбранный из группы, состоящей из радикалов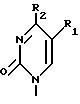
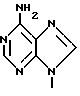
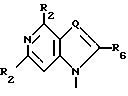
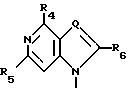
где R выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
R2 выбран из группы, состоящей из гидрокси, галоида, первичного амина или вторичного амина;
R4, R5 и R6 независимо выбраны из группы, состоящей из водорода, - OH, -NH2, N(алкила)W, галоида;
Q выбран из группы, состоящей из CH, CR8 или N, где R8 выбран из группы, состоящей из галоида или циано,
отличающийся тем, что осуществляют SN2 замещение необязательно в подходящем растворителе сульфонилоксигруппы (Y) из обогащенного альфа-аномером карбогидрата формулы II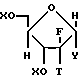
где X независимо выбран из гидроксизащитных групп;
T имеет значения, определенные выше,
по крайней мере молярным эквивалентом нуклеоснования (R''), выбранного из группы, состоящей из
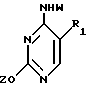
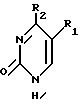
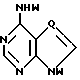
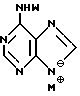
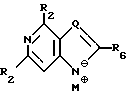
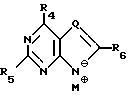
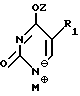
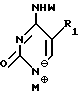
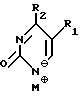
где R1, R2, R4, R5, R6 и Q имеют значения, определенные выше;
Z представляет собой гидроксизащитную группу;
W представляет аминозащитную группу;
M⊕ представляет катион,
причем SN2 замещение проводят при температуре 17 ... -120oС и деблокирование с образованием соединения формулы I.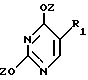
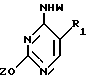
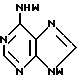
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
Z представляет гидроксизащитную группу;
W представляет аминозащитную группу;
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси и замещенной арилсульфонилокси группы,
причем процесс осуществляют в растворе, имеющем концентрацию карбогидрата более 20 мас.% на единицу объема растворителя, а в качестве растворителя используют инертный растворитель с температурой кипения более 70oС.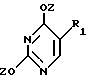
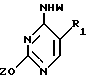
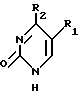
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
R2 выбран из группы, состоящей из гидрокси, галоида, первичного амино или вторичного амино;
Z представляет гидроксизащитную группу;
W представляет аминозащитную группу;
Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси,
причем SN2 замещение проводят при температуре от -120 до 25oС с использованием низкозамерзающего инертного растворителя.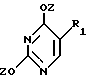
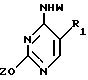
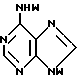
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
Z представляет гидроксизащитную группу;
W представляет аминозащитную группу;
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси,
причем процесс проводят в присутствии катализатора.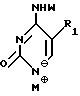
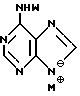
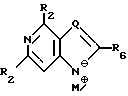
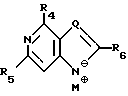
где R2 выбран из группы, состоящей из гидрокси, галоида, первичного амино или вторичного амино;
R4, R5, R6 независимо выбраны из группы, состоящей из водорода, - OH, NH2, N(алкил)W, галоида;
Q выбран из группы, состоящей из CH, CR8 и N, где R8 выбран из группы, состоящей из галоида или циано;
Z представляет гидроксизащитную группу;
W представляет аминозащитную группу;
M⊕ представляет катион;
Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси;
и растворителем является инертный растворитель с температурой замерзания ниже 26oС.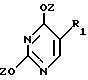
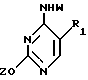
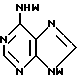
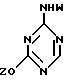
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
Z представляет собой гидроксизащитную группу;
W представляет аминозащитную группу, где Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси.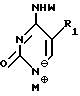
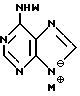
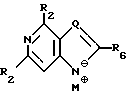
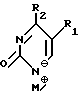
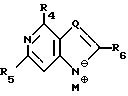
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида;
R2 выбран из группы, состоящей из гидрокси, галоида, первичного амино и вторичного амино;
R4, R5, R6 независимо выбраны из группы, состоящей из водорода, - OH, NH2, N(алкил)W, галоида;
Q выбран из группы, состоящей из CH, CR8 и N, где R8 выбран из группы, состоящей из галоида или циано;
Z представляет гидроксизащитную группу;
W представляет аминозащитную группу;
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси.
| US 4965374, 1989 | |||
| US 5256798, 1990 | |||
| Тринус Ф.П | |||
| Фармакотерапевтический справочник | |||
| - Киев, Здоровья, 1989, с.263. |
Авторы
Даты
1999-06-20—Публикация
1993-06-21—Подача