Настоящее изобретение относится к новым ингибиторам тромбина, в частности к ингибиторам тромбина, выделяемым из тканей и секреций пиявок.
Тромбин катализирует образование сгустков фибрина, а потому подавляет свертывание крови. Кроме того, тромбин выступает в роли биорегулятора в таких процессах, как прямая активация агрегирования тромбоцитов и активация воспалительного отклика путем стимулирования синтеза активационного фактора тромбоцитов клетками эндотелия. Это означает, что тромбин играет главную роль в заболеваниях, вызываемых тромбозом, таких как, например, заболевания сердечно-сосудистой системы.
По этой причине сохраняется значительный интерес к новым или обладающим улучшенными свойствами ингибиторам тромбина и антикоагулянтам.
Примерами хорошо известных ингибиторов тромбина являются гепарин и гирудин.
Гепарин усиливает антикоагуляционную активность антитромбина III. Он широко используется для лечения состояний, таких как венозный тромбоэмболизм, при которых активность тромбина ответственна за развитие или распространение тромба. Он неэффективен для терапевтического применения в тех случаях, когда содержание антитромбина III понижено, например, в случае тромбоза, вызываемого нефрозом или синдромом коагулопатии потребления. Более того, гепарин вызывает многочисленные побочные эффекты, в том числе кровотечение и тромбоцитопению.
Гирудин является хорошо известным и хорошо изученным полипептидом, который, как известно, является тромбинспецифическим и может быть выделен из экстрактов слюнных желез и других тканей пиявок вида Hirudo medicinalis. Гирудин и его производные можно получать также по рекомбинантной технологии. Полипептид имеет сравнительно небольшой молекулярный вес порядка 7000 Да и состоит из 65 остатков аминокислот. Последовательность аминокислот гирудина была впервые определена Додтом и др. (FEBS Letters. 1984, vol. 165, p. 180 - 184). В пиявках Hirudo medicinalis обнаружены три основныx гирудина (H 1, H 2, H 3), которые отличаются всего лишь приблизительно на 10% от общего числа позиций аминокислот. Наиболее значительное различие состоит в первых двух позициях N-конца молекулы: VaI-VaI в форме I гирудина и Ile-Thr в форме 2 гирудина. Указанные различия носят второстепенный характер и не оказывают влияния ни на функции, ни на специфичность взаимодействия гирудин-тромбин. Гирудин является потенциальным природным ингибитором коагуляции. Показана его эффективность для предотвращения тромбоза вен, закупорки анастомозов сосудов и вызываемого тромбином синдрома коагулоцатин потребления, однако он вызывает продолжительные кровотечения.
Фитогенетически медицинская пиявка Hirudo medicinalis является членом подсемейства Hirudininae семейства пиявок Hirudinidae (R.T. Sawyer: "Leech Biology and Behaviour" Oxford University Press, vol. 2, p. 688, 1986).
Эволюционно более развитым видом пиявок является Hirudinariinae того же семейства Hirudinidae. Неожиданно похожая, но вполне отличная изоформа гирудина была недавно обнаружена в Hirudinaria manillensis, как это описано в международной патентной заявке РСТ WO 90/05143. Указанная изоформа отличается почти по 40% позиций аминокислот при сравнении с гирудином от Hirudo medicinalis. Два указанных ранее вида, а именно Hirudo medicinalis и Hirudinaria manillensis, относятся к отряду пиявок Arhynchobdellida ("пиявки с челюстями"). Помимо отряда Arhynchobdellida существует еще один большой отряд пиявок, т.е. Rhynchobdellida ("пиявки с хоботом") (R.T. Sawyer: "Leech Biology and Behaviour" Oxford University Press, vol. 2, p. 651, 1986). Что касается белков, содержащихся в слюне, то наиболее изученным представителем отряда Rhynchobdellida является "амазонская пиявка", Haementeria ghilianii. Неожиданно было обнаружено, что этот вид не содержит антитромбин (Budzynski et al. , Proc. Soc. Exp. Biol. Med., 1981, vol. 168, p. 259 - 265). Вместо этого Haementeria ghilianii содержит фибринолитический фермент, получивший название гементин (патент США 4390630), а также ингибитор фактора коагуляции крови Ха (C.Condra et al., Thromb. Haemost., 1986, vol. 61, p. 437 - 441).
Основываясь на этом открытии и последующих публикациях, полагали, что антитромбиноподобная активность ограничивается пиявками отряда Arhynchodellida и отсутствует у отряда Rhynchobdellida.
Несмотря на обсуждающиеся выше разработки, сохраняется потребность в других, кроме гепарина и гирудина, антиокоагулянтах и антитромбинах соответственно, которые обладают более высокой эффективностью при подавлении образования сгустков, вызываемой тромбином активации действия у клеток эндотелия, и которые можно было бы получать в коммерческих количествах.
Неожиданно было обнаружено, что соединения антитромбиноподобной активностью могут быть выделены из тканей и секреций пиявок отряда Rhynchobdellida, предпочтительно семейства Theromyzon, и наиболее предпочтительно вида Theromyzon tessulatum, которых часто называют "птичьими пиявками", т.к. образ жизни этих пиявок заключаются в том, что они сосут кровь из ноздрей водоплавающих птиц.
Таким образом, целью настоящего изобретения является использование пиявок отряда Rhynchobdellida предпочтительно вида Theromyzon tessulatum, для получения соединений - нигибиторов тромбина.
Было показано, что активность ингибитора тромбина можно измерить в экстрактах, состоящих из растворимых в воде компонентов указанных пиявок. Таким образом, целью настоящего изобретения является получение экстрактов с ингибиторной активностью по отношению к тромбину из тканей или секреций пиявок отряда Rhynchobdellida или семейства Theromyzon или вида Theromyzon tessulatum, содержащих растворимые в воде компоненты указанных пиявок.
Активный ингибитор тромбина может быть выделен из указанных экстрактов. Таким образом, целью настоящего изобретения является в достаточной степени очищенный ингибитор тромбина, который можно охарактеризовать как полипептиды, обладающий антитромбиновой активностью, выделенный из указанного выше и в формуле изобретения экстракта путем очистки экстракта, полученного гомогенизацией передней третьей части замороженных и подвергнутых сублимационной сушке пиявок в смеси вода/ацетон, методом тромбинспецифический аффинной хроматографии с последующей по крайней мере одной стадией гельпроникающей хроматографии и по крайней мере одной стадией жидкостной хроматографии высокого разрешения (ЖХВР) с обращенной фазой.
Ингибитор тромбина преимущественно содержит активные полипептидные фрагменты с молекулярными весами около 3 кДа, приблизительно 9 кДа и приблизительно 14 кДа соответственно. Указанные активные полипептиды можно рассматривать как продукты разложения исходного ингибитора тромбина или предшественника ингибитора тромбина.
Ингибитор тромбина по настоящему изобретению является новым, поскольку он отличается от известных антитромбинов, в частности, от гирудина, по своему молекулярному весу, изоэлектрической точке и N-концевой последовательности аминокислотных остатков, что указывает на низкую гомологию (ниже 40%) с другими ингибиторами тромбина.
Таким образом, еще одной целью настоящего изобретения является выделение из указанного экстракта ингибитора тромбина, состоящего по крайней мере из одного полипептида, обладающего ингибиторной активностью по отношению к тромбину и имеющего молекулярный вес около 3 кДа.
Далее целью настоящего изобретения является ингибитор тромбина, состоящий по крайней мере из одного полипептида, обладающего ингибиторной активностью по отношению к тромбину и имеющего молекулярный вес около 9 кДа и следующую N-концевую последовательность аминокислот: Glu Asp Asp Asn Pro Gly Pro Pro Arg Ala Cys Pro Gly Glu.
Далее целью настоящего изобретения является ингибитор тромбина, состоящий по крайней мере из одного полипептида, обладающего ингибиторной активностью по отношению к тромбину и имеющего молекулярный вес около 14 кДа и следующую N-концевую последовательность аминокислот: Ser Glu Leu Gly Gln Ser Cys Ser Lys Glu Asn Pro Cys Pro Ser Asn Met Lys Cys Asn Arg Glu Thr Phe Lys
В соответствии с настоящим изобретением термины "около 3(9,14) кДа" включают максимальное отклонение плюс/минус 1 кДа, преимущественно 0,5 кДа. Более того, в объем притязаний по настоящему изобретению входят указанные выше и ниже по тексту последовательности, в которых произведена замена аминокислот, так что сохраняются основные биологические свойства. Изобретение охватывает также формы, фрагменты подединицы, природные мутанты и произвольно возникшие искусственные мутанты. Сюда включаются также гибридные белки, такие как белки слияния, полученные из указанных пептидов.
Изобретение относится к способу получения указанного выше и в формуле изобретения экстракта путем гомогенизации тканей или секреций пиявок отряда Rhynchobdellida преимущественно вида Theromyzon tessulatum, и приготовления фракции, включающей их растворимые в воде компоненты.
Далее целью настоящего изобретения является способ получения полипептида по пп. 4 - 7 формулы изобретения путем очистки экстракта с помощью тромбинспецифической аффинной хроматографии и по крайней мере одной стадии стандартной хроматографической очистки.
Ингибитор тромбина по настоящему изобретению обладает антикоагуляционными и антитромботическими свойствами. Поэтому он может использоваться при лечении клинических состояний, при которых нарушена система коагуляции. Это использование включает лечение тромбоза, паралича, инфаркта миокарда, глубокого тромбоза вен, закупорки артерий конечностей, тромбоза легких, тромбоза артерии сетчатки глаза или других случаев тромбоза. Более того, ингибиторы тромбина могут применяться для пациентов с артериовенозными шунтами или пациентов, которым устанавливаются коронарные обходные анастомозы. Полипептиды по настоящему изобретению могут также использоваться в качестве антикоагулянтов для профилактики тромбоза или повторной закупорки артерий, для консервации крови или продуктов крови и для экстракорпоральной циркуляции крови или плазмы.
Ингибиторы тромбина (полипептиды) по настоящему изобретению проявляют биологическую активность, которая в основном сопоставима с активностью гирудина. Сродство при присоединении к тромбину (константа ингибирования) даже несколько возрастает по сравнению с гирудином, который является в настоящее время самым сильным ингибитором тромбина.
Таким образом, еще одной целью настоящего изобретения является использование указанных выше и в формуле изобретения полипептидов в качестве медицинского средства, в частности при лечении in vivo расстройств, вызываемых тромбозом, и для подавления аггрегирования тромбоцитов и образования сгустков крови в экстракорпоральной крови.
Наконец, в настоящем изобретении заявляется также фармацевтическая композиция, включающая ингибитор тромбина или указанный выше полипептид соответственно и фармацевтически приемлемый носитель, для лечения заболеваний, вызываемых тромбозом, как это указано ранее.
Краткое описание чертежей.
Подробное описание чертежей приводится в примерах 1 - 10.
На фиг. 1 представлен профиль элюирования антитромбина после аффинной колонны (пример 3).
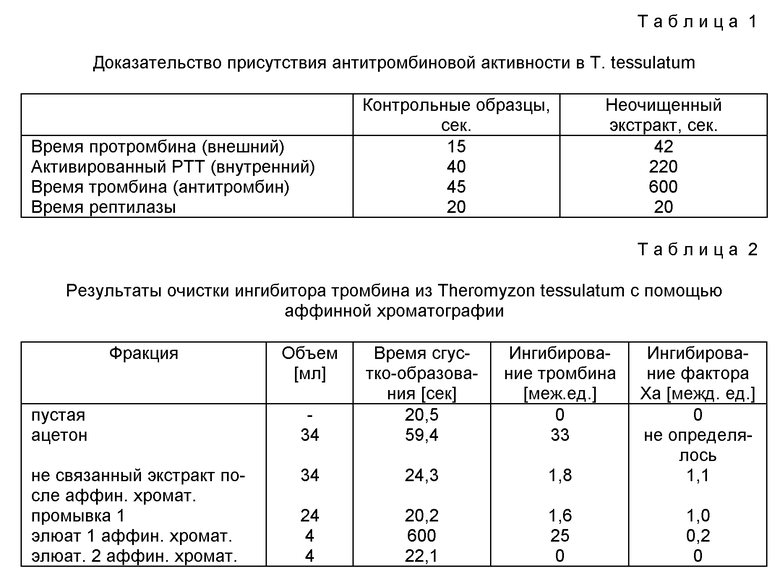
На фиг. 2 приведен фильтрационный анализ антитромбина, полученного от T. tessulatum на Biogel P4 (пример 4).
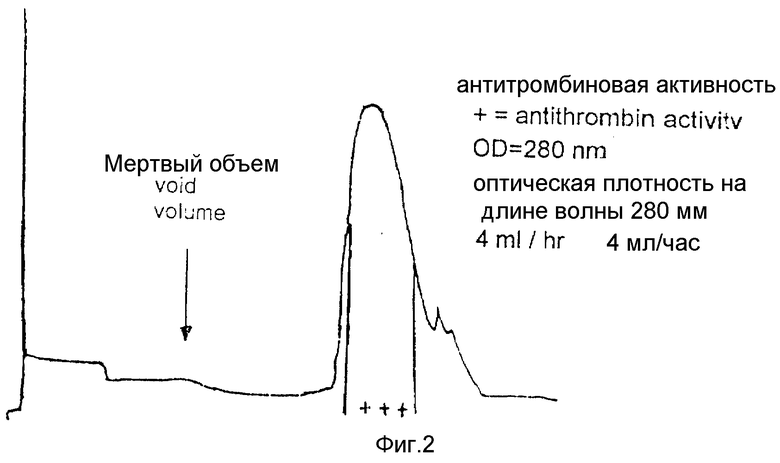
На фиг. 3 показаны результаты проведения аналитической ЖХВР с обращенной фазой позитивных фракций после аффинной хроматографии (пример 5).
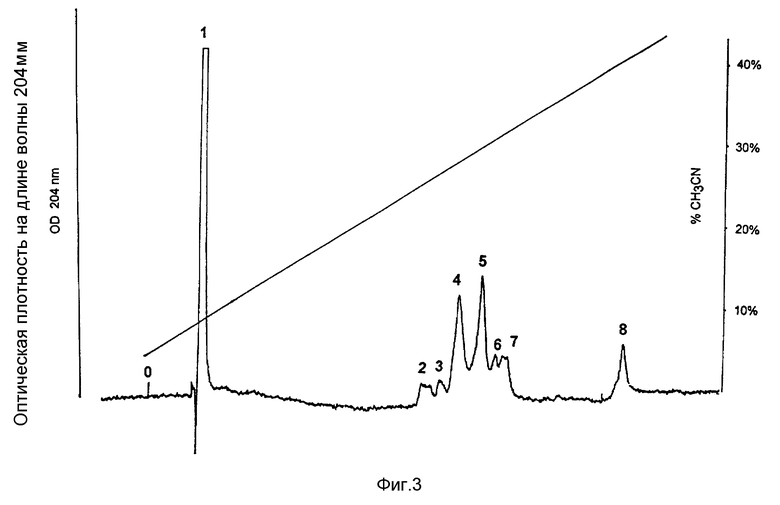
На фиг. 4 показаны результаты проведения препаративной ЖХВР с обращенной фазой позитивных фракций после аффинной хроматографии (пример 5).
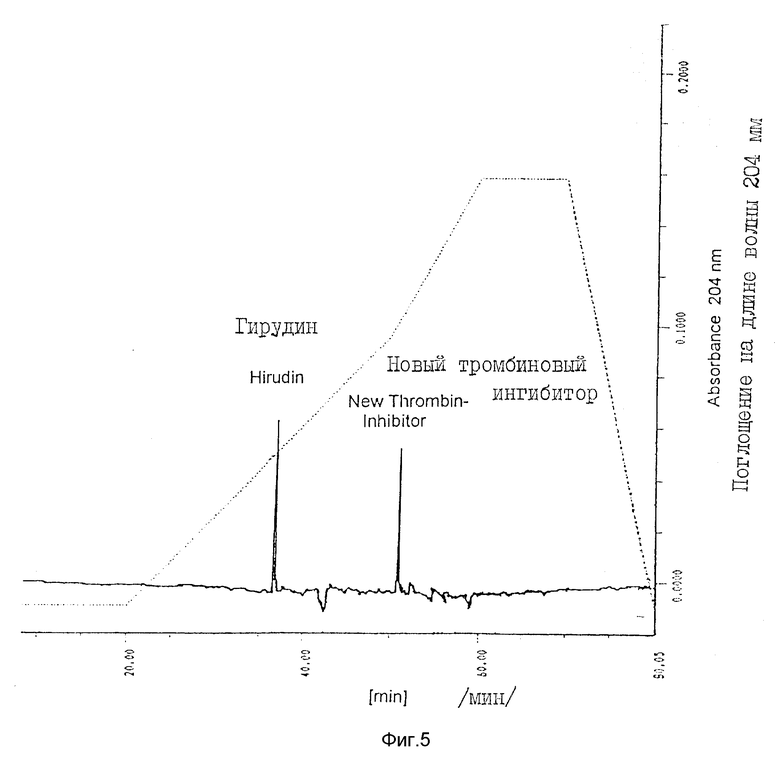
На фиг. 5 проводится сравнение гирудина ингибитора по настоящему изобретению методами ЖХВР (пример 6).
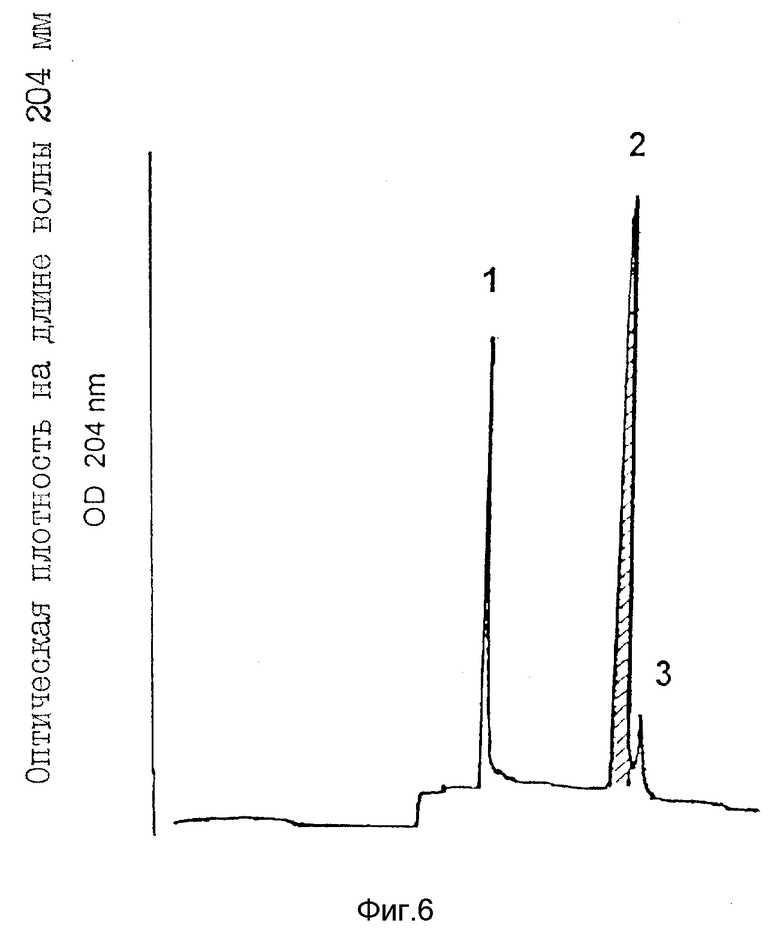
На фиг. 6 представлена повторная хроматограмма активного пика 2 после ЖХВР с обращенной фазой (пример 7).
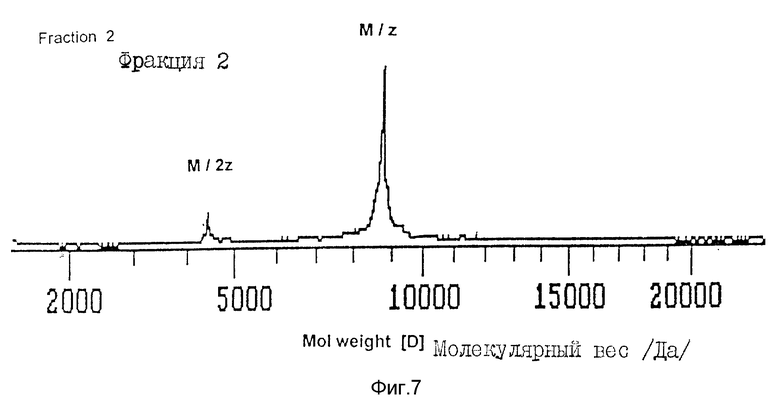
На фиг. 7 изображен масс-спектр активного пика 2 после ЖХВР с обращенной фазой (пример 7).
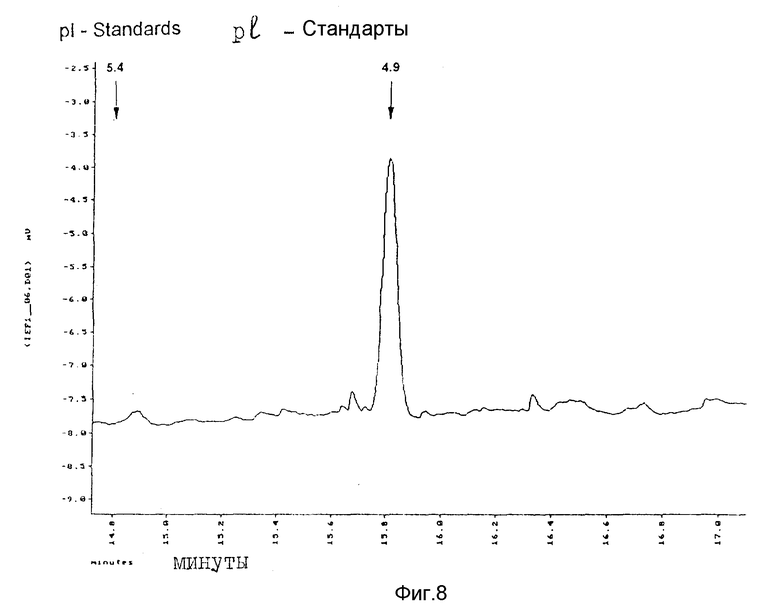
На фиг. 8 приведен IEF след активного пика 2 после ЖХВР с обращенной фазой (пример 7).
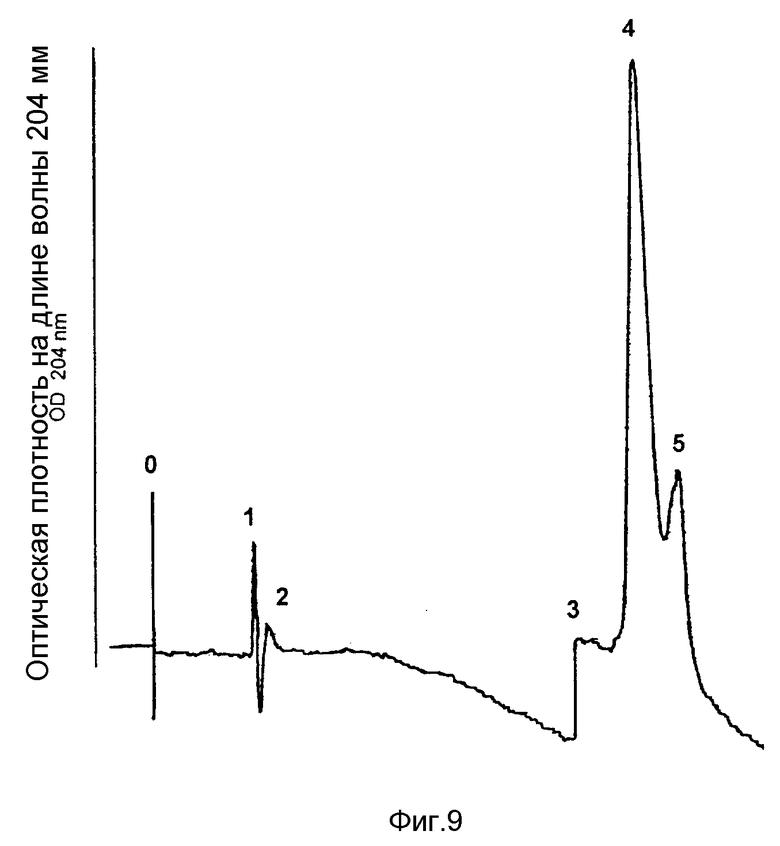
На фиг. 9 представлена повторная хроматограмма активного пика 7 после ЖХВР с обращенной фазой (пример 9).
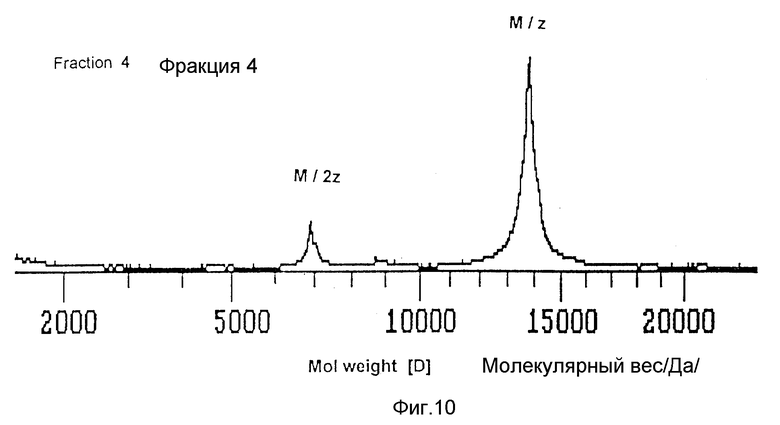
На фиг. 10 изображен масс-спектр активного пика 4 после ЖХВР с обращенной фазой (пример 9).
Подробное описание изобретения.
Ингибиторы тромбина по настоящему изобретению могут быть выделены и очищены от тканей и секреций пиявок отряда Rhynchobdellida, преимущественно семейства Theromyzon. Ингибиторы тромбина, получаемые из пиявок семейства Theromyzon, обладают сходной активностью и лишь незначительно отличаются друг от друга. Примерами подходящих видов семейства Theromyzon являются T. binannulatum, T. cooperi, T. garjaewi, T. maculocum, T. mollissium, T. pallens, T. propinguum, T. rude, T. sexoculatum и, в частности, T.Tessulatum.
В качестве источника в соответствии с настоящим изобретением используют слюнные железы пиявок. Но так как для приготовления слюнных желез необходимо приложить определенные усилия, при этом неизбежны большие потери материала, можно также использовать в качестве источника головы или первую третью часть пиявок.
Обычно первая стадия способа заключается в основном в глубоком замораживании и/или сублимационной сушке тканей пиявок перед проведением гомогенизации, которую обычно проводят в ацетоне или смесях ацетон/вода. Тем не менее для удаления не растворимых в воде компонентов могут использоваться и другие полярные растворители. Предпочтительно также, чтобы экстракт, полученный на первой стадии, подвергался центрифугированию перед проведением аффинной хроматографии для удаления нежелательных продуктов распада клеток. Аффинную хроматографию предпочтительно проводят на колонках, содержащих "активные участки тромбина". Термин "активные участки тромбина" в данном случае указывает на наличие в колонке участков тромбина, к которым может прикрепляться ингибитор тромбина. Примерами активных участков тромбина являются иммобилизованный нативный или дезактивированный тромбин, включая также пептиды - производные тромбина, напоминающие тромбин или другие производные тромбина. В соответствии с изобретением тромбин или указанные производные тромбина иммобилизуют на активную матрицу геля, преимущественно за счет взаимодействия с азлактоновой группой указанной матрицы геля с использованием известных способов. В противном случае проводят аффинную хроматографию обычными способами.
Предпочтительно использовать метод гельпроникающей хроматографии совместно с аффинной хроматографией.
Матрица геля в соответствии с настоящим изобретением имеет предел разделения приблизительно 5 кДа, что позволяет провести фракционирование в интервале приблизительно 1 - 5 кДа.
Выделенные экстракты антитромбина с целью дальнейшей очистки преимущественно подвергают далее ЖХВР с обращенной фазой. Указанные ранее полипептиды получают очисткой выделенных экстрактов с помощью ЖХВР с обращенной фазой. Примерами подходящих соединений для обращенных фаз являются силикагели, модифицированные C2-C18 алифатическими заместителями. Однако полипептиды по настоящему изобретению могут быть очищены другими хорошо известными методами хроматографии. Методики осуществления ЖХВР приведены в примерах. Активность ингибиторов тромбина в экстрактах и отдельных фракциях, получаемых на стадиях очистки, может быть определена in vitro по удлинению времени сгусткообразования (F. Markwardt: Meth. Enz. 1970, vol. 19, p. 924-932) или по ослаблению расщепления тромбинспецифических хромогенных субстратов, таких как ацетат тозил-глицил-пролил-аргинин-4-нитроанилида (Chromozyn T.H. "Boehringer" Мангейм), как это описано в монографии H.U. Bergmeyer: Meth. Enz. Anal., 3rd, Ed., vol. 5, 365-394, 1988.
Как указано ранее, полипептиды по настоящему изобретению пригодны в качестве фармацевтически эффективных соединений при создании фармацевтических композиций и смесей.
Фармацевтические составы по настоящему изобретению необязательно могут содержать дополнительные активные ингредиенты, подобные антикоагулянтам, таким как гирудин или гепарин, или подобные тромболитическим средствам, таким как активатор плазминогена или гементин.
Новые полипептиды и ингибиторы тромбина соответственно по настоящему изобретению могут образовывать фармацевтически приемлемые соли с нетоксичными, органическими или неорганическими кислотами. Неорганическими кислотами являются, например, соляная, бромистоводородная, серная или фосфорная кислота и кислые соли металлов, такие как моногидрофосфат натрия и гидросульфат калия. Примерами органических кислот являются моно-, ди- и трикарбоновые кислоты, такие как уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная, салициловая кислоты и сульфокислоты, такие как метансульфокислота. Соли остатка C-концевой аминокислоты могут включать нетоксичные соли карбоновых кислот, образованные с любыми подходящими неорганическими или органическими основаниями. Указанные соли включают, например, соли щелочных металлов, таких как натрий и калий, соли щелочноземельных металлов группы IIIA, включая алюминий, и соли органических первичных, вторичных и третичных аминов, таких как триалкиламины, в том числе триэтиламин, прокаин, дибензиламин, 1-этенамин, N,N-дибензилэтиламин-диамин, дигиброабиетиламин и N-алкилпиперидин.
Термин "фармацевтически приемлемый носитель" означает в данном случае инертный, нетоксичный твердый или жидкий наполнитель, разбавитель или материал для инкапсулирования, которые не вступают в нежелательное взаимодействие с активным соединением или не оказывают вредного воздействия на пациента. Подходящими, преимущественно жидкими носителями, хорошо известными из области техники, являются такие, как стерильная вода, солевой раствор, водный раствор декстрозы, растворы сахаров, этанол, гликоли и масла, в том числе получаемые из нефти и масла растительного, животного происхождения и синтетические масла, например, арахисовое масло, соевое масло и минеральное масло.
Составы по настоящему изобретению могут назначаться в виде стандартных доз, содержащих нетоксичные фармацевтически приемлемые носители, разбавители, вспомогательные соединения и наполнители, которые типичны для парентерального назначения.
Tермин "парентеральный" включает в данном случае подкожные, внутривенные, внутрисуставные и внутритрахейные инъекции и вливания. Пригодны и другие способы назначения, такие как оральное назначение и местное назначение. Парентеральные композиции и сочетания наиболее предпочтительно вводятся внутривенно как в виде болюсов, так и путем постоянного вливания с использованием известных методов.
Таблетки и капсулы для орального назначения содержат обычные вспомогательные соединения, такие как связующие, наполнители, разбавители, таблетирующие средства, смазывающие средства, разрыхлители и смачивающие средства. Таблетки могут быть покрыты с помощью методов, хорошо известных из области техники.
Жидкие составы для орального назначения могут быть приготовлены в виде водных или масляных суспензий, растворов, эмульсий, сиропов или элексиров или приготовлены в виде сухих продуктов, которые растворяют перед употреблением в воде и в другом подходящем носителе. Указанные жидкие препараты могут содержать обычные добавки, такие как суспендирующие средства, эмульгаторы, неводные носители и консерванты.
Составы для местного назначения могут быть в виде водных или масляных суспензий, растворов, эмульсий, желе или предпочтительно мазей в форме эмульсии.
Стандартные дозы в соответствии с настоящим изобретением могут содержать суточную дозу белка по настоящему изобретению или ее дольные единицы с тем, чтобы получить требуемую дозу. Оптимальная терапевтически приемлемая доза и интенсивность приема лекарства для данного пациента (млекопитающего, в том числе человека) зависит от ряда факторов, таких как активность конкретно применяемого активного соединения, возраста, веса тела, общего состояния здоровья, пола пациента, диеты, времени и пути введения, коэффициента очищения крови, поставленной цели лечения, т.е. терапии или профилактики, и природы тромботического заболевания, которое лечат, антитромбоцитарной и антикоагуляционной активности.
Поэтому в композициях или составах, полезных в качестве антикоагулянтов при лечении больного (в условиях in vivo) фармацевтически эффективная доза пептида по настоящему изобретению составляет приблизительно от 0,01 до 100 мг/кг веса тела, преимущественно от 0,1 до 10 мг/мг веса тела. В соответствии с изобретением одна стандартная доза может содержать от 0,5 до 10 мг ингибитора тромбина. Для достижения антикоагуляционного эффекта в экстракорпоральнной крови фармацевтически активное количество пептида по изобретению составляет от 0,2 до 150 мг/л, преимущественно от 1 до 20 мг/л экстракорпоральной крови.
Целью настоящего изобретения является также имплантируемое или размещаемое вне тела медицинское устройство, контактирующее с жидкостями организма, поверхность которого для придания ей достаточной тромборезистентности покрыта иммобилизованным полипептидом, указанным ранее и в формуле изобретения. Полипептид по настоящему изобретению иммобилизуют на медицинское устройство с целью придания поверхности свойства биосовместимости и тромборезистентности. Указанные устройства иногда имеют смачиваемые поверхности, которые вызывают агрегирование тромбоцитов, что является нежелательным, если указанные устройства предназначены для использования в имплантируемом и экстракорпоральном устройстве, контактирующем с кровью или другими жидкостями организма. Примерами подобных устройств, которые обычно изготавливают из пластмасс и синтетических волокон, являются протезы, искусственные органы, шовные материалы, сегменты искусственных сосудов, катетеры, диализаторы, трубки и сосуды для хранения крови.
Настоящее изобретение далее иллюстрируется следующими примерами, которые приведены лишь для пояснения изобретения и не лимитируют объем притязаний по настоящему изобретению.
Пример 1. Доказательство присутствия антитромбина в T. tessulatum.
Головы Theromyzon tessulatum гомогенизируют в изотоническом солевом растворе. Гомогенизат в течение короткого времени центрифугируют для удаления частичек веществ и жидкость над осадком сохраняют для проведения следующего антитромбинового анализа и для указанных гематологических испытаний.
Для оценки антитромбиновой активности 20 мкл указанного выше экстракта смешивают с 10 мкл тромбина (1 ед.). К этой смеси приливают 100 мкл раствора, содержащего 0,5 мг/мл фибриногена, перемешивают и на 1 мин помещают в инкубатор с температурой 37oC.
Дальнейшие детали осуществления этого теста описаны Р.Т. Сойером и др. (Comp. Haematol. Int., 1991, vol. 1, p. 35-41). В таблице 1 подытожены сведения об ингибировании параметров сгусткообразования в условиях in vitro с использованием неочищенных экстрактов, полученных из Theromyzon tessulatum.
Как видно из данных таблицы 1, область головы Theromyzon tessulatum содержит растворимый в воде фактор или факторы, которые значительно увеличивают время сгусткообразования тромбина.
Пример 2. Хромогенный анализ на ингибирование тромбина и фактора Xa.
а) Ингибирование тромбина.
20 мкл раствора тромбина (5 ед. ) Национального института здоровья (NIH-U) тромбина/мл в 20 мМ фосфатном буфере с pH 6,5, содержащем 0,05% полиэтиленгликоля (ПЭГ) 6000, предварительно выдерживают при комнатной температуре в течение 5 мин в инкубаторе вместе с 880 мкл буферного раствора для проведения анализа на тромбин (100 мМ Tris-HCl, 200 мМ NaCl, 0,05% ПЭГ с pH 8,3) в фотометрической кювете. Инициируют реакцию добавлением 100 мкл раствора субстрата (4 мг Chromozym TH от фирмы "Boehringer", Мангейм, Германия, растворенного в 5 мл воды) и определяют поглощение через каждые 30 с при 25oC на длине волны 405 нм в течение 5 мин.
Для оценки активности ингибирования образцы или гирудин в качестве стандарта в количестве 10 - 200 мкл смешивают с 20 мкл раствора тромбина и доводят общий объем до 900 мкл с помощью буферного раствора для анализа. Полученную смесь предварительно выдерживают в инкубаторе при комнатной температуре в течение 5 мин и инициируют реакцию добавлением 100 мкл раствора субстрата.
б) Ингибирование активности фактора Xa.
20 мкл раствора фактора Ха (10 ед./0,5 мл разбавляют водой до объема 2,0 мл) предварительно выдерживают при комнатной температуре в течение 5 мин в инкубаторе вместе с 880 мкл буферного раствора для проведения анализа на фактор Ха (100 мМ Tris-HCl, 200 мМ NaCl, 0,05% ПЭГ с pH 8,3) в фотометрической кювете. Инициируют реакцию добавлением 100 мкл раствора субстрата (3,5 мг Chromozym X от фирмы "Boehringer", Мангейм, растворенного в 5 мл воды) и определяют поглощение через каждые 30 с, при 25oC на длине волны 405 нм в течение 5 мин.
Для оценки активности ингибирования образцы или гирудин в качестве стандарта в количестве 10 - 200 мкл смешивают с 20 мкл раствора фактора Xa и доводят общий объем до 900 мкл с помощью буферного раствора для анализа. Полученную смесь предварительно выдерживают в инкубаторе при комнатной температуре в течение 5 мин и инициируют реакцию добавлением 100 мкл раствора субстрата.
Пример 3. Очистка ингибитора тромбина из Theromyzon tessulatum с помощью аффинной хроматографии.
Стадия 1.
Первые третьи части от 1000 откормленных второсортных Theromyzon tessulatum быстро замораживают при температуре минус 70oC и подвергают сублимационной сушке. К полученному материалу добавляют 40%-ный водный раствор ацетона и гомогенизуют суспензию ультратораксом трижды по 10 с. Вслед за двухминутной обработкой ультразвуком в гомогенизаторе следует еще одна стадия гомогенизации (30 с). Гомогенизат центрифугируют в течение 15 мин со скоростью 6000 об/мин и полученную жидкость над осадком сохраняют (SI).
К таблетке 1 добавляют еще 35 мл 40%-ного ацетона и проводят вторую гомогенизацию (1 x 10 с; 2 мин гомогенизации ультразвуком; 1 x 30 с). Гомогенизат опять центрифугируют в течение 15 мин со скоростью 6000 об/мин. Жидкость над осадком 2 добавляют к жидкости над осадком 1, и к объединенным растворам добавляют 80%-ный ацетон (об/об).
Доводят pH до 4,0 с помощью уксусной кислоты и полученную суспензию центрифугируют в течение 20 мин со скоростью 6000 об/мин. Таблетку 3 отделяют. Жидкость над осадком 3 упаривают в 4 раза с помощью ротационного испарителя (фирмы "Speed Vac.").
Свободный от ацетона экстракт испытывают на антитромбиновую активность по анализу сгусткообразования в соответствии с примером 1, а также по хромогенному анализу в соответствии с примером 2.
Стадия 2.
Свободный от ацетона экстракт помещают в колонку PD-10 (от фирмы "Pharmacia") для замены буфера. Колонку уравнивают аффинным буфером (20 мМ Tris-HCl, 50 мМ HCl с pH 7,4) и в колонку помещают 2,5 мл экстракта со стадии 1. Элюaт анализируют на антитромбиновую активность.
Тромбиновую аффинную колонку готовят следующим образом: 400 мг сухой матрицы Azlacton Tentacle Fractogel ("E. Meck", Дармштадт, Германия) суспендируют в 7 мл буфера для связывания (50 мМ фосфата, 150 мМ NaCl с pH 7,5) при комнатной температуре в течение 2 ч. Суспензию дважды промывают центрифугированием и ресуспендированием в буфере для связывания. 5000 NIH-U бычьего тромбина ("Sigma") растворяют в 1 мл воды и доводят pH до 7,5. Полученный раствор тромбина уравнивают буфером для связывания с помощью колонки PD-10 для гельпроникающей хроматографии. К уравновешенному раствору тромбина добавляют сульфат натрия до конечной концентрации 1 М. Тромбиновый белок быстро вносят пипеткой в активированную матрицу геля и дают возможность связываться при 4oC в течение 3 ч, при медленном перемешивании. Промывают трижды пятикратным объемом буфера для связывания. Для дезактивации матрицы добавляют 1,5 мл этаноламина и оставляют при 4oC на ночь, слегка встряхивая. Промывают матрицу дважды пятикратным объемом ацетатного буфера (100 мМ ацетата натрия, 50 мМ хлорида натрия с pH 4,0). Заключительное уравнивание проводят, дважды промывая пятикратным объемом аффинного буфера.
Активные элюаты из колонки P-10 подают в аффинную колонку с помощью перистальтического насоса (поток 10 мл/мин). Несвязанную фракцию собирают и промывают колонку 12 мл аффинного буфера (промывка 1). Элюирование проводят 6 мл ацетатного буфера с pH 4,0 и собирают фракции объемом 0,5 мл. Профиль элюирования этой колонки представлен на фиг. 1.
За первым элюированием следует второе с использованием 6 мл ацетатного буфера с pH 3,0. Собирают фракции по 1,5 мл. Колонку вновь уравновешивают с помощью 25 мл аффинного буфера.
Результаты стадии экстракции и аффинной хроматографии суммированы в таблице 2.
Пример 4. Анализ активного ингибитора тромбина из Theromyzon tessulatum с помощью гельпроникающей хроматографии.
Активное вещество помещают в колонку Bigel P4 ("Biorad") объемом 25 мл. Элюирование проводят 20 мМ Tris-HCl, 50 мМ NaCl с pH 7,4 со скоростью подачи реагентов 4 мл/ч. На антитромбиновую активность исследуют фракции объемом 1 мл.
Гель-матрица P4 имеет предел разделения 5000 Да и позволяет проводить фракционирование в интервале молекулярных весов от 1000 до 5000 Да. Неожиданно было обнаружено, что антитромбиновая активность элюируется в фракционируемый объем, т.е. очевидно имеет молекулярный вес меньше 5000 Да (фиг. 2). Такое поведение отличается от гирудина (молекулярный вес 7000 Да), который в тех же условиях остается в отделяемом объеме. Путем калибрования колонки P4 для антитромбической активности из Theromyzon tessulatum был получен молекулярный вес приблизительно 3000 Да.
Пример 5. ЖХВР с обращенной фазой ингибитора тромбина из Theromyzon tessulatum.
Активные элюаты после стадии аффинной хроматографии по примеру 3 далее анализируют методом ЖХВР с обращенной фазой. 20 мкл образца инжектируют в колонку ЖХВР (Li Chrospher 300 RP-18, 5 мкм; "E. Merck", Дармштадт, Германия) и градиентно элюируют в следующих ацетонитрильных растворах со скоростью подачи реагентов 1,0 мл/мин:
Буфер А: 0,1% трифторуксусной кислоты в воде.
Буфер Б: 0,08% трифторуксусной кислоты в ацетонитриле.
Градиент:
0 - 2 мин 10% Б;
2 - 3 мин инжекция;
3 - 28 мин 60% В.
На фиг. 3 показана типичная аналитическая хроматография, записанная на длине волны 220 нм. Активность ингибитора тромбина обнаруживается в пиках, обозначенных пик 2 и пик 4. Информацию, полученную с помощью аналитической ЖХВР, используют для проведения препаративного разделения в тех же самых условиях.
Препаративную очистку проводят, используя аликвоты 500 мкл после аффинной хроматографии (фиг. 4). Отбирают индивидуальные пики, элюируют и упаривают на ротационном испарителе Speed Vac. Упаренные фракции вновь растворяют в воде и анализируют на антитромбиновую активность в тесте по времени сгусткообразования, а также в хромогенном тесте, приведенном в примере 2.
Наибольшая активность в обеих системах обнаружена у пиков 2 и 4, некоторая активность обнаруживается в пике 5, что, вероятнее всего, свидетельствует о загрязнении пика 5 соединенном пика 4. Все другие пики на хроматограмме вовсе не проявляют антитромбиновой активности. Суммарная активность пиков 2 и 4 соответствует приблизительно 93% общей активности.
Пример 6. Сравнение ингибитора тромбина по настоящему изобретению с гирудином методами ЖХВР.
Чтобы привести дальнейшие доказательства того, что ингибитор по настоящему изобретению является молекулой, принципиально отличной от гирудина, проводят следующий эксперимент. К активному пику 2 после ЖХВР в соответствии с примером 5 добавляют аналогичную белковую концентрацию очищенного гирудина и подвергают смесь ЖХВР с обращенной фазой в градиенте ацетонтрила (40 - 70%). Обнаружены два пика, которые содержат антитромбиновую активность (фиг. 5). С помощью сравнительных экспериментов, в которых вводят индивидуальные ингибиторы, проводят отнесение пиков, как это показано на фиг. 5.
На фиг. 5 очевидно, что антитромбин по настоящему изобретению элюируется совершенно отлично от гирудина. То же самое может быть показано для активного пика 4 после разделения методом ЖХВР по примеру 5.
Пример 7. Дальнейшее изучение пика 2 антитромбиновой активностью.
Чистота.
Элюированный активный пик 2 после ЖХВР с обращенной фазой подвергают повторной хроматографии в тех же условиях, что и приведенные на фиг. 3. Как показано на фиг. 6, от основного активного пика может быть отделено небольшое количество примесного соединения, в итоге после повторной ЖХВР с обращенной фазой получают гомогенный препарат (см. также фиг. 8, на которой представлены данные капиллярного электрофореза указанной фракции).
Ингибирование тромбина.
Пик 4 после ЖХВР с обращенной фазой проявляет активность и в анализе на сгусткообразование (время тромбина > 600 с/5 мл) и в хромогенном антитромбиновом анализе по примеру 2. Активность в последнем тесте составляет 3,2 межд.ед./250 мкл. Ингибиторная активность фактора Xa, определяемая по примеру 2, в пике 2 не обнаруживается, что свидетельствует о том, что максимальная антифактор Xa активность составляет << 1% от антитромбиновой активности. На этом основании можно заключить, что описанный здесь ингибитор является весьма специфичным по отношению к тромбину.
Титрование активных участков.
Константу ингибитора по отношению к тромбину определяют спектрофотометрическим титрованием стандартизированного раствора тромбина ингибитором по настоящему изобретению. Подробности метода описаны в публикации G.W. Jameson et. al.; Biochem. J. 1973, vol. 131, p. 107 - 117.
Если коротко, то в эксперименте по титрованию используют флуорогенный субстрат Tos-Gly-Pro-Arg-AMC с концентрацией 50 мМ. Анализ проводят в 100 мМ Tr-HCl, 200 мМ NaCl, 0,05% ПЭГ 6000 с pH 7,8 при 25oC. Титрованный альфа-тромбин человека с концентрацией активных участков 20 пМ выдерживают в инкубаторе вместе с ингибитором при 0,2 - 5% Eo в течение 10 мин и определяют постоянные скорости после добавления субстрата. Кинетические константы рассчитывают, используя программу нелинейного регрессивного анализа GraFit Стейнз, Великобритания, 1980). Найдено, что Ki составляет 178 фeмтомолей.
Молекулярный вес.
Молекулярный вес активного пика 2 определяют с помощью масс-спектрометрии с лазерной десорбцией, используя метод MALDI-TOF (Kratos). 0,5 мкл образца смешивают с небольшим количеством дигидроксибензойной кислоты в ацетонитриле, которая служит матрицей. Смесь высушивают холодным воздухом на поверхности серебряного прободержателя и помещают в прибор. Полученный масс-спектр калибруют по стандартным белкам с известным молекулярным весом. Пик соответствует молекулярной массе около 9000 Да (фиг. 7).
Изоэлектрофокусировка.
Изоэлектрическую точку ингибитора определяют методом капиллярного электрофореза в режиме изоэлектрофокусировки ("Applied Biosystems"). Как видно из фиг. 8, пик ингибитора появляется при значении 4,9, если сравнивать со стандартными белками.
Пример 8. Данные о последовательности пика 2 с антитромбиновой активностью
Используя ЖХВР с обращенной фазой (пример 5), для пика 2 методом химического разложения по Эдману в белковом секвенторе фирмы "Beckman" получают следующую N-концевую последовательность: Gly Asp Asp Asn Pro Gly Pro Pro Arg Ala Cys Pro Gly Glu
Пример 9. Дальнейшее изучение пика 4 с антитромбиновой активностью.
Чистота.
Элюированный активный пик 4 после ЖХВР с обращенной фазой подвергают повторной хроматографии в тех же условиях, Как показано на фиг. 9, от основного активного пика может быть отделено небольшое количество примесного соединения, и в итоге после повторной ЖХВР с обращенной фазой получают гомогенный препарат.
Ингибирование тромбина.
Пик 4 после ЖХВР с обращенной фазой проявляет активность и в анализе на сгусткообразование (время тромбина > 600 с/5 мл), и в хромогенном антибромбиновом анализе по примеру 2. Активность в последнем тесте составляет 1,3 межд.ед./250 мкл. Ингибиторная активность фактора Xa, определяемая по примеру 2, в пике 4 не обнаруживается, что свидетельствует о том, что максимальная антифактор Xa активность составляет << 1% от антитромбиновой активности. На этом основании можно заключить, что описанный здесь ингибитор является весьма специфичным по отношению к тромбину.
Титрование активных участков.
Константу ингибитора по отношению к тромбину определяют спектрофотометрическим титрованием стандартизированного раствора тромбина ингибитором по настоящему изобретению. Подробности метода описаны в примере 7. Найдено, что Ki составляет 240 фемтомолей.
Молекулярный вес.
Молекулярный вес активного пика 4 определяют с помощью масс-спектрометрии с лазерной десорбцией, используя метод MALDI-TOF (Kratos), как описано в примере 7. Полученный масс-спектр калибруют по стандартным белкам с известным молекулярным весом. Пик соответствует молекулярной массе около 14 кДа (фиг. 10).
Пример 10. Данные о последовательности пика 4 с антитромбиновой активностью.
Используя ЖХВР с обращенной фазой (пример 5), для пика 4 методом химического разложения по Эдману в белковом секвенторе фирмы "Beckman" получают следующую N-концевую последовательность: Ser Glu Leu Gly Gln Ser Cys Ser Lys Glu Asn Pro Cys Pro Ser Asn Met Lys Cys Asn Arg Glu Thr Phe Lys
Пример 11.
Используя те же методики, что и приведенные в примерах 1 - 5, можно выделить антитромбиновую активность из следующих видов Theromyzon:
T. binannulatum,
T. cooperi,
T. garjaewi,
T. maculosum,
T. sexoculatum.
Изобретение относится к новым полипептидам, обладающим антитромбиновой активностью, которые получают из тканей или секреций пиявок отряда Rhynchobdellida преимущественно вида Theromyzon tessulatum. Полипептиды имеют молекулярный вес около 14 кДа, 9 кДа и могут использоваться в фармацевтических композициях для лечения расстройств и состояний, вызываемых тромбозом. Технический результат: расширение арсенала соединений - ингибиторов тромбина. 4 с. и 6 з.п. ф-лы, 10 ил., 2 табл.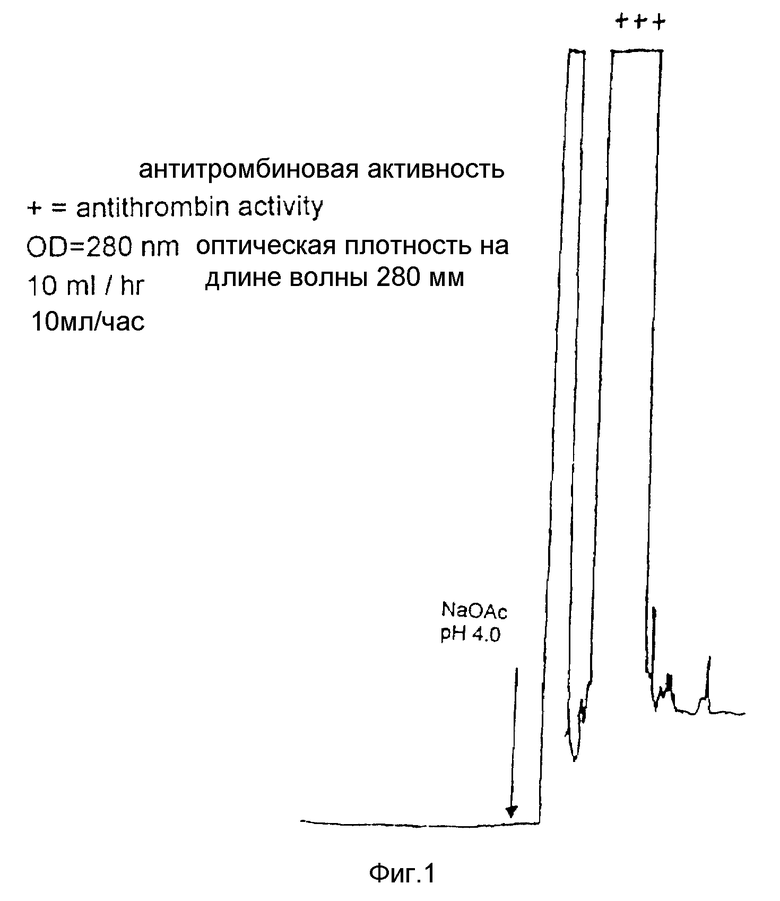
| US 3432596, 11.03.69 | |||
| КРУТИЛЬНАЯ МАШИНА | 0 |
|
SU347376A1 |
Авторы
Даты
1999-09-27—Публикация
1994-05-03—Подача