Уровень техники изобретения
[0001] 1. Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к области полипептидов; более конкретно, к полипептиду, содержащему антифибриновое антитело и фрагмент сериновой протеазы тканевого активатора плазминогена человека (hu-tPA), а также к его применению при лечении тромбоза.
[0003] 2. Описание предшествующего уровня техники
[0004] Свертывание крови (или коагуляция) представляет собой сложный процесс, посредством которого кровь образует тромб. Коагуляция включает в себя каскад катализируемых протеазой событий, которые последовательно усиливаются. На более поздних этапах фактор Xa расщепляет протромбин с образованием тромбина, а тромбин, в свою очередь, расщепляет фибриноген до фибрина, который в сочетании с тромбоцитами образует сеть сгустка (тромба). В растворении тромба принимает участие плазмин, который вырабатывается из плазминогена с помощью одного из нескольких ферментов, в том числе тканевого активатора плазминогена.
[0005] Тромбоз представляет собой нарушение свертывания крови, при котором сгусток крови (или тромб) блокирует кровеносный сосуд и, следовательно, препятствует кровотоку в пораженной области. Пациенты, страдающие различными осложнениями (например, вызванными сердечно-сосудистыми, эндокринными или другими нарушениями регуляции организма, хирургическим вмешательством, применением лекарств и др.), имеют предрасположенность к формированию таких патологических тромбов. Эти тромбы могут вызвать геморрагический инсульт, повреждение головы, инфаркт миокарда, тромбоэмболию легочной артерии или тромбоз глубоких вен, что часто приводит к серьезным, опасным для жизни клиническим состояниям.
[0006] Существует два основных аспекта фармацевтических потребностей в решении таких патологических проблем свертывания крови: один аспект заключается в предотвращении или подавлении образования или увеличения размера патологических тромбов после образования ядра тромба, а другой аспект заключается в своевременном растворении уже образовавшихся патологических тромбов. В обоих аспектах существуют батареи фармацевтических продуктов, доступных в клинической практике.
[0007] Было разработано и использовано большое количество непрямых ингибиторов фактора Xa. На протяжении многих десятилетий ингибиторами в основном являются гепарин, который представляет собой смесь встречающихся в природе полисахаридов гликозаминогликана с различной молекулярной массой от 5 до 30 кДа, низкомолекулярный гепарин и гепариноидные соединения. Эти вещества связываются с гепарин-связывающими белками, включая антитромбин, что усиливает ингибирующее действие этих веществ на фактора Xa, тем самым подавляя образование тромба. Ингибитор пути тканевого фактора (TFPI), одноцепочечный белок сыворотки крови массой от 34 до 40 кДа в зависимости от степени протеолиза, может ингибировать фактор Xa. Однако он не производится с использованием технологии рекомбинантных ДНК в качестве терапевтического средства.
[0008] Ряд прямых ингибиторов тромбина также был разработан и используется в клинической практике. Выделенный из медицинских пиявок гирудин естественного происхождения и рекомбинантный гирудин, которые связываются с тромбином, использовались в течение многих лет, прежде чем их применение было прекращено из-за появления других более эффективных лекарственных препаратов.
[0009] Совсем недавно несколько малых молекул, которые являются прямыми ингибиторами фактора Xa или тромбина, были разработаны и одобрены для клинического применения для предотвращения коагуляции при некоторых клинических показаниях. В одном наборе клинических применений эти малые молекулы являются прямыми ингибиторами фактора Xa, такими как апиксабан, эдоксабан или ривароксабан. В другом наборе применений эти малые молекулы являются прямыми ингибиторами тромбина, такими как аргатробан или дабигатран. Ксимелагатран, прямой ингибитор тромбина, имеет подходящую кинетику и может вводиться в очень малых дозах; однако он был снят с продажи из-за проблем с гепатотоксичностью.
[0010] Разработка нескольких форм рекомбинантного тканевого активатора плазминогена человека (tPA), включая альтеплазу, ретеплазу, тенектеплазу и ланотеплазу, решила значительную часть проблем тромбоза. Однако использование tPA во многих случаях либо недостаточно для растворения тромбов, либо вызывает серьезное внутреннее кровотечение, либо и то, и другое.
[0011] Молекулярная структура интактного tPA является сложной, поскольку интактный tPA содержит несколько структурных доменов с дискретными функциями или активностями, хотя не все эти домены требуются для получения тромболитического продукта, подходящего для использования при растворении тромбов. Полноразмерная молекула tPA (альтеплаза) с 527 аминокислотными остатками содержит: (i) домен фибронектинового пальца, который связывается с фибрином, (2) домен эпидермального фактора роста, который связывается с гепатоцитами и облегчает клиренс tPA, (3) домен Kringle 1, который связывается с эндотелиальными клетками печени и способствует клиренсу tPA, (4) домен Kringle 2, который связывается с фибрином и активирует сериновую протеазу, и (5) домен протеазы, который расщепляет плазминоген и ингибируется ингибитором активатора плазминогена типа 1 (PAI-1). Альтеплаза, тенектеплаза и ланотеплаза продуцируются в клетках млекопитающих, клетках СНО, а ретеплаза продуцируется в бактериях.
[0012] Ретеплаза, которая имеет длину 355 остатков, не содержит фибронектинового пальца, домена эпидермального фактора роста и домена Kringle 1. Ретеплаза вырабатывается бактериями, поэтому она не содержит посттрансляционной углеводной модификации. Хотя ретеплаза имеет более низкое сродство к фибрину и еe протеаза не активируется в такой степени, как альтеплаза, время полужизни ретеплазы в плазме крови составляет 14-18 минут; напротив, время полужизни альтеплазы в плазме крови составляет всего 3-4 минуты. Ретеплаза вводится пациентам болюсно, а альтеплаза вводится болюсно с последующей инфузией.
[0013] Тенектеплаза имеет полную длину 527 аминокислотных остатков альтеплазы, но она имеет мутации в трех сайтах. Треонин в положении 103 заменен на аспарагин, чтобы позволить модификацию гликозилирования, а аспарагин в положении 117 заменен на глутамин для устранения гликозилирования. Эти мутации ингибируют клиренс молекулы клетками печени. Кроме того, четыре остатка в положениях 296-299 (т.е. лизин-гистидин-аргинин-аргинин) заменены четырьмя остатками аланина, что увеличивает устойчивость к PAI-1 в 80 раз. Время полужизни тенектеплазы в плазме крови составляет 18 минут.
[0014] В ланотеплазе фибронектиновый палец и домен эпидермального фактора роста удалены, а аспарагин в положении 117 заменен глутамином. Время полужизни ланотеплазы в плазме крови увеличивается до 45 минут, что улучшает процедуры введения.
[0015] Клинические исследования, сравнивающие несколько форм рекомбинантного tPA, также очень активны. В различных клинических испытаниях общая терапевтическая эффективность четырех форм tPA примерно одинакова, и каждая из них, по-видимому, лучше других подходит для конкретных клинических состояний. Из большого количества опубликованной литературы по tPA и его вариантам и их медицинскому применению очевидно, что различные свойства tPA, включая аффинность связывания с фибрином, его время полужизни, предрасположенность к разрушению клетками печени и устойчивость к ингибитору активатора плазминогена, все играют роль в обеспечении желаемых свойствах tPA для конкретного клинического состояния.
[0016] Ввиду вышеизложенного, в уровне техники существует потребность в ещe более совершенных продуктах для лечения патологических или обструктивных тромбов.
Сущность изобретения
[0017] Ниже представлено упрощенное изложение сущности настоящего изобретения, чтобы дать читателю базовое понимание этой сущности. Это краткое изложение сущности изобретения не является обширным обзором настоящего изобретения, и оно не идентифицирует ключевые/критические элементы настоящего изобретения или не ограничивает объeм настоящего изобретения. Единственная цель изложения сущности изобретения состоит в том, чтобы представить некоторые концепции, раскрытые в данном документе, в упрощенной форме в качестве вступления к более подробному описанию, которое будет представлено ниже.
[0018] В первом аспекте настоящее изобретение относится к антителу, специфичному к фибрину. В соответствии с различными вариантами осуществления настоящего изобретения антифибриновое антитело специфично в отношении фибрина человека или мыши. Более того, настоящее антифибриновое антитело предпочтительно связывается с полимеризованным нерастворимым фибрином, а не с растворимым фибриногеном. В соответствии с некоторыми вариантами осуществления настоящего изобретения антифибриновое антитело связывается с человеческим фибрином с аффинностью в 10 раз большей, чем с человеческим фибриногеном.
[0019] В некоторых необязательных вариантах осуществления изобретения антифибриновое антитело содержит вариабельный домен легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 1, 17, 19 или 21, и вариабельный домен тяжелой цепи, имеющий аминокислоту последовательность SEQ ID NO: 2, 18, 20 или 22. Например, антифибриновое антитело может представлять собой scFv, имеющий аминокислотную последовательность SEQ ID NO. 3 или 5.
[0020] В соответствии с некоторыми вариантами осуществления настоящего изобретения, антифибриновое антитело содержит шесть определяющих комплементарность областей (CDR), соответственно, имеющих аминокислотные последовательности, соответствующие остаткам с 30 по 32 в SEQ ID NO: 1 (CDR-L1), остаткам с 49 по 54 в SEQ ID NO: 1 (CDR-L2), остаткам с 91 по 96 в SEQ ID NO: 1 (CDR-L3), остаткам с 30 по 33 в SEQ ID NO: 2 (CDR-H1), остаткам с 50 по 59 в SEQ ID NO: 2 (CDR-H2) и остаткам с 98 по 106 в SEQ ID NO: 2 (CDR-H3).
[0021] В соответствии с различными вариантами осуществления настоящего изобретения, антифибриновое антитело представляет собой одноцепочечный вариабельный фрагмент (scFv) или однодоменное антитело (sdAb).
[0022] В других необязательных вариантах осуществления изобретения вариабельный домен легкой цепи и вариабельный домен тяжелой цепи связаны с гидрофильным линкером, имеющим последовательность SEQ ID NO: 16.
[0023] В другом аспекте настоящее изобретение относится к полипептиду, который содержит антифибриновое антитело в соответствии с вышеупомянутым аспектом/вариантам осуществления настоящего изобретения. Как можно понять, способы лечения тромбоза с использованием таких полипептидов также находятся в рамках аспекта настоящего изобретения.
[0024] В соответствии с вариантами осуществления настоящего изобретения полипептид содержит антифибриновое антитело и фрагмент сериновой протеазы активатора плазминогена человека (hu-tPA), где антифибриновое антитело связывается с человеческим фибрином с аффинностью в 10 раз большей, чем с человеческим фибриногеном. Альтернативно или дополнительно полипептид связывается с фибрином человека лучше, чем hu-tPA. Тем не менее, альтернативно или дополнительно, полипептид имеет более длительное время полужизни в сыворотке крови животного, чем ретеплаза.
[0025] В частности, фрагмент сериновой протеазы tPA связан с N- или C-концом антифибринового антитела прямо или опосредованно с помощью связывающей последовательности между ними.
[0026] В соответствии с необязательными вариантами осуществления настоящего изобретения, фрагмент сериновой протеазы hu-tPA представляет собой ретеплазу.
[0027] В некоторых вариантах осуществления изобретения антифибриновое антитело имеет человеческое происхождение или является гуманизированным.
[0028] В соответствии с некоторыми вариантами осуществления настоящего изобретения полипептид имеет аминокислотную последовательность SEQ ID NO. 11 или 12, или 14.
[0029] Многие из сопутствующих признаков и преимуществ настоящего изобретения станут более понятными со ссылкой на следующее подробное описание, рассматриваемое в связи с сопроводительными чертежами.
Краткое описание чертежей
[0030] Настоящее описание будет лучше понято из следующего подробного описания, прочитанного в свете сопроводительных чертежей, где:
[0031] На фиг. 1A показан результат анализа титра фага, отображающего scFv, специфичный по отношению к фибрину человека; На фиг. 1B показан результат твeрдофазного ИФА отдельной колонии фага, отображающего scFv D10, специфичный по отношению к фибрину человека.
[0032] На фиг. 2 показан результат твeрдофазного ИФА очищенных антител 102-10 и 3D5, специфичных по отношению к фибрину человека.
[0033] На фиг. 3 показан результат анализа в SDS-ПААГ очищенной рекомбинантной ретеплазы-(3D5 VL-гибкий линкер-VH scFv α фибрин) и ретеплазы-(102-10 scFv α фибрин).
[0034] На фиг. 4 показан результат анализа в SDS-ПААГ очищенной рекомбинантной ретеплазы-(3D5 VL-218-VH scFv α фибрин).
[0035] На фиг. 5А показан результат анализа в SDS-ПААГ очищенной рекомбинантной ретеплазы-(3D5 scFv), хранившейся в течение трех или шести дней; На фиг. 5B показан результат анализа в SDS-ПААГ очищенной рекомбинантной ретеплазы-(3D5 scFv), хранившейся в течение одного месяца; На фиг. 5C показан результат твeрдофазного ИФА очищенной рекомбинантной ретеплазы-(3D5 scFv), хранившейся в течение трех или шести дней.
[0036] На фиг. 6 показан результат твeрдофазного ИФА полипептидов ретеплазы-(3D5 scFv) на специфичность по отношению к фибрину человека и поперечно-сшитому фибрину, обработанному человеческим фактором XIIIa.
[0037] На фиг. 7 показан результат анализа при помощи твeрдофазного ИФА связывания полипептидов рекомбинантной ретеплазы-(3D5 scFv) с фибрином мыши.
[0038] На фиг. 8 показан результат анализа при помощи твeрдофазного ИФА связывания полипептидов рекомбинантной ретеплазы-(3D5 scFv) с фибрином человека в присутствии свободного фибриногена.
[0039] На фиг. 9 показана тромболитическая активность полипептидов рекомбинантной ретеплазы-(3D5 scFv) в ФСБ или сыворотке человека.
[0040] На фиг. 10 показана тромболитическая активность полипептидов рекомбинантной ретеплазы-(3D5 scFv) при конечной концентрации 1 мМ.
[0041] На фиг. 11 показан нацеливающий эффект полипептидов рекомбинантной ретеплазы-(3D5 scFv).
[0042] На фиг. 12 показана дозозависимая тромболитическая активность рекомбинантной ретеплазы-(3D5 scFv).
[0043] На фиг. 13A-13C показана тромболитическая активность ретеплазы-(3D5 scFv) в отношении тромбов человека.
[0044] На фиг. 14A и 14B показана тромболитическая активность ретеплазы-(3D5 scFv) в отношении тромбов обезьян.
[0045] На фиг. 15 показана столбчатая диаграмма, демонстрирующую аффинность связывания фибрина человека для ретеплазы-(3D5 scFv) и альтеплазы.
[0046] На фиг. 16A и 16B показана тромболитическая активность ретеплазы-(3D5 scFv), ретеплазы и альтеплазы в отношении тромбов человека.
[0047] На фиг. 17A и 17B показана протеолитическая активность ретеплазы-(3D5 scFv) и альтеплазы.
[0048] На фиг. 18A и 18B приведены IVIS-изображения (с инфракрасных датчиков) мышей, получавших ретеплазу-(3D5 scFv) или ретеплазу, а на фиг. 18C приведен линейный график, показывающий нацеливающий эффект ретеплазы-(3D5 scFv).
[0049] На фиг. 19 показаны фармакокинетические профили альтеплазы, ретеплазы и полипептида рекомбинантной ретеплазы-(3D5 scFv).
[0050] На фиг. 20 показаны фармакокинетические профили альтеплазы и полипептида рекомбинантной ретеплазы-(3D5 scFv).
[0051] На фиг. 21A показан результат анализа в SDS-ПААГ очищенного полипептида рекомбинантной ретеплазы-(3D5 VL-(G4S)3-VH scFv α фибрин); На фиг. 21B показан результат анализа при помощи твeрдофазного ИФА связывания полипептида рекомбинантной ретеплазы-(3D5 VL-(G4S)3-VH scFv α фибрин) с фибрином человека.
[0052] На фиг. 22 показана дозозависимая тромболитическая активность полипептидов рекомбинантной ретеплазы-(3D5 scFv) по отношению к тромбу человека.
[0053] В соответствии с общепринятой практикой различные описанные признаки/элементы не показаны в масштабе, а вместо этого изображены для наилучшей иллюстрации конкретных признаков/элементов, относящихся к настоящему изобретению. Кроме того, одинаковые ссылочные позиции и обозначения на различных чертежах используются для обозначения одинаковых элементов/частей, где это возможно.
Описание
[0054] Подробное описание, представленное ниже в связи с прилагаемыми чертежами, приводится, как описание настоящих примеров и не предназначено для представления единственных форм, в которых настоящий пример может быть реализован или использован. В описании излагаются функции примера и последовательность этапов реализации и функционирования примера. Однако одни и те же или эквивалентные функции и последовательности могут быть выполнены с помощью разных примеров.
[0055] Для удобства здесь собраны некоторые термины, используемые в описании, примерах и прилагаемой формуле изобретения. Если здесь не определено иное, то научная и техническая терминология, используемая в настоящем изобретении, имеет то же значение, которые обычно понимается и используется средним специалистом в данной области техники.
[0056] Если иное не следует из контекста, то следует понимать, что термины в единственном числе включают в себя формы множественного числа тех же самых терминов, а термины во множественном числе включают в себя эти термины в единственном числе. В частности, используемые здесь и в формуле изобретения формы единственного числа, включают в себя ссылку на множественное число, если из контекста явно не следует иное. Кроме того, используемые здесь и в формуле изобретения термины «по меньшей мере, один» и «один или несколько» имеют одинаковое значение и включают в себя один, два, три или более. Кроме того, предполагается, что термины «по меньшей мере, один из A, B и C», «по меньшей мере, один из A, B или C» и «по меньшей мере, один из A, B и/или C» используются в данном описании и прилагаемой формуле изобретения для обозначения одного A, одного B, одного C, A и B вместе, B и C вместе, A и C вместе, а также A, B и C вместе.
[0057] Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объeм настоящего изобретения, являются приблизительными, числовые значения, изложенные в конкретных примерах, указаны с максимально возможной точностью. Однако любое числовое значение неизбежно содержит определенные погрешности, неустранимо являющиеся результатом стандартного отклонения, обнаруженного в соответствующих испытательных измерениях. Кроме того, используемый здесь термин «примерно» обычно означает в пределах 10%, 5%, 1% или 0,5% от заданного значения или диапазона. В качестве альтернативы термин «примерно» означает в пределах допустимой стандартной ошибки среднего значения, как это понимает средний специалист в данной области техники. За исключением функциональных/рабочих примеров, или если иное явно не указано, все раскрытые здесь числовые диапазоны, количества, значения и проценты, такие как количества материалов, продолжительность времени, температуры, рабочие условия, соотношения количеств и тому подобное следует понимать как измененные во всех случаях термином «примерно». Соответственно, если не указано иное, то числовые параметры, изложенные в настоящем описании и прилагаемой формуле изобретения, являются приблизительными и могут варьироваться по желанию. По меньшей мере, каждый числовой параметр должен толковаться, по меньшей мере, в свете количества сообщаемых значащих цифр и с применением обычных методов округления. В данном описании диапазоны могут быть выражены как от одной конечной точки до другой конечной точки или между двумя конечными точками. Все раскрытые здесь диапазоны включают в себя конечные точки, если не указано иное.
[0058] Настоящее изобретение в основном относится к антифибриновому антителу и содержащим его полипептидам. В частности, антифибриновое антитело служит нацеливающим элементом (Т) полипептида, который дополнительно содержит эффекторный элемент (Е), и, соответственно, в настоящем описании эти полипептиды иногда называют «Т-Е молекулами», «Т-Е фармацевтическими препаратами» или «Т-Е лекарственными средствами».
[0059] Хотя термины первый, второй, третий и т.д. могут использоваться здесь для описания различных элементов, компонентов, областей и/или разделов, эти элементы (а также компоненты, области и/или разделы) не ограничиваются этими терминами. Кроме того, использование таких порядковых номеров не подразумевает последовательность или порядок, если это явно не следует из контекста. Скорее, эти термины просто используются, чтобы отличить один элемент от другого. Таким образом, первый элемент, обсуждаемый ниже, можно назвать вторым элементом без отступления от идей примеров вариантов осуществления изобретения.
[0060] Здесь термины «связь», «пара» и «конъюгаты» используются взаимозаменяемо для обозначения любых средств соединения двух компонентов либо через прямую связь, либо через опосредованную связь между двумя компонентами.
[0061] Используемый здесь термин «полипептид» относится к полимеру, имеющему, по меньшей мере, два аминокислотных остатка. Обычно полипептид имеет длину от 2 до примерно 200 аминокислотных остатков; предпочтительно от 2 до 50 аминокислотных остатков. Когда в настоящем описании упоминается аминокислотная последовательность, то также подразумеваются L-, D- или бета-аминокислотные варианты этой последовательности. Полипептиды также включают аминокислотные полимеры, в которых один или несколько аминокислотных остатков являются искусственным химическим аналогом соответствующей встречающейся в природе аминокислоты, а также встречающихся в природе аминокислотных полимеров. Кроме того, этот термин применяется к аминокислотам, соединенным пептидной связью или другими «модифицированными связями», например, когда пептидная связь заменена α-сложным эфиром, β-сложным эфиром, тиоамидом, фосфорамидом, карбоматом, гидроксилатом, и тому подобным.
[0062] В некоторых вариантах осуществления изобретения в любой из описанных здесь последовательностей предусмотрены консервативные аминокислотные замены. В различных вариантах осуществления изобретения заменены один, два, три, четыре или пять различных остатков. Термин «консервативная замена» используется для обозначения аминокислотных замен, которые существенно не изменяют активность (например, биологическую или функциональную активность и/или специфичность) молекулы. Обычно консервативные аминокислотные замены включают в себя замену одной аминокислоты на другую аминокислоту с аналогичными химическими свойствами (например, заряд или гидрофобность). Некоторые консервативные замены включают в себя «замены аналогами», когда стандартная аминокислота заменяется нестандартной (например, редкой, синтетической и т.д.) аминокислотой, минимально отличающейся от исходного остатка. Считается, что аналоги аминокислот, полученные синтетическим путем из стандартных аминокислот без существенного изменения структуры исходных аминокислот, являются изомерами или метаболическими предшественниками.
[0063] В некоторых вариантах осуществления изобретения также рассматриваются полипептиды, имеющие, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85 или 90% и более предпочтительно, по меньшей мере, 95 или 98% идентичности по последовательности с любой из описанных здесь последовательностей.
[0064] «Процент (%) идентичности аминокислотной последовательности» по отношению к указанным здесь полипептидным последовательностям определяется как процент полипептидных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной полипептидной последовательности, после выравнивания последовательности и введение пробелов, если необходимо, для достижения максимального процента идентичности последовательностей и без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивание для целей определения процентной идентичности по последовательности может быть проведено различными способами, которые известны специалистам в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего изобретения сравнение последовательностей между двумя полипептидными последовательностями проводили с помощью компьютерной программы Blastp (белок-белок BLAST), предоставленной в режиме онлайн Национальным центром биотехнологической информации (NCBI). Процент идентичности аминокислотной последовательности данной полипептидной последовательности A и данной полипептидной последовательности B (что альтернативно может быть сформулировано как данная полипептидная последовательность A, которая имеет определенную идентичность аминокислотной последовательности с данной полипептидной последовательностью B) рассчитывается по формуле следующим образом:
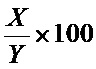 %
%
где X - количество аминокислотных остатков, оцененных программой выравнивания последовательностей BLAST как идентичные совпадения при выравнивании этой программой последовательностей A и B, и где Y - общее количество аминокислотных остатков в последовательности A или B, в зависимости от того, какая из них короче.
[0065] Используемый здесь термин «ПЭГилированная аминокислота» относится к цепи полиэтиленгликоля (ПЭГ) с одной аминогруппой и одной карбоксильной группой. Обычно пегилированная аминокислота имеет формулу NH2-(CH2CH2O)n-COOH. В настоящем изобретении значение n находится в диапазоне от 1 до 20; предпочтительно от 2 до 12.
[0066] Используемый здесь термин «конец» по отношению к полипептиду относится к аминокислотному остатку на N- или C-конце полипептида. Что касается полимера, то термин «конец» относится к структурной единице полимера (например, полиэтиленгликоля в настоящем изобретении), которая расположена на конце основной цепи полимера. В настоящем описании и формуле изобретения термин «свободный конец» используется для обозначения концевого аминокислотного остатка или структурной единицы, не связанной химически с какой-либо другой молекулой.
[0067] В настоящем описании и формуле изобретения термин «антитело» используется в самом широком смысле и охватывает полностью собранные антитела, фрагменты антител, которые связываются с антигенами, такие как антигенсвязывающий фрагмент (Fab/Fab'), фрагмент F(ab')2 (имеющий две антигенсвязывающие Fab-части, связанные вместе дисульфидными связями), вариабельный фрагмент (Fv), одноцепочечный вариабельный фрагмент (scFv), биспецифичный одноцепочечный вариабельный фрагмент (bi-scFv), однодоменный антитела (sdAb), нанотела, единичные антитела и диатела. «Фрагменты антитела» включают в себя часть интактного антитела, предпочтительно антигенсвязывающую область или вариабельный домен интактного антитела. Как правило, термин «антитело» относится к белку, состоящему из одного или нескольких полипептидов, в основном кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Хорошо известные гены иммуноглобулинов включают в себя гены константных областей каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельных доменов иммуноглобулинов. Легкие цепи классифицируются как каппа или лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, которые, в свою очередь, определяют классы иммуноглобулинов: IgG, IgM, IgA, IgD и IgE, соответственно. Известно, что типичная структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну «легкую» цепь (примерно 25 кДа) и одну «тяжелую» цепь (примерно 50-70 кДа). N-конец каждой цепи определяет вариабельный домен из примерно 100-110 или более аминокислот, в первую очередь ответственных за распознавание антигена. Термины «вариабельный домен легкой цепи (VL)» и «вариабельный домен тяжелой цепи (VH)» относятся к этим легким и тяжелым цепям, соответственно. В соответствии с вариантами осуществления настоящего изобретения фрагмент антитела может быть получен путем модификации природного антитела или путем синтеза de novo с использованием технологий рекомбинантных ДНК. В некоторых вариантах осуществления настоящего изобретения антитело и/или фрагмент антитела могут быть биспецифичными и могут иметь различные конфигурации. Например, биспецифичные антитела могут содержать два разных антигенсвязывающих сайта (вариабельные домены). В различных вариантах осуществления изобретения биспецифичные антитела могут быть получены гибридомным методом или при помощи технологии рекомбинантных ДНК. В некоторых вариантах осуществления изобретения биспецифичные антитела обладают специфичностями связывания, по меньшей мере, с двумя разными эпитопами.
[0068] Используемый здесь термин «специфично связывается» относится к способности антитела или его антигенсвязывающего фрагмента связываться с антигеном с константой диссоциации (Kd) не более чем примерно 1 × 10-6 M, 1 × 10–7 M, 1 × 10–8 M, 1 × 10–9 M, 1 × 10–10 M, 1 × 10–11 M, 1 × 10–12 M и/или связываться с антигеном с аффинностью, по меньшей мере, в два раза превышающей его аффинность к неспецифичному антигену.
[0069] Используемый здесь термин «лечение» включает в себя превентивное (например, профилактическое), лечебное или паллиативное лечение; и используемый здесь термин «лечить» также включает в себя превентивное (например, профилактическое), лечебное или паллиативное лечение. В частности, используемый здесь термин «лечение» относится к применению или введению настоящего полипептида или содержащей его фармацевтической композиции субъекту, у которого есть патологическое состояние (например, тромбоз) или симптом, связанный с этим патологическим состоянием, заболевание или нарушение, вторичное по отношению к этому патологическому состоянию, или предрасположенность к этому патологическому состоянию, с целью частично или полностью облегчить, ослабить, купировать, отсрочить начало, подавить прогрессирование, уменьшить тяжесть и/или снизить частоту возникновения одного или несколько симптомов или признаков указанного конкретного заболевания, нарушения и/или патологического состояния. Лечение может быть проведено субъекту, у которого нет признаков заболевания, нарушения и/или патологического состояния, и/или субъекту, у которого проявляются только ранние признаки заболевания, нарушения и/или патологического состояния, с целью уменьшения риска развития патологии, связанной с заболеванием, нарушением и/или патологическим состоянием.
[0070] Используемый здесь термин «эффективное количество» относится к количеству настоящего полипептида, которое достаточно для получения желаемого терапевтического ответа. Эффективное количество агента не требуется для лечения заболевания или состояния, но обеспечивает лечение заболевания или состояния, так что начало заболевания или состояния задерживается, затрудняется или предотвращается, или симптомы заболевания или состояния улучшаются. Эффективное количество может быть разделено на одну, две или более доз в подходящей форме для введения один, два или более раз в течение обозначенного периода времени. Конкретное эффективное или достаточное количество будет варьироваться в зависимости от таких факторов, как конкретное состояние, подлежащее лечению, физическое состояние пациента (например, масса тела, возраст или пол пациента), тип пациента, которого лечат, продолжительность лечения, характер сопутствующей терапии (если таковая имеется), а также конкретных используемых препаратов и структуры соединений или их производных. Эффективное количество может быть выражено, например, как общая масса активного компонента (например, в граммах, миллиграммах или микрограммах) или как отношение массы активного компонента к массе тела, например, как миллиграммы на килограмм (мг/кг).
[0071] Термины «применение» и «введение» используются здесь взаимозаменяемо для обозначения применения полипептида или фармацевтической композиции настоящего изобретения к субъекту, нуждающемуся в лечении ими.
[0072] Термины «субъект» и «пациент» используются здесь взаимозаменяемо и предназначены для обозначения животного, включая человеческий вид, которое поддается лечению полипептидом, фармацевтической композицией и/или способом настоящего изобретения. Термин «субъект» или «пациент» предназначен для обозначения как мужского, так и женского пола, если конкретно не указан один пол. Соответственно, термин «субъект» или «пациент» включает в себя любое млекопитающее, которому может быть полезен способ лечения настоящего изобретения. Примеры «субъекта» или «пациента» включают в себя без ограничений человека, крысу, мышь, морскую свинку, обезьяну, свинью, козу, корову, лошадь, собаку, кошку, птицу и домашнюю птицу. В примере варианта осуществления изобретения пациентом является человек. Термин «млекопитающее» относится ко всем членам класса Mammalia, включая людей, приматов, домашних и сельскохозяйственных животных, таких как кролик, свинья, овца и крупный рогатый скот; а также животных из зоопарков, спортивных животных или животных-компаньонов; и грызунов, таких как мышь и крыса. Термин «не являющееся человеком млекопитающее» относится ко всем членам класса Mamalis, кроме человека.
[0073] Настоящее изобретение основано, по меньшей мере, на идентификации антифибринового антитела, которое избирательно связывается с фибрином (в частности, с фибриновым сгустком), а не с фибриногеном. В соответствии с некоторыми вариантами осуществления настоящего изобретения антифибриновое антитело связывается с человеческим фибрином с аффинностью в 10 раз большей, чем с человеческим фибриногеном. По существу, настоящее антифибриновое антитело может служить в качестве нацеливающего элемента для построения Т-Е молекулы, которая локализуется вблизи фибринового сгустка. С другой стороны, Т-Е молекула содержит один или несколько эффекторных элементов, таких как те, которые способны разрушать патологические тромбы крови. Таким образом, фармацевтические T-E препараты могут доставляться к клеткам-мишеням, тканям или органам-мишеням в увеличенных пропорциях по сравнению с системой кровообращения, лимфоидной системой и другими клетками, тканями или органами. Когда это достигается, терапевтический эффект фармацевтических препаратов увеличивается, а объeм и тяжесть побочных эффектов и токсичность уменьшаются. Также возможно, что терапевтический эффектор вводится в более низкой дозировке в форме Т-Е молекулы, чем в форме без нацеливающего компонента. Следовательно, терапевтический эффектор можно вводить в более низких дозах без потери активности, при этом снижая побочные эффекты и токсичность.
[0074] Ввиду вышеизложенного, в одном аспект настоящее изобретение относится к антифибриновому антителу, которое может отличать фибриновые сгустки от фибриногена. Хотя были получены другие антифибриновые антитела, ни одно из них не позволяет различить фибриновые сгустки и фибриноген в достаточной степени для клинического применения. Следовательно, получение моноклонального антитела, которое может отличить фибриновый сгусток от фибриногена, является крупным прорывом в разработке фармацевтических T-E препаратов, нацеленных на патологические тромбы крови.
[0075] В соответствии с вариантами осуществления настоящего изобретения, антифибриновое антитело содержит вариабельный домен легкой цепи (VL) и вариабельный домен тяжелой цепи (VH), соответственно, имеющие аминокислотную последовательность SEQ ID NO: 1 и 2, SEQ ID NO: 17 и 18, SEQ ID NO: 19 и 20 или SEQ ID NO: 21 и 22. В соответствии с некоторыми вариантами осуществления изобретения, домен VL и домен VH, соответственно, содержат три определяющие комплементарность области (CDR). В частности, CDR-L1, CDR-L2 и CDR-L3 настоящего антифибринового антитела имеют аминокислотные последовательности, соответствующие остаткам 30-32, остаткам 49-54 и остаткам 91-96 SEQ ID NO: 1, соответственно. Кроме того, CDR-H1, CDR-H2 и CDR-H3 настоящего антифибринового антитела имеют аминокислотные последовательности, соответствующие остаткам 30-33, остаткам 50-59 и остаткам 98-106 SEQ ID NO: 2, соответственно.
[0076] В соответствии с различными вариантами осуществления настоящего изобретения, антифибриновое антитело может представлять собой интактное антитело или фрагмент антитела, который содержит антигенсвязывающую область или вариабельный домен (например, вышеупомянутые CDR). Например, антитело может быть представлено как одноцепочечный вариабельный фрагмент (scFv) или однодоменное антитело (sdAb). Однако настоящее изобретение этим не ограничивается.
[0077] В некоторых необязательных вариантах осуществления изобретения антифибриновое антитело содержит вариабельный домен легкой цепи, имеющий аминокислотную последовательность SEQ ID NO: 1, и вариабельный домен тяжелой цепи, имеющий аминокислотную последовательность SEQ ID NO: 2.
[0078] В соответствии с некоторыми необязательными вариантами осуществления настоящего изобретения линкерная последовательность расположена между последовательностями VL и VH или VH и VL так, чтобы увеличить время полужизни и/или аффинность связывания настоящего scFv. Например, линкерная последовательность может быть гидрофильной последовательностью. В некоторых необязательных вариантах осуществления изобретения антифибриновое антитело может представлять собой scFv, имеющий аминокислотные последовательности SEQ ID NO: 3 или 5.
[0079] В другом аспекте настоящее изобретение относится к полипептиду. В частности, полипептид представляет собой лекарственный Т-Е препарат, который содержит нацеливающий элемент (например, антифибриновое антитело в соответствии с вышеупомянутым аспектом/вариантами осуществления настоящего изобретения) и эффекторный элемент для лечения тромбоза (например, тканевый активатор плазминогена). Следовательно, способы лечения тромбоза с применением таких полипептидов также включены в объeм настоящего изобретения.
[0080] В соответствии с различными вариантами осуществления настоящего изобретения, полипептид содержит антифибриновое антитело и фрагмент сериновой протеазы тканевого активатора плазминогена человека (hu-tPA), который связан с N- или C-концом антифибринового антитела, прямо или опосредованно через линкер.
[0081] Иллюстративным примером фрагмента сериновой протеазы hu-tPA является ретеплаза. Другие полипептиды, эквивалентные ретеплазе, также включены в объeм настоящего изобретения.
[0082] В некоторых вариантах осуществления изобретения антифибриновое антитело и фрагмент сериновой протеазы hu-tPA связаны напрямую, в то время как в других случаях они связаны опосредованно с помощью промежуточной последовательности, расположенной между ними. В соответствии с определенными вариантами осуществления настоящего изобретения, между антифибриновым антителом и фрагментом сериновой протеазы расположена гидрофильная линкерная последовательность для облегчения связывания полипептида с фибриновой сеткой в сгустке. Например, когда фрагмент сериновой протеазы hu-tPA связан с N-концом антифибринового антитела, полипептид имеет аминокислотную последовательность SEQ ID NO: 11 или 12. Альтернативно, когда фрагмент сериновой протеазы hu-tPA связан с С-концом антифибринового антитела, полипептид имеет аминокислотную последовательность SEQ ID NO: 14.
[0083] В соответствии с некоторыми вариантами осуществления настоящего изобретения полипептид связывается с фибрином человека лучше, чем hu-tPA. Альтернативно или дополнительно, настоящий полипептид имеет более длительное время полужизни в сыворотке крови животного, чем ретеплаза.
[0084] Экспериментальные примеры
[0085] Пример 1: Получение планшета, покрытого человеческим фибрином, для скрининга при помощи фагового дисплея
[0086] Для получения планшетов, покрытых фибрином, фибриноген человека (Sigma), разбавленный ФСБ, добавляли в планшет Maxisoap (Nunc) в количестве 10 мкг/100 мкл на лунку, планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0087] Каждый планшет с фибрином готовили следующим образом. 100 мкл трис-забуференного физиологического раствора (TBS), содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали буфером TBS и блокировали 5% обезжиренным молоком в ФСБТ (фосфатно-солевой буфер с 0,1% твин-20).
[0088] Пример 2: Конструирование и отбор отображаемых фагом scFv, специфичных по отношению к фибрину человека
[0089] Клоны фага, несущие scFv, специфичный в отношении фибрина человека, были получены по договоренности с лабораторией доктора Ан-Суэй Янга в Центре геномных исследований, Academia Sinica, Тайбэй, Тайвань. Каркасная последовательность библиотеки scFv была получена из G6 анти-VEGF Fab (Protein Bank Code 2FJG) и клонирована в сайты рестрикции SfiI и NotI фагмидного вектора pCANTAB5E (GE Healthcare), несущего резистентность к ампициллину, промотор lacZ, лидерную последовательность pelB. для секреции scFv фрагментов в супернатанты культур и E-tag, применимый для обнаружения. Домены VH и VL матрицы scFv были диверсифицированы отдельно на основе процедуры олигонуклеотид-направленного мутагенеза; 3 CDR в каждом из вариабельных доменов были диверсифицированы одновременно. Библиотеку scFv из более чем 109 клонов использовали для отбора на человеческий фибрин.
[0090] 96-луночные планшеты Maxisorp (Nunc), покрытые расщепленным фибрином человека (1 мкг/100 мкл ФСБ на лунку), использовали для пэннинга антифибриновых антител. В кратком изложении, лунки покрывали фибрином человека путем встряхивания раствора для покрытия в лунках в течение 2 часов при комнатной температуре. Покрытые фибрином лунки затем обрабатывали блокирующим буфером (5% обезжиренного молока в ФСБТ с 0,1% твин-20) в течение 1 часа при комнатной температуре. Рекомбинантные фаги в блокирующем буфере, разведенные до 8 × 1011 КОЕ/мл, добавляли в покрытые фибрином лунки на 1 час при осторожном встряхивании. Затем лунки интенсивно промывали 10 раз ФСБТ, а затем 6 раз ФСБ для удаления неспецифично связывающих фагов. Связанные фаги элюировали 0,1 М HCl/глициновым буфером при значении pH 2,2, и раствор для элюирования немедленно нейтрализовали 2 М трис-основным буфером со значением pH 9,0. Штамм E. coli ER2738 (OD600 = ~0,6) использовали для фаговой инфекции при температуре 37°C в течение 30 минут; неинфицированные E. coli удаляли обработкой ампициллином в течение 30 минут. После этого добавляли хелперный фаг M13KO7 с устойчивостью к канамицину для ещe одной 1-часовой инкубации. Отобранные фаги, спасенные хелперным фагом в культуре E. coli, амплифицировали при энергичном встряхивании в течение ночи при температуре 37°C в присутствии канамицина. Амплифицированные фаги осаждали в ПЭГ/NaCl, а затем ресуспендировали в ФСБ для следующих циклов отбора-амплификации. Всего было выполнено три последовательных раунда пэннинга фибрина человека путем повторения этой процедуры отбора-амплификации.
[0091] Планшеты с обработанным тромбином фибрином (1 мкг/100 мкл на лунку) готовили, как описано в предыдущих примерах. Планшеты с фибрином использовали для пэннинга антифибриновых антител. В кратком изложении, покрытые фибрином лунки обрабатывали блокирующим буфером (5% обезжиренного молока в ФСБТ с 0,1% твин-20) в течение 1 часа при комнатной температуре. Рекомбинантные фаги в блокирующем буфере, разведенные до 8 × 1011 КОЕ/мл, добавляли в покрытые фибрином лунки на 1 час при осторожном встряхивании. Затем лунки интенсивно промывали 10 раз ФСБТ, а затем 6 раз ФСБ для удаления неспецифично связывающих фагов. Связанные фаги элюировали 0,1 М HCl/глициновым буфером при значении pH 2,2, и элюированную фракцию немедленно нейтрализовали 2 М трис-основным буфером со значением pH 9,0. Штамм E. coli ER2738 (OD600 = ~0,6) использовали для фаговой инфекции при температуре 37°C в течение 30 минут; неинфицированные E. coli удаляли обработкой ампициллином в течение 30 минут. После этого добавляли хелперный фаг M13KO7 с устойчивостью к канамицину для ещe одной 1-часовой инкубации. Отобранные фаги, спасенные хелперным фагом в культуре E. coli, амплифицировали при энергичном встряхивании в течение ночи при температуре 37°C в присутствии канамицина. Амплифицированные фаги осаждали в ПЭГ/NaCl, а затем ресуспендировали в ФСБ для следующего цикла отбора-амплификации. Всего было выполнено три последовательных раунда пэннинга фибрина человека путем повторения этой процедуры отбора-амплификации.
[0092] Инфицированные фагом колонии ER2738, подсчитанные с помощью серийных разведений, подсчитывали и рассчитывали титры фага, что давало выходной титр/мл (КОЕ/мл) за цикл пэннинга. После трех раундов пэннинга было получено 1000-кратное увеличение титра выхода фага с 1,6Е+04 КОЕ/лунка до 2,2Е+07 КОЕ лунка. Отношения выходного/входящего титра фага для каждого цикла показаны на фиг. 1А. Для каждого раунда пэннинга отношения выходного/входящего титра фага приведены на оси ординат. Наблюдалось явное обогащение положительных клонов за три раунда пэннинга. Третий раунд пэннинга привел к 100-кратному увеличению отношения выходного/входящего титра фага по сравнению с первым раундом, поскольку связывающие клоны стали доминирующей популяцией в библиотеке.
[0093] В типичной процедуре отбора после трех раундов пэннинга с антигеном в лунках, покрытых фибрином человека, в планшетах для твeрдофазного ИФА приблизительно 80% связанных фаговых частиц специфично связывались с фибрином в покрытым фибрином планшетах для твeрдофазного ИФА.
[0094] Пример 3: Твeрдофазный ИФА отдельной колонии фага, отображающего scFv, специфичных в отношении фибрина человека
[0095] Штамм E. coli ER2738, инфицированный моноклональными фагами, каждый из которых несет выбранный ген scFv в своей фагмиде, выращивали в средней логарифмической фазе в бульоне 2YT (16 г/л триптона, 10 г/л дрожжевого экстракта, 5 г/л NaCl, pH 7,0) со 100 мкг/мл ампициллина в глубокой лунке при температуре 37°C при встряхивании. После того, как бульон достиг OD600 1,0, добавляли IPTG до конечной концентрации 1 мкг/мл. Планшеты инкубировали при температуре 37°C в течение ночи при сильном встряхивании. После этого планшеты центрифугировали при 4000 g в течение 15 минут при температуре 4°C.
[0096] Для теста связывания растворимого scFv проводили твeрдофазный ИФА. В кратком изложении, 96-луночный планшет Maxisorp (Nunc) покрывали фибрином (0,5 мкг/100 мкл ФСБ на лунку) или антигеном отрицательного контроля, фибриногеном человека, в течение 18 часов при встряхивании при 4°C. После обработки 300 мкл блокирующего буфера в течение одного часа 100 мкл секретированного scFv в супернатанте смешивали со 100 мкл блокирующего буфера и затем добавляли в покрытый планшет ещe на один час. Козье анти-E-tag антитело (конъюгированное с пероксидазой хрена (HRP), 1:4000, каталожный номер AB19400, Abcam) добавляли в планшет на один час. Субстрат ТМБ (50 мкл на лунку) добавляли в каждую лунку и измеряли оптическую плотность при длине волны 450 нм после остановки реакции добавлением 1 н. HCl (50 мкл на лунку). Значение OD450 для каждой лунки измеряли для определения аффинности связывания каждого клона scFv с фибрином или фибриногеном. Для каждого клона scFv значение OD450 по отношению к фибрину было разделено на значение OD450 по отношению к фибриногену, чтобы получить отношение OD450, представляющее избирательное связывание указанного scFv с фибрином по сравнению с фибриногеном. В твeрдофазном ИФА одной колонии всего 192 клона фага после третьего раунда пэннинга были подвергнуты настоящему анализу. Среди них 12 клонов scFv, которые связывались с фибрином с отношением OD450 более 10, были дополнительно охарактеризованы путем секвенирования их гена, кодирующего scFv. Было идентифицировано шесть различных последовательностей ДНК. На фиг. 1B показан результат твeрдофазного ИФА клона scFv D10. Аминокислотная последовательность клона scFv D10, который связывается с фибрином человека с OD450, равным 1,3, представлена в SEQ ID NO: 4.
[0097] Дополнительный раунд отбора проводили в соответствии с протоколом, изложенным выше. На этот раз после трех раундов пэннинга было получено 1000-кратное увеличение титра выхода фага с 9,3Е+04 КОЕ/лунка до 4,5Е+07 КОЕ/лунка. Третий раунд пэннинга привел к 130-кратному увеличению отношения выходного/входящего титра фага по сравнению с первым раундом, поскольку связывающие клоны стали доминирующей популяцией в библиотеке. Всего 192 клонов фага после третьего раунда пэннинга были подвергнуты настоящему анализу. Среди них 18 клонов scFv, которые связывались с фибрином с отношением OD450 более 10, были дополнительно охарактеризованы путем секвенирования их гена, кодирующего scFv. Были идентифицированы четыре различные последовательности ДНК, и данные OD450 и последовательности этих четырех клонов приведены ниже в Таблице 1.
Таблица 1
[0098] ScFv с наивысшим соотношением OD450, scFv 3D5, подвергали последующему анализу, и аминокислотная последовательность отображаемого фагом scFv 3D5 показана в SEQ ID NO: 5.
[0099] Пример 4: Получение рекомбинантного антифибринового антитела 102-10 и антифибринового антитела 3D5
[0100] Фрагменты VL и VH антитела 3D5, специфичного по отношению к фибрину человека, помещали в экспрессионный вектор pG1K для экспрессии. Аминокислотные последовательности легкой цепи и тяжелой цепи полноразмерного антитела показаны в SEQ ID NO: 8 и 9, соответственно.
[0101] Фрагменты VH и VL антитела 102-10 (публикация заявки на патент Японии No.2012-72) помещали в экспрессионный вектор pG1K для экспрессии. Аминокислотные последовательности легкой цепи и тяжелой цепи полноразмерного антитела показаны в SEQ ID NO: 6 и 7, соответственно.
[0102] Для получения рекомбинантных антител с использованием системы экспрессии млекопитающих использовали систему сверхэкспрессии на основе линии клеток Expi293F™. В системе использовался набор реагентов для трансфекции ExpiFectamine™ 293 (Life Technologies, Карлсбад, США), состоящий из линии клеток Expi293F™, реагента ExpiFectamine™ 293 на основе катионных липидов и усилителей трансфекции ExpiFectamine™ 293 1 и 2, а также среды, которая была частью системы экспрессии (Gibco, Нью-Йорк, США).
[0102] Клетки Expi293F высевали с плотностью 2,0 × 106 жизнеспособных клеток/мл в среду для экспрессии Expi293F и поддерживали в течение 18-24 часов перед трансфекцией, чтобы гарантировать, что клетки активно делились во время трансфекции. Во время трансфекции 7,5 × 108 клеток в 255 мл среды в 2-литровом шейкере Эрленмейера трансфицировали реагентом для трансфекции ExpiFectamine™ 293. Трансфицированные клетки инкубировали при температуре 37°C в течение 16-18 часов после трансфекции в орбитальном шейкере (125 об/мин), и добавляли к клеткам в колбу для встряхивания усилитель трансфекции ExpiFectamine™ 293 1 и усилитель трансфекции 2, а затем инкубировали в течение 5 до 6 дней. Собирали культуральные супернатанты и очищали антитела в среде с использованием аффинной хроматографии на основе связывания с белком А.
[0104] Пример 5: Анализ с помощью твeрдофазного ИФА связывания антител 102-10 и 3D5 с фибриногеном человека, фибрином и поперечно-сшитым фибрином, обработанным человеческим фактором XIIIa
[0105] Для исследования связывающей способности антител 102-10 и 3D5 с фибриногеном человека, фибрином и поперечно-сшитым фибрином проводили анализ с использованием твeрдофазного ИФА.
[0106] Для получения покрытых фибрином планшетов, фибриноген человека (Sigma), разбавленный ФСБ, добавляли в 96-луночный полистирольный микропланшет в количестве 100 мкл на лунку, и планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0107] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ). После блокирования в каждую лунку добавляли 100 мкл антител, и планшет инкубировали при комнатной температуре в течение 1 часа. Затем планшет промывали три раза, в лунки добавляли конъюгированный с HRP белок L, разбавленный до 1/5000, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0108] Результаты твeрдофазного ИФА приведены на фиг. 2, которые показывают, что антитело 3D5 может связываться с фибрином человека или сшитым фибрином сильнее, чем антитело 102-10.
[0109] Пример 6: Получение полипептида, содержащего ретеплазу и scFv 102-10, специфичный по отношению к фибрину человека, в конфигурации VL-218 линкер-VH.
[0110] Полипептид (ретеплаза)-102-10 scFv был сконфигурирован путем слияния ретеплазы с N-концом 102-10 scFv через гибкий линкер (SEQ ID NO: 15, в дальнейшем, гибкий линкер). 102-10 scFv имел ориентацию VL-линкер-VH, где два домена были соединены гидрофильным линкером 218, GSTSGSGKPGSGEGSTKG (SEQ ID NO: 16). Последовательность рекомбинантного полипептида показана в SEQ ID NO: 10.
[0111] Конфигурация настоящего полипептида (ретеплаза)-(102-10 scFv α фибрин) показана ниже.
[0112] Пример 7: Экспрессия и очистка рекомбинантного полипептида (ретеплаза)-(scFv α фибрин) системой сверхэкспрессии Expi293F
[0113] Последовательность, кодирующую scFv, помещали в кассету экспрессии pcDNA3. Экспрессию сконструированного гена в клетках Expi293F и очистку экспрессированного полипептида проводили с использованием протокола, описанного в предыдущих примерах.
[0114] Характеристику новой конструкции проводили с использованием SDS-ПААГ. Результаты анализа в 10% не восстанавливающем SDA-ПААГ на фиг. 3 показывают, что рекомбинантный белок (ретеплаза)-(102-10 scFv α фибрин) (дорожка 2) имеет основную полосу массой около 71 кДа, что соответствует ожидаемому размеру.
[0115] Пример 8: Получение полипептида, содержащего ретеплазу и 3D5 scFv, специфичный по отношению к фибрину человека, в конфигурации VL-гибкий линкер-VH
[0116] Белок рекомбинантной ретеплазы (3D5 VL-гибкий линкер-VH scFv α фибрин) был сконфигурирован путем слияния ретеплазы с N-концом 3D5 scFv, специфичного по отношению к фибрину человека, через гибкий линкер.
[0117] scFv имел ориентацию VL-линкер-VH, и два домена были соединены гибким линкером. Последовательность рекомбинантного полипептида показана в SEQ ID NO: 11. Характеристику новой конструкции проводили с использованием SDS-ПААГ. Результаты анализа в 10% не восстанавливающем SDA-ПААГ на фиг. 3 показывают, что образец на дорожке 1 имеет ожидаемый продукт массой примерно 71 кДа; однако также неожиданно обнаружен разрушенный продукт с массой примерно 55 кДа.
[0118] Пример 9: Получение полипептида, содержащего ретеплазу и 3D5 scFv, специфичный по отношению к фибрину человека, в конфигурации VL-218 линкер-VH.
[0119] Белок рекомбинантной ретеплазы-(3D5 VL-218-VH scFv α-фибрин) (далее ретеплаза-(3D5 scFv)) был сконфигурирован путем слияния ретеплазы с N-концом 3D5 scFv, специфичного по отношению к фибрину человека, через гибкий линкер.
[0120] ScFv имел ориентацию VL-линкер-VH, и два домена были соединены гидрофильным линкером 218. Последовательность рекомбинантного полипептида показана в SEQ ID NO: 12. Характеристику новой конструкции проводили с использованием SDS-ПААГ. Результаты анализа в 10% невосстанавливающем SDA-ПААГ на фиг. 4 показывают, что рекомбинантная цепь новой конструкции (дорожка 1 и дорожка 2) имеет размер примерно 71 кДа, что соответствует ожидаемому размеру. Поскольку ретеплаза-(3D5 scFv), полученная в этом примере, является более стабильной, чем полипептид ретеплаза-(3D5 VL-гибкий линкер-VH scFv α фибрин) из предыдущего примера, в следующих примерах в дальнейших исследованиях изучали настоящую ретеплазу-(3D5 scFv).
[0121] Пример 10: Получение рекомбинантного белка ретеплазы-IgG4.Fc с использованием системы сверхэкспрессии Expi293F
[0122] Рекомбинантная цепь ретеплаза-CH2-CH3 (γ4 человека) была сконфигурирована путем слияния ретеплазы с N-концом домена CH2 IgG4.Fc через гибкую шарнирную область. Последовательность рекомбинантной цепи в полипептиде IgG4.Fc показана в SEQ ID NO: 13.
[0123] Экспрессию сконструированного гена в клетках Expi293F с получением экспрессированного полипептида проводили, как описано в предыдущих примерах.
[0124] Пример 11: Анализ стабильности ретеплазы (3D5 scFv) с использованием SDS-ПААГ
[0125] Для оценки стабильности ретеплазы (3D5 scFv) после хранения ретеплазу (3D5 scFv) хранили при температуре 4°C в течение 3, 6 и 30 дней, а затем проводили анализ при помощи SDS-ПААГ и твeрдофазного ИФА.
[0126] Результаты, полученные с использованием 10% невосстанавливающего SDS-ПААГ, показаны на фиг. 5A и 5B, и они указывают на то, что рекомбинантный полипептид ретеплазы-(3D5 scFv) стабилен в течение, по меньшей мере, одного месяца.
[0127] Для исследования связывающей способности сохраненных полипептидов ретеплазы-(3D5 scFv) с фибрином человека выполняли твeрдофазный ИФА.
[0128] 96-луночные микропланшеты из полистирола покрывали фибриногеном человека (Sigma) (20 мкг/мл) в буфере ФСБ (100 мкл на лунку). После инкубации в течение ночи при температуре 4°C покрытые лунки промывали буфером ФСБ. Чтобы вызвать поперечное сшивание фибрина человека, покрытые лунки инкубировали при температуре 37°C в течение 1 часа с человеческим α-тромбином (Sigma) в конечной концентрации 1 Ед/мл в буфере TBS с 2 мМ CaCl2 и 7 мМ L-цистина (Merck). После блокирования лунок блокирующим буфером (5% обезжиренное сухое молоко/ФСБ) в каждую лунку добавляли 100 мкл ретеплазы-(3D5-scFv) с конечной концентрацией 0,1, 1 и 10 мкг/мл и инкубировали при комнатной температуре в течение 1 часа. После этого планшеты промывали три раза, и в лунки добавляли конъюгированный с HRP белок L, разведенный до 1/5000, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл 3,3’,5,5’-тетраметилбензидинового (ТМБ) субстратного буфера. Через 5 минут развитие окраски остановливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов (Molecular Devices), а данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0129] При получении планшета с поперечно-сшитым фибрином, обработанным фактором XIIIa, процедуры нанесения покрытия были аналогичны процедурам, описанным для планшета, покрытого фибрином. В кратком изложении, фибриноген человека (Sigma), разбавленный ФСБ, добавляли в 96-луночный полистирольный микропланшет в количестве 100 мкл на лунку, затем планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0130] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 0,55 мкг фактора XIIIa (Zedira, Дармштадт, Германия) на лунку, 2 мМ CaCl2 и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ).
[0131] Полипептиды рекомбинантной ретеплазы-(3D5 scFv) обнаруживали с использованием конъюгированного с HRP белка L. Результаты твeрдофазного ИФА, приведенные на фиг. 5C, показывают, что даже после указанного периода хранения ретеплаза-(3D5 scFv) все ещe может связываться с фибрином человека и конкретно с поперечно-сшитым фибрином.
[0132] Пример 12: Анализ связывания фибрина человека и поперечно-сшитого фибрина полипептидами (ретеплаза)-(3D5 scFv) при помощи твeрдофазного ИФА
[0133] Для исследования зависимости от дозы способности рекомбинантных полипептидов ретеплазы-(3D5 scFv) связывать фибрин человека проводили твeрдофазный ИФА.
[0134] Процедуры твeрдофазного ИФА были аналогичны процедурам, описанным в предыдущих примерах. В кратком изложении, фибриноген мыши (Sigma), разбавленный ФСБ, добавляли в 96-луночный полистироловый микропланшет в количестве 100 мкл на лунку, а затем планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0135] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl2 и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ). После этого в каждую лунку добавляли 100 мкл ретеплазы-(3D5-scFv) в различных конечных концентрациях (600 нМ, 200 нМ, 66 нМ, 22 нМ, 7,4 нМ, 2,5 нМ и 0,8 нМ) и инкубировали при комнатной температуре в течение 1 час. Затем планшет промывали три раза, и в лунки добавляли конъюгированный с HRP белок L, разбавленный до 1/5000, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0136] Полипептиды рекомбинантной ретеплазы-(3D5 scFv) детектировали с использованием белка L, конъюгированного с HRP. Результаты твeрдофазного ИФА, приведенные на фиг. 6, показывают, что полипептид ретеплазы-(3D5 scFv) специфично связывается с фибрином человека и поперечно-сшитым фибрином; однако он имеет более сильную связывающую способность с поперечно-сшитым фибрином, чем с фибрином.
[0137] Пример 13: Анализ связывания мышиным фибрином полипептида рекомбинантной ретеплазы-(3D5 scFv) при помощи твeрдофазного ИФА
[0138] Для проверки связывающей способности полипептидов рекомбинантной ретеплазы-(3D5 scFv) с фибрином мыши с помощью твeрдофазного ИФА готовили планшеты для ИФА, покрытые фибрином мыши.
[0139] Для приготовления планшета с фибрином мыши процедуры нанесения покрытия были аналогичны процедурам, описанным для планшетов, покрытых фибрином человека. В кратком изложении, фибриноген мыши (Sigma), разбавленный ФСБ, добавляли в 96-луночный полистирольный микропланшет в количестве 100 мкл на лунку, планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0140] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl2 и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ). После этого в каждую лунку добавляли 100 мкл ретеплазы-(3D5-scFv) в конечной концентрации 200 нМ и инкубировали при комнатной температуре в течение 1 часа. Затем планшет промывали три раза, и в лунки добавляли конъюгированный с HRP белок L, разбавленный до 1/5000, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0141] Xolair представляет собой антитело против IgE и в настоящем изобретении его использовали в качестве отрицательного контроля. Полипептиды рекомбинантной ретеплазы-(3D5 scFv) и ретеплазы обнаруживали с использованием белка L, конъюгированного с HRP. Результаты твeрдофазного ИФА, приведенные на фиг. 7, показывают, что ретеплаза-(3D5 scFv) специфично связывается с фибрином мыши, но не с фибриногеном мыши.
[0142] Пример 14: Твeрдофазный ИФА связывания фибрина человека рекомбинантным полипептидом ретеплазы-(3D5 scFv) в присутствии свободного фибриногена
[0143] Для оценки связывающей способности полипептидов рекомбинантной ретеплазы-(3D5 scFv) с фибрином человека в присутствии 200 мг/дл или 400 мг/дл фибриногена человека проводили твeрдофазный ИФА, процедура которого была аналогична описанной в предыдущих примерах.
[0144] В кратком изложении, фибриноген человека, разбавленный ФСБ, добавляли в 96-луночный микропланшет из полистирола в количестве 100 мкл на лунку, затем планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0145] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl2 и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном, который затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ). После этого в каждую лунку добавляли 100 мкл ретеплазы-(3D5-scFv) с конечной концентрацией 200 нМ, которую смешивали с фибриногеном человека до конечной концентрации 200 мг/дл или 400 мг/дл, и инкубировали при комнатной температуре в течение 1 часа. Затем планшет промывали трижды, и в лунки добавляли конъюгированный с HRP белок L, разбавленный до 1/5000, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0146] Полипептиды рекомбинантной ретеплазы-(3D5 scFv) и ретеплаза обнаруживали с использованием конъюгированного с HRP белка L. Результаты твeрдофазного ИФА, приведенные на фиг. 8, показывают, что полипептиды ретеплазы-(3D5 scFv) специфично связываются с фибрином человека в присутствии свободного фибриногена при конечной концентрации 200 мг/дл или 400 мг/дл.
[0147] Пример 15: Тромболитическая активность полипептида рекомбинантной ретеплазы-(3D5 scFv) в ФСБ или сыворотке крови человека
[0148] Для исследования тромболитической активности проводили тромболитически анализ цельной крови в планшете. В кратком изложении, человеческую кровь собирали у здорового добровольца при помощи венепункции в тринатрийцитрат до конечной концентрации 3,2% (мас./об.) Образование сгустка индуцировали тромбином. Смесь для свертывания крови была свежеприготовлена из тромбина (конечная концентрация 6,25 × 10–3 Ед) и хлорида кальция до конечной концентрации 67 мМ в буфере HEPES (25 мМ HEPES, 137 мМ NaCl). 5 мкл смеси для свертывания крови наносили на дно лунки 96-луночного микропланшета (Costar) с последующим добавлением 25 мкл крови. Затем планшет герметично закрывали и инкубировали при температуре 37°С в течение 1 часа, при этом по краям лунок образовывались сгустки крови.
[0149] Ретеплазу-IgG4.Fc и ретеплазу-(3D5-scFv) разводили в 70 мкл ФСБ. Образцы объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов в лунки добавляли 70 мкл сыворотки крови человека или ФСБ и определяли разложение сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0150] Результаты тромболитического анализа, приведенные на фиг. 9, показывают, что ретеплаза-(3D5 scFv) имеет лучшую тромболитическую активность в сыворотке крови человека, чем в ФСБ.
[0151] Пример 16: Тромболитическая активность полипептида рекомбинантной ретеплазы-(3D5 scFv) при конечной концентрации 1 мМ
[0152] Ретеплазу-IgG4.Fc и ретеплазу-(3D5-scFv) разводили в 70 мкл ФСБ до конечной концентрации 1 нМ. Образцы объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов в лунки добавляли 70 мкл сыворотки крови человека и определяли разложение сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0153] Результаты тромболитического анализа, приведенные на фиг. 10, показывают, что ретеплаза-(3D5 scFv) имеет лучшую тромболитическую активность при конечной концентрации 1 мМ, чем ретеплаза-IgG4.Fc.
[0154] Пример 17: Нацеливающий эффект полипептида рекомбинантной ретеплазы-(3D5 scFv)
[0155] Ретеплазу-IgG4.Fc и ретеплазу- (3D5-scFv) разводили в 70 мкл ФСБ до конечной концентрации 30 нМ. Образцы объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов и трехкратной промывки сгустка 250 мкл ФСБ в лунки добавляли 70 мкл сыворотки крови человека и определяли деградацию сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0156] Результаты анализа, приведенные на фиг. 11, показывают, что ретеплаза-(3D5 scFv) нацелена на сгустки крови человека и все ещe проявляет желаемую тромболитическую активность даже после обработки отмывкой. Напротив, контрольный белок ретеплаза-IgG4.Fc не проявляет функции нацеливания и почти не проявляет тромболитической активности после обработки отмывкой.
[0157] Пример 18: Дозозависимая тромболитическая активность рекомбинантного полипептида ретеплазы-(3D5 scFv)
[0158] Полипептид ретеплазы-(3D5-scFv) разводили в 70 мкл PBS до конечных концентраций 5 нМ, 10 нМ, 20 нМ и 30 нМ, а ретеплазу-IgG4.Fc разводили в 70 мкл ФСБ до конечной концентрации 30 нМ. Образец объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов и трехкратной промывки сгустка 250 мкл ФСБ в лунки добавляли 70 мкл сыворотки крови человека и определяли деградацию сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0159] Результаты анализа, приведенные на фиг. 12, показывают, что настоящая ретеплаза-(3D5 scFv) нацелена на сгустки крови человека и проявляет желаемую тромболитическую активность даже при такой низкой концентрации, как 5 нМ. С другой стороны, ретеплаза-IgG4.Fc не проявляла тромболитической активности даже при концентрации 30 нМ.
[0160] Пример 19: Дозозависимая тромболитическая активность рекомбинантного полипептида ретеплазы-(3D5 scFv) и ретеплазы в отношении сгустка крови человека
[0161] Для сравнения тромболитической активности полипептидов рекомбинантной ретеплазы-(3D5-scFv) и ретеплазы (MIRel®, приобретенный у Reliance Life Science) в отношении сгустков крови человека проводили тромболитический анализ цельной крови с помощью процедуры, аналогичной описанной в предыдущих примерах.
[0162] Полипептиды ретеплазы и ретеплазы-(3D5-scFv) разводили в 70 мкл ФСБ до конечных концентраций 5 нМ, 10 нМ, 20 нМ и 30 нМ. Образец объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов и трехкратной промывки сгустка 250 мкл ФСБ в лунки добавляли 70 мкл сыворотки крови человека и определяли деградацию сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0163] Результаты анализов, приведенные на фиг. 13A и 13B, показывают, что полипептиды ретеплазы (Фигура 13A) и ретеплазы-(3D5 scFv) (Фигура 13B) проявляют тромболитическую активность при концентрациях 10 нМ, 30 нМ и 90 нМ в плазме крови человека.
[0164] Результаты анализа, приведенные на фиг. 13C, показывают, что полипептид рекомбинантной ретеплазы-(3D5 scFv) проявляет лучшую тромболитическую активность, чем ретеплаза, при концентрациях 10 нМ, 30 нМ и 90 нМ в плазме крови человека.
[0165] Пример 20: Тромболитическая активность полипептида рекомбинантной ретеплазы-(3D5 scFv) в отношении сгустка крови обезьяны
[0166] Кровь обезьяны приобретали в Национальном университете обороны (Тайбэй, Тайвань). Образование сгустка крови обезьяны индуцировали человеческим тромбином, и процедура была аналогична описанной в предыдущих примерах. В кратком изложении, смесь для свертывания крови была свежеприготовлена из тромбина (конечная концентрация 6,25 × 10–3 Ед) и хлорида кальция при конечных концентрациях 67 мМ в буфере HEPES (25 мМ HEPES, 137 мМ NaCl). 5 мкл смеси для свертывания крови наносили на дно лунки 96-луночного микропланшета (Costar) с последующим добавлением 25 мкл крови. Затем планшет герметично закрывали и инкубировали при температуре 37°С в течение 1 часа, и по краю лунок образовывались сгустки крови обезьяны.
[0167] Ретеплазу (3D5-scFv) разводили в 70 мкл ФСБ. Образцы объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови обезьяны, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов в лунки добавляли 70 мкл плазмы крови человека или ФСБ и определяли деградацию сгустков крови обезьяны с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0168] Результаты тромболитического анализа, приведеные на фиг. 14A, показывают, что настоящий полипептид ретеплазы-(3D5 scFv) в концентрациях 10 нМ, 20 нМ и 30 нМ может растворять сгустки крови обезьяны в ФСБ.
[0169] Результаты тромболитического анализа, приведенные на фиг. 14B, показывают, что настоящий полипептид ретеплазы-(3D5 scFv) в концентрациях 10 нМ, 20 нМ и 30 нМ может растворять сгустки крови обезьяны в плазме крови человека.
[0170] Пример 21: Аффинность связывания человеческого фибрина рекомбинантным полипептидом ретеплазы-(3D5 scFv) и альтеплазой
[0171] Для сравнения аффинности связывания полипептидов рекомбинантной ретеплазы-(3D5 scFv) и альтеплазы (ACTILYSE®, приобретена у Boehringer Ingelheim) с фибрином человека проводили твeрдофазный ИФА, и процедура была аналогична описанной в предыдущих примерах. В кратком изложении, фибриноген человека, разбавленный ФСБ, добавляли в 96-луночный полистирольный микропланшет в количестве 100 мкл на лунку, затем планшет герметично закрывали и оставляли на ночь при температуре 4°C.
[0172] Каждый планшет с фибрином готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 Ед/мл тромбина (Sigma), 2 мМ CaCl2 и 7 мМ L-цистеина (Merck), добавляли в лунки планшета с фибриногеном и инкубировали при температуре 37°C в течение 1 часа, после чего промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ). После этого в каждую лунку добавляли 100 мкл ретеплазы-(3D5-scFv) или альтеплазы в конечной концентрации 2, 20 или 200 нМ и инкубировали при комнатной температуре в течение 1 часа. Затем планшет промывали три раза, и в лунки добавляли поликлональные кроличьи конъюгированные с HRP антитела против ретеплазы, разведенные до 1/200, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0173] Полипептид рекомбинантной ретеплазы-(3D5 scFv) и альтеплазу обнаруживали с помощью поликлональных кроличьих конъюгированных с HRP антител против ретеплазы. Результаты твeрдофазного ИФА, приведенные на фиг. 15, показывают, что полипептиды ретеплазы-(3D5 scFv) могут специфично связываться с фибрином человека, а альтеплаза не обладает связывающей активностью в отношении фибрина человека.
[0174] Пример 22: Тромболитическая активность полипептида рекомбинантной ретеплазы-(3D5 scFv), альтеплазы и ретеплазы в отношении сгустка крови человека
[0175] Для сравнения тромболитической активности полипептидов рекомбинантной ретеплазы-(3D5 scFv), альтеплазы и ретеплазы в отношении сгустка крови человека проводили тромболитический анализ цельной крови, и процедура была аналогична описанной в предыдущих примерах.
[0176] Полипептид ретеплазы-(3D5-scFv) разводили в 70 мкл ФСБ. Образцы объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови обезьяны, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов в лунки добавляли 70 мкл плазмы крови человека или ФСБ и определяли деградацию сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0177] Результаты тромболитического анализа, приведенные на Фмгуре 16A и фиг. 16B, показывают, что полипептид ретеплазы-(3D5 scFv) обладает тромболитической активностью в отношении сгустка крови человека в ФСБ и плазме крови человека, соответственно.
[0178] Пример 23: Кинетика протеолитической активности полипептида рекомбинантной ретеплазы-(3D5 scFv) и альтеплазы
[0179] Для исследования кинетики протеолитической активности полипептида ретеплазы-(3D5 scFv) и альтеплазы проводили хромогенный анализ путем превращения плазминогена в плазмин, катализируемого рекомбинантным полипептидом ретеплазы-(3D5 scFv) и альтеплазой. В кратком изложении, различные концентрации хромогенного субстрата, CH3SO2-D-гексагидротирозин-Gly-Arg-п-нитроанилид•AcOH (Sigma), (0,1, 0,2, 0,4, 0,8, 1,6, 3,2 и 6,4 мМ) и образцы, содержащие ретеплазу-(3D5 scFv) или альтеплазу инкубировали в 96-луночных планшетах с плоским дном (Nunc) при температуре 25°C в течение 15 минут. Протеолитическая активность ретеплазы приводила к гидролизу субстрата, и высвобождение свободного п-нитроанилина желтого цвета измеряли при длине волны 405 нм с использованием считывающего устройства для микропланшетов.
[0180] Фиг. 17A представляет собой линейный график, показывающий протеолитическую активность настоящего полипептида рекомбинантной ретеплазы-(3D5 scFv) и альтеплазы при указанных концентрациях субстрата. Фигура 17B представляет собой график с двойной обратной зависимостью (график Лайнвивера-Берка), построенный по точкам данных, полученных из данных на фиг. 17A, и значения [Km], [Vmax] и [Kcat] их протеазной активности могут быть затем рассчитаны из графика Лайнвивера-Берка. Значения [Km], [Vmax] и [Kcat] рекомбинантного полипептида ретеплазы-(3D5 scFv) составляют 0,41 мМ, 170 нМ/мин и 0,85, соответственно, тогда как значения [Km], [Vmax] и [Kcat] альтеплазы составляют 0,36 мМ, 155 нМ/мин и 0,775, соответственно. Эти данные демонстрируют, что и полипептид ретеплазы-(3D5 scFv), и альтеплаза обладают аналогичной протеолитической активностью в отношении хромогенного субстрата.
[0181] Пример 24: Анализ стабильности полипептида рекомбинантной ретеплазы-(3D5 scFv) в плазме крови человека
[0182] Для оценки стабильности полипептида ретеплазы-(3D5 scFv) в плазме крови человека полипептид ретеплазы-(3D5 scFv) инкубировали в 10 или 20% плазме крови человека в течение 3, 6 и 24 часов, а затем проводили твeрдофазный ИФА.
[0183] Покрытый фибрином планшет готовили с использованием протоколов, аналогичных описанным в предыдущих примерах. В кратком изложении, 96-луночные микропланшеты покрывали фибриногеном человека (Sigma) (20 мкг/мл) в буфере ФСБ (100 мкл на лунку). После инкубации в течение ночи при температуре 4°C покрытые лунки промывали буфером ФСБ. Чтобы вызвать перекрестное сшивание фибрина человека, покрытые лунки инкубировали при температуре 37°C в течение 1 часа с α-тромбином человека (Sigma) в конечной концентрации 1 Ед/мл в буфере TBS с 2 мМ CaCl2 и 7 мМ L-цистина (Merck). После блокирования лунок блокирующим буфером в каждую лунку добавляли 100 мкл полипептида ретеплазы-(3D5-scFv), инкубированного в 10% или 20% плазме крови человека в течение 3, 6 и 24 часов, соответственно, а затем планшеты инкубировали при комнатной температуре в течение 1 часа. После этого планшеты промывали три раза, и в лунки добавляли поликлональные кроличьи конъюгированные с HRP антитела против ретеплазы, разведенные до 1/200, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при 450 нм с использованием считывающего устройства для микропланшетов (Molecular Devices), а данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0184] Результаты твeрдофазного ИФА, приведенные на фиг. 18, показывают, что ретеплаза-(3D5 scFv) стабильна в присутствии 10% или 20% плазмы крови человека.
[0185] Пример 25: Нацеливающий эффект полипептида рекомбинантной ретеплазы-(3D5 scFv) в мышиной модели с имплантированным тромбом
[0186] Для исследования нацеливающего эффекта полипептида рекомбинантной ретеплазы-(3D5 scFv) в мышиной модели с имплантированным сгустком крови человека выполняли визуализационный анализ IVIS. Чтобы контролировать имплантированный человеческий тромб в мышиной модели, использовали набор для мечения ФИТЦ (флуоресцеин изотиоцианат) (Thermo Scientific) для конъюгирования со сгустков крови человека перед имплантацией этого сгустка крови человека в кровеносный сосуд мыши в соответствии с инструкциями производителя. Сгустки крови человека, меченные ФИТЦ, получали в 384-луночном микропланшете (Axygen) для образования сгустка крови человека адекватного размера для имплантации в нижнюю полую вену (НПВ) мыши. В кратком изложении, фибриноген человека метили красителем ФИТЦ в конечной концентрации 1 мг/мл. Фибриноген, меченный ФИТЦ, смешивали с 4 мкл крови человека. Затем смешанный образец крови обрабатывали тромбином (конечная концентрация 6,25 × 10-3 Ед) и хлоридом кальция в конечной концентрации 67 мМ в буфере HEPES (25 мМ Hepes, 137 мМ NaCl). После этого 5 мкл смешанных образцов крови добавляли в каждую лунку 384-луночного микропланшета, и планшет инкубировали при температуре 37°C в течение 1 часа для образования сгустков крови человека.
[0187] Для отслеживания местоположения введенных белков использовали набор реагентов для мечения антител Dylight 680 (Thermo Scientific) для конъюгирования полипептида рекомбинантной ретеплазы-(3D5 scFv) и ретеплазы перед введением полипептида рекомбинантной ретеплазы (3D5 scFv) и ретеплазы, согласно инструкции производителя.
[0188] Мышей NOD-SCID в возрасте от 8 до 10 недель приобретали в лаборатории лабораторных животных Института клеточной и органической биологии Academia Sinica (Тайбэй, Тайвань). Меченные ФИТЦ сгустки крови человека имплантировали в нижнюю полую вену (НПВ) мыши. В кратком изложении, мышей анестезировали изофлураном в O2 и помещали под тепловую лампу для поддержания физиологической температуры тела. Брюшную стенку выбривали и дезинфицировали 70% денатурированным этанолом. Проводили серединную лапаротомию, а затем сгусток крови человека, меченный ФИТЦ, помещали в НПВ. Подвергнутую воздействию НПВ наблюдали в системе визуализации IVIS Spectrum In vivo (PerkinElmer). Флуоресцентные изображения получали с ex/em = 459/520 (для обнаружения ФИТЦ) или ex/em = 675/720 (для обнаружения Dylight680) с использованием программного обеспечения Living Image Software V3.2. Изображения были получены в указанные моменты времени с помощью тепловизора IVIS Spectrum и проанализированы с помощью программного обеспечения Living Image.
[0189] Мышей распределили по две мыши на группу и через орбитальный венозный синус вводили примерно 50 мкл 256 нМ полипептида ретеплазы-(3D5 scFv), конъюгированного с Dylight680 (группа A), или ретеплазы (группа B). Флуоресцентные изображения мышей с имплантированным сгустком крови человека получали через 0, 5, 10, 20 и 30 минут после введения белков, конъюгированных с DyLight 680.
[0190] На фиг. 18A приведены пять IVIS-изображений мышей группы A, где изображения #1 и #2 были получены с ex/em = 675/720, изображения #3 и #4 были получены с ex/em = 495/520, и флуоресцентные сигналы на изображениях #2 и #4 были объединены, чтобы получить изображение #5. Зеленая флуоресценция на обоих изображениях #3 и #4 указывает на присутствие у мышей меченного ФИТЦ сгустка крови человека. С другой стороны, сразу после введения Dylight680-конъюгированной ретеплазы-(3D5 scFv) после инъекции полипептида (0 минут) на изображении #1 не было значительной красной флуоресценции, тогда как через 30 минут после инъекции наблюдалась интенсивная красная флуоресценция на изображении №2. Перекрывающиеся красный и зеленый сигналы на объединенном изображении #5 указывают на то, что настоящий полипептид Dylight680-конъюгированной ретеплазы-(3D5 scFv), концентрируется вокруг имплантированного сгустка крови человека.
[0191] На фиг. 18B приведены пять IVIS-изображений мышей Группы B, где изображения #1 и #2 были получены с ex/em = 675/720, изображения #3 и #4 были получены с ex/em = 495/520, и флуоресцентные сигналы на изображениях #2 и #4 были объединены, чтобы получить изображение #5. Подобно IVIS-изображениям на фиг. 18A, зеленая флуоресценция на изображениях #3 и #4 указывает на присутствие у мышей меченного ФИТЦ сгустка крови человека. Однако красной флуоресценции не наблюдали при введении Dylight680-конъюгированной ретеплазы (изображение #1) или через 30 минут после введения (изображение #2). Комбинированное изображение #5 указывает на то, что Dylight680-конъюгированная ретеплаза не концентрируется вокруг имплантированного сгустка крови человека, поскольку на изображении присутствует только зеленый сигнал.
[0192] Для количественной оценки уровня флуоресценции образцов, меченных Dylight680, с точки зрения эффективности источника излучения (RE), интенсивность флуоресценции изображений, снятых в определенные моменты времени, была нормализована по отношению к эталонному изображению, полученному с ex/em = 675/720 в момент времени 0 минут. Таким образом, эти результаты приведены на фиг. 19C, которая показывает, что настоящая ретеплаза-(3D5 scFv) может нацеливаться на сгусток крови человека в НПВ мышиной модели, тогда как ретеплаза не может эффективно нацеливаться на сгусток крови человека в НПВ мышиной модели.
[0193] Пример 26: Оценка времени полужизни рекомбинантного полипептида ретеплазы-(3D5 scFv) у крыс с помощью твeрдофаного ИФА
[0194] Для измерения времени полужизни альтеплазы, ретеплазы и рекомбинантного полипептида ретеплазы-(3D5 scFv) твeрдофазный ИФА проводили на крысах после внутривенного введения. Уровни белка альтеплазы, ретеплазы и рекомбинантного полипептида ретеплазы-(3D5 scFv) в образцах сыворотки крови количественно определяли с помощью метода твeрдофазного ИФА. Крыс линии Wistar в возрасте 6 недель приобретали в компании BioLasco (Тайбэй, Тайвань). Крыс распределяли по группам по три крысы в каждой группе, и им внутривенно вводили примерно 500 мкл молекулы лекарственного средства в дозе 0,364 мг/кг.
[0195] Для твeрдофазного ИФА покрытые планшеты готовили следующим образом. 100 мкл TBS, содержащего конечную концентрацию 1,0 мкг/мл поликлонального кроличьего антитела против ретеплазы (производства LTK BioLaboratories Co., Ltd., Таоюань, Тайвань), добавляли в лунки планшетов, а затем планшеты инкубировали при температуре 4°C в течение 18 часов, затем промывали TBS и блокировали буфером (5% обезжиренное сухое молоко/ФСБ).
[0196] После этого 100 мкл собранных образцов крови в различных разведениях добавляли в каждую лунку и инкубировали при комнатной температуре в течение 1 часа. Затем планшет промывали три раза; в лунки добавляли 100 мкл 1,65 мкг/мл конъюгированных с HRP поликлональных кроличьих антител против ретеплазы; а затем планшет инкубировали в течение 1 часа при комнатной температуре. Лунки промывали трижды и добавляли 100 мкл субстратного буфера ТМБ. Через 5 минут развитие окраски останавливали с помощью 1 М HCl. Оптическую плотность (OD) измеряли при длине волны 450 нм с использованием считывающего устройства для микропланшетов.
[0197] На фиг. 19 показаны фармакокинетические профили альтеплазы, ретеплазы и полипептида рекомбинантной ретеплазы-(3D5 scFv). Как видно на фиг. 19, полипептид ретеплазы-(3D5 scFv) настоящего изобретения демонстрирует более высокие уровни белка в сыворотке крови крыс в различные моменты времени по сравнению с альтеплазой и ретеплазой. Эти данные показывают, что настоящий полипептид рекомбинантной ретеплазы-(3D5 scFv) имеет более длительное время полужизни, чем альтеплаза или ретеплаза.
[0198] Пример 27: Время полужизни рекомбинантного полипептида ретеплазы-(3D5 scFv) у крысы
[0199] Для исследования времени полужизни рекомбинантного полипептида ретеплазы-(3D5 scFv) в крыс после внутривенного введения проводили дополнительный протеолитический анализ. Уровень рекомбинантного полипептида ретеплазы-(3D5 scFv) в сыворотке крови определяли с точки зрения протеолитической активности полипептида ретеплазы-(3D5 scFv), и протоколы были аналогичны описанным в предыдущих примерах.
[0200] Крыс линии Wistar в возрасте 6 недель приобретали у фирмы BioLasco (Тайбэй, Тайвань). Крыс распределяли по группам по три крысы в группе и внутривенно вводили примерно 500 мкл рекомбинантного полипептида ретеплазы-(3D5 scFv) или альтеплазы в дозе 0,364 мг/кг. Образцы крови собирали через 10, 20, 40 и 120 минут после внутривенного введения.
[0201] 0,8 мМ хромогенного субстрата, CH3SO2-D-гексагидротирозин-Gly-Arg-п-нитроанилид•AcOH (Sigma) и каждый разбавленный образец крови (1/10) инкубировали в 96-луночных планшетах с плоским дном (Nunc) при температуре 25°C в течение 15 минут. Протеолитическая активность настоящей ретеплазы-(3D5 scFv) или альтеплазы приводила к гидролизу субстрата, и высвобождение свободного п-нитроанилина желтого цвета измеряли при длине волны 405 нм с использованием считывающего устройства для микропланшетов.
[0202] На фиг. 20 показаны фармакокинетические профили полипептида рекомбинантной ретеплазы-(3D5 scFv) и альтеплазы. Как видно на фиг. 20, полипептид ретеплазы-(3D5 scFv) настоящего изобретения демонстрирует значительно более высокие уровни белка в сыворотке крови крыс по сравнению с альтеплазой. Ввиду вышеизложенного, полипептид рекомбинантной ретеплазы-(3D5 scFv) настоящего изобретения имеет более длительное время полужизни, чем альтеплаза, что согласуется с результатами, полученными в предыдущих примерах.
[0203] Пример 28: Получение полипептида рекомбинантной-(3D5 scFv)-ретеплазы
[0204] Полипептид рекомбинантной (3D5 VL-(G4S)3-VH scFv α фибрин)-ретеплазы получали путем слияния 3D5 scFv, специфичного по отношению к фибрину человека, с N-концом ретеплазы через гибкий линкер. Экспрессия сконструированного гена в клетках Expi293F и очистка экспрессированного полипептида были аналогичны тем, которые описаны в предыдущих примерах.
[0205] scFv имел ориентацию VL-линкер-VH, и два домена были соединены гибким линкером. Последовательность рекомбинантного полипептида показана в SEQ ID NO: 14. Характеристику новой конструкции проводили с использованием SDS-ПААГ. Результаты анализа в 10% невосстанавливающем SDA-ПААГ на фиг. 21A показывают, что образец на дорожке #2 имеет ожидаемый продукт с молекулярной массой примерно 71 кДа.
[0206] Для сравнения аффинности связывания полипептидов рекомбинантной (3D5 scFv)-ретеплазы с человеческим фибриногеном и фибрином проводили твeрдофазный ИФА, и протоколы были аналогичны описанным в предыдущих примерах.
[0207] Полипептид рекомбинантной-(3D5 scFv)-ретеплазы детектировали с использованием конъюгированных с HRP поликлональных кроличьих антител против ретеплазы. Результаты твeрдофазного ИФА, приведенные на фигуре 21B, показывают, что полипептиды (3D5 scFv)-ретеплазы настоящего изобретения могут специфично связываться с фибрином человека, но не с фибриногеном человека.
[0208] Пример 29: Дозозависимая тромболитическая активность полипептидов рекомбинантной (3D5 scFv)-ретеплазы в отношении сгустка крови человека
[0209] Для оценки тромболитической активности полипептида рекомбинантной (3D5 scFv)-ретеплазы в отношении к сгустку крови человека проводили тромболитический анализ цельной крови, и протоколы были аналогичны описанным в предыдущих примерах.
[0210] Полипептид рекомбинантной (3D5 scFv)-ретеплазы разводили в 70 мкл ФСБ до конечных концентраций 12,5, 25 и 50 нМ. Образец объeмом 70 мкл одновременно добавляли в лунки, содержащие сгустки крови человека, при комнатной температуре в течение 3 минут с помощью многоканальной пипетки. После удаления образцов и трехкратной промывки сгустка 250 мкл ФСБ в лунки добавляли 70 мкл сыворотки крови человека и определяли деградацию сгустков крови человека с помощью считывающего устройства для микропланшетов (Molecular Devices) путем измерения оптической плотности при длине волны 510 нм, когда кровь из растворенного сгустка постепенно покрывала центр лунки. Данные обрабатывали с помощью программного обеспечения Graph Pad Prism.
[0211] Результаты анализа, приведенные на фиг. 22, показывают, что полипептид (3D5 scFv)-ретеплазы нацелен на сгустки крови человека и проявляет тромболитическую активность при концентрациях 12,5, 25 и 50 нМ.
[0212] Следует понимать, что приведенное выше описание вариантов осуществления изобретения дано только в качестве примера и что различные модификации могут быть выполнены специалистами в данной области техники. Приведенные выше описание, примеры и данные предоставляют полное описание структуры и применения приведенных в качестве примеров вариантов осуществления изобретения. Хотя различные варианты осуществления настоящего изобретения были описаны выше с определенной степенью конкретности или со ссылкой на один или несколько отдельных вариантов осуществления изобретения, специалисты в данной области техники могут внести многочисленные изменения в раскрытые варианты осуществления изобретения, не выходя за рамки сущности или объeма настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ИММУНВОРК ИНК.
<120> ПОЛИПЕПТИД ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ ТРОМБОВ
<130> P3168-PCT
<150> US62/770,188
<151> 2018-11-21
<160> 22
<170> BiSSAP 1.3.6
<210> 1
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Asn Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp Asp Ser Pro Val
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 2
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 3
<211> 244
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Asn Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp Asp Ser Pro Val
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Gly Ser Thr Ser
100 105 110
Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe Gly Ile
145 150 155 160
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser
165 170 175
Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
210 215 220
Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val
225 230 235 240
Thr Val Ser Ser
<210> 4
<211> 244
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Gly Phe Tyr
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Tyr Pro Ser Gly Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asp Tyr Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Gly Ser Thr Ser
100 105 110
Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Asn Asp Phe Ser Ile
145 150 155 160
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Gly
165 170 175
Ile Trp Pro Tyr Gly Gly Tyr Thr Phe Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Arg
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
210 215 220
Phe Gly Tyr Tyr Ser Phe Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val
225 230 235 240
Thr Val Ser Ser
<210> 5
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Asn Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp Asp Ser Pro Val
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Gly Gly Gly Gly
100 105 110
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
115 120 125
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
130 135 140
Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe Gly Ile His Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile Trp Pro
165 170 175
Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
180 185 190
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
195 200 205
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Trp Phe
210 215 220
Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 6
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Lys Tyr
20 25 30
Ile Ala Trp Phe Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Leu Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Asn Leu Thr Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 7
<211> 443
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 7
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ala Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Asn Thr Ala Tyr
65 70 75 80
Val Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Leu Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
115 120 125
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
180 185 190
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Lys Ala Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
210 215 220
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Asp Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
340 345 350
Glu Leu Thr Arg Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 8
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Asn Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp Asp Ser Pro Val
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 9
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Ala Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Asp Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Asp Glu Leu Thr Arg Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 10
<211> 611
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 10
Ser Tyr Gln Gly Asn Ser Asp Cys Tyr Phe Gly Asn Gly Ser Ala Tyr
1 5 10 15
Arg Gly Thr His Ser Leu Thr Glu Ser Gly Ala Ser Cys Leu Pro Trp
20 25 30
Asn Ser Met Ile Leu Ile Gly Lys Val Tyr Thr Ala Gln Asn Pro Ser
35 40 45
Ala Gln Ala Leu Gly Leu Gly Lys His Asn Tyr Cys Arg Asn Pro Asp
50 55 60
Gly Asp Ala Lys Pro Trp Cys His Val Leu Lys Asn Arg Arg Leu Thr
65 70 75 80
Trp Glu Tyr Cys Asp Val Pro Ser Cys Ser Thr Cys Gly Leu Arg Gln
85 90 95
Tyr Ser Gln Pro Gln Phe Arg Ile Lys Gly Gly Leu Phe Ala Asp Ile
100 105 110
Ala Ser His Pro Trp Gln Ala Ala Ile Phe Ala Lys His Arg Arg Ser
115 120 125
Pro Gly Glu Arg Phe Leu Cys Gly Gly Ile Leu Ile Ser Ser Cys Trp
130 135 140
Ile Leu Ser Ala Ala His Cys Phe Gln Glu Arg Phe Pro Pro His His
145 150 155 160
Leu Thr Val Ile Leu Gly Arg Thr Tyr Arg Val Val Pro Gly Glu Glu
165 170 175
Glu Gln Lys Phe Glu Val Glu Lys Tyr Ile Val His Lys Glu Phe Asp
180 185 190
Asp Asp Thr Tyr Asp Asn Asp Ile Ala Leu Leu Gln Leu Lys Ser Asp
195 200 205
Ser Ser Arg Cys Ala Gln Glu Ser Ser Val Val Arg Thr Val Cys Leu
210 215 220
Pro Pro Ala Asp Leu Gln Leu Pro Asp Trp Thr Glu Cys Glu Leu Ser
225 230 235 240
Gly Tyr Gly Lys His Glu Ala Leu Ser Pro Phe Tyr Ser Glu Arg Leu
245 250 255
Lys Glu Ala His Val Arg Leu Tyr Pro Ser Ser Arg Cys Thr Ser Gln
260 265 270
His Leu Leu Asn Arg Thr Val Thr Asp Asn Met Leu Cys Ala Gly Asp
275 280 285
Thr Arg Ser Gly Gly Pro Gln Ala Asn Leu His Asp Ala Cys Gln Gly
290 295 300
Asp Ser Gly Gly Pro Leu Val Cys Leu Asn Asp Gly Arg Met Thr Leu
305 310 315 320
Val Gly Ile Ile Ser Trp Gly Leu Gly Cys Gly Gln Lys Asp Val Pro
325 330 335
Gly Val Tyr Thr Lys Val Thr Asn Tyr Leu Asp Trp Ile Arg Asp Asn
340 345 350
Met Arg Pro Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
355 360 365
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
370 375 380
Ala Ser Leu Gly Gly Lys Val Thr Ile Thr Cys Lys Ala Ser Gln Asp
385 390 395 400
Ile Asn Lys Tyr Ile Ala Trp Phe Gln His Lys Pro Gly Lys Gly Pro
405 410 415
Arg Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser
420 425 430
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser
435 440 445
Asn Leu Glu Pro Glu Asp Leu Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
450 455 460
Asn Leu Thr Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
465 470 475 480
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
485 490 495
Lys Gly Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro
500 505 510
Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr
515 520 525
Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys
530 535 540
Trp Met Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ala Thr Tyr Ala Asp
545 550 555 560
Asp Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Asn Thr
565 570 575
Ala Tyr Val Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr
580 585 590
Phe Cys Ala Arg Leu Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr
595 600 605
Val Ser Ser
610
<210> 11
<211> 613
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 11
Ser Tyr Gln Gly Asn Ser Asp Cys Tyr Phe Gly Asn Gly Ser Ala Tyr
1 5 10 15
Arg Gly Thr His Ser Leu Thr Glu Ser Gly Ala Ser Cys Leu Pro Trp
20 25 30
Asn Ser Met Ile Leu Ile Gly Lys Val Tyr Thr Ala Gln Asn Pro Ser
35 40 45
Ala Gln Ala Leu Gly Leu Gly Lys His Asn Tyr Cys Arg Asn Pro Asp
50 55 60
Gly Asp Ala Lys Pro Trp Cys His Val Leu Lys Asn Arg Arg Leu Thr
65 70 75 80
Trp Glu Tyr Cys Asp Val Pro Ser Cys Ser Thr Cys Gly Leu Arg Gln
85 90 95
Tyr Ser Gln Pro Gln Phe Arg Ile Lys Gly Gly Leu Phe Ala Asp Ile
100 105 110
Ala Ser His Pro Trp Gln Ala Ala Ile Phe Ala Lys His Arg Arg Ser
115 120 125
Pro Gly Glu Arg Phe Leu Cys Gly Gly Ile Leu Ile Ser Ser Cys Trp
130 135 140
Ile Leu Ser Ala Ala His Cys Phe Gln Glu Arg Phe Pro Pro His His
145 150 155 160
Leu Thr Val Ile Leu Gly Arg Thr Tyr Arg Val Val Pro Gly Glu Glu
165 170 175
Glu Gln Lys Phe Glu Val Glu Lys Tyr Ile Val His Lys Glu Phe Asp
180 185 190
Asp Asp Thr Tyr Asp Asn Asp Ile Ala Leu Leu Gln Leu Lys Ser Asp
195 200 205
Ser Ser Arg Cys Ala Gln Glu Ser Ser Val Val Arg Thr Val Cys Leu
210 215 220
Pro Pro Ala Asp Leu Gln Leu Pro Asp Trp Thr Glu Cys Glu Leu Ser
225 230 235 240
Gly Tyr Gly Lys His Glu Ala Leu Ser Pro Phe Tyr Ser Glu Arg Leu
245 250 255
Lys Glu Ala His Val Arg Leu Tyr Pro Ser Ser Arg Cys Thr Ser Gln
260 265 270
His Leu Leu Asn Arg Thr Val Thr Asp Asn Met Leu Cys Ala Gly Asp
275 280 285
Thr Arg Ser Gly Gly Pro Gln Ala Asn Leu His Asp Ala Cys Gln Gly
290 295 300
Asp Ser Gly Gly Pro Leu Val Cys Leu Asn Asp Gly Arg Met Thr Leu
305 310 315 320
Val Gly Ile Ile Ser Trp Gly Leu Gly Cys Gly Gln Lys Asp Val Pro
325 330 335
Gly Val Tyr Thr Lys Val Thr Asn Tyr Leu Asp Trp Ile Arg Asp Asn
340 345 350
Met Arg Pro Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
355 360 365
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
370 375 380
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp
385 390 395 400
Val Ser Asn Asn Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
405 410 415
Lys Leu Leu Ile Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser
420 425 430
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
435 440 445
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp
450 455 460
Asp Ser Pro Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
465 470 475 480
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
485 490 495
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
500 505 510
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe Gly
515 520 525
Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
530 535 540
Ser Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys
545 550 555 560
Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu
565 570 575
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
580 585 590
Arg Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
595 600 605
Val Thr Val Ser Ser
610
<210> 12
<211> 616
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 12
Ser Tyr Gln Gly Asn Ser Asp Cys Tyr Phe Gly Asn Gly Ser Ala Tyr
1 5 10 15
Arg Gly Thr His Ser Leu Thr Glu Ser Gly Ala Ser Cys Leu Pro Trp
20 25 30
Asn Ser Met Ile Leu Ile Gly Lys Val Tyr Thr Ala Gln Asn Pro Ser
35 40 45
Ala Gln Ala Leu Gly Leu Gly Lys His Asn Tyr Cys Arg Asn Pro Asp
50 55 60
Gly Asp Ala Lys Pro Trp Cys His Val Leu Lys Asn Arg Arg Leu Thr
65 70 75 80
Trp Glu Tyr Cys Asp Val Pro Ser Cys Ser Thr Cys Gly Leu Arg Gln
85 90 95
Tyr Ser Gln Pro Gln Phe Arg Ile Lys Gly Gly Leu Phe Ala Asp Ile
100 105 110
Ala Ser His Pro Trp Gln Ala Ala Ile Phe Ala Lys His Arg Arg Ser
115 120 125
Pro Gly Glu Arg Phe Leu Cys Gly Gly Ile Leu Ile Ser Ser Cys Trp
130 135 140
Ile Leu Ser Ala Ala His Cys Phe Gln Glu Arg Phe Pro Pro His His
145 150 155 160
Leu Thr Val Ile Leu Gly Arg Thr Tyr Arg Val Val Pro Gly Glu Glu
165 170 175
Glu Gln Lys Phe Glu Val Glu Lys Tyr Ile Val His Lys Glu Phe Asp
180 185 190
Asp Asp Thr Tyr Asp Asn Asp Ile Ala Leu Leu Gln Leu Lys Ser Asp
195 200 205
Ser Ser Arg Cys Ala Gln Glu Ser Ser Val Val Arg Thr Val Cys Leu
210 215 220
Pro Pro Ala Asp Leu Gln Leu Pro Asp Trp Thr Glu Cys Glu Leu Ser
225 230 235 240
Gly Tyr Gly Lys His Glu Ala Leu Ser Pro Phe Tyr Ser Glu Arg Leu
245 250 255
Lys Glu Ala His Val Arg Leu Tyr Pro Ser Ser Arg Cys Thr Ser Gln
260 265 270
His Leu Leu Asn Arg Thr Val Thr Asp Asn Met Leu Cys Ala Gly Asp
275 280 285
Thr Arg Ser Gly Gly Pro Gln Ala Asn Leu His Asp Ala Cys Gln Gly
290 295 300
Asp Ser Gly Gly Pro Leu Val Cys Leu Asn Asp Gly Arg Met Thr Leu
305 310 315 320
Val Gly Ile Ile Ser Trp Gly Leu Gly Cys Gly Gln Lys Asp Val Pro
325 330 335
Gly Val Tyr Thr Lys Val Thr Asn Tyr Leu Asp Trp Ile Arg Asp Asn
340 345 350
Met Arg Pro Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
355 360 365
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
370 375 380
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp
385 390 395 400
Val Ser Asn Asn Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
405 410 415
Lys Leu Leu Ile Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser
420 425 430
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
435 440 445
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp
450 455 460
Asp Ser Pro Val Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
465 470 475 480
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
485 490 495
Lys Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro
500 505 510
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser
515 520 525
Asp Phe Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
530 535 540
Trp Val Ala Ser Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp
545 550 555 560
Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr
565 570 575
Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
580 585 590
Tyr Cys Ala Arg Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln
595 600 605
Gly Thr Leu Val Thr Val Ser Ser
610 615
<210> 13
<211> 599
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 13
Ser Tyr Gln Gly Asn Ser Asp Cys Tyr Phe Gly Asn Gly Ser Ala Tyr
1 5 10 15
Arg Gly Thr His Ser Leu Thr Glu Ser Gly Ala Ser Cys Leu Pro Trp
20 25 30
Asn Ser Met Ile Leu Ile Gly Lys Val Tyr Thr Ala Gln Asn Pro Ser
35 40 45
Ala Gln Ala Leu Gly Leu Gly Lys His Asn Tyr Cys Arg Asn Pro Asp
50 55 60
Gly Asp Ala Lys Pro Trp Cys His Val Leu Lys Asn Arg Arg Leu Thr
65 70 75 80
Trp Glu Tyr Cys Asp Val Pro Ser Cys Ser Thr Cys Gly Leu Arg Gln
85 90 95
Tyr Ser Gln Pro Gln Phe Arg Ile Lys Gly Gly Leu Phe Ala Asp Ile
100 105 110
Ala Ser His Pro Trp Gln Ala Ala Ile Phe Ala Lys His Arg Arg Ser
115 120 125
Pro Gly Glu Arg Phe Leu Cys Gly Gly Ile Leu Ile Ser Ser Cys Trp
130 135 140
Ile Leu Ser Ala Ala His Cys Phe Gln Glu Arg Phe Pro Pro His His
145 150 155 160
Leu Thr Val Ile Leu Gly Arg Thr Tyr Arg Val Val Pro Gly Glu Glu
165 170 175
Glu Gln Lys Phe Glu Val Glu Lys Tyr Ile Val His Lys Glu Phe Asp
180 185 190
Asp Asp Thr Tyr Asp Asn Asp Ile Ala Leu Leu Gln Leu Lys Ser Asp
195 200 205
Ser Ser Arg Cys Ala Gln Glu Ser Ser Val Val Arg Thr Val Cys Leu
210 215 220
Pro Pro Ala Asp Leu Gln Leu Pro Asp Trp Thr Glu Cys Glu Leu Ser
225 230 235 240
Gly Tyr Gly Lys His Glu Ala Leu Ser Pro Phe Tyr Ser Glu Arg Leu
245 250 255
Lys Glu Ala His Val Arg Leu Tyr Pro Ser Ser Arg Cys Thr Ser Gln
260 265 270
His Leu Leu Asn Arg Thr Val Thr Asp Asn Met Leu Cys Ala Gly Asp
275 280 285
Thr Arg Ser Gly Gly Pro Gln Ala Asn Leu His Asp Ala Cys Gln Gly
290 295 300
Asp Ser Gly Gly Pro Leu Val Cys Leu Asn Asp Gly Arg Met Thr Leu
305 310 315 320
Val Gly Ile Ile Ser Trp Gly Leu Gly Cys Gly Gln Lys Asp Val Pro
325 330 335
Gly Val Tyr Thr Lys Val Thr Asn Tyr Leu Asp Trp Ile Arg Asp Asn
340 345 350
Met Arg Pro Ala Ser Gly Gly Ser Pro Pro Cys Pro Ser Cys Pro Ala
355 360 365
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
370 375 380
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
385 390 395 400
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
405 410 415
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
420 425 430
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
435 440 445
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
450 455 460
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
465 470 475 480
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
485 490 495
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
500 505 510
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
515 520 525
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
530 535 540
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
545 550 555 560
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
565 570 575
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
580 585 590
Gly Ser Gly Gly Gly Gly Ser
595
<210> 14
<211> 617
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Asn Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Trp Ser Pro Trp Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Trp Asp Ser Pro Val
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Gly Ser Thr Ser
100 105 110
Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val
115 120 125
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
130 135 140
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Asp Phe Gly Ile
145 150 155 160
His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser
165 170 175
Ile Trp Pro Ser Gly Gly Tyr Thr Tyr Tyr Ala Asp Ser Val Lys Gly
180 185 190
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
195 200 205
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
210 215 220
Ser Trp Phe Tyr Ser Trp Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val
225 230 235 240
Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
245 250 255
Gly Gly Gly Gly Ser Ser Tyr Gln Gly Asn Ser Asp Cys Tyr Phe Gly
260 265 270
Asn Gly Ser Ala Tyr Arg Gly Thr His Ser Leu Thr Glu Ser Gly Ala
275 280 285
Ser Cys Leu Pro Trp Asn Ser Met Ile Leu Ile Gly Lys Val Tyr Thr
290 295 300
Ala Gln Asn Pro Ser Ala Gln Ala Leu Gly Leu Gly Lys His Asn Tyr
305 310 315 320
Cys Arg Asn Pro Asp Gly Asp Ala Lys Pro Trp Cys His Val Leu Lys
325 330 335
Asn Arg Arg Leu Thr Trp Glu Tyr Cys Asp Val Pro Ser Cys Ser Thr
340 345 350
Cys Gly Leu Arg Gln Tyr Ser Gln Pro Gln Phe Arg Ile Lys Gly Gly
355 360 365
Leu Phe Ala Asp Ile Ala Ser His Pro Trp Gln Ala Ala Ile Phe Ala
370 375 380
Lys His Arg Arg Ser Pro Gly Glu Arg Phe Leu Cys Gly Gly Ile Leu
385 390 395 400
Ile Ser Ser Cys Trp Ile Leu Ser Ala Ala His Cys Phe Gln Glu Arg
405 410 415
Phe Pro Pro His His Leu Thr Val Ile Leu Gly Arg Thr Tyr Arg Val
420 425 430
Val Pro Gly Glu Glu Glu Gln Lys Phe Glu Val Glu Lys Tyr Ile Val
435 440 445
His Lys Glu Phe Asp Asp Asp Thr Tyr Asp Asn Asp Ile Ala Leu Leu
450 455 460
Gln Leu Lys Ser Asp Ser Ser Arg Cys Ala Gln Glu Ser Ser Val Val
465 470 475 480
Arg Thr Val Cys Leu Pro Pro Ala Asp Leu Gln Leu Pro Asp Trp Thr
485 490 495
Glu Cys Glu Leu Ser Gly Tyr Gly Lys His Glu Ala Leu Ser Pro Phe
500 505 510
Tyr Ser Glu Arg Leu Lys Glu Ala His Val Arg Leu Tyr Pro Ser Ser
515 520 525
Arg Cys Thr Ser Gln His Leu Leu Asn Arg Thr Val Thr Asp Asn Met
530 535 540
Leu Cys Ala Gly Asp Thr Arg Ser Gly Gly Pro Gln Ala Asn Leu His
545 550 555 560
Asp Ala Cys Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Leu Asn Asp
565 570 575
Gly Arg Met Thr Leu Val Gly Ile Ile Ser Trp Gly Leu Gly Cys Gly
580 585 590
Gln Lys Asp Val Pro Gly Val Tyr Thr Lys Val Thr Asn Tyr Leu Asp
595 600 605
Trp Ile Arg Asp Asn Met Arg Pro Ala
610 615
<210> 15
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 15
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 16
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 16
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 17
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 17
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Gly Trp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Ser Thr Gly Ser Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asp Phe Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 18
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Gly Asn Ser
20 25 30
Ser Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Trp Pro Tyr Trp Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Gly Ile Asn Asn Asp Gly Phe Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 19
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asp Asn Ser
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Ser Ala Arg Ser Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 20
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Asn Asn Tyr
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Gly Ile Trp Pro Tyr Trp Gly Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Asp Ser Asn Ser Tyr Ser Ser Tyr Ser Asp Gly Phe Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 21
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Gly Gly Trp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Ser Pro Arg Ser Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Phe Ser Ser Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 22
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Asn Asp Trp
20 25 30
Ser Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Gly Pro Phe Trp Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Phe Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВНОЙ ПОЛИПЕПТИД, ИМЕЮЩИЙ МЕТАЛЛСВЯЗЫВАЮЩИЙ МОТИВ, И СОДЕРЖАЩАЯ ИХ МОЛЕКУЛЯРНАЯ КОНСТРУКЦИЯ | 2020 |
|
RU2814475C2 |
| Белки, связывающие NKG2D, CD16 и опухолеассоциированный антиген | 2018 |
|
RU2816716C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2829097C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2788531C2 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ ДЛЯ АКТИВАЦИИ КЛЕТОК-НАТУРАЛЬНЫХ КИЛЛЕРОВ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2809125C2 |
| БЕЛОК, СВЯЗЫВАЮЩИЙСЯ С NKG2D, CD16 И С ОПУХОЛЕСПЕЦИФИЧЕСКИМ АНТИГЕНОМ | 2018 |
|
RU2826991C2 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ВСМА, NKG2D И CD16 | 2018 |
|
RU2805254C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА CAIX, ANO1, МЕЗОТЕЛИН, TROP2, СEA ИЛИ КЛАУДИН-18.2 | 2018 |
|
RU2792671C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ, НАЦЕЛЕННЫЕ НА NKG2D, CD16 И TROP2 | 2018 |
|
RU2820629C2 |
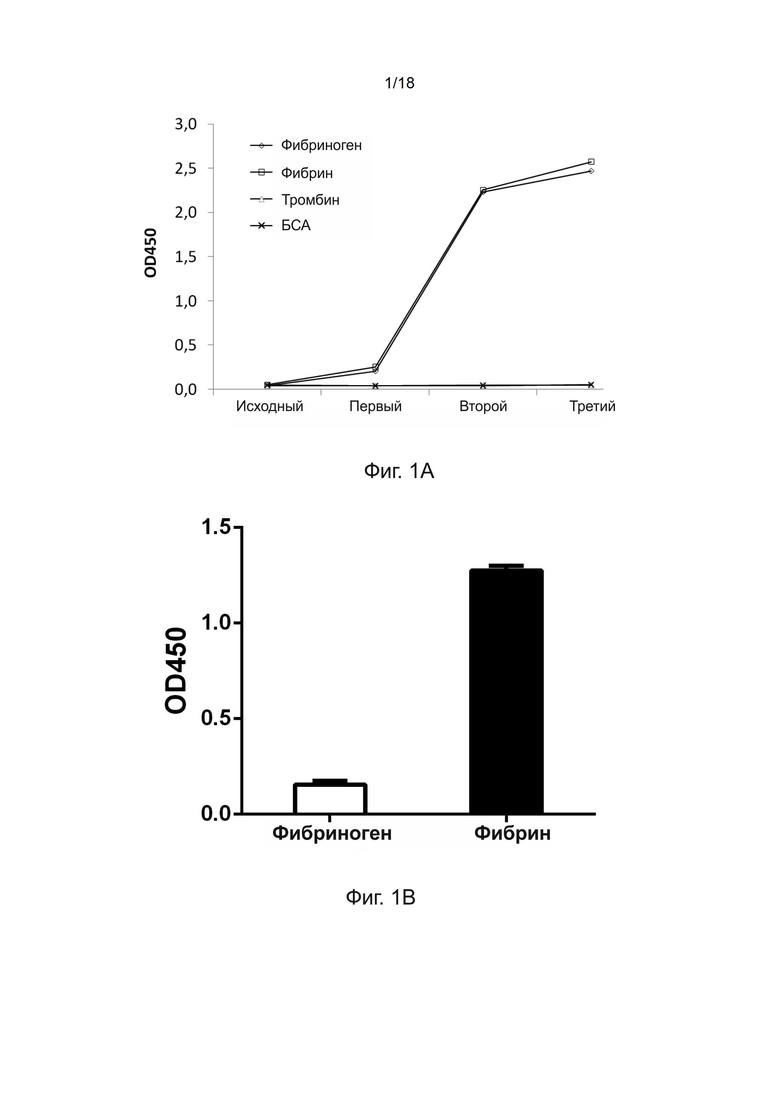
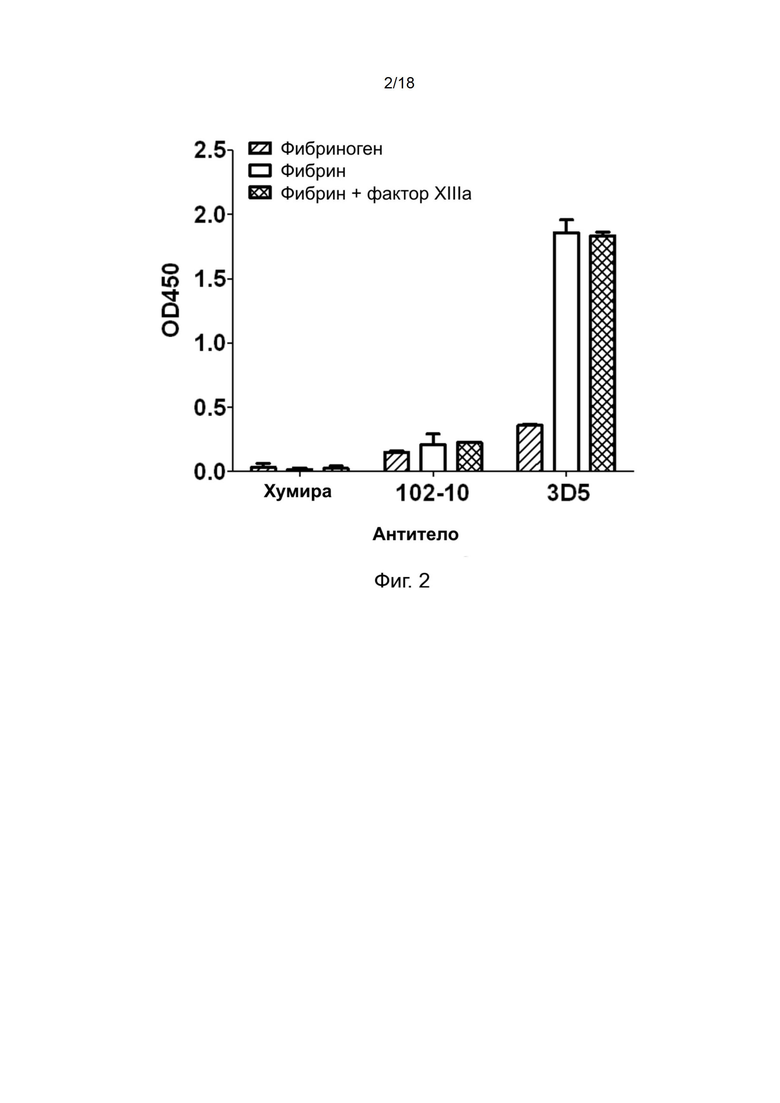
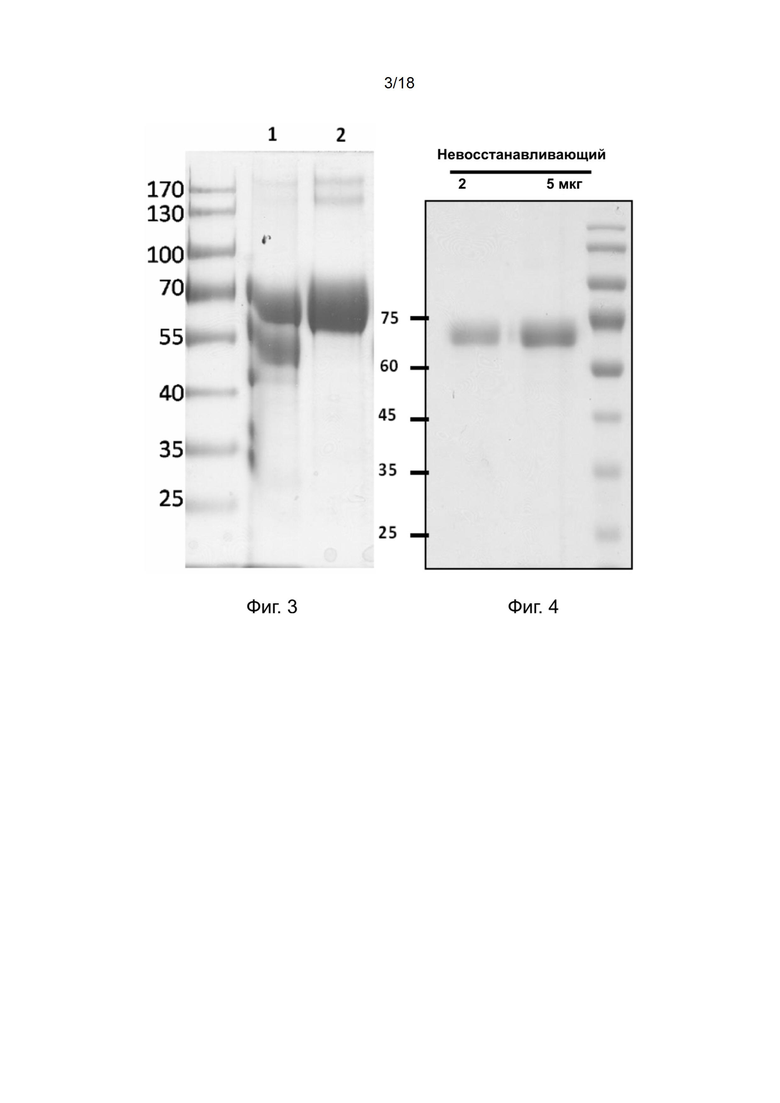
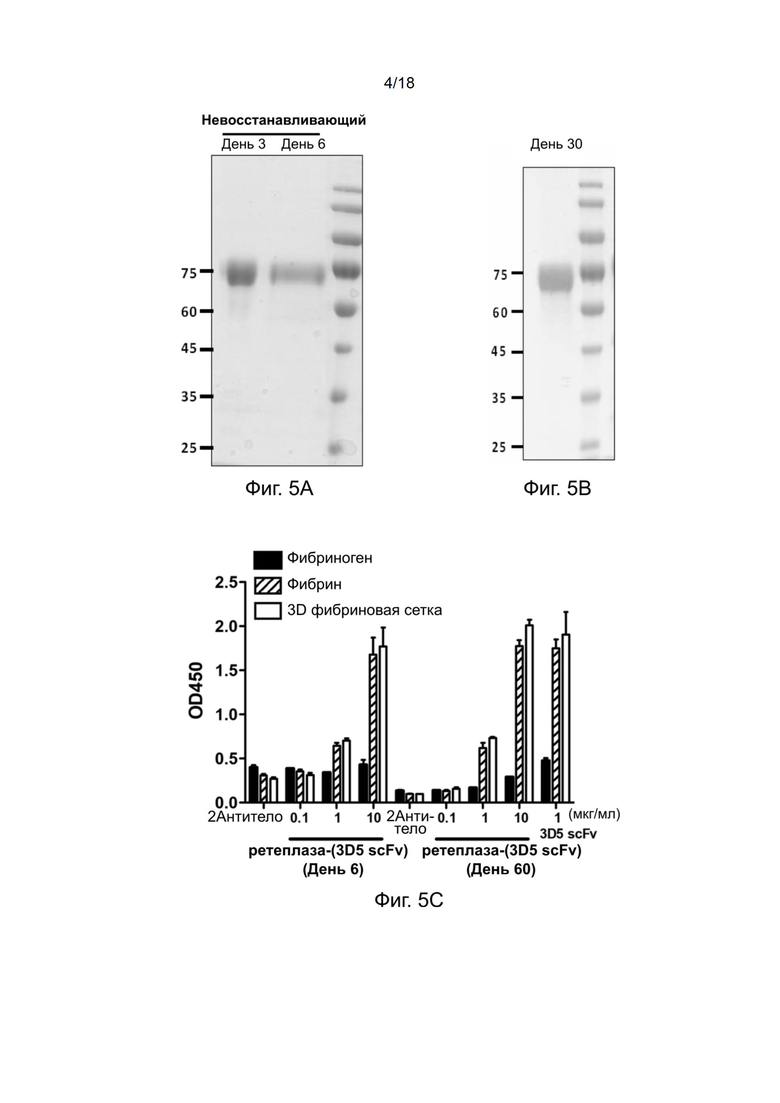
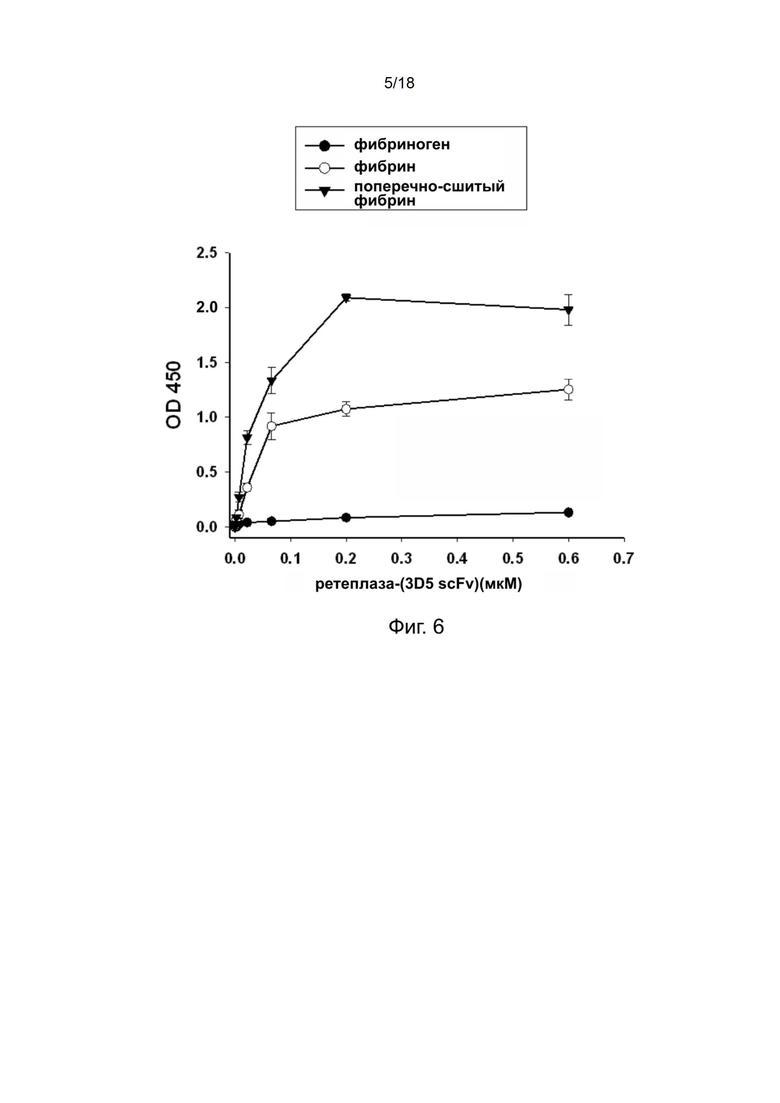
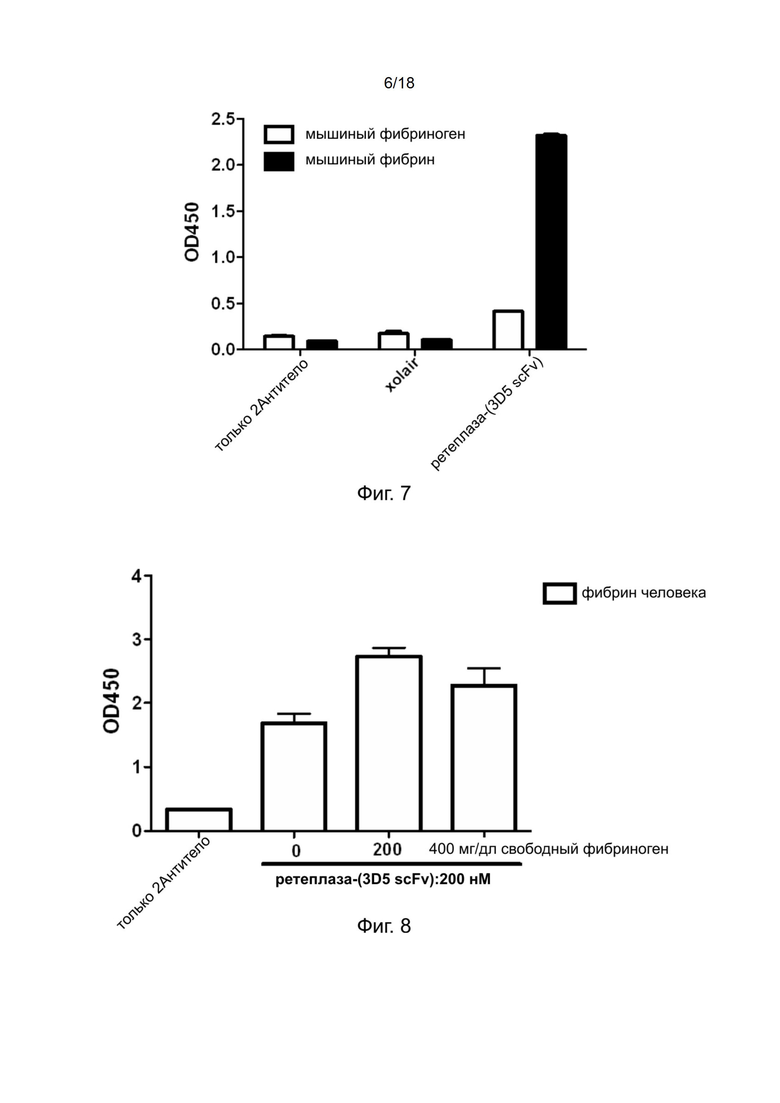
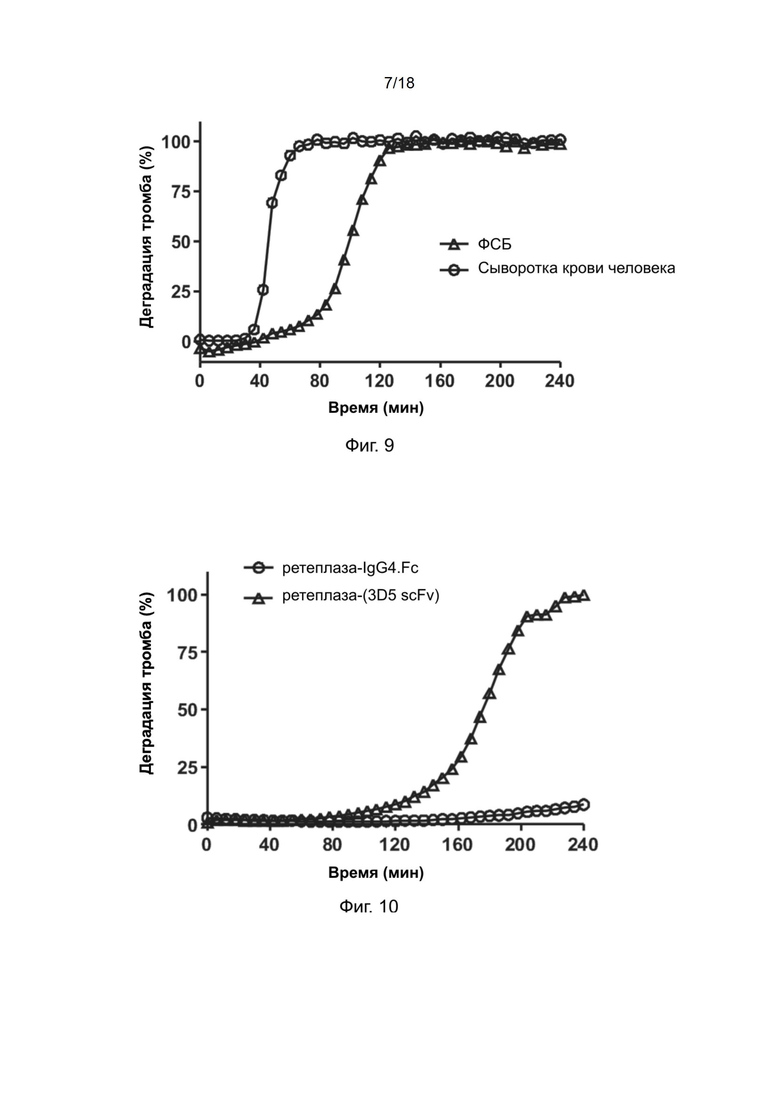
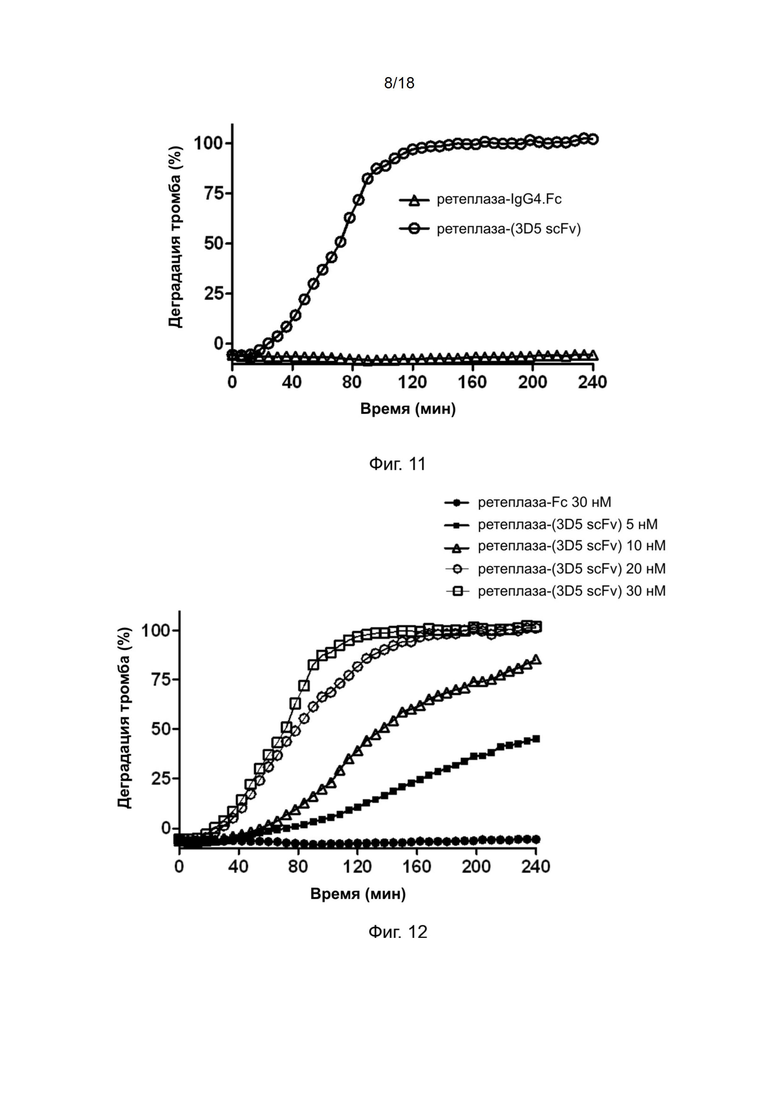
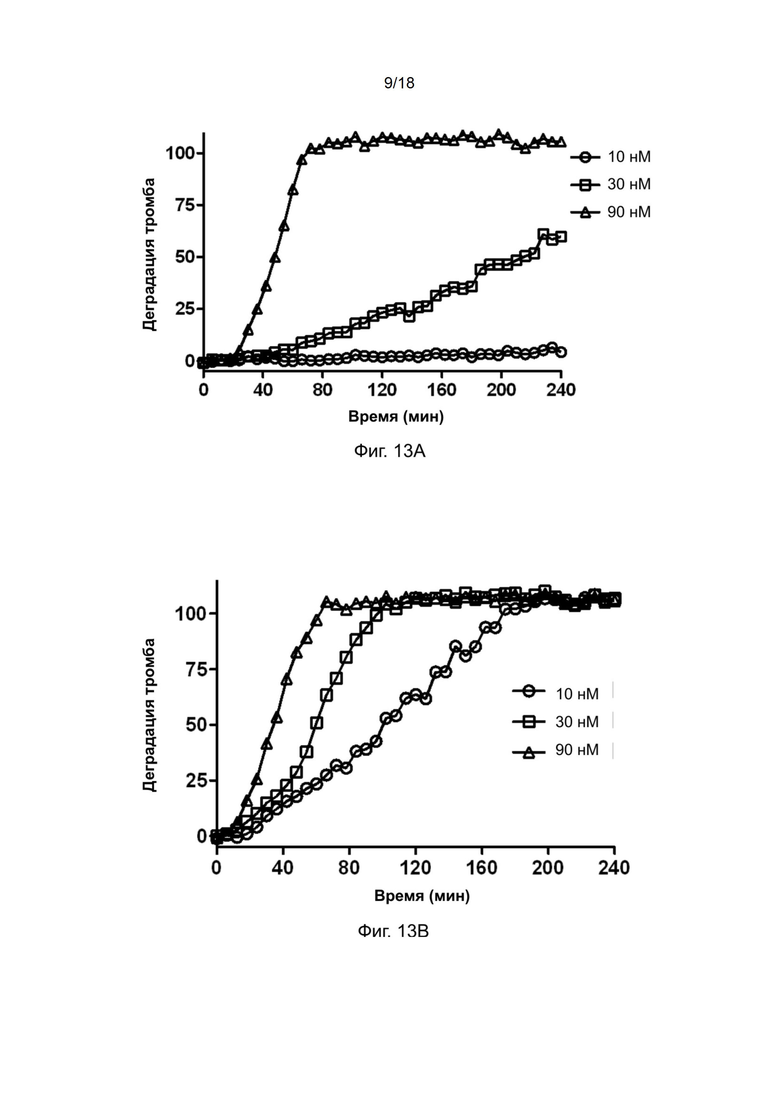
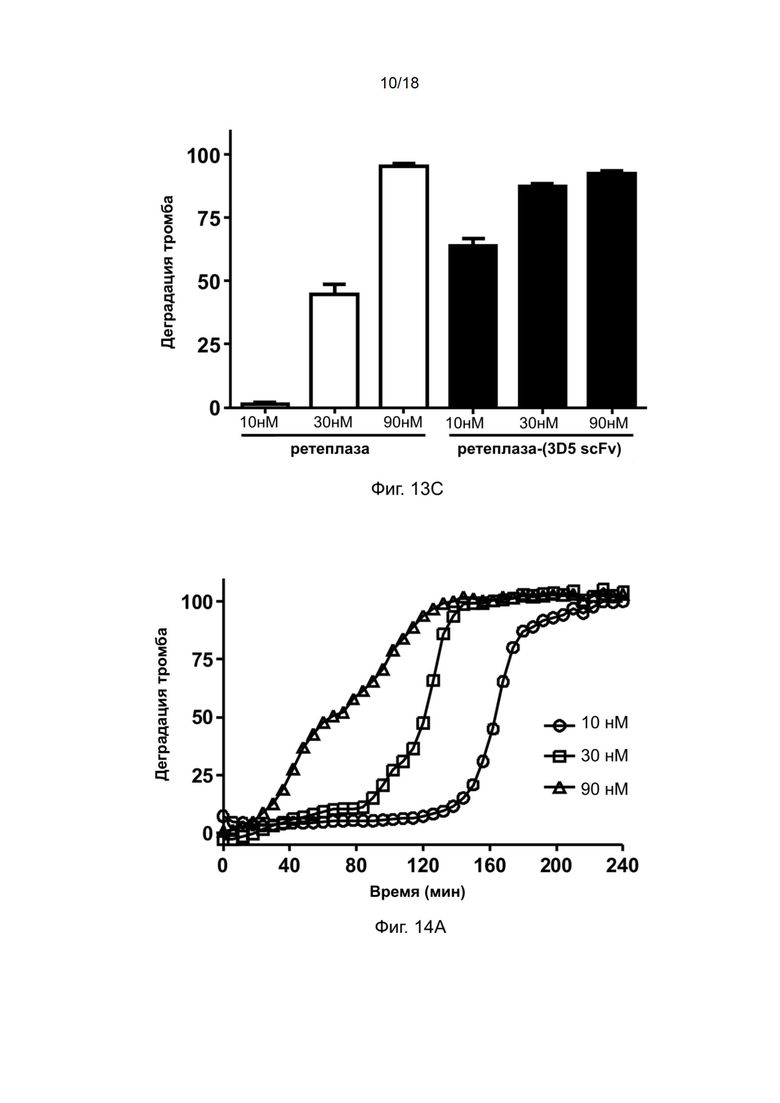
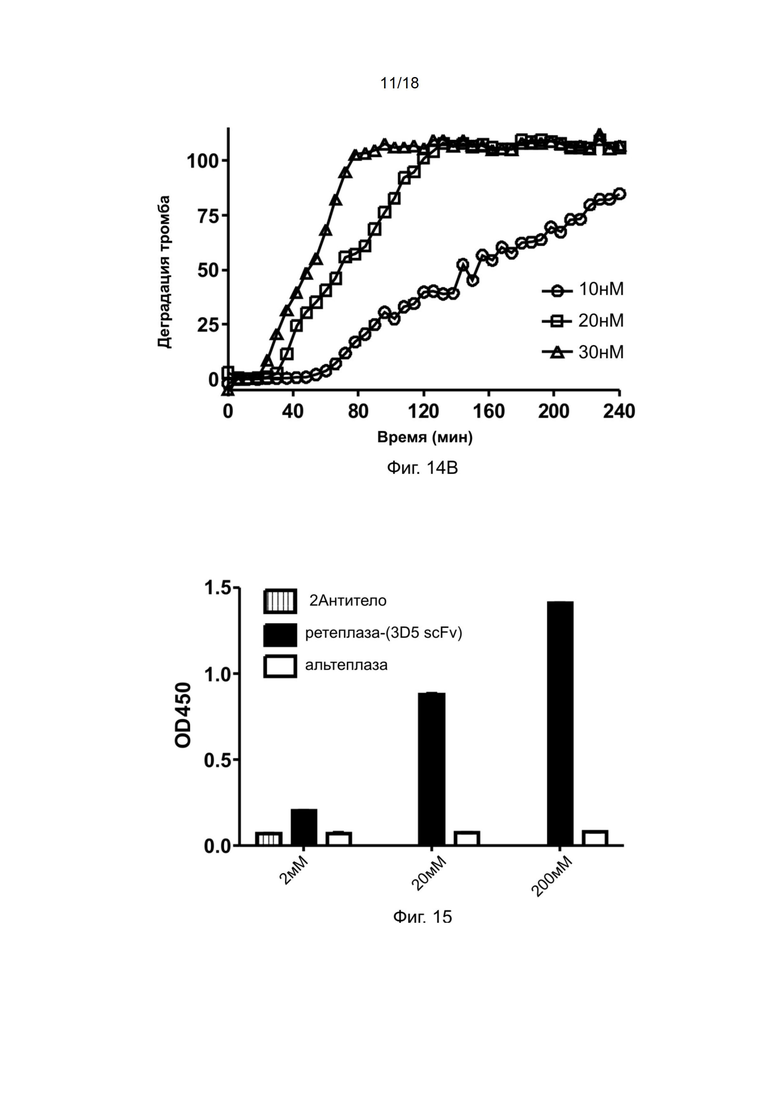
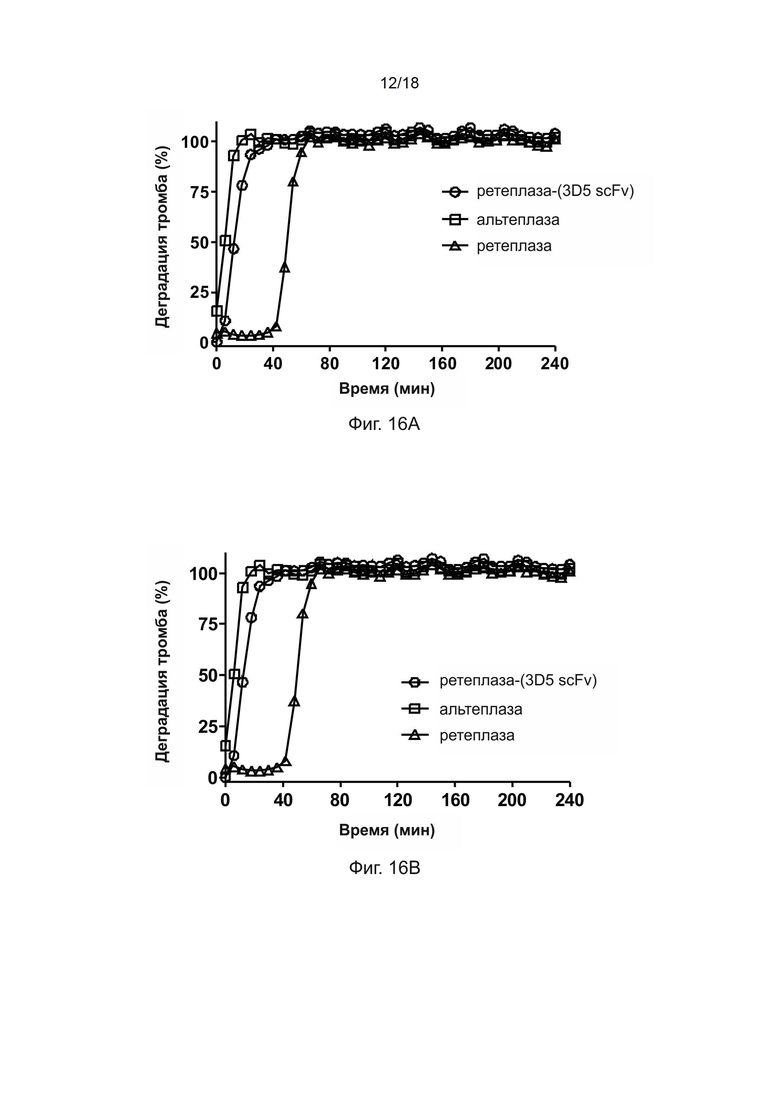
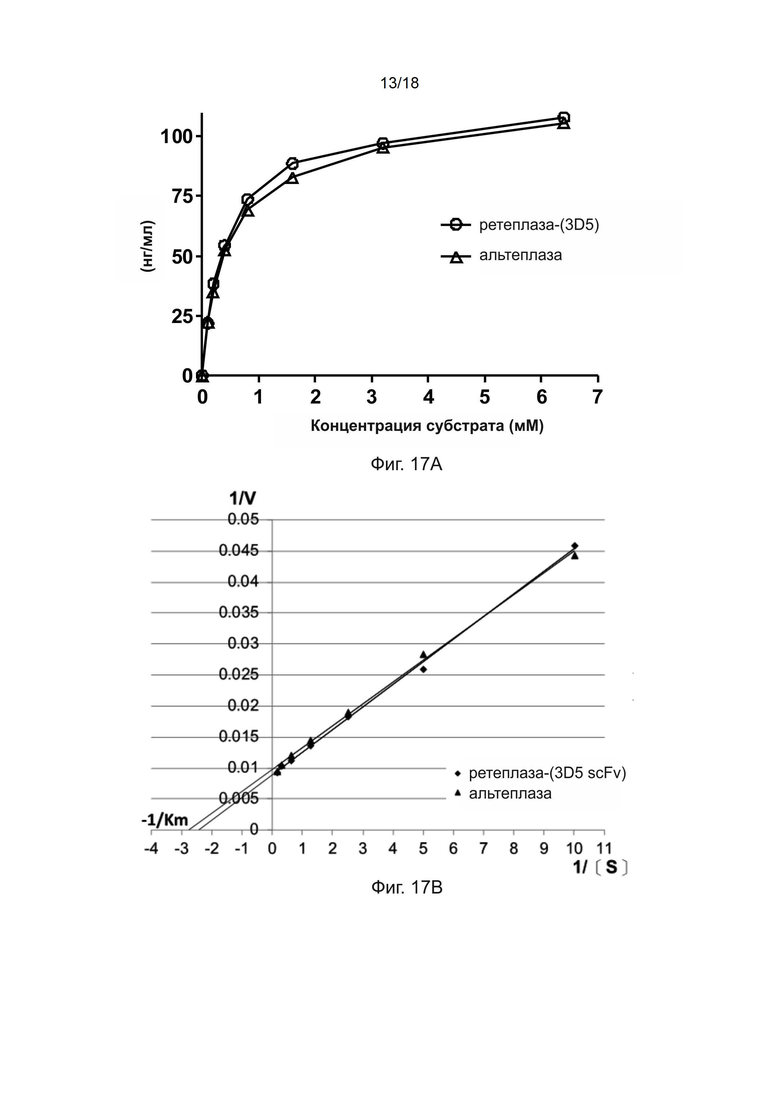
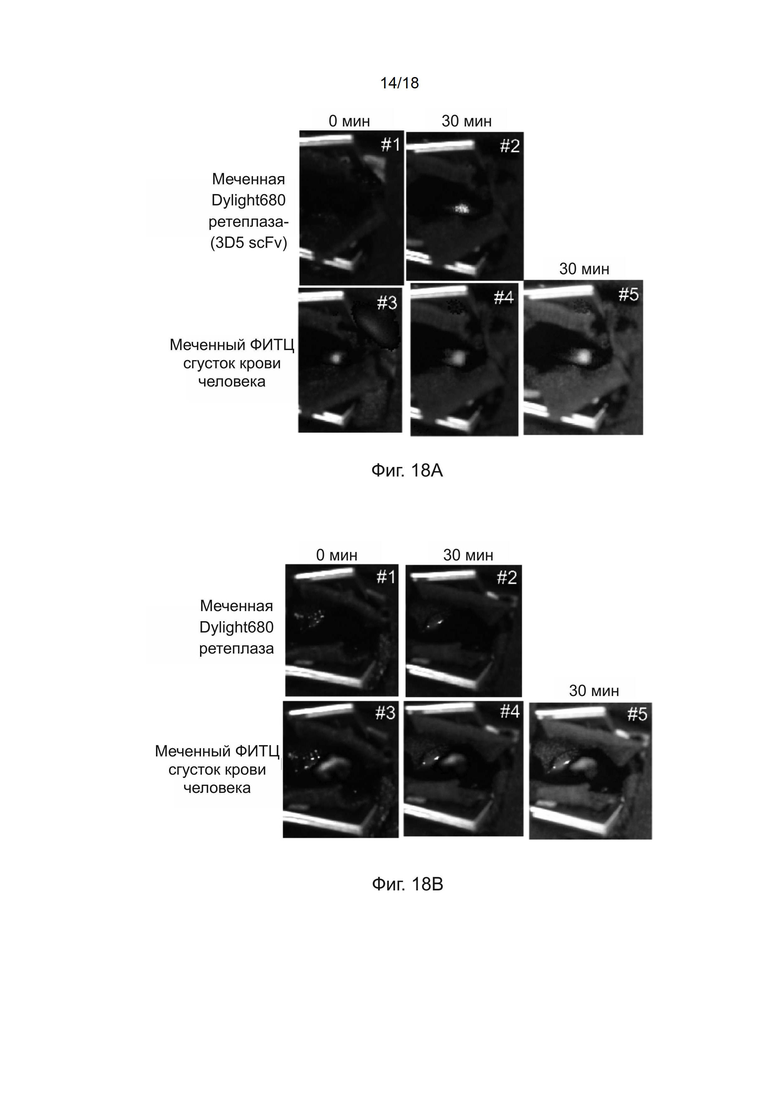
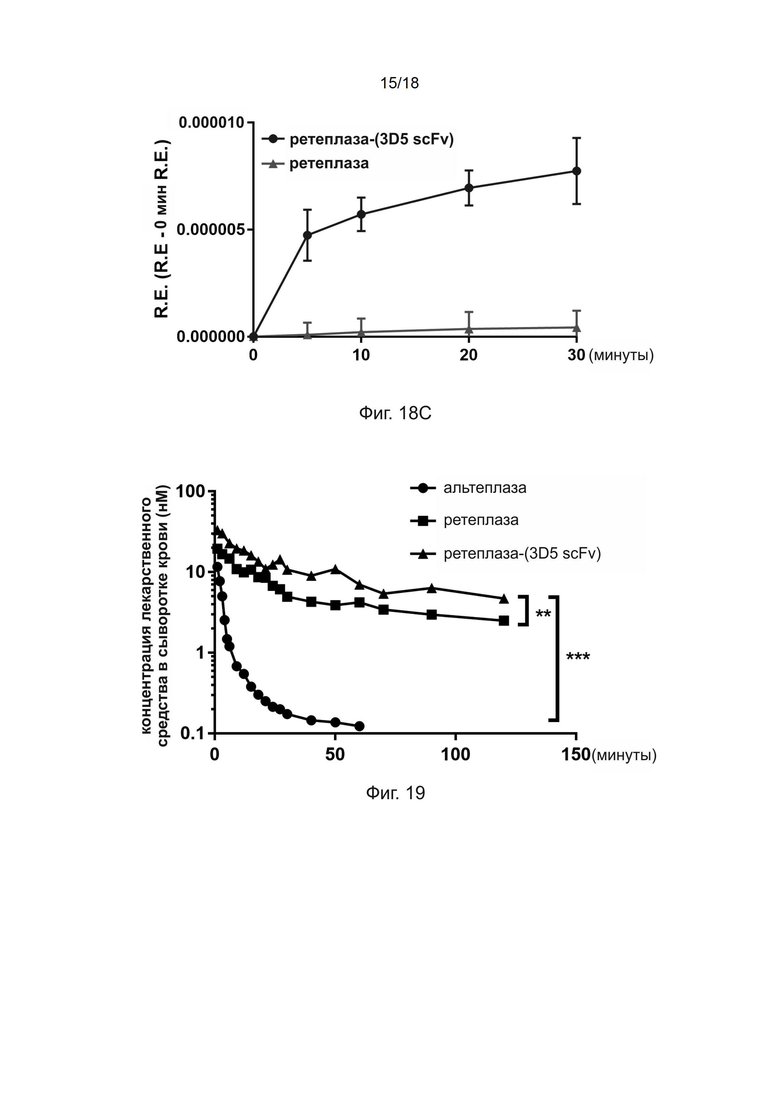
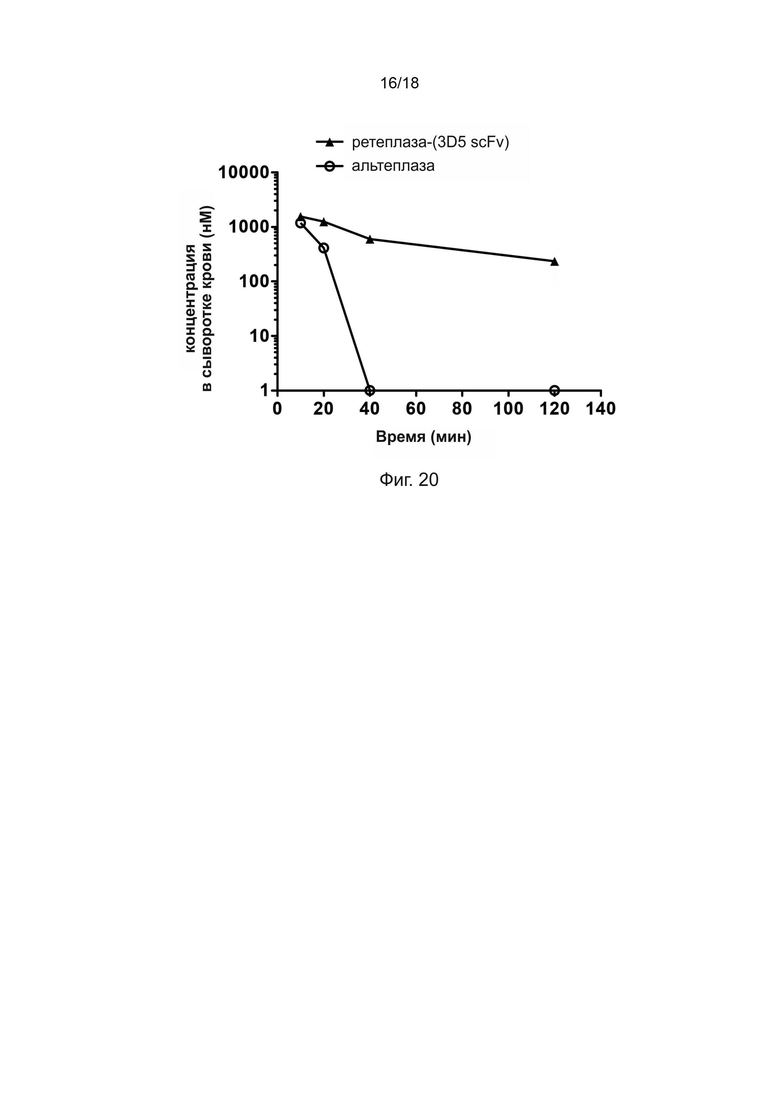
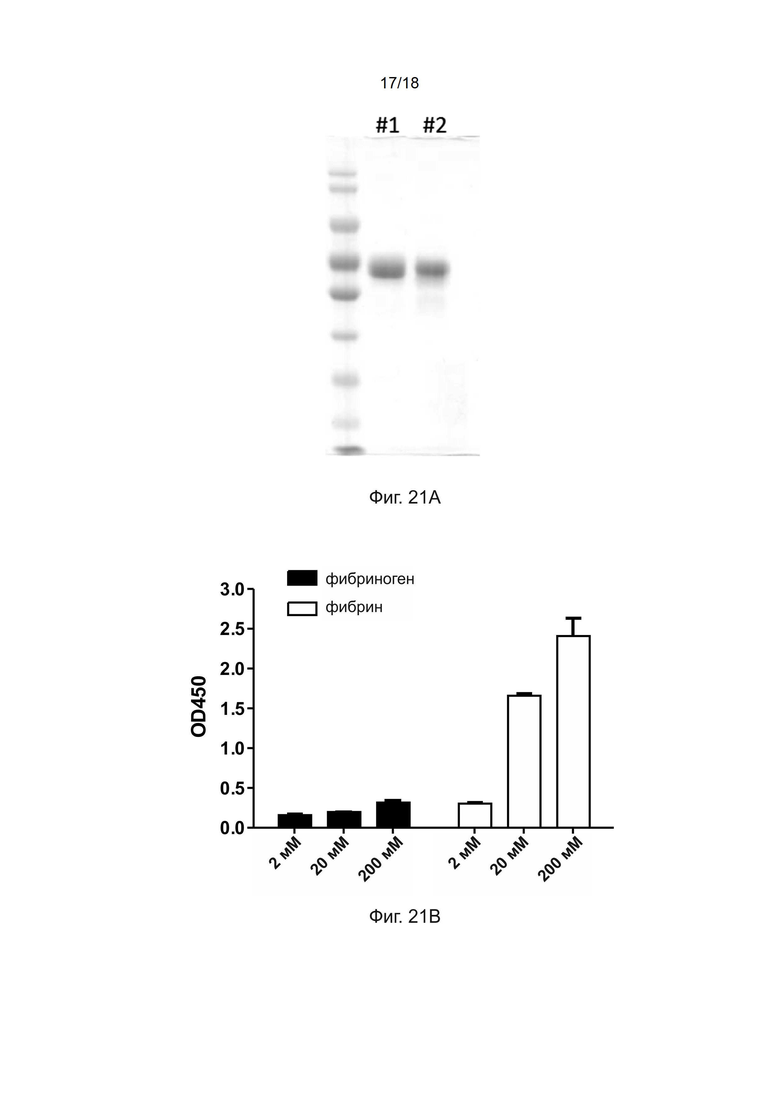
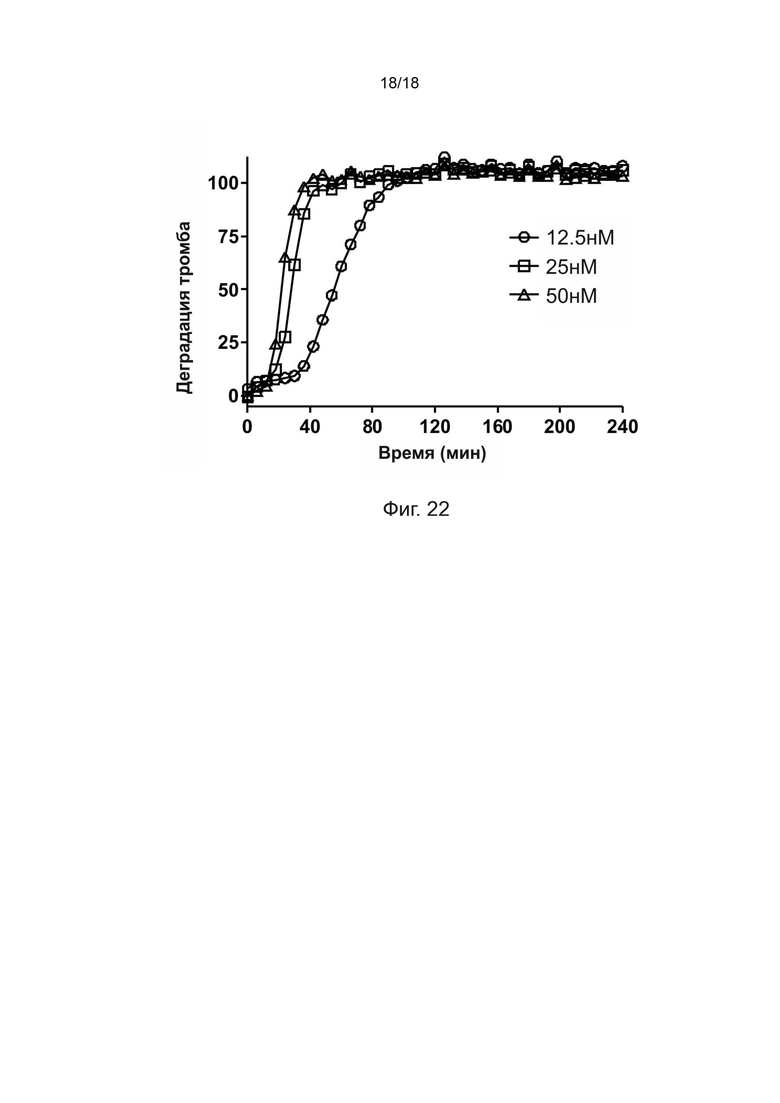
Изобретение относится к области биотехнологии и медицины, в частности к антифибриновому антителу, а также к полипептиду, содержащему упомянутое антифибриновое антитело и фрагмент сериновой протеазы активатора плазминогена человека (hu-tPA). Также представлен способ лечения тромбоза у нуждающегося в этом субъекта с помощью вышеупомянутого полипептида. 3 н. и 14 з.п. ф-лы, 22 ил., 1 табл., 29 пр.
1. Полипептид для лечения тромбоза, содержащий антифибриновое антитело и фрагмент сериновой протеазы активатора плазминогена человека (hu-tPA), где антифибриновое антитело связывается с человеческим фибрином с аффинностью в 10 раз большей, чем с человеческим фибриногеном, где антифибриновое антитело имеет вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, соответственно имеющие аминокислотные последовательности SEQ ID NO: 1 и 2, и где фрагмент сериновой протеазы hu-tPA представляет собой ретеплазу.
2. Полипептид по п.1, где полипептид связывается с человеческим фибрином лучше, чем hu-tPA.
3. Полипептид по п.1, где антифибриновое антитело представляет собой одноцепочечный вариабельный фрагмент (scFv).
4. Полипептид по п.1, где антифибриновое антитело имеет человеческое происхождение или является гуманизированным.
5. Полипептид по п.1, где антифибриновое антитело содержит линкер, имеющий последовательность SEQ ID NO: 16, соединяющий вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антифибринового антитела.
6. Полипептид по п.1, где полипептид имеет более длительное время полужизни в сыворотке крови у животного, чем ретеплаза.
7. Полипептид по п.1, где полипептид связывается с человеческим фибрином лучше, чем hu-tPA, и имеет более длительное время полужизни в сыворотке крови у животного, чем ретеплаза.
8. Полипептид по п.1, содержащий линкер, расположенный между ретеплазой и антифибриновым антителом.
9. Полипептид по п.1, где ретеплаза связана с N-концом антифибринового антитела.
10. Полипептид по п.9, где полипептид имеет аминокислотную последовательность SEQ ID NO: 11 или 12.
11. Полипептид по п.1, где ретеплаза связана с С-концом антифибринового антитела.
12. Полипептид по п.11, где полипептид имеет аминокислотную последовательность SEQ ID NO: 14.
13. Способ лечения тромбоза у нуждающегося в этом субъекта, включающий в себя этап введения субъекту эффективного количества полипептида по п.1.
14. Антифибриновое антитело, где антифибриновое антитело связывается с человеческим фибрином с аффинностью в 10 раз большей, чем с человеческим фибриногеном, и где антифибриновое антитело содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи, соответственно имеющие аминокислотные последовательности SEQ ID NO: 1 и 2.
15. Антифибриновое антитело по п.14, содержащее линкер, имеющий последовательность SEQ ID NO: 16, соединяющий вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антифибринового антитела.
16. Антифибриновое антитело по п.14, где антифибриновое антитело содержит шесть определяющих комплементарность областей (CDR), соответственно имеющих аминокислотные последовательности, соответствующие остаткам с 30 по 32 в SEQ ID NO: 1 (CDR-L1), остаткам с 49 по 54 в SEQ ID NO: 1 (CDR-L2), остаткам с 91 по 96 в SEQ ID NO: 1 (CDR-L3), остаткам с 30 по 33 в SEQ ID NO: 2 (CDR-H1), остаткам с 50 по 59 в SEQ ID NO: 2 (CDR-H2) и остаткам с 98 по 106 в SEQ ID NO: 2 (CDR-H3).
17. Антифибриновое антитело по п.14, где антифибриновое антитело представляет собой одноцепочечный вариабельный фрагмент (scFv).
| CN 0108431045 A, 21.08.2018 | |||
| Прибор для исправления снимков рельефа местности | 1921 |
|
SU301A1 |
| КАМЕРА ДЛЯ ЭЛЕКТРОКЛИМАТИЧЕСКИХ ИСПЫТАНИЙ | 1990 |
|
RU2054688C1 |
| CN 103623396 A, 12.03.2014 | |||
| MUZYKANTOV V.R | |||
| et al | |||
| Targeting of Antibody-conjugated Plasminogen Activators to the Pulmonary Vasculature | |||
| J | |||
| Pharmacol | |||
| Exp | |||
| Ther., 1996 | |||
| Vol | |||
| АППАРАТ ДЛЯ ОБОГАЩЕНИЯ РУД ПО МЕТОДУ ВСПЛЫВАНИЯ | 1915 |
|
SU279A1 |
| No | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ГИДРАВЛИЧЕСКИЙ ПЕРЕДАТОЧНЫЙ МЕХАНИЗМ ДЛЯ СООБЩЕНИЯ РАБОЧЕМУ ВАЛУ ПО ВЕЛИЧИНЕ И НАПРАВЛЕНИЮ ВРАЩЕНИЯ | 1923 |
|
SU1026A1 |
Авторы
Даты
2022-08-22—Публикация
2019-11-21—Подача