Изобретение относится к областям пептидов белковых комплексов человеческих TLP (белки, выделяемые из опухолей) с антигенной активностью, а также к антителам, реагирующим с такими белками, которые будут использоваться в диагностических и клинических целях.
Комплексы TLP являются белковыми комплексами, присутствующими в человеческих опухолевых клетках, особенно в клетках карциномы легких; среди белков TLP описан белок в 100 кДа (Tarro C., "Oncology" 40, 248-253, 1983). TLP выделены из опухолевых тканей, что описано в EP 283433, описание которого включено здесь в виде ссылки. Очень полезно иметь диагностические пробы (методы анализа) для идентификации таких комплексов или их фракций из неочищенных экстрактов легких.
Попытки автора получить специфические антитела к целым TLP не имели успеха. Поэтому важно идентифицировать антигенные области TLP (эпитопы) и индуцировать антитела к ним, чтобы получить специфические реагенты.
Автор данного изобретения идентифицировал пептидные последовательности белка TLP 100 кДа, обладающие антигенной активностью, получил специфические антитела и продемонстрировал, что указанные антитела специфически реагируют с TLP из карцином легких.
Соответственно, объектом этого изобретения является антигенный пептид выделяемых опухолью частиц (TLP), имеющий аминокислотную последовательность, заключенную в последовательности белка в 100 кДа из TLP.
По предпочтительному осуществлению изобретения указанный пептид имеет по крайней мере одну из аминокислотных последовательностей, перечисленных в конце описания, как Посл ИД N 1, Посл ИД N 2 или Посл ИД N 3. Предпочтительно указанные пептиды имеют синтетическое происхождение или же природный источник.
В дополнительном осуществлении изобретения указанный пептид содержит цистеиновый остаток или в карбоксильной, или в аминной концевой группе и молекулу-носитель, ковалентно связанную с указанным остатком; предпочтительно указанной молекулой-носителем является гемоцианин, наиболее предпочтительно указанный гемоцианин получают из устриц.
Другим объектом этого изобретения являются антитела, способные специфически обнаруживать белки TLP путем распознавания антигенного пептида выделяемых опухолью частиц (TLP), имеющего аминокислотную последовательность, заключенную в последовательности белка TLP 100 кДа.
Предпочтительно указанные антитела распознают пептид, имеющий по крайней мере одну из аминокислотных последовательностей, перечисленных в конце описания, как Посл ИД N 1, Посл ИД N 2 или Посл ИД N 3.
Дополнительным объектом этого изобретения являются диагностические наборы для определения TLP из образцов, содержащие антитела этого изобретения в качестве специфических реагентов.
Другим объектом этого изобретения является способ определения комплексов TLP в образцах, включающий стадии, как следуют ниже:
- иммунопреципитации указанного образца с помощью первого количества сыворотки к TLP;
- выявления указанных комплексов TLP в указанном иммунопреципитированном материале с помощью их реакции со вторым количеством указанной сыворотки к TLP и с помощью средств, обнаруживающих указанную реакцию.
Это изобретение будет описано далее со ссылкой на некоторые поясняющие, но не ограничивающие примеры, к которым относятся прилагаемые чертежи, где:
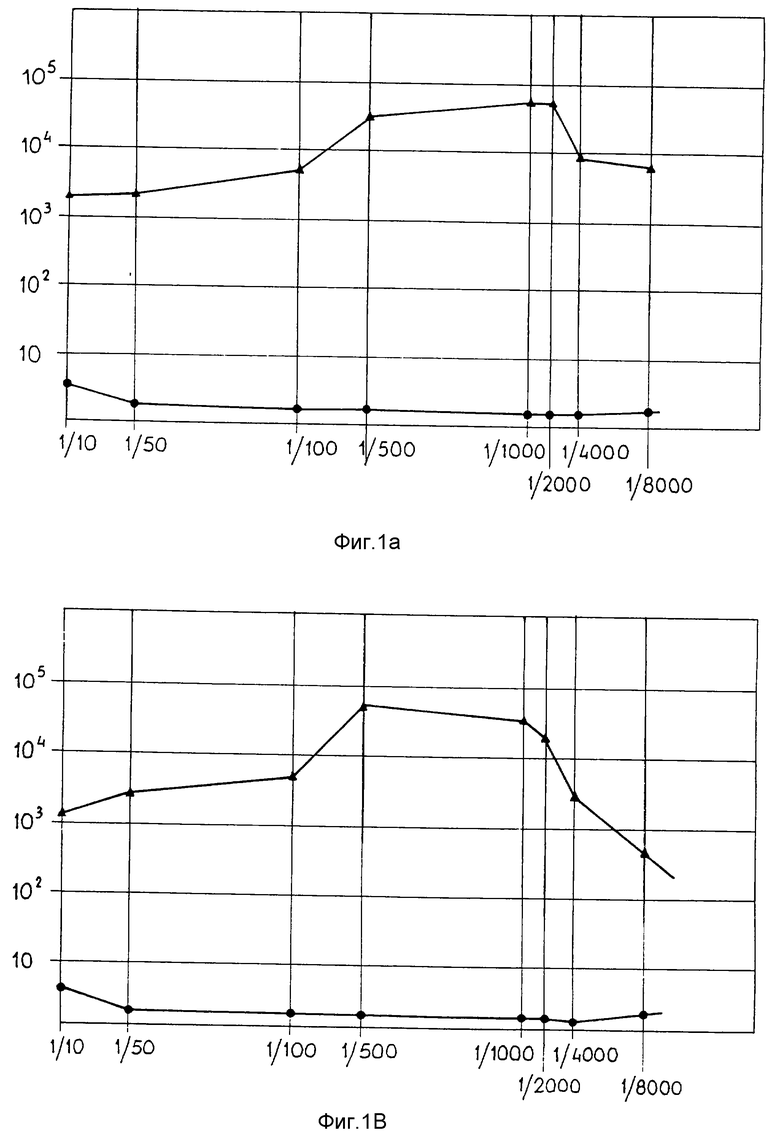
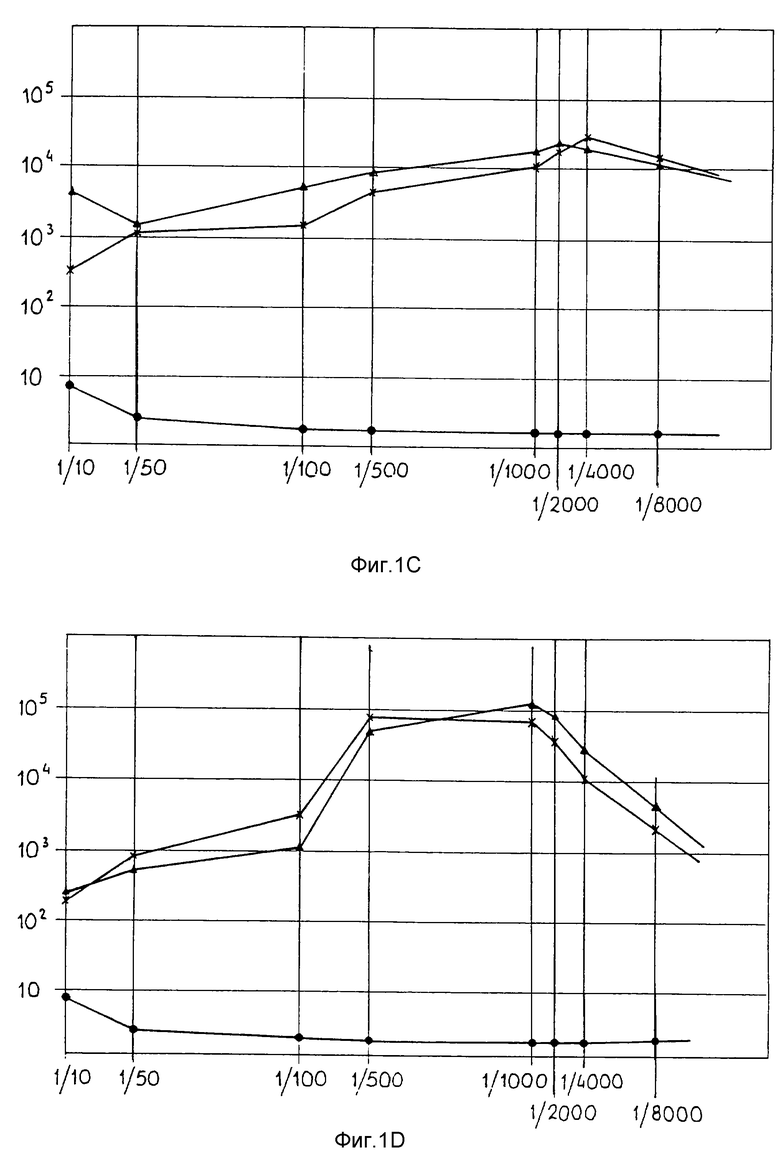
фиг. 1 представляет некоторые графики РИА иммунологических анализов образцов сыворотки от 4 кроликов, иммунизированных пептидами, описанными в Посл ИД N 1, N 2 и N 3 (A, B, C (419) и D (428));
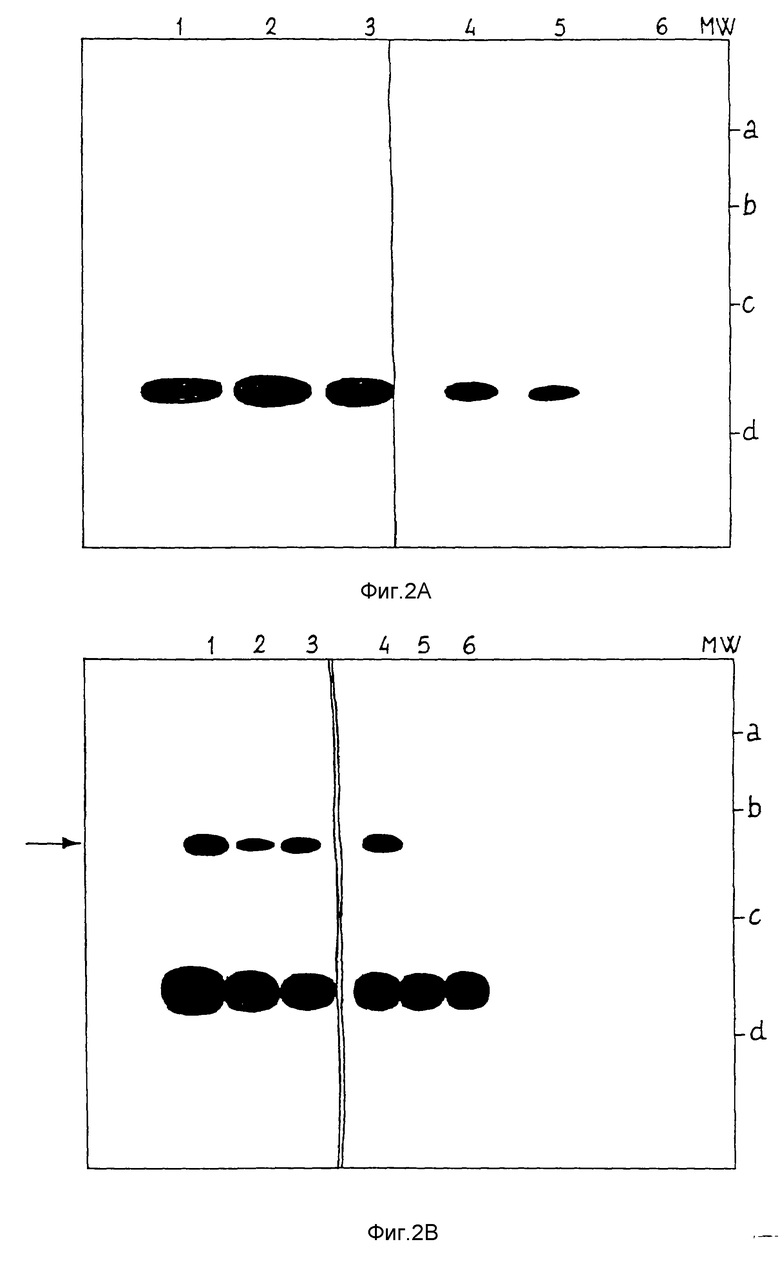
фиг. 2A показывает результат прямого иммуноблоттинга с использованием сыворотки 419 (1) и 428 (2), а также предварительно иммунизированными сыворотками (4-6) на образцах экстрактов легких;
фиг. 2B показывает результат иммуноблоттинга в случае, когда экстракты предварительно были иммунопреципитированы с использованием сывороток 419 и 428; и
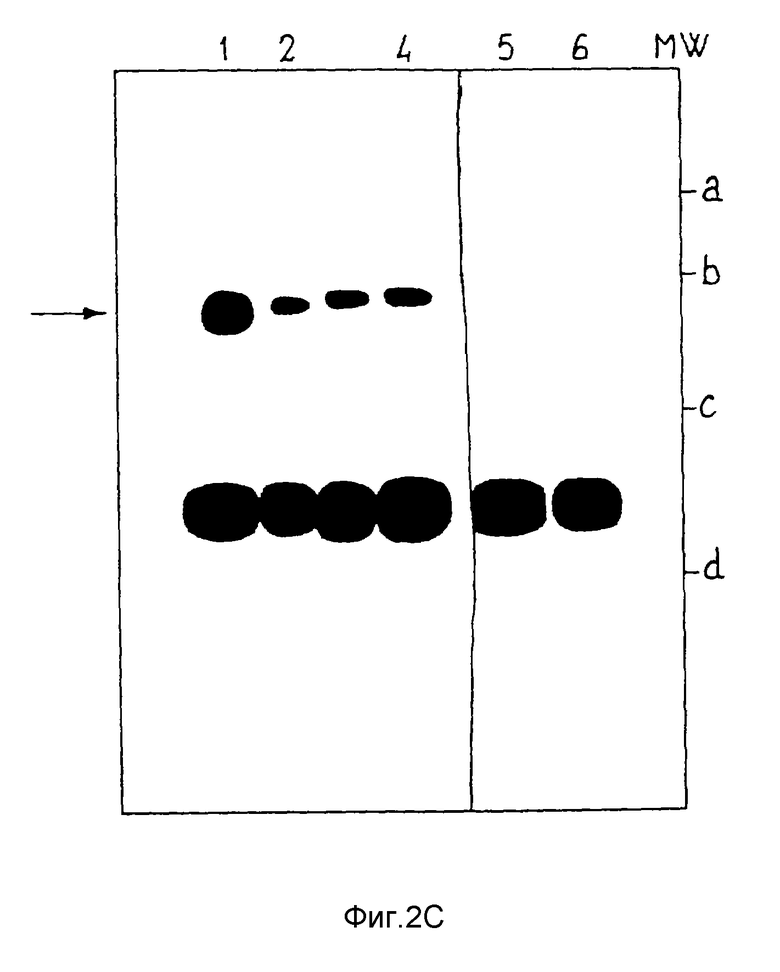
фиг. 2C показывает результат иммуноблоттинга, когда экстракты были предварительно иммунопреципитированы, как описано в примере 3.
Пример 1. Обнаружение и синтез пептидов из белка TLP.
Комплекс TLP выделен из экстрактов карциномы легких, как описано в EP 283443. Белок блокируется на концевой аминогруппе и соответственно расщепляется протеазой V8 из Staphylococcus aureus с применением известных методик. Один из полученных пептидных фрагментов представляет следующую последовательность:
XaaXaaArgThrAsnLysGluAlaSerIle
Два синтетических пептида синтезированы с применением твердофазного метода с помощью пептидного синтезатора 430 от Applied Biosystems как описано Bodanszky M., Springer Verlag, New York, N. Y, 1984, имеющие следующие последовательности:
5'-ArgThrAsnLysGluAlaSerIleCys-3'
5'-CysArgThrAsnLysGluAlaSerIle-3'
Идентичность и чистота продукта подтверждены анализом аминокислот и ВЭЖХ (с помощью методика жидкостной хроматографии высокого давления).
С помощью метода, описанного в "Laboratory Techniques in Biochemistry and Molecular Biology", M.H.V. Van Regermortel, J.P. Brian, S. Muller и S. Plau, Elseviers Publishers, Амстердам, Нидерланды, 1988, эти пептиды связываются с помощью цистеиновых сульфгидрильных концевых групп с боковым лизиновым остатком эмоцианина устриц при использовании малеингидробезоил-N-гидросукцинимидного эфира (МБС) в качестве реагента.
Пример 2. Иммунизация.
Четырем кроликам подкожно вводили 0,5 г смеси комплексов из примера 1 в 1,5 мл ФСБ (фосфатного солевого буфера) и с 0,5 мл полного адъюванта Фрейнда. Неполный адъювант в качестве активирующей инъекции вводили через двухнедельные интервалы. Образцы сывороток отбирали через каждые две недели и подвергали РИА, который описан в "Laboratory Techiques in Biochemistry and Molecular Biology", 4th edition, by T. Chard, Elsevier Science Publishers, Amsterdam, The Netherlands, 1990, с применением 96-ячеечных микротитровальных плат, покрытых известной концентрацией синтетических пептидов в качестве антигенов. Платы инкубировали с разведениями сыворотки различного уровня, затем промывали и обрабатывали иодированным протеином A для обнаружения присутствия специфических антител в сыворотке. Фиг. 1 представляет данные, полученные с образцами сывороток от четырех иммунизированных кроликов, как указано выше. Все сыворотки показывают пик радиоактивности примерно 15000 имп/мин при разведении 1:1000 и способны также реагировать при высоких разведениях. Базисные уровни, полученные с предварительно сенсибилизированными сыворотками в качестве контролей, находятся в интервале от 1000 имп/мин до 1500 имп/мин, показывая соотношение 10:1 при разведении 1:1000. Отношение к фоновому сигналу выше 20:1 для сывороток 419 и 428.
Пример 3. Реакция с сыворотками.
Сыворотки 419 и 428 анализировали с использованием экстрактов легких, которые получены, как описано в EP 283443, от трех больных, страдающих легочной карциномой эпидермоидального типа или аденокарциномой, согласно "International Classification of Diseases for Oncology", 2nd edition 1990, edited by C. Percy, V. Van Holte and C. Muir, WHO, Geneva (фиг. 2A). Образцы указанных экстрактов (1 и 4 = B.C.; 2 и 5 = S.G.; 3 и 6 = M.R.) разводят растворами детергентов и разделяют с помощью метода электрофореза в полиакриламидном геле в соответствии с известными методиками. Затем проводили прямой иммуноблоттинг, используя сыворотки 419 (1) и 428 (2). Обнаруживаются две неспецифических полосы белков примерно 55 кДа и 35 кДа, которые также присутствуют, когда используются предварительно сенсибилизированные сыворотки (4-6).
Затем экстракты иммунологически преципитируются сыворотками 419 и 428 с применением соответствующих методик, которые описаны E.Harlow and D.Lane, Gold Spring Harbor Laboratory, Gold Spring Harbor, N.Y. (1988); иммунологический преципитированный материал разделяется на геле и используется для иммуноблоттинга с теми же сыворотками. Фиг. 2 представляет результаты в случае, когда специфическая полоса 100 кДа обнаруживается во всех экстрактах при анализе как с использованием сыворотки 419 (1-3), так и сыворотки 428 (4-6). Исследуемый экстракт в 1 и 4 демонстрирует присутствие очень большого количества белка TLP.
Чтобы установить, является ли реакция специфичной, проводили следующие контрольные испытания, которые представлены на фиг. 2C, где: линия 1 представляет сыворотку больного ВС, причем иммунная сыворотка 419 используется или для иммунопреципитации или для иммуноблоттинга; линия 2 получается при использовании предварительно сенсибилизированной сыворотки для стадии иммунопреципитации и сыворотки 419 для иммуноблоттинга; линия 4 является результатом использования сыворотки 419, предварительно инкубированной с пептидом с Посл ИД N 1, для стадии преципитации и сыворотки 419 для иммуноблоттинга; линия 5 получается при использовании сыворотки 419 для стадии иммунопреципитации и предварительно сенсибилизированной сыворотки для иммуноблоттинга.
Результаты подтверждают, что полоса белка примерно 100 кДа специфически прореагировала с иммунной сывороткой 419.
Перечень последовательностей
(2) Информация по последовательности ИД N 1:
(I) Характеристики последовательности:
(A) Длина: 8 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(II) Тип молекулы: пептид
(III) Гипотетическая: нет
(III) Антисмысловая: нет
(VI) Природный источник:
(A) Организм: Homo sapiens
(F) Тип ткани: карцинома легких
(XI) Описание последовательности: Посл ИД N 1: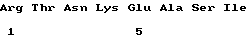
(2) Информация по последовательности ИД N 2:
(I) Характеристики последовательности:
(A) Длина: 7 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(II) Тип молекулы: пептид
(III) Гипотетическая: нет
(VI) Природный источник: Homo sapiens
(A) Организм:
(F) Тип ткани: карцинома легких
(XI) Описание последовательности: Посл ИД N 2: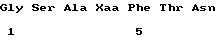
(2) Информация по последовательности ИД N 3:
(I) Характеристики последовательности:
(A) Длина: 6 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(II) Тип молекулы: пептид
(III) Гипотетическая: нет
(VI) Природный источник:
(A) Организм: Homo sapiens
(F) Тип ткани: карцинома легких
(XI) Описание последовательности: Посл ИД N 3: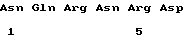
Пример 4. Получение пептида из неопластической ткани.
Неопластическая ткань после удаления некротического материала и после отмывания в растворе фосфатного буфера измельчается и гомогенизируется с повторяющимся охлаждением на льду, и гомогенат после трехкратного замораживания и оттаивания подвергается обработке ультразвуком, в частности способ включает следующие стадии:
а) обработку ультразвуком с предварительным центрифугированием при 3000g по схеме, приведенной в конце описания, причем осадок (1) предварительного центрифугирования после гомогенизации, обработки ультразвуком и последующего центрифугирования при 3000g образует супернатант (2) и осадок (2), и осадок (2), подвергаемый такой же процедуре, образует осадок (3), который выбрасывается, и супернатант (3), который добавляется к супернатантам (1) и (2);
б) центрифугирование общего супернатанта, собранного из супернатантов (1), (2) и (3) при 100000g и концентрирование супернатанта;
в) помещение (после теста на активность) супернатанта на колонку с изоэлектрическим фокусированием и сбор фракций пика, проверку их активности, и
г) увеличение степени очистки с помощью хроматографической колонки.
Исследования токсичности.
Результаты исследований продуктов Тимолип A (TLPA) и Тимолип B (TLPB) римской фирмы IFI, позволяют сделать следующие выводы:
A) Продукты Тимолип A (TLPA) и Тимолип B (TLPB) у обычных лабораторных животных:
1) имеют очень низкий уровень летальности и острой токсичности у крысы и собаки, в связи с чем при различных методах введения в организм (подкожном, интраперитонеальном, внутривенном) хорошо переносятся даже повышенные дозы, намного превышающие рекомендуемые дозы, или во всяком случае дозы, применяемые в клинической практике;
2) неоднократное введение в организм собаки и крысы не приводит к существенным изменениям наиболее важных гематических и биохимических констант (азотемия, гликемия, периферический состав крови, гемопоэтическое мозговое вещество, система мочеобразования, аспартат-аминотрансфераза, сыворотки, глютамино-пировиноградная трансаминаза сыворотки, щелочная фосфатаза сыворотки), а также внутренней гистологической структуры основных органов;
3) при дозах на кг массы, превышающих дозы, рекомендуемые в клинической практике, не вызывают у собаки, кролика и крысы существенных изменений артериального давления, дыхания и ЭКГ;
4) не причиняет вреда самкам, ожидающим потомства, не оказывает негативного воздействия на течение беременности и на развитие эмбриона и плода крысы и кролика при дозах на кг массы, иногда превышающих возможные дозы, применяемые в клинической практике (0,5 - 1 мг у взрослых особей).
В связи с вышеизложенным можно сделать вывод, что по отношению к обычным лабораторным животным продукты Тимолип A (TLPA) и Тимолип B (TLPB) являются препаратами, которые даже при дозах, превышающих дозы, применяемые в клинической практике, не проявляют острой, подострой и хронической токсичности и хорошо переносятся при каждом конкретном способе введения в организм.
Синтез антигенов.
На основе предыдущих данных последовательности белка были приготовлены два синтетических пептида с использованием методов твердофазного пептидного синтеза (метод Меррифильда) на одной группе Applied Biosistems 430. Синтезатор пептидов с ВОС-аминокислотами. Пептиды гидролизованы из смолы, лишены защитных свойств с помощью жидкости HF и очищены жидкостной хроматографией высокого разрешения. Идентичность и чистота продукта подтверждены масс-спектрометрией плазменной десорбции, аминокислотным анализом и аналитической HPLC. Цистеиновые остатки включены для присоединения к белку-носителю. Поскольку заранее не было известно, который из них даст лучший сывороточный титр, были получены пептиды с цистеинами на обоих концах. Они были по отдельности присоединены к гемоцианину фисурелла с использованием имидобензоила малеиновой кислоты - N - оксиянтарной кислоты. Этот реагент обеспечивает присоединение аминочастицы на боковой цепи лизина в носители к сульфгидрильному цистеину на пептиде.
Экстракция Тимолипа из линии опухолевых клеток.
1. Промыть 1 конфлюэнтный Т-300 в 1 х DPBS и просушить.
2. Добавить приблизительно 2 мл лизирующего буфера Тимолипа и держатель на клетках в течение 30 минут при температуре 37oC. Удалить клеточный лизат смыванием поверхности роста, центрифугировать в течение 15 мин при 15000 оборотах в минуту.
Лизирующий буфер: 50 mM Tris-Cl pH 7,4, 50 mM EDTA, 250 mM NaCl, 50 mM NaF, 0,1% Triton X-100, 0,1 mM Navo3, 0,4 mM Pefablos.
3. Удалить супернатант и установить концентрацию белка.
4. Расслоить и заморозить фракции для многократной перегонки геля с целью предотвращения разложения.
SDS - страница/перенос.
1. Ввести 60 мг Тимолипа белкового лизата в гель с 10 - 20% Трицина (NOVEX) и разогнать при напряжении 125 В, 80 мА к единице геля, пока фронт красителя не достигнет гелевого осадка.
2. Переводить белок в НЦ при 175 мА в течение приблизительно 2 часов.
3. Блокировать на один час 5% молоком - 1X TBS - tween 20, слегка взбалтывая при комнатной температуре.
4. Развести 1o AB 1:200 в 1%-ном молоке, 1X TBS-T (т.е. 100 мл ИгГ анти-Тимолипа - 1 мг/мл в 20 мл 1%-ного молока, 1 X TBS-T). Выдерживать всю ночь при t - 4oC, взбалтывая.
5. Промыть 3X в 1 X TBS-T по 10 мин на каждую промывку.
6. Развести 2o Ат 1:2000 в 1%-ном молоке, 1 X TBS-T (т.е. 10 единиц пероксидазы из хрена антикроликового ИгГ, соединенного с цельным Ат - Amersham # NA-934 в 20 мл 1%-ного молока, 1 X TBS-T). Выдерживать в течение 2 часов при комнатной температуре, взбалтывая.
7. Промыть 3X в 1 X TBS-T, 10 мин на одну промывку, продолжать по методу детекции ECL.
Антигенные белковые продукты (TLP), полученные согласно настоящему изобретению, по существу представляют липогликопротеины, имеющие следующие характеристики:
1) размеры между 48,1 и 61 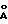 (на основе данных мол. веса),
(на основе данных мол. веса),
2) имеют липидную группу (на основе элюции с конкавалином А),
3) изоэлектрическая точка менее 7,0 (на основе характеристик элюции на Sephadex DEAEA с 0,2 M NaCl).
Опухоли, полученные из хирургического отделения больницы Monaldi, Naples, Италия, исследовались следующим образом.
Свежие опухолевые ткани с примерным весом между 25 и 150 г отделялись от некротических участков и тщательно промывались 20 мМ Трис-HCl буфером, pH 7,2. Данную процедуру выполняли при 4oC в стерильных условиях для снижения возможности инфицирования, перед подкожным введением in vivo и опытами in vitro проводили тесты на стерильность и пирогенность. После такой обработки ткани окончательно размельчали ножницами, продавливали через сито из нержавеющей стали с отверстиями размером 60 меш. и ресуспендировали в 20 мМ Трис-HCl буфере, pH 7,2 ( в отношении 1:2).
Суспензию затем центрифугировали при 1500 об/мин для получения целых клеток.
Осадок клеток, ресуспендированный, как описано выше, затем троекратно быстро замораживали и размораживали, и, наконец, обрабатывали ультразвуком с помощью ультразвукового осциллятора Raytheon в режиме 0,9 кГц в течение 9 мин на льду. Материал, обработанный ультразвуком, в котором была определена концентрация белка, центрифугировали при 100000 g в течение 1 часа при 4oC.
После ультрацентрифугирования осадок отбрасывали и образцы супернатанта объемом 0,5, 1,0, 1,5 и 2,0 мл отбирали для определения иммунологической активности.
Сефадекс G-100.
Материал, полученный на предыдущей стадии, подвергали гель-фильтрации на сефадексе G-100. Вкратце, 60 мг супернатанта наслаивали на гель, предварительно уравновешенный 20 мМ Трис-HCl буфером (pH 7,2) и элюировали тем же буфером со скоростью элюции 8,0 мл/ч. Собирали фракции по 2 мл, их оптическую плотность измеряли при длине волны 280 нм и пиковые фракции тестировали на предмет иммунологической активности.
Изоэлектрическое фокусирование.
В соответствии с настоящим изобретением предлагается экстракция TLP белков, в процедуре которой удалены недостатки на всех этапах усовершенствованной методики очистки, которая включает изоэлектрическое фокусирование (ИЭФ) в дополнение к предшествующей методике разделения, состоящей в высокоскоростном центрифугировании, в которых последовательно собирают супернатанты для получения окончательного пула.
Изоэлектрическое фокусирование проводят при pH 3,5-10, конечную стадию очистки проводят путем хроматографии на колонке ДЭАЭ А (Сефарозе). Физические свойства экстрагированного материала предпочтительно определяют на колонках геля для ИЭФ и на ПААГ с ДДС/Сефадексе в случае определения молекулярной массы и гликозидных групп. Антигенные белковые продукты (TLP), полученные в соответствии с настоящим изобретением, по существу, представляют собой липогликопротеины, имеющие следующие отличительные характеристики:
а) размеры между 48,1 и 61 ангстрем (определенные на основании известных данных об их молекулярной массе);
б) наличие липидной группы (показанной на основании характеристик элюции с конканавалина А);
в) растворимость и
г) изоэлектрическая точка меньше 7,0 (определенная на основе характеристик элюции с ДЭАЭ А Сефадекса (1 на анион) (элюция 0,2 М NaCl).
Электрофорез с полиакриламидном геле с додецилсульфатом натрия (ПААГ с ДДС).
Проводили электрофорез в ПААГ с 0,1% ДДС. Вкратце, после денатурации белка путем добавления ДДС 2-меркаптоэтанола и бромфенола синего (как маркерного красителя) до конечной концентрации 0,1, 0,1 и 0,5% соответственно, соединение кипятили в течение 2 мин. Образцы с глицерином в конечной концентрации 10% наслаивали на трубочки с 6% ПААГ, и электрофорез проводили при токе 10 мА/трубочка до тех пор, пока маркерный краситель не проходил определенного пути от верхушки геля. Молекулярную массу после окраски геля и его отмывки определяли путем линейного регрессионного анализа log10 молекулярной массы маркерных белков от подвижности относительно бромфенолового синего.
Ионообменная хроматография.
Иммунореактивный материал после гель-фильтрации хроматографировали на ДЭАЭ-Сефадексе А-50, предварительно уравновешенном 20 мМ Трис-HCl (pH 7,2), используя колонки размером 1,5 х 30 см и начальный объем геля 20 мл. 5 мл образца с концентрацией белка 15 мг/мл наносили на колонку, затем элюировали 20 мМ Трис-HCl буфером (pH 7,2) как первым элюирующим буфером. Затем применяли ступенчатую элюцию, применяя 0,4 и 0,8 M NaCl в том же буфере, пропускаемые со скоростью 30 мл/ч. Обычно переключение на второй буфер авторы настоящего изобретения осуществляли только после того, как поглощение света при 280 нм предшествующим элюатом возвращалось на контрольный уровень. Фракции элюата по 2 мл собирали и пиковые фракции объединяли и тестировали их как на концентрацию белка, так и на иммунологическую активность.
Определение антигена TLP в сыворотке крови человека с помощью твердофазного иммуноферментного анализа (ИФА). Диагностический набор.
Образцы сыворотки объемом 50 мкл инкубировали со 100 мкл биотинилированного CSH-419 IgG (кролика), иммобилизованных на планшетах для микротитрования, покрытых стрептавидином, и добавляли 100 мкл CSH-419 IgG, меченного пероксидазой, для образования нового комплекса по принципу одноступечатого сэндвич-метода: антиTLP иммобилизованный IgG/TLP/антиTLP меченый IgG. После образования комплекса добавляли хроматоген и субстрат. Интенсивность генерируемого сигнала была пропорциональна количеству TLP, содержащемуся в образце (измерения проводили с помощью ИФА ридера ETI System при 450 нм). Планшеты для микротитрования, покрытые стрептавидином, буферы, хромоген и субстрат были предоставлены фирмой Sorin Biomedica для создания тестирующего набора, пригодного для промышленного производства. Очищенный нонапептид CHS-275, связанный с БСА (CSH-275/БСА), может быть определен данным набором, демонстрируя линейную зависимость от последовательных разведений неспецифически связывающихся (HCO) контролей (данные не показаны). В качестве агентов для калибровки использовались пулы сывороток (их реактивность определяли по кривой CHS-275/БСА); агент для калибровки с наименьшей определяемой реактивностью выбирали для установления разрешающей способности метода и использовали при каждом определении. Агент для калибровки с ОП, сходной с ОП БСА (0,07 - 0,11), использовали в качестве отрицательного контроля. Разрешающая способность метода должна быть выше, чем среднее + ICO (стандартное отклонение) отрицательного контроля.
Сыворотки со значениями ОП > значения разрешающей способности метода классифицировались как позитивные в отношении TLP. Контроль достоверности осуществляли, используя следующие тесты: а) тест на линейность отношений между сывороткой с известным высоким содержанием TLP и величинами ОП; б) оценка воспроизводимости метода путем двухкратного исследования в каждом опыте 5-ти различных сывороток; в) оценка воспроизводимости метода путем исследования 2-х различных сывороток в 10 различных анализах. Все образцы сывороток исследовали вслепую.
Статистика. Хи-квадрат тест использовали для сравнения различий между двумя группами. Различия считались достоверными при величине P < 0,05.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus. Musculus, ПРОДУЦИРУЮЩИЙ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К ПЕПТИДУ, ОБЛАДАЮЩЕМУ АПОПТОТИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА | 2009 |
|
RU2402605C1 |
| ПЕПТИДЫ TLP КОМПЛЕКСА МОЧЕПОЛОВОЙ КАРЦИНОМЫ И ИХ АНТИТЕЛА | 1997 |
|
RU2203679C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОЛИГОПЕПТИДОВ | 1994 |
|
RU2136697C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PQ_F35, КОДИРУЮЩАЯ ГИБРИДНЫЙ ПОЛИПЕПТИД F 35, ОБЛАДАЮЩИЙ АНТИГЕННЫМИ И ИММУНОГЕННЫМИ СВОЙСТВАМИ БЕЛКА VP 35 ВИРУСА МАРБУРГ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - СВЕРХПРОДУЦЕНТ РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА F 35 | 1998 |
|
RU2144565C1 |
| АЛЛЕРГЕНЫ, ПОЛУЧЕННЫЕ РЕКОМБИНАНТНЫМИ СПОСОБАМИ | 2010 |
|
RU2592674C2 |
| НОВЫЙ АЛЛЕРГЕН-ПРОСТАТИЧЕСКИЙ КАЛЛИКРЕИН | 2007 |
|
RU2502074C2 |
| ОЧИЩЕННАЯ И ИЗОЛИРОВАННАЯ МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, РЕКОМБИНАНТНАЯ ПЛАЗМИДА, РЕКОМБИНАНТНЫЙ ВЕКТОР, ОЧИЩЕННЫЙ И ИЗОЛИРОВАННЫЙ БЕЛОК, ОЧИЩЕННЫЙ И ИЗОЛИРОВАННЫЙ БЕЛОК D 15 НАРУЖНОЙ МЕМБРАНЫ ИЛИ ЕГО ЧАСТЬ, СИНТЕТИЧЕСКИЙ ПЕПТИД, ХИМЕРНАЯ МОЛЕКУЛА, ИММУНОГЕННАЯ КОМПОЗИЦИЯ И АНТИСЫВОРОТКА ИЛИ АНТИТЕЛО | 1993 |
|
RU2141528C1 |
| Иммуногенная композиция на основе рекомбинантных псевдоаденовирусных частиц, а также на основе белковых антигенов и способ получения иммуногенной композиции | 2018 |
|
RU2691302C1 |
| АНТИТЕЛА ПРОТИВ АЛЛОГЕННЫХ И КСЕНОГЕННЫХ БЕЛКОВ, ИХ ПРИМЕНЕНИЕ В ДИАГНОСТИКЕ И ТЕРАПИИ И СПОСОБЫ ИХ ОПРЕДЕЛЕНИЯ | 1995 |
|
RU2160445C2 |
| НОВЫЙ РАКОВЫЙ АНТИГЕН ДЛЯ РАННЕГО ВЫЯВЛЕНИЯ РАКА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ДЕТЕКЦИИ | 2020 |
|
RU2818471C2 |
Описываются новые антигенные петиды из выделяемых опухолями частиц (ТLP), имеющие аминокислотную последовательность, входящую в последовательность белка в 100 кДа из указанных TLP, имеющие одну из нижеследующих последовательностей: a) Arg-Thr-Asn-Lys-Glu-Ala-Ser-Ite; б) Asn-Gln-Arg-Asn-Arg-Asp. Описывается также способ обнаружения выделяемых опухолями частиц. 3 с. и 3 з.п.ф-лы, 2 ил.
| СПОСОБ ОБНАРУЖЕНИЯ РАКОВОЭМБРИОНАЛЬНОГО АНТИГЕНА ПРИ ПОМОЩИ СПЕЦИАЛЬНОГО АНТИТЕЛЬНОГО ДИАГНОСТИКУМА | 1992 |
|
RU2077725C1 |
| Способ получения октапептидов | 1981 |
|
SU993816A3 |
| МОДУЛЯТОР СВЕТА | 0 |
|
SU283443A1 |
| 0 |
|
SU199586A1 | |
| ФОТОЭЛЕКТРИЧЕСКИЙ ДАТЧИК УГЛА | 0 |
|
SU200464A1 |
| Tarro et.al | |||
| Human tumor antigens inducing in vivo delayed hypersensivity in vitro mitogenic activity, Oncology 1983, v.40, с.248-254. | |||
Авторы
Даты
1999-11-27—Публикация
1993-07-01—Подача