Предлагаемое техническое решение относится к биотехнологии и касается способа получения стерильного раствора трипсина, используемого для получения первичных, поддержания диплоидных и перевиваемых линий клеток.
Обычно в биотехнологии в качестве дезагрегирующего агента применяют протеолитический фермент - трипсин, выпускаемый фирмами "Difco", "Serva", "Ferrak", "Fluka" в виде нестерильного порошка [1], из которого готовят раствор путем растворения трипсина в физиологическом растворе и последующей фильтрации через мембраны с диаметром пор 0,22 мкм с фасовкой во флаконы в асептических условиях [2, прототип].
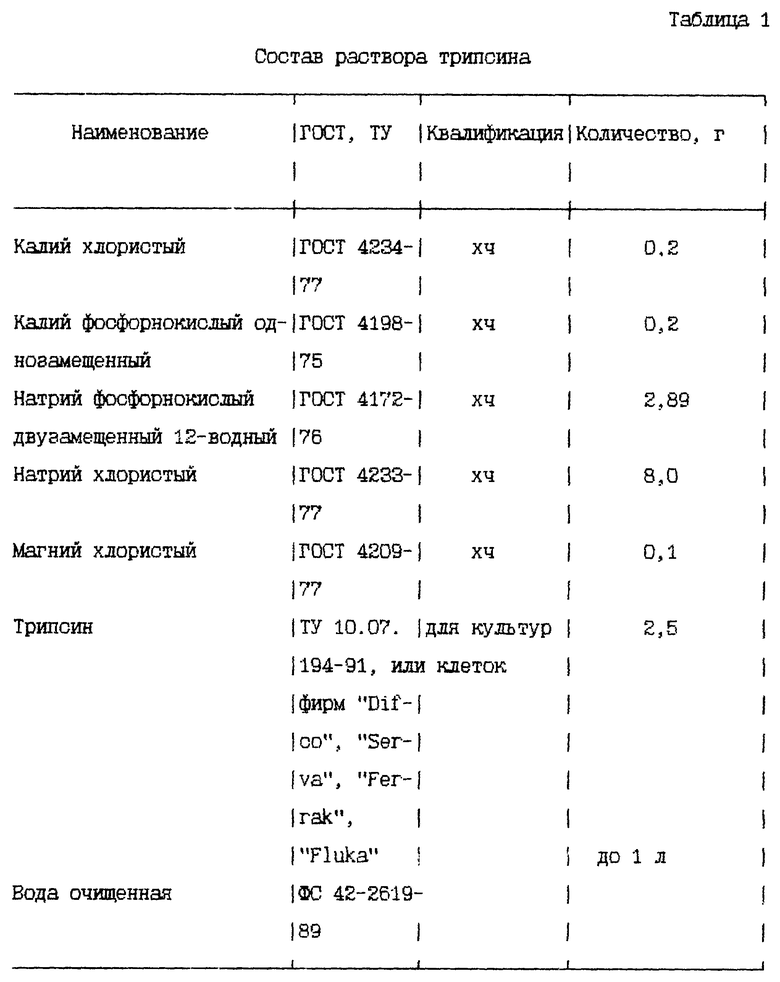
В 1 л раствора трипсина содержатся следующие компоненты (табл. 1).
При хранении стерильного раствора происходит инактивация фермента, вызванная процессами автолиза [3] . В связи с этим срок годности стерильного раствора трипсина определен 6 месяцев при температуре (6±4)oC и один год при температуре минус 20oC [2]. Изготовление, транспортировка, а также его хранение в замороженном (минус 20oC) состоянии требуют значительных затрат и экономически невыгодно. Кроме того, многократное замораживание-оттаивание препарата в процессе использования оказывает повреждающее действие на каталитические свойства фермента [4].
Технической задачей предлагаемого изобретения является разработка способа получения стерильного раствора трипсина, позволяющего увеличить срок годности препарата без потери его активности до 2 лет.
Поставленная задача решается отдельным приготовлением, высушиванием и стерилизацией смеси солей и трипсина и растворением их непосредственно перед использованием.
Предложенный способ получения стерильного раствора трипсина включает стадии приготовления сухой смеси солей из высушенных неорганических солей, фасовку смеси солей и трипсина, стерилизацию ускоренными электронами и растворение непосредственно перед использованием солевого буфера и трипсина в стерильной очищенной воде. Влажность высушенных солей не должна превышать 3% мас, перед фасовкой соли перемалывают в барабанной мельнице в течение 3 ч. Стерилизацию проводят дозой облучения 22 - 25 кГр.
Предложенный способ получения стерильного раствора трипсина неизвестен из опубликованных источников информации, что позволяет сделать вывод о соответствии критериям "новизна" и "изобретательский уровень".
Предлагаемое техническое решение поясняется следующими примерами.
Пример 1. Приготовление смеси солей, фасовка трипсина и смеси солей во флаконы ФО-10.
600 г трипсина сухого, отвечающего требованиям ТУ 10.07.194-91, фасуют во флаконы ФО-10 по (1,25±0,30) г.
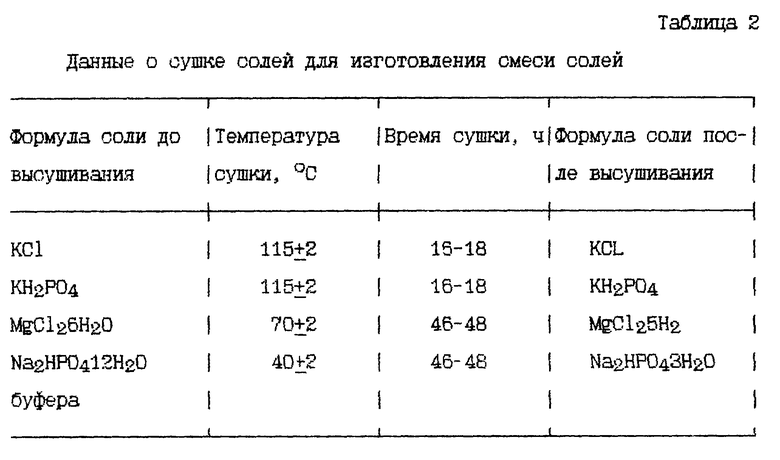
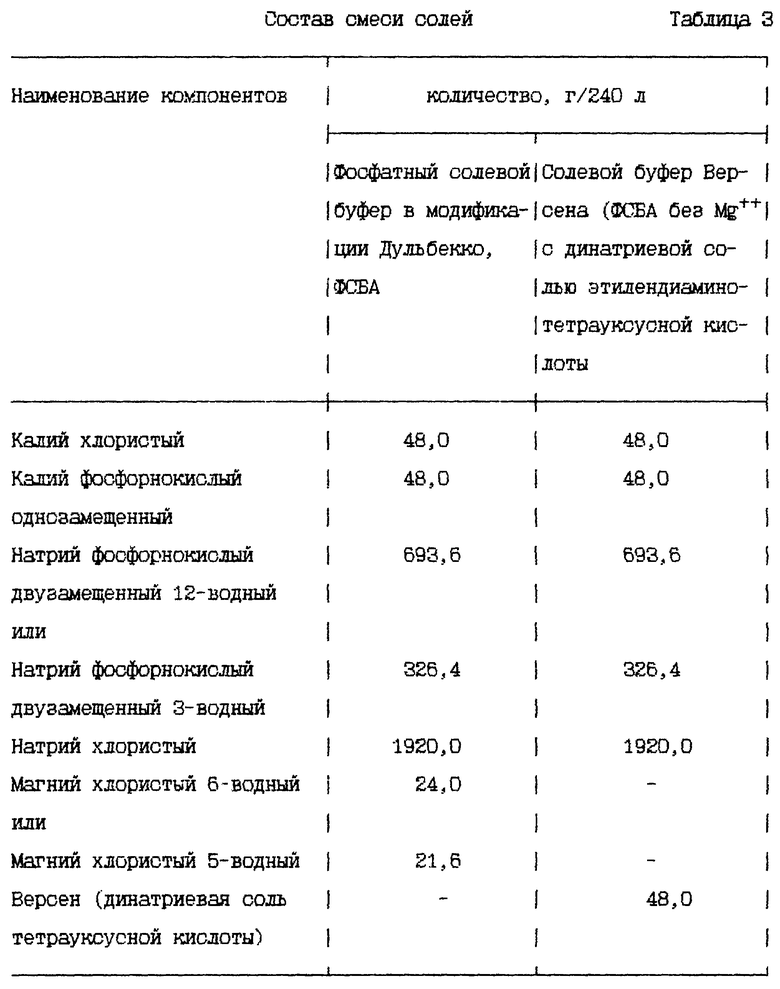
Для приготовления солевого буфера используют неорганические соли квалификации "хч" или "осч". Соли, содержащие кристаллическую воду, предварительно высушивают (табл.2). В барабанную мельницу загружают высушенные соли в количестве, указанном в табл. 3, в следующей последовательности: натрий хлористый, калий хлористый, калий фосфорнокислый однозамещенный, магний хлористый, натрий фосфорнокислый двузамещенный 12-водный и осуществляют помол в течение 3 ч [5].
Измельченную смесь солей фасуют во флаконы ФО-10 по (5,03±0,15) г, предварительно контролируют влажность, которая должна быть не более 3%.
Исходя из загруженного количества получают 480 флаконов трипсина и 480 флаконов солевого буфера, которые передают на стерилизацию.
Пример 2. Стерилизация трипсина и смеси солей ускоренными электронами
Флаконы с трипсином и смесью солей стерилизуют ускоренными электронами дозой 24-26 кГр на установке ИЛУ-6. Результаты подбора дозы облучения приведены в таблице 4.
Пример 3. Определение специфической активности на ткани почки новорожденного кролика.
Специфическую активность трипсина сухого стерильного (в течение 2 лет хранения при температуре (6±4)oC) определяют по способности дезагрегировать ткань почки новорожденного кролика, жизнеспособности и ростовой активности полученных клеток в соответствии с ВФС 42/Д-021ВС-95, протеолитическую активность по ГОСТ 202 64.2-88. Почки измельчают ножницами на фрагменты не более 0,5 см3 и помещают в колбу. Стерильный раствор трипсина готовят непосредственно перед употреблением путем растворения в 500 мл стерильной очищенной воды содержимого 1 флакона трипсина сухого стерильного и 1 флакона сухой стерильной смеси солей. В приготовленный стерильный раствор трипсина вносят пенициллин (100 ед/мл) и стрептомицин (100 мкг/мл), подогревают на термостатированной водяной бане до (36±1)oC, добавляют его в колбу с измельченной тканью в соотношении 1:5-1:7 и выдерживают 30 мин. Колбу устанавливают на магнитную мешалку. Дезагрегацию ткани проводят при постоянном перемешивании со скоростью 1 об/с в течение 5-7 мин. Дают осесть большим кусочкам ткани. Сливают мутную надосадочную жидкость в центрифужные стаканы. К остатку ткани добавляют свежий раствор трипсина и 2 раза повторяют дезагрегацию ткани до полного ее истощения. Объединенную надосадочную жидкость центрифугируют в течение 5 мин при 800 об/мин. Надосадочную фракцию осторожно сливают и клетки суспендируют в питательной среде. Характеристики стерильного раствора трипсина в течение 2 лет хранения приведены в табл. 5.
Пример 4. Определение специфической активности на культуре перевиваемой линии клеток Hep-2.
Специфическую активность стерильного раствора трипсина, приготовленного на основе образцов трипсина сухого стерильного и смеси солей сухой стерильной, хранившихся при температуре (6±4)oC в течение 2 лет, оценивают на 5-дневной культуре перевиваемой линии клеток Hep-2 с хорошо сформированным монослоем. Из матраса, содержащего монослойную культуру, сливают среду и добавляют стерильный раствор трипсина, приготовленный в соответствии с примером 3, при температуре (22±2)oC так, чтобы полностью покрыть монослой. Матрасы оставляют в термостате при температуре (36±1)oC на 3-5 мин, затем осторожно удаляют раствор трипсина, а суспензию клеток осторожно встряхивают для отслаивания клеток от стенок матраса. Отделение клеток от стекла наблюдают через 4 мин при температуре (36±1)oC. Изолированные клетки формируют монослой при последующем пассаже не позднее чем на 4 сутки после посева. Посевная доза при этом составляет 80 тыс. клеток на 1 мл среды (табл. 6).
Предложенный способ получения сухого стерильного раствора трипсина позволяет увеличить срок годности препарата без потери его активности до двух лет.
Список литературы
1. Адамс Р. Методы культуры клеток для биохимиков, М.: Мир, 1983, 243 с.
2. ФС 42-131ВС-88. Раствор трипсина стерильный.
3. Веремеенко Н. Н. Ферменты протеолиза и их ингибиторы в медицинской практике. Киев "Здоровье" - 1971, 254 с.
4. Луговой В.И. Первичные механизмы криоповреждений ферментов// В кн. 2 Всесоюзная конференция по теоретическим и прикладным вопросам криобиологии. Тезисы докладов. Харьков - 1984, 49 с.
5, Фрешни Р. Культура животных клеток. Методы. М.: Мир - 1989, 317 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОЙ СТЕРИЛЬНОЙ ПИТАТЕЛЬНОЙ СРЕДЫ НА ОСНОВЕ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗАТА | 1999 |
|
RU2161649C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУХИХ СТЕРИЛЬНЫХ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ КУЛЬТУР КЛЕТОК | 1996 |
|
RU2107724C1 |
| СУХАЯ СТЕРИЛЬНАЯ МАЛОСЫВОРОТОЧНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК МЛЕКОПИТАЮЩИХ | 2001 |
|
RU2201958C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КОРЕВОЙ ВАКЦИНЫ | 1998 |
|
RU2140288C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОЗРАСТОСПЕЦИФИЧНЫХ БИФИДОПРЕПАРАТОВ | 1999 |
|
RU2142234C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО В МАЗЕВОЙ ФОРМЕ НА ОСНОВЕ ИНТЕРФЕРОНА-АЛЬФА-2 | 1998 |
|
RU2159609C2 |
| СТАБИЛИЗИРУЮЩИЙ СОСТАВ ДЛЯ ПОЛУЧЕНИЯ РЕФЕРЕНС-СЫВОРОТОК, СОДЕРЖАЩИХ IGM-АНТИТЕЛА | 1997 |
|
RU2136313C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КОРЕВОЙ ВАКЦИНЫ | 1996 |
|
RU2123331C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ КУЛЬТИВИРОВАНИЯ ЛИМФОЦИТОВ КРОВИ ЧЕЛОВЕКА | 1993 |
|
RU2084523C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИФИДОСОДЕРЖАЩИХ ПРЕПАРАТОВ | 1996 |
|
RU2104706C1 |



Изобретение относится к биотехнологии и касается способа получения стерильного раствора трипсина, используемого для получения первичных, поддержания диплоидных и перевиваемых линий клеток. Способ получения стерильного раствора трипсина включает стадии приготовления смеси из высушенных неорганических солей, фасовки смеси солей и трипсина, стерилизации их ускоренными электронами и растворения непосредственно перед использованием стерильной смеси солей и трипсина в стерильной очищенной воде. Предложенный способ получения обеспечивает приготовление стерильного раствора трипсина с высокой дезагрегирующей способностью на протяжении всего срока хранения -2 лет - при температуре (6±4)oС. 3 з.п.ф-лы, 6 табл.
| Адамс Р | |||
| Методы культуры клеток для биохимиков | |||
| - М.: Мир, 1983, 243 с | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Раствор трипсина стерильный | |||
| Веремеенко Н.Н | |||
| Ферменты протеолиза и их ингибиторов в медицинской практике | |||
| - Киев: Здоровье, 1971, с.254 | |||
| Луговой В.И | |||
| Первичные механизмы криоповреждений ферментов в кн | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Тезисы докладов | |||
| - Харьков, 1984, 49 с | |||
| Фрешни Р | |||
| Культура животных клеток | |||
| Методы | |||
| - М.: Мир, 1989, 317 с | |||
| Сперанская И.Д | |||
| Современные методы изготовления культуральных питательных сред | |||
| Автореферат диссертации на соискание ученой степени кандидата биологических наук | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
Авторы
Даты
1999-12-10—Публикация
1997-07-01—Подача