Предлагаемое изобретение относится к области аналитической химии, а именно к способам определения метилртути, и может быть использовано для экспресс-анализа объектов окружающей среды.
Известны способы [1, 2] определения метилртути атомно-флуоресцентным и атомно-абсорбционным методами. Но указанные способы требуют сложного и дорогостоящего аппаратурного оформления.
Наиболее близким к предлагаемому изобретению по сущности и предлагаемому решению (прототипом) является способ [3].
Способ [3] заключается в том, что к твердому раствору пероксидазы в хитозане, предварительно приготовленному смешением 0.1% водного раствора хитозана и 20 мкМ раствора пероксидазы из корней хрена и воды в объемном соотношении 2: 7:1, дозированному и высушенному в токе воздуха на квадрате хроматографической бумаги "Mittelsam" (0.7х0.7 см2), добавляют фталатный буферный раствор (pH 5.0) для полного растворения препарата фермента, далее к полученному раствору последовательно добавляют 1.0 мкл 2.0 мМ раствора 3,3', 5,5'- тетраметилбензидина, 1.0 мкл 37.5 мМ раствора диэтилдитиокарбамината натрия, затем добавляют 1.0 мкл анализируемого раствора, содержащего метилртуть, 1.0 мкл 7.5 мМ пероксида водорода. Содержание метилртути определяют визуально по зависимости времени достижения голубой окраски продукта окисления ТМБ от логарифма концентрации метилртути.
Активность пероксидазы, иммобилизованной на хроматографической бумаге, сохраняется в течение 6 месяцев.
Нижняя граница определяемых содержаний метилртути 5 мМ. Время анализа составляет 10 мин.
Задача изобретения заключается в создании высокочувствительного, экспрессного и простого способа определения метилртути, который может быть использован для анализа объектов окружающей среды, в частности, природных вод.
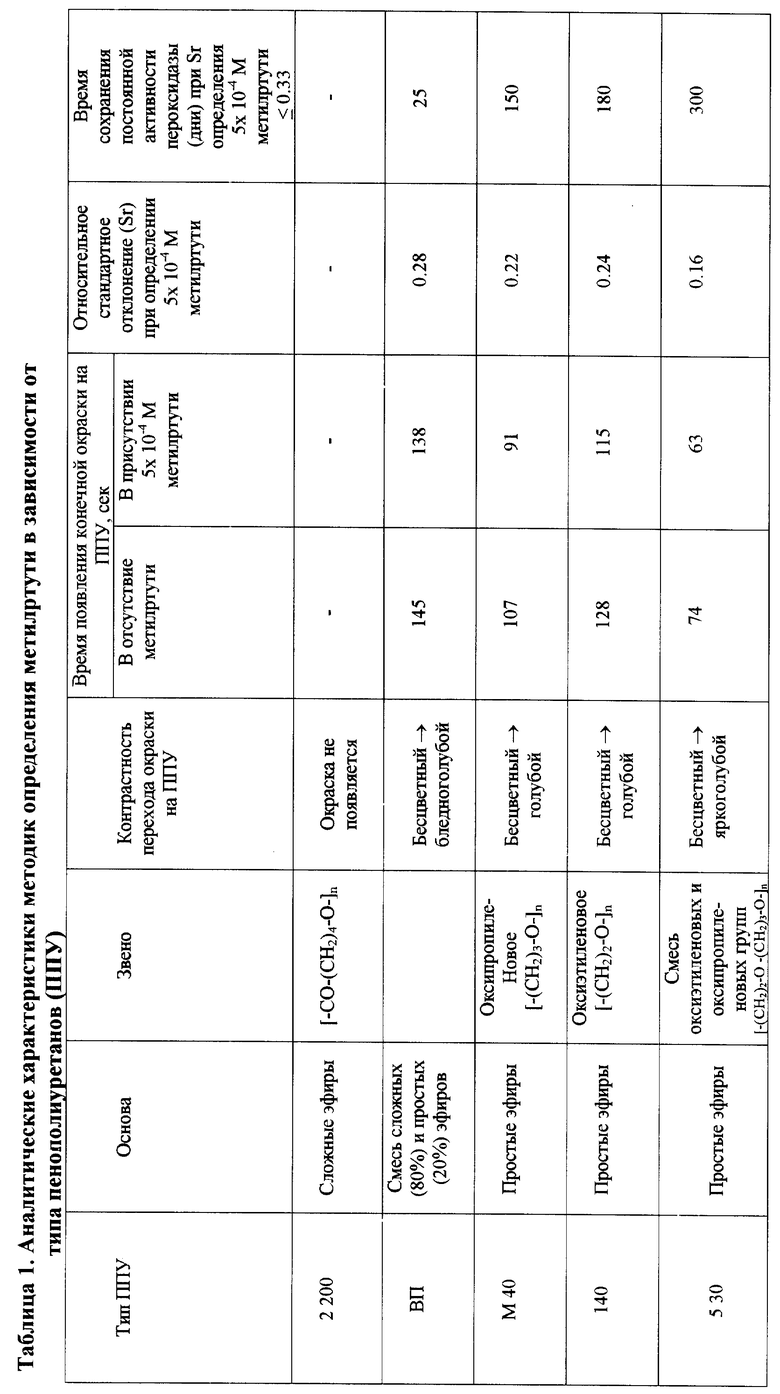
Эта задача решается тем, что в процессе анализа к иммобилизованной в хитозане пероксидазе хрена последовательно добавляют раствор диэтилдитиокарбамината натрия, раствор субстрата-восстановителя - 3,3', 5,5'- тетраметилбензидина и пероксида водорода и фиксируют время появления голубой окраски продукта окисления, при этом в качестве носителя иммобилизованного препарата пероксидазы и одновременно подложки для проведения реакции используют пенополиуретан 5 30, который предварительно выдерживают в анализируемом растворе, содержащем метилртуть. Ранее пенополиуретан (ППУ) для иммобилизации ферментов и пероксидазы, в частности, не использовался. Для выбора оптимальной марки ППУ проведено сравнительное изучение протекания индикаторной реакции, проводимой на пенополиуретанах с иммобилизованной пероксидазой, от строения структурных звеньев ППУ. Результаты исследования свидетельствуют о том, что наиболее эффективно действие метилртути проявляется при использовании ППУ 5 30 на основе простых оксиэтиленового и оксипропиленового эфиров: при протекании реакции на данном типе ППУ наблюдается наиболее контрастный переход (бесцветный - ярко-глубой) окраски; достигается наилучшая воспроизводимость при определении метилртути (Sr = 0.16), при этом наблюдается фиксируемое различие во времени протекания реакции в присутствии и в отсутствии метилртути - 11 сек; наиболее длительное время иммобилизованный фермент сохраняет свою каталитическую активность (в течение 10 месяцев) (табл. 1).
При использовании предлагаемого способа:
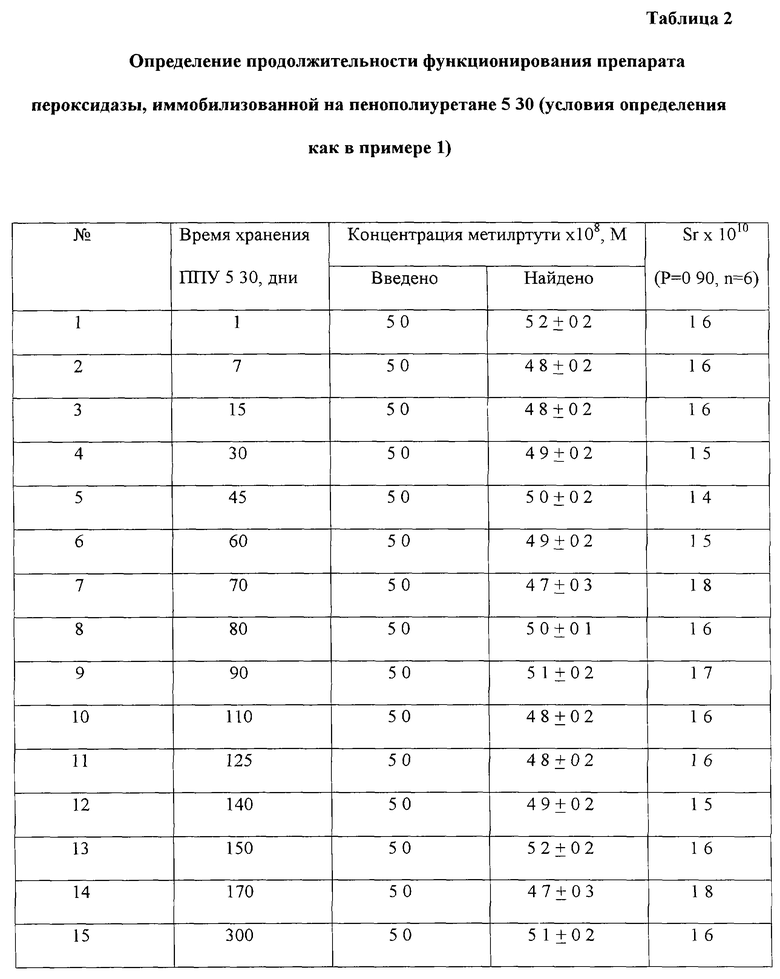
1. повышается стабильность препарата фермента пероксидазы, иммобилизованной на ППУ 5 30, активность пероксидазы в твердом растворе в хитозане на пенополиуретане 5 30 не изменяется в течение 10 месяцев (табл. 2);
2. повышается чувствительность определения метилртути до уровня ПДК в природных водах при использовании ППУ в качестве носителя иммобилизованного фермента: Сн = 0.01 мкМ (при иммобилизации пероксидазы на хроматографической бумаге: Сн = 5 мкМ);
3. повышается интенсивность перехода окраски реакционного раствора (от бесцветного к ярко-голубому), что облегчает визуальное детектирование ферментативного процесса и улучшает воспроизводимость методики (Sr = 0.16 в случае пероксидазы, иммобилизованной на ППУ и Sr = 0.31 в случае иммобилизации на хроматографической бумаге);
4. значительно понижается расход фермента: концентрация пероксидазы, необходимая для получения ее высокоактивного препарата при иммобилизации на ППУ (0.01 мкМ), в 2000 раз меньше чем концентрация, требуемая для получения пероксидазы той же активности при иммобилизации на хроматографической бумаге (20 мкМ).
Выявленные отличия в аналитической химии и других смежных областях науки не использовались.
Предложенный способ иллюстрируется следующими примерами.
Пример 1. Для приготовления иммобилизованного препарата пероксидазы хрена таблетку ППУ 5 30 диаметром 0.8 см и толщиной 0.3 см помещают в чашку Петри и пропитывают в течение 5 мин смесью 0.01 мкМ раствора пероксидазы в боратном буферном растворе, 0.01% раствора хитозана и воды в соотношении 7: 2: 1. После пропитки таблетку высушивают в течение 1 часа в токе воздуха. После этого таблетки пенополиуретана 5 30 помещают в анализируемый раствор, который содержит метилртуть, и выдерживают в нем в течение 5 мин, затем таблетки извлекают из раствора и на поверхность ППУ последовательно вводят 12 мкл фталатного буферного раствора (pH 5.0), 6 мкл 2.5 мМ раствора диэтилдитиокарбамината натрия, 6 мкл 2.5 мМ раствора 3,3', 5,5' - тетраметилбензидина и 6 мкл 5 мМ раствора пероксида водорода. В момент введения последнего включают секундомер и фиксируют время появления ярко-голубой окраски пятна на таблетке ППУ. Определение метилртути в диапазоне концентраций 1•10-8 - 1•10-7 М проводят по градуировочному графику, построенному в координатах: t, время появления ярко-голубой окраски пятна на таблетке пенополиуретана - lgС, логарифм концентрации метилртути, линейному в соответствии с уравнением
t,c = 21.48 - 8.54 lgC.
При концентрации метилртути 1.0•10-8 найдено (1.2 ± 0.2)•10-8М при Sr = 0.16 (Р= 0.90, n = 6).
Пример 2. Условия определения, как в примере 1.
При концентрации метилртути 5.2•10-8М найдено (5.2 ± 0.2)•10-8 М при Sr= 0.14 (P=0.90, n=6).
Пример 3. Условия определения как в примере 1.
При концентрации метилртути 8.0•10-8 М найдено (7.8 ± 0.2)•10-8 М при Sr=0.12 (P=0.90, n=6).
Список литературы
1. Saouter E., Blattmann B. Analyses of organic and inorganic mercury by atomic fluorescence spectrometry using a semiautomatic analytical system.// Anal. Chem. 1994. V. 66. N13. P. 2031-2037.
2. Magos L. Selective atomicabsorrption determination of inorganic mercury and methylmercury in undigested biological samples. //Analyst. 1971. v. 96. p. 847 - 853.
3. Shekhovtsova T.N., Muginova S.V., Bagirova N.A. Determination of organomercury compounds using immobilized peroxidase.//Anal. Chim. Acta. 1997. v. 344. p. 145 - 151.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1997 |
|
RU2144184C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1994 |
|
RU2073864C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ МАРКЕРОВ НЕЙРОМЕДИАТОРНОГО ОБМЕНА В ОБРАЗЦАХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2708917C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ИСПОЛЬЗОВАНИЕМ ТВЕРДОФАЗНОГО ФЛУОРЕСЦЕНТНОГО БИОСЕНСОРА | 2013 |
|
RU2554499C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ГИДРОЛАЗЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1994 |
|
RU2159818C2 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1992 |
|
RU2013770C1 |
| Способ и набор для иммуноферментного определения количественного содержания антитоксических противодифтерийных IgG антител в сыворотках крови людей | 2020 |
|
RU2744521C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУОРЕСЦИРУЮЩИХ ПРОИЗВОДНЫХ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ МЕТОДОМ ДЕРИВАТИЗАЦИИ | 2012 |
|
RU2546672C2 |
| СПОСОБ ПРИЖИЗНЕННОЙ ДИАГНОСТИКИ ТРИХИНЕЛЛЕЗА ПЛОТОЯДНЫХ И ВСЕЯДНЫХ ЖИВОТНЫХ | 2006 |
|
RU2339038C2 |
| СПОСОБ БИОКАТАЛИТИЧЕСКОЙ КОНВЕРСИИ ДИБЕНЗОТИОФЕНА | 2012 |
|
RU2527050C2 |
Изобретение относится к аналитической химии, а именно к способам определения микроколичеств метилртути, и может быть использовано для экспресс-анализа объектов окружающей среды. К иммобилизованному в хитозане ферментному препарату пероксидазы, помещенному на носитель, последовательно добавляют растворы диэтилдитиокарбамината натрия, анализируемой пробы, 3,3',5,5'-тетраметилбензидина и пероксида водорода. При этом в качестве носителя для иммобилизованного препарата пероксидазы используют пенополиуретан ППУ 5 30 на основе простых оксиэтиленового и оксипропиленового эфиров. В момент введения пероксида водорода начинают отсчет и фиксируют время появления ярко-голубой окраски пятна на пенополиуретане. Определение метилртути в интервале концентраций 1•10-8-1•10-4 М проводят по градуировочному графику. Способ прост и технологичен. 2 табл.
Способ ферментативного определения метилртути, предусматривающий последовательное добавление к иммобилизованному в хитозане ферментному препарату пероксидазы, помещенному на носитель, раствора диэтилдитиокарбамината натрия, растворов 3,3',5,5'-тетраметилбензидина и пероксида водорода, и визуальную регистрацию появления окраски продукта реакции, отличающийся тем, что в качестве носителя для иммобилизованного препарата пероксидазы используют пенополиуретан 5 30 (на основе простых оксиэтиленового и оксипропиленового эфиров), который после иммобилизации на нем пероксидазы предварительно выдерживают в анализируемом растворе.
| Shekhovtsova T.N., Muginova S.V., Baginova N.A | |||
| Determination of organomercury compounds using immobilized peroxidase // Anal | |||
| Chim | |||
| Acta | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| Заслонка для русской печи | 1919 |
|
SU145A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОЙ ПЕРОКСИДАЗЫ | 1990 |
|
RU2005784C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1992 |
|
RU2013770C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1992 |
|
RU2013770C1 |
Авторы
Даты
1999-12-27—Публикация
1997-11-28—Подача