Изобретение относится к области медицины и может быть применено для определения катехоламинов и их метаболитов в объектах на основе матриц сложного состава, в том числе нерастворимых в воде, без их дополнительной пробоподготовки.
Определение катехоламинов (КА) (допамин (ДА), адреналин (АД)) и их метаболитов (гомованилиновая и ванилилминдальная кислоты (ГВК и ВМК соответственно)) в биологических жидкостях и тканях человека является актуальной задачей современного химического анализа. Значимая проблема при определении перечисленных соединений в реальных биообъектах заключается в необходимости проведения дополнительной пробоподготовки анализируемого образца (использование токсичных или агрессивных органических растворителей, фильтрование, разделение), что существенно увеличивает погрешность результатов измерений и усложняет процедуру анализа. Перспективный подход к решению перечисленных проблем заключается в создании твердофазных оптических сенсоров, основанных на формировании и измерении аналитического сигнала не в растворе, а непосредственно на поверхности - в чувствительном слое сенсора, содержащем распознающие элементы (компоненты индикаторной системы, в том числе ферменты). Согласно исследованиям в областях, смежных биохимическому анализу, катехоламины и их метаболиты необходимо определять на наномолярном уровне и ниже. По этой причине наибольший интерес представляет разработка твердофазных оптических сенсоров с высокочувствительным детектированием отклика чувствительного слоя методом флуориметрии.
Известен способ определения адреналина с помощью оптоволоконного флуоресцентного биосенсора на основе фермента - лакказы, иммобилизованной в матрице {тетрааминофталоцианин меди - Fe3O4} (Huang J., Fang H., Liu С., Gu E., Jiang D. A novel fiber optic biosensor for the determination of adrenaline based on immobilized laccase catalysis. Anal. Lett. 2008. V.41. №8. P.1430-1442). Сенсор представляет собой ячейку, в которую помещена матрица, содержащая иммобилизованную лакказу, а также отделенные от нее тефлоновой мембраной частицы додецилсульфата трис(4,7-дифенил-1,10-фенантролин) рутения (II). Через прозрачное окошко ячейка контактирует с оптическим волокном. Действие сенсора основано на реакции окисления фенола кислородом в присутствии лакказы до o-хинона, приводящей к потреблению кислорода в системе. Аналитическим сигналом служит уменьшение интенсивности флуоресценции комплекса рутения в присутствии кислорода. Аналитический сигнал регистрируют в режиме отражения непосредственно в растворе (λех=450 нм, λem=600 нм). Однако измерение аналитического сигнала непосредственно в растворе не позволяет анализировать непрозрачные и мутные среды без их дополнительной пробоподготовки (растворение в токсичных органических растворителях, экстракция, фильтрование).
Известен принятый за прототип способ определения фенола, простейших изомерных o- и n-дифенольных соединений и флавоноидов с использованием твердофазных спектрофотометрических биосенсоров на основе оптически прозрачных пленок {хитозан-пероксидаза}, закрепленных на поверхности стеклянных пластинок (I.A. Veselova, L.I. Malinina, P.V. Rodionov, T.N. Shekhovtsova. Properties and analytical application of self-assembled complex {peroxidase-chitosan}. Talanta 102 (2012) 101-109). Действие биосенсора основано на ферментативном окислении фенольного соединения (до соответствующего o- или n-хинона) и последующем взаимодействии продукта окисления с хитозаном с образованием аддукта Михаэля, характеризующегося максимумом поглощения в области 345-355 нм. Формирование чувствительного слоя биосенсора осуществляют равномерным нанесением смеси {хитозан-пероксидаза} на поверхность горизонтально расположенной стеклянной пластинки и ее последующем высушивании на воздухе при комнатной температуре. Для проведения индикаторной реакции биосенсор выдерживают необходимое время в реакционной системе. Для измерения аналитического сигнала биосенсор извлекают из раствора, высушивают на воздухе при комнатной температуре и далее закрепляют на фронтальной поверхности кюветного отделения спектрофотометра. Аналитический сигнал регистрируют в режиме поглощения относительно чистой стеклянной пластинки. Окисление пероксидом водорода (H2O2, 1 мМ) проводят в 5 мМ фосфатном буферном растворе pH 6.5 в присутсвии пероксидазы из корней хрена (10 нМ) при комнатной температуре в течение 24 ч. Однако низкая технологичность указанного процесса обусловливается длительностью времени проведения анализа, кроме того, описанный спектрофотометрический биосенсор позволяет определять фенольные соединения на уровне не ниже микромолярного, а также не позволяет определять катехоламины и их метаболиты.
Предлагаемое изобретение решает задачу простого и чувствительного определения катехоламинов и их метаболитов в объектах, анализ которых с использованием оптических методов детектирования по инструментальным причинам был ранее затруднен или невозможен вследствие мешающего влияния матрицы реального объекта, а также недостаточной чувствительности и воспроизводимости биосенсоров.
Поставленная задача решается изменением принципиальной схемы формирования и измерения аналитического сигнала - переходом к твердофазной флуоресценции. Новизна при этом заключается в том, что компоненты индикаторной реакции иммобилизованы в чувствительном слое на поверхности биосенсора, в результате флуоресцентный сигнал формируется и регистрируется непосредственно на твердой поверхности в режиме отражения. Действие предложенного авторами биосенсора основано на реакции ферментативной дериватизации катехоламинов и их метаболитов с органическими аминами (o-фенилендиамином, этилендиамином) с образованием производных хиноксалина, флуоресцирующих в области 450-550 нм.
Наибольшую интенсивность флуоресцентного сигнала получают при использовании в качестве дериватизирующего агента o-фенилендиамина и проведении процесса при концентрации пероксидазы хрена - 10-25 нМ; концентрации пероксида водорода - 250-500 мкМ; концентрации o-фенилендиамина - 50-100 мкМ; концентрации катехоламинов и метаболитов - 5-2000 нМ. В качестве буферного раствора берут 5 мМ фосфатный буферный раствор pH 9.5-10.0. Чувствительный слой биосенсора представляет собой двухслойную пленку {хитозан - o-фенилендиамин/хитозан - пероксидаза}, нанесенную ровным слоем на поверхность стеклянной пластинки (14×40 мм). Объем смеси {хитозан - o-фенилендиамин} - 100 мкл, объем смеси {хитозан - пероксидаза} - 150 мкл, объемная доля хитозана в пленке 95%. Биосенсор устанавливают в кюветном отделении флуориметра перед отражающей поверхностью (зеркальная пластинка 14×40 мм) под углом 75 градусов относительно источника возбуждения (ксеноновая лампа).
Нами впервые был предложен подход, заключающийся в иммобилизации дериватизирующих агентов (o-фенилендиамина, этилендиамина) в хитозановой пленке на поверхности стекла и регистрации флуоресцентного сигнала непосредственно на твердой поверхности в чувствительном слое сенсора, что позволяет проводить анализ в непрозрачных и мутных средах.
Технический результат предлагаемого изобретения при этом состоит в улучшении технологичности процесса из-за исключения необходимости проведения дополнительной пробоподготовки анализируемого образца (кроме разбавления); чувствительность по сравнению с аналогом и прототипом возрастает до 3-70 нМ; время анализа сокращается до 30 с.
Анализ известных технических решений позволяет сделать вывод о том, что предлагаемое изобретение не известно из уровня техники, что свидетельствует о его соответствии критерию "новизна".
Сущность настоящего изобретения для специалистов не следует явным образом из уровня техники, что позволяет сделать вывод о его соответствии критерию "изобретательский уровень".
Возможность проведения способа на традиционном оборудовании с достижением поставленной задачи свидетельствует о соответствии изобретения критерию "промышленная применимость".
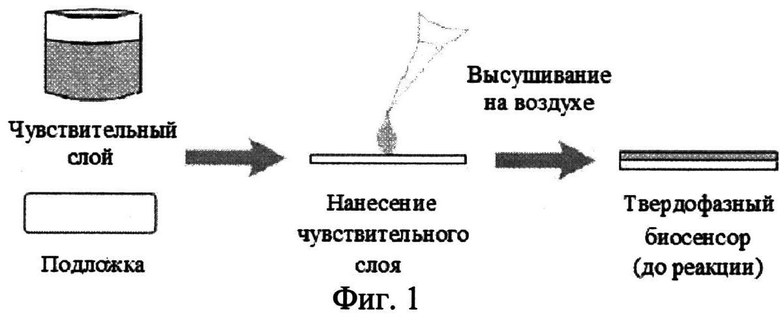
На фиг.1 представлена схема формирования чувствительного слоя биосенсора.
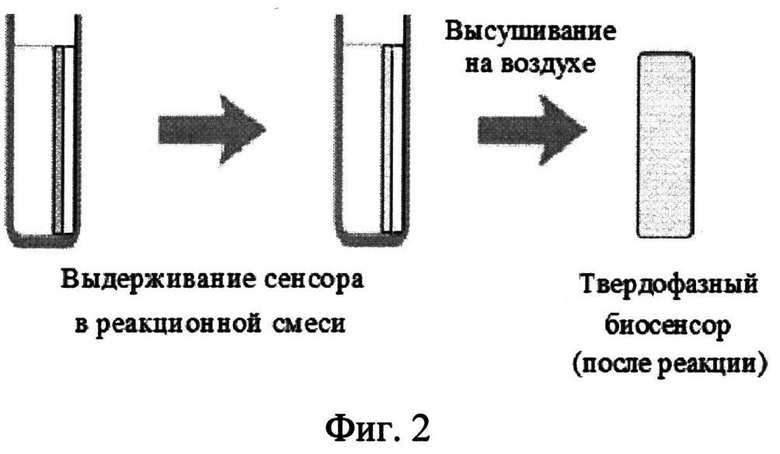
На фиг.2 представлена схема проведения индикаторной реакции.
На фиг.3 представлена схема измерения аналитического сигнала с использованием оптического биосенсора.
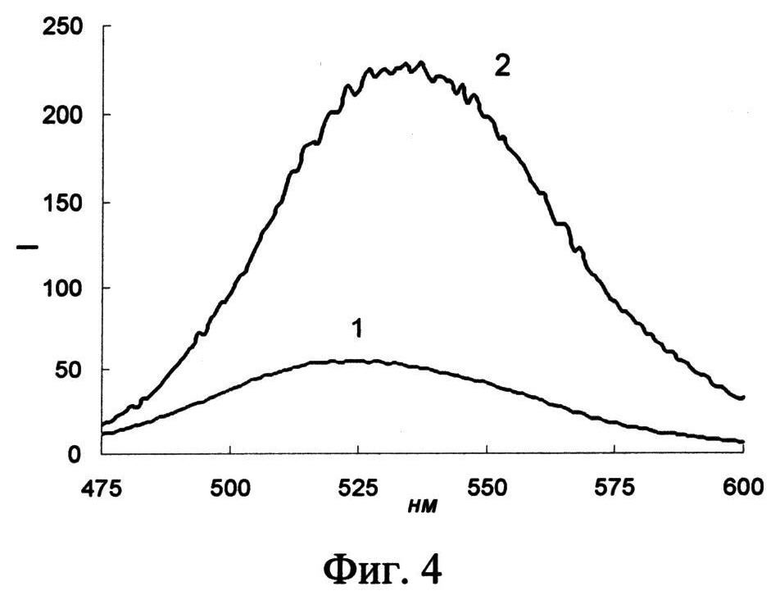
На фиг.4 представлены спектры флуоресценции чувствительного слоя биосенсора в отсутствие (1) и в присутствии АД (2) (сАД - 0.5 мкМ; время реакции 30 с).
Приведенные примеры подтверждают, но не ограничивают заявляемое изобретение.
Пример 1. Способ получения в чувствительном слое биосенсора 2,3-бензо-7-метиламин-хиноксалина, флуоресцирующего производного катехоламинов, на примере ферментативной дериватизации ДА с o-фенилендиамином
В качестве производного катехоламинов был взят допамин (ДА). Реакцию дериватизации ДА с o-фенилендиамином проводили по следующей методике: в стеклянную пробирку последовательно вводили 4.8 мл 5 мМ фосфатного буферного раствора (pH 9.5), раствор ДА (0.2-2.0 мкМ в системе) и 0.100 мл 25 мМ раствора Н2О2 (0.5 мМ в системе). Реакционную смесь тщательно перемешивали и погружали в нее биосенсор, чувствительный слой которого содержал пероксидазу (25 нМ в системе) и o-фенилендиамин (100 мкМ в системе). Биосенсор выдерживали в реакционной системе в течение 30 с, извлекали и высушивали на воздухе при комнатной температуре. Для измерения аналитического сигнала биосенсор устанавливали в кюветном отделении флуориметра перед отражающей поверхностью (зеркальная пластинка) под углом 75 градусов относительно источника возбуждения (ксеноновая лампа) и регистрировали интенсивность флуоресценции чувствительного слоя (λех=440-450 нм, λem=520 нм). Предел обнаружения - 70 нМ.
Пример 2. Способ получения в чувствительном слое биосенсора 2,3-бензо-7-гидроксиметиламин-хиноксалина, флуоресцирующего производного катехоламинов, на примере ферментативной дериватизации АД с o-фенилендиамином
В качестве производного катехоламинов был взят адреналин (АД). Реакцию дериватизации АД с o-фенилендиамином проводили по следующей методике: в стеклянную пробирку последовательно вводили 4.8 мл 5 мМ фосфатного буферного раствора (pH 9.75), раствор АД (0.1-1.0 мкМ в системе) и 0.070 мл 25 мМ раствора H2O2 (0.35 мМ в системе). Реакционную смесь тщательно перемешивали и погружали в нее биосенсор, чувствительный слой которого содержал пероксидазу (25 нМ в системе) и o-фенилендиамин (100 мкМ в системе). Биосенсор выдерживали в реакционной системе в течение 30 с, извлекали и высушивали на воздухе при комнатной температуре. Для измерения аналитического сигнала биосенсор устанавливали в кюветном отделении флуориметра перед отражающей поверхностью (зеркальная пластинка) под углом 75 градусов относительно источника возбуждения (ксеноновая лампа) и регистрировали интенсивность флуоресценции чувствительного слоя (λex=440-450 нм, λem=540 нм). Предел обнаружения - 50 нМ.
Пример 3. Способ получения в чувствительном слое биосенсора 2,3-бензо-хиноксалин-7-уксусной кислоты, флуоресцирующего производного метаболитов катехоламинов, на примере ферментативной дериватизации ГВК с o-фенилендиамином
В качестве производного метаболитов катехоламинов была взята гомованилиновая кислота (ГВК). Реакцию дериватизации ГВК с o-фенилендиамином проводили по следующей методике: в стеклянную пробирку последовательно вводили 4.8 мл 5 мМ фосфатного буферного раствора (pH 10.0), раствор ГВК (10-100 нМ в системе) и 0.050 мл 25 мМ раствора H2O2 (0.25 мМ в системе). Реакционную смесь тщательно перемешивали и погружали в нее биосенсор, чувствительный слой которого содержал пероксидазу (10 нМ в системе) и o-фенилендиамин (100 мкМ в системе). Биосенсор выдерживали в реакционной системе в течение 30 с, извлекали и высушивали на воздухе при комнатной температуре. Для измерения аналитического сигнала биосенсор устанавливали в кюветном отделении флуориметра перед отражающей поверхностью (зеркальная пластинка) под углом 75 градусов относительно источника возбуждения (ксеноновая лампа) и регистрировали интенсивность флуоресценции чувствительного слоя (λех=440-450 нм, λem=540 нм). Предел обнаружения - 5 нМ.
Пример 4. Способ получения в чувствительном слое биосенсора 2,3-бензо-хиноксалин-7-гидроксиуксусной кислоты, флуоресцирующего производного метаболитов катехоламинов, на примере ферментативной дериватизации ВМК с o-фенилендиамином
В качестве производного метаболитов катехоламинов была взята ванилилминдальная кислота (ВМК). Реакцию дериватизации ВМК с o-фенилендиамином проводили по следующей методике: в стеклянную пробирку последовательно вводили 4.8 мл 5 мМ фосфатного буферного раствора (pH 9.5), раствор ВМК (5-75 нМ в системе) и 0.070 мл 25 мМ раствора H2O2 (0.35 мМ в системе). Реакционную смесь тщательно перемешивали и погружали в нее биосенсор, чувствительный слой которого содержал пероксидазу (10 нМ в системе) и o-фенилендиамин (50 мкМ в системе). Биосенсор выдерживали в реакционной системе в течение 30 с, извлекали и высушивали на воздухе при комнатной температуре. Для измерения аналитического сигнала биосенсор устанавливали в кюветном отделении флуориметра перед отражающей поверхностью (зеркальная пластинка) под углом 75 градусов относительно источника возбуждения (ксеноновая лампа) и регистрировали интенсивность флуоресценции чувствительного слоя (λex=440-450 нм, λem=530 нм). Предел обнаружения - 3 нМ.
Как видно из приведенных примеров, предлагаемое изобретение решает задачу получения флуоресцирующих производных катехоламинов и их метаболитов непосредственно в чувствительном слое твердофазного оптического биосенсора.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ МАРКЕРОВ НЕЙРОМЕДИАТОРНОГО ОБМЕНА В ОБРАЗЦАХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2708917C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУОРЕСЦИРУЮЩИХ ПРОИЗВОДНЫХ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ МЕТОДОМ ДЕРИВАТИЗАЦИИ | 2012 |
|
RU2546672C2 |
| СПОСОБ ГЕНЕРАЦИИ ПЕРОКСИДА ВОДОРОДА НА ОСНОВЕ НАНО- И/ИЛИ МИКРОЧАСТИЦ ZnO2 ДЛЯ ПРИМЕНЕНИЯ В СПЕКТРОФОТОМЕТРИЧЕСКОМ И ЛЮМИНЕСЦЕНТНОМ АНАЛИЗЕ С УЧАСТИЕМ ПЕРОКСИДАЗЫ | 2022 |
|
RU2800949C1 |
| ОПТИЧЕСКИЙ БИОСЕНСОР НЕОБРАТИМЫХ ИНГИБИТОРОВ ХОЛИНЭСТЕРАЗЫ В ВОЗДУХЕ | 2007 |
|
RU2386120C2 |
| Способ количественного определения 5-гидроксиизофлавонов | 1988 |
|
SU1576859A1 |
| Оптический биосенсор необратимых ингибиторов холинэстеразы в воздухе | 2016 |
|
RU2654294C2 |
| Способ подготовки проб мочи на принципах мицеллярной экстракции для определения содержания адреналина | 2022 |
|
RU2800474C1 |
| СПОСОБ СОЗДАНИЯ РЕГЕНЕРИРУЕМОГО БИОСЕНСОРА НА ОСНОВЕ КОМПЛЕКСА ФОТОННОГО КРИСТАЛЛА С АФФИННЫМИ МОЛЕКУЛАМИ | 2015 |
|
RU2618606C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СОСТАВА ГЛИФОСАТСОДЕРЖАЩИХ СМЕСЕЙ | 2022 |
|
RU2787117C1 |
| БИОСЕНСОР ТОКСИЧНОСТИ ВОЗДУХА | 2008 |
|
RU2381277C1 |

Изобретение относится к области медицины и может быть применено для определения катехоламинов их метаболитов в объектах на основе матриц сложного состава, в том числе нерастворимых в воде, без их дополнительной пробоподготовки. Способ осуществляют путем изменения принципиальной схемы формирования и измерения аналитического сигнала, регистрируемого в чувствительном слое биосенсора, - переходом к твердофазной флуоресценции. Действие биосенсора основано на реакции ферментативной дериватизации катехоламинов и их метаболитов с органическими аминами (o-фенилендиамин, этилендиамин) с образованием производных хиноксалина, флуоресцирующих в области 450-550 нм. При этом компоненты индикаторной реакции иммобилизованы в чувствительном слое на поверхности биосенсора, в результате флуоресцентный сигнал формируется и регистрируется непосредственно на твердой поверхности в режиме отражения. Наибольшую интенсивность флуоресцентного сигнала получают при использовании в качестве дериватизирующего агента o-фенилендиамина и проведении процесса при концентрации пероксидазы хрена - 10-25 нМ; концентрации пероксида водорода - 250-500 мкМ; концентрации o-фенилендиамина - 50-100 мкМ; концентрации катехоламинов и метаболитов - 5-2000 нМ. В качестве буферного раствора берут 5 мМ фосфатный буферный раствор pH 9.5-10.0. Чувствительный слой биосенсора представляет собой двухслойную пленку {хитозан - o-фенилендиамин/хитозан - пероксидаза}, нанесенную ровным слоем на поверхность стеклянной пластинки (14×40 мм). Изобретение обеспечивает простое и чувствительное определение катехоламинов и их метаболитов в объектах, анализ которых с использованием оптических методов детектирования по инструментальным причинам был ранее затруднен или невозможен вследствие мешающего влияния матрицы реального объекта, а также недостаточной чувствительности и воспроизводимости биосенсоров. 3 з.п. ф-лы, 4 ил.
1. Способ определения катехоламинов и их метаболитов, характеризующийся использованием флуоресцентного биосенсора путем ферментативной дериватизации катехоламинов и их метаболитов с образующими конденсированные структуры аминами, причем аналитический сигнал регистрируется непосредственно в чувствительном слое сенсора, закрепленном на поверхности подложки, чувствительный слой биосенсора содержит иммобилизованный фермент и дериватизирующий агент и представляет собой двухслойную пленку - о-фенилендиамин/хитозан-пероксидаза, сформированнную последовательным нанесением смеси хитозан - о-фенилендиамин и смеси хитозан - пероксидаза на поверхность стеклянной пластинки; для проведения индикаторной реакции биосенсор выдерживается 30 с в реакционной системе и высушивается на воздухе при комнатной температуре; для измерения аналитического сигнала биосенсор устанавливается в кюветном отделении флуориметра перед отражающей поверхностью под углом 75 градусов относительно источника возбуждения, причем интенсивность флуоресценции чувствительного слоя регистрируется в режиме отражения.
2. Способ по п. 1, отличающийся тем, что в качестве фермента используют пероксидазу из корней хрена, в качестве окислителя используют пероксид водорода, в качестве амина используют о-фенилендиамин; процесс проводят при концентрации пероксидазы хрена - 10-25 нМ; концентрации пероксида водорода - 250-500 мкМ, концентрации дериватизирующего агента - 50-100 мкМ; концентрации катехоламинов и метаболитов - 5-2000 нМ; в качестве буферного раствора берут 5 мМ фосфатный буферный раствор pH 9.5-10.0.
3. Способ по п. 1, отличающийся тем, что формирование чувствительного слоя осуществляют последовательным нанесением 100 мкл смеси хитозан - о-фенилендиамин и 150 мкл смеси хитозан - пероксидаза на поверхность стеклянной пластинки 14×40 мм; объемная доля хитозана в пленке - 95%; после нанесения каждого слоя поверхность биосенсора высушивается на воздухе при комнатной температуре.
4. Способ по п. 1, отличающийся тем, что для измерения аналитического сигнала биосенсор устанавливается в кюветном отделении флуориметра перед отражающей поверхностью, зеркальной пластинкой 14×40 мм, под углом 75 градусов относительно источника возбуждения, ксеноновой лампы.
| VESELOVA I.A | |||
| et al | |||
| Properties and analytical application of self-assembled complex { peroxidase-chitosan} | |||
| Транспортер для перевозки товарных вагонов по трамвайным путям | 1919 |
|
SU102A1 |
| БИОСЕНСОРНАЯ СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ 2,4-ДИНИТРОФЕНОЛА И ИОНОВ НИТРИТА И БИОСЕНСОРЫ ДЛЯ ЭТОЙ СИСТЕМЫ | 2000 |
|
RU2207377C2 |
| Г.К | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| СИДОРОВА А.А | |||
| и др | |||
| Хроматографическое и электрофоретическое определение катехоламинов, метанефринов и | |||
Авторы
Даты
2015-06-27—Публикация
2013-05-23—Подача