Изобретение относится к области аналитической химии, а именно к способам определения микроколичеств ртути, и может быть использовано для экспресс-анализа объектов окружающей среды.
Известны способы [1, 2] ферментативного определения ртути по ее ингибирующему действию на ферменты уреазу и холинэстеразу, заключающиеся в предварительной инкубации пробы с иммобилизованным ферментом и последующем определении скорости ферментативного гидролиза специфических субстратов - мочевины и эфиров холина соответственно - с помощью потенциометрических датчиков. Указанные способы неселективны, требуют пробоподготовки и специального оборудования, включая ион-селективные датчики и ферментсодержащие мембраны.
Способ [3] заключается в том, что на полоску хроматографической бумаги, пропитанной раствором пероксидазы хрена в хитозане, наносят растворы тиомочевины, анализируемой пробы, содержащей ртуть, 3,3',5,5'-тетраметилбензидина и пероксида водорода. Содержание ртути в пробе определяют визуально по времени достижения желтой окраски конечного продукта окисления 3,3',5, 5'-тетраметилбензидина, линейно зависящего от логарифма концентрации ртути. Способ достаточно чувствителен (Сн = 10 пг/мл), экспрессен, однако стабильность иммобилизованного препарата фермента при хранении невысока. Активность пероксидазы, иммобилизованной на хроматографической бумаге, сохраняется в течение 6 месяцев.
Наиболее близким к предлагаемому изобретению по сущности и предлагаемому решению (прототипом) является способ [4].
Способ [4] заключается в том, что к твердому раствору пероксидазы в хитозане, предварительно приготовленному смешением 0.1% водного раствора хитозана и 20 мкМ раствора пероксидазы из корней хрена в объемном соотношении 10: 1, дозированному и высушенному в токе воздуха в течение 20 мин в ячейках полистирольного планшета для иммунохимического анализа, добавляют фталатный буферный раствор (pH 5.0) для полного растворения препарата фермента, далее к полученному раствору последовательно добавляют 20 мкл 25 мМ раствора тиомочевины, выдерживают в течение 5 мин, затем добавляют 20 мкл анализируемого раствора, содержащего ртуть, инкубируют смесь еще в течение 10 мин, после чего добавляют 10 мкл 2.5 мМ раствора о-дианизидина, 10 мкл 10 мМ пероксида водорода. Содержание ртути определяют визуально по зависимости времени достижения красно-коричневой окраски конечного продукта окисления о-дианизидина от логарифма концентрации ртути.
Активность пероксидазы хрена, иммобилизованной в полистирольном планшете, сохраняется в течение 6 месяцев.
Нижняя граница определяемых содержаний ртути 10 пг/мл. Время анализа составляет 20 мин.
Задача изобретения заключается в создании высокочувствительного, экспрессного и простого способа определения микроколичеств ртути, который может быть использован для анализа объектов окружающей среды, в частности, природных вод.
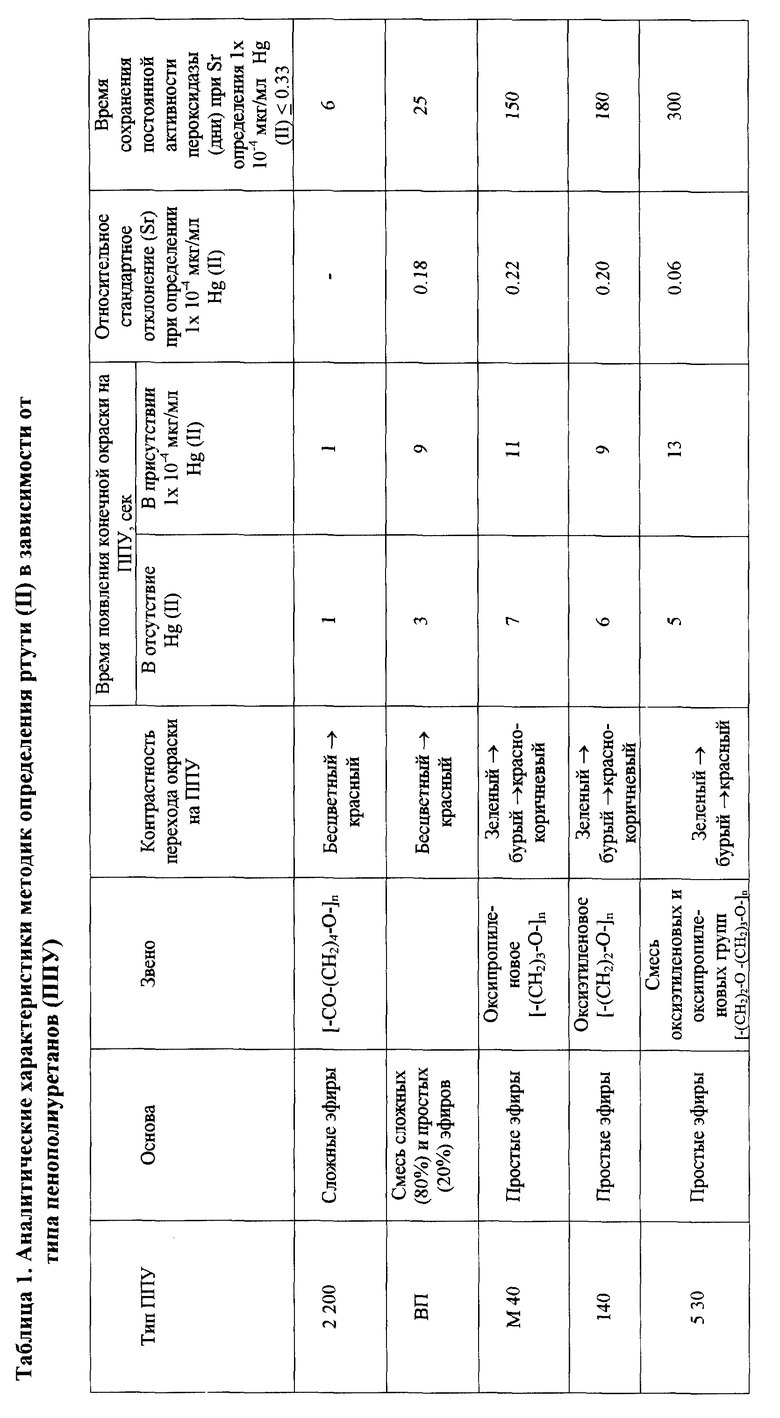
Эта задача решается тем, что в процессе анализа к иммобилизованной в хитозане пероксидазе хрена последовательно добавляют раствор тиомочевины, анализируемую пробу, содержащую ртуть, раствор субстрата-восстановителя - о-дианизидина и пероксида водорода и фиксируют время достижения окраски продукта окисления, при этом в качестве носителя иммобилизованного препарата пероксидазы и одновременно подложки для проведения реакции используют пенополиуретан 5 30. Ранее пенополиуретан (ППУ) для иммобилизации ферментов, пероксидазы, в частности, не использовался. Для выбора оптимальной марки ППУ, позволяющей достичь максимальной активности и стабильности иммобилизованной на нем пероксидазы, изучена зависимость скорости индикаторной реакции, проводимой на пенополиуретанах с иммобилизованной пероксидазой, от строения структурных звеньев ППУ. Результаты исследования свидетельствуют о том, что наиболее эффективно действие ртути проявляется при использовании для иммобилизации пероксидазы ППУ 5 30 на основе простых оксиэтиленового и оксипропиленового эфиров: наблюдается наиболее контрастный переход (зеленый-бурый-красный) окраски при протекании реакции на данном типе ППУ; достигается максимальное различие во времени протекания реакции в присутствии и в отсутствие ртути - 8 с, наилучшая воспроизводимость при определении ртути (Sr = 0.06); наиболее длительное время иммобилизованный фермент сохраняет свою каталитическую активность (в течение 10 месяцев) (табл. 1).
При использовании предлагаемого способа
1. упрощается способ иммобилизации ферментного препарата: таблетку ППУ 5 30 пропитывают смесью пероксидазы с хитозаном, отпадает необходимость использования и хранения полистирольного планшета;
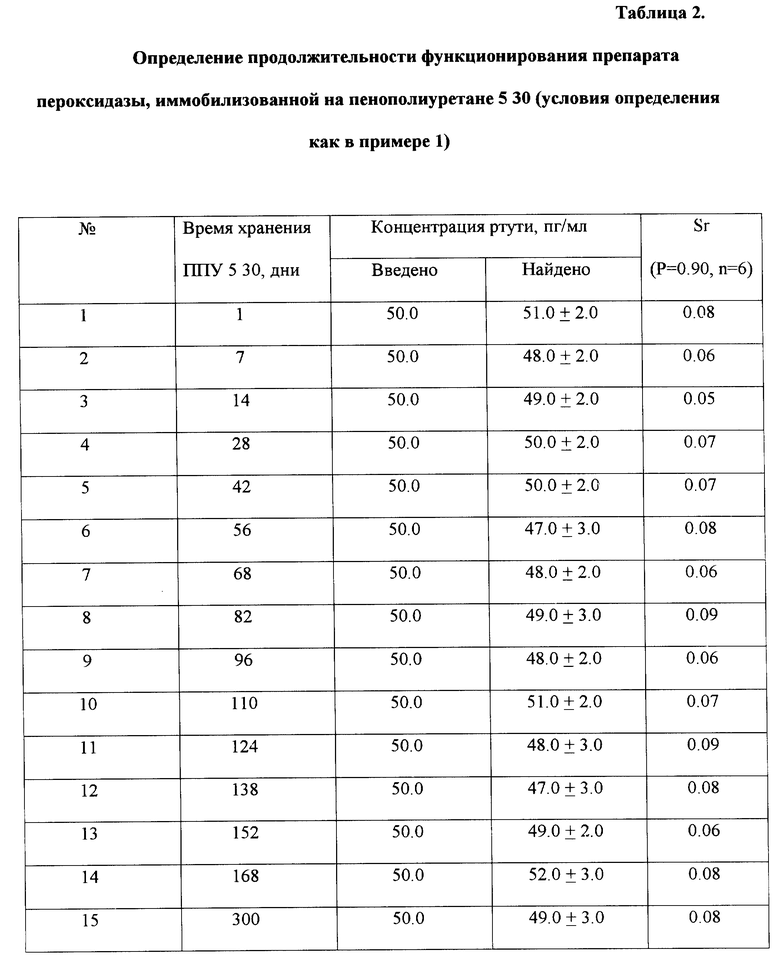
2. повышается стабильность пероксидазы, иммобилизованной на ППУ 5 30, активность пероксидазы в твердом растворе в хитозане на пенополиуретане 5 30 не изменяется в течение 10 месяцев (табл.2);
3. повышается чувствительность определения ртути при использовании ППУ в качестве носителя иммобилизованного фермента: Сн = 2.5 пг/мл (при иммобилизации пероксидазы в полистирольном планшете Сн = 10 пг/мл);
4. повышается контрастность перехода окраски реакционного раствора - зеленый-бурый-красный (в полистирольном планшете - зеленый-бурый-красно-коричневый), что облегчает визуальную индикацию завершения ферментативного процесса и улучшает воспроизводимость методики (Sr = 0.06 в случае пероксидазы, иммобилизованной на ППУ и Sr = 0.17 в случае иммобилизации в полистирольном планшете);
5. значительно понижается расход фермента: концентрация пероксидазы, необходимая для получения ее высокоактивного препарата при иммобилизации на ППУ 5 30 (0.01 мкМ), в 100 раз меньше, чем концентрация, требуемая для получения пероксидазы той же активности при иммобилизации в полистирольном планшете (1.0 мкМ);
6. сокращается продолжительность анализа - время анализа составляет 5 мин. Это достигается за счет того, что отпадает необходимость предварительного инкубирования смесей компонентов реакции в отличие от способа, в котором используется препарат, иммобилизованный в полистирольном планшете (время анализа - 20 мин). Кроме того, повышается экспрессность анализа при проведении серийных опытов, так как при использовании препарата, иммобилизованного на пенополиуретане 5 30, необходим только один контрольный опыт в течение дня, а в случае использования полистирольного планшета его необходимо повторять каждые два часа.
Выявленные отличия в аналитической химии и других смежных областях науки не использовались.
Пример 1. Для приготовления иммобилизованного препарата пероксидазы хрена таблетку ППУ 5 30 диаметром 0.8 см и толщиной 0.3 см помещают в чашку Петри и пропитывают в течение 5 мин смесью 0.01 мкМ раствора пероксидазы в боратном буферном растворе, 0.01% раствора хитозана и воды в соотношении 7: 2:1. После пропитки таблетку высушивают в течение 1 часа в токе воздуха. После этого на поверхность таблетки пенополиуретана 5 30 наносят последовательно 12 мкл фталатного буферного раствора (pH 5.0), 6 мкл 25 мМ раствора тиомочевины, 6 мкл анализируемой пробы, содержащей ртуть, 6 мкл 5 мМ раствора о-дианизидина и 6 мкл 5 мМ раствора пероксида водорода. В момент введения последнего включают секундомер и фиксируют время достижения красной окраски пятна на таблетке ППУ. Определение ртути в диапазоне концентраций 2.5-10.0 пг/мл проводят по градуировочному графику, построенному в координатах: t, время достижения красной окраски пятна на таблетке пенополиуретана - lgC, логарифм концентрации ртути, линейному в соответствии с уравнением t,c= 3.45+5.381gC
При концентрации ртути 2.5 пг/мл найдено (2.6±0.2) пг/мл при Sr = 0.06 (P = 0.90, n = 6).
Пример 2. Условия определения как в примере 1.
При концентрации ртути 10.0 пг/мл найдено (9.0±2.0) пг/мл при Sr = 0.07 (P = 0.90, n = 6).
Пример 3. Условия определения как в примере 1.
При концентрации ртути 50.0 нг/мл найдено (51.0±2.0) нг/мл при Sr = 0.06 (P = 0.90, n = 6).
Список литературы
1. Orgen L. Johansson G. Determination of traces of mercury (II) by inhibition of an enzyme reactor electrode loaded with immobilized urease. // Anal. Chim. Acta. 1978. V. 96. N 1. P. 1-11
2. Медянцева Э.П., Будников Г.К., Бабкина С.С. Ферментативный электрод на основе иммобилизованной холинэстеразы для определения потенциальных загрязнителей окружающей среды. // Журн. аналит. химии. 1990. Т.45. N 7. С. 1386-1389.
3. Долманова И.Ф., Никольская Е.Б., Чернецкая С.В., Шеховцова Т.Н. Патент РФ 2013770. Способ ферментативного определения микроколичеств ртути. Заявл. 29.05.1992. Опубл. бюл. N 10. 1994.
4. Шеховцова Т. Н. , Чернецкая С.В., Долманова И.Ф. Патент РФ 2073864. Способ ферментативного определения микроколичеств ртути. Заявл. 11.04.1994. Опубл. бюл. N 5.1997
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1994 |
|
RU2073864C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ МЕТИЛРТУТИ | 1997 |
|
RU2143683C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1992 |
|
RU2013770C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ МАРКЕРОВ НЕЙРОМЕДИАТОРНОГО ОБМЕНА В ОБРАЗЦАХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2708917C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ИСПОЛЬЗОВАНИЕМ ТВЕРДОФАЗНОГО ФЛУОРЕСЦЕНТНОГО БИОСЕНСОРА | 2013 |
|
RU2554499C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ОСНОВНОГО БЕЛКА ТЕПЛОВОГО ШОКА 70 КДА | 2003 |
|
RU2242764C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЛУОРЕСЦИРУЮЩИХ ПРОИЗВОДНЫХ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ МЕТОДОМ ДЕРИВАТИЗАЦИИ | 2012 |
|
RU2546672C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИЕЛОПЕРОКСИДАЗЫ В ПЛАЗМЕ КРОВИ | 2011 |
|
RU2464575C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ГИДРОЛАЗЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1994 |
|
RU2159818C2 |
| СПОСОБ КОМПЛЕКСНОЙ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА ПУТЕМ ТВЕРДОФАЗНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2012 |
|
RU2488832C1 |
Изобретение относится к области аналитической химии, а именно к способам определения микроколичеств ртути и может быть использовано для экспресс-анализа объектов окружающей среды. К иммобилизованному в хитозане ферментному препарату пероксидазы, помещенному на носитель, последовательно добавляют растворы тиомочевины, анализируемой пробы, растворы о-дианизидина и пероксида водорода. При этом в качестве носителя иммобилизованного ферментного препарата используют пенополиуретан ППУ 5 30 на основе простых оксиэтиленового и оксипропиленового эфиров. В момент введения пероксида водорода начинают отсчет и фиксируют время появления красной краски пятна на пенополиуретане. Определение ртути в интервале концентраций 2,5•l0-6-5•10-3 мкг/мл проводят по градуировочному графику. Изобретение упрощает способ, сокращает продолжительность анализа и расход фермента. 2 табл.
Способ ферментативного определения микроколичеств ртути, предусматривающий последовательное добавление к иммобилизованному в хитозане ферментному препарату пероксидазы, помещенному на носитель, раствора тиомочевины, анализируемой пробы, растворов о-дианизидина и пероксида водорода, визуальную регистрацию появления окраски продукта реакции, отличающийся тем, что в качестве носителя для иммобилизованного препарата пероксидазы используют пенополиуретан 5 30 на основе простых оксиэтиленового и оксипропиленового эфиров.
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1992 |
|
RU2013770C1 |
| СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ РТУТИ | 1994 |
|
RU2073864C1 |
| Orgen L., Johansson G | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| II Anal | |||
| Chim | |||
| Acta | |||
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2000-01-10—Публикация
1997-11-28—Подача