Изобретение относится к фармации, в частности к синтезу фармакологически активных соединений.
Сердечно-сосудистые заболевания являются основной причиной смертности населения в России. Наиболее часто в основе сердечно-сосудистых заболеваний лежит атеротромбоз - процесс патологического тромбообразования, ведущий к инфаркту миокарда и инсульту.
В образовании тромба значимую роль играют гликопротеиновые рецепторы тромбоцитов. Именно связывание фибриногена с активированными GP IIb/IIIa-рецепторами тромбоцитов является конечным звеном в агрегации последних. Ингибиторы GP IIb/IIIa-рецепторов тромбоцитов являются мощными антитромбоцитарными препаратами, так как механизм их действия заключается в блокировании конечного этапа агрегации тромбоцитов - процесса образования мостиков из молекул фибриногена между соседними активированными тромбоцитами. Антагонисты GP IIb/IIIa рецепторов тромбоцитов представлены разными классами химических соединений, однако существенный интерес среди антиагрегантов представляют антагонисты GP IIb/IIIa рецепторов, имеющие пептидную природу.
Известно также, что в результате взаимодействия оксида азота (NO) с тромбоцитами и лейкоцитами снижается их агрегация и адгезия на стенках кровеносных сосудов, что приводит к ингибированию процессов тромбообразования. Нарушения, связанные с нормальным протеканием вышеуказанных реакций, лежат в основе патофизиологических процессов, характерных для развития различных заболеваний сердечно-сосудистой системы. При таких заболеваниях наблюдаются множественные нарушения синтеза эндогенного NO, его рецепции растворимой формой гуанилатциклазы (рГЦ), а также регуляции уровня циклических нуклеотидов и ионов кальция [Dessy С, Ferron О. Pathophysiological Roles of Nitric Oxide: In the Heart and the Coronary Vasculature. Current Medical Chemistry - Anti-mflammatory & Anti-Allergy Agents in Medicinal Chemistry. 2004. Vol. 3. P. 207-216].
К настоящему времени доказано образование оксида азота в результате биотрансформации нитроглицерина и других нитратов, которые используются для лечения сердечно-сосудистых заболеваний в качестве антиишемических и антиангинальных препаратов. Однако, их существенным недостатком является возникновение толерантности и других побочных эффектов при длительном применении [Граник В.Г., Григорьев Н.Б. Оксид азота (NO). Новый путь к поиску лекарственных средств: монография. - М.: Вузовская книга. 2004, 360 с.].
В связи с этим проводится поиск новых соединений, способных образовывать NO в живом организме неэнзиматическим путем. Данный подход рассматривается как актуальное и перспективное направление создания новых, более эффективных в сравнении с известными ранее антигипертензивными и антиагрегантными фармпрепаратами, обладающими антиангинальной и антиишемической активностью.
Один из классов химических соединений, производные которого являются донорами оксида азота - фуроксаны. Фуроксаны рассматриваются как пролекарства, реализующие свою биологическую активность через рГЦ-цГМФ-путь [Граник В.Г., Григорьев Н.Б. Оксид азота (NO). Новый путь к поиску лекарственных средств: монография. - М.: Вузовская книга. 2004, 360 с; Граник В.Г., Каминка М.Э., Григорьев М.Б., Северина И.С., Калинкина М.А., Макаров В.А., Левина В.И. Фуроксанопиримидины как экзогенные доноры оксида азота // Хим. Фарм. Журнал. 2002, Том 36, №10, стр. 7-11].
В патенте RU 2119354 1998 описан направленный транспорт лекарств, заключающийся в связывании in vivo молекул-носителей фармакоактивных соединений с форменными элементами крови. Для связывания синтезированы производные фармакологических агентов и пептида, содержащего RGD последовательность. Однако, в вышеописанном патенте не рассматривается антиагрегационное действие пептида и он используется лишь как носитель фармакоактивных соединений.
В патенте US №2012/021007 2012 г. был проведен скрининг фуроксанов, однако их антиагрегационная активность не исследовалась.
В патентах RU 2123046 1998 г. и RU 2139932 1998 г. описаны фуроксаны как доноры оксида азота и активаторы рГЦ, но данные по их антиагрегационной активности не представлены.
В патенте US №7838023 2010 г. упоминается, что биологически активные производные фуроксана обладают антиагрегационной активностью, однако никаких данных по исследованиям не приведено.
Задачей настоящего изобретения является создание новых эффективных ингибиторов агрегации тромбоцитов с двумя различными механизмами воздействия на агрегацию тромбоцитов, состоящих из двух фармакофор: пептидной - ингибиторы GP IIb/IIIa-рецепторов тромбоцитов и фуроксановой - доноры оксида азота.
Поставленная задача решается гетеромерными пептидами на основе имидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана общей формулы:
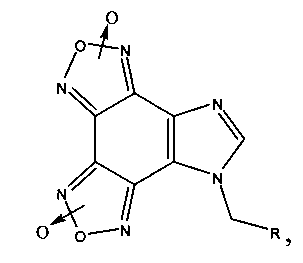
где R=Phe-Ile-Ala-Asp-Thr; Arg-Tyr-Gly-Asp-Arg; Lys-Ile-Ala-Asp-Asp; His-Ile-Giy-Asp-Asp.
Предварительный выбор именно этих соединений в качестве вероятных ингибиторов агрегации тромбоцитов сделан на основании результатов математического моделирования.
С помощью программы «Алгокомб» [Ramensky V., Sobol A., Zaitseva N. et al. A novel approach to local similarity of protein binding sites substantially improves computational drug design results // Proteins. - 2007; 69 (2): 349-357] нами выполнено компьютерное моделирование связывания гетеромерных пептидов с имидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксановым фрагментом на N-конце с белком интегрин αIIb/β3. Расчет оценки связывания [Хельтье Х.-Д., Зиппель В., Роньян Д. и др. Молекулярное моделирование: теория и практика. - М.: БИНОМ. Лаборатория знаний, 2009. - 318] с белком интегрин αIIb/β3 проводился для соединений вида Fur-A-B-C-Asp-D, где «Fur» - метиленимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксан; «А», «В», «С», «D» - L-аминокислотные остатки, структура которых варьировалась в процессе моделирования; в качестве аминокислоты «С» рассматривались глицин или аланин. Всего сгенерировано 48000 молекул.
Для докинга из базы данных PDB (открытая база данных PDB (Protein Data Bank) является общепринятым источником используемой при расчетах информации о пространственной структуре белков) был выбран комплекс белка интегрин αIIb/β3 с идентификатором 2vdp. Докинг начинали с правильного расположения кислотного фрагмента гетеромерного пептида для учета наличия ионной связи лиганда с ионом магния в активном сайте. Так же в процессе докинга учитывали наличие двух молекул воды в активном сайте белка. Молекулы воды образуют водородные связи с С-концевым остатком и с кислородом третьего с С-конца остатка нативного лиганда.
Выбор вышеуказанных четырех соединений из общего количества сгенерированных (48000 молекул) определялся хорошими результатами их оценки связывания с белком интегрин αIIb/β3 (таблица 1).

Синтез целевых соединений.
Синтез гетеромерных пептидов был выполнен на твердой фазе в условиях автоматического пептидного синтезатора ABI 433А PeptideSynthesizer (AppliedBiosystems, США), используя FastMoc 0.25-стратегию. Стратегия FastMoc 0.25 подразумевает последовательное присоединение остатков аминокислот к нерастворимой полимерной подложке. Базовая лабильная группа Fmoc - 9-флуоренилметоксикарбонил- используется для защиты N-групп каждого аминокислотного остатка. Остатки, которые имеют потенциально реактивные боковые цепи, защищены кислотонеустойчивыми группами.
После удаления группы Fmoc пиперидином следующая защищенная аминокислота добавляется, используя или реактив сцепления, или предварительно активированное производное аминокислоты.
В качестве активатора первой аминокислоты в Fmoc-стратегии в реакции присоединения ее к смоле выступает дициклогексилкарбодиимид (DCC). Реакция протекает в присутствии 4-диметиламинопиридина (DCC/DMAP), который играет роль катализатора процесса.
В качестве активатора второй и последующих аминокислот в Fmoc-стратегии выступает 1-гидроксибензотриазол / дициклогексилкарбодиимид (HOBt/DCC) в диметилформамиде. Реакция протекает с образованием активированной аминокислоты и N,N′-дициклогексилмочевины (DCU).
Все вышеперечисленные операции протекают в пептидном синтезаторе.
Для снятия гетеромерных пептидов со смолы в вытяжном шкафу в полипропиленовой пробирке готовили смесь со следующим соотношением компонентов: 2.5% тианизола (TAN), 2.5% триизопропилсилана (TIPS), 5.0% этандитиола (EDT), 90.0% трифторуксусной кислоты (TFA). Приготовленную смесь помещали на лед до остывания на 20-30 мин. Затем в холодную смесь для снятия гетеромерных пептидов помещали пептид-смолу и перемешивали. Помещали пробирку с пептид-смолой в полипропиленовую пробирку, закрывали и выдерживали на качалке в течение 4 часов.
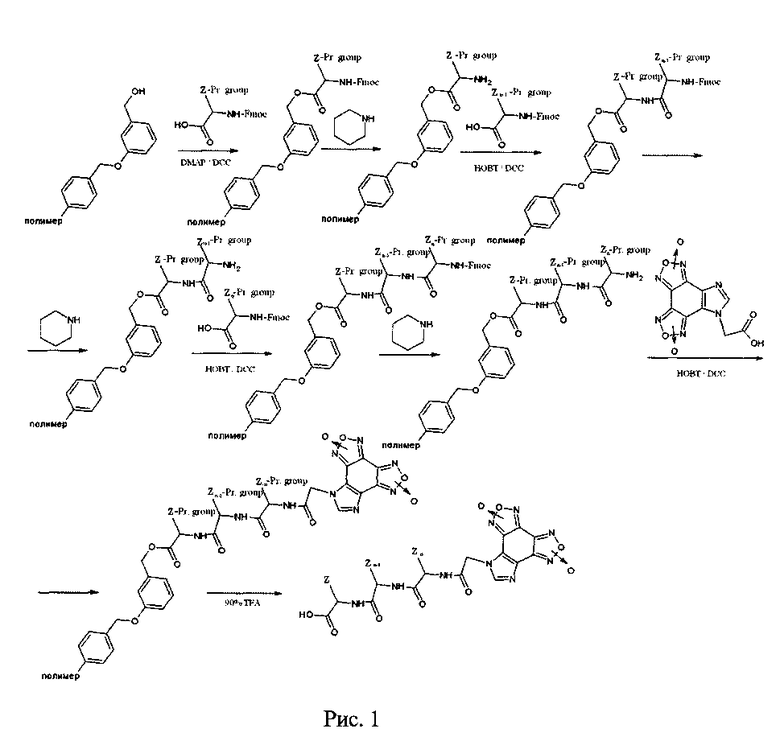
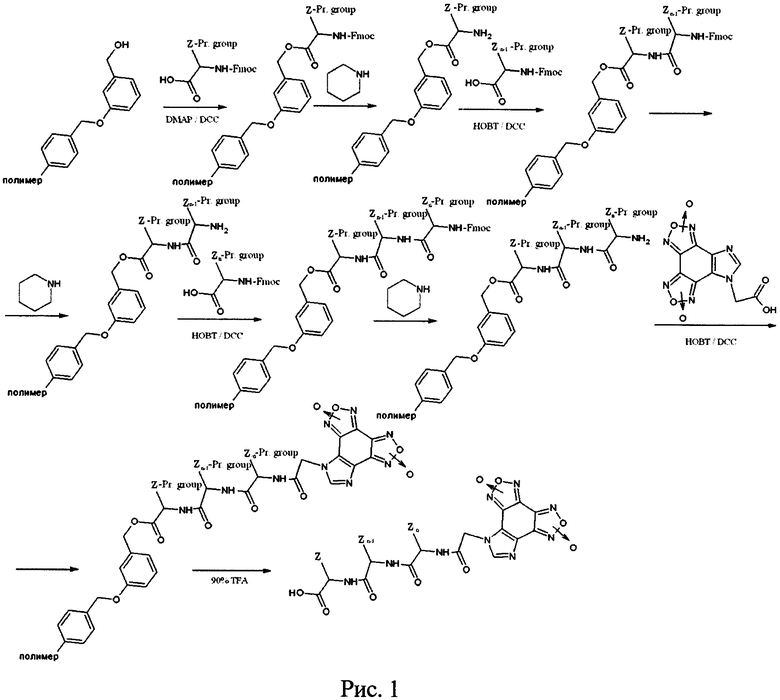
Экстракция гетеромерных пептидов со смолы проводилась на стеклянном фильтре-воронке в вытяжном шкафу. Воронка предварительно ополаскивалась дважды МТВЕ (метилтретбутиловый эфир). По окончанию снятия сливали смесь со смолой и пептидом на фильтр Шотта. Промывали пробирку, в которой шла реакция TFA, смыв сливали на фильтр. Фильтровали при небольшом вакууме до осушения смолы. Добавляли холодный МТВЕ, тщательно промывали смолу и фильтровали до осушения. Промывали пробирку, в которой находилась пептид-смола, трижды холодным МТВЕ и добавляли смыв к основному сливу. Тщательно перемешивали взвесь, оставляли не менее, чем на 1 час при -20°C. Осадок отфильтровывали, сушили. Схема синтеза гетеромерных пептидов представлена на рисунке 1, где Z = радикалы аминокислот, Pr. Group (Protected Group) = защитные группы аминокислот.
Очистку гетеромерных пептидов осуществляли с помощью высокоэффективного препаративного жидкостного хроматографа PtiriFlash 450 (InterChim). Содержание основных веществ после очистки составляло не менее 95%.
Условия ВЭЖХ: картридж InterChim PF-C18 (20g), 15 мкм. Могут использоваться другие обращенные картриджи С18 или С8.
a. Детекторная ячейка: препаративная
b. Скорость потока - 20.0 мл/мин
c. Длина волны: диапазон 200-400 нм
d. Диапазон детектирования: 2 AUFS
e. Величина петли: 2 мл (объем инжекции 1.5-1.8 мл образца)
f. Элюент А: 5.0% ацетонитрила, 0.1% трифторуксусной кислоты в воде
g. Элюент В: 0.1% трифторуксусной кислоты в ацетонитриле
h. Градиент: 10-90% В в течение 12 мин.
Строение синтезированных соединений подтверждено методом хромато-масс-спектроскопии.
Хромато-масс-спектрометрический анализ проводили на приборе Waters MSD SQD - ESI с УФ- и масс-спектрометрическими детекторами: длина волны 220 нм, температура пробоотборника 15°C, температура термостата колонок 40°C. MSD - параметры: температура источника 130°C, температура газа 400°C, напряжение на капилляре 3kV; колонка Waters Acquity 1.7 µm 2.1·50 mm. Градиент от 5 до 100% В за 4 мин (А: 0.1% муравьиной кислоты в воде; В: 0.1% муравьиной кислоты в ацетонитриле).
Исходные производные аминокислот, содержащие защитные группы, полимерная подложка и растворители для пептидного синтеза произведены фирмой «Applied Biosystems», США, N-карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксан получен по методике [В.В. Топоров, В.Л. Королев, В.П. Ившин, В.М. Даниленко. Исследование поведения имидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксанов в реакциях нитрования, алкилирования и кислотного гидролиза. // Тез. докл. XVIII Менделеевского съезда по общей и прикладной химии, Москва, 23-28 сентября, 2007, 462].
Пример 1. К 423.73 мг полимерной подложки Wang Resin (количество активных центров 0.59 ммоль/г, масштаб синтеза 0.25 моль) добавляли 10 мл раствора 1 моль Fmoc-Thr(tBu)-OH в диметилформамиде, 10 мл раствора дициклогексилкарбодиимида (1 моль) / 4-диметиламинопиридина (0.1 моль) в диметилформамиде, выдерживали 1 час, промывали 3×5 мл диметилформамида. Добавляли 10 мл 20%-ного раствора пиперидина в диметилформамиде, выдерживали 20 минут, промывали 3×5 мл диметилформамида. Добавляли 10 мл раствора 1 моль Fmoc-Asp(otBu)-OH в диметилфорамиде, 10 мл раствора 1-гидроксибензотриазола (0.1 моль) / дициклогексилкарбодиимида (1 моль) в диметилфорамиде, выдерживали 30 мин, промывали 3×5 мл диметилформамида. Добавляли 10 мл 20%-ного раствора пиперидина в диметилформамиде, выдерживали 20 минут, промывали 3×5 мл диметилформамида. Аналогично Fmoc-Asp(otBu)-OH последовательно пришивали Fmoc-Ala-OH, Fmoc-Ile-OH, Fmoc-Phe-OH с последующей депротекцией 10 мл 20%-ного раствора пиперидина в диметилформамиде после каждого цикла присоединения аминокислоты. Добавляли 10 мл раствора 0,1 ммоль N-карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана в диметилфорамиде, 10 мл раствора 1-гидроксибензотриазола (0.1 моль) / дициклогексилкарбодиимида (1 моль) в диметилфорамиде, выдерживали 30 мин, промывали 3×5 мл диметилформамида, 3×5 мл дихлорметана. Все вышеперечисленные операции проходили в пептидном синтезаторе. К полимерной подложке с присоединенным гетеромерным пептидом добавляли 10 мл охлажденного раствора, содержащего: 250 мкл TAN, 250 мкл TIPS, 500 мкл EDT, 9 мл TFA, перемешивали 4 часа, отфильтровали на фильтре Шотта (поры 40) при вакууме. К маточному раствору кислоты, содержащей гетеромерный пептид, добавляли 50 мл холодного метилтретбутилового эфира (МТВЕ), перемешивали, охлаждали при -20°C на 1 час, осадок отфильтровывали на фильтре Шотта (поры 14). Получали 151,3 мг (выход 72%) продукта. Масс-спектр [MS (ES)] m/z 840.6 [М+Н]+, время удерживания 2.78 мин.
Пример 2. В условиях, описанных в примере 1, из 2 х 10 мл раствора 1 моль Fmoc-Arg(Pbf)-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Asp(otBu)-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Gly-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Tyr-OH в диметилфорамиде, 10 мл раствора 1 моль №карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана в диметилфорамиде получали 152.9 мг (выход 65%) продукта. Масс-спектр [MS (ES)] m/z 940.7 [М+Н]+, время удерживания 1.81 мин.
Пример 3. В условиях, описанных в примере 1, из 2×10 мл раствора 1 моль Fmoc-Asp(otBu)-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Gly-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Ile-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-His(trt)-OH в диметилфорамиде, 10 мл раствора 1 моль N-карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана в диметилфорамиде получали 141.2 мг (выход 68%) продукта. Масс-спектр [MS (ES)] m/z 830.6 [М+Н]+, время удерживания 2.16 мин.
Пример 4. В условиях, описанных в примере 1, из 2×10 мл раствора 1 моль Fmoc-Asp(otBu)-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Ala-ОН в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Ile-OH в диметилфорамиде, 10 мл раствора 1 моль Fmoc-Lys(Boc)-OH в диметилфорамиде, 10 мл раствора 1 моль N-карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана в диметилфорамиде получали 154.5 мг (выход 74%) продукта. Масс-спектр [MS (ES)] m/z 835.6 [М+Н]+, время удерживания 2.11 мин.
Фармакологическое действие.
Оценку специфической активности антиагрегационного действия гетеромерных пептидов проводили in vitro с использованием крови здоровых доноров. Взятие крови проводили непосредственно перед исследованием, используя в качестве антикоагулянта цитрат натрия (3.8%). Соотношение антикоагулянт: кровь соответствовало 1:9.
Антиагрегационная активность полученных соединений изучалась на богатой тромбоцитами плазме с использованием аденозиндифосфата (АДФ) в качестве индуктора агрегации тромбоцитов.
Для приготовления богатой тромбоцитами плазмы кровь сразу после получения центрифугировали в течение 10 минут при 1000 об/мин, после чего верхний слой плазмы переносили в другую пробирку, а остаток центрифугировали в течение 20 мин при 3000 об/мин для получения бестромбоцитарной плазмы. Все процедуры проводили в полистирольной посуде, обладающей тромборезистентными свойствами. В течение всего периода исследования богатая и бестромбоцитарная плазма находились при комнатной температуре, а запись агрегации тромбоцитов осуществляли при 37°C.
Для исследования специфической антиагрегационной активности руководствовались требованиями к доклиническим исследованиям фармакологических веществ данного класса, утвержденными Фармакологической службой по надзору в сфере здравоохранения и социального развития.
Агрегацию тромбоцитов изучали с использованием турбидиметрического метода Борна (Born, 1962), основанного на изменении пропускания света (540 нм) через исследуемую плазму при ее постоянном перемешивании (1000 об/мин). В качестве образца сравнения использовали бестромбоцитарную плазму. Светопропускание через бестромбоцитарную плазму принимали за 100%, а светопропускание через богатую тромбоцитами плазму принимали за 0%. Концентрацию тромбоцитов доводили в богатой тромбоцитами плазме до 2.5·10-8 клеток/мл с помощью разведения бедной тромбоцитами плазмой.
Для проведения исследования применяли двухканальный лазерный анализатор агрегации тромбоцитов/счетчик 230LA-2 (НПФ «Биола»). Объем пробы составлял 300 мкл. Время проведения измерения - 8 мин. В качестве индуктора использовали АДФ в концентрации 50 мкМ. Получаемые агрегограммы представляют собой зависимость степени агрегации от времени, прошедшего после добавления индуктора агрегации. Изучаемые соединения (в виде водного раствора, при необходимости, содержащего ДМСО до 0.2%) в разных концентрациях добавляли в пробу до внесения индуктора агрегации (АДФ). Полумаксимальное ингибирование (IC50) гетеромерных пептидов представлено в таблице 2.


| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2709017C1 |
| N-КАРБ(АРГИНИЛ)ОКСИМЕТИЛИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАН, ИНГИБИРУЮЩИЙ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2014 |
|
RU2549355C1 |
| N-КАРБ(ГЛУТАМИНИЛ)ОКСИМЕТИЛИМИДАЗО[4,5-Е]БЕНЗО[1,2-С;3,4-С']ДИФУРОКСАН, ИНГИБИРУЮЩИЙ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2012 |
|
RU2502739C9 |
| RGD-ПОДОБНЫЕ ПЕПТИДЫ | 2009 |
|
RU2396271C1 |
| N-КАРБОКСИМЕТИЛИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАН | 2014 |
|
RU2544547C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА ЭКСЕНАТИДА | 2011 |
|
RU2458066C1 |
| RGD-СОДЕРЖАЩИЕ ПЕПТИДЫ | 2001 |
|
RU2214416C2 |
| АНАЛОГ ЭКСЕНАТИДА | 2020 |
|
RU2823623C1 |
| Способ получения N-карбэтоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с']дифуроксана | 2016 |
|
RU2618230C1 |
| Способ получения N-карбэтоксиметилимидазо[4,5-e]бензо[1,2-c;3,4-c′]дифуроксана | 2017 |
|
RU2663846C1 |
Предложены гетеромерные пептиды на основе имидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана, ингибирующие агрегацию тромбоцитов:
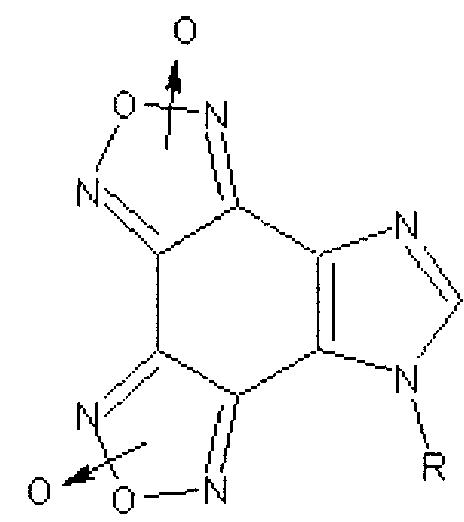 ,
,
где R=Phe-Ile-Ala-Asp-Thr; Arg-Tyr-Gly-Asp-Arg; Lys-Ile-Ala-Asp-Asp; His-Ile-Gly-Asp-Asp. 1 ил., 2 табл., 4 пр.
Гетеромерные пептиды на основе имидазо[4,5-е]бензо[1,2-с;3,4-с′]дифуроксана, ингибирующие агрегацию тромбоцитов:
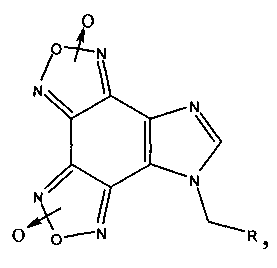
где R=Phe-Ile-Ala-Asp-Thr; Arg-Tyr-Gly-Asp-Arg; Lys-Ile-Ala-Asp-Asp; His-Ile-Gly-Asp-Asp.
| N-КАРБ(ГЛУТАМИНИЛ)ОКСИМЕТИЛИМИДАЗО[4,5-Е]БЕНЗО[1,2-С;3,4-С']ДИФУРОКСАН, ИНГИБИРУЮЩИЙ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2012 |
|
RU2502739C9 |
| RU 2002134671 A, 27.06.2004 | |||
| ДОНОР ОКСИДА АЗОТА И АКТИВАТОР РАСТВОРИМОЙ ФОРМЫ ГУАНИЛАТЦИКЛАЗЫ | 1998 |
|
RU2139932C1 |
| US 7145016 B1, 05.12.2006 | |||
Авторы
Даты
2015-05-10—Публикация
2014-04-28—Подача