Изобретение относится к химической технологии, преимущественно получений кислородных соединений азота, и может быть использовано в химический промышленности, например в производстве азотной кислоты, минеральных удобрений, капролактама, нитрит-нитратных солей и других азотосодержащих соединений.
Из известных способов получения оксидов азота, единственным получившим признание и широкое промышленное применение, является способ каталитического окисления аммиака кислородом воздуха до оксида азота II (Караваев М.М., Засорин А. П., Клещев Н.Ф. "Каталитическое окисление аммиака". М., Химия, 1983 г.).
Окисление производится на платиноидных или комбинированных катализаторах, при температуре 780-950oC, при атмосферных или повышенных давлениях; теплота реакции окисления аммиака обычно используется для производства пара, а оксид азота II перерабатывается в азотную кислоту (Атрашенко В.И., Каргин С.И. "Технология азотной кислоты". М., Химия, 1970 г.).
Недостатком этого способа получения оксидов азота является использование в процессе в качестве сырья аммиака - синтетического продукта многоступенчатого производства с использованием в начальной стадии природного газа. Другим недостатком является использование для окисления аммиака дорогостоящих и дефицитных платинородиевых катализаторов.
Наиболее близким по технологической сущности и достигаемому эффекту является стадия каталитического окисления молекулярного азота парами азотной кислоты, описанная в патенте РФ N2070865 от 27.12.1996 г.
В вышеуказанном патенте предусматривается, что в полученные при окислении аммиака на первой ступени катализатора нитрозные газы вводят поток газа, содержащий кислородные соединения азота и осуществляют окисление ими молекулярного азота нитрозных газов на второй ступени катализатора.
В качестве соединений азота используют пары азотной кислоты или их смесь с оксидами азота, а процесс ведут при температурах 900-450oC.
Недостатком способа получения оксидов азота, описанного в патенте РФ N2070865 является то, что в качестве сырья для получения нитрозных газов, на 1-ой ступени используется дорогостоящий аммиак, в то время как за счет окисления молекулярного азота получают только 65-85% продукционной кислоты.
Целью изобретения является повышение эффективности процесса окисления молекулярного азота за счет полного или частичного исключения из него аммиака, как исходного сырья для получения оксидов азота на 1-ой ступени катализатора.
Поставленная цель достигается тем, что в качестве энергетического источника, необходимого для осуществления температурного режима реакции окисления N2, используют продукты горения водородсодержащего газа, полученные сжиганием или каталитическим окислением водорода в потоке воздуха или другого кислородсодержащего газа.
Катализатор окисления азота в реакторе располагается в несколько слоев, перед каждым из которых вводится поток газа с окислителем и может вводиться поток газа, несущего энергию.
Новизна способа заключается в следующем. Отличительной способностью процессов окисления азота его кислородными соединениями является эндотермичность протекающих при этом химических реакций (Караваев М.М. и др., Москва, "Химическая промышленность", N11, с.720, 1996 г.). В прототипе необходимая для процесса энергия получается за счет окисления аммиака кислородом воздуха и подводится с потоком нитрозных газов. Это ограничивает степень получения HNO3 из молекулярного азота в общем процессе; с другой стороны - увеличивает вероятность побочных процессов за счет компонентов нитрозных газов.
В предлагаемом способе поток несущей энергии и азот получают за счет горения водорода в воздушной среде.
2H2+O2 = 2H2O + 483,2 кДж
При сгорании выделяется энергия 10,786 кДж/л или 10786 кДж/м3 H2 и образуются только пары воды, то есть не вводится каких-либо компонентов, которые могли бы привести к параллельным или последовательным реакциям в процессе окисления молекулярного азота.
В то же время при исследованиях влияния паров воды на каталитическую реакцию окисления азота не обнаружено.
Таким образом, получаемая при горении газовая смесь может быть использована для непосредственного введения ее в требующую подвода энергии реагирующую среду. При этом устраняется необходимость внешнего обогрева и ограничения по режимам, связанные с протеканием побочных реакций.
Водород может быть использован как в чистом виде (H2), так и в виде азотоводородной смеси. Возможны другие варианты смеси газов, однако продукты горения их не должны являться ядами для катализатора окисления азота. Водород может быть сожжен непосредственно в воздухе или другом кислородсодержащем газе. При технологической или технической необходимости водород также может быть окислен на катализаторах, например платиновой группы, имеющих низкую температуру зажигания. При таком варианте обеспечивается равномерное распределение температуры газа по периметру и объему реактора, что важно для второй стадии процесса окисления азота и смешения с потоком, содержащим окислитель.
Химически и технологически возможно предлагаемым способом получать на выходе высокие концентрации оксидов азота, для чего, естественно, необходимо подавать большее количество паров окислителя. Это технологически возможно, но в свою очередь требует подвода большего количества энергии. Однако поднимать очень высоко температуру горения водорода (например, до 2000oC), ввиду возможных химических преобразований окислителя нецелесообразно. Поэтому энергетический поток с температурой ниже 1000oC может подаваться в реактор, в зону окисления азота несколькими потоками, например перед каждым слоем.
Поток газа с окислителем получается в отдельном аппарате, путем пропускания газового потока через несколько ступеней горячего раствора азотной кислоты. Количество и концентрация паров кислоты в газовом потоке определяется заданными технологическими условиями, в том числе количеством подводимой энергии и могут изменяться в широких пределах.
Проведены опытные, лабораторные исследования и инженерные проработки способа.
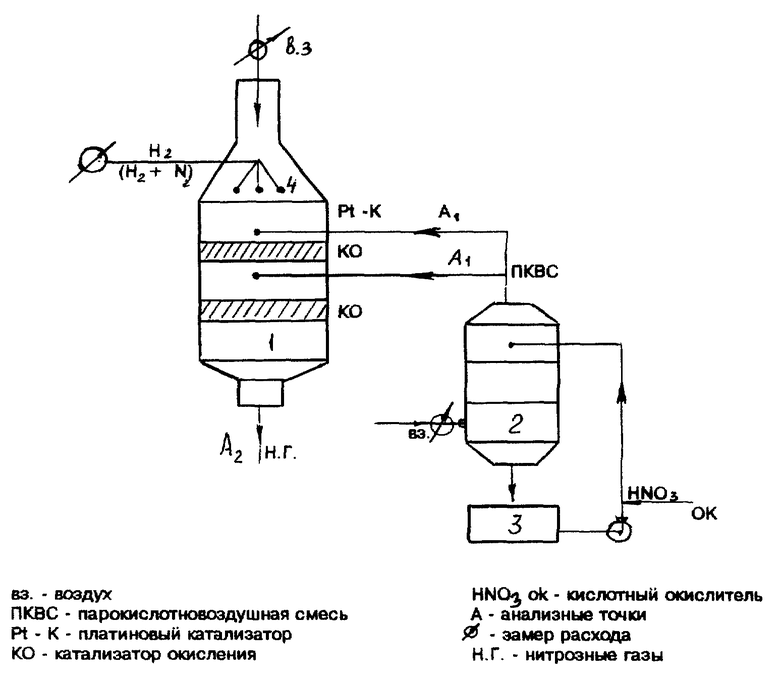
Основным аппаратом лабораторной установки (см. чертеж) из кварцевого стекла являлся реактор (1). В верхнюю часть последнего подавался воздух. В головке реактора по окружности располагались приспособления (4) для подачи водорода, которые могли быть одновременно горелками. В нижней части горелки устанавливались платиновые сетки, а в средней части реактора располагался слой катализатора окисления азота. Перед слоем через распределительное устройство, в газовую смесь, полученную при горении H2, подавался поток ПКВС (паро-кислото-воздушной смеси). Пройдя слой катализатора, нитрозные газы выводились из реактора, охлаждались, освобождались от оксидов азота и выбрасывались под тягу.
Газовая смесь с окислителем (ПКВС) приготовлялась пропусканием воздуха через слой разогретой азотной кислоты, залитой в сосуд насытителя (3).
Реактор (1) и насытитель (2) оборудованы электрообогревом, который позволял устанавливать заданные температуры газовой смеси и жидкости.
На основании замера реометрами потоков воздуха и водорода (N2 - H2) и результатов химического анализов ПКВС и нитрозных газов рассчитывался материальный баланс процесса и его показатели.
Пример 1. Включается обогрев реактора и насытителя. При достижении температуры в реакторе 300oC включалась подача воздуха D количестве 1940 л/час. После прогрева Pt-сетки и слоя оксидного катализатора до указанной температуры газа, включалась подача водорода в начале небольшой порцией, затем, после загорания Pt-сетки, она доводилась до 60 л/час. В результате взаимодействия водорода с кислородом по реакции
2H2+O2 = 2H2O + 483,2 кДж (1)
температуру газов после катализатора доводили до 850oC.
В насытитель подавался воздух в количестве 400 л/час, где он проходил через раствор 60% HNO3 при температуре около 95oC и насыщался парами кислоты и воды. Полученная ПКВС анализировалась на содержание паров HNO3. В ней содержалось 20% HNO3 и 25,3% паров воды (по расчету на основании давления насыщения паров воды). Исходя из замерного расхода воздуха это составляло 100 л/час паров HNO3.
Боковой поток вводится в реактор после сетки в горячие газы, образовавшиеся при горении водорода. Здесь он смешивался и при температуре смеси до 750oC поступал на катализатор, где протекали реакции окисления азота
2HNO3 + N2 = 3NO + NO2 +H2O - 355,0 кДж (2)
и разложения непрореагировавших по реакции 2 паров кислоты:
4HNO3 = 4NO2 + 2H2O - O2 -191,0 кДж (3)
Поскольку эти реакции являются эндотермическими, температура газа в слое снижалась до 485oC.
После стабилизации режима отбирались анализы на содержание паров HNO3 в ПКВС и оксидов азота (NO2) в выходящих нитрозных газах.
По результатам анализов рассчитывался материальный баланс опыта и его показатели (на компьютере по спецпрограмме).
Газы до и после катализатора имели состав:
Перед катализатором
HNO3 - 100 л/час 4,05%
H2O - 206,3 л/час 8,35%
N2 - 1736,6 л/час 70,31%
O2 - 427,1 л/час 17,29%
Всего: 2470,0 л/час 100%
После катализатора
H2O - 256,3 л/час 10,0%
N2 - 1699,1 л/час 66,26%
O2 - 433,7 л/час 16,91%
NO - 112,5 л/час 4,39%
NO2 - 62,5 л/час 2,44%
Всего: 2564,1 л/час 100%
Показатели процесса устанавливались по изменению объемов (V) реагирующих компонентов.
Степень прироста соединений азота (степень полезного использования паров HNO3)
Степень разложения паров HNO3 по реакции 3 находится по разности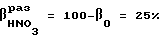
Пример 2. Разогревали за счет электрообогрева, примерно до 300oC реактор и до 90oC насытитель с 60% HNO3. В реактор подавался поток воздуха в количестве 560 л/час. Включалась подача водорода, он поджигался при выходе из горелок прямым пламенем. Расход водорода доводился до 140 л/час. Температура газа поднималась до 900oC (регулировалась расходами компонентов и электрообогревом). В насытитель подавался воздух в количестве до 490 л/час, который при температуре 93oC насыщался парами кислоты и воды (см. пример 1). Потоки смешивались и при температуре 760oC поступали на катализатор, где протекали реакции окисления азота, разложение HNO3 и окисление, в незначительной степени, NO кислородом.
Газы имели состав:
До катализатора
HNO3 - 180,0 л/час 11,76%
N2 - 826,1 л/час 54,00%
O2 - 149,6 л/час 9,78%
H2O - 374,3 л/час 24,48%
Всего: 1532,0 л/час 100,00%
После катализатора
N2 - 754,1 л/час 44,33%
O2 - 158,6 л/час 9,32%
H2O - 464,3 л/час 27,40%
NO2 - 108,0 л/час 6,35%
NO - 218,0 л/час 12,70%
Всего: 1701,0 л/час 100%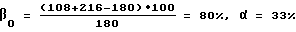
На реакционной воде может быть выпущено 71% HNO3. При выпуске 60% HNO3 в абсорбционную колонну необходимо добавлять 235 кг H2O/т HNO3, то есть, трудностей с абсорбцией не должно быть. Концентрация оксидов азота составила 19,02 об.
Пример 3. Опыт проведен на описанной в примерах 1 и 2 установке, однако вместо водорода использовалась азото-водородная смесь. Использовалась методика опыта 2.
На горелки подавалось 173 л азото-водородной смеси (130 л водорода) и 620 л воздуха. На насытитель подавалось 400 л воздуха при температуре азотной кислоты 95oC.
Состав газов определяем на основании результатов анализов, показаний реометров и материального баланса
До горелки (рассчитан по замерам 2-х потоков)
H2 - 130,0 л/час 16,25% об.
N2 - 533,4 л/час 66,67% об.
O2 - 130,3 л/час 16,24% об.
H2O - 6,3 л/час 0,79% об.
Всего: 800 л/час 100%
После горелки
N2 - 533,4л/час 72,6%
O2 - 65,3 л/час 8,9%
H2O - 136,3 л/час 18,5%
Всего: 735,0 л/час 100%
Боковой поток
HNO3 -175,0 л/час 22,0%
H2O -220,0 л/час 27,6%
O2 - 84,0 л/час 10,6%
N2 - 316,6 л/час 39,8%
Всего: 795,0 л/час 100%
До катализатора
HNO3 - 175,0 л/час 11,4%
N - 849,4 л/час 55,5%
O2 - 149,3 л/час 9,8%
H2O - 356,3 л/час 23,3%
Всего: 1530 л/час 100%
После катализатора
N2 - 775,9 л/час 45,7%
O2 - 156,3 л/час 9,2%
H2O - 443,8 л/час 26,1%
NO - 220,5 л/час 13,0%
NO2 - 101,5 л/час 6,0%
Всего: 1698,0 л/час 100%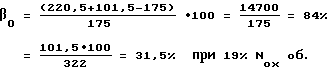
Газ может быть переработан в HNO3, так как при концентрации прод. кислоты 60% HNO3 орошение составляет ~ 250 кг H2O/т HNO3.
Предложенный способ ведения процесса получения оксидов азота может быть принят как под атмосферным, так и при повышенном давлении. Он позволяет в широких пределах изменить температуру, составы и количество головного потока, а изменением температуры, концентрации кислоты и количества воздуха - объемы подаваемого окислителя.
В свою очередь, указанные возможности обеспечивают использование нового способа для получения различных продуктов связанного азота.
Эффективность способа относительно прототипа очевидна - получение водорода является только одной из стадий получения аммиака (сырье в прототипе), причем наименее сложной.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОИЗВОДСТВА АЗОТНОЙ КИСЛОТЫ | 2000 |
|
RU2174946C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 1998 |
|
RU2151736C1 |
| СПОСОБ ПРОИЗВОДСТВА АЗОТНОЙ КИСЛОТЫ | 1997 |
|
RU2127224C1 |
| КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ МОЛЕКУЛЯРНОГО АЗОТА | 1997 |
|
RU2131398C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 1991 |
|
RU2009996C1 |
| СПОСОБ ПРОИЗВОДСТВА ДИНИТРОГЕНА ТЕТРАОКСИДА | 2012 |
|
RU2547752C2 |
| СПОСОБ ПРОИЗВОДСТВА ГИДРОКСИЛАМИНСУЛЬФАТА | 2008 |
|
RU2364570C1 |
| Получение красного железоокисного пигмента | 2013 |
|
RU2649430C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 2021 |
|
RU2825631C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА ВОДОРОДА | 2012 |
|
RU2537172C1 |
Изобретение относится к получению кислородных соединений азота, в частности оксидов азота каталитическим окислением молекулярного азота его кислородными соединениями. Сущность способа включает получение и смешение потока азотосодержащего газа с потоком газа, содержащего окислитель в виде кислородных соединений азота, энергетический поток с использованием продуктов его горения для проведения реакции окисления азота, в качестве которого используют продукты горения водородсодержащего газа, полученного сжиганием или каталитическим окислением водорода в потоке воздуха или другого кислородсодержащего газа, при этом катализатор расположен в несколько слоев, перед каждым из которых вводится поток газа с окислителем и поток газа, несущего тепловую энергию. Технический результат состоит в повышении эффективности процесса окисления молекулярного азота за счет полного или частичного исключения из него аммиака, как исходного сырья для получения оксидов азота на 1-ой ступени катализатора. 1 з.п.ф-лы, 1 ил.
| RU 2070865 C1, 27.12.1996 | |||
| СПОСОБ ПРОИЗВОДСТВА АЗОТНОЙ КИСЛОТЫ | 1997 |
|
RU2127224C1 |
| СПОСОБ ОКИСЛЕНИЯ АММИАКА | 1986 |
|
SU1635448A1 |
| US 4287040 A, 01.09.1981. | |||
Авторы
Даты
2000-09-27—Публикация
2000-01-27—Подача