Изобретение относится к медицине, а именно к фармакологии, и может быть использовано для профилактики и лечения иммунодефицитных состояний различной этиологии.
В современной иммунофармакологии имеется определенный арсенал лекарственных средств, содержащих пептиды и используемых при лечении иммунодефицитных состояний у больных с врожденной (синдром Луи- Барр) и приобретенной иммунной патологией, вызванной инфекцией и злокачественными новообразованиями.
Известно применение комплекса пептидов тимуса - Тактивина при врожденных нарушениях иммунитета (синдром Louis-Bar) и у больных лимфогранулематозом [(Lopukhin J.M., Petrov R.V. et al., Pat. 4377511 (USA) // C.A. - 1983]. Тактивин вызывает значительное улучшение состояние Т-клеточного иммунитета, улучшение нервно-мышечной проводимости у лиц с синдромом Louis-Bar, сокращение явлений интоксикации у больных лимфогранулематозом. Однако известный препарат не оказывает выраженного действия на показатели силы иммунного ответа и продукцию антител, что ограничивает область его применения. Кроме того, Тактивин представляет собой неразделенную смесь пептидов и не подлежит надежной стандартизации.
Наиболее близким аналогом предложенного средства является препарат бурсопоэтин, полученный на основе синтетического трипептида Lys-His-Gly-NH2 (лизил-гистидил-глицил-амид) [Audhya Т., Kroon D.J., Heavner G., Goldstein G. Bursopoietin. Pat. 4584284 (USA) //C.A. - 1986. - Vol. 105. - 173063n.]. Препарат стимулирует дифференцировку В-лимфоцитов и может быть использован для лечения больных с нарушениями гуморального звена иммунитета.
Предложенное изобретение направлено на создание лекарственного средства с более высокой эффективностью действия в отношении стимуляции гуморального иммунитета (антителогенеза), силы иммунного ответа и молекул межклеточного взаимодействия для терапии врожденных и приобретенных иммунодефицитных состояний.
Решение поставленной задачи обеспечивается тем, что в качестве средства для лечения иммунодефицитных состояний различной этиологии используется циклогексапептид структурной формулы: цикло-лизил-гистидил-глицил-лизил-гистидил-глицин. Брутто-формула: C28H44O6N12.
Предложенное средство содержит в качестве действующего вещества синтетический гексапептид, молекулярная масса 644,7 Д.
Действующее вещество представляет собой белый порошок без запаха, легко растворимый в воде и изотоническом растворе хлорида натрия. Вещество не растворимо в спирте и хлороформе.
Предложенное средство для лечения иммунодефицитных состояний содержит 0,001-1% (0,00001-0,01 г) циклогексапептида. В качестве стабилизатора (наполнителя) средство содержит 0,05-5% (0,0005-0,05 г) глицина. Лекарственное средство выпускают в виде 0,005% раствора циклогексапептида для подкожных или внутримышечных инъекций в ампулах по 1,0 мл. В качестве стабилизатора предложенное средство содержит 0,5%-ный раствор глицина. Срок хранения 2 года при 4-8oC.
Лекарственное средство разработано в научно-производственном предприятии "Бионокс" и из его структурной формулы с очевидностью не следуют свойства стимулировать гуморальный иммунитет, усиливать силу иммунного ответа (экспрессия HLA-DR на поверхности гемопоэтических клеток), а также активировать Т-звено иммунитета с достижением лечебного эффекта.
Результаты доклинического и клинического изучения предложенного средства показывают, что оно не вызывает побочных действий.
Экспериментальные и клинические данные показывают, что:
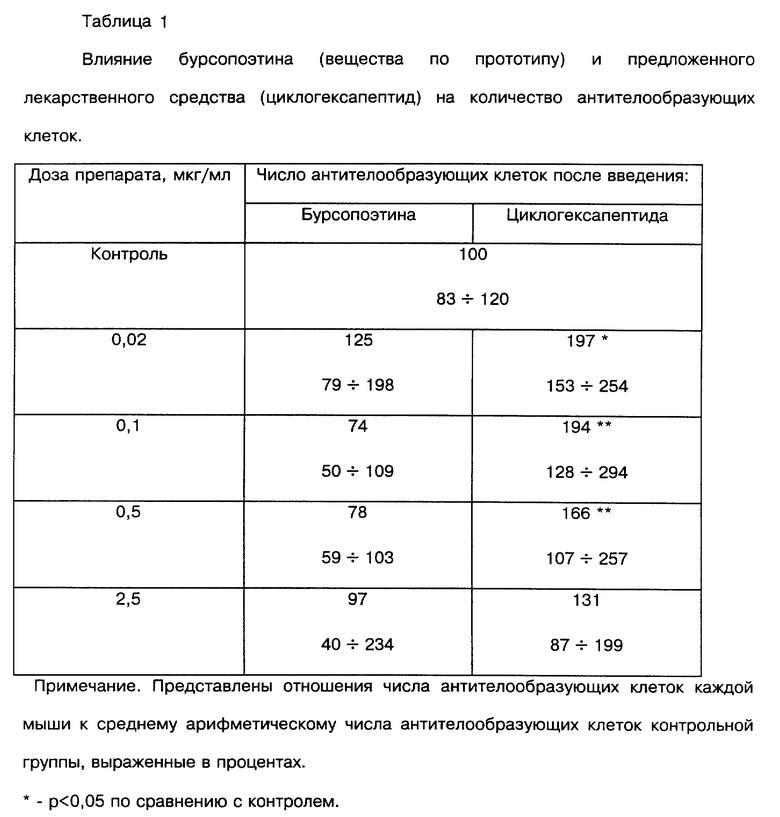
1. Циклогексапептид стимулирует образование антителообразующих клеток в 2 раза эффективнее по сравнению с веществом по прототипу (см. табл. 1), предупреждает возникновение бактерионосительства и активирует продукцию секреторного lgA (Sig A).
2. Заявленное средство стимулирует силу иммунного ответа по критерию экспрессии антигенов HLA DR лимфоцитов человека; активирует межклеточные взаимодействия по показателю экспрессии антигена CD2. Напротив, вещество по прототипу подавляет экспрессию антигенов силы иммунного ответа (HLA DR) и межклеточного взаимодействия (CD2) (см. табл. 2).
3. Циклогексапептид обладает исключительно низкой токсичностью и обеспечивает широкий резерв безопасности. Разовая доза, в тысячу раз превышающая среднюю терапевтическую, не вызывает гибели экспериментальных животных.
4. Определение хронической токсичности лекарственного средства демонстрирует его безвредность. Выявленные колебания гематологических и биохимических показателей при назначении животным лекарственного средства ежедневно, в течение одного месяца, в терапевтической или 10-ти кратно превышающей терапевтическую дозе, после отмены лекарственного средства возвращается к исходному уровню.
5. Введение лекарственного средства больным не вызывает местно раздражающего действия, лекарственное средство не обладает аллергенностью и мутагенной активностью.
Лекарственное средство показало хорошие клинические результаты при лечении инфекционных больных со сниженной функцией гуморального звена иммунитета.
Клиническое применение лекарственного средства у больных с гипопродукцией секреторного иммуноглобулина А проводят с учетом клинико-иммунологического состояния пациентов. Так, в популяции населения наличие секреторного иммуноглобулина А (Sig А) отмечается в 60,9±10,4% случаев. У инфекционных больных после традиционного лечения соответственно в 69,0±7,1% случаев. Нарушение продукции Sig А является причиной бактерионосительства и низкой эффективности терапии бактериальных инфекций. Применение лекарственного средства вызывает активацию местного иммунитета и появление Sig А в 100,0% случаев.
В связи с этим перед назначением лекарственного средства определяют состояние гуморального иммунитета и количество Sig А в слюне больных.
Эффективность терапии оценивают по положительной динамике количества секреторного иммуноглобулина А, устранению бактерионосительства и снижению явлений интоксикации. Назначение лекарственного средства больным проводят в комплексной терапии с антибиотиками и средствами патогенетической терапии. Лекарственное средство назначают курсами для подкожного или внутримышечного введения в дозе 0,5 - 5 мкг/кг массы тела однократно, ежедневно или с интервалом 1-3 дня в течение 7-15 дней. При необходимости по клинико-иммунологическим показателям проводят повторные курсы в течение 1-3 недель.
Конкретные примеры получения предложенного средства, описания биологических и лечебных свойств лекарственного средства.
Пример 1. Циклогексапептид синтезируют по методу твердофазного синтеза на автоматизированном синтезаторе "Beckman-990".
Аминометилполимеразе (1.8 г, 1 ммоль) дают набухнуть в хлороформе в течение 30 минут, затем присоединяют Boc Gly-OCH2C6H4CH2COOH (0,65 г, 2 ммоль) с помощью N,N-дициклогексилкарбодиимид (ДЦГК) (0,4 г, 2 ммоль в 15 мл хлороформа в течение 2 часов). После промывки диметилформамидом полимер обрабатывают 20 мл смеси диизопропилэтиламин-уксусный ангидрид, 2:1 в течение 30 минут. После промывки диметилформамидом и хлороформом полимер обрабатывают 30 мл смеси трифторуксуная кислота - хлороформ 1:1 20 минут, промывают хлороформом и нейтрализуют 7% раствором диизопропилэтиламина в диметилформамиде в течение 10 минут, затем аминоацилполимер промывают диметилформамидом. Присоединения Boc-аминокислоты проводят с помощью симметричного ангидрида Boc-аминокислоты: 4 ммоль Boc-аминокислоты растворяют в 5 мл хлороформа, охлаждают до 0oC, добавляют раствор 2 ммоль ДЦГК в 5 мл хлороформа. После перемешивания в течение 10 минут при 0oС смесь добавляют к пептидилполимеру, приливают 10 мл диметилформамида и перемешивают с пептидилполимером 30 минут при 28oC.
После присоединения очередной аминокислоты пептидилполимер промывают диметилформамидом, хлороформом, затем удаляют защитную Boc-группу.
Удаление динитрофенильной группы: 2 г пептидилполимера перемешивают в течение 1,5 часов при комнатной температуре в 40 мл 20% раствора тиофенола в диметилформамиде. Затем пептидилполимер промывают диметилфорамидом, хлороформом и сушат в вакууме.
Снятие пептида со смолы: 2 г пептидилполимера помещают в реакционный сосуд прибора для работы с фтористым водородом, добавляют 1 г n-крезола, охлаждают жидким азотом и после вакуумирования сосуда перегоняют в него 10 мл жидкого безводного фтористого водорода. Доводят температуру реакционного сосуда до -20oC и перемешивают полимер в течении 30 минут поддерживая температуру смеси CCl4-твердый CO2, затем помещают реакционный сосуд в ледяную баню и выдерживают при перемешивании еще 30 минут. После этого фтористый водород упаривают на водоструйном насосе, полимер промывают на фильтре диэтиловым эфиром. Затем пептид экстрагируют 20% уксусной кислотой и лиофилизируют.
Циклизация пептида: снятый со смолы пептид очищают с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Затем пептид (50 мг) растворяют в 25 мл диметилформамида и добавляют по каплям при перемешивании и охлаждении до 0oC к раствору диметилфосфорилазида (10 экв) в 25 мл диметилформамида, в котором суспендирован кристаллический карбонат калия. Суспензию перемешивают в течение 2 суток, после чего отфильтровывают карбонат калия и упаривают диметилформамид.
Удаление трифторацетильной группы. Снятый со смолы пептид обрабатывают 60 мл одномолярного водного раствора пиперидина при 0oC в течение 2 часов. Затем реакционную смесь лиофилизируют и обессоливают гельфильтрацией на колонке Sephadex G-25 в 5% уксусной кислоте.
Пример 2. Исследование влияния предложенного лекарственного средства и бурсопоэтина (вещества по прототипу) на продукцию антителообразущих клеток в селезенке мышей.
Используют мышей-самцов линии CBA/CaLacSto, которых иммунизируют внутривенно эритроцитами барана в дозе 2•106. Через 10-15 минут после иммунизации мышам внутрибрюшинно вводят заявленное вещество и вещество по прототипу в объеме 0,5 мл в концентрациях 0,02; 0,1; 0,5 и 2,5 мкг/мл (7-8 животных в группе). Мышам контрольной группы (7-8 животных в группе) внутрибрюшинно вводят аналогичный объем физиологического раствора. На четвертые сутки после иммунизации определяют число антителообразующих клеток в селезенке мыши путем подсчета зон локального гемолиза эритроцитов барана в агарозном геле. Результаты исследования представлены в таблице 1.
Полученные данные демонстрируют, что циклогексапептид (заявленное средство) вызывает двукратное превышение образования антителообразующик клеток в селезенке мыши по сравнению с действием вещества по прототипу. Таким образом, заявленное средство обладает более высокой активностью по признаку стимуляции антителогенеза, чем вещество по прототипу.
Пример 3. Исследование влияния циклогексапептида и вещества по прототипу (бурсопоэтина) на экспрессию маркера силы иммунного ответа (HLA-DR), маркеров Т-лимфоцитов (CD2, CD4) и B-лимфоцитов (CD22) клетками практически здоровых доноров.
В работе используют клетки периферической крови человека. Для получения фракции мононуклеарных клеток из гепаринизированной (25 ЕД/мл) крови применяют одноступенчатый градиент фиколл-верографина с плотностью 1,077 г/см3.
Уровень экспрессии мембраноассоциированных структур CD2, CD4, CD22, HLA-DR на мононуклеарных клетках определяют клеточным твердофазным иммунопероксидазным методом, с использованием моноклональных антител к структурам CD2, CD4, CD22, HLA-DR ("Seromed, Великобритания) и антимышиных F(ab')-фрагментов иммуноглобулинов, конъюгированных с пероксидазой хрена ("Seromed, Великобритания). Анализ проводят после часовой инкубации клеток в присутствии 0,02: 0,1; 0,5; 2,5 мкг/мл изучаемого вещества и вещества по прототипу. В контрольных опытах мононуклеарные клетки инкубируют в аналогичных условиях в культуральной среде без добавления веществ. Культивирование клеток проводят в среде RPMI- 1640 с добавлением 5% эмбриональной телячьей сыворотки, в конечном объеме 3 мл и концентрацией 2•106/мл.
Иммуноферментный анализ проводят на плоскодонных планшетах ("Nunc", Дания), предварительно обработанных 0,001% раствором поли-L-лизина ("Sigma", США) на фосфатно-солевом буфере, рН 7,3. Изучаемые клетки вносят в концентрации 4•106/мл, по 50 мкл на лунку. После центрифугирования клетки фиксируют с помощью 50 мкл 0,5% раствора глутарового альдегида ("Sigma", США) на фосфатно-солевом буфере в течение 15 минут. Планшеты трижды промывают фосфатно-солевым буфером и затем обрабатываются М раствором глицина ("Sigma", США), после чего в лунки вносят 1% раствор бычьего сывороточного альбумина на фосфатно-солевом буфере и инкубируют в течение 12-14 часов при +4oC. При постановке реакции в лунки вносят по 100 мкл соответствующих моноклональных антител, разведенных на фосфатно-солевом буфере с 0,5% раствором бычьего сывороточного альбумина, инкубируют в течение 1 часа при +37oC. После отмывок 0,01% раствором Твина 20 ("Merck", Германия) на фосфатно-солевом буфере, наносят конъюгат ("Sigma", США) в объеме 100 мкл на лунку, инкубируют, отмывают и добавляют раствор субстрата - ортофенилендиамин ("Sigma", США) в 0,1 М цитрат-фосфатном буфере, pH 4,5 и 0,004% перекиси водорода. После инкубации в течение 30 минут реакцию останавливают IN серной кислотой и оценивают спектрофотометрически, определяя уровни поглощения при длине волны 492 нм. Результаты выражают в проценте изменения значений оптической плотности в опыте, по отношению к значению оптической плотности в контроле (клетки, не обработанные веществом), с учетом контроля реакции, в качестве которого используют систему без моноклональных антител, позволяющую выявить фон естественной пероксидазной активности и неспецифической сорбции конъюгата на клетках. Каждую опытную группу клеток исследуют в триплете.
Статистическую обработку экспериментальных данных проводят с определением достоверности разности по критерию Стьюдента-Фишера. Определяют достоверность различий выборочных средних опыта и контроля. По вычисленному значению t и количеству сравниваемых вариант определяют достоверность различий, используя таблицу Стьюдента-Фишера. Разницу считают достоверной при уровне значимости не более 5% (p<0,05).
Сравнительная оценка экспрессии поверхностных структур на клетках здоровых доноров под влиянием заявленного препарата (циклогексапептида) и вещества по прототипу (бурсопоэтина) см. таблицу 2.
Полученные данные демонстрируют, что циклогексапептид (заявленное вещество) вызывает достоверное превышение экспрессии HLA-DR и CD2 на поверхности гемопоэтических клеток человека. Напротив, вещество по прототипу вызывает снижение экспрессии указанных поверхностных структур. Таким образом, заявленное вещество в отличие от прототипа обладает свойством увеличивать экспрессию генов иммунного ответа (HLA-DR) и созревание Т-лимфоцитов (CD2).
Пример 4. Больной Г., 25 лет. Клинический диагноз: сальмонеллез, гастроинтестинальная форма, среднетяжелое течение.
Заболел остро: сильные боли в животе схваткообразного характера, жидкий стул со слизью, многократная рвота, температура тела повысилась до 39oC.
При лабораторном обследовании пациента отмечено: РПГА с сальмонеллезным антигеном: сыворотка крови 1:20; слюна 1:4. Иммуноглобулины сыворотки крови: lgA - 2,97 мг/мл, lgG - 12,45 мг/мл, lgM - 0,43 мг/мл; слюны lgA - 0,19 мг/мл, Sig А - отс. , lgG - 0,25 мг/мл, lgM - следы. Бактериологическое исследование испражнений: S. Typhimurium (гр. В).
Лечение. Трисоль, глюкоза 5% в/в кап., сульгин 1,0 х 4 раза в сутки. Циклогексапептид 1,0 мл. 0,005% раствора 1 раз в день в/м в течение 7 дней.
На десятый день болезни бактериологическое исследование испражнений на сальмонеллы отрицательно, РПГА с сальмонеллезным антигеном: сыворотка крови 1:1280, слюна 1:64. Иммуноглобулины сыворотки крови: lgA - 5,70 мг/мл, lgG - 13,40 мг/мл, lgM - 0,88 мг/мл; слюны: lgA - 0,16 мг/мл, Sig А - 0,42 мг/мл, lgG - 0,22 мг/мл, lgM - следы. На 12 день болезни с выздоровлением больной выписан из стационара. Побочных реакций на введение препарата не отмечено.
Таким образом, заявленное средство обладает выраженным терапевтическим действием, предупреждает появление бактерионосительства и стимулирует продукцию секреторного lgA.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ | 1999 |
|
RU2157234C1 |
| СРЕДСТВО ДЛЯ ПРЕОДОЛЕНИЯ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ | 2008 |
|
RU2434879C2 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ АНТИГЕННЕЗАВИСИМУЮ ДИФФЕРЕНЦИРОВКУ B-ЛИМФОЦИТОВ | 2000 |
|
RU2166956C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2170101C1 |
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ИММУННЫХ НАРУШЕНИЙ, ВЫЗЫВАЕМЫХ ТОКСИЧЕСКИМИ ВЕЩЕСТВАМИ | 2007 |
|
RU2364396C2 |
| СРЕДСТВО ДЛЯ ПРЕОДОЛЕНИЯ СТЕРОИДНОЙ РЕЗИСТЕНТНОСТИ | 2009 |
|
RU2404792C1 |
| СПОСОБ ПОЛУЧЕНИЯ АУТОЛОГИЧНОЙ ВАКЦИНЫ ДЛЯ ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2008 |
|
RU2372936C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2006 |
|
RU2323728C2 |
| СПОСОБ ОЦЕНКИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ИММУННОЙ СИСТЕМЫ У ПАЦИЕНТОВ С ПОВРЕЖДЕНИЕМ ГОЛОВНОГО МОЗГА | 2001 |
|
RU2184969C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ИНЪЕКЦИОННАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ТИЛОРОНА ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ДЕСТРУКТИВНЫХ ПРОЦЕССОВ С ПРИЗНАКАМИ ИММУННОЙ НЕДОСТАТОЧНОСТИ | 2007 |
|
RU2359664C1 |

Средство может быть использовано в медицине и фармакологии для лечения иммунодефицитных состояний. В качестве средства для лечения предложен циклогексапептид структурной формулы цикло-лизил-гистидил-глицил-лизил-гистидил-глицин. Дополнительно средство содержит стабилизатор (наполнитель) глицин. Средство обладает высокой эффективностью действия в отношении стимуляции гуморального иммунитета, силы иммунного ответа и молекул межклеточного взаимодействия для терапии иммунодефицитных состояний. 2 з.п.ф-лы, 2 табл.
| US 4584284, Apr.22.1986 | |||
| RU 2062096 C1, 20.06.1996 | |||
| ПЕПТИДЫ И КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБНАЯ РЕГУЛИРОВАТЬ ИММУННУЮ ФУНКЦИЮ МЛЕКОПИТАЮЩИХ | 1990 |
|
RU2036930C1 |
| Goldstein G et al | |||
| Thymopoetin to Thymopoetin: Experimental Studies - Sur V immunol | |||
| Res | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2000-10-10—Публикация
1999-10-08—Подача