Изобретение относится к области ветеринарной микробиологии, в частности к способам получения диагностических препаратов, используемых для массовой прижизненной диагностики сальмонеллеза птиц на птицефабриках и крупных птицеводческих комплексах в условиях промышленного птицеводства.
Известен цветной пуллорный антиген для диагностики пуллорозатифа птиц (см. Ветеринарные препараты. Справочник. Под ред. Д.Ф. Осидзе. - М.: Колос, 1981, с с. 231 - 232). Цветной поллуорный антиген представляет собой гомогенную взвесь микробных клеток сальмонелл, убитых формалином и окрашенных кристаллвиолетом.
В процессе получения антигена производственные штаммы выращивают в реакторе на бульоне Хоттингера в определенных условиях до максимального накопления бактериальной массы, затем осаждают центрифугированием, разводят физиологическим раствором в соотношении 1 : 4, шуттелируют до получения гомогенной взвеси, доводят до концентрации 100 млрд. микробных тел в мл и окрашивают. Окрашенную массу инактивируют в термостате в течение суток, проверяют на стерильность и расфасовывают во флаконы по 20 мл.
Недостатком такого способа получения антигена является длительный процесс производства и, кроме того, при исследованиях этим антигеном нередки случаи неспецифических реакций, так как бактериальные клетки, имеющие Н-антигены, после окраски в процессе хранения приобретают свойства к спонтанной агглютинации. В связи с этим и срок хранения цветного антигена крайне ограничен (до 3-х месяцев), что сдерживает его применение.
Известен также широкоприменяемый пуллорный эритроцитарный антиген, предназначенный для прижизненной диагностики пуллорозатифа птиц реакцией непрямой гемагглютинации (РНГА) на стекле с каплей крови (см. Ветеринарные препараты. Справочник. Под ред. Д.Ф. Осидзе. - М.: Колос, 1981, с. 230 - 231).
При использовании пуллорного эритроцитарного антигена берут кровь от птиц и ставят реакции так же, как при использовании цветного антигена.
Изготовление эритроцитарного антигена слагается в основном из последовательности процессов выращивания бактериальной массы, получения полисахаридно-полипептидного комплекса, получения и консервирования эритроцитов барана, сенсибилизации консервированных эритроцитов полисахаридно-полипептидной фракцией, разведения взвеси эритроцитов буфером, расфасовки препарата и его контроля (см. Описание изобретения к А. С. N 955573, A 61 K 39/02, опубл. Бюл. N 31 от 10.11.96 г.).
При высоком качестве получаемого антигена основным недостатком препарата является его чрезвычайно высокая стоимость, связанная, в частности, со сложной многоступенчатой и длительной технологией получения препарата и с использованием в технологии дорогостоящих компонентов (крови баранов) для получения эритроцитов.
Задачей изобретения является разработка способа получения антигена для прижизненной диагностики сальмонеллоносительства у птиц, по эффективности не уступающего эритроцитарному антигену, но имеющего более простую технологию изготовления - без использования крови животных и более низкую стоимость, что позволило бы сократить затраты на обследование птицы и снизить себестоимость получаемой продукции.
Задача решается тем, что выращенную на питательных средах бактериальную массу штаммов сальмонелл разводят физиологическим раствором до заданной концентрации, инактивируют микроволновым излучением с частотой СВЧ поля 2450 ± 50 МГц в течение 1 - 5 минут при нагреве не выше 80oC, центрифугируют, отделяя активную часть, окрашивают генцианвиолетов, определяют активность полученного препарата в сравнении с пуллорным эритроцитарным антигеном по общепринятым методикам, после чего расфасовывают полученный препарат.
Способ получения антигена для диагностики сальмонеллоносительства у птиц осуществляется следующим образом.
Для выращивания бактериальной массы в предложенном способе получения антигена суточную бульонную культуру сальмонеллы высевают в матрасы объемом 500 - 1000 мл, залитые слоем твердой питательной среды. В качестве питательной среды применяют 2,5% мясо-пептонный агар (МПА). Культуры выращивают в термостате при температуре порядка 37oC в течение 18 - 24 часов.
Для инактивации инфекционности выращенной бактериальной массы используют лабораторную СВЧ печь типа "Титан-С", работающую на частоте 2450 ± 50 МГц. Объем рабочей камеры СВЧ печи - 32 литра, причем камера оборудована усиленной вытяжной вентиляцией и имеет устройство плавной регулировки активной мощности.
Суспензию микробов, разведенную физиологическим раствором в процессе смыва, помещают в рабочую камеру микроволновой печи в закрытой посуде из термостойкого стекла. Режим СВЧ обработки принят импульсным и подобран таким образом, чтобы инактивируемая среда в процессе СВЧ обработки не нагревалась выше 80oC.
Центрифугирование инактивированной массы производят на центрифуге с подвесными стаканами марки МР - 340 польского производства с регулируемой частотой вращения до 4500 оборотов/мин.
Окрашивание осажденной при центрифугировании инактивированной бактериальной массы производят 2% водным раствором генцианвиолета.
Практически предложенный способ получения антигена для диагностики сальмонеллоносительства у кур осуществляется аналогично способу получения цветного пуллорного антигена, с той разницей, что процесс интактивации бактериальной массы производят не формалином, а микроволновым изучением с частотой 2450 ± 50 МГц в СВЧ-печи при нагреве среды не выше 80oC в течение 1 - 5 минут.
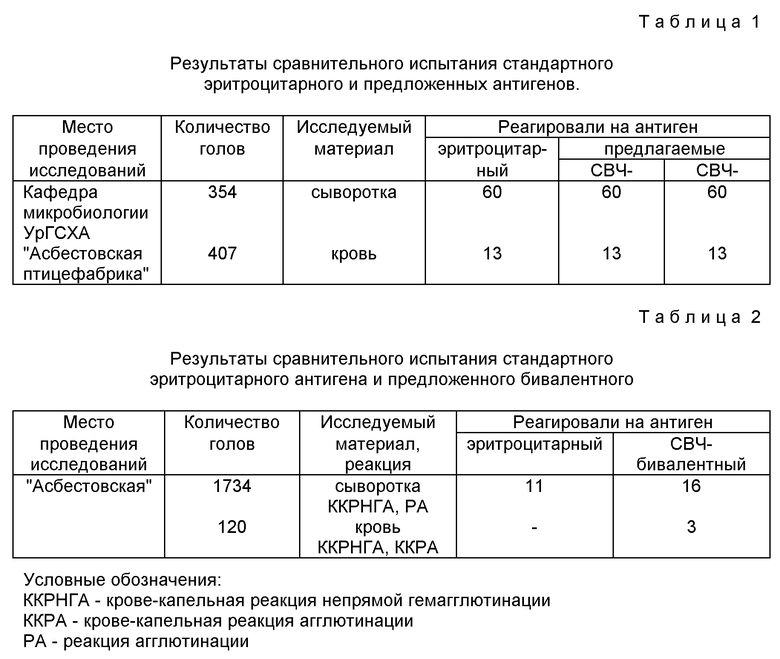
Экспериментальную проверку предложенного способа получения антигена для диагностики сальмонеллоносительства у кур проводили в лаборатории кафедры микробиологии Уральской государственной сельскохозяйственной академии, а производственную проверку - на "Асбестовской птицефабрике (пос. Белокаменный, Свердловской обл.).
Пример 1. Бактериальную массу Salmonella pullorum-gallinorum Salmonella enteritidis выращивали раздельно на питательной среде (2,5%-ный МПА), смывали с матраса объемом 500 мл стерильным физиологическим раствором в количестве 50 мл. Чистоту культуру контролировали бактериоскопическим методом. Смытую бактериальную массу объединяли и подвергали воздействию СВЧ поля частотой 2450 ± 50 МГц в режиме "Умеренный нагрев" в СВЧ печи "Титан-С" при экспозиции 3 минуты.
Далее инактивированную суспензию охлаждали и центрифугировали при 4000 оборотов/мин в течение 20 минут и удаляли надосадочную жидкость. Осадок промывали стерильным физиологическим раствором путем повторного центрифугирования в том же режиме. Осадок суспендировали в физиологическом растворе, получая концентрированную взвесь микробных клеток, и окрашивали 2%-ным водным раствором генциавиолета.
Полученный препарат проверяли на специфичность и активность путем постановки реакции агглютинации на стекле с сальмонеллезными агглютинирующими сыворотками и в кровекапельной реакции агглютинации с кровью цыплят, зараженных вышеуказанными культурами.
Пробы сывороток и крови птиц исследовали антигенами, полученными предложенным способом по той же методике, что и со стандартным эритроцитарным антигеном. Сравнительные результаты исследований представлены в табл. 1.
Результатами исследований установлено, что антигены, полученные предлагаемым способом, выявляют всех сальмонеллоносителей, реагирующих на эритроцитарный антиген.
Пример 2. Культуры Salmonella enteritides, Salmonella pullorum gallinarum выращивали на твердой питательной среде. Условия выращивания, инактивакции и выделения антигена как в примере 1. Далее приготовленные антигены смешивали в равных количествах. Полученную смесь антигенов окрашивали 2%-ным водным раствором генцианвиолета и получали бивалентный антиген, приготовленный по предлагаемому способу.
Изучение активности полученного бивалентного сальмонеллезного антигена проводили путем постановки реакции агглютинации и кровекапельной реакции агглютинации с кровью и сывороткой крови птиц. Результаты представлены в табл. 2.
В результате проведенных опытов установлено, что бивалентный антиген, полученный по предлагаемому методу, полностью выявляют всех птиц, реагирующих на антиген прототипа, а также реагирует с кровью птиц с сомнительной реакцией, которых не выявляет стандартный эритроцитарный антиген.
Для выявления сальмонеллоносительства среди птиц также использовали постановку реакции агглютинации с желтком яиц. Исследовано 300 яиц с антигенами: стандартными (Эритроцитарный и цветной пуллорный) и бивалентным. Результаты со всеми антигенами аналогичные - положительных реакций не было установлено.
Представленные результаты лабораторной и производственной проверок предложенного способа получения антигена для диагностики сальмонеллоносительства у кур показывают техническую осуществимость способа и его эффективность для диагностики, не уступающую стандартному эритроцитарному антигену.
Бивалентный антиген, полученный по предлагаемому способу, по чувствительности несколько превышает эритроцитарный антиген при значительно более низких затратах времени и материальных средств на его получение.
Учитывая значительное распространение сальмонеллезной инфекции у птиц, в частности на крупных птицефабриках, и то, что в настоящее время птицеводство России не имеет на вооружении общедоступного с низкой ценой антигена для прижизненной диагностики этой инфекции, предлагаемый способ получения антигена представляет большой интерес для промышленного птицеводства, в частности, его широкое внедрение в лабораторную практику позволит сократить сроки оздоровления хозяйств от этого заболевания, повысить сохранность молодняка птиц и тем самым будет способствовать ликвидации одного из главных источников сальмонеллезной токсикоинфекции у людей.
Методика исследования птиц не меняется по сравнению с используемой для известных антигенов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ДИАГНОСТИКИ ПУЛЛОРОЗА-ТИФА ПТИЦ | 1993 |
|
RU2070055C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ДИАГНОСТИКИ ПОЛЛУРОЗА-ТИФА ПТИЦ | 2018 |
|
RU2685413C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ ДИАГНОСТИКИ ПОЛЛУРОЗА-ТИФА ПТИЦ | 1996 |
|
RU2085949C1 |
| ПРЕПАРАТ ПРОТИВ САЛЬМОНЕЛЛЕЗА ГОЛУБЕЙ И СПОСОБ ЛЕЧЕНИЯ САЛЬМОНЕЛЛЕЗА ГОЛУБЕЙ | 2007 |
|
RU2366456C1 |
| ВАКЦИНА ПРОТИВ САЛЬМОНЕЛЛЕЗА КУР И СПОСОБ ПРОФИЛАКТИКИ САЛЬМОНЕЛЛЕЗА КУР | 1992 |
|
RU2030916C1 |
| СПОСОБ ЛЕЧЕНИЯ ПТИЦ ПРИ САЛЬМОНЕЛЛЕЗЕ, ВЫЗВАННОМ SALMONELLA TYPHIMURIUM | 2008 |
|
RU2375075C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К БАКТЕРИАЛЬНЫМ АНТИГЕНАМ | 2014 |
|
RU2563885C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОЙ СТАБИЛЬНОЙ СЫВОРОТКИ | 2015 |
|
RU2584596C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭРИТРОЦИТАРНОГО ДИАГНОСТИКУМА ДЛЯ РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ (РНГА) ПРИ КЛОСТРИДИОЗАХ ЖИВОТНЫХ | 2020 |
|
RU2754465C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО АНТИГЕННОГО САПНОГО | 2001 |
|
RU2188036C1 |
Изобретение предназначено для массовой прижизненной диагностики сальмонеллеза птиц на птицефабриках в условиях промышленного птицеводства. Выращивают культуры Salmonella enteritides и Salmonella pullorum-gallinarum раздельно на твердых питательных средах. Выращенные культуры смывают физиологическим раствором. Смывы объединяют. Полученную микробную суспензию инактивируют в микроволновой печи. Частота СВЧ излучения составляет 2450 ± 50 МГц. Обработку проводят в течение 1 - 5 мин при нагреве среды не выше 80°С. После остывания микробную суспензию центрифугируют. Клетки промывают и окрашивают. Получают антиген, по своим качествам не уступающий пуллорному эритроцитарному антигену. Изобретение позволит сократить сроки оздоровления хозяйств от сальмонеллеза, повысить сохранность молодняка птиц, сократить затраты на обследование птицы и снизить себестоимость получаемой продукции. 2 з.п.ф-лы, 2 табл.
| SU 955573 А, 10.11.1996 | |||
| SU 1121825 А, 10.11.1996 | |||
| СПОСОБ ИНАКТИВАЦИИ ИНФЕКЦИОННОЙ АКТИВНОСТИ ВОЗБУДИТЕЛЕЙ КИШЕЧНЫХ ИНФЕКЦИЙ И ВАКЦИНА ДЛЯ ИММУНИЗАЦИИ ЖИВОТНЫХ | 1995 |
|
RU2098134C1 |
Авторы
Даты
2000-10-27—Публикация
1998-05-07—Подача