Область технологии
Данное изобретение относится к новому белку (молекуле OCIF-связывающего белка, далее этот белок может называться ОВМ), который связывается с ингибирующим остеокластогенез фактором (который далее может называться OCIF) и способу получения этого белка.
Данное изобретение относится также к ДНК, кодирующей этот белок, белкам, содержащим аминокислотную последовательность, кодируемую этой ДНК, способу получения этого белка с применением способов генной инженерии и фармацевтическим композициям, содержащим этот белок.
Данное изобретение относится, далее, к способам скрининга, с использованием этого белка и этой ДНК, веществ для регуляции экспрессии этого белка, веществ, ингибирующих или регулирующих биологическую активность этого белка, или рецепторов, переносящих сигнал этого белка посредством взаимодействия с этим белком, к веществам, получаемым при помощи этого скрининга, и к фармацевтическим композициям, которые содержат полученные вещества.
Данное изобретение относится также к антителам против этого белка, способам получения этих антител и фармацевтическим композициям, содержащим эти антитела.
Предшествующий уровень техники Костный метаболизм зависит от общей активности остеобластов, которые регулируют остеогенез (костеобразование), и остеокластов, которые регулируют резорбцию костей (рассасывание). Считается, что нарушение костного метаболизма вызывается нарушением баланса остеогенеза и резорбции костей. Остеопороз, гиперкальциемия, болезнь Педжета (деформируюшая остеодистрофия), почечная остеодистрофия, хронический ревмакардит, остеоартрит и т.п. известны как заболевания, сопутствующие нарушению костного метаболизма. Остеопороз является типичным заболеванием, вызываемым таким нарушением костного метаболизма. Это заболевание возникает, когда резорбция костей остеокластами преобладает над остеогенезом, совершаемым остеобластами. Это заболевание характеризуется уменьшением как подвергнутого кальцинозу костного материала, так и костного матрикса. Хотя механизм этого заболевания не выяснен полностью, заболевание вызывает боли в костях, делает их хрупкими и может приводить к переломам. Это заболевание становится социальной проблемой, поскольку оно увеличивает количество прикованных к постели лиц по мере увеличения популяции пожилых людей. Получение терапевтического средства для этого заболевания крайне желательно. Ожидается, что заболевание, вызываемое уменьшением костной массы, должно излечиваться супрессией костной резорбции, ускорением костеобразования (остеогенеза) или улучшением баланса между резорбцией и костеобразованием.
Ожидается, что остеогенез усиливается ускорением пролиферации, дифференцировки или активации остеобластов, которые образуют костную ткань, или супрессией пролиферации, дифференцировки или активации остеокластов, которые рассасывают костную ткань. В последние годы большой интерес вызывали гормоны, низкомолекулярные вещества или физиологически активные белки, проявляющие такие активности, и эти вещества являются объектом интенсивных фундаментальных исследований и разработок, осуществляемых в настоящее время.
Лекарственные средства, такие как кальцитониновые агенты, агенты активных форм витамина D3, гормональные агенты, содержащие эстрадиол, иприфлавон, витамин К2 и бифосфонатные соединения, уже известны в качестве лекарственных средств для лечения и сокращения периода лечения заболеваний, связанных с костями. Разрабатываются клинические тесты для производных активных форм витамина D3, производных эстрадиола и бисфосфонатных соединений второго и третьего поколения для разработки терапевтических агентов с превосходной эффективностью и минимальными побочными эффектами.
Однако способы терапии с использованием этих агентов не всегда были удовлетворительными по эффективности и терапевтическим результатам. Настоятельно необходима разработка новых терапевтических агентов, которые являются более безопасными и более эффективными. Некоторые агенты, используемые для лечения заболеваний, связанных с костным метаболизмом, применяют лишь ограниченно из-за их побочных действий. Кроме того, способы лечения с использованием двух или нескольких агентов в сочетании являются в настоящее время основным направлением в лечении заболеваний, связанных с костным метаболизмом, таких как остеопороз. С этой точки зрения желательна разработка лекарственных средств, имеющих механизм действия, отличающийся от общепринятых лекарственных средств, и проявляющих более высокую эффективность и минимальные побочные эффекты.
Как упоминалось выше, клетками, контролирующими костный метаболизм, являются остеобласты и остеокласты. Известно, что эти клетки имеют тесные взаимодействия, называемые "сопряжением". В частности, известно, что цитокины, такие как Интерлейкины 1 (IL-1), 3 (IL-3), 6 (IL-6) и 11 (IL-11), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), интерферон-γ (IFN-γ), фактор некроза опухолей α (TNF-α) и трансформирующий фактор роста β (TGF-β), секретируемые остеобластными стромальными клетками, усиливают или ингибируют дифференцировку или созревание остеокластов (Raisz: Disorders of Bone and Mineral Metabolism, 287-311, 1992; Suda et al.: Principles of Bone Biology, 87-102, 1996; Suda et al.: Endocrine Reviews, 4, 266-270, 1995, Lacey et al.: Endocrinology, 186, 2369-2376, 1995). Сообщалось, что остеобластные стромальные клетки играют важную роль в дифференцировке и созревании остеокластов, а также в таких функциях остеокластов, как резорбция костей зрелыми остеокластами посредством клетка-клеточных контактов с незрелыми предшественниками остеокластов или со зрелыми остеокластами.
Считали, что фактор, называемый фактором дифференцировки остеокластов (ODF, Suda et al: Endocrine Rev., 13, 66-80, 1992; Suda et al.: Bone, 17, 87S-91S, 1995), экспрессируется на мембране остеобластных стромальных клеток и участвует в образовании остеокластов посредством контакта клетка-клетка. Согласно этой гипотезе на клетках-предшественниках остеокластов присутствует рецептор ODF. Однако до сих пор не были очищены или идентифицированы ни ODF, ни его рецептор. Не было также сообщений, касающихся их свойств, механизма действия или структуры. Таким образом, механизм, участвующий в дифференцировке и созревании остеокластов, пока еще не выяснен в достаточной степени. Выяснение этого механизма явится большим вкладом не только в фундаментальную медицину, но также в разработку новых лекарственных средств для лечения заболеваний, связанных с нарушением костного метаболизма.
Авторы данного изобретения провели интенсивные исследования в связи с этой ситуацией и обнаружили ингибирующий остеокластогенез фактор (OCIF) в культуральном бульоне фибробластов легких эмбриона человека, IMR-90 (ATCC Deposition No. CCL186) (WO 96/26217).
Авторам данного изобретения удалось клонировать ДНК, кодирующую OCIF, получить рекомбинантный OCIF в клетках животных и подтвердить in vivo фармацевтические эффекты (улучшающее действие на костный метаболизм и т.д.) рекомбинантного OCIF. Ожидается, что OCIF можно будет использовать в качестве агента для предотвращения или лечения заболеваний, связанных с нарушением костного метаболизма, с большей эффективностью, чем эффективность общепринятых лекарственных средств, и с меньшими побочными действиями.
Описание изобретения
Авторы данного изобретения провели поиск белка, который связывается с ингибирующим остеокластогенез фактором (OCIF), и обнаружили, что OCIF-связывающий белок экспрессируется на остеобластных стромальных клетках, культивируемых в присутствии фактора резорбции костей, такого как активная форма витамина D3 и паратиреоидный гомон (РТН). Кроме того, авторы данного изобретения исследовали характеристики и физиологические функции OCIF-связывающего белка и нашли, что этот белок проявляет биологическую активность фактора, поддерживающего или усиливающего дифференцировку и созревание остеокластов из незрелых предшественников остеокластов. Эти открытия составили данное изобретение. Дальнейшее исследование белка данного изобретения доказало, что он представляет собой важный белок, регулирующий дифференцировку и созревание остеокластов из незрелых предшественников остеокластов в системе сокультивирования остеобластных стромальных клеток и клеток селезенки. Успех в идентификации и выделении белка, действующего в качестве фактора, поддерживающего или усиливающего дифференцировку и созревание остеокластов, в данном изобретении сделал возможным скрининг нового лекарственного средства, применимого для лечения патологии костного метаболизма, на основе механизма костного метаболизма, использующего белок данного изобретения.
В соответствии с этим целью данного изобретения является получение нового белка (OCIF-связывающей молекулы или ОВМ), который связывается с ингибирующим остеокластогенез фактором (OCIF), и способа получения этого белка.
Другой целью данного изобретения является получение ДНК, кодирующей этот белок, белков, содержащих аминокислотную последовательность, кодируемую этой ДНК, и способа получения этого белка с применением способов генной инженерии и фармацевтических композиций, содержащих этот белок.
Следующей целью данного изобретения является разработка способов скрининга веществ, контролирующих экспрессию этого белка, с применением этих белка и ДНК, веществ, ингибирующих или регулирующих биологическую активность этого белка, рецепторов, трансдуцирующих действие этого белка путем связывания с этим белком, веществ, получаемых этим скринингом, и фармацевтических композиций, содержащих эти вещества.
Еще одной целью данного изобретения является получение антител против этого белка, способов получения этих антител и фармацевтических композиций, содержащих эти антитела.
Белок данного изобретения имеет следующие физико-химические свойства и биологическую активность:
(а) аффинность: специфически связывается с ингибирующим остеокластогенез фактором (OCIF) и проявляет высокую аффинность в отношении OCIF (константа диссоциации на клеточной мембране Kd=10-9 М или менее);
(b) молекулярная масса: имеет молекулярную массу приблизительно 30000-40000 при определении электрофорезом в SDS-полиакриламидном геле (SDS-ПААГ-электрофорезом) при невосстанавливающих условиях и среднюю молекулярную массу приблизительно 90000-110000 при сшивании с мономерной формой OCIF и
(c) биологическая активность: проявляет активность поддержания или усиления дифференцировки и созревания в системе сокультивирования мышиных остеобластных стромальных клеток и мышиных клеток селезенки в присутствии факторов костной резорбции, таких как активная форма витамина D3 и паратиреоидный гормон (РТН).
Система сокультуры ST2, мышиной остеобластной стромальной клеточной линии и мышиных клеток селезенки в присутствии активной формы витамина D3 или РТН хорошо известна в качестве типичной системы in vitro культуры для образования остеокластов. Клетки, экспрессирующие белок данного изобретения, могут быть определены тестированием связывания OCIF с мышиными остеобластными стромальными клетками или мышиными клетками селезенки в присутствии или в отсутствие активной формы витамина D3. Белок данного изобретения характеризуется как белок, который специфически индуцируется на остеобластных стромальных клетках, культивируемых в присутствии остеотропного фактора, такого как активная форма витамина D3 или РТН. Кроме того, белок данного изобретения может быть охарактеризован как белок, проявляющий биологическую активность, поддерживающую или усиливающую дифференцировку и созревание остеокластов, на основании следующих результатов. А именно, образование остеокластов ингибируется зависимым от дозы образом путем добавления 1-40 нг/мл OCIF к вышеупомянутой системе сокультуры в присутствии активной формы витамина D3, временной ход экспрессии белка данного изобретения на клетках ST2 в присутствии активной формы витамина D3 хорошо коррелирует с временным ходом образования остеокластов в этой сокультуре. Кроме того, количество белка данного изобретения, экспрессируемого на клетках ST2, коррелирует со способностью этих клеток к поддержанию образования остеокластов и связывание OCIF с белком данного изобретения на клетках ST2 полностью подавляет образование остеокластов.
Аффинность белка данного изобретения в отношении OCIF может быть оценена мечением OCIF и испытанием связывания меченого OCIF с поверхностью мембраны клеток животного. OCIF может быть помечен по общепринятому способу мечения, такому как мечение радиоактивным изотопом или флуоресцентное мечение. Мечение остатков тирозина 125I может быть приведено в качестве характерного примера мечения OCIF радиоактивным изотопом. Могут быть использованы такие способы мечения, как способ с Иодогеном, способ с хлорамином Т и ферментативный способ. Связывание меченого OCIF с поверхностной мембраной клеток животного может тестироваться общепринятым способом. Добавление немеченого OCIF к среде, используемой для теста связывания, в концентрации, в 100-400 раз превышающей концентрацию меченого OCIF, обеспечивает измерение неспецифического связывания. Величина специфического связывания OCIF может быть рассчитана вычитанием величины неспецифического связывания из общей величины связывания меченого OCIF. Аффинность белка данного изобретения, экспрессируемого на клеточной мембране, в отношении OCIF может оцениваться изменением величины меченого OCIF и анализом специфического связывания при помощи кривой Скетчарда.
Определенная аффинность белка данного изобретения в отношении OCIF равна приблизительно 100-500 пМ. Белок данного изобретения характеризуется высокой аффинностью (константа диссоциации на клеточной мембране Кd=10-9 M или менее) в отношении ингибирующего остеокластогенез фактора (OCIF). Молекулярная масса ОВМ может быть оценена гель-фильтрацией, электрофорезом в SDS-ПААГ или т.п. Для точного определения молекулярной массы предпочтительным является электрофорез в SDS-ПААГ. ОВМ является белком, имеющим молекулярную массу приблизительно 40000 (40000±4000) в восстанавливающих условиях.
Белок данного изобретения может быть получен из мышиной остеобластной стромальной клеточной линии ST2, мышиной клеточной линии преадипоцитов РА6, остеобластных клеточных линий человека или других остеобластных клеток, выбранных из клеток млекопитающих, таких как человек, мыши или крысы. В качестве веществ, индуцирующих экспрессию белка данного изобретения, могут быть приведены остеотропные факторы, такие как активная форма витамина D3 (кальцитриол), паратиреоидный гормон (РТН), интерлейкин (IL-1, IL-6, IL-11), Онкостатин М и ингибирующий лейкоз фактор (LIF). Эти вещества могут быть добавлены в концентрации 10-8 М (активная форма витамина D3 и РТН), 10 нг/мл (IL-11) или 1 нг/мл (Онкостатин М). IL-6 предпочтительно используют в концентрации 20 нг/мл с 500 нг/мл растворимого рецептора IL-6. Предпочтительно могут быть использованы конфлюентные клетки мышиной остеобластной стромальной клеточной линии ST2, культивируемые в среде α-МЕМ, к которой добавлены 10-8 М активная форма витамина D3, 10-7 М дексаметазон и 10% фетальная телячья сыворотка. Культивируемые клетки могут быть собраны выскребанием "скребком" для клеток. Собранные клетки могут храниться при -80°С до использования.
Белок данного изобретения может быть эффективно очищен из мембранных фракций собранных клеток. Мембранные фракции могут быть получены общепринятым способом, который используют для получения внутриклеточных органелл. Различные типы ингибиторов протеаз могут быть добавлены к буферному раствору, используемому для получения мембранной фракции. Примеры ингибиторов протеаз включают ингибиторы сериновой протеазы, ингибиторы тиоловых протеаз и ингибиторы метапротеазы. В качестве специфических примеров приводятся PMSF, APMSF, ЭДТА, о-фенантролин, лейпептин, пепстатин А, апротинин, соевый ингибитор трипсина. Гомогенизатор Даунса, политронный гомогенизатор или ультразвуковой процессор могут быть использованы для гомогенизации клеток. Гомогенат клеток суспендируют в буферном растворе, содержащем 0,5 М сахарозу, и центрифугируют в течение 10 минут при 600 × g для отделения ядер и неразрушенных клеток в виде осадка. Супернатант центрифугируют в течение 90 минут при 150000 х g для получения мембранных фракций в виде осадка. Полученную мембранную фракцию обрабатывают различными типами детергентов для эффективной солюбилизации и экстракции белка данного изобретения из клеточной мембраны. Могут быть использованы детергенты, которые обычно используют для солюбилизации белков клеточных мембран, такие как CHAPS (3-[(3-холамидопропил)диметиламонио]-1-пропансульфонат), Тритон Х-100, Nikkol и н-октилгликозид. Предпочтительно к мембранной фракции добавляют 0,5% CHAPS и смесь перемешивают в течение 2 часов при 4°С для солюбилизации белка данного изобретения. Полученную таким образом пробу центрифугируют при 150000 × g в течение 60 минут для получения фракции солюбилизированных мембран в виде супернатанта.
Белок данного изобретения может быть очищен из фракции солюбилизированных мембран с использованием колонки, геля или смолы, связанных с OCIF. Иммобилизованный OCIF может быть OCIF, выделенным из культурального бульона фибробластов легких эмбриона человека IMR-90, описанным в WO 96/26217, или rOCIF, полученным при помощи способов генной инженерии. rOCIF может быть получен введением кДНК человека, кДНК мыши или кДНК крысы в экспрессирующий вектор в соответствии с общепринятым способом, перенесением сконструированного вектора в клетки животного, такие как клетки СНО, клетки ВНК или клетки Namalwa, или в клетки насекомого для получения rOCIF и очисткой rOCIF. Полученный OCIF имеет молекулярную массу приблизительно 60 кДа (мономерная форма) или 120 кДа (димерная форма). OCIF димерной формы является предпочтительным для иммобилизации. Примерами гелей и смол, с которыми иммобилизуют OCIF, являются ECH-Sepharose 4B, EAH-Sepharose 4B, Thiopropyl Sepharose 6В, CNBr-активированная Sepharose 4B, активированная СН Sepharose 4B, эпокси-активированная Sepharose 6B, активированная тиолом Sepharose 4B (изготавливаемые Pharmacia Co.), TSKgel AF-Epoxy Toyopal 650, TSKgel AF-Amino Toyopal 650, TSKgel AF-Formyl Toyopal 650, TSKgel AF-Carboxy Toyopal 650, TSKgel AF-Tresyl Toyopal 650 (изготовляемые Tosoh Corporation), Amino-Cellulofine, Carboxy-Cellulofine, FMP активированный Cellulofine, Formyl-Cellulofine (изготовляемые Seikagaku Kogyo Co.), Affigel 10, Affigel 15 и Affiprep 10 (изготовляемые BioRad Co.). В качестве колонок, на которых может быть иммобилизован OCIF, могут быть приведены HiTrap NHS-активированная колонка (Pharmacia Co.), TSKgel AF-Tresyl 5PW (Tosoh Corporation) и т.д. В качестве характерного примера способа иммобилизации OCIF с HiTrap NHS-активированной колонкой (1 мл, Pharmacia Co.) может быть приведен следующий способ. В частности, 1 мл 0,2 М раствора NаНСО3/0,5 М NaCl (рН 8,3), содержащего 13,0 мг OCIF, инъецируют в эту колонку для проведения реакции связывания при комнатной температуре в течение 30 минут. На колонку наносят последовательно 0,5 М этаноламин/0,5 М NaCl (pH 8,3) и 0,1 М уксусную кислоту, 0,5 М NaCl (pH 4,0). Затем колонку опять промывают 0,5 М этаноламином/0,5 М NaCl (pH 8,3) и колонке дают стоять в течение 1 часа при комнатной температуре для блокирования избыточных активных групп. Колонку последовательно промывают дважды 0,5 М этаноламином/0,5 М NaCl (pH 8,3) и 0,1 М уксусной кислотой/0,5 М NaCl (pH 4,0) и затем промывают раствором 50 мМ Трис/1 М NaCl/0,l% CHAPS (pH 7,5), получая колонку с иммобилизованным OCIF. Белок данного изобретения может быть эффективно очищен колонкой с иммобилизованным OCIF, приготовленной таким образом, или гелем или смолой с иммобилизованным OCIF.
Для ингибирования деградации белка данного изобретения желательно добавлять различные вышеупомянутые ингибиторы протеаз к буферным растворам, используемым для очистки этого белка. Белок данного изобретения может быть очищен нанесением вышеупомянутой фракции солюбилизированных мембран на колонку с иммобилизованным OCIF или смешиванием с гелем или смолой с иммобилизованным OCIF и элюцией белка из этой колонки, геля или смолы кислотой, различными денатурирующими белок агентами, какодилатным буфером или т.п. Желательно использовать для элюции кислоту и нейтрализовать сразу после элюции для снижения денатурации белка данного изобретения. В качестве кислотного раствора, используемого для элюции, может быть приведен раствор 0,1 М глицина-соляной кислоты (pH 3,0), раствор 0,1 М глицина-соляной кислоты (pH 2,0), раствор 0,1 М цитрата натрия (рН 2,0) и т.п.
Белок данного изобретения может быть дополнительно очищен общепринятыми способами очистки, используемыми для очистки различных белков из биологических материалов, и различными способами очистки, использующими физико-химические свойства этого белка. Для концентрации растворов, содержащих белок данного изобретения, могут быть использованы общепринятые способы, используемые в процессе очистки для белков, такие как ультрафильтрация, лиофилизация и высаливание. Предпочтительно используют, например, ультрафильтрацию с применением Centricon-10 (BioRad Co.). В качестве способов очистки используют в сочетании различные способы, обычно применяемые для очистки белков, такие как ионообменная хроматография, гель-фильтрационная хроматография, гидрофобная хроматография, хроматография с обращенной фазой (обращенно-фазовая хроматография) и препаративный электрофорез. Более конкретно, можно очищать белок данного изобретения комбинированием гель-фильтрации на колонке Superose 12 (Pharmacia Co.) и обращенно-фазовой хроматографии. Для детектирования белка данного изобретения определяют активность связывания белка данного изобретения с иммобилизованным OCIF или материал, связавшийся с иммобилизованным OCIF, иммунопреципитируют антителами против OCIF и анализируют при помощи электрофореза в SDS-полиакриламидном геле (электрофореза в SDS-ПААГ).
Полученный белок данного изобретения применим в качестве средства для лечения заболеваний, вызываемых нарушением костного метаблизма, таких как врожденный системный остеопетроз (болезнь Альберс-Шенберга), или в качестве реагента для исследований или диагностики таких заболеваний.
Данное изобретение обеспечивает также ДНК, кодирующую новый белок (OCIF-связывающую молекулу или ОВМ), который связывается с ингибирующим остеокластогенез фактором, белки, содержащие аминокислотную последовательность, кодируемую этой ДНК, способ получения этого белка способами генной инженерии и фармацевтические композиции, содержащие такой белок. Кроме того, данное изобретение обеспечивает способы скрининга веществ для регуляции экспрессии ОВМ, способ скрининга веществ, ингибирующих или модифицирующих биологическую активность ОВМ, или способ скрининга рецепторов, передающих действие ОВМ путем связывания с ОВМ, и фармацевтические композиции, содержащие вещества, полученные в результате этого скрининга.
Новый белок ОВМ, кодируемый ДНК данного изобретения, имеет следующие физико-химические свойства и биологическую активность:
(a) связывается специфически с ингибирующим остеокластогенез фактором (OCIF),
(b) имеет молекулярную массу приблизительно 40000 (±4000) при определении при помощи электрофореза в SDS-ПААГ при восстанавливающих условиях и среднюю молекулярную массу 90000-110000 при сшивании с мономерной формой OCIF и
(c) проявляет активность поддержания или усиления дифференцировки и созревании остеокластов.
Ингибирующий остеокластогенез фактор (OCIF) человека, который используют в качестве зонда для идентификации ДНК, кодирующей ОВМ, OCIF-связывающей молекулы данного изобретения, и для оценки свойств ОВМ, может быть выделен из культурального бульона фибробластной клеточной линии легких эмбриона человека IMR-90 согласно WO 96/26217. Рекомбинантный OCIF человека, рекомбинантный OCIF мыши, рекомбинантный OCIF крысы и т.п. могут быть также использованы для выделения и идентификации ДНК, кодирующей ОВМ. Эти рекомбинантные белки OCIF могут быть получены встраиванием ДНК-фрагментов, кодирующих эти белки, в экспрессирующие векторы в соответствии с общепринятыми способами, экспрессией в клетках животных, таких как клетки СНО, клетки ВНК или клетки Namalwa, или в клетках насекомых, и их очисткой.
В качестве способа выделения кДНК, кодирующей белок-мишень, (клонирования кДНК), может быть использован способ, предусматривающий определение частичной аминокислотной последовательности этого белка и выделение кДНК-мишени при помощи гибридизации с использованием нуклеотидной последовательности, соответствующей этой аминокислотной последовательности. Другой доступный способ, даже в случае, когда аминокислотная последовательность белка неизвестна, предусматривает конструирование библиотеки кДНК в экспрессирующем векторе, введение этой кДНК в клетки и скрининг на экспрессию белка-мишени для выделения целевой кДНК (способ экспрессионного клонирования, D'Andrea et al.: Cell, 57, 277-285, 1989; FuKunaga et al.: Cell, 61, 341-350, 1990). В способе экспрессионного клонирования подходящие клетки-хозяева, такие как бактерии, дрожжи, клетки животных и т.п., выбирают в зависимости от цели. Во многих случаях выбирают клетки животных в качестве клеток-хозяев для клонирования кДНК, кодирующей белок, такой как белок данного изобретения, который предположительно присутствует на мембранной поверхности клеток животных. Обычно отбирают клетки-хозяева, проявляющие высокую эффективность трансфекции ДНК и достигающие высоких уровней экспрессии введенной ДНК. Одним из примеров таких клеток животного являются клетки почек обезьяны COS-7, используемые в данном изобретении. Поскольку большой Т-антиген SV40 экспрессируется в клетке COS-7, плазмида, которая имеет репликатор SV40, может присутствовать в виде эписомы из множественных копий в этой клетке, так что ожидается высокий уровень экспрессии. Кроме того, поскольку экспрессия белка-мишени клетками COS-7 достигает максимума в пределах нескольких дней после введения ДНК, эта клетка пригодна для быстрого скрининга. Сочетание этой клетки-хозяина с плазмидой, способной к высокой экспрессии, обеспечивает экспрессию гена чрезвычайно высокого уровня. Фактором, оказывающим наибольшее влияние на экспрессию гена, находящегося на плазмиде, является промотор. В качестве промоторов, обеспечивающих высокую экспрессию, используют такие промоторы, как промотор SRα и полученные из цитомегаловируса промоторы. Для скрининга кДНК, кодирующих мембранный белок, согласно стратегии экспрессионного клонирования используют процедуры скрининга, такие как способ связывания, способ пэннинга или film emulsion способ.
Данное изобретение относится к ДНК, кодирующей белок (ОВМ), который специфически связывается с OCIF, выделенной сочетанием стратегии экспрессионного клонирования и скрининга при помощи способа связывания с экспрессируемым белком, и к скринингу физиологически активных веществ с использованием этой ДНК или экспрессируемого белка. ОВМ, кодируемый ДНК данного изобретения, может быть детектирован мечением OCIF и тестированием связывания меченого OCIF с поверхностной мембраной клетки животного. OCIF может быть помечен общепринятым способом мечения, таким как способ мечения радиоактивным изотопом или способ флуоресцентного мечения, который используют для мечения обычных белков. В качестве характерного примера мечения OCIF радиоактивным изотопом может быть приведено мечение остатков тирозина 125I. Могут быть использованы такие способы мечения, как способ с Иодогеном, способ с хлорамином Т и ферментативный способ. Связывание меченого OCIF с поверхностной мембраной клеток животного может тестироваться общепринятыми способами. Добавление немеченого OCIF к среде, используемой для теста связывания, в концентрации, в 100-400 раз превышающей концентрацию меченого OCIF, обеспечивает измерение неспецифического связывания. Величина специфического связывания OCIF может быть рассчитана вычитанием величины неспецифического связывания из общей величины связывания меченого OCIF.
Авторы данного изобретения предположили, что существует взаимодействие между фактором, участвующим в дифференцировке остеокластов, и OCIF. На основании этого предположения авторы изобретения для выделения белка, с которым связывается OCIF, подвергли скринингу экспрессионную библиотеку, полученную из мРНК мышиной остеобластной стромальной клеточной линии ST2 в соответствии со следующим способом. В частности, ДНК, синтезированную с использованием мРНК ST2, встраивали в экспрессирующий вектор клеток животных и вектор с этой вставкой вводили в клетки почек обезьян COS-7. Целевой белок, экспрессируемый на клетках COS-7, подвергали скринингу с использованием OCIF, меченного 125I, в качестве зонда. В результате была выделена ДНК, кодирующая белок, который специфически связывается с OCIF. Затем определяли нуклеотидную последовательность ДНК, кодирующей эту OCIF-связывающую молекулу (ОС IF-связывающую молекулу; ОВМ). Кроме того, было обнаружено, что ОВМ, кодируемый этой ДНК, связывается специфически и сильно с OCIF на клеточной мембране.
Сравнительно мягкими условиями для гибридизации ДНК данного изобретения являются, например, условия, когда ДНК переносят на нейлоновую мембрану и иммобилизуют на ней в соответствии с общепринятыми способами и гибридизуют в буферном растворе для гибридизации с зондом ДНК, меченным изотопом, при температуре 40-70°С в течение от приблизительно 2 часов до ночи с последующим промыванием в 0,5 × SSC (0,075 М хлорид натрия и 0,0075 М цитрат натрия) при 45°С в течение 10 минут.
В частности, в качестве нейлоновой мембраны для перенесения на нее и иммобилизации на ней ДНК используют Highbond N (Аmersham Co.). Затем ДНК гибридизуют с зондом ДНК, меченным 32P, в буфере для быстрой гибридизации (Amersham, Co) при 65°С в течение 2 часов с последующим промыванием 0,5 × SSC (0,075 М хлорид натрия и 0,0075 М цитрат натрия) при 45°С в течение 10 минут.
Система сокультуры мышиных остеобластных стромальных клеток и мышиных клеток селезенки в присутствии активной формы витамина D3 или РТН хорошо известна в качестве типичной системы культуры in vitro для образования остеокластов. Белок данного изобретения характеризуется как белок, который индуцируется специфически на остеобластных стромальных клетках, культивируемых в присутствии агента, который усиливает резорбцию костей, такого как активная форма витамина D3 или РТН. Кроме того, вследствие того факта, что образование остеокластов стимулируется добавлением белка, кодируемого ДНК данного изобретения, к мышиным клеткам селезенки, культивируемым даже в отсутствие активной формы витамина D3 или РТН, считают, что ОВМ, который кодируется ДНК данного изобретения, участвует в дифференцировке и созревании остеокластов.
Рекомбинантный ОВМ может быть получен встраиванием ДНК данного изобретения в экспрессирующий вектор для конструирования плазмиды и введением этой плазмиды в различные клетки или микроорганизмы для экспрессии рекомбинантного ОВМ. В качестве хозяина, в котором может экспрессироваться рекомбинантный OBM, могут быть использованы клетки млекопитающих, такие как COS-7, CHO, Namalwa, или бактерии, такие как Escherichia coli. OBM может экспресироваться в виде мембраносвязанной формы белка с использованием полноразмерной ДНК и в виде секретируемой формы или растворимой формы белка путем удаления части, кодирующей трансмембранный домен. Продуцируемый рекомбинантный OBM может быть эффективно очищен с применением подходящего сочетания общепринятых способов очистки, используемых для обычных белков, таких как аффинная хроматография с использованием колонок с иммобилизованным OCIF, ионообменная хроматография и гель-фильтрационная хроматография. Полученный белок данного изобретения применим в качестве агента для лечения заболеваний, вызываемых нарушением костного метаболизма, таких как врожденный системный остеопетроз, или в качестве реагента для исследования и диагностики таких заболеваний.
С использованием белка OBM, кодируемого ДНК данного изобретения, могут проводиться следующие операции скрининга:
(1) скрининг веществ, которые регулируют экспрессию OBM,
(2) скрининг веществ, которые специфически связываются с OBM и ингибируют биологическую активность OBM, и
(3) скрининг белков, которые присутствуют в клетках-предшественниках остеокластов и передают (трансдуцируют) биологическую активность OBM (рецептор OBM). Можно также создавать антагонисты и агонисты с использованием этого рецептора OBM. В комбинаторной химии с применением вышеупомянутых OBM или рецептора ОВМ пептидная библиотека, используемая для скрининга антагонистов или агонистов, может быть получена следующим способом. В частности, одним из таких способов является способ расщепления (Lam et al.: Nature, 354, 82-84, 1991). Согласно этому способу синтетические носители (гранулы), каждая из которых содержит специфическую аминокислоту (единицу), связанную с ней, готовят отдельно для всех единиц. Синтезированные носители смешивают вместе и делят на порции, равные числу этих единиц. Затем связывают следующие единицы. Эту процедуру повторяют n раз с получением библиотеки, содержащей носители, с которыми связаны n единиц. Согласно этому способу синтеза каждый пул носителей имеет один тип последовательности. Таким образом, можно идентифицировать пептид, специфически связывающийся с белком данного изобретения путем отбора пула, который дает сигнал, позитивный в этом способе скрининга, с использованием белка данного изобретения, и путем определения аминокислотной последовательности пептида, связанного на этом пуле. Другим способом является способ фаговой индикации, который использует фаг, несущий синтетическую ДНК, которая кодирует пептиды со случайными аминокислотными последовательностями. Этот способ имеет преимущество, заключающееся в увеличении числа молекул в библиотеке в сравнении с вышеупомянутым способом библиотеки синтетических пептидов, но имеет недостаток, заключающийся в том, что он дает меньшее разнообразие для данного числа молекул, поскольку могут быть конкретные последовательности, которые отсутствуют в этой библиотеке, если фаги неспособны экспрессировать эти последовательности. В способе фаговой индикации система скрининга с использованием белка данного изобретения также может быть применена для определения нуклеотидной последовательности, кодирующей этот пептид, т.е. фаг, специфически связывающийся с белком данного изобретения, концентрируют пэннингом, отобранный фаг амплифицируют в Escherichia coil и определяют нуклеотидную последовательность, кодирующую этот пептид. Кроме того, пептид, проявляющий высокую специфичность и высокую аффинность в отношении ОВМ или рецептора ОВМ, может быть скринирован из пептидной библиотеки с использованием систем скрининга, упомянутых выше в (2) и (3), скринингом в присутствии ОВМ или OCIF при увеличении концентрации ОВМ или OCIF. Таким образом отбирают только позитивные пулы носителей или фаги. Например, низкомолекулярные пептидные агонисты, проявляющие ЕРО (эритропоэтин-подобную) активность, подвергали скринингу из пептидной библиотеки с использованием рецептора эритропоэтина (ЕРО), который является гематопоэтическим гормоном, третичную структуру этого вещества анализировали и на основе этой третичной структуры синтезировали низкомолекулярные вещества (антагонисты), проявляющие ЕРО-подобную активность (Nicholas et al.: Science, 273, 458-463, 1996).
Авторы данного изобретения обнаружили ранее с использованием ингибирующего остеокластогенез фактора OCIF, что OCIF-связывающий белок специфически экспрессируется на остеобластной стромальной клеточной линии ST2, культивируемой в присутствии активной формы витамина D3 или паратиреоидного гормона (РТН). Далее, авторы данного изобретения нашли, что этот белок проявляет биологическую активность поддержания или стимулирования дифференцировки или созревания остеокластов из незрелых клеток-предшественников остеокластов, и выяснили разнообразные физико-химические свойства и биологическую активность этого белка посредством его очистки. Для сравнения рекомбинантного ОВМ, экспрессируемого ДНК данного изобретения, и вышеупомянутого очищенного белка природного типа, который специфически связывается с OCIF, авторы данного изобретения исследовали физико-химические свойства и биологические активности этих двух белков. В результате было подтверждено, что эти два белка (1) являются оба мембраносвязанными белками, специфически связывающимися с OCIF, (2) имеют молекулярные массы приблизительно 40000 при определении при помощи электрофореза в SDS-ПAAГ и (3) имеют средние молекулярные массы приблизительно 90000-110000, когда они сшиты с мономерной формой OCIF. Не только эти физико-химические свойства являются идентичными, но и оба белка обнаруживают биологическую активность поддержания или стимулирования дифференцировки или созревания остеокластов, что позволяет предположить, что они представляют собой один и тот же белок. Кроме того, было подтверждено, что кроличьи поликлональные антитела против ОВМ, полученные с использованием очищенного белка, продуцируемого экспрессией ДНК данного изобретения при помощи генно-инженерных способов (рекомбинантного ОВМ), перекрестно реагировали с описанным выше очищенным белком природного типа и ингибировали специфическое связывание этого очищенного белка природного типа с OCIF так же, как эти антитела ингибируют специфическое связывание ОВМ и OCIF. На основании этих результатов ясно, что рекомбинантный ОВМ, экспрессируемый ДНК данного изобретения, идентичен белку природного типа, который специфически связывается с OCIF.
Для выделения гена (кДНК), кодирующего OCIF-связывающий белок человека (далее называемый ОВМ человека), который специфически связывается с OCIF и проявляет активность поддержания и стимулирования дифференцировки и созревания остеокластов из мышиных клеток селезенки так же, как доза ОВМ природного типа или рекомбинантного мышиного ОВМ, библиотеку кДНК, полученную из мРНК, выделенной из лимфатических узлов человека, подвергали скринингу с использованием кДНК-фрагмента ОВМ человека в качестве зонда. кДНК-фрагмент ОВМ человека получали полимеразной цепной реакцией (ПЦР) в соответствии со способом, упомянутым выше, с применением кДНК, полученной из лимфатического узла человека, в качестве матрицы и праймера, полученного из кДНК мышиного ОВМ. В результате выделяли кДНК, кодирующую белок человека, который специфически связывается с OCIF, и определяли нуклеотидную последовательность кДНК, кодирующей эту OCIF-связывающую белковую молекулу (т.е. кДНК, кодирующей ОВМ человека). Подобно мышиному ОВМ этот ОВМ человека, кодируемый этой кДНК, имеет свойство сильного и специфического связывания с OCIF на клеточной мембране и проявляет активность поддержания и усиления дифференцировки и созревания остеокластов из клеток селезенки мыши. В частности, данное изобретение обеспечивает ДНК, кодирующую новый белок ОВМ человека, который связывается с ингибирующим остеокластогенез фактором (OCIF), белок, который имеет аминокислотную последовательность, кодируемую этой ДНК, способ получения белка, проявляющего свойство специфического связывания с OCIF и активность поддержания и усиления дифференцировки и созревания остеокластов из клеток селезенки мыши, способами генной инженерии, фармацевтические композиции, содержащие этот белок, для лечения заболеваний, вызываемых нарушением костного метаболизма, способ для скрининга веществ, регулирующих экспрессию ОВМ человека, способ для скрининга веществ, которые ингибируют или модулируют активность ОВМ человека и передают действие ОВМ, и фармацевтические композиции, содержащие вещества, полученные этими скринингами.
Данное изобретение обеспечивает, кроме того, ДНК, кодирующую новый белок ОВМ человека, который специфически связывается с OCIF и проявляет биологическую активность поддержания и стимулирования дифференцировки и созревания остеокластов, белок, который имеет аминокислотную последовательность, кодируемую этой ДНК, способ получения белка, проявляющего свойство специфического связывания с OCIF и активность поддержания и усиления дифференцировки и созревания остеокластов из клеток селезенки мыши, способами генной инженерии, и фармацевтические композиции, содержащие этот белок, для лечения заболеваний, вызывающих нарушение костного метаболизма. Кроме того, данное изобретение обеспечивает способ скрининга веществ, регулирующих экспрессию ОВМ человека, способ скрининга веществ, которые ингибируют или модулируют активность ОВМ человека посредством связывания с ним, способ скрининга рецепторов, связывающихся с ОВМ человека и передающих действие ОВМ, антитела против OCIF-связывающего белка человека и фармацевтические композиции, содержащие эти антитела, для предупреждения или лечения заболеваний, вызывающих нарушение костного метаболизма.
Новая OCIF-связывающая белковая молекула человека (ОВМ), которая кодируется ДНК данного изобретения, имеет следующие физико-химические свойства и биологическую активность:
(a) связывается специфически с ингибирующим остеокластогенез фактором (OCIF) (WO 96/26217),
(b) имеет молекулярную массу приблизительно 40000 (±5000) при определении при помощи электрофореза в SDS-ПААГ при восстанавливающих условиях и среднюю молекулярную массу приблизительно 90000-110000 при сшивании с мономерной формой OCIF и
(c) проявляет активность поддержания и стимулирования дифференцировки и созревания остеокластов.
кДНК ОВМ мыши, которая кодирует мышиный OCIF-связывающий белок и используется в качестве зонда для выделения и идентификации кДНК, кодирующей ОВМ человека данного изобретения, может быть выделена в соответствии с вышеупомянутым способом из библиотеки кДНК мышиной остеобластной стромальной клеточной линии ST2. Ингиоирующий остеокластогенез фактор человека (OCIF), который необходим для оценки свойств и биологической активности белка, получаемого экспрессией кДНК ОВМ человека, может быть получен в соответствии со способом, описанным в WO 96/26217, выделением из культурального бульона линии фибробластных клеток человека IMR-90 или способами генной инженерии с использованием ДНК, кодирующей OCIF. Рекомбинантный OCIF человека, рекомбинантный OCIF мыши, рекомбинантный OCIF крысы и т.п. могут быть использованы для оценки свойств и биологической активности ОВМ человека. Эти рекомбинантные OCIF могут быть получены в соответствии с общепринятыми способами встраиванием кДНК в экспрессирующий вектор, экспрессией этой кДНК в клетках животных, таких как клетки СНО, клетки ВНК или клетки Namalwa, или клетках насекомых и очисткой экспрессированных белков.
Следующие способы могут быть использованы для выделения кДНК, кодирующей белок-мишень (клонирования кДНК). (1) Способ, предусматривающий очистку этого белка, определение частичной аминокислотной последовательности этого белка и выделение кДНК-мишени при помощи гибридизации с использованием ДНК-фрагмента, содержащего нуклеотидную последовательность, соответствующую этой аминокислотной последовательности, в качестве зонда, (2) способ, применимый даже в случае, когда аминокислотная последовательность белка неизвестна, предусматривающий конструирование библиотеки кДНК в экспрессирующем векторе, введение этой библиотеки кДНК в клетки и скрининг на экспрессию белка-мишени для выделения целевой кДНК (способ экспрессионного клонирования), и (3) способ выделения кДНК, кодирующей белок-мишень человека, из библиотеки кДНК, сконструированной с использованием клеток или тканей человека, при помощи гибридизации или с использованием полимеразной цепной реакции (ПЦР) с применением кДНК, кодирующей белок, происходящий из млекопитающего (не человека), который обладает такими же характеристиками и биологической активностью, что и белок-мишень человеческого происхождения, в качестве зонда, при предположении, что этот кДНК-зонд имеет высокую гомологию с кДНК человеческого происхождения, которая должна быть клонирована. На основании предположения, что кДНК ОВМ человеческого происхождения имеет высокую гомологию с кДНК ОВМ мыши, можно определить, какие клетки или ткани продуцируют ОВМ человека, при помощи способа Нозерн-гибридизации с применением кДНК ОВМ мыши в качестве зонда. кДНК ОВМ человека может быть получена следующим способом с применением мышиного праймера ОВМ, полученного из кДНК ОВМ мыши. Фрагменты кДНК ОВМ человека могут быть получены по способу ПЦР с использованием кДНК, полученной из продуцирующих ОВМ тканей человека, таких как лимфатические узлы человека, в качестве матрицы. Эти кДНК-фрагменты ОВМ человека используют в качестве зондов для скрининга библиотеки кДНК продуцирующих ОВМ человека клеток или тканей, которые были идентифицированы согласно вышеупомянутому способу. Данное изобретение относится к ДНК, кодирующей ОВМ человека, который имеет характеристики специфического связывания с OCIF и проявляет активность поддержания и стимулирования дифференцировки и созревания остеокластов. Поскольку ОВМ, кодируемый ДНК данного изобретения, является мембраносвязанным белком, содержащим трансмембранный домен, этот белок может детектироваться посредством мечения OCIF и испытания связывания меченого OCIF с поверхностью клеток животных, в которых экспрессируется кДНК данного изобретения. Описанный выше способ мечения с использованием радиоактивного изотопа или флуоресцеина, обычно применяемый для мечения белков, может быть использован для мечения OCIF.
Молекулярная масса белка, экспрессируемого кДНК ОВМ человека данного изобретения, может быть оценена гель-фильтрационной хроматографией, электрофорезом в SDS-ПААГ или т.п. Для точного определения молекулярной массы желательно использовать способ электрофореза в SDS-ПААГ, при помощи которого ОВМ человека был охарактеризован как белок, имеющий молекулярную массу приблизительно 40000 (40000±5000), при восстанавливающих условиях.
Сравнительно мягкими условиями для гибридизации ДНК данного изобретения являются, например, условия, когда ДНК переносят на нейлоновую мембрану и иммобилизуют на ней в соответствии с общепринятым способом и гибридизуют с зондом ДНК, помеченным изотопом, в буферном растворе для гибридизации при температуре 40-70°С в течение от приблизительно 2 часов до ночи, с последующим промыванием в 0,5 × SSC (0,075 М хлорид натрия и 0,0075 М цитрат натрия) при 45°С в течение 10 минут. В частности, в качестве нейлоновой мембраны для перенесения на нее и иммобилизации на ней ДНК используют Highbond N (Amersham, Co.). Затем ДНК гибридизуют с зондом ДНК, меченным 32P, в буфере для быстрой гибридизации (Amersham, Co) при 65°С в течение 2 часов с последующим промыванием 0,5 × SSC при 45°С в течение 10 минут.
Система сокультуры мышиных остеобластных стромальных клеток и мышиных клеток селезенки в присутствии активной формы витамина D3 или РТН хорошо известна в качестве типичной системы культуры in vitro для образования остеокластов. Взаимодействие посредством адгезии остеобластных стромальных клеток и клеток селезенки и присутствие остеотропного фактора, такого как активная форма витамина D3 или РТН, являются обязательными в этой системе культуры in vitro. В этой системе культуры in vitro клетки COS, клетки почек обезьяны, не способные поддерживать образование остеокластов, приобретают способность поддержания образования остеокластов из клеток селезенки в отсутствие остеотропного фактора при экспрессии кДНК данного изобретения, как это имело место в остеобластной стромальной клеточной линии ST2. На основании того факта, что кДНК данного изобретения кодирует белок, содержащий трансмембранный домен, эта кДНК может экспрессироваться в виде секретируемой формы или растворимой формы путем удаления части, кодирующей этот трансмембранный домен. Было подтверждено, что остеокласты могли образовываться при добавлении секретируемой формы ОВМ человека в вышеупомянутую систему культуры in vitro в отсутствие остеотропных факторов. На основании этих результатов ОВМ человека, кодируемый кДНК данного изобретения, характеризуется как фактор, участвующий в дифференцировке и созревании остеокластов.
Рекомбинантный ОВМ человека может быть получен встраиванием ДНК данного изобретения в экспрессирующий вектор, получением экспрессионной плазмиды ОВМ человека, введением этой плазмиды в различные клеточные штаммы и экспрессией ОВМ в клетках. В качестве хозяина для экспрессии ОВМ, могут быть использованы клетки млекопитающих, такие как COS-7, CHO, Namalwa, или бактерии, такие как Escherichia coli. В этом случае ОВМ может экспрессироваться в виде мембраносвязанной формы белка с использованием полноразмерной ДНК или в виде секретируемой формы или растворимой формы белка путем удаления части, кодирующей трансмембранный домен. Продуцируемый таким образом рекомбинантный ОВМ может быть эффективно очищен с применением подходящего сочетания общепринятых способов очистки, используемых для обычных белков, таких как аффинная хроматография с использованием колонок с иммобилизованным OCIF, ионообменная хроматография и гель-фильтрационная хроматография. Полученный таким образом ОВМ человека данного изобретения применим в качестве агента для лечения заболеваний, вызываемых нарушением костного метаболизма, таких как врожденный системный остеопетроз, или в качестве реагента для исследования и диагностики таких заболеваний.
С использованием белка ОВМ, кодируемого ДНК данного изобретения могут проводиться следующие операции скрининга: (1) скрининг веществ, которые могут регулировать экспрессию ОВМ человека, (2) скрининг веществ, которые специфически связываются с ОВМ человека и ингибируют или модифицируют биологическую активность ОВМ, и (3) скрининг белков человека, которые присутствуют в клетках-предшественниках остеокластов и передают (трансдуцируют) биологическую активность ОВМ человека (рецептор ОВМ человека). Можно также создавать антагонисты и агонисты с использованием этого рецептора ОВМ человека. В комбинаторной химии с применением вышеупомянутых ОВМ человека или рецептора ОВМ человека пептидные библиотеки, необходимые для скрининга антагонистов или агонистов, могут быть получены по способу, используемому для скрининга с применением мышиного ОВМ. Посердством скрининга с применением ОВМ человека вместо мышиного ОВМ может быть получен пептид с чрезвычайно высокой специфичностью и аффинностью.
Хотя этот ОВМ является очень ценным, как указано выше, и антитела, специфически узнающие ОВМ, и иммуноферментный анализ с применением этих антител необходимы для определения концентрации ОВМ, до сих пор не были доступны антитела, применимые для оценки концентрации ОВМ. Кроме того, предполагается, что антитела против ОВМ или антитела против sOBM ингибируют биологическую активность ОВМ или sOBM, в частности активность индукции образования остеокластов. Ожидается, что они будут применимы в качестве терапевтических агентов для лечения нарушения костного метаболизма. Однако до сих пор такие антитела не были доступными.
В связи с этой ситуацией авторы данного изобретения провели интенсивные исследования. В результате авторы данного изобретения обнаружили антитела (антитела против ОВМ/sОВМ), которые узнают обе формы ОВМ, мембраносвязанный белок, который специфически связывается с ингибирующим остеокластогенез фактором (OCIF), и растворимый ОВМ (sОВМ), который не имеет трансмембранного домена. Таким образом, данное изобретение обеспечивает антитела (антитела против ОВМ/sОВМ), которые узнают обе формы ОВМ, мембраносвязанный белок, который специфически связывается с ингибирующим остеокластогенез фактором (OCIF), и растворимый ОВМ (sОВМ), который не имеет трансмембранного домена; способ их получения; способ определения концентраций ОВМ и sОВМ при помощи этих антител и агенты для предупреждения или лечения заболеваний, вызываемых нарушением костного метаболизма.
Данное изобретение относится к антителам (антителам против ОВМ/sОВМ), которое узнают обе формы ОВМ, мембраносвязанный белок, который специфически связывается с ингибирующим остеокластогенез фактором (OCIF), и растворимый ОВМ (sОВМ), который не имеет трансмембранного домена; способу их получения; способу количественного определения ОВМ и sОВМ при помощи этих антител и агентам для предупреждения или лечения заболеваний, вызываемых нарушением костного метаболизма.
Антитела данного изобретения проявляют активность нейтрализации усиливающей остеокластогенез активности, которая является биологической активностью ОВМ и зОВМ, и включают антитела, имеющие следующие характеристики:
(a) поликлональные антитела, которые узнают как мышиный ОВМ, так и мышиный sОВМ (поликлональные антитела против мышиного ОВМ/sОВМ,
(b) поликлональные антитела, которые узнают как ОВМ человека, так и sОВМ человека (поликлональные антитела против ОВМ/sОВМ человека),
(c) моноклональные антитела, которые узнают как мышиный ОВМ, так и мышиный sОВМ (моноклональные антитела против мышиного ОВМ/sОВМ),
(d) моноклональные антитела, которые узнают как ОВМ человека, так и sОВМ человека (моноклональные антитела против ОВМ/sОВМ человека), и
(е) моноклональные антитела против ОВМ/sОВМ человека, которые перекрестно реагируют как с мышиным ОВМ, так и с мышиным sОВМ.
Поликлональные антитела, которые узнают как мышиный ОВМ, так и мышиный sОВМ (далее называемые поликлональными антителами против мышиного ОВМ/sОВМ), и поликлональные антитела, которые узнают как ОВМ человека, так и sОВМ человека (далее называемые поликлональными антителами против ОВМ/sОВМ человека), получали согласно следующему способу. Очищенный мышиный ОВМ, используемый в качестве антигена для иммунизации, может быть получен по вышеупомянутому способу. В частности, мышиную остеобластную стромальную клеточную линию ST2 обрабатывали активной формой витамина D3, и ОВМ на клеточной мембране очищали с применением колонки с иммобилизованным OCIF и гель-фильтрационной хроматографии с получением природного ОВМ мыши (нативного ОВМ). Вышеупомянутые кДНК мышиного ОВМ (Таблица последовательностей, SEQ ID №15) или кДНК ОВМ человека (Таблица последовательностей, SEQ ID №12) встраивали в экспрессирующий вектор общепринятыми способами. Рекомбинантный мышиный ОВМ (Таблица последовательностей, SEQ ID №1) и рекомбинантный ОВМ человека (Таблица последовательностей, SEQ ID №11) могут быть получены экспрессией кДНК в клетках животных, таких как клетки СНО, клетки ВНК, Namalwa или клетки COS-7, клетках насекомых или Escherichia coli, и очисткой их с применением вышеупомянутых способов очистки. В этом случае очистка большого количества и высокого уровня мышиного ОВМ или ОВМ человека, которые являются мембраносвязанными белками, является задачей, требующей больших затрат труда. С другой стороны, как упоминалось выше, известно, что ОВМ, который является мембраносвязанным белком, и растворимый ОВМ (sОВМ), который получают делегированием трансмембранного домена ОВМ, являются почти одинаковыми по их активности в дифференцировке и созревании остеокластов. Для иммунизации можно использовать в качестве антигенов мышиный sОВМ и sОВМ человека, которые относительно легко экспрессируются и очищаются до высокого уровня.
Мышиный sОВМ (Таблица последовательностей, SEQ ID №16) и sОВМ человека (Таблица последовательностей, SEQ ID №17) могут быть получены присоединением нуклеотидной последовательности, кодирующей известную сигнальную последовательность, происходящую из другого секретируемого белка, против хода транскрипции от 5'-конца соответственно кДНК мышиного sОВМ (Таблица последовательностей, SEQ ID №18) и кДНК sОВМ человека (Таблица последовательностей, SEQ ID №19), встраиванием их в экспрессирующий вектор с применением способов генной инженерии, созданием условий для экспрессии этих белков в клетках-хозяевах, таких как различные клетки животных, клетки насекомых или Escherichia coil, и очисткой полученных продуктов. Антигены для иммунизации, полученные таким образом, растворяют в забуференном фосфатом солевом растворе (PBS), смешивают с таким же объемом полного адъюванта Фрейнда для эмульгирования раствора, если необходимо, и вводят подкожно животным приблизительно один раз в неделю для иммунизации этих животных несколько раз. Бустер-инъекцию дают при достижении максимального титра антител. Обескровливание проводят через 10 дней после бустер-инъекции. Полученную антисыворотку обрабатывают осаждением при помощи сульфата аммония. Фракцию IgG очищают при помощи анионообменной хроматографии или очищают колоночной хроматографией на колонке с протеин А- или протеин G-сефарозой после разбавления антисыворотки в два раза буфером для связывания (Binding Buffer™, BioRad Co.) с получением поликлональных антител против ОВМ/sОВМ мыши или человека.
Моноклональные антитела данного изобретения могут быть получены по следующему способу. Так же, как и в случае поликлональных антител, природный мышиный ОВМ (нативный ОВМ), рекомбинантный мышиный или человеческий ОВМ или мышиный или человеческий sОВМ могут быть использованы в качестве иммуногенов для получения моноклональных антител. Гибридомы получают в соответствии с общепринятыми способами иммунизацией млекопитающих этими антигенами или иммунизацией лимфоцитов in vitro и слиянием иммунизированных клеток с клетками миеломы. При помощи анализа культурального супернатанта гибридом, полученных таким образом, с применением твердофазного способа ELISA отбирают продуцирующие антитела гибридомы, узнающие высокоочищенный антиген. Полученные гибридомы клонируют и устанавливают в качестве стабильных продуцирующих антитела гибридомных клонов. Эти гибридомы культивируют для получения антител. Для получения гибридом обычно используют небольших животных, таких как мыши или крысы. Животных иммунизируют внутривенной или внутрибрюшинной инъекцией антигена, разведенного до подходящей концентрации подходящим растворителем, таким как физиологический солевой раствор. Антиген можно вводить совместно с полным адъювантом Фрейнда. Инъекции обычно проводят 3-4 раза, один раз в неделю или каждые две недели. Иммунизированных животных вскрывают через три дня после последней иммунизации. В качестве иммунизированных клеток используют спленоциты из удаленной селезенки. В качестве мышиной миеломы для слияния с иммунизированными клетками используют p3/x63-Ag8, р3XUl, NS-1, МРС-11, SP-2/0, FO, Р3×63 Аg8.653 и S194. Клеточную линию, такую как R-210, используют в качестве клеток крысиного происхождения. Антитела человека получают иммунизацией человеческих В-лимфоцитов in vitro и слиянием иммунизированных клеток с клетками миеломы человека или клеточной линии, трансформированной вирусом ЕВ. Слияние иммунизированных клеток и клеток миеломы можно проводить в соответствии с общепринятым способом, таким как способ Кёлера и Мильстейна (Koehler et al.: Nature, 256, 495-497 (1975)). Применим также способ электрических импульсов. Иммунизированные лимфоциты и клетки миеломы смешивают при общепринятом соотношении и сливают в не содержащей фетальной телячьей сыворотки (FCS) культуральной среде с добавлением полиэтилэнгликоля и культивируют в содержащей FCS селектирующей среде ГАТ (среде с гипоксантином-аминоптерином-тимидином) для отбора слитых клеток (гибридом). Затем гибридомы, продуцирующие антитела, отбирали с применением общепринятого способа обнаружения антител, такого как ELISA, способ бляшек, способ Охтерлони или способ агрегации, для установления стабильных гибридом. Гибридомы, установленные таким образом, могут быть субкультивированы общепринятым способом культивирования или могут храниться в замороженном виде, если необходимо. Гибридома может культивироваться общепринятым способом для сбора культурального супернатанта или может имплантироваться в брюшную полость млекопитающего для получения антител из асцитной жидкости. Антитела в культуральном супернатанте или в асцитной жидкости могут быть очищены общепринятым способом, таким как высаливание, ионообменная и гель-фильтрационная хроматография, или протеин А- или протеин С-аффинной хроматографией. Почти все моноклональные антитела, полученные с использованием sОВМ в качестве антигена, могут специфически узнавать не только sCBM, но и также ОВМ (такие антитела называются далее моноклональными антителами против OBM/sOBM). Эти антитела могут быть использованы для количественного определения ОВМ или sОВМ. Количества ОВМ и sОВМ могут быть определены мечением этих антител радиоактивным изотопом и использованием меченых антител в системе для количественного определения, известной как радиоиммуноанализ (РИА) или иммуноферментный анализ (ИФА). С применением этих систем количественного определения количество sОВМ в биологической пробе, такой как кровь или моча, может быть определено с легкостью с высокой чувствительностью. Кроме того, количество ОВМ, связывающегося с тканью или поверхностью клеток, может быть легко измерено с высокой чувствительностью при помощи теста связывания с использованием этих антител.
При использовании антител в качестве лекарственного средства для людей желательно использовать антитела человека против OBM/sOBM человека. Человеческие антитела против OBM/sOBM человека могут быть получены в соответствии со следующими способами (1), (2) или (3). В способе (1) лимфоциты человека, собранные из периферической крови человека или селезенки, иммунизировали антигеном ОВМ человека или sОВМ человека in vitro в присутствии IL-4. Полученные иммунизированные лимфоциты человека сливали с гибридомой К6Н6/В5 (АТСС CRL1823), которая является гетерогибридомой мыши и человека, и подвергали скринингу для получения продуцирующей целевые антитела гибридомы. Антитела, продуцируемые полученными продуцирующими антитела гибридомами, являются человеческими моноклональными антителами против OBM/sOBM человека. Из этих антител отбирают антитела, нейтрализующие активность OBM/sOBM человека. Однако обычно трудно получить антитела, проявляющие высокую аффинность в отношении антигена, способом иммунизации лимфоцитов человека in vitro. Поэтому для получения моноклональных антител с высокой аффинностью в отношении ОВМ и sОВМ человека необходимо увеличить аффинность человеческих моноклональных антител против OBM/sOBM человека, полученных описанным выше способом. Сначала вводят случайную мутацию в район CDR (в частности, в район CDR3) человеческого моноклонального антитела против OBM/sOBM человека, которое нейтрализует ОВМ, но имеет низкую аффинность, и дают фагу экспрессировать белок. Фаги, которые могут сильно связываться с OBM/sOBM человека, отбирают по способу фаговой индикации с использованием чашек, на которых иммобилизованы антигены OBM/sOBM человека. Отобранные фаги выращивают в Escherichia coli. Аминокислотную последовательность CDR, который проявляет высокую аффинность, определяют на основании нуклеотидной последовательности ДНК, клонированной в этом фаге. Полученную таким образом ДНК, кодирующую человеческие моноклональные антитела против ОВМ/sОВМ человека, вводят в обычно используемый экспрессирующий вектор для клеток млекопитающих для получения человеческих моноклональных антител против ОВМ/sОВМ человека. Из этих моноклональных антител могут быть отобраны целевые человеческие моноклональные антитела, проявляющие высокую аффинность и способные нейтрализовать биологическую активность ОВМ/sОВМ человека. В способе (2) моноклональные антитела мышиного типа против ОВМ/sОВМ человека получают по способу данного изобретения с применением мышей BALB/c (Koehler et al.: Nature, 256, 495-49, 1975) и отбирают моноклональные антитела, которые могут нейтрализовать биологическую активность ОВМ/sОВМ человека и проявляют высокую аффинность. Эти высокоаффинные мышиные антитела против ОВМ/sОВМ человека могут быть превращены в антитела человеческого типа при помощи способа CDR-прививки (Winter and Milstein: Nature, 349, 293-299, 1991) путем имплантации их CDR-районов (CDR-1, 2 и 3) в CDR-районы человеческого IgG. В Способе (3) лимфоциты периферической крови человека имплантируют в мышей с тяжелым комбинированным иммунодефицитом (SCID). Поскольку имплантированные имеющие SCID мыши могут продуцировать антитела человека (Моsier D.E. et al.: Nature, 335, 256-259, 1988; Duchosal M.A. et al.: Nature, 355, 258-262, 1992), лимфоциты, которые могут продуцировать человеческие моноклональные антитела, специфические в отношении ОВМ/sОВМ человека, могут быть собраны скринингом имеющих SCID мышей, иммунизированных ОВМ или sОВМ человека. Полученные лимфоциты сливают с гибридомой К6Н6/В5 (АТСС CRL 1823), которая является гетерогибридомой мыши и человека, в соответствии с процедурой, описанной выше для антител человека в способе (1). Полученные гибридомы подвергают скринингу для получения гибридом, которые могут продуцировать целевые человеческие моноклональные антитела. Полученные таким образом гибридомы культивируют с получением больших количеств целевых человеческих моноклональных антител. Эти антитела могут быть очищены описанным выше способом очистки. Кроме того, можно производить рекомбинантные человеческие моноклональные антитела в больших количествах путем конструирования библиотеки кДНК из гибридомы, которая может продуцировать целевые человеческие моноклональные антитела, для получения гена (кДНК), кодирующего целевые человеческие моноклональные антитела, клонированием, встраиванием этого гена в подходящий экспрессирующий вектор способами генной инженерии и экспрессией этих моноклональных антител в клетках-хозяевах, таких как различные клетки животных, клетки насекомых или Escherlchia coli. Большие количества очищенных человеческих моноклональных антител могут быть получены очисткой из полученного культурального супернатанта способами очистки, описанными выше.
Антитела, которые могут нейтрализовать биологическую активность ОВМ/sОВМ, могут быть получены из моноклональных антител против ОВМ/sОВМ, полученных согласно этому способу. Ожидается, что антитела, которые нейтрализуют биологическую активность ОВМ/sОВМ, применимы в качестве средств для лечения или предупреждения нарушения костного метаболизма вследствие их способности ингибировать in vivo биологическую активность ОВМ/sОВМ, в частности способности предотвращать индукцию образования остеокластов. Активность антител против ОВМ/sОВМ в нейтрализации биологической активности ОВМ или sОВМ может быть измерена определением активности ингибирования образования остеокластов в системе in vitro. В частности, может быть приведена следующая система культуры для остеокластогенеза in vitro: (1) система сокультуры штамма мышиных остеобластных стромальных клеток, клеток ST2, и мышиных клеток селезенки в присутствии активной формы витамина D3 и дексаметазона, (2) система сокультуры, содержащей экспрессирующий ОВМ штамм почечных клеток обезьяны COS-7, иммобилизации экспрессирующих ОВМ клеток формальдегидом и культивирования мышиных клеток селезенки на этих клетках в присутствии M-CSF и (3) система культуры мышиных клеток селезенки в присутствии рекомбинантного sОВМ и M-CSF. Ингибирующая остеокластогенез активность антител против ОВМ/sОВМ может быть измерена добавлением антител против ОВМ/sОВМ при различных концентрациях к этим культуральным системам и исследованием их действий на образование остеокластов. Ингибирующая остеокластогенез активность антител против ОВМ/sОВМ может быть также оценена измерением их ингибирующей резорбцию костей активности с использованием экспериментальных животных in vivo. В частности, модель животного, подвергнутого овариэктомии, дается в качестве модели животного с прогрессирующим образованием остеокластов. Ингибирующая остеокластогенез активность антител против ОВМ/sОВМ может быть определена введением антител против ОВМ/sОВМ таким экспериментальным животным и оценкой ингибирования резорбции костей (увеличивающей плотность костей активности).
Полученные таким образом антитела, способные нейтрализовать биологическую активность ОВМ/sОВМ, применимы, в частности, в фармацевтических композициях для предупреждения или лечения нарушений костного метаболизма или в качестве антител для иммунологического диагноза таких заболеваний. Препараты, содержащие антитела данного изобретения, могут вводиться перорально или не перорально. Такие препараты могут безопасно вводиться людям или животным в виде фармацевтических композиций, которые содержат антитела, узнающие ОВМ и/или sОВМ, в качестве активного компонента. В качестве форм фармацевтической композиции приводятся агенты для инъекций, в том числе для внутривенного капельного вливания, суппозитории, подъязычные агенты, чрескожные абсорбционные агенты и т.п. Поскольку моноклональные антитела являются макромолекулярными белками, они не только легко прилипают к стеклянному контейнеру, такому как флакон или шприц, но также легко денатурируются физико-химическими факторами, такими как нагревание, рН или влажность. Поэтому препараты должны быть стабилизированы добавлением стабилизаторов, корректоров рН, буферящих агентов, солюбилизирующих агентов или детергентов. В качестве стабилизаторов могут быть приведены аминокислоты, такие как глицин и аланин, сахариды, такие как декстран 40 и манноза, и сахароспирты, такие как сорбит, маннит и ксилит. Эти стабилизаторы могут быть использованы по отдельности или в сочетаниях из двух или более. Количество добавляемых стабилизаторов предпочтительно в 0,01-100 раз, особенно предпочтительно в 0,1-10 раз, больше количества антитела. Добавление этих стабилизаторов увеличивает стабильность при хранении жидких препаратов или их лиофилизированных продуктов. В качестве примеров забуферивающих агентов приводятся фосфатные буферы и цитратные буферы. Забуферивающие агенты не только корректируют рН жидких препаратов или водных растворов, полученных перерастворением их лиофилизированных продуктов, но также увеличивают стабильность и растворимость антител. Желательно добавлять забуферивающий агент в количестве для получения 1 - 10 мМ конечной концентрации в жидком препарате или водном растворе, приготовленном из лиофилизированного продукта. Примерами детергента являются Polysolbate 20, Pulluronic F-68 и полиэтиленгликоль. Особенно предпочтительным примером является Polysolbate 80. Эти детергенты могут использоваться отдельно или в сочетаниях из двух или более детергентов. Макромолекулярные белки, такие как антитела, легко прилипают к стеклянным контейнерам. Прилипание к контейнерам антител в жидком препарате или в водном растворе, приготовленном повторным растворением лиофилизированного продукта, может быть предотвращено добавлением таких детергентов в концентрации от 0,001 до 1%. Препараты, содержащие антитела данного изобретения, могут быть получены добавлением стабилизаторов, забуферивающих агентов или агентов, которые предотвращают адсорбцию. При использовании этих препаратов в качестве инъекционных агентов для лекарственного лечения или для животных такие инъекционные агенты должны иметь коэффициент осмотического давления 1-2. Коэффициент осмотического давления может корректироваться увеличением или уменьшением количества хлорида натрия при приготовлении препаратов. Количество антител в препарате может подходящим образом корректироваться в зависимости от заболевания, пути введения и т.п. Доза антител человека для людей может изменяться в зависимости от аффинности антител в отношении OBM/sOBM человека, в частности от константы диссоциации (величины Kd) для OBM/sOBM человека. Чем выше аффинность (или чем ниже величина Kd), тем меньше должна быть доза, вводимая человеку, для получения определенного целебного эффекта. Поскольку антитела человеческого типа имеют продолжительный период полувыведения в крови (приблизительно 20 дней), достаточно вводить их людям в дозе ~0,1-100 мг/кг один раз или несколько раз в 1-30-дневном периоде времени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 показывает результат электрофореза в SDS-ПААГ мышиного белка ОВМ данного изобретения, полученного в Примере 3.
Объяснение символов
(А): Дорожка 1: маркеры молекулярных масс.
Дорожка 2: частично очищенная проба (элюированная фракция Gly-HCl (pH 2,0)), полученная из клеток ST2, культивируемых в присутствии активной формы витамина D3 и дексаметазона.
Дорожка 3: частично очищенная проба (элюированная фракция Gly-HCl (pH 2,0)), полученная в отсутствие активной формы витамина D3 и дексаметазона.
(В): Дорожка 1: маркеры молекулярных масс.
Дорожка 2: мышиный белок ОВМ данного изобретения после очистки жидкостной хроматографией высокого разрешения с обращенной фазой (Пример 3).
Фиг.2 показывает результат анализа связывания 125I-меченого OCIF с остеобластными стромальными клетками ST2 в Примере 4.
Фиг.3 показывает способность образования остеокластов остеобластных стромальных клеток ST2 из различных генераций в Примере 5(1).
Объяснение символов
1: способность клеток ST2 из ~10-ой субкультуры к поддержанию образования остеокластов.
2: способности клеток ST2 из ~40-ой субкультуры к поддержанию образования остеокластов.
Фиг.4 показывает изменение с прохождением времени в экспрессии белка данного изобретения на клеточной мембране остеобластных стромальных клеток, культивируемых в присутствии активной формы витамина D3 и дексаметазона в Примере 5(2).
Фиг.5 показывает изменение с прохождением времени в образовании остеокластов в системе сокультуры Примера 5(2).
Фиг.6 показывает ингибирующее действие образования остеокластов при обработке OCIF в течение различных периодов культуры во время периода сокультивирования в Примере 5(3).
Фиг.7 показывает результаты теста сшивания 125I-меченого OCIF с белком данного изобретения в Примере 6.
Объяснение символов
Дорожка 1: 125I-меченый OCIF-CDD1.
Дорожка 2: 125I-меченый OCIF-CDD1, сшитый с клетками ST2.
Дорожка 3: 125I-меченый OCIF-CDD1, сшитый в присутствии 400-кратного избытка немеченого OCIF.
Фиг.8 показывает результат электрофореза в SDS-ПААГ в Примере 9.
Объяснение символов
Дорожка 1: белки трансфецированных плазмидой рОВМ291 клеток COS-7, иммунопреципитированные в отсутствие OCIF.
Дорожка 2: белки трансфецированных плазмидой рОВМ291 клеток COS-7, иммунопреципитированные в присутствии OCIF.
Фиг.9 показывает результаты анализа способности связывания 125I-меченого OCIF с клетками COS-7, трансфецированными рОВМ291, в Примере 10.
Объяснение символов
Дорожки 1 и 2: количество 125I-меченого OCIF, связывающегося с клетками COS-7, трансфецированными рОВМ291.
Дорожки 3 и 4: количество 125I-меченого OCIF, связывающегося с клетками COS-7, трансфецированными рОВМ291, в присутствии 400-кратного избытка немеченого OCIF.
Фиг.10 показывает результат теста сшивания с использованием OCIF, меченого 125I, в Примере 11.
Объяснение символов
Дорожка 1: 125I-меченый OCIF.
Дорожка 2: 125I-меченый OCIF, сшитый с клетками COS-7, трансфецированными рОВМ291.
Дорожка 3: 125I-меченый OCIF, сшитый с клетками COS-7, трансфецированными рОВМ291, в присутствии 400-кратного избытка немеченого OCIF.
Фиг.11 показывает результат Нозерн-блоттинга в Примере 12.
Оъяснение символов
Дорожка 1: РНК, происходящая из клеток ST2, культивируемых без добавления витамина D и дексаметазона.
Дорожка 2: РНК, происходящая из клеток ST2, культивируемых с
добавлением витамина D и дексаметазона
Фиг.12 показывает OCIF-связывающую способность белков в кондиционированной среде при различных концентрациях OCIF в Примере 14 (2).
Объяснение символов
о: рСЕР4.
•: рСЕР sOBM.
Фиг.13 показывает OCIF-связывающую способность белка в кондиционированной среде при различных соотношениях кондиционированной среды в Примере 14 (2).
о: рСЕР4.
•: рСЕР sOBM.
Фиг.14 показывает результат электрофореза в SDS-ПААГ слитого белка, состоящего из тиоредоксина и мышиного ОВМ, экспрессируемого в Escherichia coli в Примере 15(2).
Объяснение символов
Дорожка 1: маркеры молекулярных масс.
Дорожка 2: фракции растворимого белка, происходящие из G1724/pTrxFus.
Дорожка 3: фракции растворимого белка, происходящие из G1724/pTrxOBM25.
Фиг.15 показывает OCIF-связывающую способность при различных соотношениях фракций растворимого белка в Примере 15(3).
Объяснение символов
 : GI724/pTrxFus.
: GI724/pTrxFus.
о: GI724/pTrxOBM25.
Фиг.16 показывает OCIF-связывающую способность фракций растворимого белка (1%) при различных концентрациях OCIF в Примере 14(3).
Объяснение символов
 : GI724/pTrxFus.
: GI724/pTrxFus.
о: GI724/pTrxOBM25.
Фиг.17 показывает результаты ингибирования специфического связывания с OCIF мышиного ОВМ, полученного экспрессией кДНК мышиного ОВМ данного изобретения и очисткой природного OCIF-связывающего белка при помощи кроличьих антител против мышиного ОВМ.
Oбъяснение символов
1: очищенный ОВМ, полученный экспрессией кДНК, в присутствии антитела, ОВМ + 125I-OCIF,
2: природный белок в присутствии антитела + 125I-OCIF,
3: мышиный ОВМ, полученный экспрессией кДНК, в отсутствие антитела, мышиного ОВМ + 125I-OCIF,
4: природный белок в отсутствие антитела + 125I-OCIF,
5: 3 + немеченый OCIF (в 400 раз больше, чем 125I-OCIF),
6: 4 + немеченый OCIF (в 400 раз больше, чем 125I-CCIF).
Фиг.18 показывает результат электрофореза в SDS-ПААГ белка ОВМ человека, экспрессируемого кДНК данного изобретения.
Oбъяснение символов
Дорожка 1: маркеры молекулярных масс.
Дорожка 2: белки клеток COS-7, трансфецированных phOBM (экспрессирующим вектором, содержащим кДНК данного изобретения), иммунопреципитированные кроличьими поликлональными антителами против OCIF, в отсутствие OCIF.
Дорожка 3: белки клеток COS-7, трансфецированных phOBM (экспрессирующим вектором, содержащим кДНК данного изобретения), иммунопреципитированные кроличьими поликлональными антителами против OCIF, в присутствии OCIF.
Фиг.19 показывает результат анализа связывания OCIF с клетками COS-7, трансфецированными phOBM, экспрессирующим вектором, содержащим кДНК данного изобретения.
Oбъяснение символов
Дорожка 1: клетки COS-7, трансфецированные phOBM, и добавление 125I-OCIF.
Дорожка 2: клетки COS-7, трансфецированные phOBM, и добавление 125I-OCIF, в присутствии 400-кратного избытка немеченого OCIF.
Фиг.20 показывает результат сшивания ОВМ человека, который является белком, кодируемым кДНК данного изобретения, с 125I-OCIF (мономерного типа).
Объяснение символов
Дорожка 1: 125I-OCIF.
Дорожка 2: сшитые продукты 125I-OCIF с белками на мембране клеток COS-7, трансфецированных phOBM.
Дорожка 3: сшитые продукты 125I-OCIF с белками на мембране клеток COS-7, трансфецированных phOBM, в присутствии 400-кратного избытка немеченого OCIF.
Фиг.21 показывает OCIF-связывающую способность белка (секретируемой формы ОВМ человека (hOBM)) в кондиционированной среде при различных концентрациях OCIF в Примере 24 (2).
Oбъяснение символов
о: кондиционированная среда клеток 293-EBNA, трансфецированных рСЕР4, которая не содержит кДНК, кодирующей секретируемую форму ОВМ человека.
•: кондиционированная среда клеток 293-EBNA, трансфецированных pCEPshOBM, которая содержит кДНК, кодирующую секретируемую форму ОВМ человека.
Фиг.22 показывает OCIF-связывающую способность белка (секретируемой формы ОВМ человека) в кондиционированной среде при определенной концентрации OCIF и при меняющемся количестве добавляемой кондиционированной среды в Примере 24 (2).
Объяснение символов
о: кондиционированная среда клеток 293-EBNA, трансфецированных рСЕР4, которая не содержит кДНК, кодирующей секретируемую форму ОВМ человека.
•: кондиционированная среда клеток 293-EBNA, трансфецированных pCEPshOBM, которая содержит кДНК, кодирующую секретируемую форму ОВМ человека.
Фиг.23 показывает результат электрофореза в SDS-ПААГ слитого белка, состоящего из тиоредоксина и ОВМ человека, экспрессируемого в Escherichia coli.
Oбъяснение символов
Дорожка 1: маркеры молекулярных масс.
Дорожка 2: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxFus.
Дорожка 3: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxhOBM.
Фиг.24 показывает OCIF-связывающую способность слитого белка, состоящего из тиоредоксина и ОВМ человека, с OCIF при варьировании количества фракции растворимого белка, происходящего из Escherichia coli, включающего добавленный слитый белок, в Примере 25 (3).
Объяснение символов
о: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxFus.
•: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxshOBM.
Фиг.25 показывает OCIF-связывающую способность слитого белка, состоящего из тиоредоксина и ОВМ человека, во фракциях растворимого белка, происходящего из Escherichia coli, с OCIF в различных концентрациях в Примере 25(3).
Объяснение сммволов
о: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxFus.
•: фракции растворимого белка, происходящие из Escherichia coli GI724/pTrxshOBM.
Фиг.26 показывает результат количественного определения ОВМ человека и sOBM человека при помощи сэндвич-метода ELISA с использованием кроличьих поликлональных антител против OBM/sOBM человека данного изобретения.
Oбъяснение символов
 : ОВМ человека.
: ОВМ человека.
•: sOBM человека.
Фиг.27 показывает результат количественного определения ОВМ человека и sOBM человека при помощи сэндвич-метода ELISA с использованием кроличьих моноклональных антител против OBM/sOBM человека данного изобретения.
Объяснение символов
 : ОВМ человека.
: ОВМ человека.
•: sOBM человека.
Фиг.28 показывает результат количественного определения мышиных ОВМ и sOBM при помощи сэндвич-метода ELISA с использованием моноклональных антител против OBM/sOBM человека данного изобретения, которые перекрестно реагируют с мышиными ОВМ и sOBM.
Oбъяснение символов
 : Мышиный ОВМ.
: Мышиный ОВМ.
•: Мышиный sOBM.
Фиг.29 показывает активность слитого белка, состоящего из тиоредоксина и мышиного ОВМ, в стимуляции образования остеокластподобных клеток человека.
Фиг.30 показывает ингибирование антителами против OBM/sOBM активности резорбции костей, стимулируемой витамином D3.
Фиг.31 показывает ингибирование антителами против OBM/sOBM активности резорбции костей, стимулируемой простагландином Е2 (PGE2).
Фиг.32 показывает ингибирование антителами против OBM/sOBM активности резорбции костей, стимулируемой паратиреоидным гормоном (РТН).
Фиг.33 показывает ингибирование антителами против OBM/sOBM активности резорбции костей, стимулируемой интерлейкином 1α (IL-1).
НАИЛУЧШИЙ СПОСОБ ПРОВЕДЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение будет описано более подробно при помощи примеров, которые приведены с целью иллюстрации данного изобретения и не ограничивают его каким-либо образом в остальном описании.
Пример 1
Получение белка данного изобретения
(1) Крупномасштабное культивирование клеток ST2
Мышиную линию остеобластных стромальных клеток ST2 (RIKEN CELL BANK RCB0224) культивировали с использованием среды α-МЕМ, содержащей 10% фетальную телячью сыворотку. Клетки ST2, культивированные до конфлюентности в Т-колбе 225 см2 для культуры прикрепленных клеток, обрабатывали трипсином и собирали из Т-колбы. После промывания клетки переносили в пять Т-колб 225 см2. После добавления 60 мл α-МЕМ, содержащей 10-8 М активную Форму витамина D3 (Calcitriol), 10-7 М дексаметазон и 10% фетальную телячью сыворотку, клетки в каждой колбе культивировали в течение 7-10 дней в СО2-термостате. Культивированные клетки ST2 собирали клеточным "скребком" и хранили при -80°С до использования.
(2) Получение мембранной фракции и солюбилизация мембраносвязанных белков
К клеткам ST2 (объем ~12 мл), описанным в Примере 1(1), культивируемым с применением восьмидесяти Т-колб 225 см2, добавляли три объема (36 мл), 10 мМ Трис-НС1-буфера (рН 7,2), содержащего ингибиторы протеаз (2 мМ APMSFP, 2 мМ ЭДТА, 2 мМ о-фенантролин, 1 мМ лейпептин, 1 мкг/мл пепстатина А и 100 единиц/мл апротинина). После энергичного перемешивания в течение 30 секунд при помощи voltex-миксера клетки оставляли на 10 минут на льду. Клетки гомогенизировали при помощи гомогенизатора (DOUNCE TISSUE GRINDER, A syringe, WHEATON SCIENTIFIC Co.). Равный объем (48 мл) 10 мМ Трис-НСl-буфера (рН 7,2), содержащего вышеуказанные ингибиторы протеаз, 0,5 М сахарозу, 0,1 М хлорид калия, 10 мМ хлорид магния и 2 мМ хлорид кальция, добавляли к гомогенизированным клеткам. После перемешивания смесь центрифугировали при 600 × g в течение 10 минут при 4°С с отделением ядер и негомогенизированных клеток в виде осадка. Супернатант, полученный при центрифугировании, центрифугировали при 150000 × g в течение 90 минут при 4°С с получением фракции мембран клеток ST2 в виде осадка. 8 мл 10 мМ Трис-НСl-буфера (рН 7,2), содержащего те же ингибиторы протеаз, 150 мМ хлорид натрия и 0,1 М сахарозу, добавляли к этой фракции мембран. После добавления 200 мкл 20% CHAPS (3-[(3-холамидопропил)диметиламонио]-1-пропансульфонат, Sigma Co.) смесь перемешивали в течение 2 часов при 4°С. Затем смесь центрифугировали при 150000 × g в течение 60 минут при 4°С с получением супернатанта в качестве солюбилизированной мембранной фракции.
Пример 2
Очистка белка данного изобретения
(1) Приготовление аффинной колонки с иммобилизованным OCIF
После замены изопропанола в HiTrap NHS-активированной колонке (1 мл, изготовленной Pharmacia Co.) 1 мМ соляной кислотой в колонку добавляли шприцем (5 мл, изготовленным Теrumo Corp.) 1 мл раствора 0,2 М NаНСО3/0,5 М NaCl (pH 8,3), содержащего 13,0 мг рекомбинантного OCIF, полученного по способу WO 96/26217, для выполнения реакции связывания при комнатной температуре в течение 30 минут. В колонку подавали 3 мл смеси 0,5 М этаноламин/0,5 М NaCl (pH 8,3) и 3 мл смеси 0,1 М уксусная кислота/0,5 М NaCl (pH 4,0) три раза поочередно для инактивации избыточных активных групп, затем этот раствор заменяли смесью 0,5 М этаноламин/0,5 М NaCl (pH 8,3). После оставления при комнатной температуре на 1 час колонку промывали дважды попеременно смесью 0,5 М этаноламин/0,5 М NaCl (pH 8,3) и смесью 0,1 М уксусная кислота/0,5 М NaCl (pH 4,0) и этот раствор заменяли затем буфером 50 мМ Трис/1 М NaCl/0,1% CHAPS (pH 7,5).
(2) Очистка белка данного изобретения при помощи аффинной колонки с иммобилизованным OCIF
Очистку OCIF-связывающего белка проводили при 4°С, если нет других указаний. Описанную выше колонку с иммобилизованным OCIF уравновешивали 10 мМ Трис-НСl-буфером (pH 7,2), к которому добавляли ингибиторы протеаз, описанные в Примере 1(2), 0,15 М хлорид натрия и 0,5% CHAPS. Приблизительно 8 мл солюбилизированной мембранной фракции, описанной в Примере 1(2), наносили на колонку при скорости тока 0,01 мл/мин. Затем колонку промывали 10 мМ буфером Трис-НСl (рН 7,2), к которому были добавлены вышеуказанные ингибиторы протеаз, 0,15 М хлорид натрия и 0,5% CHAPS, в течение 100 минут при скорости тока 0,5 мл/мин. Затем белки, адсорбированные на колонке, элюировали 0,1 М глицин-гидрохлоридным буфером (рН 3,3), содержащим ингибиторы протеаз, 0,2 М хлорид натрия и 0,5% CHAPS, в течение 50 минут при скорости тока 0,1 мл/мин. Таким же образом белки, адсорбированные на колонке, элюировали 0,1 М содержащим цитрат натрия буфером (рН 2,0), содержащим ингибиторы протеаз, 0,2 М хлорид натрия и 0,5% CHAPS, в течение 50 минут при скорости тока 0,1 мл/мин. Элюат собирали в виде фракций по 0,5 мл. Каждую фракцию сразу же нейтрализовали добавлением 2 М раствора Триса. Фракции, полученные из элюции этими буферами (каждая фракция состояла из 1,0-5,0 мл элюата), концентрировали до 50-100 мкл при помощи Centricon-10 (производимого Amicon USA). OCIF добавляли к части каждой сконцентрированной фракции и иммунопреципитировали поликлональными антителами против OCIF. Преципитированные фракции обрабатывали SDS и подвергали электрофорезу на SDS-ПААГ. Фракции (номера фракций 3-10), в которых появлялась полоса белка со специфической связывающей способностью в отношении OCIF, рассматривали как фракции белка данного изобретения.
(3) Очистка белка данного изобретения гель-фильтрацией
Сконцентрированный OCIF-связывающий белок (фракции, полученные элюцией 0,1 М глицин-гидрохлоридным буфером (рН 3,3) и содержащим 0,1 М цитрат натрия буфером (рН 2,0), полученный в Примере 2(2), наносили на колонку Superose 12 HR10/30 (1,0×30 см, производимую Phamacia Co.), которая была уравновешена 10 мМ Трис-HCl, 0,5 М NaCl, 0,5% CHAPS (pH 7,0), и использовали в качестве подвижной фазы буфер для уравновешивания при скорости тока 0,5 мл/мин, и собирали фракции по 0,5 мл. Фракции, содержащие белок данного изобретения (номера фракций 27-32), идентифицировали в соответствии со способом, описанным выше. Каждую из фракций концентрировали при помощи Centricon-10 (производимого Amicon).
(4) Очистка высокоэффективной жидкостной хроматографией с обращенной фазой
Вышеупомянутый OCIF-связывающий белок, очищенный гель-фильтрацией, наносили на колонку С4 (2,1×250 мм, Vydac, USA), которая была уравновешена 0,1% трифторуксусной кислотой (TFA) и 30% ацетонитрилом. Белки, связанные с колонкой, элюировали линейными градиентами ацетонитрила от 30 до 55% в течение первых 50 минут и от 55 до 80% в течение следующих 10 минут при скорости тока 0,2 мл/мин. Пики элюированных белков детектировали измерением оптической плотности при 215 нм. Белки в различных пиках анализировали для идентификации фракций, содержащих белок данного изобретения, и получали высокоочищенный белок данного изобретения.
Пример 3
Электрофорез в SDS-ПААГ очищенного белка данного изобретения
Фракцию солюбилизированных мембран, полученную из клеток ST2, которые культивировали в присутствии или в отсутствие активной формы витамина D3, подвергали очистке с использованием аффинной колонки с иммобилизованным OCIF. Очищенные препараты подвергали электрофорезу в SDS-ПААГ. Как показано на Фиг.1 (А), основную белковую полосу с молекулярной массой (MW) -30000-40000 детектировали только в очищенном препарате из клеток ST2, которые культивировали в присутствии активной формы витамина D3, что подтверждает, что белок, который специфически связывается с OCIF (т.е. белок данного изобретения) может быть селективно очищен аффинной колонкой с иммобилизованным OCIF. Однако полосы нескольких белков (иных, чем белок данного изобретения), которые неспецифически связываются с носителями или спейсерами колонки с иммобилизованным OCIF, были обнаружены в обоих очищенных препаратах. Белки, иные, чем белок данного изобретения, удалялись в соответствии с вышеописанным способом гель-фильтрацией и хроматографией с обращенной фазой на колонке С4. Электрофорез в SDS-ПААГ полученного высокоочищенного белка данного изобретения показан на Фиг.1(В). Было обнаружено, что высокоочищенный белок данного изобретения является электрофоретически гомогенным и имеет молекулярную массу приблизительно 30000-40000.
Пример 4
Тест связывания OCIF с остеобластами
(1) Получение 125I-меченого OCIF
OCIF метили 125I при помощи Иодоген-метода. Конкретно, 20 мкл 2,5 мг/мл раствора Иодоген-хлороформ переносили в пробирку Эппендорфа на 1,5 мл и хлороформ выпаривали при 40°С с получением пробирки, покрытой Иодогеном. Пробирку промывали три раза 400 мкл содержащего 0,5 М фосфат натрия буфера (Na-Pi, рН 7,0). 5 мкл 0,5 М Na-Pi (pH 7,0) добавляли в каждую пробирку. Сразу же после этого добавления в пробирку добавляли 1,3 мкл (18,5 МБк) раствора Na-125I (NEZ-033H20, производимого Amersham Co.), 10 мкл 1 мг/мл раствора rOCIF (мономерного или димерного типа). После смешивания vortex миксером смеси давали стоять при комнатной температуре в течение 30 секунд. Раствор переносили в пробирку, содержащую 80 мкл раствора 10 мг/мл иодида калия в 0,5 М Na-Pi (рН 7,0) и 5 мкл забуференного фосфатом солевого раствора, содержащего 5% бычий сывороточный альбумин, и перемешивали. Смесь наносили на ротационную колонку (1 мл, G-25 fine, производимый Pharmacia Co.), которая была уравновешена забуференным фосфатом солевым раствором, содержащим 0,25% бычий сывороточный альбумин, и колонку центрифугировали в течение 5 минут при 2000 об/мин. 400 мкл забуференного фосфатом солевого раствора, содержащего 0,25% бычий сывороточный альбумин, добавляли к фракции, элюированной из этой колонки, и смесь перемешивали. Аликвоту 2 мкл брали для измерения радиоактивности при помощи гамма-счетчика. Радиохимическую чистоту 125I-меченого OCIF определяли измерением радиоактивности, осажденной 10% ТХУ. Биологическую активность 125I-меченого OCIF измеряли в соответствии со способом, описанным в WO 96/26217. Концентрацию 125I-меченого OCIF измеряли при помощи ELISA в соответствии со следующей процедурой.
(2) Измерение концентрации 125I-меченого OCIF при помощи ELISA
100 мкл 50 мМ NаНСО3 (рН 9,6), в котором были растворены кроличьи поликлональные антитела против OCIF, описанные в WO 96/26217, до концентрации 2 мкг/мл, добавляли в каждую лунку 96-луночного иммунопланшета (MaxiSorp™, производимого Nunc Co.). Планшету давали стоять в течение ночи при 4°С. После удаления раствора отсасыванием в каждую лунку добавляли 300 мкл Block Асе™ (Snow Brand Milk Products Co., Ltd.), забуференного фосфатом солевого раствора (25/75). Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием лунки промывали три раза забуференным фосфатом солевым раствором, содержащим 0,01% Polysorbate 80 (P-PBS). Затем в каждую лунку добавляли 300 мкл Block Асе™, забуференного фосфатом солевого раствора (25/73), с которым был смешан 125I-меченый OCIF или стандартный препарат OCIF. Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием каждую лунку промывали шесть раз 200 мкл P-PBS.
100 мкл Block Асе™ (Snow Brand Milk Products Co., Ltd.), забуференного фосфатом солевого раствора (25/75), содержащего меченые пероксидазой кроличьи поликлональные антитела против OCIF, добавляли в каждую лунку. Планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием лунки промывали шесть раз 200 мкл P-PBS. Затем в каждую лунку добавляли 100 мкл раствора ТМВ (ТМВ Soluble Reagent, High Sensitivity, Scytek Co.). После инкубирования при комнатной температуре в течение 2-3 минут в каждую лунку добавляли 100 мкл останавливающего раствора (стоп-раствора) (Stopping Reagent, Scytek Co.). Поглощение каждой лунки измеряли при 490 нм с применением микропланшет-ридера. Концентрацию 125I-меченого OCIF определяли из калибровочной кривой, построенной с применением стандартного препарата OCIF.
(3) Тест связывания OCIF с остеобластами или клетками селезенки
Линию мышиных остеобластных стромальных клеток ST2 или клетки селезенки суспендировали в α-МЕМ, содержащей 10% фетальную телячью сыворотку (FCS) с 10-8 M активной формой витамина D3 (Calcitriol) и 10-7 М дексаметазоном или без них, до концентрации 4×104 клеток/мл (ST2-клеток) или 2×106 клеток/мл (клеток селезенки) соответственно. Каждую клеточную суспензию инокулировали в 24-луночный микропланшет. Клетки культивировали в течение 4 дней в СО2-термостате. После промывания клеток α-МЕМ, к каждой лунке добавляли 200 мкл среды для теста связывания (α-МЕМ, к которой были добавлены 0,2% бычий сывороточный альбумин, 20 мМ HEPES-буфер и 0,2% NaN3), содержащей 20 нг/мл вышеописанного 125I-меченого OCIF (мономерной формы или димерной формы). К лункам для неспецифического связывания добавляли 200 мкл среды для теста связывания, содержащей 8 мкг/мл rOCIF (400-кратной концентрации), кроме 20 нг/мл 125I-меченого OCIF. Клетки культивировали в течение 1 часа в СО2-термостате и промывали 3 раза 1 мл забуференного фосфатом солевого раствора. В этой процедуре клетки селезенки промывали центрифугированием 24-луночного планшета в каждой стадии промывания, поскольку клетки селезенки не были прикрепленными. После промывания в каждую лунку добавляли 500 мкл 0,1 н. NaOH и планшету давали стоять в течение 10 минут при комнатной температуре для растворения клеток. Количество RI в каждой лунке измеряли в гамма-счетчике.
Как показано на Фиг.2, 125I-меченый OCIF не связывался с культивируемыми клетками селезенки, но специфически связывался только с остеобластными стромальными клетками, которые культивировали в присутствии активной формы витамина D3. Эти результаты свидетельствуют о том, что белок данного изобретения является мембраносвязанным белком, индуцируемым активной формой витамина D3 и дексаметазоном на остеобластных стромальных клетках.
Пример 5
Биологическая активность белка данного изобретения
(1) Образование остеокластов, поддерживаемое остеобластными стромальными клетками
Способность поддержания образования остеокластов остеобластных стромальных клеток оценивали измерением устойчивой к винной кислоте фосфатазной активности (TRAP-активности) образовавшихся остеокластов. В частности, клетки селезенки (2×105 клеток/100 мкл/лунку) из мыши ddy (8-12-недельного возраста) и мышиные остеобластные стромальные клетки ST2 (5×103 клеток/100 мкл/лунку) суспендировали в α-МЕМ, к которой были добавлены 10-8 М активная форма витамина D3, 10-7 M дексаметаэон и 10% фетальная телячья сыворотка. Клетки инокулировали в 96-луночные планшеты и культивировали в течение 1 недели в СO2-термостате. После промывания каждой лунки забуференным фосфатом солевым раствором в каждую лунку добавляли 100 мкл смеси этанол/ацетон (1:1) и клетки иммобилизовали при комнатной температуре в течение 1 минуты. После иммобилизации в каждую лунку добавляли 100 мкл 50 мМ цитратного буфера (рН 4,5), содержащего 5,5 мМ п-нитрофенилфосфат и 10 мМ тартрат натрия. После 15 минут реакции при комнатной температуре в каждую лунку добавляли 0,1 н. раствор NaOH и измеряли поглощение при 405 нм при помощи микропланшет-ридера. Результаты образования остеокластов клетками ST2 с числом пассажей приблизительно 10 или 40 после получения этих клеток из RIKEN CELL BANK показаны на Фиг.3. Эти результаты свидетельствуют о том, что клетки ST2 с более высоким числом пассажей проявляют более высокую способность поддержания образования остеокластов.
(2) Временной ход изменения экспрессии белка данного изобретения на мембране остеобластных стромальных клеток в культуральной системе, включающей активную форму витамина D3 и дексаметазон, и временной ход изменения образования остеокластов в системе сокультуры
Так же, как в Примере 4(3), остеобластные стромальные клетки ST2 культивировали в течение 7 дней в присутствии активной формы витамина D3 и дексаметазона. Тест связывания OCIF проводили с использованием 125I-меченого OCIF (мономерного типа), как описано в эксперименте Примера 4(1). Неспецифическое связывание измеряли конкуренцией связывания 125I-OCIF с клетками ST2 с 400-кратной концентрацией немеченого OCIF. В результате было подтверждено, что величина специфического связывания 125I-меченого OCIF увеличивается соответственно увеличению культурального периода в присутствии активной формы витамина D3 и дексаметазона. В частности, как показано на Фиг.4 и 5, белок данного изобретения экспрессировался на поверхности клеток ST2 под действием активной формы витамина D3 соответственно увеличению культурального периода и экспрессия достигала максимума на 4-й день культивирования. С другой стороны, при сокультивировании мышиных клеток селезенки и клеток ST2 в присутствии активной формы витамина D3 образуются остеокластподобные клетки. TRAP (маркерный фермент остеокластов)-позитивные мононуклеарные преостеокластподобные клетки образуются на третий или четвертый день культуры. Более дифференцированные и зрелые TRAP-позитивные многоядерные клетки образуются на пятый-шестой день культуры. Таким образом, была продемонстрирована хорошая корреляция между временным ходом экспрессии белка данного изобретения и образованием остеокластов.
(3) Ингибирование образования остеокластов обработкой OCIF в различные периоды сокультуры
Для того чтобы ясно показать, что белок данного изобретения является фактором, участвующим в образовании остеокластов, клетки обрабатывали 100 мг/мл OCIF во время различных периодов культуры на протяжении шестидневного периода сокультивирования, описанного в приведенном выше Примере 5(2) (два последовательных дня в шестидневном периоде, за исключением 5-го дня, для которого применяли однодневный период). В результате, как показано на Фиг.6, было обнаружено, что обработка OCIF при 48-96 часах после начала культивирования, когда экспрессия белка данного изобретения на клетках ST2 является максимальной, была наиболее эффективной для ингибирования образования остеокластов. В частности, было подтверждено, что OCIF регулирует образование остеокластов путем связывания с клетками ST2 через белок данного изобретения.
На основании результатов приведенных выше экспериментов было подтверждено, что белок данного изобретения индуцируется на клеточной мембране остеобластных стромальных клеток активной формой витамина D3 и дексаметазоном и проявляет биологическую активность поддержания или ускорения дифференцировки или созревания остеокластов.
Пример 6
Тест сшивания для 125I-меченого OCIF и белка данного изобретения
Для более ясной идентификации белка данного изобретения этот белок сшивали с 125I-меченым OCIF. Линию мышиных остеобластных стромальных клеток ST2 культивировали в течение 4 дней в присутствии или в отсутствие активной формы витамина D3 и дексаметазона, как описано в Примере 4(3). После промывания клеток 1 мл забуференного фосфатом солевого раствора, добавляли 200 мкл среды для теста связывания (α-МЕМ, к которой были добавлены 0,2% бычий сывороточный альбумин, 20 мМ НЕРЕS-буфер, 0,2% NаN3 и 100 мкг/мл гепарина), содержащей 25 нг/мл 125I-меченого OCIF (мономерного типа) или 40 нг/мл 125I-меченого OCIF-CDD1, который получали экспрессией белка SEQ ID №76 (WO 96/26217) в клетках животного. Вышеописанную культуральную среду для теста связывания дополняли также 400-кратной концентрацией OCIF и добавляли в другие лунки для оценки неспецифического связывания. После культивирования в течение 1 часа в СО2-термостате каждую лунку промывали трижды 1 мл забуференного фосфатом солевого раствора, содержащего 100 мкг/мл гепарина. 500 мкл забуференного фосфатом солевого раствора, содержащего 100 мкг/мл сшивающего агента, DSS (дисукцинимидилсуберата, Pierce Co.), добавляли в каждую лунку и планшет выдерживали в течение 10 минут при 0°С. Лунки промывали дважды 1 мл забуференного фосфатом солевого раствора при 0°С. Затем в лунки добавляли 100 мкл 20 мМ HEPES-буфера, содержащего 1% Тритон Х-100, 10 мкМ пепстатин, 10 мкМ лейпептин, 2 мМ PMSF (фенилметилсульфонилфторид), 10 мкМ антипаин и 2 мМ ЭДТА. Планшету давали стоять в течение 30 минут при комнатной температуре для растворения клеток. 15 мкл этих проб обрабатывали ДСН в невосстанавливающих условиях в соответствии с общепринятым способом и подвергали электрофорезу в SDS-ПААГ (4-20% градиенте полиакриламида, производимом Daiichi Chemical Co., Ltd.). После электрофореза гели сушили и экспонировали на пленке BioMax MS (производимой Kodak) в течение 24 часов при -80°С с использованием интенсифицирующих экранов BioMax MS (производимых Kodak). После экспонирования пленку проявляли общепринятым способом. При использовании 125I-меченого OCIF (мономерного типа, 60 кДа) обнаруживали полосу сшитого продукта с молекулярной массой 90000-110000. При использовании 125I-меченого OCIF-CDD1 (31 кДа) обнаруживали полосу сшитого продукта ~70-80 кДа (среднее 78 кДа), как показано на Фиг.7.
Пример 7
Анализ белка данного изобретения, экспрессируемого клетками ST, при помощи кривой Скетчарда
Вышеупомянутый 125I-меченый OCIF (мономерного типа) добавляли до концентрации 1000 пМ к культуральной среде для теста связывания (α-МЕМ, к которой были добавлены 0,2% бычий сывороточный альбумин, 20 мМ НЕРЕS-буфер и 0,2% NaN3), и эту культуральную среду серийно разводили 1:2 культуральной средой, не содержащей 125I-меченый OCIF. Растворы для измерения неспецифического связывания готовили дополнительным добавлением 400-кратной концентрации мономерной формы OCIF к этим растворам. 200 мкл приготовленных растворов добавляли в вышеупомянутые лунки с клетками ST2, культивируемыми в течение 4 дней (число пассажей ~10) в присутствии 10-8 М активной формы витамина D3 (Calcitriol) и 10-7 М дексаметазона, для оценки связывания 125I-меченого OCIF по способу, описанному в Примере 4(3). Эти результаты подвергали Scatchard Plot-анализу для определения константы диссоциации OCIF и OCIF-связывающего белка и числа (сайтов) OCIF-связывающего белка на клетку ST2. В результате было обнаружено, что константа диссоциации OCIF и белка данного изобретения равна 280 пМ, а число сайтов OCIF-связывающего белка на клетку ST2 было ~33000/клетку. На основании обнаружения в Примере 5(1), что образование остеокластов, поддерживаемое клетками ST2, с числом пассажей ~40 было более интенсивным, чем с числом пассажей ~10, оценивали число (сайтов) белка данного изобретения, экспрессируемого на клетке ST2, с числом пассажей ~40. Это число (сайтов) было 58000/клетку и было явно большим, чем в случае клеток ST2 с числом пассажей ~10, что свидетельствовало о том, что количество белка данного изобретения, экспрессируемого на клетках ST2, связано с их способностью поддержания образования остеокластов. Эти результаты показали, что белок данного изобретения является фактором, поддерживающим или индуцирующим дифференцировку или созревание остеокластов.
Пример 8
Клонирование кДНК ОВМ
(1) Экстракция РНК из мышиных клеток ST2
Линию мышиных остеобластных стромальных клеток ST2 (RIKEN CELL BANK, RCB0224) культивировали в α-MEM (Gibco BRL Co.), содержащей 10% фетальную телячью сыворотку. Клетки ST2, культивируемые по конфлюентности в Т-колбе (225 см2) для прикрепленных клеток, обрабатывали трипсином для сбора клеток из Т-колбы. Клетки промывали и переносили в пять Т-колб (225 см2). В каждую колбу добавляли 60 мл (α-МЕМ, содержащей 10 М активную форму витамина D3 (Calcitriol, Waco Pure Chemicals Co., Ltd.), 10-7 М дексаметазон и 10% фетальную телячью сыворотку, и клетки культивировали в течение 5 дней в СО2-термостате. Общую РНК экстрагировали из культивированных клеток ST2 при помощи ISOGEN (Wako Pure Chemicals Co., Ltd.). Поли A+PHK получали из ~600 мкг общей РНК при помощи колонки Олиго(dt)-целлюлозы (5'-3' Prime Co.). Получали ~8 мкг Поли А+РНК.
(2) Конструирование экспрессионной библиотеки
Двухцепочеченую кДНК синтезировали из 2 мкг поли A+PHK, полученной в Примере 8(1), с применением набора Great Length cDNA Synthesis (Clontech Co.) в соответствии с инструкцией в руководстве. Конкретно, 2 мкг поли А+РНК и Олиго(dt) 25 (dN) -праймера смешивали и добавляли к этой смеси дистиллированную воду до конечного объема 6,25 мкл. После инкубирования в течение ~3 минут при 70°С смесь охлаждали на льду в течение 2 минут. К смеси добавляли 2,2 мкл дистиллированной воды, 2,5 мкл 5х буфера для первой цепи, 0,25 мкл 100 мМ ДДТ (дитиотрейтола), 0,5 мкл ингибитора РНК-азы PRIME (1 Е/мл) (5'-3' Prime Co.), 0,5 мкл [α-32P]dCTP (Amersham Co., 3000 Ки/ммоль), разбавленного дистиллированной водой для получения 2 мкКи/мкл, 0,65 мкл dNTP (20 мМ каждый) и 1,25 мкл (250 единиц) обратной транскриптазы MMLV (РНК-аза Н-). Смесь инкубировали в течение 90 минут при 42°С, затем добавляли еще 62,25 мкл дистиллированной воды, 20 мкл 5х буфера для второй цепи, 0,75 мкл dNTP (20 мМ каждый) и 5 мкл ферментной смеси для второй цепи. Полученную смесь выдерживали при 16°С в течение двух часов. Затем к этой реакционной смеси добавляли 7,5 единиц ДНК-полимеразы Т4. После инкубирования при 16°С в течение 30 минут реакцию останавливали добавлением 5 мкл 0,2 М ЭДТА. После обработки фенолом-хлороформом продукт осаждали этанолом. EcoRI-SalI-NotI-линкер (Clontech Co.) присоединяли к концам полученной двухцепочеченой кДНК. Затем концы фосфорилировали и продукт наносили на фракционирующую по размеру (гель-фильтрационную) колонку для получения кДНК с длиной более 500 п.н. ДНК осаждали этанолом, растворяли в воде и лигировали с pcDL-SR α296 (Molecular and Cellular Biology, Vol. 8, рр. 466-472, 1988), которая была разрезана рестриктазой EcoRI (Takara Shuzo Co.), и обрабатывали СIАР (щелочной фосфатазой кишечника теленка, Takara Shuzo Co.).
(3) Скрининг экспрессионной библиотеки посредством связывания с OCIF
Штамм Escherichia coli XL2 Blue MRF' (Toyobo Co., Ltd.) трансформировали ДНК, полученной в Примере 8(2), и культивировали на L-Carbenisilin-агаре (1% триптон, 0,5% дрожжевой экстракт, 1% NaCl, 60 мкг/мл карбенизилин, 1,5% агар), приготовленном в 24-луночных пластиковых планшетах, с получением приблизительно 100 колоний на лунку. Трансформанты в каждой лунке суспендировали в 3 мл культуральной среды Terrific Broth ampicillin (1,2% триптон, 2,4% дрожжевой экстракт, 0,4% глицерин, 0,017 М KH2PO4, 0,072 М К2НРО4, 100 мкг/мл ампициллина) и культивировали при 37°С в течение ночи при встряхивании. Клетки собирали центрифугированием для получения плазмидной ДНК с применением набора QIAwell kit (QIAGEN Co.). Концентрацию ДНК определяли измерением поглощения при 260 нм. ДНК концентрировали осаждением этанолом и растворением в дистиллированной воде до концентрации 200 нг/мкл. Получали 500 пулов ДНК, каждый из которых был получен из ~100 колоний, и использовали для трансфекции в клетки COS-7 (RIKEN CELL BANK, RCB0539). Клетки COS-7 высевали в DMEM, содержащую 10% фетальную телячью сыворотку, в каждую лунку 24-луночных планшетов при плотности клеток 8×104 клеток/лунку и культивировали в течение ночи при 37°С в СО2-термостате. На следующий день культуральную среду удаляли и клетки промывали ее сывороточной культуральной средой DMEM. Вышеописанную плазмидную ДНК, которую предварительно разводили культуральной средой OPTI-MEM (Gibco BRL Со.) и смешивали с Липофектамином (реагентом для траснфекции, производимым Gibco BRL Co.), согласно протоколу дополняли Липофектамином. После 15 минут эту смесь добавляли к клеткам в каждой лунке. Количества используемых Липофектамина и ДНК были соответственно 1 мкг и 4 мкл на лунку. После 5 часов культуральную среду удаляли и в каждую лунку добавляли 1 мл культуральной среды DMEM (Gibco BRL Со.), содержащей 10% фетальную телячью сыворотку. Планшеты инкубировали в течение 2-3 дней при 37°С в СО2-термостате (5% СО2). Клетки COS-7, трансфецированные и культивированные в течение 2-3 дней таким образом, промывали бессывороточной культуральной средой DMEM. Затем 200 мкл культуральной среды для теста связывания (бессывороточная культуральная среда DMEM, содержащая 0,2% телячий сывороточный альбумин, 20 мМ HEPES-буфер, 0,1 мг/мл гепарина и 0,02% NaN3) с 20 нг/мл 125I-меченого OCIF, добавленного к ней, добавляли в каждую лунку. После культивирования в течение 1 часа при 37°С в СО2-термостате (5% CO2) клетки промывали дважды 500 мкл забуференного фосфатом солевого раствора, содержащего 0,1 мг/мл гепарина. После промывания в каждую лунку добавляли 500 мкл 0,1 н. раствора NaOH. Планшетам давали стоять в течение 10 минут при комнатной температуре для лизиса клеток. Количество 125I в каждой лунке измеряли при помощи гамма-счетчика (Packard Co.). Посредством скрининга в целом 500 пулов был обнаружен один пул ДНК, содержащий кДНК, кодирующую белок, который специфически связывается с OCIF. Этот пул ДНК, содержащий эту кДНК, разделяли и вышеописанные операции трансфекции и скрининга повторяли для выделения кДНК, кодирующей белок, связывающийся с OCIF. Плазмида, содержащая эту кДНК, была названа рОВМ291. Escherichia coli, содержащую эту плазмиду, депонировали в The National Institute of Bioscience and Human Technology, Agency of Industrial Science and Technology, Biotechnology Laboratory, в виде рОВМ291 23 мая 1997 под депозитным номером FERM ВР-5953.
Способы мечения OCIF 125I и количественный анализ 125I-меченого OCIF при помощи ELISA показаны ниже. Мечение OCIF 125I проводили по Иодоген-способу. 20 мкл 25 мг/мл раствора Иодоген-хлороформ добавляли в пробирку Эппендорфа на 1,5 мл и хлороформ выпаривали нагреванием при 40°С для получения покрытой Иодогеном пробирки. Эту пробирку промывали три раза 400 мкл содержащего 0,5 М фосфат натрия буфера (Na-Pi, рН 7,0) и 5 мкл 0,5 М Na-Pi (pH 7,0). Сразу же после этого добавления в пробирку добавляли 1,3 мкл (18,5 МБк) раствора Na-125I (NEZ-033H20, Amersham Co.), 10 мкл 1 мг/мл раствора rOCIF (мономерного типа или димерного типа). После смешивания содержимого vortex-миксером пробирке давали стоять при комнатной температуре в течение 30 секунд. Раствор переносили в пробирку, в которую предварительно добавляли 80 мкл раствора 10 мг/мл йодида калия в 0,5 М Na-Pi (рН 7,0) и 5 мкл забуференного фосфатом солевого раствора, содержащего 5% бычий сывороточный альбумин (BSA-PBS). После перемешивания смесь наносили на ротационную колонку (1 мл, G-25 fine, производимый Pharmacia Co.), которая была уравновешена BSA-PBS, и колонку центрифугировали в течение 5 минут при 2000 об/мин. 400 мкл BSA-PBS добавляли к фракции, элюированной из этой колонки. После перемешивания аликвоту 2 мкл брали для измерения радиоактивности при помощи гамма-счетчика. Радиохимическую чистоту 125I-меченого OCIF определяли измерением радиоактивности, осажденной 10% ТДУ. Биологическую активность 125I-меченого OCIF измеряли в соответствии со способом, описанным в WO 96/26217. Концентрацию 125I-меченого OCIF измеряли при помощи ELISA следующим образом. Конкретно, 100 мкл 50 мМ NаНСО3 (рН 9,6), в котором были растворены кроличьи поликлональные антитела против OCIF, описанные в WO 96/26217, до концентрации 2 мкг/мл, добавляли в каждую лунку 96-луночного иммунопланшета (Мах-iSorp™, производимого Nunc Co.). Планшету давали стоять в течение ночи при 4°С. После удаления раствора отсасыванием в каждую лунку добавляли 300 мкл Block Асе™ (Snow Brand Milk Products Co., Ltd.), забуференного фосфатом солевого раствора (25:75) (B-PBS). Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием лунки промывали три раза забуференным фосфатом солевым раствором, содержащим 0,01% Polysorbate 80 (P-PBS). Затем в каждую лунку добавляли 100 мкл B-PBS, содержащего 125I-меченый OCIF или стандартный препарат OCIF. Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием каждую лунку промывали шесть раз 200 мкл P-PBS. 100 мкл меченых пероксидазой кроличьих поликлональных антител против OCIF, разбавленных B-PBS, добавляли в каждую лунку. Планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора отсасыванием лунки промывали шесть раз 200 мкл P-PBS. Затем в каждую лунку добавляли 100 мкл раствора ТМВ (ТМВ Soluble Reagent, High Sensitivity, Scytek Co.). После инкубирования планшета при комнатной температуре в течение 2-3 минут в каждую лунку добавляли 100 мкл останавливающего раствора (стоп-раствора) (Stopping Reagent, Scytek Co.). Поглощение каждой лунки измеряли при 490 нм с применением микропланшет-ридера. Концентрацию 125I-меченого OCIF определяли на основе калибровочной кривой, построенной с применением стандартного препарата OCIF.
(4) Определение нуклеотидной последовательности кДНК, кодирующей полную аминокислотную последовательность ОВМ
Нуклеотидную последовательность кДНК ОВМ, полученной в Примере 8(3), определяли с применением набора Taq DyeDeoxy Terminator Cycle Sequencing kit (Perkin Elmer Co.). В частности, нуклеотидную последовательность фрагмента-вставки определяли непосредственно с использованием рОВМ291 в качестве матрицы. Фрагменты с длиной ~1,0 т.п.н. и 0,7 т.п.н., которые получали расщеплением рОВМ291 рестриктазой EcoRI, встраивали в сайт EcoRI плазмиды pUC19 (Takara Shuzo Co.). Нуклеотидные последовательности этих фрагментов также были определены. Использовали следующие праймеры: праймер SRR2, который использовали для определения нуклеотидных последовательностей ДНК-фрагментов, встроенных в pcDL-SR α296, праймеры M13PrimerM3 и M13PrimerRV (оба производимые Takara Shuzo Co.), которые использовали для определения нуклеотидных последовательностей ДНК-фрагментов, встроенных в плазмиду pUC19, и синтезированный праймер OBM#8, сконструированный на основе нуклеотидной последовательности кДНК ОВМ. Последовательности этих праймеров показаны в виде SEQ ID №3 - SEQ ID №6 в таблице последовательностей.
Кроме того, определенная нуклеотидная последовательность кДНК ОВМ показана в виде SEQ ID №2, а определенная из нее аминокислотная последовательность показана в виде SEQ ID №1.
Пример 9
Экспрессия белка, кодируемого кДНК данного изобретения
Плазмиду рОВМ291 трансфецировали в клетки COS-7 в каждой лунке 6-луночного планшета с использованием Липофектамина, и трансфецированные клетки COS-7 культивировали в течение 2 дней в DMEM, содержащей 10% фетальную бычью сыворотку. Среду заменяли не содержащей цистеина-метионина DMEM (Dainippon Seiyaku Co. Ltd.) (800 мкл/лунку), содержащей 5% диализованную фетальную бычью сыворотку. Клетки культивировали в течение 15 минут с последующим добавлением 14 мкл смеси для быстрого мечения Express Protein Labeling Mix (10 мКи/мл, производимой NEN Co.). После культивирования в течение 4 часов добавляли 200 мкл DMEM, содержащей 10% фетальную бычью сыворотку. После 1 часа культивирования клетки дважды промывали PBS. Затем добавляли 0,5 мл TSA-буфера (10 мМ Трис-НСl (рН 8,0), содержащий 0,14 М NaСl, 0,025% NaN3), содержащего 1% Тритон Х-100, 1% бычий гемоглобин, 10 мкг/мл лейпептина, 0,2 TIU/мл апротинина, 1 мМ PMSF, и смеси давали стоять в течение 1 часа на льду. Клетки разрушали пипетированием и центрифугировали при 3000 × g в течение 10 минут при 4°С с получением супернатанта. 200 мкл буфера для разведения (TSA-буфер, содержащий 1% Тритон Х-100, 1% бычий гемоглобин, 10 мкг/мл лейпептина, 0,2 TIU/мл апротинина, 1 мМ PMSF) добавляли к 100 мкл этого супернатанта. Смесь встряхивали в течение 1 часа при 4°С с Протеин А-Сефарозой (50 мкл). Полученную смесь центрифугировали при 1500 × g в течение 1 минуты при 4°С для сбора супернатанта и тем самым удаляли фракцию (фракции), которые неспецифически адсорбируются на Протеин А-Сефарозе. К этому супернатанту добавляли OCIF (1 мкг) и смесь встряхивали при 4°С в течение 1 часа для достижения связывания OCIF с ОВМ. Добавляли поликлональные антитела против OCIF (50 мкг) и смесь встряхивали в течение 1 часа при 4°С. Затем добавляли Протеин А-Сефарозу (10 мкл) и смесь встряхивали еще в течение 1 часа при 4°С с последующим центрифугированием при 1500 × g в течение 1 минуты при 4°С для сбора осадка. Осадок промывали дважды буфером для разбавления, дважды буфером для разбавления без бычьего гемоглобина, один раз TSA-буфером и один раз 50 мМ Трис-НСl (рН 6,5). После промывания к осадку добавляли SDS-буфер (0,125 М Трис-HCl, 4% додецилсульфат натрия, 20% глицерин, 0,002% бромфеноловый синий, рН 6,8), содержащий 10% β-меркаптоэтанол. Смесь нагревали в течение 5 минут при 100°С и подвергали электрофорезу в SDS-ПААГ (12,5% полиакриламидном геле, Daiichi Chemical Co., Ltd.). Гель фиксировали в соответствии с общепринятым способом. Сигналы изотопа усиливали при помощи Amplify™ (Amersham Co.) и пробу экспонировали на пленке BioMax MR (KODAK Со.) при -80°С. Эти результаты приведены на Фиг.8, который показывает, что белок, кодируемый кДНК данного изобретения, имеет молекулярную массу -40000.
Пример 10
Связывание белка, кодируемого кДНК данного изобретения, с OCIF
Плазмиду рОВМ291 трансфецировали в клетки COS в каждой лунке 24-луночного планшета с использованием Липофектамина. После культивирования в течение 2-3 дней клетки промывали бессывороточной культуральной средой DMEM. В лунки добавляли 200 мкл культуральной среды для теста связывания (бессывороточной культуральной среды DMEM, содержащей 0,2% телячью сыворотку, альбумин, 20 мМ HEPES, 0,1 мг/мл гепарин и 0,2% NaN3), дополненной 20 нг/мл 125I-меченого OCIF. В другие лунки добавляли 200 мкл культуральной среды для теста связывания, к которой был добавлен немеченый OCIF (8 мкг/мл), кроме 20 нг/мл 125I-меченого OCIF. После культивирования в течение 1 часа при 37°С в CO2-термостате (5% СО2) клетки промывали дважды 500 мкл забуференного фосфатом солевого раствора, содержащего 0,1 мг/мл гепарина. Затем в каждую лунку добавляли 500 мкл 0,1 н. раствора NaOH и планшету давали стоять в течение 10 минут при комнатной температуре для растворения клеток. Количество 125I в каждой лунке измеряли гамма-счетчиком. В результате, как показано на Фиг.9, было обнаружено, что 125I-меченый OCIF связывается только с клетками, в которые трансфецировали плазмиду рОВМ291. Кроме того, было подтверждено, что это связывание заметно ингибируется добавлением (немеченого) OCIF в 400-кратной концентрации. Эти результаты продемонстрировали, что белок ОВМ, кодируемый кДНК на плазмиде рОВМ291, специфически связывается с OCIF на поверхности трансфецированных клеток COS-7.
Пример 11
Сшивание 125I-меченого OCIF и белка, кодируемого кДНК данного изобретения
Сшивание 125I-меченого OCIF мономерного типа и белка, кодируемого кДНК данного изобретения, проводили для более детального исследования характеристик белка, кодируемого кДНК данного изобретения. После трансфекции плазмиды рОВМ291 в клетки COS-7 согласно способу, использованному в Примере 8(3), в лунки добавляли 200 мкл культуральной среды для теста связывания, описанной выше, содержащей 125I-меченый OCIF (25 нг/мл). В другие лунки добавляли культуральную среду для теста связывания, к которой был добавлен немеченый OCIF в 400-кратной концентрации, кроме 125I-меченого OCIF. После культивирования в течение 1 часа при 37°С в СО2-термостате (5% СО2) клетки промывали дважды 500 мкл забуференного фосфатом солевого раствора, содержащего 0,1 мг/мл гепарина. К этим клеткам добавляли 500 мкл забуференного фосфатом солевого раствора, содержащего 100 мкг/мл сшивающего агента, DSS (дисукцинимидилсуберата, производимого Pierce Co.), с последующей реакцией в течение 10 минут при 0°С. Клетки в этих лунках промывали дважды 1 мл холодного забуференного фосфатом солевого раствора (0°С). После добавления 100 мкл 20 мМ HEPES-буфера, содержащего 1% Тритон Х-100 (Wako Pure Chemicals Co., Ltd.), 2 мМ PMSF (фенилметилсульфонилфторид, Sigma Co.), 10 мкМ Пепстатин (Wako Pure Chemicals Co., Ltd.), 10 мкМ Лейпептин (Wako Pure Chemicals Co., Ltd.), 10 мкМ антипаин (Wako Pure Chemicals Co., Ltd.) и 2 мМ ЭДТА (Wako Pure Chemicals Co., Ltd.), лункам давали стоять в течение 30 минут при комнатной температуре для растворения клеток. Аликвоты 15 мкл этих проб нагревали в присутствии SDS при восстанавливающих условиях в соответствии с общепринятым способом и подвергали электрофорезу в SDS-ПААГ с использованием 4-20% полиакриламидного градиентного геля (Daiichi Pure Chemical Co., Ltd.). После электрофореза гели сушили и экспонировали на пленке BioMax MS (Kodak Со.) в течение 24 часов при -80°С с использованием интенсифицирующих экранов BioMax MS (Kodak Co.). Экспонированную пленку проявляли общепринятым способом. В результате полосу с молекулярной массой в диапазоне 90000-110000, показанную на Фиг.10, детектировали сшиванием 125I-меченого OCIF мономерного типа и белка, кодируемого кДНК данного изобретения.
Пример 12
Нозерн-блот-анализ
Клетки ST2, культивируемые до конфлюентности в Т-колбе (25 см2) для культур прикрепленных клеток, обрабатывали трипсином и извлекали из Т-колбы. После промывания эти клетки высевали в Т-колбу (225 см2) и культивировали в течение 4 дней в СО2-термостате с 60 мл культуральной среды α-МЕМ, содержащей 10-8 М активную форму витамина D3, 10-7 М дексаметазон и 10% фетальную бычью сыворотку. Общую РНК экстрагировали из культивированных клеток ST2 с использованием ISOGEN (Wako Pure Chemicals Co., Ltd.). Общую РНК экстрагировали также тем же способом из клеток ST2, которые культивировали в отсутствие активной формы витамина D3 и дексаметазона. После добавления 2,0 мкл 5х буферного раствора для гель-электрофореза (0,2 М морфолинопропансульфоновая кислота, рН 7,0, 50 мМ ацетат натрия, 5 мМ ЭДТА), 3,5 мкл формальдегида и 10,0 мкл формамида к 20 мкг (4,5 мкл) каждой из общих РНК смеси инкубировали в течение 15 минут при 55°С и подвергали электрофорезу. Гель для электрофореза готовили в соответствии с рецептурой: 1,0% агароза, 2,2 М деионизованный формальдегид, 40 мМ морфолинопропансульфоновая кислота (рН 7,0), 10 мМ ацетат натрия и 1 мМ ЭДТА. Электрофорез проводили в буферном растворе, состоящем из 40 мМ морфолинопропансульфоновой кислоты, рН 7,0, 10 мМ ацетата натрия и 1 мМ ЭДТА. После электрофореза РНК переносили на нейлоновую мембрану. ДНК-фрагмент приблизительно 1,0 т.п.н. получали расщеплением рОВМ291 рестриктазой EcoRI. Гибридизацию проводили с использованием этого ДНК-фрагмента, меченого с применением набора для мечения Megaprime DNA labeling kit (Amersham Co.) и α-32P-dCTP (Amersham Co.), в качестве зонда. В результате, как показано на Фиг.11, было подтверждено, что при культивировании клеток ST2 в присутствии активной формы витамина D3 и дексаметазона генная экспрессия белка, кодируемого кДНК данного изобретения (ОВМ), сильно индуцируется.
Пример 13
Поддерживающая образование остеокластов способность белка, кодируемого кДНК данного изобретения
рОВМ291 трансфицировали в клетки COS по способу, описанному в Примере 8(3). После трех дней трипсинизированные клетки промывали один раз забуференным фосфатом солевым раствором с применением центрифугирования, затем фиксировали PBS, содержащим 1% параформальдегид, при комнатной температуре в течение 5 минут с последующим промыванием PBS шесть раз с применением центрифугирования. 700 мкл 1×106/мл мышиных клеток селезенки и 350 мкл 4×104/мл клеток ST2, которые были суспендированы в α-МЕМ культуральной среде, содержащей 10-8 М активную формулу витамина D3, 10-7 дексаметазон и 10% фетальную бычью сыворотку, добавляли в 24-луночный планшет. ТС-вставку (Nunc Co.) вводили в каждую лунку. Описанные выше фиксированные клетки COS (350 мкл), разведенные до различных концентраций вышеупомянутой культуральной средой, и раствор OCIF (50 мкл) добавляли к ТС-вставке и культивировали в течение 6 дней при 37°С. В результате было подтверждено, что ингибирующая образование остеокластов активность OCIF может ингибироваться белком, кодируемым кДНК данного изобретения.
Пример 14
Экспрессия секретируемой формы ОВМ
(1) Конструирование плазмиды для экспрессии секретируемой формы ОВМ
Реакцию ПЦР проводили с применением ОВМ HF (Таблица последовательностей, SEQ ID №7) и ОВМ XR (Таблица последовательностей, SEQ ID №8) в качестве праймеров и рОВМ291 в качестве матрицы. После очистки электрофорезом в агарозном геле продукт расщепляли рестриктазами HindIII и EcoRI и дополнительно очищали электрофорезом в агарозном геле. Очищенный фрагмент (0,6 т.п.н.), HindIII/EcoRI фрагмент (5,2 т.п.н.) pSec TagA (Invitrogen Co.) и EcoRI/PmacI фрагмент (0,32 т.п.н.) кДНК ОВМ лигировали с применением набора для лигирования верс. 2 (Takara Shuzo Co.). Escherichia coli DH5α трансформировали продуктом реакции. Плазмиды очищали по щелочному-SDS-способу из полученных устойчивых к ампициллину штаммов и расщепляли рестриктазами для отбора плазмиды с фрагментами длиной 0,6 т.п.н. и 0,32 т.п.н., вставленными в рSес ТаgА. Отобранную плазмиду идентифицировали в виде плазмиды, имеющей последовательность, кодирующую секретируемую форму ОВМ (нуклеотидная последовательность: 338-1355) в SEQ ID №2, аминокислотная последовательность: 72-316 в SEQ ID №1), посредством секвенирования с применением набора Dyeter-minator cycle Sequencing FS kit (Perkin Elmer Co.). Эту плазмиду расщепляли рестриктазами NheI и XhoI для выделения фрагмента (1,0 т.п.н.), содержащего кДНК секретируемой формы ОВМ, агарозным гель-электрофорезом. Этот фрагмент встраивали во фрагмент NheI/XhoI (10,4 т.п.н.) экспрессирующего вектора, рСЕР4 (Invitrogen Co.), с применением набора для лигирования, и Escherichia coil DH5a трансформировали с использованием продукта реакции. Плазмиды очищали щелочным-SDS-cnocoбoм из полученных устойчивых к ампициллину штаммов и расщепляли рестриктазами для отбора штамма Escherichia coli, имеющего экспрессирующую секретируемую форму ОВМ плазмиду (рСЕРsОВМ) с точной структурой. Штамм Escherichia coli, содержащий рСЕР-sOBM, культивировали и рСЕРsОВМ очищали с использованием набора QIA filter plasmid midi kit (QIAGEN Co.).
(2) Экспрессия секретируемой формы ОВМ
Клетки 293-EBNA суспендировали в IMDM, содержащей 10% FCS (IMDM-10% FCS) и высевали в 24-луночный планшет, покрытый коллагеном (производимый Sumitomo Bakelite Co., Ltd.), при плотности клеток 2×105/2 мл/лунку и культивировали в течение ночи. Клетки трансфецировали 1 мкг рСЕРsОВМ или рСЕР4 с использованием 4 мкл Липофектамина (Gibco Co.). После культивирования в течение 2 дней в 0,5 мл бессывороточной IMDM или IMDM-10% FCS кондиционированную среду собирали. Экспрессия секретируемой формы ОВМ в кондиционированной среде была подтверждена следующим образом. Бикарбонат натрия добавляли к кондиционированной среде до конечной концентрации 0,1 М и этот раствор добавляли в 96-луночный планшет. Планшету давали стоять в течение ночи при 4°С для иммобилизации тем самым ОВМ в кондиционированной среде на 96-луночном планшете. Планшет заполняли раствором Block Асе™ (Snow Brand Milk Products Co., Ltd.), разбавленным в 4 раза PBS (B-PBS), и давали стоять в течение 2 часов при комнатной температуре для блокирования остаточных сайтов связывания планшета. После добавления к каждой лунке 100 мкл 3-100 нг/мл OCIF, разбавленного B-PBS, планшету давали стоять в течение 2 часов при 37°С с последующим промыванием PBS, содержащим 0,05% Твин 20 (PBS-Т). Затем в каждую лунку добавляли 100 мкл меченых пероксидазой кроличьих поликлональных антител против OCIF, описанных в WO 96/26217, которые были разбавлены B-PBS. После оставления в течение 2 часов при 37°С лунки промывали шесть раз PBS-T. Затем добавляли ТМВ-раствор (ТМВ Soluble Reagent, High Sensitivity, Scytek Co.) в количестве 100 мкл на лунку и давали стоять при комнатной температуре в течение ~10 минут, после чего реакцию останавливали добавлением 100 мкл останавливающего раствора (стоп-раствора) (Stopping Reagent, Scytek Co.) в каждую лунку. Поглощение каждой лунки при 450 нм измеряли микропланшет-ридером. Эти результаты представлены на Фиг.12, которая показывает, что поглощение при 450 нм увеличивалось соответственно концентрации добавленного OCIF в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных рСЕРsОВМ. С другой стороны, не наблюдали увеличения поглощения в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных вектором рСЕР4. Фиг.13 показывает результаты эксперимента, в котором соотношение кондиционированной среды, которую используют для иммобилизации, изменяли в диапазоне 5-90% и добавляли определенную концентрацию OCIF (50 нг/мл). Можно видеть, что поглощение при 450 нм увеличивалось пропорционально увеличению кондиционированной среды в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных рСЕРsОВМ, тогда как такого увеличения не наблюдали в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных вектором рСЕР4. Эти результаты подтвердили, что секретируемая форма ОВМ продуцируется в кондиционированную среду клеток, трансфецированных pCBPsOBM.
Пример 15
Экспрессия слитого тиоредоксин-ОВМ белка (Тrх-ОВМ)
(1) Конструирование экспрессирующего вектора слитого тиоредоксин-ОВМ белка (Тrх-ОВМ)
10 мкл 10х ExTaq-буфера (Takara Shuzo Co.), 8 мкл 10 мМ dNTP (Takara Shuzo Co.), 77,5 мкл стерилизованной дистиллированной воды, 2 мкл водного раствора рОВМ291 (10 нг/мл), 1 мкл праймера ОВМЗ (100 пмоль/мкл, Таблица последовательностей, SEQ ID №9), 1 мкл праймер OBMSalR2 (100 пмоль/мкл, Таблица последовательностей, SEQ ID №10) и 0,5 мкл ExTaq (5 Е/мкл) (Takara Shuzo Со.) смешивали и подвергали реакции (ПЦР-реакции) в микроцентрифужной пробирке. После реакции при 95°С в течение 5 мин, при 50°С в течение 1 сек, при 55°С в течение 1 мин, при 74°С в течение 1 сек и при 72°С в течение 5 мин циклическую реакцию, состоящую из реакции при 96°С в течение 1 мин, при 50°С в течение 1 сек, при 55°С в течение 1 мин, при 74°С в течение 1 сек и 72°С в течение 3 мин, повторяли 25 раз. Из всей реакционной жидкости ДНК-фрагмент ~750 п.н. очищали электрофорезом в 1% агарозном геле с применением QIAEX II gel extraction kit (QIAGEN Co.). Все количество очищенного ДНК-фрагмента расщепляли рестриктазами SaII и EcoRI (Takara Shuzo Co.) и подвергали электрофорезу в 1,5% агарозном геле для очистки ДНК-фрагмента ~160 п.н. (Фрагмент 1), который растворяли в 20 мкл стерилизованной дистиллированной воды. Таким же образом ДНК-фрагмент ~580 п.н. (Фрагмент 2), полученный расщеплением 4 мкг рОВМ291 рестриктазами BamHI и EcoRI (Takara Shuzo Co.) и ДНК-фрагмент ~3,6 т.п.н. (Фрагмент 3), полученный расщеплением 2 мкг pTrXFus (Invitrogen Co.) рестриктазами BamHI и SaII (Takara Shuzo Co.), соответственно очищали и растворяли в 20 мкл стерилизованной дистиллированной воды. QIAEXII gel extraction kit использовали для очистки ДНК-фрагментов. Фрагменты 1-3 лигировали инкубированием при 16°С в течение 2,5 часов с использованием набора для лигирования ДНК DNA ligation kit ver.2 (Takara Shuzo Co.). С использованием реакционной жидкости лигирования штамм Escherichia coil G1724 (Invitrogen) трансформировали по способу, описанному в руководстве Instruction Manual of ThioFusion Expression System (Invitrogen Co.). Штамм микроорганизма с плазмидой, в которой кДНК-фрагмент ОВМ (нуклеотидная последовательность: 350-1111 в SEQ ID №2, аминокислотная последовательность: 76-316 в SEQ ID №1) слит в рамке считывания с геном тиоредоксина, отбирали из полученных устойчивых к ампициллину трансформантов анализом рестрикционных карт, полученных расщеплением рестриктазами, и определением последовательности ДНК. Полученный таким образом штамм микроорганизма был назван G1724/pTrxOBM25.
(2) Экспрессия ОВМ в Escherichia coil
Плазмиды G1724/pTrxOBM25 и G1724, содержащую pTrxFus (G1724/pTrxFus), культивировали соответственно шесть часов при встряхивании при 30°С в 2 мл культуральной среды RMG-Amp (0,6% Na2HPО4, 0,3% КН2РO4, 0,05% NaCl, 0,1% NH4Cl, 1,2% казаминокислота (Difco Co.), 1% глицерин, 1 мМ MgCl2 и 100 мкг/мл ампмциллина (Sigma Co.), pH 7,4). 0,5 мл бульона добавляли к 50 мл Индукционной культуральной среды (0,6% Na2HPO4, 0,3% KH2PO4, 0,05% NaCl, 0,1% NH4Cl, 0,2% казаминокислота, 0,5% глюкоза, 1 мМ MgCl2 и 100 мкг/мл ампициллина, pH 7,4) и культивировали при встряхивании при 30°С. Когда OD600 нм достигала ~0,5, добавляли L-триптофан до конечной концентрации 0,1 мг/мл и затем встряхивали культуру при 30°С еще в течение 6 часов. Культуральный бульон центрифугировали при 3000 × g для сбора клеток, которые суспендировали в 12,5 мл PBS (10 мМ фосфатный буфер, 0,15 М NaCl, pH 7,4). Суспензию подвергали обработке ультразвуком (Ultrasonics Co.) для разрушения клеток. Разрушенные клетки центрифугировали при 7000 х g в течение 30 минут с получением супернатанта в качестве фракции растворимого белка. 10 мкл этой фракции растворимого белка подвергали электрофорезу в SDS-ПААГ (10% ПААГ) при восстанавливающих условиях. В результате полосу с молекулярной массой 40 кДа, которую не обнаруживали во фракции растворимого белка G1724/pTrxFus, наблюдали во фракции растворимого белка G1724/pTrxOBM25 (Фиг.14). Таким образом, было подтверждено, что слитый белок (Тrх-ОВМ) тиоредоксина и ОВМ экспрессировался в Escherichia coli.
(3) Способность связывания Тrх-ОВМ с OCIF
Связывание экспрессируемого Тrх-ОВМ с OCIF подтверждали в соответствии со следующим экспериментом. Антитела против тиоредоксина (Invitrogen Co.), которые разводили в 5000 раз 10 мМ раствором бикарбоната натрия, добавляли в 96-луночный иммунопланшет (Nunc Co.) в количестве 100 мкл на лунку. После стояния в течение ночи при 4°С жидкость в лунках выбрасывали. 200 мкл раствора, приготовленного разведением в два раза Block Асе™ (Snow Brand Milk Products Co., Ltd.) при помощи PBS (BA-PBS), добавляли в каждую лунку. После стояния в течение 1 часа при комнатной температуре раствор выбрасывали и в каждую лунку добавляли по 100 мкл фракций растворимого белка, происходящих из вышеописанных плазмид G1724/pTrxOBM25 или G1724/pTrxFus, разбавленных (каждая) BA-PBS в различных концентрациях. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали три раза PBS-T и загружали 100 мкл OCIF (100 нг/мл), который разбавляли BA-PBS. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали три раза PBS-T и загружали 100 мкл меченых пероксидазой кроличьих поликлональных антител против OCIF (описанных в WO 96/26217), разбавленных в 2000 раз BA-PBS. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали шесть раз PBS-T и добавляли 100 мкл ТМВ-раствора (ТМВ Soluble Reagent, High Sensitivity, Scytek Co.). После стояния в течение приблизительно 10 минут при комнатной температуре в каждую лунку добавляли 100 мкл стоп-раствора (Stopping Reagent, Scytek Co.). Поглощение каждой лунки при 450 нм измеряли микропланшет-ридером. Результаты показаны на Фиг.15. Не было различия в поглощении между пробой с добавленной к ней фракцией растворимого белка, происходящей из G1724/pTrxFus, и пробой без добавления этой фракции растворимого белка. С другой стороны, поглощение увеличивалось в пробах, к которым была добавлена фракция растворимого белка, происходящая из G1724/pTrxOBM25, пропорционально концентрации фракции растворимого белка. Результаты другого эксперимента, в котором скорость разбавления фракции растворимого белка сохранялась постоянной (1%), в то время как добавляли OCIF, разбавленный BA-PBS, в различных концентрациях (0-100 нг/мл), представлены на Фиг.16. Можно видеть, что поглощение оставалось низким при любых концентрациях OCIF в пробах при использовании фракции растворимого белка, происходящего из G1724/pTrxFus, тогда как поглощение увеличивалось пропорционально концентрации OCIF в пробах, к которым добавляли фракцию растворимого белка, происходящего из G1724/pTrxOBM25. На основании этих результатов было подтверждено, что Тrх-ОВМ, полученный из G1724/pTrxOBM25, обладает способностью связывания с OCIF.
(4) Крупномасштабное культивирование Escherichia coil, продуцирующей Тrх-ОВМ
Клетки G1724/pTrxOBM25 распределяли на RMG-Amp-агар (0,6% Na2PO4, 0,3% KH2PO4, 0,05% NaCl, 0,1% NH4Cl, 2% казаминокислота, 1% глицерин, 1 мМ MgCl2, 100 мкг/мл ампициллина, 1,5% агар, рН 7,4) платиновой петлей. Клетки культивировали в течение ночи при 30°С. Культивированные клетки суспендировали в 10 мл Индукционной среды. По 5 мл суспензии добавляли в каждую из двух колб Эрленмейера на 2 л, содержащую 500 мл Индукционной среды, и культивировали при 30°С при встряхивании. При достижении ОD600 нм ~0,5 добавляли L-триптофан до конечной концентрации 0,1 мг/мл. Культивирование со встряхиванием продолжали в течение 6 часов при 30°С. Культуральный бульон центрифугировали в течение 20 минут при 3000 х g для сбора клеток, которые суспендировали в 160 мл PBS. Суспензию подвергали обработке генератором ультразвука (Ultrasonics Co.) для разрушения клеток. Супернатант центрифугировали в течение 30 минут при 7000 × g для получения фракции растворимого белка.
(5) Приготовление аффинной колонки с иммобилизованным OCIF
2 г TSKgel AF-TolesyI Toyopal 650 (Tosoh Corp.) и 40 мл содержащего 1,0 М фосфат калия буфера (рН 7,5), содержащего 35,0 мг рекомбинантного OCIF, полученного по способу, описанному в WO 96/26217, смешивали. Смесь осторожно качали в течение ночи при 4°С для выполнения реакции сочетания. Реакционную смесь центрифугировали для удаления супернатанта. Для инактивации избыточных активных остатков к осажденному носителю добавляли 40 мл 0,1 М Трис-НСl-буфера (рН 7,5) и смесь осторожно качали при комнатной температуре в течение 1 часа. Носитель в колонке промывали буфером 0,1 М глицин-НСl (рН 3,3), содержащим 0,01% Polysorbate 80 и 0,2 М NaCl, и буфером с 0,1 М цитратом натрия (рН 2,0), содержащим 0,01% Polysorbate 80 и 0,2 М NaCl. Носитель в колонке уравновешивали внесением дважды буфера с 10 мМ фосфатом натрия (рН 7,4), содержащим 0,01% Polysorbate 80.
(6) Очистка Тrх-ОВМ при помощи аффинной колонки с иммобилизованным ОСIF
Если нет других указаний, очистку Тrх-ОВМ проводили при 4°С. Вышеупомянутый аффинный носитель с иммобилизованным OCIF (10 мл) и фракцию растворимого белка (120 мл), полученную в Примере 15(4), смешивали. Смесь осторожно перемешивали в течение ночи при 4°С в четырех центрифужных пробирках на 50 мл при помощи ротора. Колонку Econo-column™ (внутренний диаметр 1,5 см, длина 15 см, производимая BioRad Co.) заполняли носителем в этой смеси. Колонку загружали 300 мл PBS, содержащим 0,01% Polysorbate 80, 100 мл содержащего 10 мМ фосфат натрия буфера (рН 7,0), содержащего 0,01% Polysorbate 80 и 0,2 М NaCl, и 100 мл 0,1 М глицин-НСl-буфера (рН 3,3), содержащего 0,01% Polysorbate 80 и 0,2 М NaCl, в этой последовательности. Затем белки, адсорбированные в колонке, элюировали 0,1 М цитрат натрия-буфером (рН 2,0), содержащим 0,01% Polysorbate 80 и 0,2 М NaCl. Элюат собирали в виде фракций по 5 мл. Каждую фракцию, собранную таким образом, сразу же нейтрализовали добавлением 10% объема 2 М Трис-буфера (рН 8,0). Присутствие или отсутствие Тrх-ОВМ в элюированных фракциях определяли согласно способу, описанному ранее в Примере 15(3) (по способности связывания с OCIF). Фракции, содержащие Тrх-ОВМ, собирали и дополнительно очищали.
(7) Очистка Тrх-ОВМ гель-фильтрацией
~ 25 мл фракций Тrх-ОВМ, полученных в Примере 15(6), концентрировали до ~0,5 мл центрифугированием с использованием Centriplus 10 и Centricon 10 (Amicon Co.). Эту пробу наносили на колонку Superose 12 HR 10/30 (1,0×30 см, Pharmacia Co.), предварительно уравновешенную PBS, содержащим 0,01% Polysorbate 80. Для разделения в качестве подвижной фазы использовали PBS, содержащий 0,01% Polysorbate 80, при скорости тока 0,25 мл/мин. Элюат из колонки собирали порциями по 0,25 мл. Тrх-ОВМ в собранных таким образом фракциях детектировали по способу, описанному ранее в Примере 15(3), и при помощи электрофореза в SDS-ПААГ (10-15% полиакриламидный гель, Pharmacia Со.) с применением системы Phast System (Pharmacia Co.) и окрашивания серебром. Фракции (Фракции 20-23), содержащие очищенный Тrх-ОВМ, собирали и определяли концентрацию белка Тrх-ОВМ. Измерение концентрации белка проводили с бычьим сывороточным альбумином в качестве стандартного вещества с использованием тест-набора DC-Protein (BioRad Co.).
Пример 16
Индуцирующая образование остеокластов активность ОВМ
рОВМ291 и pcDL-SR α296 соответственно трансфецировали в клетки COS-7 с использованием Липофектамина (Gibco Co.). Клетки культивировали в DMEM, содержащей 10% FCS, в течение 1 дня, трипсинизировали, высевали на покровные стекла (15 мм, округлой формы, производимые Matsunami Co.) в 24-луночных планшетах при 5×104 клеток на лунку и культивировали в течение 2 дней. Культуральный планшет промывали один раз PBS. Клетки фиксировали PBS, содержащим 1% параформальдегид, при комнатной температуре в течение 8 минут. Планшет, на котором были прикреплены фиксированные клетки, промывали 6 раз PBS, затем в каждую лунку добавляли 700 мкл мышиных клеток селезенки, суспендированных при 1×106/мл в α-МЕМ, содержащей 10-8 М активную форму витамина D3, 10-7 М дексаметазон и 10% фетальную бычью сыворотку. Millicell PCF (Millipore Co.) устанавливали в каждой лунке и добавляли суспензию клеток ST2 в вышеупомянутой культуральной среде (4×104/мл), 700 мкл на лунку, в Millicell PCF, с последующим инкубированием при 37°С в течение 6 дней. После культивирования Millicell PCF удаляли, планшет промывали один раз PBS и клетки фиксировали раствором ацетон-этанол (50:50) в течение 1 минуты. Затем клетки, обнаруживающие устойчивую к винной кислоте активность кислой фосфатазы (TRAP), являющуюся специфическим маркером для остеокласта, селективно окрашивали с использованием набора LEUKOCYTE ACID PHOSPHATASE kit (Sigma Co.). Микроскопическое наблюдение показало, что TRAP-позитивные клетки не обнаруживались в лунках, в которых были фиксированы клетки COS-7, трансфецированные pcDL-SR α296. В противоположность этому 45±18 (среднее значение±стандартное отклонение, n=3) trap-позитивных клеток наблюдали в лунках, в которых были фиксированы клетки COS-7, трансфецированные рОВМ291. Кроме того, было также подтверждено, что кальцитонин связывался с этими trap-позитивными клетками. Эти открытия доказали, что ОВМ обладает индуцирующей образование остеокластов активностью.
Пример 17
Индуцирующая образование остеокластов активность Тrх-ОВМ и секретируемой формы ОВМ
Мышиные клетки селезенки суспендировали в α-МЕМ, содержащей 10-8 М активную форму витамина D3, 10-7 М дексаметазон и 10% фетальную бычью сыворотку, при концентрации 2×106/мл. Эту суспензию добавляли в 24-луночный планшет в количестве 350 мкл на лунку. Затем каждую лунку загружали 350 мкл раствора, полученного разбавлением очищенного Тrх-ОВМ вышеуказанной культуральной средой (40 нг/мл), 350 мкл раствора, полученного 10-кратным разбавлением кондиционированной среды, которую получали культивированием клеток 293-EBNA, в которые были трансфецированы pCEPsOBM или рСЕР4, в IMDM-10% FGS, вышеуказанной культуральной средой, или 350 мкл только вышеуказанной культуральной среды. Millicell PCF (Millipore Co.) помещали в каждую лунку, к которому добавляли 600 мкл клеток ST2, суспендированных в вышеуказанной культуральной среде (4×104/мл). После культивирования в течение шести дней Millicell PCF удаляли. Планшет промывали один раз PBS и клетки фиксировали раствором ацетон-этанол (50:50) в течение 1 минуты. Затем клетки, проявляющие устойчивую к винной кислоте активность кислой фосфатазы (TRAP-активность), селективно окрашивали с использованием набора LEUKOCYTE ACID PHOSPHATASE kit (Sigma Co.). Микроскопическое наблюдение показало, что в лунках, к которым не добавляли Тrх-ОВМ, не обнаруживались клетки, проявляющие TRAP-активность, тогда как 106±21 (среднее значение±стандартное отклонение, n=3) TRAP-позитивных клеток наблюдали в лунках, к которым добавляли Тrх-ОВМ. Подобным образом в то время как в лунках, к которым была добавлена кондиционированная среда клеток 293-EBNA, трансфецированных рСЕР4, не обнаруживали клеток, проявляющих TRAP-активность, 120±31 (среднее значение±стандартное отклонение, n=3) TRAP-позитивных клеток наблюдали в лунках, к которым была добавлена кондиционированная среда клеток 293-EBNA, трансфецированных рСЕРsОВМ. Кроме того, было подтверждено, что кальцитонин связывается с этими TRAP-позитивными клетками. Эти результаты доказали, что Тrх-ОВМ и секретируемая форма ОВМ проявляют ингибирующую образование остеокластов активность.
Пример 18
Идентичность белка ОВМ, экспрессируемого кДНК данного изобретения, и OCIF-связывающего белка природного типа данного изобретения
(1) Получение кроличьих поликлональных антител против ОВМ
Трех самцов японских белых кроликов (вес 2,5-3,0 кг, поставляемые Kitayama Labes Co.) иммунизировали очищенным ОВМ (тиоредоксин-ОВМ слитый белок), полученным в соответствии со способом Примера 14(6) и 14(7), подкожной инъекцией 1 мл/дозу эмульсии, полученной смешиванием 200 мг/мл очищенного ОВМ с равным объемом полного адъюванта Фрейнда (DIFCO Со.), шесть раз, один раз в неделю. Через 10 дней после последней иммунизации кроликов обескровливали. Антитела очищали из сыворотки следующим образом. Сульфат аммония добавляли к антисыворотке, которая была разбавлена в 2 раза PBS до конечной концентрации 40% (мас./об.). После стояния в течение 1 часа при 4°С смесь центрифугировали в течение 20 минут при 8000 × g для получения осадка. Осадок растворяли в небольшом количестве PBS, диализовали против PBS при 4°С и нагружали на Протеин G-Сефарозную колонку (производимый Pharmacia Co.). После промывания PBS адсорбированный иммуноглобулин G элюировали 0,1 М глицин-HCl-буферным раствором (рН 3,0). Элюат сразу же нейтрализовали 1,5 М Трис-НСl-буфером (рН 8,7). После диализа элюированных белковых фракций против PBS измеряли поглощение при 280 нм для определения концентрации белка (Е1% 13,5). Антитела против ОВМ, меченные пероксидазой хрена, получали с использованием набора малеимид-активированной пероксидазы (Pierce Co.) следующим образом. 80 мкг N-сукцинимид-S-ацетилтиоуксусной кислоты добавляли к 1 мг очищенных антител и реакцию проводили при комнатной температуре в течение 30 минут. К полученной смеси добавляли 5 мг гидроксиламина для деацетилирования антител. Модифицированные антитела фракционировали при помощи полиакриламидной обессоливающей колонки. Белковые фракции смешивали с 1 мг малеимид-активированной пероксидазы и давали им реагировать в течение 1 часа при комнатной температуре для получения меченных ферментом антител.
(2) Способность кроличьих поликлональных антител против ОВМ ингибировать специфическое связывание белка (ОВМ), экспрессируемого кДНК данного изобретения, или белка природного типа данного изобретения с OCIF
Очищенный ОВМ (тиоредоксин-ОВМ слитый белок), полученный согласно способу, описанному в Примере 15(6) и 15(7), и очищенный OCIF-связывающий белок природного типа Примера 2(4) растворяли соответственно в содержащем 0,1 М карбонат натрия буфере до концентрации 2 мкг/мл. Аликвоту каждого раствора добавляли при 100 мкл на лунку соответственно в 96-луночный иммунопланшет (производимый Nunc Co.). Планшету давали стоять в течение ночи при 4°С. В каждую лунку добавляли 200 мкл 50% Block Асе и планшету давали стоять при комнатной температуре в течение 1 часа. После промывания каждой лунки три раза PBS, содержащим 0,1% Polysolbate 20 (P20-PBS), 100 мкл раствора кроличьих антител против ОВМ, которые были растворены в 25% Block Асе, приготовленном с P20-PBS, до концентрации 200 мкг/мл, или 100 мкл 25% Block Асе (не содержащего антител) добавляли в каждую лунку с последующим инкубированием при 37°С в течение 1 часа. Каждую лунку промывали три раза P20-PBS и загружали 100 мкл/лунку тест-раствором для связывания (P20-PBS, содержащим 0,2% сывороточный альбумин теленка, 20 мМ HEPES и 0,1 мг/мл гепарина), к которому добавляли 20 нг/мл 125I-меченого OCIF, описанного в Примере 8(3). Альтернативно каждую лунку загружали 100 мкл/лунку другого тест-раствора для связывания, содержащего 8 мкг/мл немеченого OCIF, кроме 20 нг/мл 125I-меченого OCIF. После инкубирования этих иммунопланшетов при 37°С в течение 1 часа лунки промывали шесть раз P20-PBS. Количество 125I в каждой лунке измеряли гамма-счетчиком. Результаты показаны на Фиг.17. Как показано на Фиг.17, как очищенный ОВМ, экспрессируемый кДНК данного изобретения, так и белок, который специфически связывает OCIF-связывающий белок природного типа данного изобретения, не связываются с 125I-меченым OCIF вообще, когда они обработаны кроличьими поликлональными антителами против ОВМ, в то время как оба белка связывали 125I-меченый OCIF, когда они не были обработаны антителами. Было подтверждено, что связывание обоих белков с 125I-меченым OCIF было явно специфическим, поскольку это связывание значимо ингибировалось добавлением 400-кратной концентрации немеченого OCIF (8 мкг/мл). Описанные выше результаты показали, что кроличьи поликлональные антитела против ОВМ узнают как ОВМ, который является белком, экспрессируемым кДНК данного изобретения, так и OCIF-связывающий белок природного типа данного изобретения и ингибируют специфическое связывание этих белков с OCIF.
Пример 19
Клонирование кДНК ОВМ человека
(1) Получение праймера мышиного ОВМ
Праймеры мышиного ОВМ, полученные согласно способу Примеров (ОВМ#3 и ОВМ#8), описанных выше, использовали для скрининга кДНК ОВМ человека. Эти последовательности показаны в Таблице последовательностей, SEQ ID №9 и SEQ ID №6 соответственно.
(2) Выделение кДНК ОВМ человека при помощи ПЦР
кДНК-фрагменты ОВМ человека получали при помощи ПЦР с использованием кДНК-праймеров мышиного ОВМ, полученных в (1) выше, и готовой кДНК Human Lymph Node Marathon (Clontech Co.) в качестве матрицы. Условия для ПЦР были следующими:
10 х EX Taq буфер (Takara Shuzo Co.) 2 мкл
2,5 мМ dNTP I,6 мкл
Раствор кДНК 1 мкл
EX Taq (Takara Shuzo Co.) 0,2 мкл
Дистиллированная вода 14,8 мкл
40 мкМ праймер ОВМ#3 0,2 мкл
40 мкМ праймер ОВМ#8 0,2 мкл
Эти растворы смешивали в центрифужной пробирке и прединкубировали при 95°С в течение 2 минут с последующими 40 циклами трехстадийной реакции, состоящей из реакций при 95°С в течение 30 секунд, при 57°С в течение 30 секунд и при 72°С в течение 2,5 минут. После этой реакции раствор инкубировали в течение 5 минут при 72°С и часть раствора подвергали электрофорезу на агарозном геле. Был обнаружен ДНК-фрагмент (~690 п.н.), амплифицированный кДНК-праймерами мышиного ОВМ, описанными выше.
(3) Очистка кДНК-фрагмента ОВМ человека, амплифицированного ПЦР, и определение нуклеотидной последовательности
кДНК-фрагмент ОВМ человека, полученный в Примере 19(2), разделяли электрофорезом на агарозном геле и дополнительно очищали с применением набора для экстракции гелей QIAEX (Qiagen Co.). Опять проводили ПЦР с использованием очищенного кДНК-фрагмента ОВМ человека в качестве матрицы и кДНК-праймеров мышиного ОВМ, описанных выше, для получения большого количества кДНК-фрагмента ОВМ человека. Этот ДНК-фрагмент очищали с применением набора для экстракции гелей QIAEX, как описано выше. Нуклеотидную последовательность очищенного ДНК-фрагмента ОВМ человека определяли с применением набора Taq Dye Deoxy Terminator Cycle Sequencing FS (Perkin Elmer Co.) с использованием ОВМ#3 или ОВМ#8 (SEQ ID №9 и SEQ ID №6 соответственно) в качестве праймера. При сравнении этой последовательности с соответствующим участком кДНК мышиного ОВМ нуклеотидная последовательность кДНК-фрагмента ОВМ человека обнаружила 80,7% гомологию с последовательностью кДНК мышиного ОВМ.
(4) Скрининг полноразмерной кДНК ОВМ человека при помощи гибридизации с использованием кДНК-фрагмента (приблизительно 690 п.н.) ОВМ человека в качестве зонда
Скрининг полноразмерной кДНК ОВМ человека проводили с использованием кДНК-фрагмента (~690 п.н.) ОВМ человека, который был очищен в Примере 19(3) и помечен [α32P]-dCTP с применением набора для мечения Megaprime DNA Labeling kit (Amersham Co.). Библиотеку кДНК Human Lymph Node 5'-STRETCH PLUS (Clontech Co., the USA) подвергали скринингу с использованием ДНК-зонда. В соответствии с протоколом изготовителя Escherichia coil C600 Hfl инфицировали рекомбинантным фагом в течение 15 минут при 37°С. Инфицированную Escherichia coil добавляли на LB-агар (1% триптон, 0,5% дрожжевой экстракт, 1% NaCl, 0,7% агар), который был нагрет при 45°С. LB-агар выливали на чашку для LB-агара, содержащую 1,5% агар. После инкубирования в течение ночи при 37°С HyBond-N™ (Amersham Co.) помещали на эту чашку, на которой продуцировались стерильные пятна, и выдерживали в течение ~3 минут. В соответствии с общепринятым способом фильтр обрабатывали щелочным раствором, нейтрализовали и погружали в раствор 2 х SSC. Затем ДНК иммобилизовали на этом фильтре при помощи UV CROSSLINKER (Stratagene Со.). Полученный фильтр погружали в буфер для быстрой гибридизации (Rapidhyb buffer, Amersham Co.). После предобработки в течение 15 минут при 65°С фильтр помещали в Rapid-hyb-буфер, содержащий денатурированный нагреванием кДНК-фрагмент ОВМ человека (~690 п.н., 5×105 имп/мин/мл), описанный выше. После гибридизации в течение ночи при 65°С фильтр промывали 2 х SSC, 1 х SSC и 0,1xSSC, каждый из которых содержал 0,1% SDS, в указанной последовательности соответственно в течение 15 минут при 65°С. Несколько полученных позитивных клонов дополнительно очищали повторением два раза этого скрининга. Клон, обладающий вставкой (~2,2 т.п.н.), отбирали из очищенных клонов и использовали в последующих экспериментах. Этот очищенный фаг был назван λhOBM. Приблизительно 10 мкг ДНК получали из очищенного λhOBM с применением набора QIAGEN Lambda kit (Qiagen Co.) в соответствии с протоколом изготовителя. ДНК расщепляли рестриктазой SalI и подвергали электрофорезу на агарозном геле для отделения кДНК вставки λhOBM (~2,2 т.п.н.). Этот ДНК-фрагмент, очищенный при помощи набора для экстракции гелей QIAEX (Qiagen Co.), расщепляли рестриктазой SalI и встраивали в плазмиду pUC19 (MBI Co.), которую предварительно расщепляли рестриктазой SalI и дефосфорилировали, с использованием набора DNA ligation kit ver. 2 (Takara Shuzo Co.). Escherichia coli DH5a (Gibco BRL Co.) трансформировали pUC19, содержащей полученный ДНК-фрагмент. Полученный трансформант был назван pUC19hOBM. Трансформант выращивали и pUC19hOBM, в которую была встроена кДНК ОВМ человека (~2,2 т.п.н.), очищали общепринятым способом.
(5) Определение нуклеотидной последовательности кДНК, кодирующей полную аминокислотную последовательность ОВМ человека
Нуклеотидную последовательность полученной в Примере 19(4) кДНК ОВМ человека определяли с применением набора Taq Dye Deoxy Terminator Cycle Sequencing FS (Perkin Elmer Co.). Конкретно, нуклеотидную последовательность встроенного фрагмента определяли с применением pUC19hOBM в качестве матрицы. В качестве праймеров использовали праймеры для определения нуклеотидной последовательности встроенного ДНК-фрагмента в pUC19hOBM, М13 Primer M3 и М13 Primer RV (производимый Takara Shuzo Co.), и синтетический праймер, ОВМ#8 человека, сконструированный на основе нуклеотидной последовательности кДНК-фрагмента ОВМ человека (~690 п.н.).
Нуклеотидная последовательность использованных праймеров, М13 Primer M3 и М13 Primer RV, показана соответственно в виде SEQ ID №4 и SEQ ID №5. Аминокислотная последовательность ОВМ человека, расшифрованная из нуклеотидной последовательности кДНК ОВМ человека, показана в Таблице последовательностей в виде SEQ ID №11. Нуклеотидная последовательность кДНК ОВМ человека показана в виде SEQ ID №12.
Escherichia coli, которая была трансформирована pUC19hOBM, являющейся плазмидой, содержащей полученную кДНК ОВМ человека, была депонирована в National Institute of Bioscience and Human Technology, Agency of Industrial Science and Technology, 13 августа 1997 года под депозитным номером FERM ВР-6058.
Пример 20
Радиойодинирование OCIF 125I и количественный анализ 125I-мечeного OCIF при помощи ELISA
OCIF метили 125I при помощи IODO-GEN-способа. 20 мкл 2,5 мг/мл раствора IODO-GEN-хлороформа переносили в пробирку Эппендорфа на 1,5 мл и хлороформ выпаривали при 40°С с получением пробирки, покрытой IODO-GEN. Пробирку промывали три раза 400 мкл содержащего 0,5 М фосфат натрия буферного раствора (Na-Pi, pH 7,0), с последующим добавлением 5 мкл 0,5 М Na-Pi (pH 7,0). В эту пробирку добавляли 1,3 мкл (18,5 МБк) раствора Na-125I (Amersham Co., NEZ-033H) и сразу же после этого 10 мкл 1 мг/мл раствора OCIF (мономерного типа или димерного типа). Смесь перемешивали в voltex-миксере и давали ей стоять при комнатной температуре в течение 30 секунд. Этот раствор переносили в пробирку, в которую предварительно добавляли 80 мкл 0,5 М раствора Na-Pi (pH 7,0), содержащего 10 мг/мл KI, и 5 мкл забуференного фосфатом солевого раствора, содержащего 5% бычий сывороточный альбумин (BSA-PBS). Этот раствор перемешивали, наносили на ротационную колонку (1 мл, G-25 Sephadex fine, производимый Pharmacia Co.), которая была уравновешена заранее BSA-PBS, и центрифугировали в течение 5 минут при 2000 об/мин. К фракциям, элюированным из этой колонки, добавляли 400 мкл BSA-PBS. После смешивания 2 мкл этого раствора использовали для измерения радиоактивности гамма-счетчик. Радиохимическую чистоту полученного раствора 125I-меченого OCIF измеряли счетом радиоактивности фракций, осажденных 10% трихлоруксусной кислотой (ТСА).
Биологическую активность 125I-меченого OCIF измеряли по способу, описанному в WO 96/26217. Концентрацию 125I-меченого OCIF измеряли при помощи ELISA следующим образом. Конкретно, 50 мМ NаНСО3 (pH 9,6), в котором были растворены кроличьи поликлональные антитела против OCIF, описанные в WO 96/26217, до концентрации 2 мкг/мл, добавляли в каждую лунку 96-луночного иммунопланшета (MaxiSorp™, производимый Nunc Co.) в количестве 100 мкл на лунку. После стояния этих лунок в течение ночи при 4°С раствор удаляли. Затем лунки загружали смесью водного раствора Block Асе™ (Snow Brand Milk Products Co., Ltd.) и забуференного фосфатом солевого раствора (25:75) (B-PBS) в количестве 200 мкл на лунку. Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора лунки промывали три раза забуференным фосфатом солевым раствором, содержащим 0,01% Polysolvate 80 (P-PBS). Затем B-PBS, содержащий пробу 125I-меченого OCIF или стандартный OCIF, добавляли в количестве 100 мкл на лунку. Затем планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора каждую лунку промывали шесть раз 200 мкл P-PBS. Раствор, приготовленный разбавлением меченных пероксидазой поликлональных кроличьих антител B-PBS, добавляли в количестве 100 мкл на лунку. Планшету давали стоять в течение 2 часов при комнатной температуре. После удаления раствора лунки промывали шесть раз 200 мкл P-PBS. Затем ТМВ-раствор (ТМВ Soluble Reagent, High Sensitivity Scytek Co.) добавляли в количестве 100 мкл на лунку. После стояния при комнатной температуре в течение 2-3 минут в каждую лунку добавляли 100 мкл останавливающего раствора (Stopping Reagent, Scytek Co.). Поглощение каждой лунки измеряли при 450 нм при помощи микропланшет-ридера. Концентрацию 125I-меченого OCIF определяли при помощи калибровочной кривой, полученной с применением стандартного OCIF.
Пример 21
Экспрессия белка, кодируемого кДНК данного изобретения
(1) Конструирование экспрессирующего hOBM вектора для клеток животных
pUChOBM расщепляли рестриктазой SalI и ДНК-фрагмент (~2,2 т.п.н.) очищали электрофорезом на 1% агарозном геле. Концы ДНК-фрагментов затупляли с применением набора для затупления ДНК (Takara Shuzo Co.) (hOBMcDNA-фрагмент с затупленными концами). Экспрессионную плазмиду pcDL-SRα296 (Molecular and Cellular Biology, Vol. 8, pp. 466-472 (1988)) расщепляли рестриктазой EcoRI, затупляли с применением набора для затупления концов и лигировали с кДНК-фрагментом hOBM с затупленными концами с применением набора для лигирования (ver.2). Escherichia coli DHα трансформировали реакционной смесью для лигирования. Плазмиду в полученном устойчивом к ампициллину трансформанте подвергали расщеплению рестриктазой для анализа рестрикционной карты ДНК и определения последовательности ДНК. В результате был отобран штамм, имеющий плазмиду, в которой кДНК hOBM встроена в том же самом направлении транскрипции, что и промотор SRα. Этот штамм микроорганизма был назван DH5α/phOBM.
(2) Экспрессия ОВМ человека в клетках COS-7
Escherichia coil DH5α/phOBM культивировали и плазмиду phOBM очищали с применением набора Qiafilter Plasmid Midi kit (Qiagen Co.). phOBM трасфецировали с использованием Липофектамина в клетки COS-7 в лунках 6-луночного планшета и культивировали в течение 2 дней в DMEM, содержащей 10% фетальную бычью сыворотку. Эту культуральную среду заменяли не содержащей цистеина-метионина DMEM (производимой Dainippon Seiyaku Co., Ltd.), к которой была добавлена 5% диализованная фетальная бычья сыворотка (88 мкл/лунку). Клетки инкубировали в течение 15 минут с последующим добавлением 14 мкл смеси для быстрого мечения белков Express Protein Labeling Mix (NEN Co., 10 мКи/мл). После 4 часов инкубирования в каждую лунку добавляли 200 мкл DMEM, содержащей 10% фетальную бычью сыворотку. Клетки культивировали в течение 1 часа и промывали дважды PBS. Затем в каждую лунку добавляли 0,5 мл TSA-буфера (10 мМ Трис-HCl, содержащий 0,14 М NaCl и 0,025% NaN3, pH 8,0), содержащего 1% Тритон Х-100, 1% бычий гемоглобин, 10 мкг/мл лейпептина, 0,2 TIU/мл апротинина и 1 мМ PMSF, и смесям давали стоять в течение 1 часа на льду. Клетки перемешивали пипетированием и центрифугировали при 3000 × g в течение 10 минут при 4°С с получением супернатантов. 200 мкл буфера для разведения (TSA-буфер, содержащий 0,1% Тритон Х-100, 0,1% бычий гемоглобин, 10 мкг/мл лейпептина, 0,2 TIU/мл апротинина и 1 мМ PMSF) добавляли к 100 мкл супернатанта из каждой лунки. Полученные смеси перемешивали при 4°С в течение 1 часа вместе с Протеин А-Сефарозой (50 мкл) и центрифугировали при 1500 × g в течение 1 минуты при 4°С для сбора супернатантов, удаляя тем самым белок, который неспецифически адсорбировала Протеин А-Сефароза. К этим супернатантам добавляли OCIF (1 мкг) и смеси перемешивали в течение 1 часа при 4°С для связывания ОВМ человека и OCIF. Затем добавляли кроличьи поликлональные антитела против OCIF (50 мкг) и перемешивали при 4°С в течение 1 часа. К полученному раствору добавляли Протеин А-Сефарозу (10 мкл) с последующим перемешиванием при 4°С еще в течение часа. Полученные таким образом смеси центрифугировали в течение 1 минуты при 1500 × g при 4°С для сбора осадков. Осадки промывали дважды буфером для разведения, дважды буфером для разведения без бычьего гемоглобина, один раз ТSА-буфером и один раз 50 мМ Трис-НСl (рН 6,5). После добавления SDS-буфера, содержащего 10% β-меркаптоэтанол (0,125 М Трис-HCl, 4% додецилсульфат натрия, 20% глицерин, 0,002% бромфеноловый синий, рН 6,8), смесь нагревали в течение 5 минут при 100°С и подвергали электрофорезу в SDS-ПААГ (12,5% полиакриламидный гель, Daiichi Pure Chemical Co.,). Гель фиксировали и сушили в соответствии с общепринятым способом. После усиления сигналов изотопа при помощи Amplify™ (Amersham Co.) высушенный гель подвергали авторадиографии при -80°С с использованием пленки Bio Max MR (Kodak Co.). Результаты представлены на Фиг.18, которая показывает, что молекулярная масса белка, кодируемого кДНК данного изобретения, равна ~40000.
Пример 22
Связывание белка, кодируемого кДНК данного изобретения, и OCIF
Плазмиду phOBM, которая была очищена согласно способу, описанному в Примере 21(2), трансфецировали в клетки COS-7 в каждой лунке 24-луночного планшета с использованием Липофектамина. После культивирования в течение 2-3 дней клетки промывали бессывороточной DMEM. В лунки добавляли 200 мкл культуральной среды для тест-среды связывания (бессывороточной DMEM, к которой были добавлены 0,2% бычий сывороточный альбумин, раствор 20 мМ НЕРЕS-буфера, 0,1 мг/мл гепарина и 0,2% NaN3), содержащей 20 нг/мл 125I-меченого OCIF. В другие лунки добавляли 200 мкл культуральной среды для тест-среды связывания, содержащей 8 мкг/мл немеченого OCIF, кроме 20 нг/мл 125I-меченого OCIF. После инкубирования в течение 1 часа при 37°С в СО2-термостате (5% СО2) клетки промывали дважды 500 мкл забуференного фосфатом солевого раствора, содержащего 0,1 мг/мл гепарина. Затем в каждую лунку добавляли 500 мкл 0,1 н. раствора NaOH и планшету давали стоять в течение 10 минут при комнатной температуре для растворения клеток. Радиоактивность 125I в лунках измеряли гамма-счетчиком. В результате, как показано на Фиг.19, было подтверждено, что 125I-меченый OCIF связывается только с клетками, трансфецированными phOBM. Кроме того, связывание значимо ингибировалось добавлением 400-кратного избытка немеченого OCIF (8 мкг/мл). Описанные здесь результаты подтвердили, что белок ОВМ человека, кодируемый кДНК в phOBM, специфически связывается с OCIF на поверхности клеток COS-7.
Пример 23
Сшивание 125I-меченого OCIF и белка, кодируемого кДНК данного изобретения
Для дополнительного исследования характеристик белка, кодируемого кДНК данного изобретения проводили сшивание 125I-меченого OCIF мономерного типа и белка, кодируемого кДНК данного изобретения. После конструирования экспрессирующего вектора phOBM и трансфекции его в клетки COS-7 по способу, используемому в Примере 21(1) и 21(2), добавляли 200 мкл тест-среды для связывания, содержащей 125I-меченый OCIF (25 нг/мл), описанной выше. Для других лунок использовали тест-среду для связывания, к которой был добавлен немеченый OCIF в 400-кратной концентрации. После культивирования в течение 1 часа при 37°С в СО2-термостате (5% СО2) клетки промывали дважды 500 мкл забуференного фосфатом солевого раствора, содержащего 0,1 мг/мл гепарина. 500 мкл забуференного фосфатом солевого раствора, в котором был растворен сшивающий агент (DSS: дисукцинимидилсуберат, производимый Pierce Co.) (100 мкг/мл), добавляли к этим клеткам с последующим инкубированием в течение 10 минут при 0°С. Клетки в этих лунках промывали дважды 1 мл охлажденного на льду забуференного фосфатом солевого раствора. После добавления 100 мкл 20 мМ НЕ-PES-буфера, содержащего 1% Тритон Х-100 (Wako Pure Chemicals Co., Ltd.), 2 мМ PMSF (фенилметилсульфонилфторид, Sigma Co.), 10 мкМ Пепстатин (Wako Pure Chemicals Co., Ltd.), 10 мкМ Лейпептин (Wako Pure Chemicals Co., Ltd.), 10 мкМ антипаин (Wako Pure Chemicals Co., Ltd.) и 2 мМ ЭДТА (Wako Pure Chemicals Co., Ltd.), лункам давали стоять в течение 30 минут при комнатной температуре для растворения клеток. Аликвоты 15 мкл этих проб обрабатывали SDS при восстанавливающих условиях в соответствии с общепринятым способом и подвергали SDS-электрофорезу с использованием 4-20% полиакриламидного градиентного геля (Daiichi Pure Chemical Co., Ltd.). После электрофореза гель сушили и подвергали авторадиографии в течение 24 часов при -80°С с использованием пленки BioMax MS (Kodak Со.) и интенсифицирующего экрана BioMax MS (Kodak Co.). Пленку, подвергнутую авторадиографии, проявляли общепринятым способом. В результате полосу с молекулярной массой в диапазоне 90000-110000, показанную на Фиг.20, детектировали сшиванием 125I-меченого OCIF мономерного типа и белка, кодируемого кДНК данного изобретения.
Пример 24
Экспрессия секретируемой формы ОВМ человека
(1) Конструирование плазмиды, экспрессирующей секретируемую форму ОВМ человека
Реакцию ПЦР проводили с применением ОВМ SF человека (Таблица последовательностей, SEQ ID №13) и мышиного ОВМ#8 (Таблица последовательностей, SEQ ID №6) в качестве праймеров и pUC19hOBM в качестве матрицы. После очистки электрофорезом в агарозном геле продукт расщепляли рестриктазами SplI и HindIII и дополнительно очищали электрофорезом в агарозном геле для получения очищенного фрагмента (0,27 т.п.н.). кДНК ОВМ человека частично расщепляли рестриктазой DraI и ДНК-фрагменты, расщепленные DraI в одном сайте, очищали электрофорезом на агарозном геле. Очищенный фрагмент дополнительно очищали рестриктазой HindIII. Фрагмент 0,53 т.п.н. DraI/HindIII очищали электрофорезом на агарозном геле. Очищенный фрагмент лигировали с фрагментом SplI/HindIII 0,27 т.п.н., полученным из ПЦР, описанной выше, с использованием набора для лигирования верс.2 (Takara Shuzo Co.) вместе с фрагментом HindIII/EcoRI (5,2 т.п.н.) pSec TagA (Invitrogen Co.). Escherichia coil DH5α трансформировали продуктом реакции. Плазмиды очищали по щелочному-SDS-cnoco6y из полученных устойчивых к ампициллину трансформантов и расщепляли рестриктазами для отбора плазмиды, содержащей фрагменты длиной 0,27 т.п.н. и 0,53 т.п.н. в виде вставок в pSec TagA. Было подтверждено, что эта плазмида имела последовательность, кодирующую секретируемую форму ОВМ человека, секвенированием с применением набора Tag Dyedeoxyterminator cycle Sequencing FS kit (Perkin Elmer Co.). Эту плазмиду расщепляли рестриктазами NheI и XhoI для получения фрагмента (0,8 т.п.н.), соответствующего кДНК секретируемой формы ОВМ человека, при электрофорезе на агарозном геле. Этот фрагмент встраивали во фрагмент NheI/XhoI (10,4 т.п.н.) экспрессирующего вектора, рСЕР4 (Invitrogen Co.), с применением набора для лигирования, и Еscherichia coli DH5α трансформировали с использованием продукта реакции. Плазмиды очищали щелочным SDS-способом из полученных устойчивых к ампициллину трансформантов и расщепляли рестриктазами для отбора штамма Escherichia coli, имеющего плазмиду, экспрессирующую секретируемую форму ОВМ человека (pCEPshOBM). Штамм Escherichia coli, содержащий pCEPshOBM, культивировали и pCEPshOBM очищали с использованием набора Qiafilter plasmid midi kit (QIAGEN Co.).
(2) Экспрессия секретируемой формы ОВМ
Клетки 293-EBNA суспендировали в IMDM, содержащей 10% FCS (IMDM-10% FCS), добавляли в 24-луночный планшет, покрытый коллагеном (производимый Sumitomo Bakelite Co. Ltd.), при плотности клеток 2×105/2 мл/лунку и культивировали в течение ночи. Клетки трансфецировали 1 мкг pCEPshOBM или рСЕР4 с использованием 4 мкл Липофектамина (Gibco Co.). После культивирования в течение 2 дней в 0,5 мл бессывороточной IMDM или IMDM-10% FCS собирали культуральные супернатанты. Экспрессию секретируемой формы ОВМ человека в культуральном супернатанте обнаруживали следующим образом. Бикарбонат натрия добавляли к культуральному супернатанту до конечной концентрации 0,1 М, и эти смеси добавляли в 96-луночный планшет. Планшету давали стоять в течение ночи при 4°С для иммобилизации тем самым ОВМ человека в культуральных супернатантах на 96-луночном планшете. Планшет блокировали раствором Block Асе™ (Snow Brand Milk Products Co., Ltd.), разбавленным в 4 раза PBS (B-PBS), и давали стоять в течение 2 часов при комнатной температуре. После добавления к каждой лунке 3-100 нг/мл OCIF, разбавленного B-PBS, планшету давали стоять в течение 2 часов при 37°С с последующим промыванием PBS, содержащим 0,05% Polysolvate 20 (P-PBS). Затем в каждую лунку добавляли 100 мкл меченных пероксидазой кроличьих поликлональных антител против OCIF, описанных в WO 96/26217, которые были разбавлены B-PBS. После стояния в течение 2 часов при 37°С лунки промывали шесть раз P-PBS. Затем добавляли ТМВ-раствор (ТМВ Soluble Reagent, High Sensitivity, ScyTek Co.) в количестве 100 мкл на лунку и давали стоять при комнатной температуре в течение ~10 минут. Реакцию останавливали добавлением 100 мкл останавливающего раствора (стоп-раствора) (Stopping Reagent, ScyTek Co.) в каждую лунку. Поглощение при 450 нм для каждой лунки измеряли микропланшет-ридером. Эти результаты представлены на Фиг.21, которая показывает, что поглощение при 450 нм увеличивалось соответственно концентрации добавленного OCIF в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных pCEPshOBM. С другой стороны, не наблюдали увеличения поглощения в лунках, в которых была иммобилизована кондиционированная среда клеток, трансфецированных вектором рСЕР4. Фиг.22 показывает результаты эксперимента, в котором соотношение кондиционированной среды, использованной для иммобилизации, изменяли в диапазоне 5-90% в присутствии постоянной концентрации OCIF (50 нг/мл). Поглощение при 450 нм увеличивалось пропорционально увеличению кондиционированной среды в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных pCEPshOBM, тогда как такого увеличения в поглощении не наблюдали в планшете, в котором была иммобилизована кондиционированная среда клеток, трансфецированных вектором рСЕР4. Эти результаты подтвердили, что секретируемая форма ОВМ человека продуцируется в кондиционированную среду клеток, трансфецированных pCBPshOBM.
Пример 25
Экспрессия слитого белка тиоредоксин-ОВМ человека (Trx-hOBM)
(1) Конструированние вектора, экспрессирующего слитый белок тиоредоксин-ОВМ человека (Trx-hOBM)
10 мкл 10х ExTaq-буфера (Takara Shuzo Co.), 8 мкл 10 мМ dNTP (Takara Shuzo Co.), 77,5 мкл стерилизованной дистиллированной воды, 2 мкл водного раствора pUC19hOBM (10 нг/мл), 1 мкл праймера, мышиного ОВМ#3 (100 пмоль/мкл, Таблица последовательностей, SEQ ID №9), 1 мкл праймера, hOBMSalR2 (100 пмоль/мкл, Таблица последовательностей, SEQ ID №14) и 0,5 мкл ExTaq (5 Е/мкл) (Takara Shuzo Со.) смешивали и подвергали реакции (ПЦР-реакции) в микроцентрифужной пробирке. После реакции при 95°С в течение 5 мин, при 50°С в течение 1 сек, при 55°С в течение 1 мин, при 74°С в течение 1 сек и при 72°С в течение 5 мин циклическую реакцию, состоящую из реакции при 96°С в течение 1 мин, при 50°С в течение 1 сек, при 55°С в течение 1 мин, при 74°С в течение 1 сек и при 72°С в течение 3 мин, повторяли 25 раз. Из всей реакционной смеси очищали ДНК-фрагмент (750 п.н.). Все количество очищенного ДНК-фрагмента расщепляли рестриктазами SalI (Takara Shuzo Со.) и BspHI (New England Biolabs Co.) и подвергали электрофорезу на 1% агарозном геле для получения очищенного ДНК-фрагмента (Фрагмент 1, ~320 п.н.). Этот фрагмент растворяли в 20 мкл стерилизованной дистиллированной воды. Таким же образом ДНК-фрагмент (Фрагмент 2, ~450 п.н.), полученный расщеплением 4 мкг pUC19hOBM рестриктазами BamHI и BspHI (Takara Shuzo Co.), и ДНК-фрагмент (Фрагмент 3, ~3,6 т.п.н.), полученный расщеплением 2 мкг pTrXFus (Invitrogen Co.) рестриктазами BamHI и SalI (Takara Shuzo Co.), соответственно очищали и растворяли в 20 мкл стерилизованной дистиллированной воды. QIAEXII gel extraction kit использовали для очистки ДНК-фрагментов. Фрагменты 1-3 лигировали инкубированием при 16°С в течение 2,5 часов с использованием набора для лигирования ДНК DNA ligation kit ver.2 (Takara Shuzo Co.). С использованием реакционной жидкости лигирования штамм Escherichia coil G1724 (Invitrogen) трансформировали по способу, описанному в руководстве Instruction Manual of ThioFusion Expression System (Invitrogen Co.). Штамм микроорганизма с плазмидой, в которой кДНК-фрагмент hOBM слит в рамке считывания с геном тиоредоксина, отбирали из полученных устойчивых к ампициллину трансформантов анализом рестрикционных карт ДНК, полученных расщеплением рестриктазами, и определением последовательности ДНК. Полученный таким образом штамм микроорганизма был назван G1724/pTrxhOBM.
(2) Экспрессия Trx-hOBM в Escherichia coli
Плазмиды G1724/pTrxhOBM и G1724, содержащую pTrxFus (G1724/pTrxFus), культивировали соответственно шесть часов при встряхивании при 30°С в 2 мл культуральной среды RMG-Amp (0,6% Na2HPO4, 0,3% КН2РO4, 0,05% NaCl, 0,1% NH4Cl, 1,2% казаминокислота (Difco Co.), 1% глицерин, 1 мМ MgCl2 и 100 мкг/мл ампициллина, рН 7,4). 0,5 мл бульона добавляли к 50 мл Индукционной культуральной среды (0,6% Na2HPO4, 0,3% КН2РO4, 0,05% NaCl, 0,1% NH4Cl, 0,2% казаминовые кислоты, 0,5% глюкоза, 1 мМ MgCl2 и 100 мкг/мл ампициллина, рН 7,4) и культивировали при встряхивании при 30°С. Когда ОD600 нм достигала ~0,5, добавляли L-триптофан до конечной концентрации 0,1 мг/мл и затем культивировали при встряхивании при 30°С еще в течение 6 часов. Культуральный бульон центрифугировали при 3000 × g для сбора клеток, которые суспендировали в 12,5 мл PBS. Суспензию подвергали обработке ультразвуком (Ultrasonics Co.) для разрушения клеток. Разрушенные клетки центрифугировали при 7000 х g в течение 30 минут с получением супернатанта в качестве фракции растворимого белка. 10 мкл этой фракции растворимого белка подвергали электрофорезу в SDS-ПААГ (10% ПААГ) при восстанавливающих условиях. В результате, как показано на Фиг.23, полосу с молекулярной массой 40000, которую не обнаруживали во фракции растворимого белка G1724/pTrxFus, наблюдали во фракции растворимого белка G1724/pTrxhOBM (Фиг.14). Таким образом, было подтверждено, что слитый белок (Trx-hOBM) тиоредоксина и ОВМ человека экспрессировался в Escherichia coli.
(3) Способность связывания Trx-hOBM с OCIF
Связывание экспрессируемого Trx-hOBM с OCIF подтверждали в соответствии со следующим экспериментом. Антитела против тиоредоксина (Invitrogen Co.), которые разводили в 5000 раз 10 мМ раствором бикарбоната натрия, добавляли в 96-луночный иммунопланшет (Nunc Co.) в количестве 100 мкл на лунку. После стояния в течение ночи при 4°С жидкость в лунках выбрасывали. 200 мкл раствора, приготовленного разведением в два раза Block Асе™ (Snow Brand Milk Products Co., Ltd.) при помощи PBS (BA-PBS), добавляли в каждую лунку. После стояния в течение 1 часа при комнатной температуре лунки промывали три раза P-PBS. В каждую лунку добавляли по 100 мкл фракций растворимого белка, происходящих из вышеописанных G1724/pTrxhOBM25 или G1724/pTrxFus, разбавленных (каждая) BA-PBS в различных концентрациях. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали три раза P-PBS и добавляли 100 мкл OCIF (100 нг/мл), который разбавляли BA-PBS. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали три раза P-PBS и добавляли 100 мкл меченных пероксидазой антител против OCIF (описанных в WO 96/26217), разбавленных в 2000 раз BA-PBS. После стояния в течение 2 часов при комнатной температуре каждую лунку промывали шесть раз P-PBS и добавляли 100 мкл ТМВ-раствора. После стояния в течение приблизительно 10 минут при комнатной температуре в каждую лунку добавляли 100 мкл стоп-раствора (Stopping Reagent, ScyTek Co.). Поглощение каждой лунки при 450 нм измеряли микропланшет-ридером. Результаты показаны на Фиг.24. Не было различия в поглощении между пробой с добавленной к ней фракцией растворимого белка, происходящей из G1724/pTrxFus, и пробой без добавления этой фракции растворимого белка. С другой стороны, поглощение увеличивалось в пробах, к которым была добавлена фракция растворимого белка, происходящая из G1724/pTrxhOBM, пропорционально концентрации фракции растворимого белка. Результаты другого эксперимента, в котором скорость разбавления фракции растворимого белка поддерживалась постоянной (1%), в то время как добавляли OCIF, разбавленный BA-PBS, в различных концентрациях (0-100 нг/мл), представлены на Фиг.25. Можно видеть, что поглощение оставалось низким при любых концентрациях OCIF в пробах при использовании фракции растворимого белка, происходящей из G1724/pTrxFus, тогда как поглощение увеличивалось пропорционально концентрации OCIF в пробах, к которым добавляли фракцию растворимого белка, происходящую из G1724/pTrxhOBM. На основании этих результатов было подтверждено, что Trx-hOBM, полученный из G1724/pTrxhOBM, обладает способностью связывания с OCIF.
(4) Крупномасштабное культивирование Escherichia coli, продуцирующей Trx-hOBM
Клетки G1724/pTrxhOBM распределяли на RMG-Amp-агаре (0,6% Nа2HPO4, 0,3% КН2РO4, 0,05% NaCl, 0,1% NH4Cl, 2% казаминокислота, 1,5% агар, рН 7,4) платиновой петлей 100р. Клетки культивировали в течение ночи при 30°С. Культивированные клетки суспендировали в 10 мл Индукционной среды. По 5 мл суспензии добавляли в каждую из двух колб Эрленмейера на 2 л, содержащую 500 мл Индукционной среды, и культивировали при 30°С при встряхивании. При достижении ОD600 нм ~0,5 добавляли L-триптофан до конечной концентрации 0,1 мг/мл. Культивирование со встряхиванием продолжали в течение 6 часов при 30°С. Культуральный бульон центрифугировали в течение 20 минут при 3000 × g для сбора клеток, которые суспендировали в 160 мл PBS. Суспензию подвергали обработке генератором ультразвука (Ultrasonics Со.) для разрушения клеток. Супернатант центрифугировали в течение 30 минут при 7000 х g для получения фракции растворимого белка.
(5) Приготовление аффинной колонки с иммобилизованным OCIF
2 г TSKgel AF-TolesyI Toyopal 650 (Tosoh Corp.) и 40 мл 1,0 М содержащего фосфат калия буфера (рН 7,5), содержащего 35,0 мг рекомбинантного OCIF, полученного по способу, описанному в WO 96/26217, смешивали. Смесь осторожно качали в течение ночи при 4°С для выполнения реакции связывания. Реакционную смесь центрифугировали для удаления супернатанта. Для инактивации избыточных активных остатков к осажденному носителю добавляли 40 мл 0,1 М Трис-НСl-буфера (рН 7,5) и смесь осторожно качали при комнатной температуре в течение 1 часа. Носитель в колонке промывали буфером 0,1 М глицин-НСl (рН 3,3), содержащим 0,01% Polysorbate 80 и 0,2 М NaСl, и буфером с 0,1 М цитратом натрия (рН 2,0), содержащим 0,01% Polysorbate 80 и 0,2 М NaCl. Носитель в колонке уравновешивали внесением дважды буфера с 10 мМ фосфатом натрия (рН 7,4), содержащим 0,01% Polysorbate 80.
(6) Очистка Trx-hOBM при помощи аффинной колонки с иммобилизованным OCIF
Если нет других указаний, очистку Trx-hOBM проводили при 4°С. Вышеупомянутый аффинный носитель с иммобилизованным OCIF (10 мл) и фракцию растворимого белка (120 мл), полученную в Примере 25(4), смешивали. Смесь осторожно перемешивали в течение ночи при 4°С в четырех центрифужных пробирках на 50 мл при помощи ротора. Колонку Econo-column™ (внутренний диаметр 1,5 см, длина 15 см, производимая BioRad Co.) заполняли носителем в этой смеси. Колонку загружали 300 мл PBS, содержащим 0,01% Polysorbate 80, 100 мл содержащего 10 мМ фосфат натрия буфера (рН 7,0), содержащего 0,01% Polysorbate 80 и 0,2 М NaCl, и 100 мл 0,1 М глицин-НСl-буфера (рН 3,3), содержащего 0,01% Polysorbate 80 и 0,2 М NaCl, в этой последовательности. Затем белки, адсорбированные в колонке, элюировали 0,1 М цитрат натрия-буфером (рН 2,0), содержащим 0,01% Polysorbate 80 и 0,2 М NaCl. Элюат собирали в виде фракций по 5 мл. Каждую фракцию, собранную таким образом, сразу же нейтрализовали добавлением 10% объема 2 М Трис-буфера (рН 8,0). Присутствие или отсутствие Trx-hOBM в элюированных фракциях определяли согласно способу, описанному ранее в Примере 25(3) (по способности связывания с OCIF). Фракции, содержащие Trx-hOBM, собирали и дополнительно очищали.
(7) Очистка Trx-hOBM гель-фильтрацией
~25 мл фракций Trx-hOBM, полученных в Примере 25(6), концентрировали до ~0,5 мл центрифугированием с использованием Centriplus 10 и Centricon 10 (Amicon Co.). Эту пробу наносили на колонку Superose 12 HR 10/30 (1,0×30 см, Pharmacia Co.), предварительно уравновешенную PBS, содержащим 0,01% Polysorbate 80. Для разделения в качестве подвижной фазы использовали PBS, содержащий 0,01% Polysorbate 80, при скорости тока 0,25 мл/мин. Элюат из колонки собирали порциями по 0,25 мл. Trx-hOBM в собранных таким образом фракциях детектировали по способу, описанному ранее в Примере 25(3), и при помощи электрофореза в SDS-ПААГ. Фракции, содержащие очищенный Trx-hOBM, собирали и определяли концентрацию белка Trx-hOBM. Измерение концентрации белка проводили с бычьим сывороточным альбумином в качестве стандартного вещества с использованием тест-набора DC-Protein (BioRad Co.).
Пример 26
Индуцирующая образование остеокластов активность hOBM
phOBM и pcDL-SR α296 соответственно трансфицировали в клетки COS-7 с использованием Липофектамина (Gibco Co.). Клетки культивировали в DMEM, содержащей 10% FCS, в течение 1 дня, трипсинизировали, высевали на покровные стекла (15 мм, округлой формы, производимые Matsunami Co.) в 24-луночных планшетах при 5×104 клеток на лунку и культивировали в течение 2 дней. Культуральный планшет промывали один раз PBS. Клетки фиксировали PBS, содержащим 1% параформальдегид, при комнатной температуре в течение 8 минут. Планшет, на котором были прикреплены фиксированные клетки, промывали 6 раз PBS, затем в каждую лунку добавляли 700 мкл мышиных клеток селезенки, суспендированных при 1×106/мл в α-МЕМ, содержащей 10-8 М активную форму витамина D3, 10-7 M дексаметазон и 10% фетальную бычью сыворотку. Minicell PCF (Millipore Co.) устанавливали в каждой лунке и добавляли суспензию клеток ST2 в вышеупомянутой культуральной среде (4×104/мл), 700 мкл на лунку, в Millicell PCF, с последующим инкубированием при 37°С в течение 6 дней. После культивирования Millicell PCF удаляли, планшет промывали один раз PBS и клетки фиксировали раствором ацетон-этанол (50:50) в течение 1 минуты. Затем клетки, обнаруживающие устойчивую к винной кислоте активность кислой фосфатазы (TRAP), являющуюся специфическим маркером для остеокласта, селективно окрашивали с использованием набора LEUKOCYTE ACID PHOSPHATASE kit (Sigma Co.). Микроскопическое наблюдение показало, что TRAP-позитивные клетки не обнаруживались в лунках, в которых были фиксированы клетки COS-7, трансфецированные pcDL-SR α296. В противоположность этому, 65±18 (среднее значение±стандартное отклонение, n=3) TRAP-позитивных клеток наблюдали в лунках, в которых были фиксированы клетки COS-7, трансфицированные phOBM. Кроме того, экспрессия рецептора кальцитонина была подтверждена тем фактом, что 125I-меченый кальцитонин лосося (Amersham Co.) специфически связывался с этими TRAP-позитивными клетками. Эти открытия доказали, что ОВМ человека, который предоставляет белок, кодируемый при помощи кДНК данного изобретения, обладает индуцирующей образование остеокластов активностью.
Пример 27
Индуцирующая образование остеокластов активность Trx-hOBM и декретируемой формы ОВМ человека
Мышиные клетки селезенки суспендировали в α-МЕМ, содержащей 10-8 М активную форму витамина D3, 10-7 М дексаметазон и 10% фетальную бычью сыворотку, при концентрации 2×106/мл. Эту суспензию добавляли в 24-луночный планшет в количестве 350 мкл на лунку. Затем каждую лунку загружали 350 мкл раствора, полученного разбавлением очищенного Trx-hOBM вышеуказанной культуральной средой (40 нг/мл), 350 мкл раствора, полученного 10-кратным разбавлением кондиционированной среды, которую получали культивированием клеток 293-EBNA, в которые были трансфецированы pCEPshOBM или рСЕР4, в культуральной среде IMDM-10% FGS, вышеуказанной культуральной средой, или 350 мкл только вышеуказанной культуральной среды. В каждую лунку помещали Millicell PCF (Millipore Co.), к которому добавляли 600 мкл клеток ST2, суспендированных в вышеуказанной культуральной среде (4×104/мл). После культивирования в течение шести дней Millicell PCF удаляли. Планшет промывали один раз PDS и клетки фиксировали раствором ацетон-этанол (50:50) в течение 1 минуты. Затем клетки, проявляющие устойчивую к винной кислоте активность кислой фосфатазы (TRAP-активность), селективно окрашивали с использованием набора LEUKOCYTE ACID PHOSPHATASE kit (Sigma Co.). Микроскопическое наблюдение показало, что в лунках, к которым не добавляли Trx-hOBM, не обнаруживались клетки, проявляющие TRAP-активность, тогда как 115±19 (среднее значение±стандартное отклонение, n=3) TRAP-позитивных клеток наблюдали в лунках, к которым добавляли Trx-hOBM. Подобным образом в то время как в лунках, к которым была добавлена кондиционированная среда клеток 293-EBNA, трансфецированных рСЕР4, не обнаруживали клеток, проявляющих TRAP-активность, 125±23 (среднее значение±стандартное отклонение, n=3) TRAP-позитивных клеток наблюдали в лунках, к которым была добавлена кондиционированная среда клеток 293-EBNA, трансфецированных pCEPshOBM. Кроме того, экспрессия рецептора кальцитонина была подтверждена тем фактом, что 125I-меченый кальцитонин лосося (Amersham Co.) связывается с этими TRAP-позитивными клетками. Эти результаты доказали, что Тrх-рОВМ и секретируемая форма hОВМ проявляют ингибирующую образование остеокластов активность.
Пример 28
Получение поликлональных антител
Мышиный sОВМ или sOBM человека, использованный в качестве иммуногена, получали согласно способу, описанному выше. В частности, кДНК мышиного sОВМ (кДНК, SEQ ID №18), кодирующую мышиный sOBM (SEQ ID №16), который не имеет района связывания с мембраной мышиного ОВМ вследствие отсутствия аминокислот от N-конца до 72-й аминокислоты) или кДНК sOBM человека (кДНК, SEQ ID №19), кодирующую sOBM человека (SEQ ID №17), который не имеет района связывания с мембраной ОВМ человека вследствие отсутствия аминокислот от N-конца до 71-й аминокислоты), лигировали с фрагментом HindIII/EcoRV (5,2 т.п.н.) экспрессирующего вектора pSec TagA (Invitrogen Co.), включающим нуклеотидную последовательность, кодирующую сигнальный пептид к-цепи иммуноглобулина, вместе с фрагментом EcoRI/PmaCI (0,32 т.п.н.) кДНК ОВМ, с использованием набора для лигирования (ver. 2, Takara Shuzo Co.). Escherichia coli DH5α трансформировали продуктом реакции. Плазмиды, полученные из образующихся устойчивых к ампициллину штаммов, очищали щелочным SDS-cnocoбом и расщепляли рестриктазой для отбора плазмиды с фрагментами 0,6 т.п.н. и 0,32 т.п.н., встроенными в pSec TagA. Последовательность этой плазмиды идентифицировали с применением набора Dyedeoxyterminator Cycle Sequencing FS kit (продукта Perkin Elmer Co.). В результате было подтверждено, что эта плазмида имеет последовательность, кодирующую sOBM мыши или sOBM человека. После расщепления плазмиды рестриктазами NheI/XhoI фрагмент (1,0 т.п.н.), соответствующий кДНК секретируемой формы ОВМ, извлекали электрофорезом в агарозном геле. Этот фрагмент встраивали во фрагмент NheI/XhoI (10,4 т.п.н.) экспрессирующего вектора рСЕР4 (Invitrogen Co.) с применением набора для лигирования. Escherichia coli DH5α трансформировали продуктом реакции. Плазмиды очищали щелочным SDS-способом из полученных устойчивых к ампициллину штаммов. Анализом этих плазмид путем расщепления рестриктазой был отобран штамм Escherichia coli, обладающий экспрессирующей плазмидой ОВМ секретируемого типа (рСЕР sOBM), имеющей целевую структуру. Этот штамм Escherichia coli, имеющий рСЕР sOBM, культивировали и рСЕР sOBM очищали с применением набора Qiafilter plasmid midy kit (Qiagen Co). Затем клетки 293-EBNA суспендировали в среде IMDM (IMDM-10% FCS), содержащей 10% FCS, и высевали на 24-луночный планшет, покрытый коллагеном (продукт Sumitomo Bakelite Co., Ltd.) при плотности клеток 2×105/2 мл/лунку. После культивирования в течение ночи клетки трансформировали 1 мкг рСЕР sOBM или рСЕР4 с использованием 4 мкл Липофектамина (Gibco Co.) и культивировали далее в течение 2 дней в 0,5 мл бессывороточной IMDM или IMDM-10% FCS. Культуральный супернатант извлекали. Клеточную линию с высокой продуктивностью рекомбинантного мышиного растворимого ОВМ (msOBM) или человеческого растворимого ОВМ (hsOBM) подвергали скринингу следующим образом. Бикарбонат натрия добавляли к культуральному супернатанту, который предположительно содержал msOBM или hsOBM, до конечной концентрации 0,1 М. 100 мкл культурального супернатанта добавляли в каждую лунку 96-луночных иммунопланшетов (Nunc Co.) и давали им стоять в течение ночи при 4°С, посредством чего msOBM или hsOBM в культуральном супернатанте был иммобилизован на каждой лунке. В каждую лунку добавляли 200 мкл раствора Block Асе™ (Snow Brand Milk Products Co., Ltd.), разбавленного в 4 раза PBS (B-PBS), и планшетам давали стоять в течение 2 часов при комнатной температуре. После промывания каждой лунки в планшетах три раза PBS (P-PBS), содержащим 0,1% Polysorbate 20, 100 мкл каждого раствора рекомбинантного OCIF (rOCIF) (3-100 нг/мл), серийно разведенного P-PBS, добавляли в каждую лунку в планшетах. Планшетам давали стоять в течение 2 часов при 37°С. После промывания планшетов три раза PBS в каждую лунку добавляли 100 мкл меченных пероксидазой поликлональных антител против OCIF (WO 96/26217), разведенных B-PBS. После стояния в течение 2 часов при 37°С лунки промывали шесть раз P-PBS. Затем 100 мкл ТМВ-раствора (ТМВ Soluble Reagent, High Sensitivity ScyTek Co.) добавляли в каждую лунку в планшетах и планшетам давали стоять при комнатной температуре в течение приблизительно 10 минут, затем реакцию останавливали добавлением 100 мкл стоп-раствора (Stopping Reagent, ScyTek Co.) в каждую лунку. Поглощение при 450 нм каждой лунки измеряли при помощи микропланшет-ридера. Было подтверждено, что поглощение значимо увеличивалось пропорционально концентрации добавленного OCIF в планшетах, в которых был иммобилизован msOBM или hsOBM в культуральном супернатанте клеточной линии, продуцирующей msOBM или hsOBM.
Клеточная линия, которая обнаруживала высокую скорость увеличения поглощения, была отобрана в качестве штамма с высокой продуктивностью. Полученные таким образом клетки 293-EBNA с высокой продуктивностью msOBM или hsOBM культивировали крупномасштабно в среде IMDM, содержащей 5% FCS, с применением 25 Т-колб (Т-225). После достижения конфлюентности клеток в каждую из Т-225 колб добавляли свежую культуральную среду в количестве 100 мл на колбу и клетки культивировали в течение 3-4 дней для сбора культурального супернатанта. Эти процедуры повторяли 4 раза с получением 10 л культурального супернатанта, содержащего msOBM или hsOBM. Очищенный msOBM (10 мг) или hsOBM (12 мг), обнаруживающий гомогенную полосу (молекулярная масса 32 кДа) при электрофорезе в SDS-полиакриламидном геле, получали из культурального супернатанта при помощи аффинной хроматографии на колонке с иммобилизованным OCIF и гель-фильтрационной хроматографии согласно способу, описанному в Примерах 25(6) и 25(7). Каждый полученный таким образом очищенный препарат использовали в качестве антигена для иммунизации. Каждый полученный белковый антиген растворяли в забуференном фосфатом солевом растворе (PBS) до концентрации 200 мкг/мл и эмульгировали с эквивалентным объемом полного адъюванта Фрейнда. 1 мл этой эмульсии вводили подкожно для иммунизации каждому из трех японских белых кроликов приблизительно 1 раз в неделю. Бустер-инъекцию давали при достижении максимального титра антител. Цельную кровь собирали через 10 дней после этого. Сыворотку разводили в 2 раза буфером для связывания для хроматографии на Протеин А-Сефарозной колонке (BioRad Со.) и наносили на Протеин А-колонку, уравновешенную тем же буфером. После интенсивного промывания этой колонки тем же буфером антитела против sOBM, адсорбированные на колонке, элюировали буфером для элюции (BioRad Co.) или 0,1 М глицин-HCl-буфером, рН 3,0. Для немедленной нейтрализации элюата элюат фракционировали с применением тест-пробирок, содержащих небольшое количество 1,0 М Трис-НСl (рН 8,0). Элюат диализовали против PBS в течение ночи при 4°С. Содержание антител в растворе антител измеряли по методу Лоури с применением бычьего IgG в качестве стандартного белка. Так получали ~10 мг очищенного иммуноглобулина (IgG), включающего поликлональные антитела данного изобретения, на 1 мл кроличьей антисыворотки.
Пример 29
Измерение ОВМ и sOBM при помощи ELISA с использованием поликлональных антител
Сэндвич-ELISA выполняли с использованием кроличьих поликлональных антител против sOBM человека, полученных в Примере 28, в качестве твердофазного антитела и меченного ферментом антитела. Меченные пероксидазой (POD) антитела получали согласно способу Ishikawa (Isikawa et al., J. Immunoassay, Vol. 4, 209-327, 1983).
Поликлональные антитела против sOBM человека, полученные в Примере 28, растворяли в 0,1 М NаНСО3 до концентрации 2 мкг/мл. 100 мкл полученного раствора добавляли в каждую лунку в 96-луночных иммунопланшетах (Nunc Co.), которым затем давали стоять при комнатной температуре в течение ночи. Затем 200 мкл 50% Block Асе™ (Snow Brand Milk Products Co., Ltd.) добавляли в каждую лунку и планшетам давали стоять в течение 1 часа при комнатной температуре. Лунки промывали 3 раза PBS, содержащим 0,1% Polysorbate 20 (буфер для промывания).
ОВМ человека экспрессировали согласно способу Примера 26 и очищали согласно способу Примера 2. Очищенный ОВМ человека и очищенный sОВМ человека, полученные в Примере 28, серийно разводили первым реакционным буфером (0,2 М Трис-НСl-буфер, рН 7,2, содержащий 40% Block Асе и 0,1% Polysorbate 20) соответственно и 100 мкл разведенного раствора добавляли в каждую лунку в планшетах. Планшетам давали стоять при комнатной температуре в течение 2 часов и промывали 3 раза вышеуказанным буфером для промывания. Затем в каждую лунку на планшетах добавляли 100 мкл POD-меченых поликлональных антител против sОВМ человека, разведенных в 1000 раз вторым реакционным буфером (0,1 М Трис-НСl-буфер, рН 7,2, содержащий 25% Block Асе и 0,1% Polysorbate 20). После стояния планшетов при комнатной температуре в течение 2 часов каждую лунку промывали 3 раза буфером для промывания. Затем в каждую лунку на планшетах добавляли 100 мкл раствора субстрата фермента (ТВМ, ScyTek Co.) и планшетам давали стоять в течение 10 минут с последующим добавлением 100 мкл останавливающего реакцию раствора (Stopping Reagent, ScyTek Co.) для остановки ферментативной реакции. Поглощение при 450 нм каждой лунки измеряли при помощи микропланшет-ридера. Результаты показаны на Фиг.26. Сэндвич-ELISA с использованием кроличьих поликлональных антител против sОВМ человека узнавал почти одинаково sOBM человека (молекулярная масса ~32 кДа) и ОВМ человека (молекулярная масса ~40 кДа) с чувствительностью измерения ~12,5×10-3 пмоль/мл (ОВМ человека ~500 пг/мл, sOBM человека ~400 пг/мл). Измерение мышиного sOBM и мышиного ОВМ при помощи ELISA с использованием кроличьих поликлональных антител против мышиного sOBM, полученных в Примере 28, могло быть проведено подобным образом. Было подтверждено, что крайне малое количество мышиного sOBM или мышиного ОВМ может быть измерено почти с той же самой чувствительностью, как описано выше.
Как упоминалось выше, поликлональные антитела против sOBM человека данного изобретения, полученные в Примере 28, могут одинаково узнавать антигены sOBM человека и ОВМ человека. Таким образом, эти антитела были названы поликлональными антителами против ОВМ/sOBM человека. Подобным образом поликлональные антитела против мышиного sOBM, полученные в Примере 28, одинаково узнают антигены sOBM и ОВМ мышей. Эти антитела были, следовательно, названы поликлональными антителами против мышиного ОВМ/sOBM.
Пример 30
Получение моноклональных антител
Очищенный sOBM человека, полученный в Примере 28, использовали в качестве антигена для иммунизации. Очищенный sOBM человека растворяли в физиологическом солевом растворе до концентрации 10 мкг/мл и эмульгировали смешиванием с равным объемом полного адъюванта Фрейнда. Эту эмульсию вводили внутрибрюшинно мышам BALB/c в дозе 200 мкл три раза, один раз в неделю, для иммунизации мышей. Затем равный объем полного адъюванта Фрейнда добавляли к физиологическому солевому раствору, содержащему 5 мкг/мл sОВМ человека и смеси давали в достаточной степени эмульгироваться. Эту эмульсию инъецировали внутрибрюшинно мышам BALB/c в дозе 200 мкл, один раз в неделю, в течение 4 недель для иммунизации. Через 1 неделю после четвертой иммунизации 100 мкл физиологического солевого раствора, содержащего 10 мкг/мл sОВМ человека, вводили внутривенно мышам BALB/c в качестве бустер-инъекции. После трех дней извлекали селезенку и выделяли клетки селезенки. Клетки селезенки сливали с клетками мышиной миеломы Р3×63-Аg8.653 в соответствии с общепринятым способом (Koehler G. and Milstein С., Nature, 256, 495 (1975)). Суспендированные слитые клетки культивировали в течение 10 дней в среде ГАТ, содержащей гипоксантин, аминоптерин и тимидин. После гибели миеломных клеток и появления гибридом среду ГАТ заменяли не содержащей аминоптерина средой ГАТ и продолжали культивирование клеток.
Пример 31
Отбор гибридомы и клонирование
Появление гибридом отмечали через 10 дней после слияния клеток в Примере 30. Моноклональные антитела, узнающие с высокой аффинностью sОВМ человека, и гибридомы, продуцирующие эти антитела, отбирали в соответствии со следующей процедурой с использованием усовершенствованного твердофазного ELISA, описанного ниже. Кроме того, для отбора моноклональных антител против ОВМ, которые узнают как sОВМ человека, так и sОВМ мыши, кроме sОВМ человека, в качестве антигена для твердофазного ELISA использовали мышиный sОВМ, полученный в Примере 27. sОВМ человека и sОВМ мыши соответственно растворяли в 0,1 М растворе бикарбоната натрия при концентрации 5 мкг/мл. 50 мл раствора каждого антигена добавляли в каждую лунку в 96-луночных иммунопланшетах (Nunc Со.). Планшетам давали стоять при 4°С в течение ночи для иммобилизации антигенов. Раствор антигена в каждой лунке выбрасывали. Затем каждую лунку заполняли 200 мкл 50% Block Асе™ (Snow Brand Milk Products Co., Ltd.) и давали стоять при комнатной температуре в течение 1 часа. После промывания каждой лунки забуференным фосфатом солевым раствором (PBS-P), содержащим 0,1% Polysorbate 20, в каждую лунку добавляли 40 мкл сыворотки теленка (Hiclone Inc.). Затем в каждую лунку добавляли 10 мкл каждого гибридомного культурального супернатанта и каждую лунку инкубировали при комнатной температуре в течение 2 часов в присутствии 80% сыворотки теленка. Целью твердофазного ELISA в присутствии 80% сыворотки теленка является отбор гибридомы, которая продуцирует антитела, которые могут обнаружить очень малое количество sОВМ человека или sОВМ мыши даже в растворе, содержащем высокую концентрацию белка, и в присутствии мешающего иммунной реакции вещества, происходящего из сыворотки, т.е. гибридомы, которая может продуцировать антитела с высокой аффинностью в отношении sОВМ человека или мышиного sОВМ. После реакции при комнатной температуре в течение 2 часов планшеты промывали PBS-P и затем в каждую лунку добавляли 50 мкл меченных пероксидазой антител против мышиного IgG (KPL Со.), разведенных в 5000 раз физиологическим солевым раствором, содержащим 25% Block Асе. После реакции при комнатной температуре в течение 2 часов планшеты промывали 3 раза PBS-P. После добавления 50 мкл раствора субстрата фермента (ТМВ, ScyTek Co.) в каждую лунку реакцию продолжали при комнатной температуре в течение 5 минут. Ферментативную реакцию останавливали добавлением 50 мкл останавливающего раствора (Stopping Reagent, ScyTek С.). Гибридомы, продуцирующие антитела, узнающие sОВМ человека или мышиный sОВМ, отбирали измерением поглощения при 450 нм каждой лунки при помощи микропланшет-ридера (Immune Reader NJ2000™, Nippon InterMed. Co.). Отбирали гибридомы, продуцирующие антитела, обнаруживающие особенно высокое поглощение (ОD450 нм). Клонирование этих гибридом по способу серийного разведения повторяли 3-5 раз для получения стабильных гибридом. Гибридомы, проявляющие особенно высокую продуктивность антител, отбирали среди установленных продуцирующих антитела гибридомных клонов.
Пример 32
Получение и очистка моноклональных антител
Продуцирующие антитела гибридомы, полученные в Примере 31, т.е. продуцирующую высокоаффинные антитела гибридому, узнающую sОВМ человека, и гибридому, продуцирующую антитела, обнаруживающие перекрестную реактивность с sОВМ мыши, культивировали соответственно. Каждую гибридому имплантировали внутрибрюшинно мышам BALB/c (1×106 клеток на мышь), которым за неделю до этого вводили пристан (Aldorich Со.). После ~2-3 недель собирали накопленное в асцитах. Моноклональные антитела, которые узнают sОВМ человека данного изобретения или как sОВМ человека, так и мышиный sОВМ в асцитах, очищали в соответствии со способом очистки поликлональных антител против ОВМ/sОВМ с использованием Протеин А-колонки, описанной в Примере 28. Очищенные моноклональные антитела получали таким образом из асцитов при помощи хроматографии на Протеин А-колонке (Pharmacia Co.).
Пример 33
Антигенная специфичность моноклональных антител
Антигенную специфичность моноклональных антител, которые специфически узнают sОВМ человека, и моноклональных антител, проявляющих перекрестную реактивность как с sОВМ человека, так и с мышиным sОВМ, исследовали с использованием sОВМ человека, интактного ОВМ человека, имеющего район связывания с мембраной, мышиного sОВМ и мышиного интактного ОВМ, имеющего район связывания с мембраной. Получали более 30 типов моноклональных антител. Результаты нескольких характерных (репрезентативных) антител показаны в Таблице 1. В результате было найдено, что большинство моноклональных антител против sОВМ человека, которые специфически узнают sОВМ человека, узнают также интактный ОВМ человека, имеющий район связывания с мембраной, но не узнают мышиный ОВМ и мышиный интактный ОВМ, который имеет район связывания с мембраной. С другой стороны, было обнаружено, что было получено только небольшое число антител, узнающих как sОВМ человека, так и мышиный sOBM, и что эти антитела обнаруживают перекрестную реактивность как в отношении ОВМ человека, так и в отношении мышиного ОВМ. Эти результаты показывают, что имеются общие сайты узнавания антигена, а именно общие эпитопы как в ОВМ человека, так и в мышином ОВМ. На основании того факта, что моноклональные антитела против sOBM человека, полученные с использованием sОВМ человека в качестве иммунного антигена, одинаково узнают также ОВМ человека, имеющий район связывания с мембраной, моноклональные антитела против sOBM человека были названы моноклональными антителами против OBM/sOBM человека.
Пример 34
Определение класса и подкласса моноклональных антител
Класс и подкласс моноклональных антител данного изобретения определяли при помощи набора для анализа классов и подклассов иммуноглобулинов в (Amersham Co.) в соответствии с указанным протоколом. Результаты для репрезентативных моноклональных антител показаны в Таблице 2. Как показано в Таблице 2, большинство моноклональных антител против OBM/sOBM человека были IgG1, другие были IgG2a и IqG2b. Легкие цепи для всех антител были к-цепями.
Пример 35
Измерение константы диссоциации (величины Кd) моноклональных антител
Константу диссоциации моноклонального антитела измеряли в соответствии с известным способом (Betrand Friguet et al.: Journal of Immunological Methods, 77, 305-319, 1986). А именно, очищенные антитела, полученные в Примере 32, разводили 0,4 М Трис-НСl-буфером (первичный буфер, рН 7,4), содержащим 40% Block Асе и 0,1% Polysorbate 20, с получением концентрации 5 нг/мл. Этот раствор смешивали с равным объемом разведенного раствора очищенного растворимого ОВМ человека (hsOBM), полученного в Примере 28, в первичном буфере с диапазоном концентраций 6,25-10 мкг/мл. Смеси давали стоять в течение 15 минут при 4°С для связывания hsOBM с моноклональным антителом. После 15 часов антитела, не связанные с hsOBM (10 мкг/мл, 100 мкл/лунку), измеряли при помощи иммобилизованного твердофазного ELISA, для расчета константы диссоциации моноклональных антител с hsOBM. Кроме того, аффинность в отношении msOBM антител, которые являются моноклональными антителами для hsOBM и также проявляют перекрестную реактивность в отношении мышиного растворимого ОВМ (msOBM), измеряли по тому же способу, но с использованием msOBM вместо hsOBM. Константы диссоциации антител, которые проявляют высокую аффинность в отношении каждого антигена и применимы для ферментного иммуноанализа и анализа связывания, показаны в Таблице 3.
В результате, константы диссоциации (Kd) Н-ОВМ 1 и Н-ОВМ 4, которые являются антителами, специфическими для растворимого ОВМ человека (hsOBM), были порядка 10-11 М, что указывает на высокую аффинность в отношении hsOBM. С другой стороны, величина Кd антитела Н-ОВМ 9, которое узнает как hsOBM, так и мышиный растворимый ОВМ (msOBM), была порядка 10-8 М для msOBM и порядка 10-9 М для hsOBM. Кроме того, константа диссоциации другого антитела, которое узнает оба антигена в Таблице 1, т.е. константа диссоциации Н-ОВМ 13 для каждого антигена, была равна Н-ОВМ 9, и эти два антитела относятся к одному и тому же подклассу. Эти факты предполагают возможность того, что они являются идентичными антителами, узнающими один и тот же эпитоп каждого антигена.
Пример 36
Способ измерения ОВМ и sOBM человека при помощи сэндвич-ELISA с использованием моноклональных антител против OBM/sOBM человека
Сэндвич-ELISA проводили с использованием двух высокоаффинных моноклональных антител, полученных в Примере 35, Н-ОВМ 1 и Н-ОВМ 4 соответственно, в виде твердофазного антитела и меченного ферментом антитела. Мечение антитела проводили с применением набора малеимид-активированной пероксидазы (Piers Co.). Антитело, Н-ОВМ 1, растворяли в 0,1 М растворе бикарбоната натрия до концентрации 10 мкг/мл и 100 мкл этого раствора добавляли в каждую лунку в 96-луночных иммунопланшетах (Nunc Co.). После стояния в течение ночи при 4°С для иммобилизации антитела раствор выбрасывали и 300 мкл раствора 50% Block Асе добавляли в каждую лунку в планшетах. Каждую лунку в планшетах блокировали выдерживанием планшетов при комнатной температуре в течение 2 часов. После блокирования планшеты промывали забуференным фосфатом солевым раствором, содержащим 0,1% Polysorbate 20 (PBS-P). OBM человека (hsOBM) и растворимый OBM человека (hsOBM) соответственно разводили 0,4 М Трис-НСl-буфером, рН 7,4, содержащим 40% Block Асе™ (Snow Brand Milk Products Co., Ltd.) и 0,1% Polysorbate 20 (Wako Pure Chemicals Co., Ltd.) (первый реакционный буфер), для приготовления тест-проб с различными концентрациями. Эти тест-пробы с различными концентрациями добавляли в каждую лунку в количестве 100 мкл на лунку и они реагировали с антителом Н-ОВМ 1, иммобилизованным на каждой лунке, при инкубировании при комнатной температуре в течение 2 часов. После 2 часов планшеты промывали PBS-P. Затем 100 мкл раствора POD-меченых антител Н-ОВМ 4 в 0,2 М Трис-НСl-буфере, рН 7,4, содержащем 25% Block Асе™ и 0,1% Polysorbate 20 (второй реакционный буфер) добавляли в каждую лунку с последующим дополнительным инкубированием при комнатной температуре в течение 2 часов. Затем планшеты промывали PBS-P и 100 мкл раствора субстрата фермента (ТМВ, ScyTek Co.) добавляли в каждую лунку для инициации реакции фермента. Ферментную реакцию останавливали добавлением 100 мкл останавливающего реакцию раствора (Stopping Reagent, ScyTek Co.) в каждую лунку. Поглощение каждой лунки при 450 нм измеряли при помощи микропланшет-ридера. Результаты показаны на Фиг.27.
В результате было подтверждено, что сэндвич-ELISA, проведенный с использованием двух моноклональных антител против OBM/sOBM человека, Н-ОВМ 1 и Н-ОВМ 4, высокоаффинных в отношении OBM/sOBM человека, полученных в Примере 35, одинаково узнает ОВМ человека и sОВМ человека и способен измерять очень небольшое количество ОВМ и sОВМ человека в количественных пределах приблизительно 1,25×10-3-2,5×10-3 пмоль/мл (~50-100 пг/мл для ОВМ человека с молекулярной массой 40 кДа, ~40-80 пг/мл для sОВМ человека с молекулярной массой 32 кДа). Гибридомы, продуцирующие эти два моноклональных антитела против OBM/sOBM человека, Н-ОВМ1 и Н-ОВМ4, были названы Н-ОВМ1 и Н-ОВМ4 соответственно. Гибридома, продуцирующая моноклональное антитело против OBM/sOBM человека (Н-ОВМ 9), которая узнает мышиный ОВМ и мышиный sОВМ и также обладает ингибирующей образование остеокластов активностью, была названа Н-ОВМ9. Эти гибридомы были депонированы в National Institute of Bioscience and Human Technology 5 ноября 1993 года под депозитными номерами FERM ВР-6264 (Н-ОВМ 1), FERM ВР-6265 (Н-ОВМ 4) и FERM BP-6266 (Н-ОВМ 9).
Пример 37
Измерение мышиного ОВМ и мышиного sОВМ с использованием моноклональных антител против OBM/sOBM человека, узнающих мышиный ОВМ и мышиный sOBM
Сэндвич-ELISA проводили с использованием моноклональных антител против OBM/sOBM человека, Н-ОВМ 9, узнающих мышиный ОВМ и мышиный sOBM, полученных в качестве твердофазных антител в Примерах 33 и 35, и поликлональных антител против мышинных ОВМ/sОВМ в качестве меченных ферментом антител, полученных в Примере 28. Мышиный ОВМ и мышиный sOBM соответственно разводили первым реакционным буфером с получением различных концентраций, как описано в Примере 35, и затем измеряли sOBM по способу, описанному в Примере 36. Результаты показаны на Фиг.28. Было обнаружено, что мышиный ОВМ и мышиный sOBM могут быть подобным образом измерены с использованием Н-ОВМ 9, которые являются моноклональными антителами против ОВМ/sОВМ человека, узнающими мышиный ОВМ и мышиный sOBM данного изобретения. Как показывают результаты Примера 35, это моноклональное антитело Н-ОВМ 9 против ОВМ/sОВМ человека имеет высокую константу диссоциации в отношении мышиного sOBM, т.е. оно имеет сравнительно низкую аффинность в отношении мышиного sOBM. Чувствительность в измерении мышиного ОВМ (молекулярная масса ~40 кДа) и мышиного ОВМ (молекулярная масса ~32 кДа) этим ELISA-тестом была приблизительно 25×10-3 пмоль/мл (~1 нг/мл для мышиного ОВМ и ~0,8 нг/мл для мышиного sOBM).
Пример 38
Ингибирующая остеокластогенез активность антител против ОВМ/sОВМ
Известно, что остеокластподобные клетки (OCL) индуцируются сокультивированием мышиных клеток селезенки и клеток ST2 (полученных из костного мозга мышей стромальных клеток; Endocrinology, 125, 1805-1813 (1989)). Была исследована способность антител против ОВМ/sОВМ ингибировать образование OCL при добавлении в систему сокультуры. Поскольку мышиный ОВМ экспрессируется в этой системе сокультуры, в этом Примере использовали кроличьи поликлональные антитела против мышиных ОВМ/sОВМ, которые узнают мышиный ОВМ, и моноклональные антитела против ОВМ/sОВМ человека (Н-ОВМ 9), которые узнают антигены как ОВМ человека, так и ОВМ мыши. 700 мкл на лунку каждого из антител против ОВМ, разведенных серийно средой α-МЕМ, содержащей 10% фетальную телячью сыворотку, и 350 мкл/лунку спленоцитов самцов мышей (2×106/мл), суспендированных в той же среде, описанной выше, добавляли в каждую лунку в 24-луночном планшете (Nunc). Затем клетки ST2, трипсинизированные и суспендированные в вышеупомянутой культуральной среде, содержащей 4×10-8 М витамин D3 и 4×10-7 М дексаметазон (8×104 клеток/мл), добавляли в каждую лунку в количестве 350 мкл/лунку с последующим культивированием в течение 6 дней при 37°С. После промывания планшетов 1 раз PBS клетки в каждой лунке фиксировали смесью этанола и ацетона (50:50) в течение 1 часа при комнатной температуре. Планшеты сушили на воздухе и 500 мкл раствора субстрата добавляли в каждую лунку в соответствии с протоколом набора LEUKOCYTE ACID PHOSPHATASE kit (Sigma Co.) с последующим инкубированием в течение 55 минут при 37°С. Только клетки, проявляющие устойчивую к винной кислоте активность кислой фосфатазы (TRAP-активность), которая является специфическим маркером для остеокластов, окрашивались при этой реакции. Планшеты промывали 1 раз дистиллированной водой, сушили на воздухе и считали число TRAP-позитивных клеток. Результаты представлены в Таблице 4. Как показано в Таблице 4, как кроличьи поликлональные антитела против мышиных ОВМ/sОВМ, так и моноклональные антитела против ОВМ/sОВМ человека, Н-ОВМ 9, узнающие мышиный ОВМ, ингибировали образование OCL зависимым от дозы образом. Было обнаружено, что эти антитела обладают ингибирующей остеокластогенез активностью подобно ингибирующему остеокластогенез фактору, OCIF/OPG, и, следовательно, являются перспективными в качестве терапевтического агента для лечения симптомов нарушения костного метаболизма.
Пример 39
Индуцирующая образование остеокластов человека активность
Тгх-ОВМ
Мононуклеарные клетки получали из цельной крови, собранной из вены здорового взрослого при помощи градиента плотности с использованием Histopaque (Sigma Co.) в соответствии с прилагаемым протоколом. Мононуклеарные клетки суспендировали при плотности клеток 1,3×106/мл в α-МЕМ, содержащей 10-7 М дексаметазон, 200 нг/мл макрофагального колониестимулирующего фактора (The Green Cross Corp.), 10% фетальную бычью сыворотку и очищенный Тrх-ОВМ (0-100 нг/мл), полученный в Примере 15. Суспензию клеток добавляли в каждую лунку в 48-луночных планшетах в количестве 300 мкл на лунку, и клетки культивировали при 37°С в течение 3 дней. После замены культурального бульона вышеуказанной культуральной средой клетки культивировали при 37°С в течение 4 дней. Культивируемые клетки, имеющие устойчивую к винной кислоте активность кислой фосфатазы (TRAP-активность) селективно окрашивались по способу, описанному в Примере 5. Число окрашенных мультинуклеатов измеряли наблюдением под микроскопом. Результаты показаны на Фиг.29. Было подтверждено, что TRAP-позитивные мультинуклеаты индуцировались зависимым от дозы образом добавлением Тrх-ОВМ, тогда как в лунках, к которым не добавляли Тrх-ОВМ, не обнаруживали TRAP-позитивных клеток. Кроме того, было обнаружено, что эти TRAP-позитивные мультинуклеаты являются позитивными в отношении рецептора витронектина, являющегося маркером для остеокластов. Кроме того, при проведении подобного культивирования клеток на пластинках из слоновой кости (ivory slices), помещенных на каждую лунку в 48-луночном планшете, образование ямок наблюдали на этих пластинках только в присутствии Тrх-ОВМ. На основании этих фактов можно заключить, что образованный Тгх-ОВМ имел активность индуцирования образования остеокластов человека.
Пример 40
Ингибирование активности резорбции костей антителами против OBM/sOBM
[45Са] -CaCl2-pacтвоp (Amersham Co.) инъецировали подкожно мыши ddY (Japan SLC Со.) на 15-й день беременнности в дозе 25 мкКи на мышь для мечения костей плода 45Са. На следующий день мышь умерщвляли для получения плода. Переднюю лапку плода извлекали и удаляли кожу и мышцу для получения длинных (трубчатых) костей. Хрящ удаляли для получения тела (стержня) трубчатых костей. Тела трубчатых костей свободно плавали одно за другим в 0,5 мл культуральной среды (BGJb-среда (GIBCO BRL company), содержащей 0,2% бычий сывороточный альбумин (Sigma Со.)) в каждой лунке в 24-луночных планшетах и их культивировали в течение 24 часов при 37°С в 5% CO2. После предкультивирования эти кости переносили в различные свежие культуральные среды (0,5 мл), каждая из которых содержала один из различных факторов резорбции костей (витамин D3, простагландин Е2, паратиреоидный гормон, интерлейкин 1α) и нормальный кроличий IgG (100 мкг/мл, в качестве контроля) или кроличьи поликлональные антитела против OBM/sOBM, полученные в Примере 28, с последующим культивированием в течение 72 часов. После культивирования длинные (трубчатые) кости помещали в 0,5 мл водного раствора 5% трихлоруксусной кислоты (Wako Pure Chemicals Co., Ltd.) и им давали стоять при комнатной температуре более 3 часов для декальцинирования. 5 мл сцинтиллятора (AQUASOL-2, PACKARD Co.) добавляли к культуральному бульону и экстракту раствора трихлоруксусной кислоты (по 0,5 мл каждого) для измерения радиоактивности 45Са, посредством чего рассчитывали отношение 45Са, который высвобождался в культуральный бульон в результате резорбции кости. Результаты показаны на Фиг.30-33. В результате было обнаружено, что витамин D3 (10-8 М) увеличивает активность резорбции костей, но кроличьи поликлональные антитела против OBM/sOBM подавляли резорбцию костей, стимулируемую витамином D3, зависимым от концентрации образом, полностью ингибируя увеличенную резорбцию костей при концентрации 100 мкг/мл (Фиг.30). Простагландины Е2 (10-6 М) и паратиреоидный гормон (100 нг/мл) также увеличивали активность резорбции костей. Однако добавление 100 мкг/мл кроличьих поликлональных антител почти польностью ингибировало резорбцию костей, стимулируемую простагландинами Е2 и паратиреоидным гормоном (Фиг.31 и 32). С другой стороны, нормальный кроличий IgG (100 мкг/мл), который использовали в качестве позитивного контроля, не влиял на активность резорбции костей, индуцированную простагландинами E2 и паратиреоидным гормоном. Резорбция костей увеличивалась также интерлейкином 1α (10 нг/мл), но значимо ингибировалась добавлением кроличьих поликлональных антител против OBM/sOBM (100 мкг/мл) (Фиг.33). На основании этих результатов очевидно, что антитела данного изобретения являются превосходным веществом в качестве ингибитора резорбции костей. Результаты, полученные в сходном эксперименте с использованием Н-ОВМ 9, которые являются мышиными антителами против OBM/sOBM человека, подтвердили, что эти антитела обнаруживают почти равноценное ингибирующее резорбцию костей действие, что и кроличьи поликлональные антитела против OBM/sOBM.
Промышленная применимость
Данное изобретение обеспечивает новый белок, который специфически связывается с ингибирующим остеокластогенез фактором (OCIF), способ получения этого белка, способ скрининга на вещество, которое регулирует экспрессию этого белка, с использованием этого белка, способ скрининга на вещество, которое ингибирует или модулирует активность этого белка, способ скрининга на рецептор, который передает (трансдуцирует) активность этого белка посредством связывания с ним, фармацевтическую композицию, которая содержит вещество, полученное этими способами скрининга, антитело к этому белку и агент (средство) для лечения нарушения костного метаболизма с использованием этого антитела.
Кроме того, данное изобретение обеспечивает ДНК, кодирующую новый белок (OCIF-связывающую молекулу), который связывается с ингибирующим остеокластогенез фактором (OCIF), белок, который имеет аминокислотную последовательность, кодируемую этой ДНК, способ получения белка, специфически связывающегося с OCIF, с использованием этой ДНК согласно генно-инженерному способу, и агент, содержащий этот белок, для лечения акатастазии костного метаболизма. Кроме того, данное изобретение обеспечивает способ скрининга на вещество, которое регулирует экспрессию OCIF-связывающей молекулы, способ скрининга на вещество, которое ингибирует или модулирует активность OCIF-связывающей молекулы путем связывания с ней, способ скрининга на рецептор, который передает (трансдуцирует) активность OCIF-связывающей молекулы путем связывания с ней, и фармацевтическую композицию, которая содержит вещество, полученное этими способами скрининга.
Кроме того, данное изобретение обеспечивает ДНК, кодирующую новый белок человека, способный связываться с ингибирующим остеокластогенез фактором, OCIF (OCIF-связывающую молекулу человека, ОВМ человека), белок, содержащий аминокислотную последовательность, кодируемую этой ДНК, способ получения белка, имеющего характеристики специфического связывания с OCIF и проявляющего биологическую активность поддержания и усиления дифференцировки и созревания остеокластов при помощи способа генной инженерии, и агент для лечения нарушения костного метаболизма с использованием этого белка. Кроме того, данное изобретение обеспечивает способ скрининга на вещество, которое регулирует экспрессию OCIF-связывающей молекулы, способ скрининга на вещество, которое ингибирует или модулирует активность OCIF-связывающей молекулы путем связывания с ней, способ скрининга на рецептор, который передает (трансдуцирует) биологическую активность OCIF-связывающей молекулы путем связывания с ней, фармацевтическую композицию, которая содержит вещество, полученное этими способами скрининга, антитело к ОСIF-связывающему белку человека и агент для предупрежедения и/или лечения симптомов нарушения костного метаболизма с использованием этого антитела.
Кроме того, данное изобретение обеспечивает антитела, которые узнают оба антигена (антитела против ОВМ/sОВМ), один из которых является мембраносвязанным белком, который специфически связывается с OCIF (OCIF-связывающей молекулой; ОВМ), а другой является растворимым ОВМ (sОВМ), который не имеет района связывания с мембраной, способ получения этого антигена, способ измерения ОВМ и sОВМ с использованием этих антител и агент для предупреждения и/или лечения симптомов нарушения костного метаболизма с использованием этих антител в качестве эффективного компонента.
Белок и антитела, полученные способом данного изобретения, применимы в качестве лекарственных препаратов и/или реагентов для целей исследований и анализов.
Описание депонированных микроорганизмов
(1) Название и адрес учреждения-депозитария, в котором был депонирован микроорганизм
Agency of Industrial Science and Technology 1-3,
Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken,
Japan (postal code 305)
Дата депонирования в учреждении-депозитарии
23 мая 1997 года
Номер депозита
FERM ВР-5953
(2) Название и адрес учреждения-депозитария, в котором был депонирован микроорганизм
Agency of Industrial Science and Technology 1-3,
Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken,
Japan (postal code 305)
Дата депонирования в учреждении-депозитарии
13 августа 1997 года
Номер депозита
FERM BP-6058
(3) Название и адрес учреждения-депозитария, в котором был депонирован микроорганизм
Agency of Industrial Science and Technology 1-3,
Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken,
Japan (postal code 305)
Дата депонирования в учреждении-депозитарии
5 ноября 1997 года (первоначальная дата депонирования)
Номер депозита
FERM ВР-6264
(4) Название и адрес учреждения-депозитария, в котором был депонирован микроорганизм
Agency of Industrial Science and Technology 1-3, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan (postal code 305)
Дата депонирования в учреждении-депозитарии
5 ноября 1997 года (первоначальная дата депонирования)
Номер депозита
FERM BP-6265
(5) Название и адрес учреждения-депозитария, в котором был депонирован микроорганизм
Agency of Industrial Science and Technology 1-3, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan (postal code 305)
Дата депонирования в учреждении-депозитарии
5 ноября 1997 года (первоначальная дата депонирования)
Номер депозита
FERM BP-6266















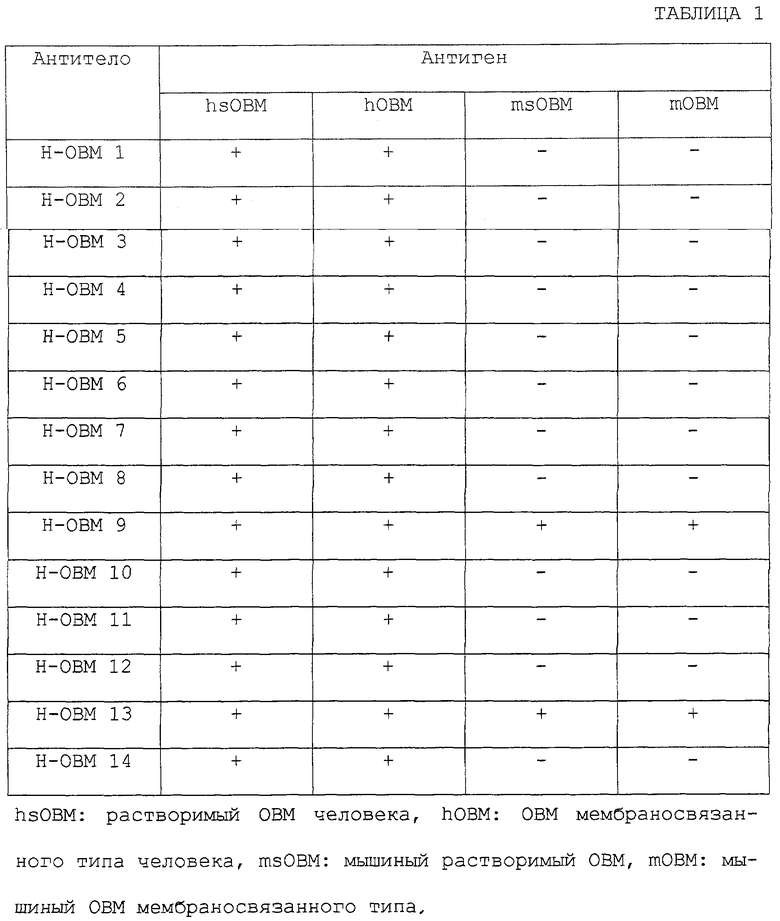
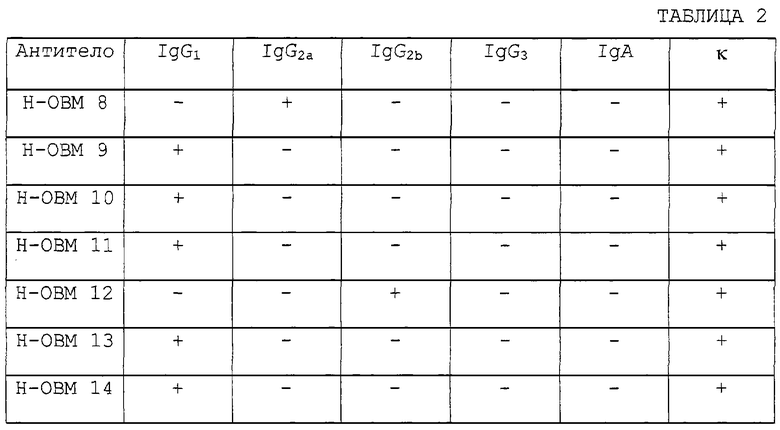
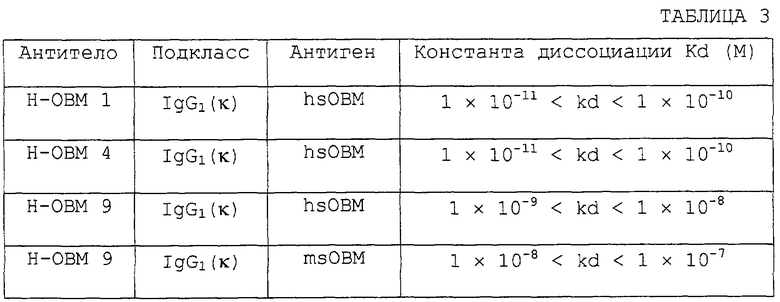
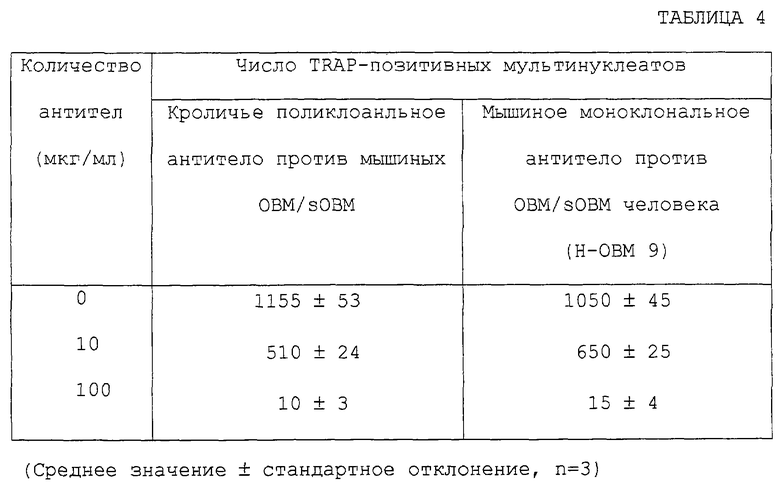
















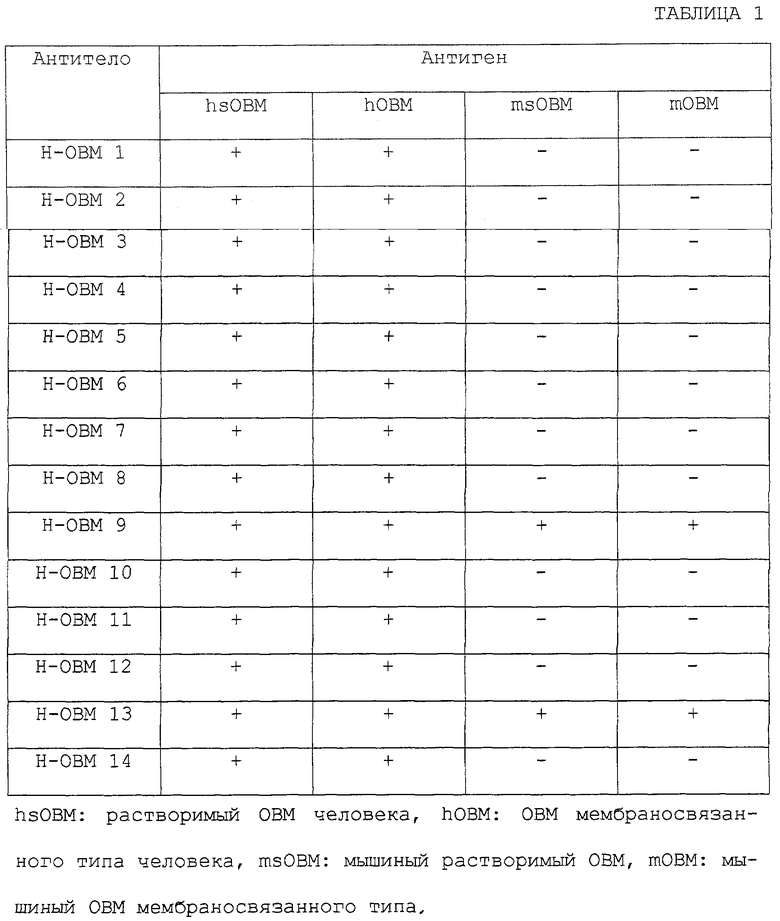
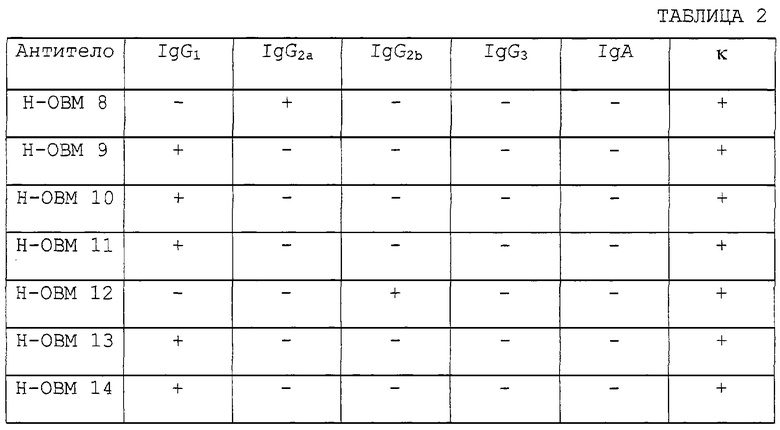
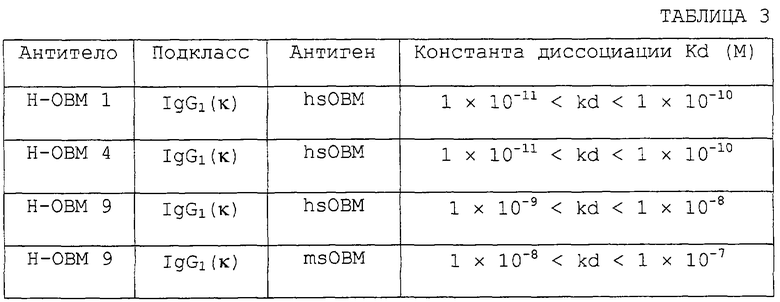
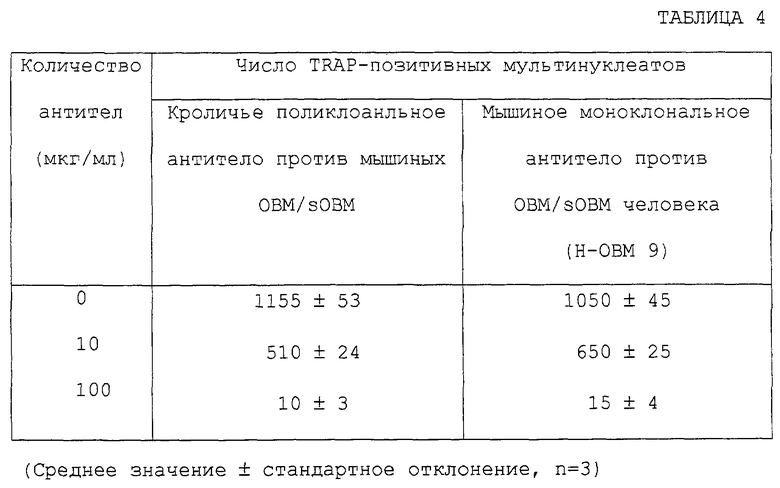
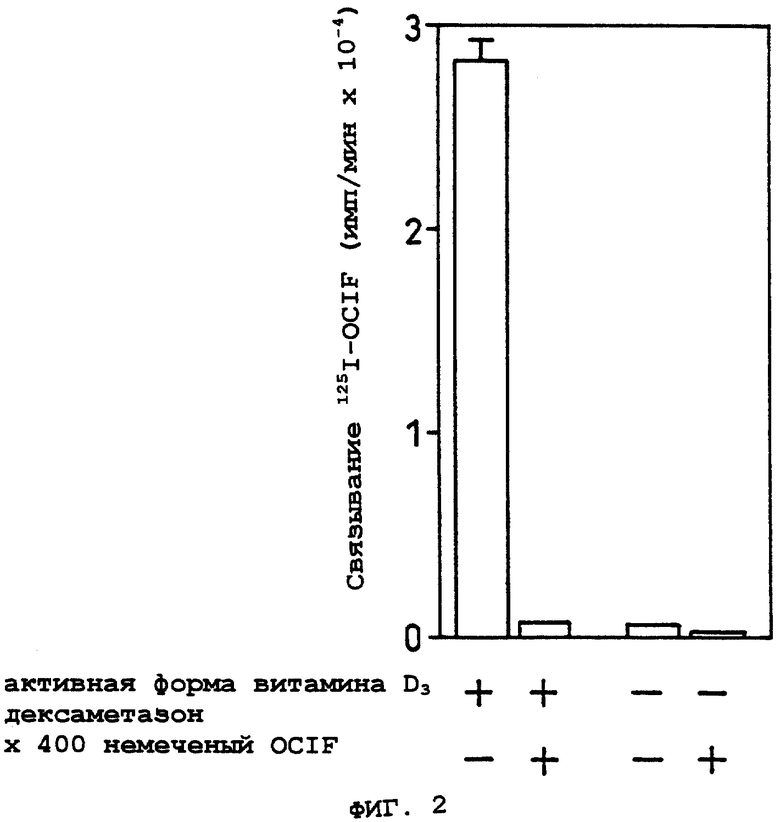
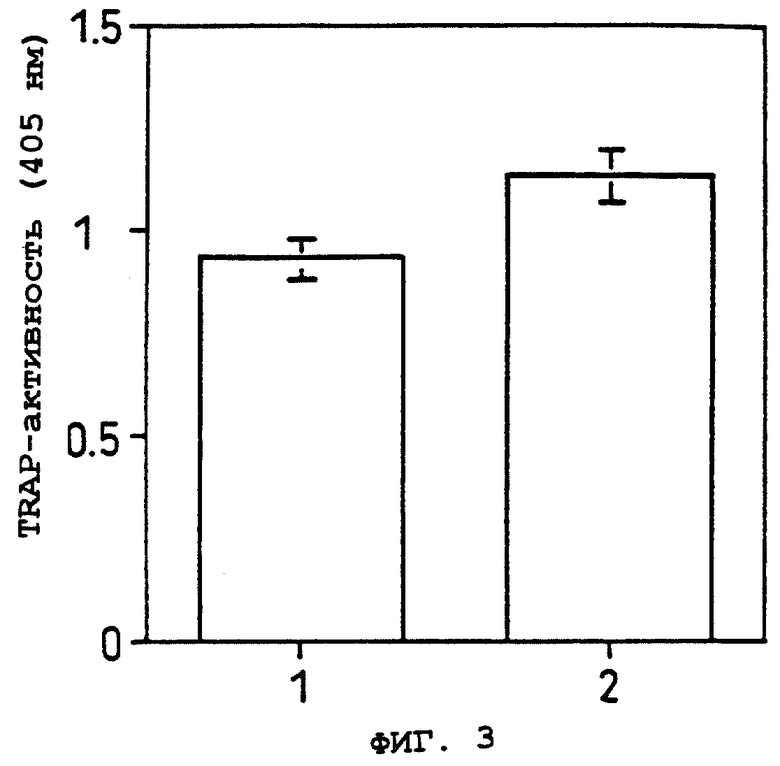
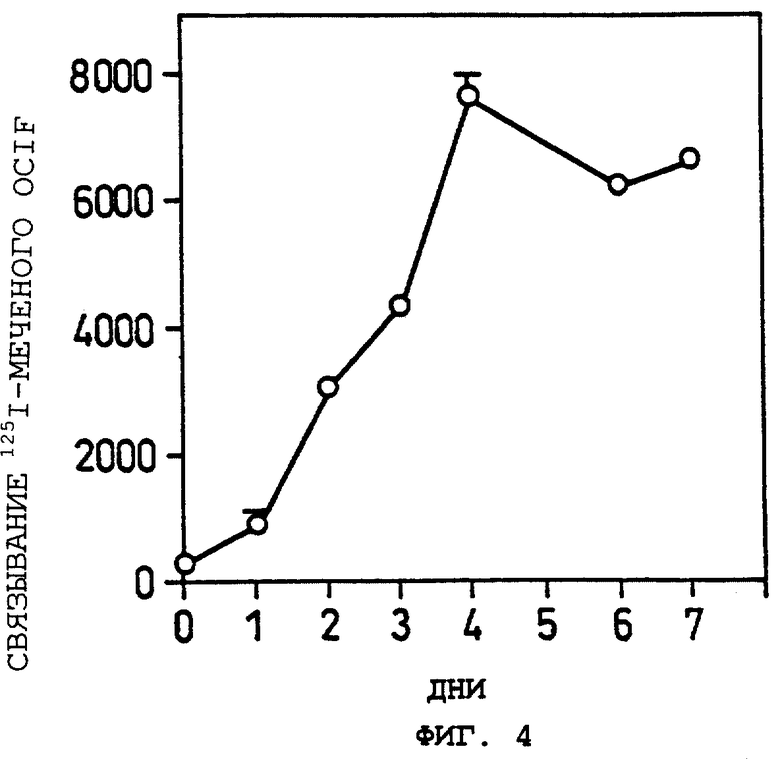
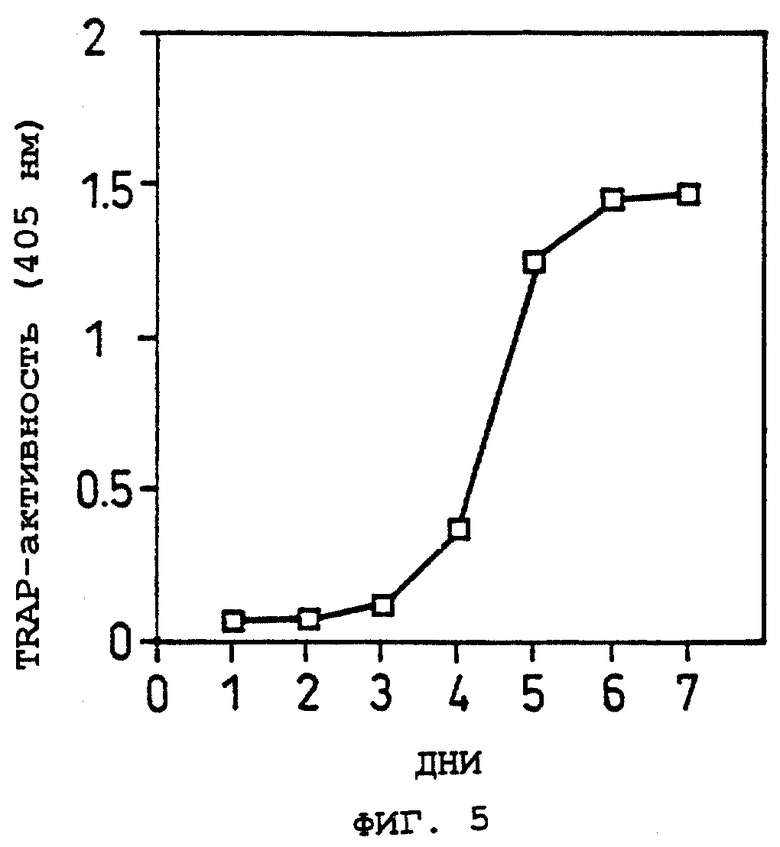
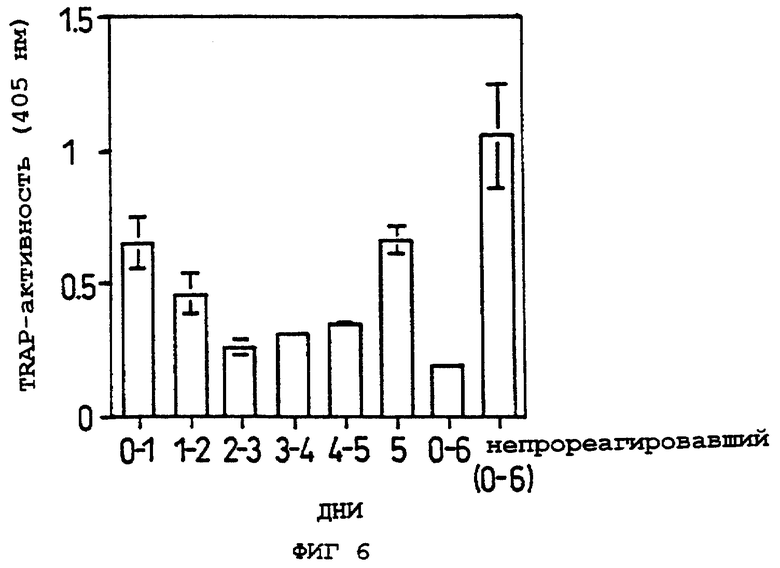

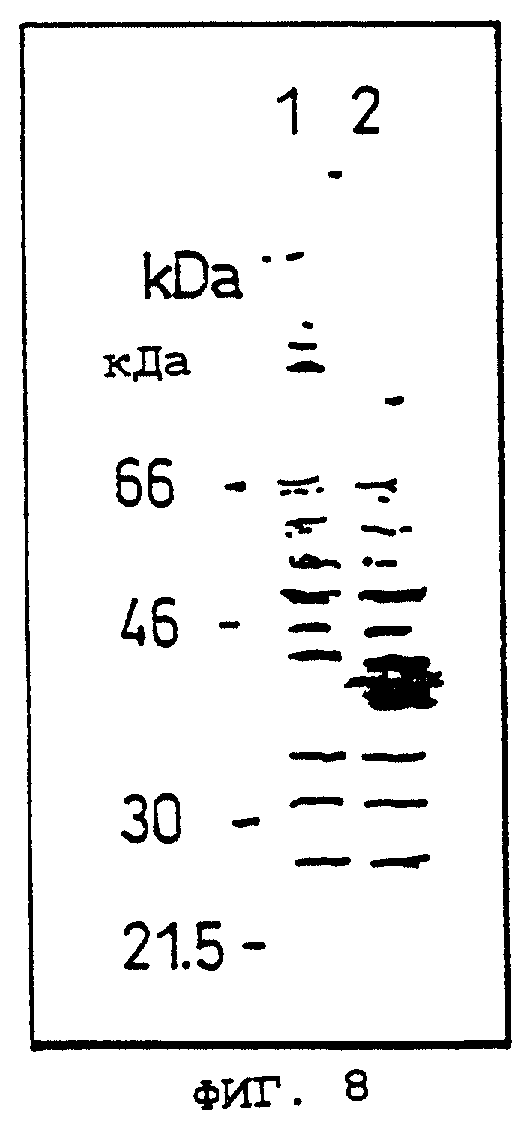
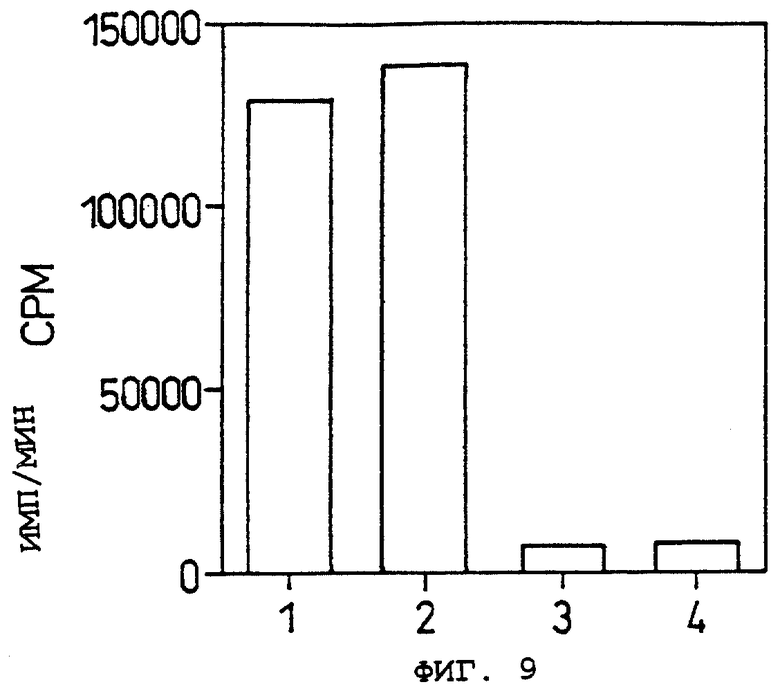
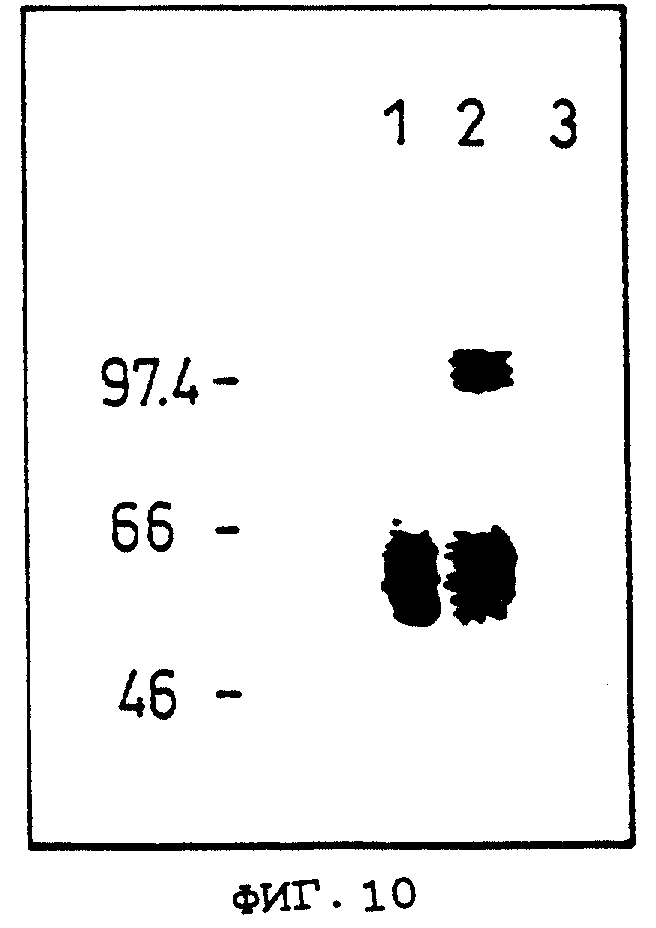

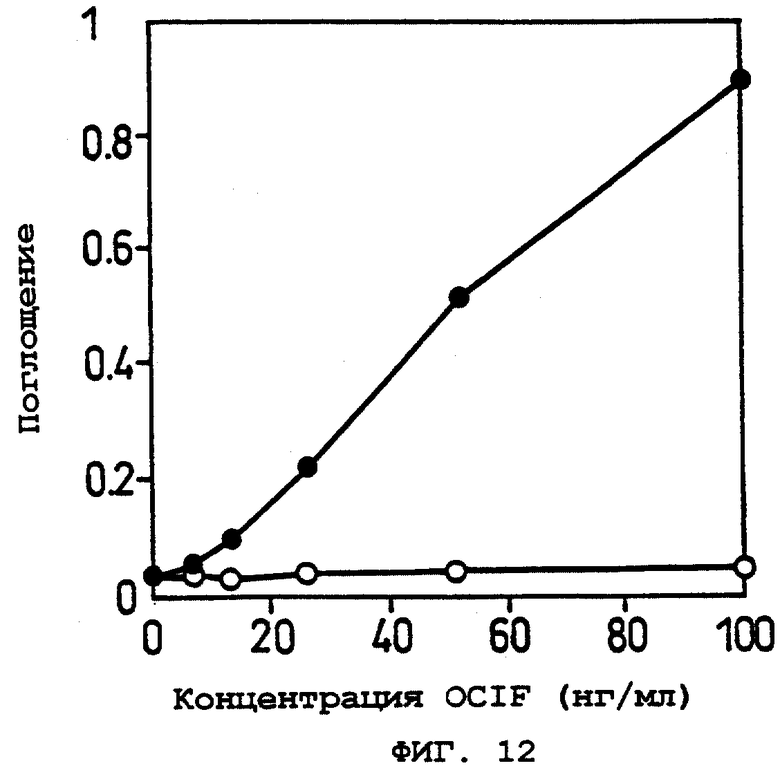
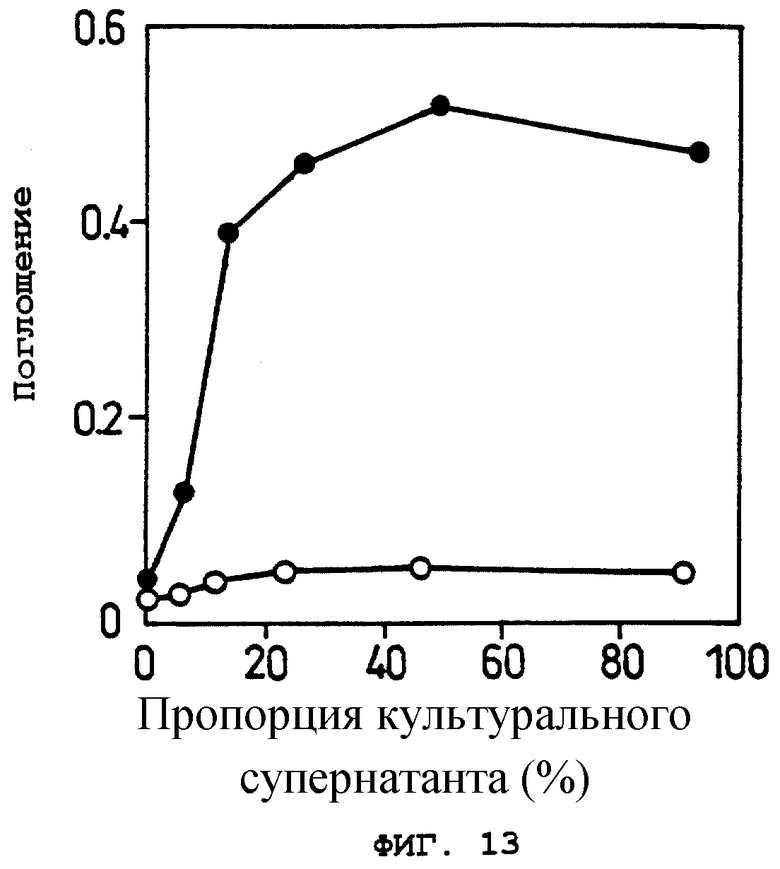
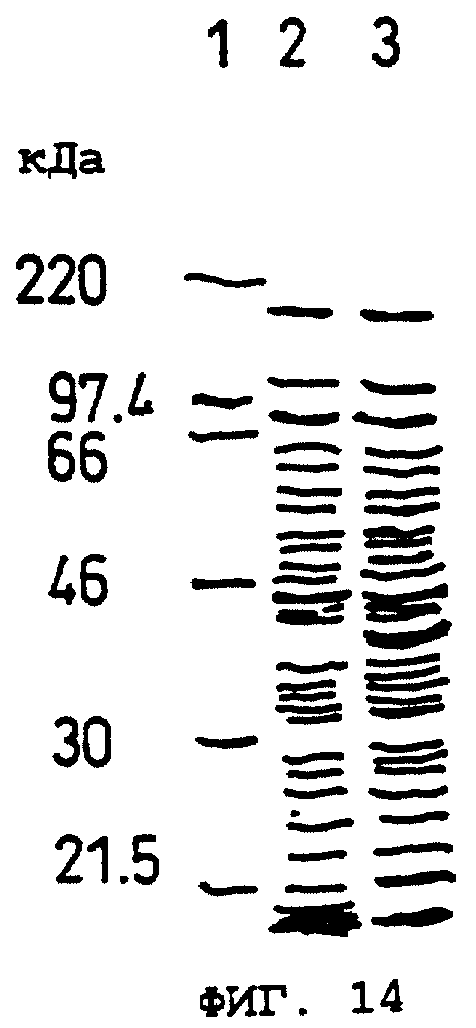
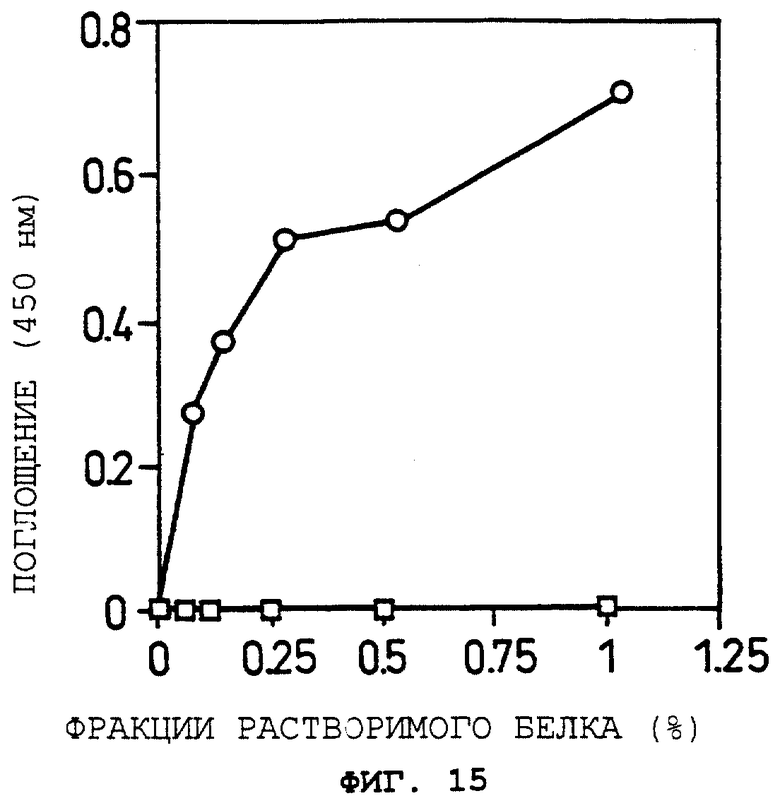
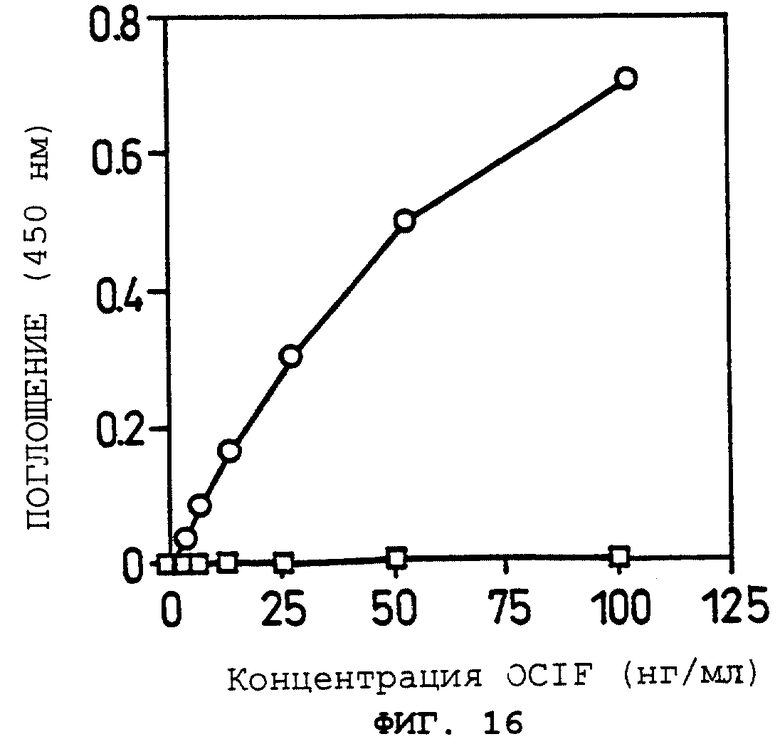
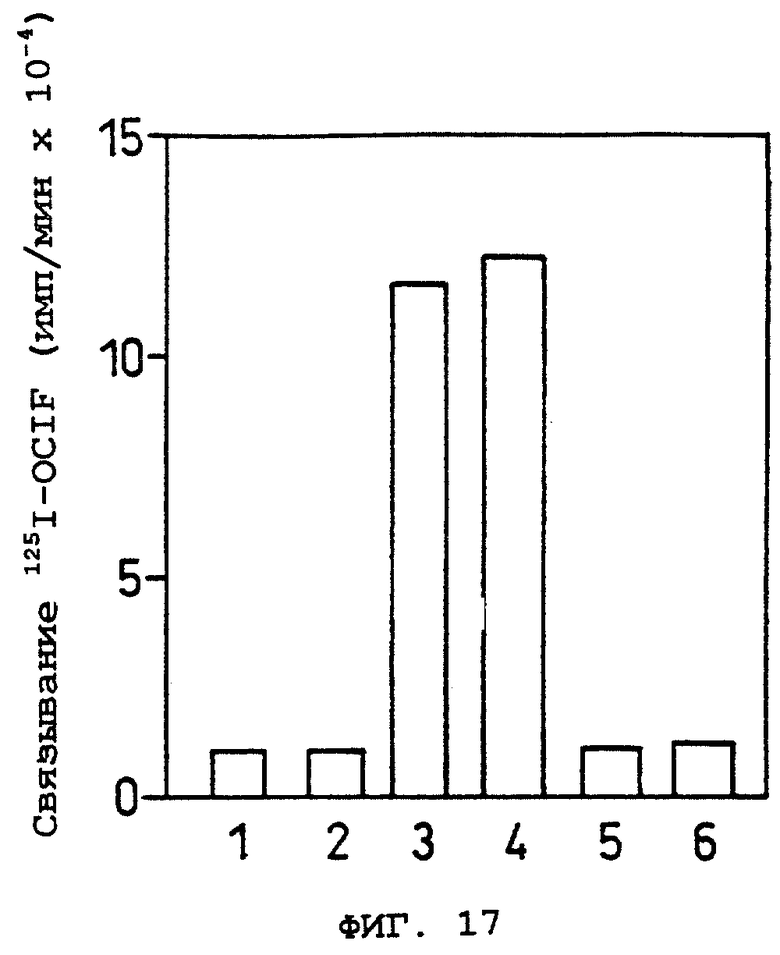
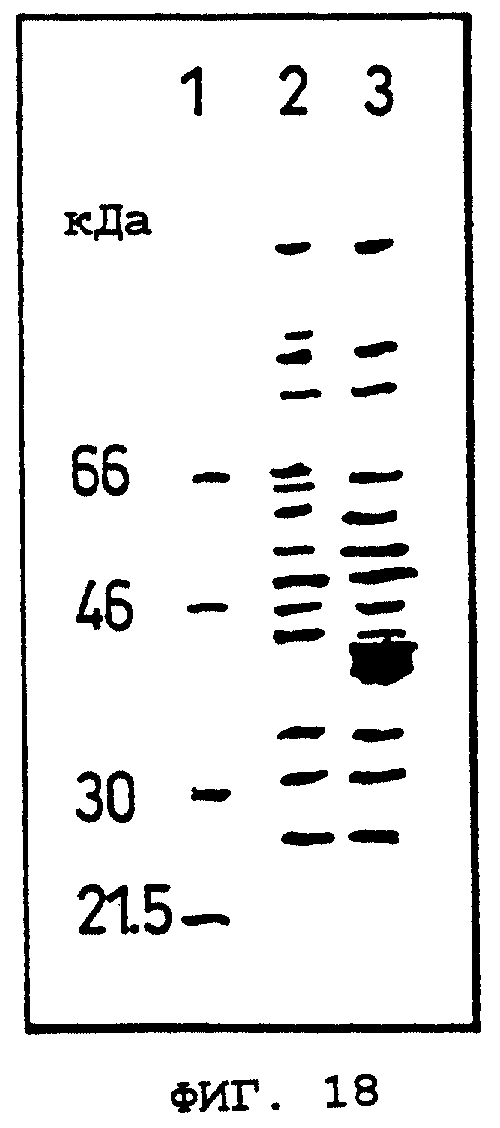
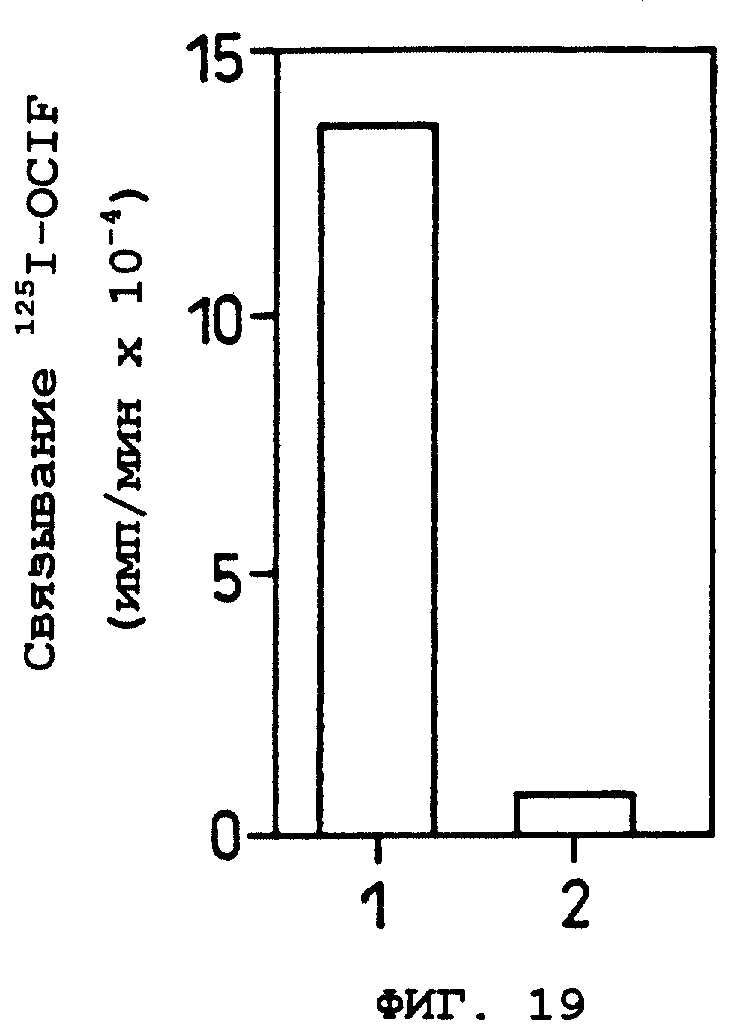
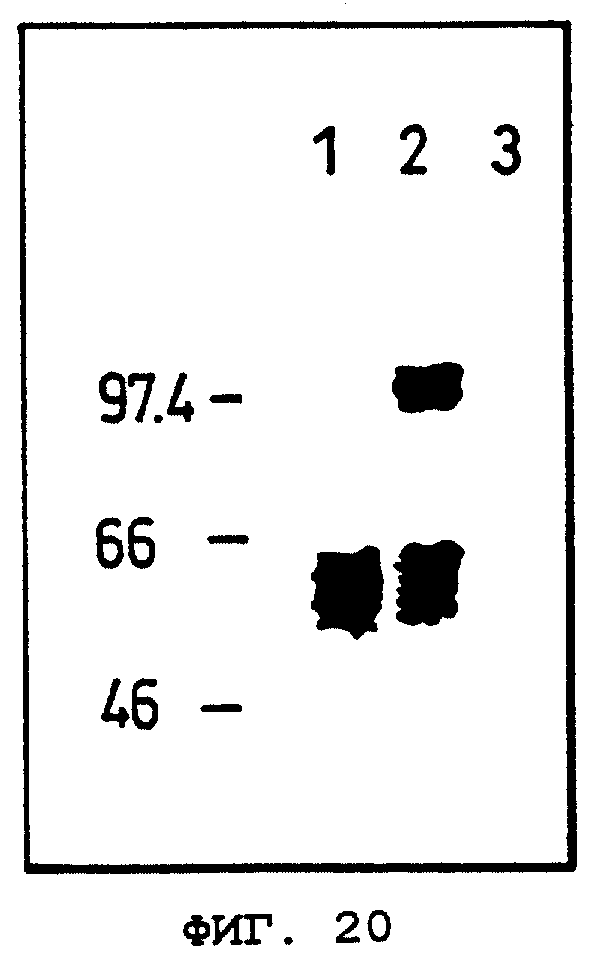
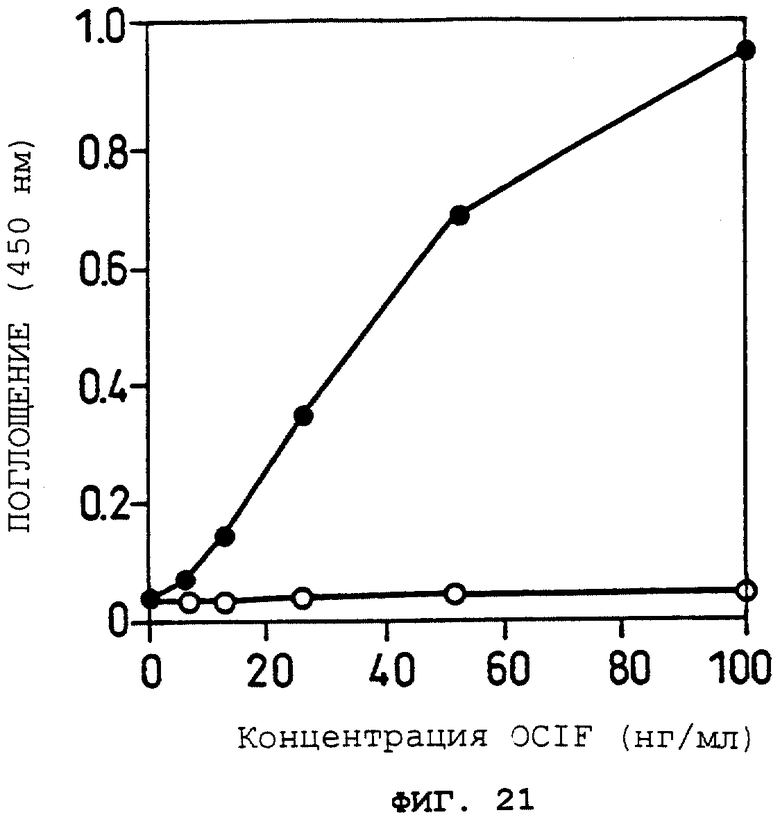
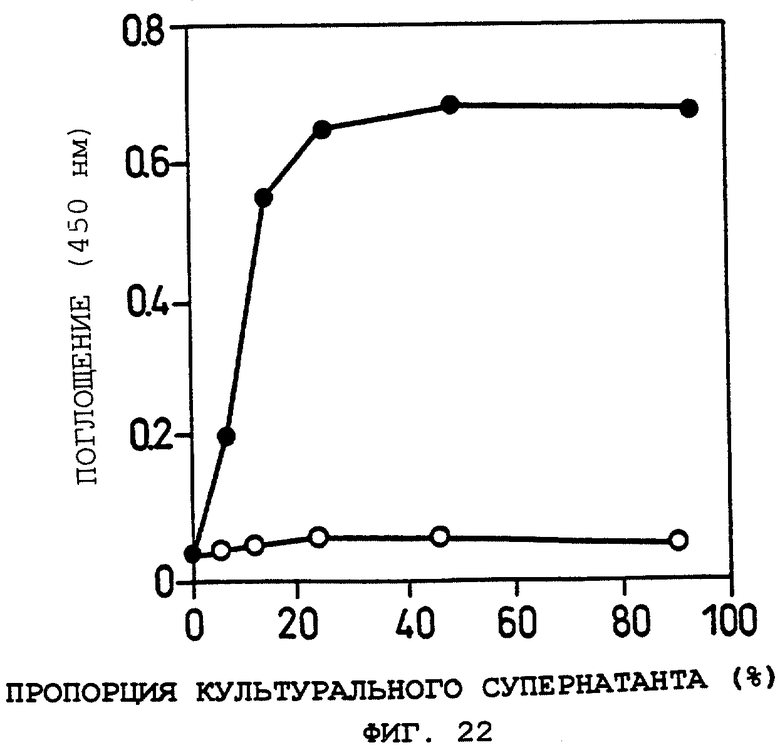
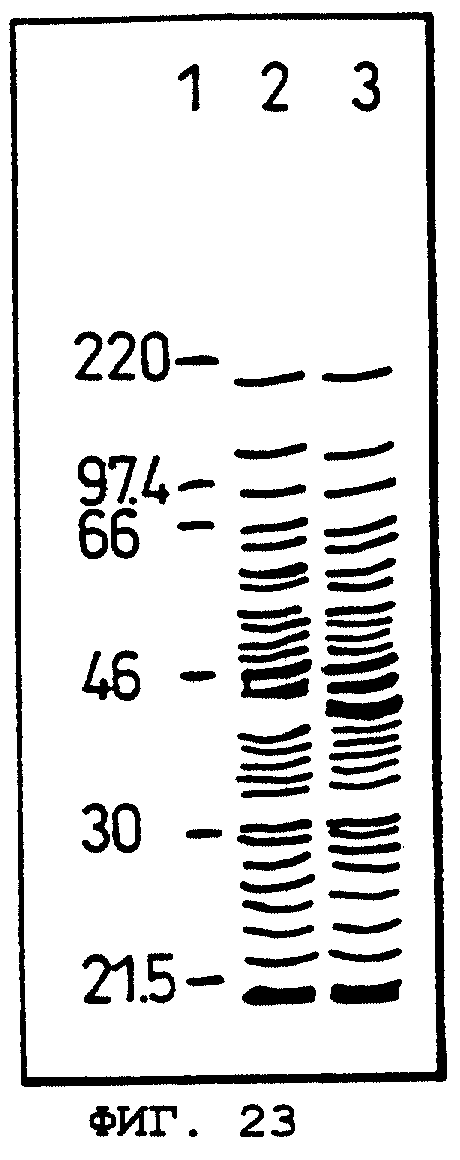
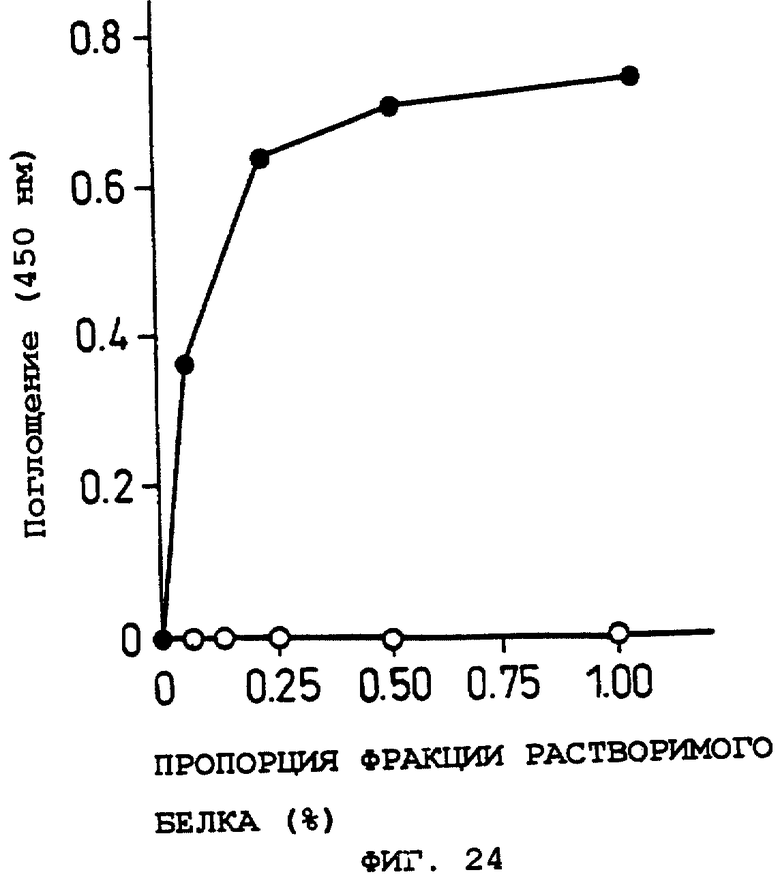
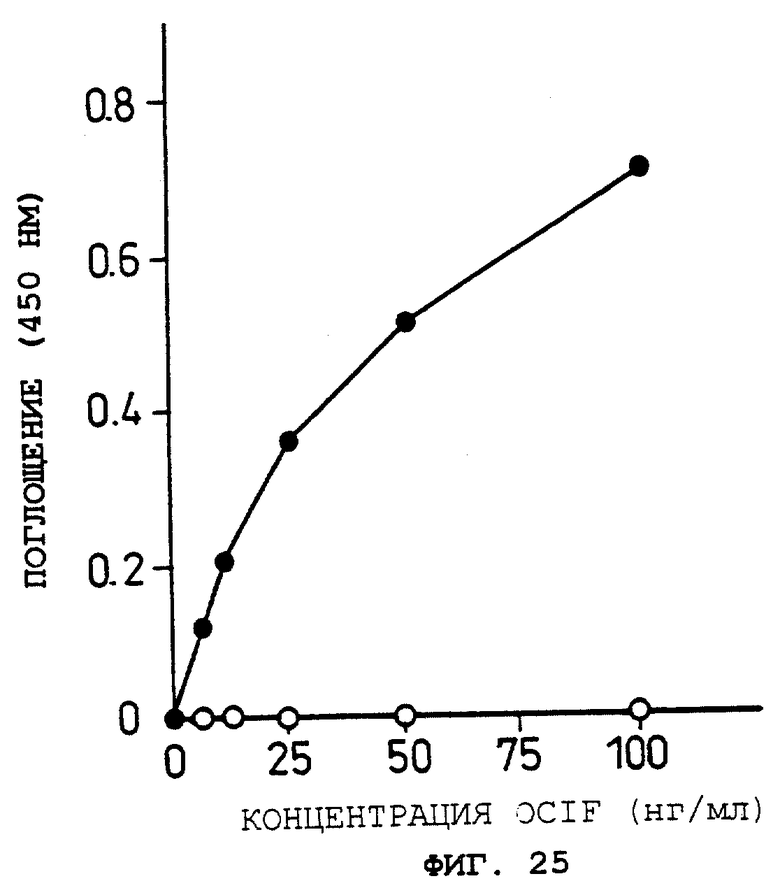
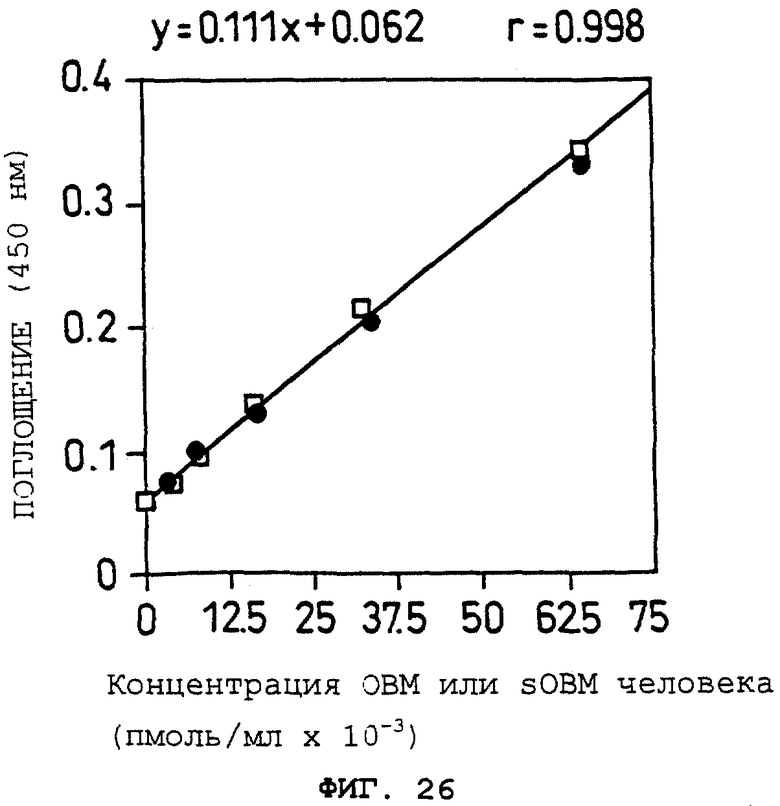
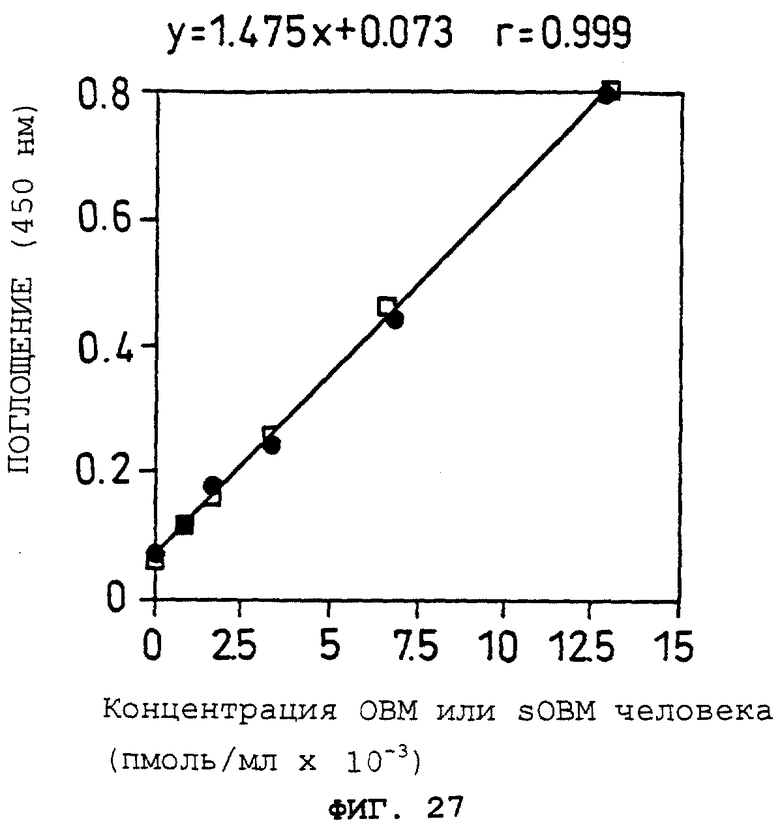
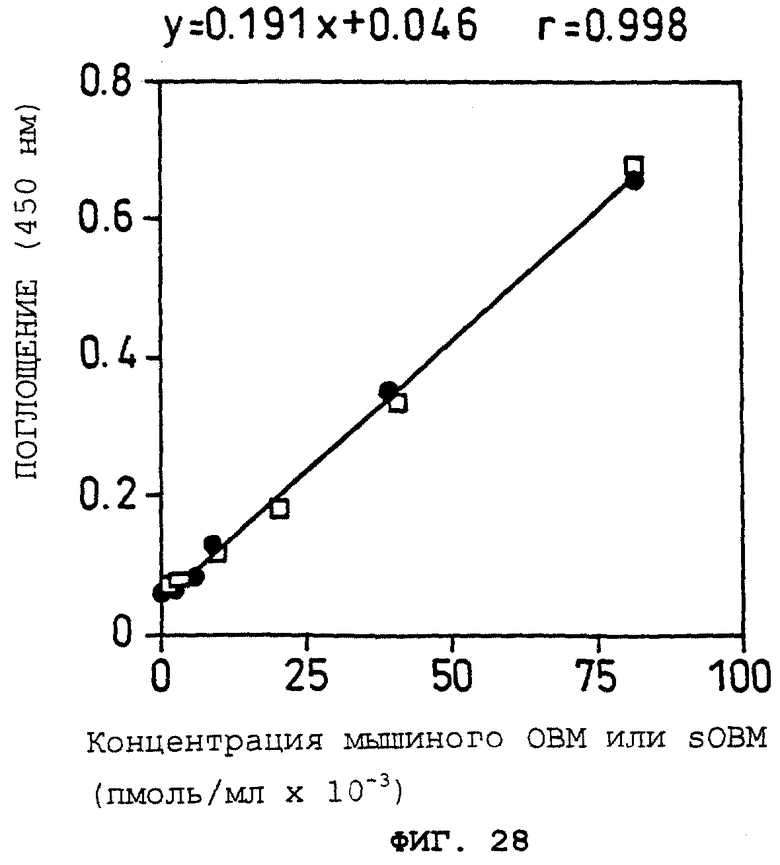
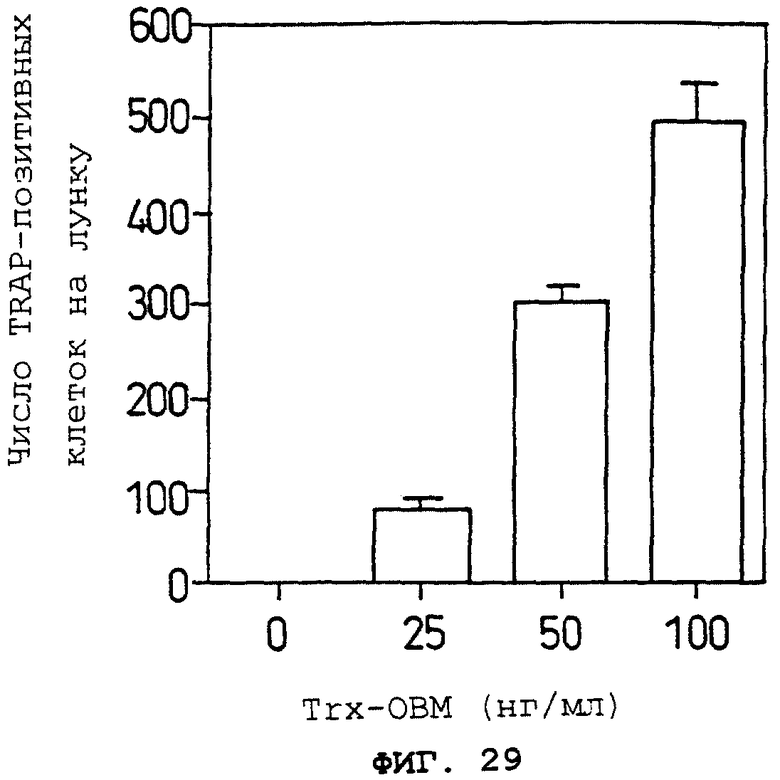
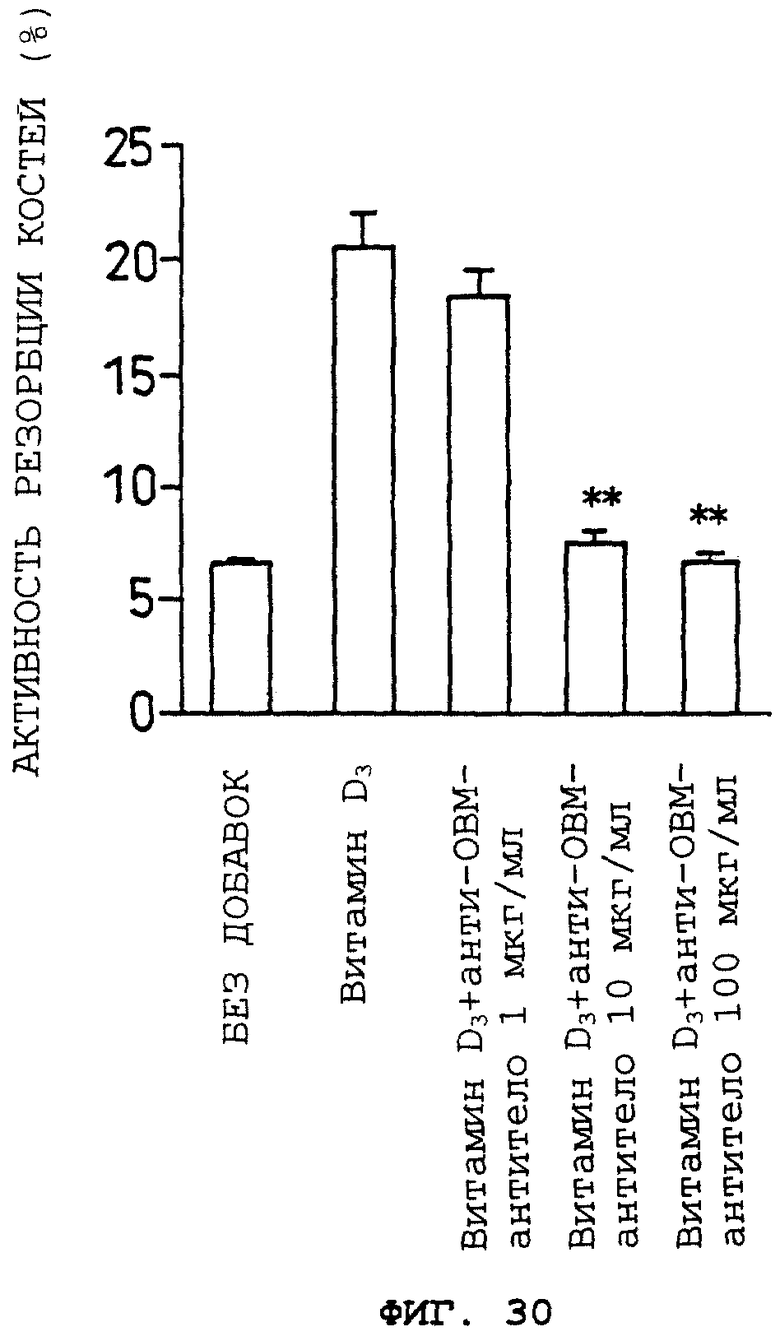
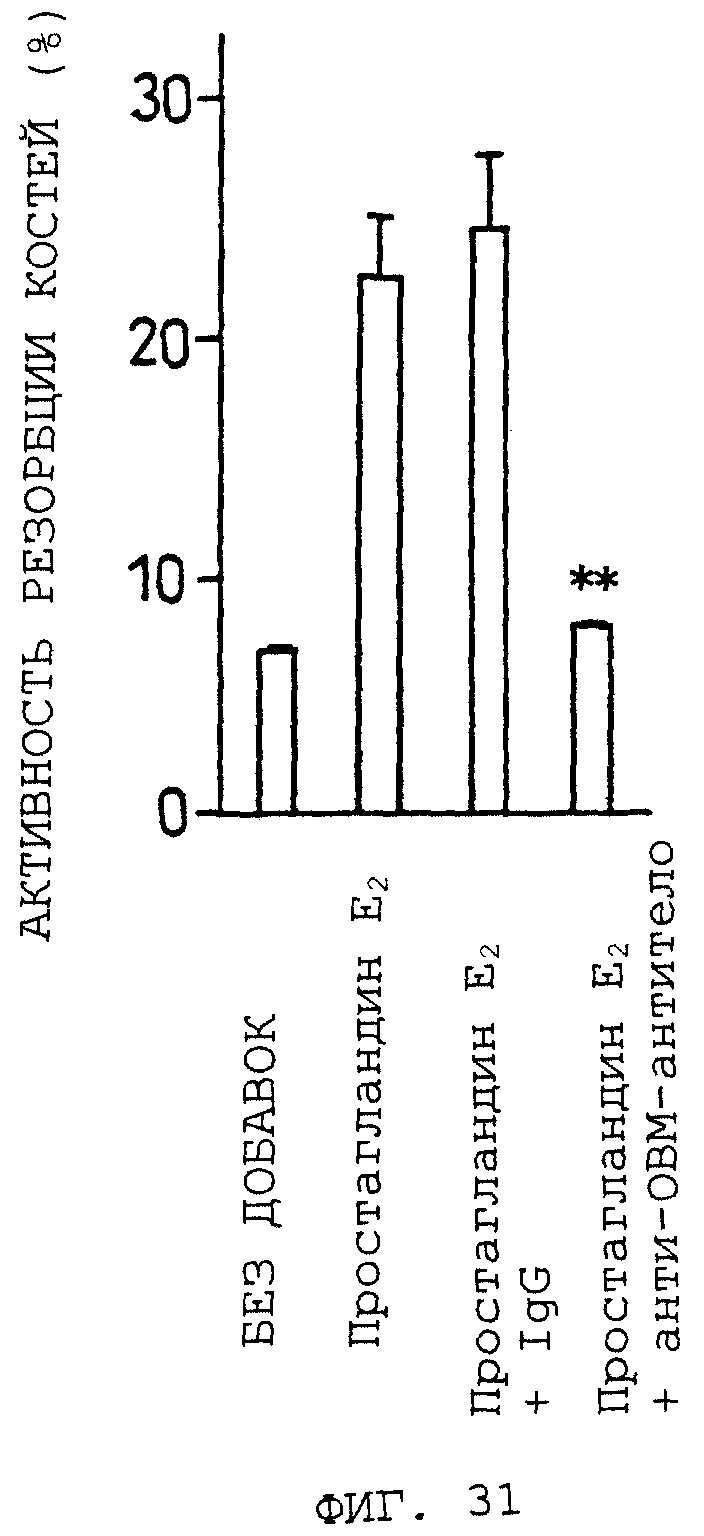
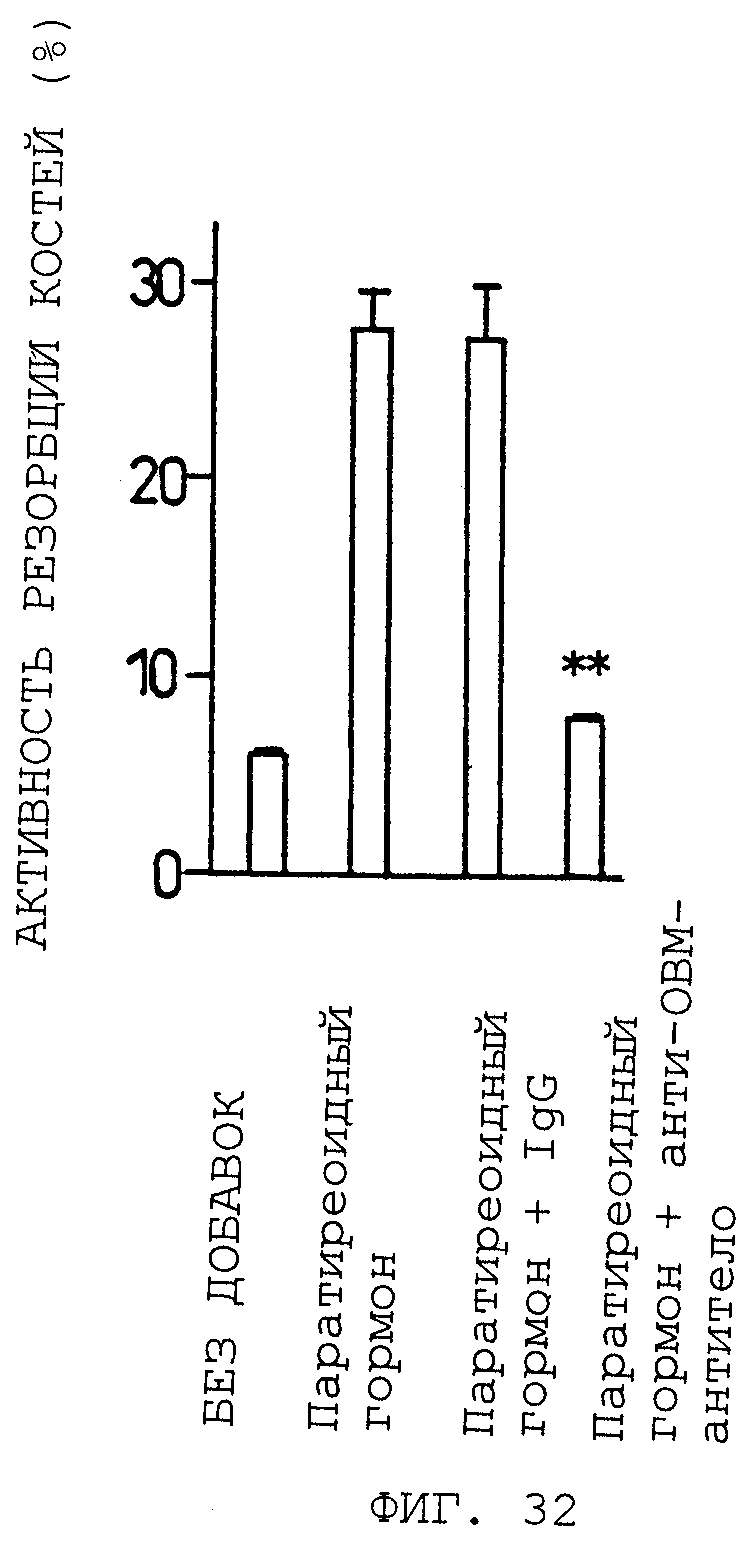
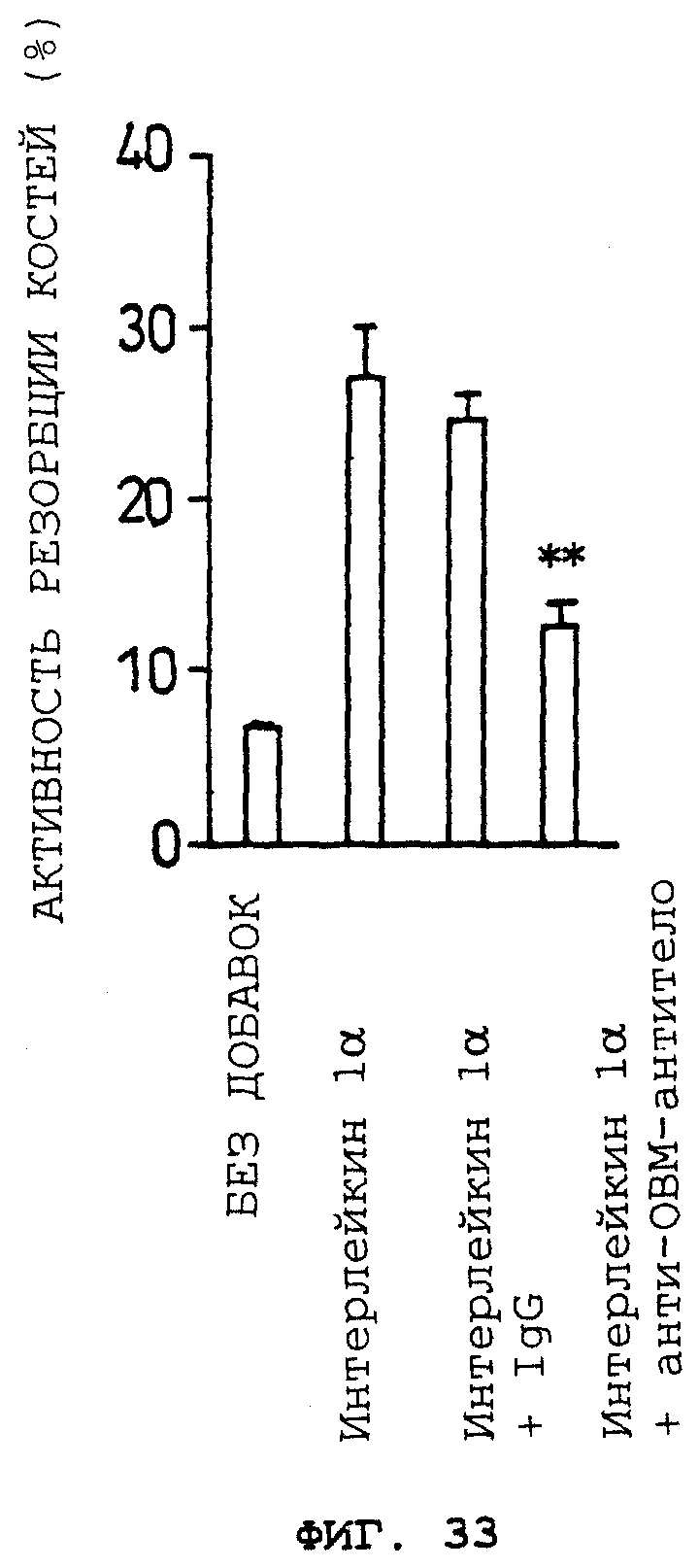
Изобретение относится к биотехнологии, в частности к генной инженерии и медицине, и может быть использовано для получения белка, специфически связывающегося с ингибирующим остеокластогенез фактором (OCIF). OCIF-связывающий белок специфически связывается с ингибирующим остеокластогенез фактором и проявляет высокую аффинность в отношении OCIF (константа диссоциации на клеточной мембране Kd=10-9 М или менее), имеет молекулярную массу приблизительно 30000-40000 при измерении при помощи электрофореза в SDS-полиакриламиде при невосстанавливающих условиях, проявляет активность поддержания или усиления дифференцировки и созревания остеокластов. Рекомбинантный OCIF-связывающий белок получают путем культивирования клеток, трансформированных вектором, содержащим ДНК, кодирующую OCIF – связывающий белок. Антитело, распознающее OCIF-связывающий белок, получают путем иммунизации животного или путем культивирования гибридомы ВР-6264 или ВР-6265, или ВР-6266. Антитело используют для получения фармацевтической композиции для профилактики или лечения нарушения или патологии костного метаболизма. Изобретение позволяет разрабатывать средства для предотвращения или лечения заболеваний, связанных с нарушением костного метаболизма. 29 н. и 21 з.п. ф-лы, 33 ил., 4 табл.
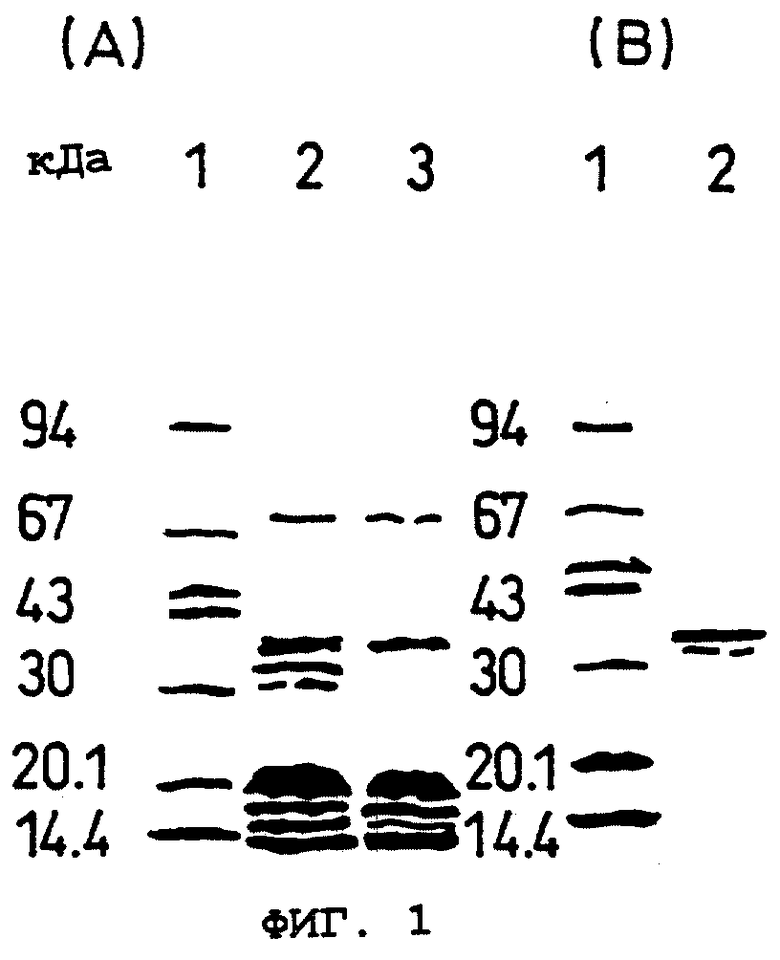
Приоритет по пунктам и признакам:
| TSUDA, E., et al., "Isolation of a novel cytokine from human fibroblasts that specifically inhibits osteoclastogenesis", Biochem | |||
| Biophys | |||
| Res | |||
| Commun., 1997, Vol | |||
| Крутильный аппарат | 1922 |
|
SU234A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления строительного изолирующего материала | 1923 |
|
SU137A1 |
| KAJI, H., et al., "Insulin-like growth factor-I mediates osteoclast-like cell formation stimulated by parathyroid hormone", Journal of Cellular Physiology, 1997, Vol | |||
| Приспособление для воспроизведения изображения на светочувствительной фильме при посредстве промежуточного клише в способе фотоэлектрической передачи изображений на расстояние | 1920 |
|
SU172A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| ANDERSON, D.M., et al., "A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function", Nature, 1997, Vol | |||
| Поливное приспособление для паровозов | 1922 |
|
SU390A1 |
| Ручной прибор для загибания кромок листового металла | 1921 |
|
SU175A1 |
| WONG, B.R., et al., "TRANCE is a novel ligand of the tumor necrosis factor receptor family that activates c-Jun N-terminal kinase in Т-cell", J | |||
| Biol | |||
| Chem., 1997, Vol | |||
| Паровоз с приспособлением для автоматического регулирования подвода и распределения топлива в его топке | 1919 |
|
SU272A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Контрольный висячий замок | 1930 |
|
SU24727A1 |
Авторы
Даты
2004-10-27—Публикация
1998-04-15—Подача