Предпосылки создания изобретения
Последняя разработка цепной реакции полимеразы (ЦРП) обеспечила важный механизм для анализа последовательностей нуклеиновых кислот, присутствующих в низких концентрациях (Mullis, К. B. et. al., U.S. Patent N 4683195 and 4683202).
В процессе ЦРП целевую последовательность, имеющую границы, определенные двумя олигонуклеотидными праймерами удлинения, амплифицируют путем повторяющихся ферментативных циклов, чтобы обеспечить дополнительные матрицы для последующих реакций амплификации. В соответствии с этим небольшое число целевых последовательностей может быть экспоненциально амплифицировано и быстро проанализировано.
Главным недостатком ЦРП является экстенсивное образование побочных продуктов в результате случаев неспецифического праймирования, например беспорядочного праймирования матрицы нуклеиновой кислоты и/или самопраймирования праймеров удлинения. Так, когда для амплификации целевой последовательности, присутствующей в относительно низкой концентрации, необходимо большое число циклов амплификации, продукты случаев неспецифического праймирования значительно мешают чувствительности ЦРП.
К тому же относительным недостатком ЦРП является необходимость стадии разделения перед анализом амплифицированной мишени. Согласно стандартным условиям ЦРП отделение амплифицированной целевой последовательности от продуктов случаев неспецифического праймирования является необходимым как условие для анализа амплифицированной целевой последовательности. Отсутствие реакции гомогенной амплификации, т.е. реакции, при которой амплификация и анализ происходят в одном и том же реакционном сосуде, создает препятствие для автоматизации процедуры ЦРП. Кроме того, необходимость стадии разделения подвергает ЦРП смесь потенциальному загрязнению в результате процедуры разделения. Вероятность загрязнения жестко ограничивает возможное применение ЦРП в практической клинической диагностике.
Были сообщения о попытках разработать гомогенный анализ для амплификации и обнаружения. Одна такая попытка описана Holland et al., (1991, Proc. Natl. Acad. Sci. USA 88 : 7276) в анализе, использующем активность 5' 3' экзонуклеазы Taq полимеразы для генерирования сигнала детекции одновременно с ЦРП амплификацией. Однако для обнаружения сигнала, генерированного экзонуклеазой, требуется последующая стадия разделения. Higuchi et al., (1992, Bio/Technology 10 : 413) описывает способ гомогенного анализа на основе мониторинга (отслеживания) улучшенной флюоресценции этидиум бромида, когда его интеркалируют в двухцепочечный продукт амплификации. Такой способ анализа не является специфическим к целевой последовательности, так как уязвим из-за вмешательства присутствия любой двухцепочечной ДНК. Другим подходом к решению проблемы является использование поляризации флюоресценции для обнаружения гибридизации флюоресцентной пробы нуклеиновой кислоты или флюоресцентных продуктов удлинения праймера (Garmen, А. J. et al., European Patent Office Publication N 382433). Этот способ анализа позволяет отличить гибридизованную или удлиненную пробу, которая имеет более высокую молекулярную массу (и за счет этого пониженную поляризацию флюоресценции), от непрореагировавшей пробы. Однако присутствие негибридизованной пробы с более сильной поляризацией сильно влияет на наблюдаемую поляризацию, создавая сильный фон.
Передача неизлучаемой энергии путем тесного сближения двух флюоресцентных частей молекул может быть использована как эффективный механизм обнаружения сигнала. Гомогенные иммуноанализы на основе передачи энергии флюоресценции были описаны (Patel. et al., European Patent Application N 137515). Передача энергии флюоресценции была также приспособлена для обнаружения гибридизации нуклеиновой кислоты (Heller et al., European Patent Application N 070685 and U. S. Patent 4996143). В таких заявках сигнал передачи энергии флюоресценции генерируется, когда пробы, несущие различные флюоресцентные части молекул, приводят в тесную физическую близость, как результат гибридизации, с цепью целевой нуклеиновой кислоты.
Описание изобретения
Один аспект этого изобретения относится к способу обнаружения целевой нуклеиновой кислоты, который включает в себя стадии: (1) амплифицирования целевой нуклеиновой кислоты для получения продукта амплификации с использованием полимеразы, первого праймера с сегментом, не соприкасающимся (несмежным) с первой праймирующей последовательностью, или без такого сегмента и второго праймера с сегментом, несмежным со второй праймирующей последовательностью, или без него в присутствии олигонуклеотида, который не способен действовать как праймер для полимеразы, этот олигонуклеотид имеет по меньшей мере 5 (предпочтительно по меньшей мере 8) последовательных нуклеотидов, полностью комплементарных по меньшей мере 5 (предпочтительно по меньшей мере 8) последовательным нуклеотидам первого праймера; и (II) обнаружения присутствия целевой нуклеиновой кислоты путем мониторинга ее амплификации.
Первый и второй праймеры, которые соответствуют паре праймеров, используемой в ЦРП процедуре, гибридизуют с первой и второй праймирующими последовательностями, соответственно, в целевой нуклеиновой кислоте до удлинения полимеразой. Термин "полимераза", использованный в этой заявке, относится к катализатору, способному как вызывать активность ДНК полимеразы, так и смещать "нисходящий" одноцепочечный олигонуклеотид.
Вышеописанный олигонуклеотид является "блокирующим олигонуклеотидом" настоящего изобретения. Для удобства любой олигонуклеотид, который (а) непригоден для применения как ЦРП праймер и (б) имеет по меньшей мере 5 последовательных нуклеотидов, полностью комплементарных по меньшей мере 5 последовательным нуклеотидам праймера (со смежным сегментом или без него), называется "блокирующим олигонуклеотидом" в этой заявке. Блокирующий олигонуклеотид блокирует праймер в том смысле, что он гибридизуется с ним и делает его менее склонным к связыванию с его последовательностью праймирования в целевой нуклеиновой кислоте. В предпочтительном воплощении этого способа стадию амплифицирования проводят в присутствии дополнительного блокирующего олигонуклеотида для второго праймера.
Полная комплементарность по 5 основаниям может быть образована между блокирующим олигонуклеотидом и либо смежным сегментом, либо несмежным сегментом праймера. Смежный сегмент праймера представляет собой последовательность, которая комплементарна праймирующей последовательности в целевой нуклеиновой кислоте. С другой стороны, несмежный сегмент праймера представляет собой последовательность, которая не комплементарна праймирующей последовательности в целевой нуклеиновой кислоте.
Предпочтительные длины каждого из праймеров и блокирующих олигонуклеотидов настоящего изобретения находятся в пределах от 10 до 50 нуклеотидов (более предпочтительно 15 - 40 нуклеотидов). Рабочая концентрация блокирующего олигонуклеотида сильно варьируется в зависимости от различных факторов, например степени комплементарности между блокирующим олигонуклеотидом и соответствующим ему праймером, температуры анализа и т.п., и в любом случае может быть легко определена специалистом в этой области без чрезмерного экспериментирования. Что касается молярного отношения блокирующего олигонуклеотида к соответствующему ему праймеру, пределы 0,3 - 5,0 (или 0,5 - 2,5) являются в основном приемлемыми.
Стадия обнаружения может быть осуществлена путем мониторинга продукта амплификации целевой нуклеиновой кислоты на геле после электрофореза. Альтернативно, можно ковалентно связать два флюорофора с первым (или вторым) праймером и соответствующим ему блокирующим олигонуклеотидом, соответственно, причем один из двух флюорофоров должен быть донорным флюорофором, а другой - акцепторным флюорофором с тем, чтобы, когда первый праймер и блокирующий олигонуклеотид гибридизуются, донорный флюорофор и акцепторный флюорофор оказывались в тесной близости, которая делает возможным передачу энергии резонанса между ними. Когда блокирующий олигонуклеотид и соответствующий ему праймер помечены таким образом флюорофором, можно проводить мониторинг изменения флюоресцентной эмиссии акцепторного флюорофора при облучении донорного флюорофора возбуждающим светом для количественной оценки амплификации целевой нуклеиновой кислоты, так как такое изменение является функцией того, насколько блокированный праймер диссоциирован от блокирующего олигонуклеотида, а затем внедрен в продукт амплификации целевой нуклеиновой кислоты.
Другой аспект настоящего изобретения относится к наборам для обнаружения целевой нуклеиновой кислоты. Например, аналитический набор настоящего изобретения может содержать (1) пару праймеров (10 - 50 оснований или 15 - 40 оснований) для использования с полимеразой для амплификации целевой нуклеиновой кислоты, каждый из которых либо имеет сегмент, несмежный с его праймирующей последовательностью, либо не имеет такого сегмента; и (11) блокирующий олигонуклеотид (10 - 50 оснований или 15 - 40 оснований), способный блокировать один из двух праймеров. Целесообразно, чтобы соответствующий блокирующий олигонуклеотид(ы) и праймер(ы) были помечены флюорофором указанным выше способом. Блокирующий олигонуклеотид и соответствующий ему праймер могут быть подготовлены как дуплекс (например, "дуплекс специфической детекции", когда он помечен флюорофором, см. фиг. 1, середина, и фиг. 2, верх, и приводимое ниже обсуждение). Целесообразно также, чтобы набор еще содержал один или оба из таких реагентов, как полимераза и дополнительный блокирующий олигонуклеотид для блокирования другого праймера.
Как другой пример, набор настоящего изобретения может содержать (1) первый меченный флюорофором олигонуклеотид (10-50 оснований или 15-40 оснований), не пригодный для использования как праймер в амплификации полимеразой, и (11) второй меченный флюорофором олигонуклеотид (5-30 оснований или 7-15 оснований), который имеет свободную 3' ОН. Оба олигонуклеотида гибридизованы через по меньшей мере 5 (предпочтительно по меньшей мере 8) последовательных полностью комплементарных нуклеотидных спариваний, одного с другим, и первый олигонуклеотид перекрывает 3' конец второго олигонуклеотида 1-12 основаниями (предпочтительно 4-8 основаниями), и, кроме того, первый и второй флюорофоры, один из которых является донорным флюорофором, а другой - акцепторным флюорофором, находятся в тесной близости для обеспечения передачи энергии резонанса между ними. Первый и второй олигонуклеотиды могут быть представлены как дуплекс, например, "дуплекс универсальной детекции" (обсуждение см. ниже). Желательны другие реагенты, такие как лигаза, киназа и полимераза с активностью 5'---> 3' экзонуклеазы. Лигаза и киназа (или полимераза с активностью 5'---> 3' экзонуклеазы) могут быть использованы для прикрепления какого-либо выбранного праймера к дуплексу универсальной детекции, в результате чего последний превращается в дуплекс специфической детекции.
Оба вышеописанных дуплекса специфической и универсальной детекции так же, как и "выведенный из строя" олигонуклеотид, который образует одну из двух цепей дуплекса, также находятся в сфере действия настоящего изобретения.
Другие свойства и преимущества настоящего изобретения будут понятны из следующих фигур и описания предпочтительных вариантов воплощения изобретения, а также из прилагаемой исправленной формулы изобретения.
Краткое описание фигур
Фиг. 1 представляет воплощение способа настоящего изобретения: 1 - ассиметричная амплификация, 2 - амплификация с использованием дуплекса специфической детекции, 3 - обнаружение.
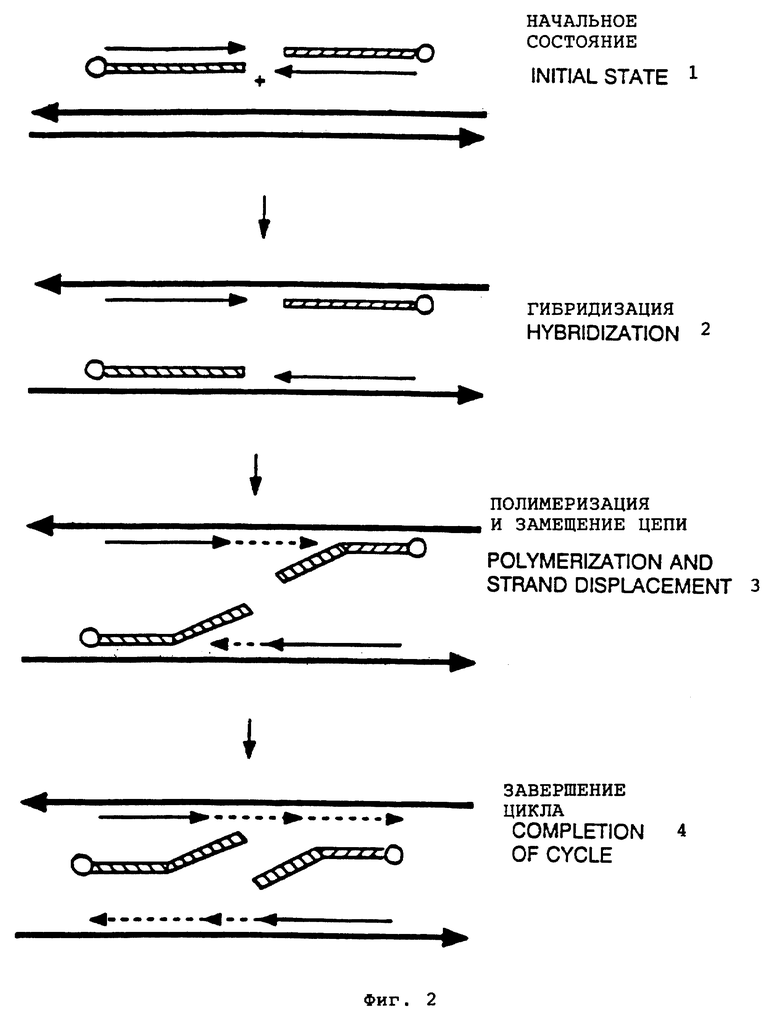
Фиг. 2 представляет другое воплощение способа настоящего изобретения: 1 - начальное состояние, 2 - гибридизация, 3 - полимеризация и замещение цепи, 4 - завершение цикла.
Фиг. 3 представляет фотографию геля, показывающую воздействие блокирующего олигонуклеотида на уменьшение случаев неспецифического праймирования.
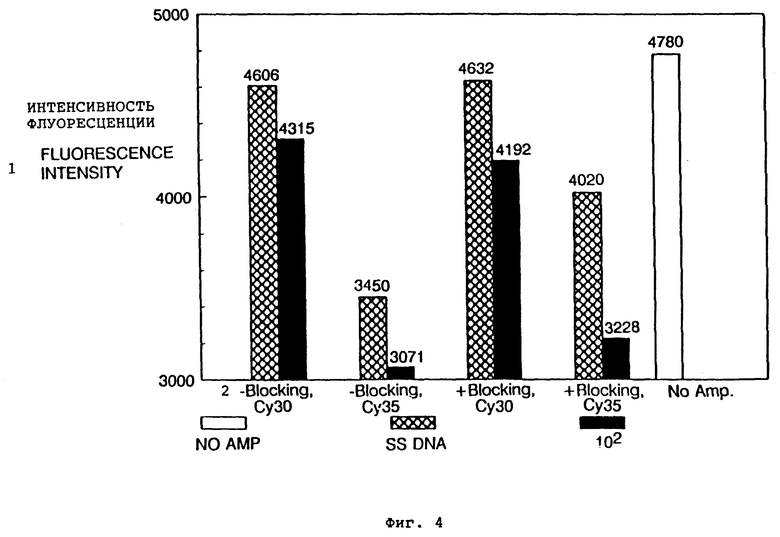
Фиг. 4 представляет графическое изображение применения меченного флюорофором блокирующего олигонуклеотида для мониторинга случаев специфического праймирования: 1 - интенсивность флюоресценции, 2 - блокирование.
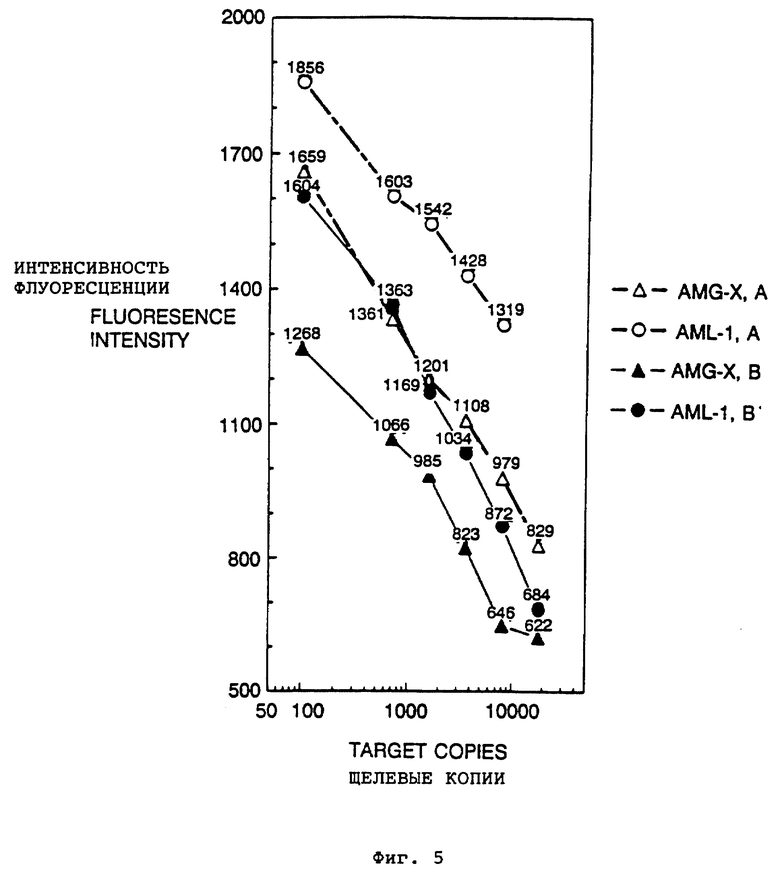
Фиг. 5 представляет график, показывающий разрешение и чувствительность в анализе двух различных целевых последовательностей с использованием двух проб, воплощенных настоящим изобретением. По вертикали - интенсивность флюоресценции, по горизонтали - целевые копии.
Описание предпочтительных вариантов воплощения настоящего изобретения
Как используется здесь, "амплификация" относится в общих чертах к процессу применения полимеразы и пары праймеров для получения индивидуальной последовательности нуклеиновых кислот, например "целевой последовательности нуклеиновой кислоты" или "целевой нуклеиновой кислоты" в количестве, которое выше того, которое присутствует первоначально.
Настоящее изобретение относится к способу обнаружения присутствия специфической последовательности нуклеиновой кислоты путем мониторинга включения праймера(ов) в продукт амплификации специфической нуклеиновой кислоты. В настоящем изобретении блокирующий олигонуклеотид используют для предотвращения случаев неспецифического праймирования во время процесса амплификации. В предпочтительном воплощении амплифицированную целевую последовательность обнаруживают путем отслеживания по интенсивности флюоресценции отщепления блокирующего олигонуклеотида от комплементарного ему праймера.
Амплификация базируется на гибридизации каждого из пары праймеров к специфически праймирующей последовательности, например, последовательности исходной матрицы нуклеиновой кислоты, к которой праймер имеет наивысшую степень комплементарности и гибридизуется наиболее предпочтительно. В дополнение к специфически праймирующим последовательностям начальная матрица нуклеиновой кислоты может включать неспецифически праймирующие последовательности, с которыми праймер также может быть способен к гибридизации. Случаи неспецифического праймирования, например, случаи, которые ведут к амплификации иной последовательности матрицы, чем специфическая последовательность нуклеиновой кислоты, включают такие реакции, как гибридизация праймера к иной последовательности матрицы, чем ее праймирующая последовательность, и самопраймирование, такое как димеризация вследствие внутримолекулярных взаимодействий между праймерами (Chou et al., in Nuclеic Acid Rеsearch (1992) 20 : 1717).
Праймер является олигонуклеотидом либо выделенным из гидролизата рестрикции, либо полученным органическим способом и способным при помещении в подходящие условия действовать как центр инициации синтеза продукта удлинения праймера, комплементарного целевой последовательности. В дополнение к последовательности, комплектарной к специфической праймирующей последовательности в исходной матрице нуклеиновой кислоты, праймер настоящего изобретения может также заключать на 5' участке последовательность, несмежную с праймирующей последовательностью исходной матрицы. Другими словами, смежный сегмент является участком последовательности на 3' участке праймера, той последовательности, которая комплементарна специфической праймирующей последовательности в исходной нуклеиновой кислоте-мишени, в то время как несмежный сегмент является участком последовательности на 5' участке праймера, той последовательности, которая не является комплементарной к праймирующей последовательности исходной матрицы нуклеиновой кислоты.
Как используется здесь, исходная матрица нуклеиновой кислоты относится к очищенной или неочищенной нуклеиновой кислоте в пробе, содержащей или предположительно содержащей целевую последовательность. Так, в способе могут быть использованы, например, ДНК, РНК или гибрид ДНК : РНК. Исходная матрица нуклеиновой кислоты не ограничивается только ДНК или РНК, некоторые в конце концов транслируются в белковый продукт, но может также включать некодирующую нуклеиновую кислоту или некодирующие последовательности нуклеиновой кислоты, размещенные между кодирующими последовательностями.
Для существенного уменьшения возможности случаев неспецифического праймирования изобретение представляет для гибридизации с праймером блокирующий олигонуклеотид, который конкурирует с неспецифически праймирующими последовательностями. Блокирующий олигонуклеотид этого изобретения является "неспособным действовать как праймер для полимеразы", т.е. не способен действовать как центр инициации синтеза продукта удлинения. Блокирующий нуклеотид может быть сделан неспособным к действию как праймер для реакции удлинения за счет удаления или модификации 3' концевой гидроксильной группы, например, путем присоединения концевого 3'- дидезоксинуклеотида, 3' фосфорилирования, 3'-амино терминации и конъюгации с объемной частью молекулы, такой как родамин, вблизи 3' конца, чтобы стерически затруднить полимеразу от катализирования реакции удлинения. Типичные условия синтеза продукта удлинения приведены в Примерах.
Желательно в большинстве случаев, когда 3' концевая группа праймера выступает или вытягивается за его блокирующий олигонуклеотид, предотвратить любое непреднамеренное удлинение праймера в направлении 5'--->3', когда он гибридизуется с его блокирующим олигонуклеотидом в "дуплекс праймер:блокирующий олигонуклеотид". В этом контексте следует отметить, что образование дуплекс праймер: блокирующий олигонуклеотид является обратимым процессом. Так, при соответствующих условиях (например, повышение температуры с последующим снижением температуры) дуплекс может быть повторно диссоциирован и снова ассоциирован.
Термин "блокирующий олигонуклеотид" относится, в основном, к нуклеотиду, способному к гибридизации с праймером для предотвращения случаев неспецифического праймирования. Так как блокирующий олигонуклеотид имеет достаточную комплементарность к соответствующему ему праймеру, при подходящей концентрации он может стабилизировать праймер, не вовлеченный в случай специфического праймирования, и тем самым предотвращать случай неспецифического праймирования. Под "достаточной комплементарностью" подразумевается, что две последовательности должны иметь степень нуклеотидной комплементарности, достаточную для осуществления гибридизации. Целесообразно присутствие блокирующего олигонуклеотида для каждого праймера на начальный момент реакции амплификации.
Специалисту в этой области должно быть понятно, что при осуществлении гибридизации между двумя цепями степень комплементарности и концентрация являются взаимозависимыми переменными. Так, блокирующий олигонуклеотид может быть совершенно комплементарен с соответствующим ему праймером, или, альтернативно, не совсем комплементарен с праймером при условии, что блокирующий олигонуклеотид присутствует в достаточной концентрации для предотвращения связывания праймера с неспецифическими последовательностями. В основном проба нуклеиновой кислоты является двухцепочечной. Поэтому необходимо разделить цепи перед синтезом продукта удлинения. В приведенных ниже Примерах для разделения цепей в пробе нуклеиновой кислоты применяют тепловое денатурирование. Однако, известны альтернативные средства для разделения цепей нуклеиновой кислоты, которые включают ферментативные агенты, такие как RecBCD геликаза (см. Muskavitch et al., (1981, Enzyme 14 : 233)). Праймер и его блокирующий олигонуклеотид могут быть добавлены к пробе нуклеиновой кислоты как дуплекс или как два отдельных вещества. Если праймер и его блокирующий олигонуклеотид добавляют как дуплекс, стадии, предпринятые для осуществления денатурирования пробы нуклеиновой кислоты также разделят дуплекс праймер: блокирующий олигонуклеотид на их соответствующие цепи.
После разделения цепей реакционную смесь подвергают воздействию подходящих условий гибридизации для усиления гибридизации каждого праймера либо с его праймирующей последовательностью матрицы с образованием комплекса праймер: матрица, либо с блокирующим олигонуклеотидом с образованием дуплекса праймер: блокирующий олигонуклеотид. Подходящие условия гибридизации известны, и некоторые из них могут быть встречены в приведенных ниже Примерах.
Когда праймеры гибридизуют с праймирующими последовательностями матрицы, реакционную смесь подвергают воздействию подходящих условий реакции удлинения, чтобы позволить праймерам действовать как начальные центры реакции удлинения, например реакции полимеризации. Нет необходимости, чтобы гибридизация праймера с матрицей и удлинение праймера протекали как две различные реакции. Так, гибридизация и удлинение могут происходить одновременно при комбинировании условий, необходимых для гибридизации, с условиями, необходимыми для удлинения. Подходящими условиями реакции удлинения, которые хорошо известны, являются регулируемые условия (например, температура, pH и ионная сила) для индуцирования синтеза продукта удлинения на 3' конце праймера, гибридизованного с матрицей нуклеиновой кислоты, при добавлении нуклеотидов в присутствии катализатора, например ДНК полимеразы. Типичные условия реакции удлинения представлены также в приведенных ниже Примерах. Катализатором реакции удлинения являются, главным образом, ДНК полимераза, например термостойкая полимераза из Thermus aquaticus или Termus thermophilus (Kong et al., J. Biol. Chem. (1993) 268: 1965). Для осуществления этого изобретения критическим является то, что полимераза способна проявлять активность замещения олигонуклеотида, гибридизованного к матрице "ниже по потоку" по отношению к той последовательности, к которой гибридизован праймер. При соответствующих условиях реакции удлинения полимераза переходит к последовательному добавлению нуклеотидов к 3' концу праймера удлинения и замещению блокирующего олигонуклеотида, если он гибридизован "ниже по потоку" по отношению к праймеру, в результате чего синтезируется продукт удлинения, имеющий последовательность, которая комплементарна целевой последовательности матрицы и охватывает последовательность блокирующего олигонуклеотида.
В случае двухцепочечной матрицы нуклеиновой кислоты вначале синтезируют два продукта удлинения, каждый продукт удлинения соответствует одной цепи целевой последовательности. Заново синтезированный продукт удлинения не только представляет собой дубликат целевой последовательности, но также включает в себя последовательность праймера, которая может содержать или может не содержать участок несмежной последовательности. Заново синтезированные продукты удлинения затем отделяют от цепи исходной матрицы и используют как последующие матрицы для синтеза дополнительных продуктов удлинения. Согласно этому сегмент праймера, который является несмежным для праймирующей последовательности исходной матрицы, если он есть, копируется и интегрируется в продукт удлинения. Замечено, что каждый продукт удлинения, который затем может быть использован как матрица в последующей реакции удлинения, состоит из двух ковалентно связанных частей: (I) цельного праймера, включая несмежный сегмент, если он есть, и (II) амплифицированной последовательности нуклеиновой кислоты, комплементарной к цепи целевой последовательности. Совокупность из отделения цепи, гибридизации и удлинения /замещения образует один цикл реакции амплификации. Так, концентрация продукта удлинения возрастает экспоненциально с завершением нарастающих циклов амплификации.
В предпочтительном воплощении и праймер, и его блокирующий олигонуклеотид метят соответственно, например, донорным флюорофором и акцепторным флюорофором, которые приводят в тесную близость путем гибридизации, чтобы обеспечить передачу энергии резонанса. Когда происходит удлинение, доступность меченого праймера снижается из-за его включения в продукт удлинения. Это снижает количество меченого праймера, доступного для гибридизации с меченым блокирующим олигонуклеотидом. Когда удлинение происходит в повторяющихся циклах, немеченный продукт удлинения, способный к связыванию с праймером, образуется и конкурирует с меченым блокирующим олигонуклеотидом в гибридизации с праймером. Так, в предпочтительном воплощении блокирующие олигонуклеотиды играют двойную роль: (1) как блокирующие молекулы для исключения или уменьшения случаев неспецифического праймирования и (2) как сигнальный зонд, принимающий участие в процессе анализа.
Когда флюорофоры используют для осуществления этого изобретения, два флюорофора, донор и акцептор, присоединяют к блокирующему олигонуклеотиду и соответствующему ему праймеру, так что они находятся в пределах расстояния передачи энергии резонанса один от другого, когда блокирующий олигонуклеотид и праймер гибридизуют один с другим в форме дуплекса, флюорофоры предпочтительно отделены один от другого по меньшей мере одним нуклеотидом, но не более чем на 100 ангстрем (Clegg, Methods in Enzymology 211: 353). Целесообразно также, чтобы флюорофоры были присоединены к внутренним нуклеотидам. При желании может быть использовано более двух флюорофоров. Следует также отметить, что флюорофоры могут быть одинаковыми или разными. Частичное совпадение эмиссионного спектра донорного флюорофора и спектра возбуждения акцепторного флюорофора обеспечивает передачу энергии между ними. Соответственно, изменение в сигнале вследствие нарушения передачи энергии гарантируется, когда дуплекс праймеp:блокирующий олигонуклеотид денатурируется или диссоциирует, например, во время реакции удлинения.
При желании, вначале может быть приготовлен меченный флюорофором блокирующий олигонуклеотид, который практически не является комплементарным (т.е. комплементарность по меньшей мере из 5 спариваний оснований) ни к праймеру, ни к целевой последовательности исходной матрицы. "Универсальный дуплекс детекции" получают из блокирующего олигонуклеотида и второго меченного флюорофором олигонуклеотида, в котором блокирующий олигонуклеотид комплементарен ко второму олигонуклеотиду и перекрывает его 3' конец. Перед смешиванием специфического праймера с исходной матрицей для реакции удлинения блокирующий олигонуклеотид приводят к комплементарности праймера через процесс сшивания, при котором 3' конец второго олигонуклеотида ковалентно связывают с 5' концом праймера. Другими словами, термин "универсальный дуплекс детекции" используют для описания олигонуклеотида, образованного между блокирующим олигонуклеотидом и его комплементарным олигонуклеотидом, который не может служить как праймер. По очевидным причинам два флюорофора (или более) универсального дуплекса детекции должны быть в тесной близости. В наиболее предпочтительном воплощении донорный флюорофор и акцепторный флюорофор присоединяют к соответствующим олигонуклеотидам универсального дуплекса детекции слабой стабильности, а последующее сшивание праймера с дуплексом дает более стабильный дуплекс-праймер. В результате увеличивается интенсивность передачи энергии между двумя флюорофорами.
В отличие от универсального дуплекса детекции "дуплекс специфической детекции" готов к применению для амплификации/обнаружения целевой нуклеиновой кислоты. См. фиг. 1. Сплошной круг и сплошной квадрат - обозначения двух флюорофоров, а полный круг обозначает выведенный из строя 3' конец блокирующего олигонуклеотида. Следует отметить, что в воплощении, показанном на фиг. 1, меченый праймер содержит сегмент, несмежный с его праймирующей последовательностью. В дальнейшем для усиления чувствительности проводят предварительную асимметричную амплификацию, которая преимущественно амплифицирует цепь, с которой связан меченый праймер. Асимметричная реакция может быть индуцирована за счет обеспечения неравных количеств праймеров, например избыточного количества одного и лимитирующего другого, или за счет использования праймеров неравных длин в комплектарности к специфической праймирующей последовательности. Другие факторы также могут вносить свой вклад в асимметричный характер амплификации, такие как различие в скорости синтеза каждой цепи матрицы. Оптимальная пропорция праймера для асимметричной амплификации является фактором, который должен быть найден эмпирически (Shyamala et al., 1989, J. Bacteriol. 111 : 1602).
Способ настоящего изобретения может быть осуществлен в аппарате для одновременного проведения амплификации целевой последовательности в матрице нуклеиновой кислоты и обнаружения присутствия амплифицированной мишени без проведения стадии разделения. Аппарат содержит (1) олигонуклеотидный контейнер для размещения олигонуклеотидов; (2) реакционный сосуд для размещения пробы нуклеиновой кислоты, причем этот сосуд оперативно связан с олигонуклеотидным контейнером, чтобы можно было осуществлять автоматический перенос содержимого олигонуклеотидного контейнера в реакционный сосуд; (3) контролирующее устройство для смешивания олигонуклеотидов и пробы; (4) терморегулятор для регулирования температуры реакционного сосуда; (5) источник излучения и (6) детектор для определения излучения, испускаемого из реакционного сосуда. Предпочтительно реакционный сосуд является лункой многолуночного планшета для микротитрования. В основном источник излучения является устройством, способным генерировать фотоны нужной длины волны. Такое устройство хорошо известно специалистам в этой области и действительно коммерчески доступно (например, вольфрамовые лампы или ионизирующие лазерные осветительные приборы). Детектор является устройством, способным к преобразованию энергии фотона в электрический сигнал. Кроме того, такое устройство хорошо известно и может быть получено от многих поставщиков. Примерами могут служить фотоумножители и детекторы фотонов на полупроводниках.
Особенно желательно, чтобы аппарат также содержал процессор данных для обработки сигнальных данных, полученных детектором. Аппарат может содержать контрольный механизм, который останавливает реакцию амплификации, когда детектор обнаруживает предварительно обозначенный уровень излучения, соответствующий предварительно выбранному уровню амплификации. Так, аппарат приспособлен для мониторинга "на линии" реакции амплификации способом, аналогичным такому мониторингу продуктов ферментации, используемых для синтеза рекомбинантного белка в промышленных масштабах. Поэтому применение гомогенного способа амплификации и анализа в комбинации с аппаратом, раскрытым здесь, исключает загрязнение реакционного сосуда за счет исключения необходимости взятия пробы смеси для определения степени, до которой произошла амплификация целевой последовательности.
Предполагается, что и без дальнейшего уточнения, специалист в этой области, основываясь на приведенном здесь описании, использует настоящее изобретение в наиболее полном его объеме. Следующие специфические воплощения изобретения должны быть поэтому истолкованы только как иллюстративные, а не ограничивающие остального из раскрытого как бы то ни было иначе.
ПРИМЕР I
Влияние блокирующего олигонуклеотида на уменьшение случаев неспецифического праймирования
Для иллюстрации влияния блокирующего олигонуклеотида на эффективность праймирования сегмент из 127 комплементарных пар оснований SRY гена человека (Sinclair et al., Nature 346 : 240) амплифицируют в присутствии блокирующего олигонуклеотида или без него. Последовательность определяющих мишень праймеров является праймером (А) 5'-ААСТС AGAGA ТСАGС AAGGA GCTGG GATAC-3' и праймером (B) 5'-АСТТА ТААТТTR CGGGT АТТТС ТTR CTCT GTGCA-3'. Каждый TTR обозначает конъюгированный с Техасским Красным амино-С6-dT остаток (Glenn Research, Sterling, VA), который конъюгируют с праймером (В), следуя методикам, предложенным поставщиком (Molecular Probes, Inc. Eugene, OR. USA). Используемый блокирующий олигонуклеотид комплементарен 24 основаниям праймера (А) и имеет последовательность 5'- CAGCT GCTTG CTGAT CTCTG AGTTL-3', в которой "L" обозначает 3'-амин окончание (3'-амин-ON CPG, Clontech, Palo Alio, CA).
Все эти олигонуклеотиды синтезируют по Operon Technologies, Inc. (Alameda CA) и затем очищают электрофорезом на геле 8 М мочевина/15% акриламид. Специфические зоны олигонуклеотидов электрофоретически элюируют и количественно определяют по УФ оптической плотности при 260 нм.
Мужскую геномную ДНК человека, которую используют как целевую ДНК, экстрагируют из цельной крови методом O TAB/CTAB (Gustinicich et al., 1991, Biotechniques 11 : 298), количественно определяют по УФ 260 нм оптической плотности и последовательно разбавляют в ТЕ буфере (10 мМ трис-HCl и 1 мМ этилендиаминтетрауксусная кислота, pH 8,0) 50 нг/мкл дрожжевой тРНК в качестве носителя.
Амплификацию проводят на 96-луночном поликарбонатном планшете для микротитрования (Costar, Gambridge, MA) c использованием AG-9600 термостанции (MJ Research, Watertown, MA). К 10 мкл реакционной смеси из 50 мМ Tris-HCl, pH 8,7, 40 мМ KCl, 5 мМ NH4Cl, 2 мМ OTT, 0,1% Triton X-100, 100 мкМ dNTP с 0,3 единицами Tth ДНК-полимеразы (Carballeira et. al., 1990, Biotechniques 9 : 276-281) и варьируемыми количествами целевой ДНК (102, 103 и 104) добавляют по 30 нг каждого из праймеров с равным количеством блокирующего олигонуклеотида или без него. Дрожжевую тРНК и ДНК спермы лосося используют как отрицательные контроли. В целом 35 термоциклов (94oC в течение 25 секунд, 60oC в течение 20 секунд и 72oC в течение 40 секунд) проводят перед анализом проб на 9% акриламидном геле, подвергаемом электрофорезу в TBE буфере при 10 В/см. Молекулярным маркетом, используемым для электрофореза на геле, является HPa11 гидролизат pBR322 ДНК. Гель временно окрашивают этидиум бромидом и фотографируют при УФ-освещении. Фотография показана на фиг. 3.
Относительно фиг. 3 содержимое каждой трассы геля обозначено, tRNA обозначает дрожжевую транспортную РНК, SS обозначает ДНК спермы лосося. М обозначает молекулярный размер маркера, и цифры обозначают количества целевых молекул. Символ "+" или "-" обозначает отсутствие или присутствие блокирующего олигонуклеотида. Интенсивность SRY специфической последовательности из 127 пар оснований является наиболее выдающейся для реакций в присутствии блокирующего олигонуклеотида, даже при более низких дозировках мишеней. Напротив, интенсивность димера праймера является более заметной для реакций в отсутствие блокирующего олигонуклеотида. Эффективность амплификации специфической целевой последовательности, таким образом, непосредственно зависит от степени вмешательства случаев неспецифического праймирования, таких как образование димера праймера, которое значительно более обильно в реакциях без блокирующих олигонуклеотидов.
ПРИМЕР II
Применение меченного флюорофором блокирующего олигонуклеотида для мониторинга амплификации целевой нуклеиновой кислоты
Этот пример иллюстрирует, что блокирующий олигонуклеотид может не только уменьшать неспецифическое праймирование, но, когда он помечен флюорофором, он может быть также использован для контроля процесса амплификации. В этом примере используют целевую ДНК, блокирующий олигонуклеотид, в основном, такие же, как в Примере 1, за исключением того, что вводят индикаторную пробу, которая комплементарна 20 основаниям праймера (В) и имеет последовательность 5'-AGAGA GAAAT ACCCG AATTAL-3', чтобы она принимала участие в передаче энергии флуоресценции с праймером (В). "L" обозначает 3'-амин окончание (3'-амин-ON CPG, Clontech, Palo Alto, CA). После очистки индикаторную пробу еще конъюгируют с флюоресцеином, следуя методикам, предложенным поставщиком (Molecular Probes, Inc. Eugene, OR. USA).
Амплификацию проводят на 96-луночном поликарбонатном планшете для микротитрования (Techne Inc., Cambridge, England) с использованием устройства для термоциклирования MW-1 Thermocycler (Techne Inc., Cambridge, England). К 20 мкл реакционной смеси из 50 мМ Tris-HCl, рН 8,7, 40 мМ KCl, 5 мМ NH4Cl, 2 мМ OTT, 0,1% Triton X-100 100 мкМ dNTP с 0,6 единицы Tth ДНК-полимеразы и 102 копий целевой ДНК добавляют по 20 нг каждого из праймеров с равным количеством блокирующего олигонуклеотида или без него. ДНК спермы лосося используют как отрицательные контроли. В целом 24 термоцикла (94oC в течение 42 секунд, 53oC в течение 42 секунд и 72oC в течение 60 секунд) проводят перед добавлением индикаторной пробы к каждой реакции. Начальное считывание флюоресценции при 630 нм предпринимают на 25 цикле с помощью микропластинчатого флюориметра (Model 7600, Cambridge Technologies, Inc., Watertown, MA, USA). Последующие считывания предпринимают на 30 цикле и 35 цикле. Данные замеров флюоресценции представлены в виде диаграммы на фиг. 4.
Столбики на фиг. 4 иллюстрируют степень изменения сигнала флюоресценции на двух различных циклах в амплификации, проводимой с начальным добавлением блокирующего олигонуклеотида и без его добавления. Уменьшение сигнала флюоресценции является показателем диссоциации дуплекса праймер:блокирующий олигонуклеотид, которая в отсутствие случаев неспецифического праймирования пропорциональна степени включения праймера в амплифицированную целевую последовательность. Реакцию без Tth ДНК полимеразы используют как контроль сигнала флюоресценции (помечено как "No Amp"). Пробы, содержащие 102 копий SR последовательности и ДНК спермы лосося, анализируют параллельно для наблюдения мишень-специфических и неспецифических сигналов. Как показано на фиг. 4, на поздней стадии амплификации (цикл 35) присутствие блокирующего олигонуклеотида уменьшает случаи неспецифического праймирования, что очевидно из различия в изменении флюоресценции между двумя контролями ДНК спермы лосося, в которых блокирующий олигонуклеотид отсутствует и присутствует, соответственно.
ПРИМЕР III
Усовершенствование передачи энергии за счет сшивки универсального дуплекса детекции с праймером
В этом примере используют два набора универсальных олигонуклеотидов для иллюстрации усовершенствования передачи энергии за счет процесса сшивания, в котором комплементарный олигонуклеотид сшивают с праймером с участием его блокирующего олигонуклеотида в качестве матрицы.
Все олигонуклеотиды синтезируют, очищают и конъюгируют с флюорофорами в соответствии с методиками, описанными в предыдущих примерах. Для реакции сшивания 200 нг блокирующего олигонуклеотида наряду с равными молярными количествами его комплементарного олигонуклеотида и праймера добавляют к 20 мкл реакционной смеси, содержащей 0,15 единицы Т4 ДНК-лигазы (New England Biolab, Beverly, MA), 0,5 единицы Т4 полинуклеотид-киназы (New England Biolab, Beverly MA), 1 мМ АТФ и буфер (70 мМ Tris-HCl рН 7,6, 10 мМ MgCl2 и 5 мМ OTT). Реакции сшивания проводят в дублете путем инкубирования при 40oC в течение 1 часа и 30 минут и прекращают реакцию нагреванием при 95oC в течение 10 минут. Как до, так и после каждой реакции измеряют интенсивность флюоресценции аликвотной пробы реакционной смеси при эмиссии 630 нм с возбуждением 495 нм.
Набор А: Блокирующий олигонуклеотид имеет последовательность 5'-TTR TTTT GAACA GGCCT TGTTR G-3', его комплементарный олигонуклеотид имеет последовательность 5'-CAAGG CCTF G-3', и праймер имеет последовательность  подчеркнуты основания, комплeментарные к праймирующей последовательности. TTR обозначает конъюгированный с Техасским Красным амино-C6-dT остаток, и TF обозначает конъюгированный с флюоресцеином амино-C6-dT остаток. Об их присоединении к олигонуклеотидам см. Примеры I и II выше. Показание флюоресценции реакционной смеси до сшивания - 900 ± 23, а показание после сшивания - 1336 ± 211. Таким образом, сшивка улучшает передачу энергии в наборе А в 1,48 раза.
подчеркнуты основания, комплeментарные к праймирующей последовательности. TTR обозначает конъюгированный с Техасским Красным амино-C6-dT остаток, и TF обозначает конъюгированный с флюоресцеином амино-C6-dT остаток. Об их присоединении к олигонуклеотидам см. Примеры I и II выше. Показание флюоресценции реакционной смеси до сшивания - 900 ± 23, а показание после сшивания - 1336 ± 211. Таким образом, сшивка улучшает передачу энергии в наборе А в 1,48 раза.
Набор B: Блокирующий олигонуклеотид имеет последовательность 5'-TTR TGGT CTCGA CCTCC TTGTTR G-3', его комплементарный олигонуклеотид имеет последовательность 5'-CAAGG AGGTFC G-3', и праймер имеет последовательность 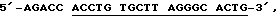 подчеркнуты основания, комплементарные к праймирующей последовательности.
подчеркнуты основания, комплементарные к праймирующей последовательности.
Показание флюоресценции реакционной смеси до сшивания -1489 ± 58, а показание после сшивания - 3019 ± 94. Таким образом, сшивка улучшает передачу энергии в наборе B в 2,03 раза.
ПРИМЕР IV
Применение дуплекса детекции для управления асимметической амплификацией целевых нуклеиновых кислот
Для демонстрации применения дуплекса детекции для управления процессом амплификации мы используем либо (А) дуплекс праймер:блокирующий олигонуклеотид, либо (В) универсальный дуплекс детекции, связанный с праймером. Для дуплекса (А), блокирующий олигонуклеотид комплементарен как к праймеру, так и к начальной целевой последовательности. Для дуплекса (В) праймер сшивают с комплементарным олигонуклеотидом блокирующего олигонуклеотида, чтобы добиться комплементарности между праймером и блокирующим олигонуклеотидом. Оба дуплекса используют в одинаковых реакциях амплификации. Сегменты последовательности, относящейся к точечному разрыву при остром миелоидном лейкозе человека (AML-1), и специфичного в X-хромосоме амелогинена человека (AMG-X) используют как мишени амплификации для иллюстрации применения.
Получение дуплекса праймер:блокирующий олигонуклеотид
Дуплекс (А): Последовательности праймера и блокирующего олигонуклеотида, используемых для АМL-1, представлены 5'-ACGGG GATAC GCATC АСААС АА-3' и 5' GCGTA TCCCC
GCGTA TCCCC  3', соответственно, а для AMG-X - 5'- AGACT
3', соответственно, а для AMG-X - 5'- AGACT  AGAGT GGCCA GGC-3' и 5'
AGAGT GGCCA GGC-3' и 5'  TCTGA CTCAG
TCTGA CTCAG 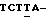 3', соответственно. Праймеры и блокирующие олигонуклеотиды конъюгируют с флюоресцеином и Техасским Красным, соответственно, в подчеркнутых положениях. Окончание 3' блокирующего олигонуклеотида выводят из строя удлинением 3'-дезокси окончанием.
3', соответственно. Праймеры и блокирующие олигонуклеотиды конъюгируют с флюоресцеином и Техасским Красным, соответственно, в подчеркнутых положениях. Окончание 3' блокирующего олигонуклеотида выводят из строя удлинением 3'-дезокси окончанием.
Дуплекс (В): Праймер для AML-1 имеет последовательность 5' 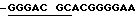 AGGCA TCACA ACАА-3', а праймер для AMG-X имеет последовательность 5'
AGGCA TCACA ACАА-3', а праймер для AMG-X имеет последовательность 5' 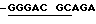 CTGAG TCAGA GTGGC-3'. Каждый праймер сшивают с дуплексом детекции подобно тому, как показано в Примере III. Передача энергии для AML-1 праймера и AMG-X праймера улучшается при сшивке в 2,62 и 2,42 раза, соответственно.
CTGAG TCAGA GTGGC-3'. Каждый праймер сшивают с дуплексом детекции подобно тому, как показано в Примере III. Передача энергии для AML-1 праймера и AMG-X праймера улучшается при сшивке в 2,62 и 2,42 раза, соответственно.
Асимметричная амплификация и анализ
Для AML-1 мишени избыточный праймер представлен 5'-TGTTT GCAGG GTCCT AACTC AATCG-3', лимитирующий праймер представлен 5'-GCGGC GTGAA GCGGC GGCTC G-3'; а для AMG-X мишени избыточный праймер представлен 5'-TGATG GTTGG CCTCA AGCCT GTG-3', лимитирующий праймер представлен 5'-TGGGA TAGAA CCAAG CTGGT CAG-3'.
Мужскую геномную ДНК экстрагируют из цельной крови способами в соответствии с Примером I.
Целевые последовательности асимметрично амплифицируют в течение 20 циклов перед добавлением дуплекса праймера. Асимметричную амплификацию проводят при отношении избыточного праймера к лимитирующему праймеру 7,5 (1,2 мкМ против 0,16 мкМ) в 10 мкл реакционной смеси, содержащей 1 единицу Tth ДНК полимеразы, 50 мМ Tris-HCl, 40 мМ KCl, 5 мМ NH4Cl, 100 мкМ dNTP, 5 мкМ MgCl2 и 0,1% Triton X-100. Условия циклирования идентичны тем, которые приведены в Примере I. Реакции проводят на 96-луночном поликарбонатном микропланшете (Costar, Cambridge, MA) на AG-9600 термостанции с серебряным блоком (MJ Research, Watertown, MA).
По 4 нг каждого дуплекса праймера добавляют в реакционную лунку при комнатной температуре, чтобы инициировать сопутствующие амплификацию и детекцию сигнала. Как базис для калибрования измеряют начальную эмиссию флюоресценции 630 нм на цикле 21, используя 485 нм возбуждение. Последующее измерение сигнала предпринимают на цикле 28 и на каждом из следующих за ним циклов.
Результаты, компилированные из данных, полученных на цикле 30, приведены на фиг. 5, которая демонстрирует количественное разрешение и чувствительность обнаружения с помощью дуплексов (А) и (В). Как показано на фиг. 5, уменьшение интенсивности флюоресценции отражает начальные целевые дозы.
Другие воплощения изобретения
Из приведенного выше описания специалист может легко выяснить существенные характеристики настоящего изобретения и, не выходя за пределы его сущности и объема, может делать различные изменения и модификации изобретения, чтобы приспособить его для различных надобностей и условий. Таким образом, другие воплощения изобретения также заключены в пунктах формулы изобретения.

Изобретение относится к области биотехнологии. Способ обнаружения целевой нуклеиновой кислоты основан на обнаружении продуктов амплификации. При этом при амплификации используют первый праймер, содержащий или несодержащий сегмент, несмежный с первой праймирующей последовательностью, второй праймер, содержащий или несодержащий сегмент, несмежный со второй праймирующей последовательностью. Амплификацию осуществляют в присутствии олигонуклеотида, который не способен действовать как праймер для используемой полимеразы и содержит, по меньшей мере, 5 последовательных нуклеотидов, комплементарных, по меньшей мере, 5 последовательным нуклеотидам первого праймера. Предложены набор, дуплекс и композиция для обнаружения целевой нуклеиновой кислоты. Способ позволяет существенно снизить возможность неспецифического праймирования и может быть осуществлен в виде гомогенного анализа. 5 с. и 11 з. п.ф-лы, 5 ил.
| US 5210015 A, 11.05.1993 | |||
| СПОСОБ ВЫЯВЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ L | 0 |
|
SU391172A1 |
| Способ выявления нуклеотидных последовательностей | 1989 |
|
SU1678838A1 |
| Способ амплификации фрагмента ДНК неизвестной последовательности, расположенного на некотором расстоянии от фрагмента ДНК известной последовательности | 1990 |
|
SU1792972A1 |
Авторы
Даты
2000-11-10—Публикация
1994-05-23—Подача