Данное изобретение относится к способу получения 3-(α-метокси)метиленбензофуранонов, которые являются промежуточными продуктами в процессе получения феноксипиримидиновых соединений, полезных в качестве промежуточных веществ для фунгицидов.
Известно, что 3-(α-метокси)метиленбензофуран-2(3H)-он может быть получен с помощью метилирования 3-формилбензофуран- 2(3H)-она или диазометаном, или метанольной серной кислоты (J.A. Elix and B.A. Ferguson, Australian Journal of Chemistry 26/5/ 1079-91 (1973)).
Сообщается, что попытки формилировать бензофуран-2(3H)-он оказались безуспешными (A. D. Haimon and C.P. Hutchinson Journal of Organic Chemistry 40/24 3474-3480 (1975)).
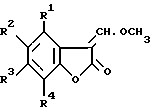
Согласно настоящему изобретению предоставляется процесс получения 3-(α-метокси)метиленбензофуранонов, имеющих общую формулу (II), в которой R1, R2, R3 и R4 независимо представляют водород, галоген, C1-4 алкил, C1-4 алкокси, ацетокси или ацил; включающий реакцию соединения формулы (XIV), где R1, R2, R3 и R4 имеют значения, определенные выше, с триметилортоформиатом.
Согласно изобретению соединение формулы (II) получают с помощью взаимодействия соединения формулы (XIV) с триметилортоформиатом в подходящем растворителе (например, триметилортоформиате или в инертном растворителе, таком как углеводородный растворитель, например толуол), при подходящем давлении, предпочтительно в интервале 1-5 атм, обычно при атмосферном давлении и при подходящей температуре (предпочтительно в интервале 20-180oC, подходящим образом 90-130oC (например, 95-110oC). Предпочтительно, чтобы ангидрид кислоты (предпочтительно ангидрид алкановой кислоты (например, уксусный ангидрид или изомасляный ангидрид)) использовался в данной реакции с триметилортоформиатом, и в данном случае подходящим растворителем может быть ангидрид кислоты, триметилортоформиат, или смесь указанных двух и/или инертный растворитель, такой как углеводородный растворитель, например толуол.
Как отмечалось выше, соединения формулы (II) являются промежуточными продуктами для феноксипиримидиновых соединений.
Например, соединения (II) с помощью реакции с соединением формулы ROCH3, в которой R представляет металл; и последующего взаимодействия полученного продукта с соединением формулы (III), в которой Z1 и Z2 представляют атомы галогена, дают соединения формулы (I), в которой R1, R2, R3 и R4 имеют указанные выше значения, Z1 представляет атом галогена и W представляет группу (CH3)2 CH•CH-CO2CH3 или CH3О•CH=CCO2CH3.
Следующие примеры иллюстрируют способ данного изобретения, а также получение из продуктов данного способа соединений формулы (I). Все реакции проводятся в атмосфере азота.
Там, где это показано, данные ЯМР являются выборочными и не делается попыток перечислить каждый сигнал. В примерах используются следующие сокращения: т. пл. = точка плавления, шир.с. = широкий синглет, с. = синглет, гх = газовая хроматография, д. = дублет, м. = мультиплет, т. = триплет, МС = масс-спектр.
Пример 1
Данный пример иллюстрирует получение 3-(α-метокси) метиленбензофуран-2(3H)-она.
Бензофуран-2(3H)-он (10.2 г), уксусный ангидрид (30 см3) и триметилортоформиат (12.1 г) перемешивались при 100-105oC в течение 12 ч. В течение данного времени жидкости с низкой точкой кипения собирались с использованием аппарата Дина-Старка.
Реакционная смесь оставлялась охлаждаться и концентрировалась при пониженном давлении (с использованием температуры водной бани 60oC), давая коричневое твердое вещество. Данное вещество растворялось в дихлорметане (100 см3), и данный раствор промывался водой (2 х 50 см3) и концентрировался при пониженном давлении (с использованием температуры водяной бани 60oC), давая сырой продукт (13.5 г). Некоторая часть данного сырого продукта добавлялась к сырому продукту от аналогичных экспериментов, и весь сырой продукт брался в метанол и обрабатывался активированным углем. После этого метанольный раствор нагревался с обратным холодильником в течение 30 мин, охлаждался до ниже 10oC, фильтровался, и остаток промывался холодным метанолом. Остаток сушился при 50oC под вакуумом, давая не совсем белое твердое вещество с т. пл. 102-103oC.
Продукт от аналогичного эксперимента давал следующие физические данные:
1H ЯМР (CDCl3, 250 МГц); δ 7.6 (1H, с.), 7,6-7.1 (4H, м.), 4.15 (3H, с.) млн.дол.
13C ЯМР (CDCl3, 62,9 МГц); δ 169.9, 160.1, 152.0, 128.3, 123.9, 123.0, 122.8, 110.4, 103.9, 63.9 млн.дол.
МС: молекулярный ион m/z 176.
Пример 2
Данный пример иллюстрирует получение соединения (I), в котором R1, R2, R3 и R4 все являются водородом, Z1 представляет хлор и W представляет (CH3O)2CHCHCO2CH3.
(α- Метокси)метиленбензофуран-2(3H)-он (8.8 г) растворялся в тетрагидрофуране (100 мл). К данному раствору добавлялся метилат натрия (2.7 г) и метанол (1.6 г). После добавления реакционная смесь становилась красной, и имела место экзомерия (реакционная смесь от 20oC достигала 45oC). Реакционная смесь охлаждалась до 20oC, перемешивалась в течение 15 мин, добавлялся 4,6- дихлорпиримидин (7.45 г), и смесь перемешивалась в течение 22 ч. Реакционная смесь затем фильтровалась, и остаток промывался дихлорметаном (50 мл). Фильтрат и промывные воды объединились и выпаривались при пониженном давлении с использованием температуры водяной бани 30oC, оставляя оранжевое масло. Масло растворялось в дихлорметане (200 мл), к которому добавлялась вода (100 мл). Смесь встряхивалась, водный слой нейтрализовался концентрированной соляной кислотой, и органический слой отделялся и выпаривался при пониженном давлении (с использованием температуры водяной бани 50oC), оставляя вязкое мутное оранжевое масло (15,66 г). Протонный ЯМР показал, что данное вещество включало главным образом соединение формулы (I), в которой Z1 представляет хлор, W представляет (CH3O)2CHCHCO2CH3, X представляет кислород, и R1, R2, R3 и R4 представляют водород.
Продукт от аналогичного эксперимента показал следующие физические данные:
1H ЯМР (CDCl3): δ 8.6(1H, с.), 7.7-7.1 (4H, м.), 6.9 (1H, с.), 5.0 (1H, д.), 4.2 (1H, д.), 3.55 (3H, с.), 3.4 (3H, с.), 3.2 (3H, с.) млн.дол.
13C ЯМР (CDCl3): δ 170.8, 170.4, 162.0, 158.4, 150.2, 130.0, 129.1, 126.7, 122.4, 107.9, 104.8, 55.5, 53.6, 52.2, 48.0 млн.дол.
Пример 3
Данный пример иллюстрирует получение (Е)-изомера соединения формулы (I), в которой R1, R2, R3 и R4 все являются водородом, Z1 представляет хлор и W представляет CH3O•CH=CCO2CH3.
Метилат натрия (2.84 г) суспендировался в метилацетате (30 мл) и метаноле (1.6 г), и суспензия охлаждалась до 0-5oC. К суспензии добавлялся порциями на протяжении 1 мин (α-метокси)метиленбензофуран-2(3H)-он (8,8 г) для поддержания температуры ниже 20oC. Реакционная смесь оставлялась подогреваться до комнатной температуры, и добавлялся 4,6-дихлорпиримидин (7.45 г). Реакционная смесь перемешивалась при 20-25oC в течение 19 ч (приблизительно). Реакционная смесь охлаждалась до 0-5oC, и к ней добавлялись дополнительные загрузки метилата натрия (1.0 г), метанола (0.56 г) и 4,6-дихлорпиримидина (2.61 г). Реакционная смесь перемешивалась при комнатной температуре в течение 23 ч.
Реакционная смесь затем фильтровалась, и остаток промывался метилацетатом (2х20 мл). Фильтрат и промывные воды объединялись и выпаривались при пониженном давлении (с использованием температуры водяной бани 60oC и в течение периода времени, достаточно продолжительного для удаления летучих пиримидиновых остатков), давая вязкое мутное красное масло (17.02 г).
Данное масло затем нагревалось при 160oC при 20 мм Hg в течение 1 ч с использованием аппарата Кугельрора. После данного периода времени к маслу добавлялся бисульфат калия (0.16 г), и масло хранилось при 160oC при 20 мм рт. ст. в течение 2 ч. Масло охлаждалось, растворялось в дихлорметане (100 мл), и данный раствор промывался водой (100 мл), содержащей 36%-ную соляную кислоту (1 см3). Органический слой отделялся и выпаривался при пониженном давлении (с использованием температуры водяной бани 30oC), оставляя масло. Данное масло нагревалось при 180oC при 20 мм рт.ст. в течение 3 ч.
Пример 4
Данный пример иллюстрирует альтернативное получение (E)-изомера соединения общей формулы (I), в которой R1, R2, R3 и R4 все являются водородом; Z1 представляет хлор и W представляет CH3O• CH=CCO2CH3.
Метилат натрия (6.25 г, 0.11 моль), метилацетат (100 мл) и метанол (3.52 г, 0.11 моль) загружались в 250-мл колбу в атмосфере азота и охлаждались до 0-5oC. К данной смеси добавлялся 3-(α-метокси)метиленбензофуран-2(3H)-он (21.12 г, 0.12 моль) при поддержании температуры ниже 10oC, и по завершении добавления реакционная смесь оставлялась подогреваться до комнатной температуры.
Затем к реакционной смеси добавлялся 4,6-дихлорпиримидин (15.05 г, 0.10 моль), и реакционная смесь перемешивалась на протяжении ночи (приблизительно в течение 20 ч) при 20-25oC и затем оставлялась стоять на протяжении уикэнда.
Реакционная смесь выпаривалась на вращающемся испарителе при 40oC, давая красное масло. Красное масло растворялось в толуоле (200 мл) и фильтровалось через активированный уголь, причем уголь промывался дополнительным количеством толуола (50 мл). Толуольный раствор и промывные воды объединялись, промывались водой (200 мл) и выпаривались на вращательном испарителе при 60oC, давая вязкое красное масло (33.15 г).
Некоторое количество вязкого масла (23.15 г) нагревалось с бисульфатом калия (0.14 г) при 120-130oC при 12 мм Hg в течение 1 ч. Данная смесь охлаждалась до 80oC и растворялась в толуоле (150 мл). Толуольный раствор промывался водой (150 мл), а затем выпаривался на вращательном испарителе при 75oC, давая сырой продукт (20.51 г).
Кристаллизация сырого продукта из изопропилацетата (25 мл) давала целевое соединение (10.6 г, т.пл. 104-106oC).
1H ЯМР (CDCl3, 250 МГц): δ 8.6 (1H, с.), 7.5 (1H, с.), 7.5-7.1 (4H, м.), 3.8 (1H, с.), 3.7 (3H, с.), 3.6 (3H, с.) млн. дол.
Пример 5
Данный пример иллюстрирует получение соединения формулы (I), в которой R1, R2, R3 и R4 все являются водородом, Z1 представляет хлор и W представляет CH3O•CH=CCO2CH3.
Метилат натрия (2.97 г, 0.055 моль) и ацетонитрил (19.60 г) загружались в колбу при температуре окружающей среды, и на протяжении 2 мин добавлялся (α-метокси)метиленбензофуран- 2-(3H)-он (11.40 г, 0.065 моль), вызывая увеличение температуры реакционной смеси до примерно 40oC. Реакционная смесь охлаждалась до температуры окружающей среды, и добавлялся 4,6- дихлорпиримидин (7,45 г, 0.05 моль), давая красно-коричневый раствор, который нагревался при 60oC в течение 6.25 ч. Растворитель отгонялся при 60oC/15 мм рт. ст. , давая красный полутвердый продукт (21.85 г). Анализ с помощью газовой хроматографии продукта показал целевой продукт с концентрацией примерно 55% и соединение формулы (I) (в которой X представляет кислород, R1, R2, R3 и R4 все представляют водород, Z1 - хлор и W представляет (CH3O)2CHCHCO2CH3) с концентрацией примерно 2.5%.
Сырой продукт кристаллизовался с использованием изопропилацетата, давая целевое соединение в виде твердого продукта (т.пл. 103-105oC), который по данным анализа газовой хроматографии был чистым.
Твердый продукт показал следующие физические данные:
1H ЯМР (CDCl3, 250 МГц): δ 8.6 (1H, с.), 7.5 (1H, с.), 7.2-7.5 (4H, м.), 6.8 (1H, с.), 3.7 (3H, с.), 3.6 (3H, с.) млн.дол.
13C ЯМР (CDCl3, 62.9 МГц): δ 170.3, 167.2, 161.8, 160.6, 158.5, 149.9, 132.8, 129.2, 126.1, 125.9, 121.9, 107.2, 106.9, 61.9, 51.5, млн.дол. Масс-спектроскопия показала молекулярный ион при m/z 320.
Пример 6
Данный пример иллюстрирует получение 3-(α-метокси) метилен)-5-хлор-бензофуран-2(3H)-она.
5-Хлор-бензофуран-2(3H)-он (4 г, 0.02 М), уксусный ангидрид (16.7 г, 0.16 М) и триметилортоформиат (4.24 г, 0.04 М) нагревались до 100oC в течение 2 ч. После этого реакционная смесь охлаждалась до 20oC, а затем концентрировалась при пониженном давлении (водяная баня при 70oC), давая сырой продукт в виде темно-красной смолы (3.7 г).
Смола растворялась в горячем метаноле (5 мл), и получающийся в результате раствор оставлялся охлаждаться. Из данного раствора кристаллизовалось твердое вещество.
Указанная выше процедура растворения сырого продукта в горячем метаноле, а затем сбор кристаллического продукта повторялись дважды, давая целевое соединение в виде желтовато-коричневого твердого вещества (0.3 г) с температурой плавления 128-130oC.
1H ЯМР (CDCl3, 250 МГц): δ 7.6 (1H, с.), 7.6-7.0 (3H, м.), 4.2 (3H, с.) млн.дол.
Пример 7
Данный пример иллюстрирует получение 3-( (α -метокси)метилен)- 5-ацетокси-бензофуран-2(3H)-она.
Уксусный ангидрид (25 мл) и 5-гидрокси-бензофуран-2(3H)-он (1 г, 0.0067 М) перемешивались при комнатной температуре в атмосфере азота в течение 10 мин. После этого добавлялся триметилортоформиат (1.06 г, 0.01 М), и получающаяся реакционная смесь нагревалась при 100oC (±5oC) в течение 12 ч. Реакционная смесь затем оставлялась охлаждаться до комнатной температуры, и из смеси выделялось розовое твердое вещество.
Реакционная смесь концентрировалась при пониженном давлении (водяная баня при 70oC), давая остаток, включающий розовое твердое вещество. Розовое твердое вещество растворялось в дихлорметане (50 мл), и получающийся в результате раствор промывался холодной водой (50 мл). Органический слой затем концентрировался при пониженном давлении (водяная баня при 70oC), давая целевое соединение в виде розовых игловидных кристаллов (1.15 г) с точкой плавления 206-210oC.
1H ЯМР (CDCl3, 250 МГц): δ 7.6 (1H, с.), 7.4-6.9 (3H, м.), 4.2 (3H,с.), 2.3 (3H, с.) млн.дол.
13C ЯМР (CDCl3, 100.6 МГц/: δ 169.8, 169.5, 160.7, 149.0. 146.6, 123.2, 121.0, 116.3, 110.6, 103.4, 63.8, 21.1 млн.дол.
Химические формулы приведены в конце описания.
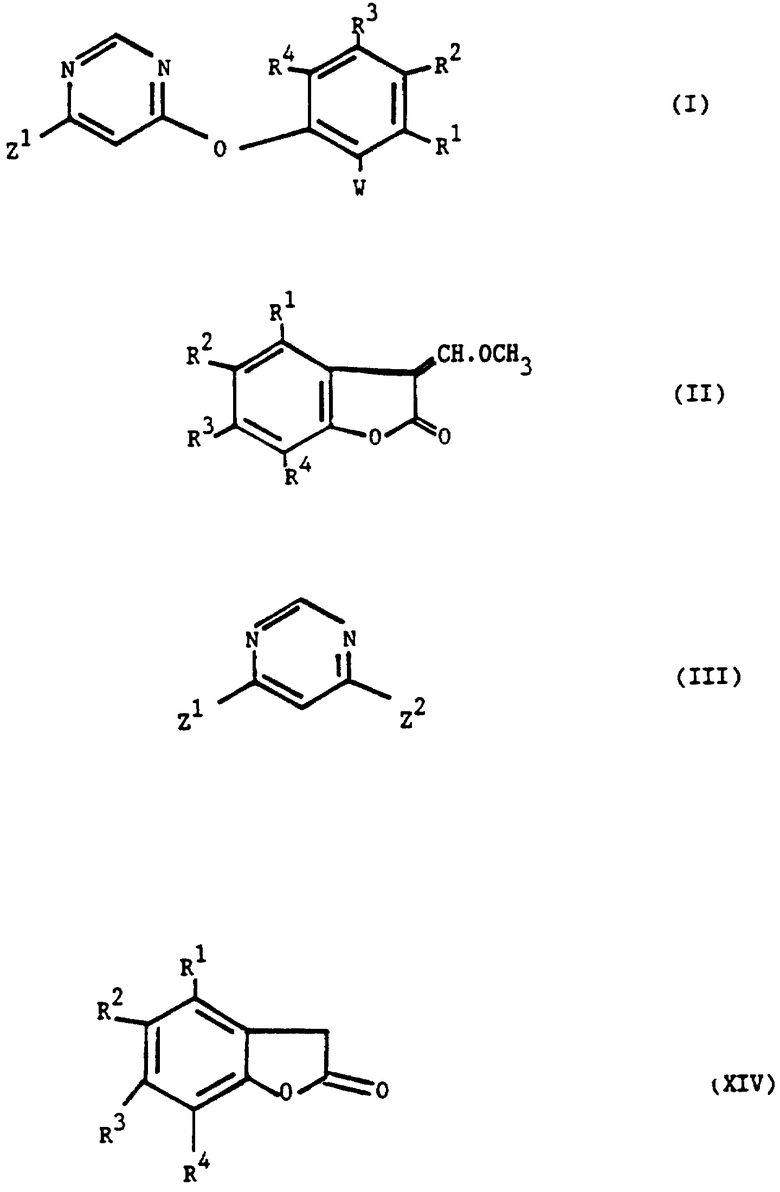
Описывается способ получения соединения формулы II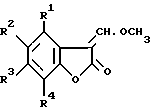
в которой R1, R2, R3 и R4 независимо представляют водород, галоген, С1-4 алкил, С1-4 алкокси, ацетокси или ацил. При этом соединение формулы XIV
где R1, R2, R3 и R4 имеют значения, определенные выше, подвергают взаимодействию с триметилортоформиатом. Бензофураноновые соединения полезны в качестве промежуточных соединений в процессе получения агрохимических веществ. 2 з.п. ф-лы.
в которой R1, R2, R3 и R4 представляют независимо водород, галоген, C1-4 алкил, C1-4 алкокси, ацетокси или ацил,
отличающийся тем, что соединение формулы XIV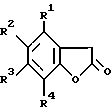
в которой R1, R2, R3 и R4 имеют значения, определенные выше,
подвергают реакции с триметилортоформиатом.
| Y.A.ELIX ET Al | |||
| Annellated furans .. | |||
| AUSTRALIAN Y | |||
| OF CHEM., 1973, v.26 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ПОРТАТИВНЫЙ ШТАТИВ ДЛЯ РЕНТГЕНОВСКОЙ ТРУБКИ | 1924 |
|
SU1075A1 |
| Вставной воздухо- или газоструйный глубокий насос | 1948 |
|
SU78240A1 |
| ТУННЕЛЬНАЯ СКОЛЬЗЯЩАЯ ОПАЛУБКА | 0 |
|
SU282390A1 |
| 6-Ацетоксиметилен-3-оксо-2-окса-бицикло-/3,3,0/-окт-7-ен как промежуточное соединение в полном синтезе простагландинов и способ его получения | 1978 |
|
SU731731A1 |
| CHAPMAN O.L | |||
| ET AL | |||
| Synthesis of Substituted .. | |||
| Y | |||
| Chem | |||
| Soc | |||
| Commun., 1971, p.384, 385. | |||
Авторы
Даты
2000-11-20—Публикация
1991-11-12—Подача