Настоящее изобретение относится к производным 7-(2,2,2- трихлор-трет.бутоксикарбонил)-10-гидрокситаксана, способу их получения и к промежуточным соединениям в синтезе таксанов.
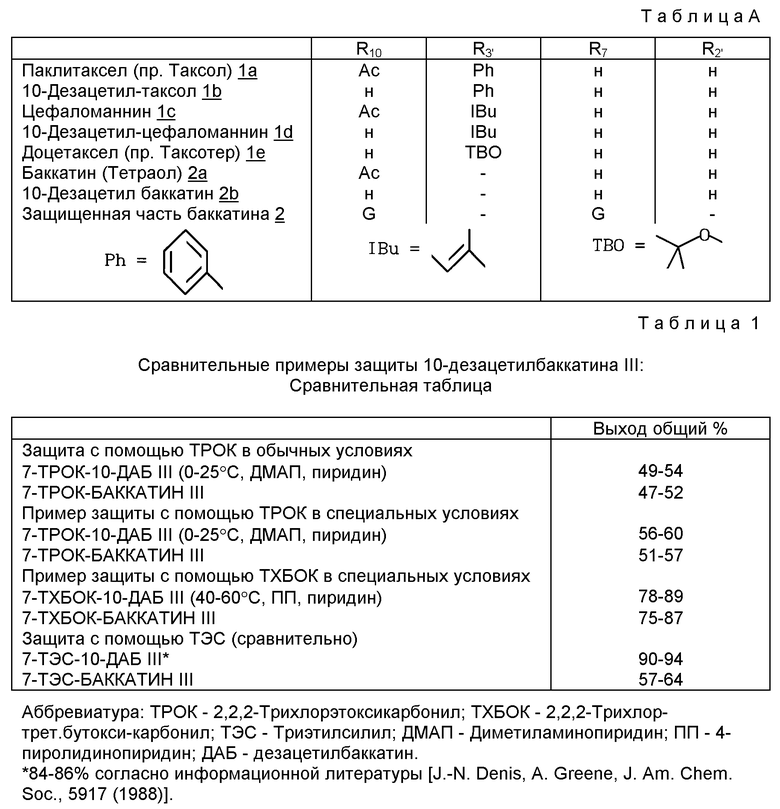
Таксаны, являющиеся природными веществами, дитерпеновой скелет которых обычно этерифицирован боковой β-аминокислотной цепью, производной N-алкил- или N-ароил-фенил-изосерина, известны в качестве противораковых средств. Насчитывается несколько десятков таксанов, выделенных из растений семейства тисовых, рода Taxus, как, например, паклитаксел (R1=ацетил, R2=фенил, R3=R4= H), цефаломанин, их дезацетилированные в положении 10 производные или баккатины (производные без боковой цепи), отвечающие нижеприведенным формулам 1 и 2 и представленные в таблице А (см. в конце описания).
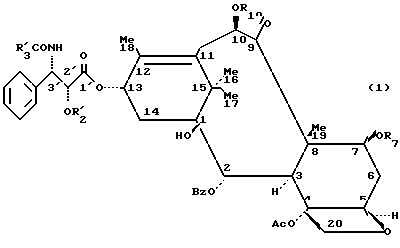
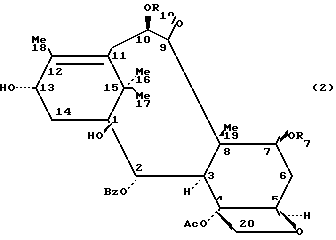
Для того, чтобы быстро не исчерпать источник сырья T.brevifolia, французские исследователи стремились выделить палитаксел из возобновляемых частей (листья) тиса европейского, таким образом, они выявили возможный биогенетический предшественник таксанов, 10-дезацетилбаккатин III, исходное вещество для полусинтеза, выбранное вследствие его относительно большого содержания в экстрактах из листьев.
Полусинтез таксанов, таких как паклитаксел или доцетаксел (R1=ацетил, R2= трет.бутилоксигруппа, R3=R4=H), заключается в этерификации гидроксильной функции, находящейся в положении 13, защищенного производного баккатина или защищенного 10- дезацетилбаккатина III с помощью производного β-аминокислоты.
В уровне техники описываются различные способы полусинтеза паклитаксела или доцетаксела (европейские патенты NN 0253738, 0336840, 0336841, 0495718; международные заявки NN 92/09589, 94/07877, 94/07878, 94/07879, 94/10169, 94/12482; европейские патенты N 0400971 и 0428376; международная заявка 94/14787). Две работы последних лет [I. Georg, Т.Т. Chen, I Ojima and D.M. Vyas, "Taxane Anticancer Agents, Basic Science and Current Status" ACS Symposium Series 583, Washington (1995)] и в особенности Matthew Suffness, "TAXOL® Science and Applications'' CRC press (1995) и 1500 цитированных ссылок включают исчерпывающий обзор методик полусинтезов таксанов.
Селективная монозащита дигидроксилированных в положении 7 и в положении 10 таксанов до сих пор могла быть получена только с помощью триалкилсилановых эфирных групп (ЕР-А 0336840). Эта защита представляет собой большой интерес вследствие того, что, с одной стороны, например, баккатин III, являющийся прямым предшественником паклитаксела, является малодоступным, а с другой стороны, отсутствует рентабельный способ его получения из более легко доступного 10-дезацетилбаккатина III без эффективной селективной защиты в положении 10.
Так, использование широко известных групп, таких как ацетатные или галогеналкоксикарбонильные группы, которые являются пространственно малозатрудненными, в частности классически известные трихлорэтоксикарбонильные группы, для защиты дигидрокситаксанов, таких как 10-дезацетилбаккатин III, имеет тот недостаток, что они не являются абсолютно селективными. Напротив до сих пор они широко использовались для неселективного снятия защиты с 7,10-дигидрокситаксанов, таких как 10-дезацетилбаккатин III, чтобы получить 7,10-ди-(2,2,2- трихлорэтоксикарбонилокси)-10-дезацетилбаккатин III, ключевой промежуточный продукт в синтезе доцетаксела (европейский патент А-0336841).
Использование триалкилсиланов для защиты гидроксильного радикала, находящегося в положении 7 дигидроксилированных в положениях 7 и 10 таксанов, вследствие относительной нестойкости этих защитных групп в слабокислой среде, имеет определенное число значительных недостатков, приводящих к дисбалансу их хорошей селективности.
1/. Последующее ацилирование в положении 10, которое обуславливает предварительную селективную защиту в положении 7, о которой идет речь в данном изобретении, приводит к средним выходам порядка 50% - 60% вследствие того, что триалкилсилилированные эфиры легко замещаются ацилирующей группой, находящейся в реакционной среде, причем эта ситуация осложняется тем, что очень трудно проводить этерификацию в положении 10, если положение 7 занято пространственно затрудненной группой. Этой вторичной реакции можно избежать, если осуществлять ее при очень низкой температуре, а в качестве промежуточного продукта использовать щелочной алкоголят, но при этом появляется новый недостаток при промышленном проведении синтеза, который указан в международной заявке WO-A-94/14787.
2/. Чувствительность алкилсилилированных эфиров к кислым условиям ограничивает возможности использования кислых реактивов на последующих этапах синтеза, следовательно, делает более узкой область применения этих защитных групп. Кроме того, нужно заметить, что высшие гомологи, такие как трет.бутилдиметилсилиловый эфир, были бы более устойчивы к этим условиям, однако введение этих групп становится невозможным из-за слишком большой стерической пространственной затрудненности.
3/. Хорошо известная чувствительность алкилсилилированных эфиров к гидроксилсодержащим растворителям, таким как вода и спирты, делает невозможным использование этих растворителей для перекристаллизации, хотя эти системы очень ценны в связи с высокой очищающей способностью в отношении этой группы соединений, что является еще одним значительным недостатком.
4/. Частичное разложение при промышленной очистке методом хроматографии промежуточных продуктов, которые являются носителями групп силилированных эфиров, не позволяет практически прибегать к этой технике очищения, которая, однако, очень ценна с точки зрения получения высококачественного и чистого фармацевтического сырья.
Таксоиды, не являющиеся носителями боковой цепи, формулы 3а:
в которой R1, R2, R4, R5, R6, R14 представляют собой независимо друг от друга радикал Q, где
Q = R, H, OH, OR, SH, SR, OCOR, OCOOR, HCO, X,
X = галоген и
R представляет собой, независимо один от другого, алкильный радикал, линейный или разветвленный, насыщенный или ненасыщенный, пергалогеноалкильный радикал, гетероалкильный радикал линейный или разветвленный, насыщенный или ненасыщенный, циклоалкильный радикал насыщенный или ненасыщенный, гетероциклоалкильный радикал насыщенный или ненасыщенный, радикал арил, аралкил, причем радикалы могут быть замещены, в частности, одним или несколькими атомами галогена, их простые и многочисленные сочетания и комбинации, в более общем смысле, любая содержащая эти радикалы комбинация в форме простых или повторяющихся звеньев,
и, в частности, производные общей формулы 2, как, например, 10- дезацетилбаккатин III, часто имеют по меньшей мере четыре свободные гидроксильные группы, одну - третичную в положении 1, пространственно очень затрудненную и этерифицируемую только в жестких условиях, три другие, вторичные, находящиеся в положениях 7, 10 и 13 и легче этерифицируемые, которые можно разделить, основываясь на степени их пространственной затрудненности, на две группы с разной реакционной способностью:
- первая группа в положении 13 с относительно низкой реакционной способностью к этерификации в стандартных реакционных условиях (в том числе к введению боковой цепи);
вторая группа в положениях 7 и 10, которая рассматривается в настоящем изобретении, может быть в свою очередь разделена на две слабо отличающиеся друг от друга группы по их реакционной способности к этерификации или к образованию карбоната, где предпочтение отдается гидроксилу, находящемуся в положении 7.
Из приведенных заявителем работ также следует, что оба положения гидроксилирования представляют собой случай аллостерического взаимодействия: введение пространственно затрудненного сложного эфира в одно из положений 7 или 10 изменяет пространственную доступность другого положения.
Таким образом, настоящее изобретение касается нового способа селективной защиты в положении 7 7,10-дигидрокситаксанов формулы За, указанной выше, путем его проведения в особых реакционных условиях с одновременным использованием алкоксикарбонильных групп, замещенных в положении 2 (или β), имеющих большую пространственную затрудненность, чем 2,2,2- трихлорэтоксикарбонильная (которая остается неселективной в предлагаемых конкретных реакционных условиях), способных удаляться с помощью механизма β-элиминирования (Protecting Groups, P.J. Kocienski, Thieme Verlag Ed, p.7 (1994) и указанные ссылки), при этом они не имеют ни одного из недостатков триалкилсилилированных эфиров, указанных выше.
Заявка на патент WO-A-94/07877 описывает синтез таксанов, в котором можно использовать 2-трихлорметил-2-пропоксикарбонил в качестве защитной группы гидроксилов 7 и 10 в 10-дезацетилбаккатине III. Однако из описания следует, что эта группа не использовалась для селективной защиты гидроксила в положении 7, а использовалось для защиты двух гидроксилов 7 и 10, необходимой для получения доцетакселя, единственного продукта, реально полученного в приведенных примерах, кроме того, с единственным примером использования 2,2,2-трихлорэтоксикарбонила в качестве защитной группы. Сведения, указанные в этой заявке, склоняют специалистов к тому, чтобы не использовать β-галогеналкоксикарбонильные группы, хотя они более пространственно затрудненные, чем 2,2,2-трихлорэтоксикарбонильные, для получения баккатина III, защищенного в положении 7, исходя из 10-дезацетилбаккатина III.
Изобретение относится также к новым образующимся промежуточным продуктам, к способу селективного ацилирования в положении 10 (по отношению к гидроксилу, находящемуся в положении 13) таксанов, защищенных в положении 7, и к новым 7- (алколсикарбонилокси-β-замещенным)-10-ацилокси-таксанам, к их использованию в реакции сочетания с боковыми цепями таксанов и к новым, образующимся при этом промежуточным защищенным таксанам.
Настоящее изобретение заключается в описании селективного удаления защитных групп β-замещенных-алкоксикарбонильных групп, приводящего к конечным таксанам, в частности к доцетакселу.
Более конкретно, изобретение относится к способу получения производных 7-алкоксикарбонилокси -β- замещенных-10-гидрокситаксанов следующей формулы 3b: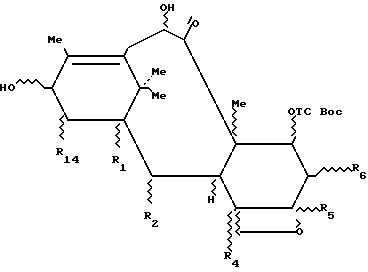
в которой R1, R2, R4, R5 R6 и R14 представляют собой, независимо друг от друга, радикал Q, где
Q = H, ОН, R, OR, OCOR, OCOOR;
R представляет собой, независимо друг от друга, радикал алкил линейный или разветвленный, радикал арил или аралкил,
путем медленного добавления при температуре выше комнатной, предпочтительно от 20oC до 80oC, соответствующего алкоксикарбонилхлорида, замещенного в положении 2, разбавленного в соответствующем растворителе, к интенсивно перемешиваемому раствору 7,10-дигидрокситаксана общей формулы 3a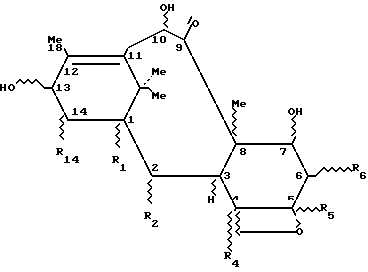
в которой R1, R2, R4, R5, R6 и R14 имеют значения, указанные выше, в присутствии пиридина и/или замещенного пиридина, пространственно затрудненного, например 4-пиролидинопиридина или диметиламинопиридина.
Преимущественно, этерификацию проводят с 1-1,5 эквивалентами хлорформиата по отношению к 7,10-дигидрокситаксана общей формулы 3a.
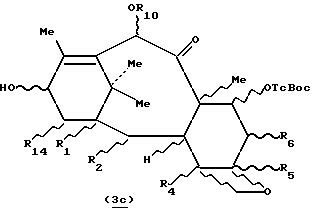
7- (алкоксикарбонилокси-β-замещенные) 10-ацилокси-таксаны общей формулы 3с: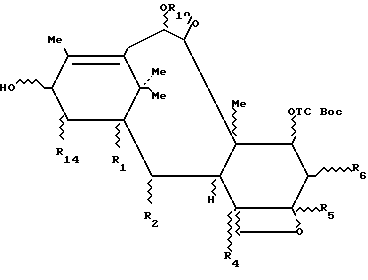
в которой R1, R2, R4, R5, R6 и R14 имеют значения, указанные выше, и R10 представляет собой радикал ацил формулы O-CO-R, причем R имеет значения, указанные выше,
получают путем медленного добавления при комнатной температуре соответствующего ацилхлорида (1-1,2 эквивалента), разбавленного в соответствующем растворителе, к интенсивно перемешиваемому раствору производного 7- (алкоксикарбонилокси-β-замещенного) -10-гидрокси-таксана, полученного выше, в присутствии пиридина и/или замещенного пространственно затрудненного пиридина, как, например, 4-пиролидинопиридина или диметиламинопиридина.
В этих двух реакциях в качестве соответствующего растворителя используют растворитель, не содержащий гидроксильных групп, в частности алкилгалогенид, например метиленхлорид, хлороформ или дихлорэтан.
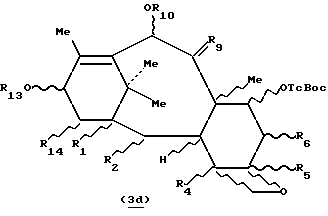
Таксаны, отвечающие формуле 3c, защищенные в положении 7, полученные выше, могут быть использованы для полусинтеза таксанов путем этерификации гидроксила в положении 13 соответствующим предшественником боковой цепи таксана, чтобы получить производное таксана общей формулы 3d: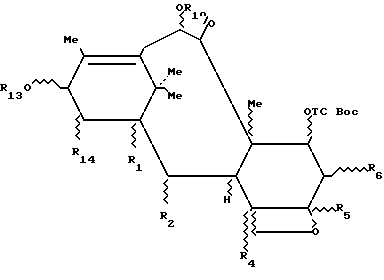
в которой R1, R2, R4, R5, R6, R10 и R14 имеют указанные выше значения и R13 представляет собой радикал-предшественник боковой цепи таксана, и затем, путем снятия селективной защиты с гидроксила в положении 7, в случае необходимости, с последующим и/или предшествующим раскрытием цикла и/или превращением и/или снятием защиты с предшественника боковой цепи, чтобы получить целевой таксан.
Предпочтительно R13 означает предшественник боковой цепи паклитаксела.
Можно использовать, в частности, предшественники боковой цепи таксанов, описанные в известном уровне техники (ЕР-0253738, ЕР-0336840, ЕР-0336841, ЕР-0495718, международные заявки WO 92/09589, WO 94/07877, WO 94/07878, WO 94/07879, WO 94/10169, WO 94/12482, EP-0400971, EP-0428376, международная заявка WO 94/14787), или оксазолидинон, описанный во французской заявке на патент FR-9512735, на которую дается ссылка в данном описании. Речь идет, в частности, о следующих предшественниках боковой цепи: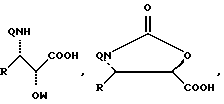
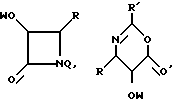
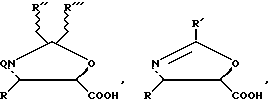
в которых
Q = H, RCO, ROCO,
W = Bz или защитная группа гидроксифункции GP,
R' = R, OR, SR, X, Si(R)3,
R'' и R''' = R,
причем R имеет указанные выше значения,
соединенных с производным формулы 3c согласно известным в литературе методикам (европейские патенты ЕР-0253738, ЕР-0336840, ЕР-0336841, ЕР-0495718, международные заявки WO 92/09589, WO 94/07877, WO 94/07878, WO 94/07879, WO 94/10169, WO 94/12482, EP-0400971, EP-0428376, международная заявка WO 94/14787 или французская заявка FR 9512735) для получения прямого предшественника соответствующих таксанов.
Предпочтительно можно использовать следующие предшественники боковых цепей таксанов:
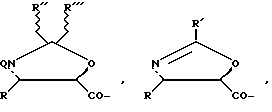
в которых Q, R, R', R'', R''' и W имеют указанные выше значения, в частности значения, при которых R и R' представляют собой арил, а Q представляет собой радикал ароил.
Если речь идет об оксазолидиноне, описанном во французской заявке на патент FR 9512735, то предпочтительно речь идет о N-бензоил-4-фенил-оксазолидин-2-он-карбоновой кислоте, в частности об изомере (4S,5R), получаемом преимущественно путем мягкого омыления соответствующего (+)-ментилового сложного эфира.
Снятие защиты с гидроксила в положении 7 баккатина осуществляют β-элиминированием согласно известным методикам [P.J. Kocienski, Protecting Groups, Thieme Verlag Ed., стр. 7 (1994) и приведенные выше ссылки].
Изобретение относится к производным 7- (алкоксикарбонилокси-β-замещенных) -10-гидрокси-таксанов следующей формулы 3b: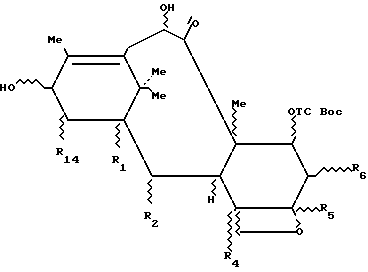
в которой R1, R2, R4, R5, R6 и R14 определены выше.
Изобретение относится к производным общей формулы 3c: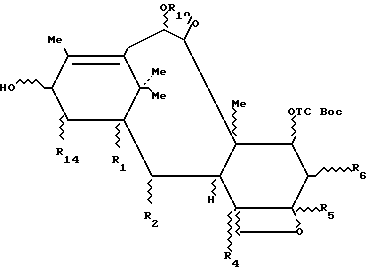
в которой R1, R2, R4, R5, R6, R10 и R14 имеют значения, определенные выше.
Изобретение относится к производным формулы 3d: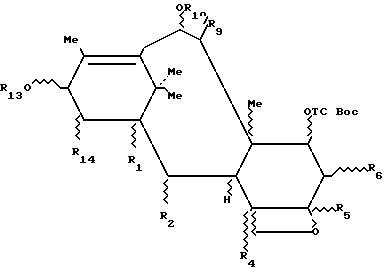
в которой R1, R2, R4, R5, R6, R10 и R14 определены выше, a R13 представляет собой радикал - предшественник боковой цепи таксана.
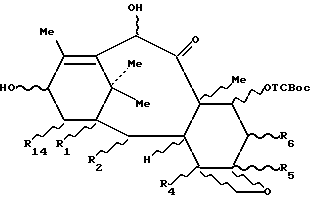
Способ согласно изобретению описан в целом для 7,10- дигидрокситаксанов общей формулы 3a, потому что он касается селективной защиты гидроксила в положении 7 независимо от природы заместителей R1, R2, R4, R5, R6 или R14. Разумеется, он очень хорошо подходит для защиты 10-дезацетилбаккатина общей формулы 2, в которой R7 и R10 представляют собой атом водорода, являющегося ключевым промежуточным продуктом в полусинтезе паклитаксела.
Настоящее изобретение касается также способа получения паклитаксела путем этерификации производного баккатина III общей формулы 2, в которой R7 представляет собой защитную группу, описанную выше, a R10 представляет собой ацетильный радикал, с соответствующим предшественником боковой цепи паклитаксела, затем путем снятия защиты с гидроксила в положении 7 согласно методике, описанной выше, в случае необходимости, с последующим и/или предшествующим раскрытием цикла и/или превращением и/или снятием защиты с предшественника боковой цепи паклитаксела, для получения названной боковой цепи паклитаксела.
Под линейным или разветвленным алкилом подразумевают преимущественно, согласно изобретению, алкил C1-C6, в частности, выбираемый среди радикалов: метил, этил, пропил, изопропил, бутил и его различные разветвленные изомеры, например третичный бутил, пентил и гексил, и их различные разветвленные изомеры. Это определение относится также к алкильным частям радикалов алкокси, аралкил и аралкокси.
Под арилом подразумевают, согласно изобретению, преимущественно ароматический или гетероароматический радикал, в частности, выбираемый среди радикалов фенил, нафтил, антрил, фенантрил, пиридил, пиримидил и т.д.
Под галогеном подразумевают преимущественно хлор, бром или йод. Что касается пергалогеноалкильных радикалов, то речь идет преимущественно о перхлорированных радикалах, в частности радикалах трихлорметил или пентахлорэтил.
Другие отличительные признаки способа и промежуточные продукты согласно изобретению будут ясны на примерах, рассматриваемых ниже.
СРАВНИТЕЛЬНЫЕ ИССЛЕДОВАНИЯ С ПОМОЩЬЮ ГАЛОГЕНАЛКОКСИКАРБОНИЛОВ
Основная цель данного изобретения - показать значительное преимущество в части селективности защитных β-замещенных алкоксикарбонильных групп, более пространственно затрудненных, чем 2,2,2-трихлорэтоксикарбонил (ТРОК), используемых ранее для неселективной защиты таксанов, имеющих, по меньшей мере, два свободных гидроксила, находящихся в положениях 7 и 10 (ЕР-А-0336841), кинетическое сравнительное исследование было осуществлено по отношению к этому последнему.
В качестве сравнения и без ограничения объема настоящего изобретения были выбраны в качестве примера 2,2,2-трихлор-трет.бутоксикарбонил (ТХБОК) и трибромэтоксикарбонил (ТБРОК), защитные группы, значительно более пространственно затрудненные, чем ТРОК, используя в качестве примера субстрата 10-дезацетилбаккатин III, известный предшественник полусинтеза паклитаксела и доцетаксела.
Реакционные условия, используемые при данном кинетическом исследовании, являются следующие:
- температура: 38oC
- растворитель: дихлорметан
Хлорформиат: 1,1-1,5 мольных эквивалента
- Общая продолжительность исследования: 16 часов
- Катализаторы: пиридин (5 мольных эквивалента), 4-пиролидинопиридин (1,4 мольных эквивалента)
- Условия работы: энергичное перемешивание, медленное введение хлорформиата (1 мольный эквивалент в час)
Последующий количественный анализ осуществлялся путем высокоэффективной жидкостной хроматографии.
Результаты этого кинетического сравнительного исследования показаны в таблице 1.
Результаты этого сравнительного исследования ясно показывают, что новые защитные группы согласно изобретению, используемые для синтеза баккатина III, защищенного в положении 7, позволяют получить 10-дезацетилбаккатин III, защищенный в положении 7 с селективностью, близкой к селективности триэтилсилила, единственной группы, используемой в известном уровне техники.
Когда затем осуществляют селективное ацилирование гидроксила в положении 10, получают выходы, которые больше выходов, получаемых с 7-триэтилсилил-10-дезацетилбаккатином III.
Таким образом, общий выход синтеза баккатина III, защищенного в положении 7, из 10-дезацетилбаккатина больше, чем выход, получаемый способом согласно известному уровню техники (75-87% против 57-64%).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример 1
7-O-(2,2,2-Трихлор-трет.бутоксикабонил)-10-дезацетилбаккатин III
В раствор, перемешиваемый при 40oC в инертной атмосфере, 500 мг (0,919 ммоль) 10-дезацетилбаккатина III и 0,19 г (1,29 ммоль) 4- пиролидинопиридина в 5 мл сухого дихлорметана добавляют раствор 0,26 г (1,10 ммоль) 2,2,2-трихлор-трет. бутоксикарбонилхлорида в 2 мл дихлорметана в течение 50 минут. После 1 часа реакции и возврата к комнатной температуре органический раствор промывают 2%-ным водным раствором HCl (5 мл), затем промывают осмотизированной водой (2 х 5 мл), сушат над MgSO4 и концентрируют под уменьшенным давлением. После хроматографии неочищенного продукта на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 60/40) получают 7-O-(2,2,2-трихлор-трет.бутоксикарбонил)- 10-дезацетилбаккатин III в виде белого порошка (выход = 89%).
Полученный продукт имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,10 (2H, d, J=7,3 Гц); 7,62 (1H, t, J= 7,3 Гц); 7,49 (2H, t, J=7,6 Гц); 5,64 (1H, d, J=6,8 Гц); 5,50 (1H, d); 5,39 (1H, dd, J=10,6 и 7,3 Гц); 4,97 (1H, d, J=8,6 Гц); 4,89 (1H, m); 4,34 и 4,20 (2H, 2d, J=8,4 Гц); 4,09 (1H, d); 4,06 (1H, d); 2,60 (1H, m); 2,31 (3H, s); 2,29 (1H, m); 2,13 (3H, s) и (1H, m); 2,06 (1H, m); 1,90 (6H, s); 1,85 (3H, s); 1,09 (3H, s); 1,06 (3H, s).
Пример 2
7-O-(2,2,2-Трихлор-трет.бутоксикарбонил)баккатин III
В раствор, перемешиваемый при комнатной температуре в инертной атмосфере, 260 мг (0,347 ммоль) 7-O-(2,2,2-трихлор-трет.бутоксикарбонил)- 10-дезацетилбаккатина III и 127,5 мг (1,04 ммоль) 4-диметиламинопиридина в 2,5 мл сухого дихлорметана добавляют 50 мкл (0,695 ммоль) ацетилхлорида. После 2 час реакции при комнатной температуре органическую фазу промывают 2%-ным водным раствором HCl до получения pH 6, сушат над MgSO4 м концентрируют под уменьшенным давлением. После хроматографии полученного осадка на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 6/4) получают 7-O-(2,2,2-трихлор-трет.бутоксикарбонил)баккатин III в твердом состоянии (выход = 96%).
Полученное соединение имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,10 (2H, d, J=7,6 Гц);) 7,61 (1H, t, J= 7,4 Гц); 7,48 (2H, t, J=7,7 Гц); 6,52 (1H, s); 5,65 (1H, d, J=6,9 Гц); 5,39 (1H, dd, J=10,4 и 7,3 Гц); 4,96 (1H, d, J=8,9 Гц); 4,86 (1H, m); 4,32 и 4,17 (2H, 2d, J=8,4 Гц); 4,01 (1H, d, J=6,9 Гц); 2,69 (1H, m); 2,30 (2H, m); 2,29 (3H, s); 2,16 (3H, s); 2,14 (3H, s); 2,07 (1H, d, J=4,8 Гц); 1,97 (1H, m); 1,95 и 1,91 (6H, 2s); 1,80 (3H, s); 1,61 (1H, s); 1,15 (3H, s); 1,07 (3H, s).
Пример 3 (сравнительный)
7-O-трихлорэтоксикарбонил-10-дезацетилбаккатин III
В раствор, перемешиваемый при 40oC в инертной атмосфере, 500 мг (0,919 ммоль) 10-дезацетилбаккатина III и 0,19 г (1,29 ммоль) 4-пиролидинопиридина в 5 мл сухого дихлорметана добавляют раствор 0,152 мл (1,10 ммоль) трихлорэтоксикарбонилхлорида в 2 мл дихлорметана в течение 40 минут. После 1 часа реакции и возврата к комнатной температуре органический раствор промывают 2%-ым водным раствором HCl (5 мл), промывают осмотизированной водой (2 х 5 мл), сушат над MgSO4 и концентрируют под уменьшенным давлением (выход ВЭЖХ = 57%). После хроматографии неочищенного продукта на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 60/40) получают 7-O-трихлорэтоксикарбонил-10-дезацетилбаккатин III в виде белого порошка.
Полученный продукт имеет следующие характеристики:
ЯМР 1H 400 МГц (COCl3) (δ ч/млн): 8,10 (2H, d, J=7 Гц); 7,62 (1H, t, J= 7,4 Гц); 7,49 (2H, t, J=7,6 Гц); 5,65 (1H, d, J=6,9 Гц); 5,44 (1H, dd, J= 10,8 и 7,3 Гц); 5,39 (1H, d); 4,98 (1H, d, J=7,5 Гц); 4,89 (1H, m); 4,84 и 4,70 (2H, 2d, J=11,9 Гц); 4,35 и 4,20 (2H, 2d, J=8,4 Гц); 4,10 (1H, d, J=7 Гц): 4,01 (1H, d, J=1,8 Гц); 2,64 (1H, m); 2,31 (3H, s); 2,29 (1H, m); 2,11 (3H, d); 2,05 (2H, m); 1,89 (3H, s); 1,09 (3H, s); 1,07 (3H, s).
Пример 4
7-O-трихлорэтоксикарбонилбаккатин III (сравнительный)
К раствору, перемешиваемому при комнатной температуре в инертной атмосфере, 1,70 г (2,36 ммоль) 7-O-трихлорэтоксикарбонил- 10-дезацетилбаккатина III и 0,96 мл (12 ммоль) пиридина в 17 мл сухого дихлорметана добавляют 0,68 мл (0,695 ммоль) ацетилхлорида. После 3 часов реакции при комнатной температуре органическую фазу промывают в воде (2 х 20 мл), сушат над MgSO4 и концентрируют под уменьшенным давлением. После хроматографии полученного осадка на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 6/4) получают 1,38 г 7-O- трихлорэтоксикарбонилбаккатина III в твердом состоянии (выход = 75%).
Полученное соединение имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,11 (2H, d, J=7,1 Гц); 7,62 (1H, t, J= 7,4 Гц); 7,49 (2H, t, J=7,6 Гц); 6,39 (1H, s); 5,64 (1H, d, J=6,9 Гц); 5,61 (1H, dd, J=10,7 и 7,2 Гц); 5,04 и 4,65 (2H, 2d, J=12 Гц); 4,99 (1H, d, J= 8,2 Гц); 4,87 (1H, m); 4,33 и 4,16 (2H, 2d, J=8,4 Гц); 4,02 (1H, d, J=6,9 Гц); 2,64 (IH, ddd, J=14,4, 9,5 и 7,2 Гц); 2,30 (3H, s) и (2H, m); 2,17 (3H, s); 2,13 (3H, d, J=0,8 Гц); 2,04 (1H, m); 1,83 (3H, s); 1,63 (1H, s); 1,14 (3H, s); 1,09 (3H, s).
Пример 5
13-O-[[(4S, 5R)-2,4-Дифенил-4,5-дигидрооксазол-5-ил] -карбонил] -7-O- (2,2,2-трихлор-трет.бутоксикарбонил)-баккатин III
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 3,38 г (12,7 ммоль) (4S,5R)-2,4-дифенил-4,5- дигидрооксазол-5-карбоновой кислоты в 60 мл безводного толуола добавляют 2,61 г (12,7 ммоль) дициклогексилкарбодиимида. После 5 минут перемешивания добавляют 5 г (6,33 ммоль) 7-O-(2,2,2-трихлор-трет.бутоксикарбонил)баккатина III и 0,77 г (6,33 ммоль) 4-диметиламинопиридина и полученную смесь перемешивают при комнатной температуре в течение 15 минут. После удаления нерастворимых веществ путем фильтрации органическую фазу концентрируют под уменьшенным давлением и полученный остаток очищают путем хроматографии на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 9/1).
Получают таким образам 6,2 г целевого соединения в форме белого твердого вещества (выход = 94%), который имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,18 (2H, d, J=7,2 Гц); 8,07 (2H, d, J= 7,6 Гц); 7,64 (1H, t, J=7,4 Гц); 7,60 (1H, t, J=7,3 Гц); 7,52 (4H, m); 7,39 (5H, m); 6,47 (1H, s); 6,24 (1H, t, J=8,4 Гц); 5,70 (1H, d, J=7 Гц); 5,59 (1H, d, J=7,3 Гц); 5,35 (1H, dd, J=10,4 и 7,2 Гц); 4,93 (2H, d, J=7,3 Гц); 4,29 и 4,17 (2H, 2d, J=8,5 Гц); 3,96 (1H, d, J=6,9 Гц); 2,71 (1H, m); 2,37 (1H, dd, J=15,1 и 9,2 Гц); 2,28 (1H, dd, J= 15,1 и 8,8 Гц); 2,13 (3H, s); 2,01 (6H, s); 1,95 и 1,93 (6H, 2s); 1,80 (3H, s); 1,72 (1H, s); 1,23 (3H, s); 1,18 (3H, s).
Пример 6
13-O-[[(2R,3S)-O-Бензоил-3-фенилизосерин-1-ил]-7-O- (2,2,2-трихлор-трет. бутоксикарбонил)баккатин III
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 100 мг (0,0963 ммоль) 13-O-[[(4S,5R)-2,4- дифенил-4,5-дигидрооксазол-5-ил] карбонил]-7-O-(2,2,2-трихлор- трет.бутоксикарбонил)баккатина III в смеси тетрагидрофурана (1 мл) и метанола (1 мл) добавляют 0,2 мл (0,2 ммоль) 1 молярного водного раствора HCl и реакционную смесь перемешивают при комнатной температуре в течение 14 часов 30 минут. После добавления 15 мг (0,2 ммоль) твердого кислого карбоната натрия с последующим перемешиванием в течение 10 мин реакционную среду экстрагируют этилацетатом (2 х 2 мл), органическую фазу промывают в воде, сушат над MgSO4, концентрируют под уменьшенным давлением.
Выделяют таким образом 102 мг целевого соединения (выход неочищенного продукта = количественный), которое используют таким как оно есть в следующем этапе и которое имеет следующие характеристики:
ЯМР 1H 400 МГц (DMCO-d6) (δ ч/млн): 8,15 (2H, d, J=7,9 Гц); 7,97 (2H, d, J= 7,7 Гц); 7,75 (2H, t, J=7,4 Гц); 7,64 (1H, t, J=7,7 Гц); 7,59 (1H, t, J= 7,7 Гц); 7,48 (2H, d, J=7,3 Гц); 7,42 (2H, t, J=7,5 Гц); 7,42 (2H, t, J=7,5 Гц); 7,19 (1H, t, J=7 Гц); 6,34 (1H, s); 5,89 (1H, t, J=8,9 Гц); 5,47 (1H, d, J= 7 Гц); 5,28 (1H, dd, J=10,5 и 7,3 Гц); 5,16 (1H, d, J=6,8 Гц); 4,98 (1H, d, J=9,5 Гц); 4,80 (1H, s); 4,41 (1H, d, J=6,8 Гц); 4,06 (2H, s ушир.); 3,72 (1H, d, J=7 Гц); 2,26 (3H, s); 2,07 (3H, s); 2,0 и 1,6 (4H, m); 1,86 (6H, s); 1,83 (3H, s); 1,64 (3H, s); 1,05 (3H, s); 1,01 (3H, s).
Пример 7
7-O-(2,2,2-трихлор-трет.бутоксикарбонил)таксол
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 90 г (0,0852 ммоль) 13-O-[(2R,3S)-O-бензоил- 3-фенилизосерин-1-ил] -7-O-(2,2,2-трихлор-трет.бутоксикарбонил)баккатина III в смеси тетрагидрофурана (4 мл) и метанола (4 мл) добавляют 0,25 мл насыщенного водного раствора кислого карбоната натрия и реакционную смесь перемешивают при комнатной температуре в течение 48 часов. После экстрагирования реакционной среды этилацетатом (2 х 5 мл) отделенную органическую фазу промывают водой (5 мл), сушат над MgSO4, концентрируют под уменьшенным давлением, а полученный остаток очищают хроматографией на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 6/4).
Получают таким образом 63 мг целевого соединения в виде белого твердого вещества (выход = 70%), который имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,12 (2H, d, J=7,4 Гц); 7,75 (2H, d, J= 7,3 Гц); 7,61 (1H, t, J=7,4 Гц); 7,50 (5H, m); 7,38 (5H, m); 7,19 (1H, d, J= 9 Гц); 6,47 (1H, s); 6,18 (1H, t, J=8,6 Гц); 5,79 (1H, dd, J=8,9 и 2,2 Гц); 5,70 (1H, d, J=6,8 Гц); 5,33 (1H, dd, J=10,3 и 7,2 Гц); 4,93 (1H, d, J= 9 Гц); 4,80 (1H, d, J=2,4 Гц); 4,31 и 4,21 (2H, 2d, J=8,5 Гц); 3,91 (1H, d, J=6,8 Гц); 2,66 (1H, m); 2,38 (3H, s); 2,33 (2H, m); 2,13 (3H, s); 1,99 (1H, m); 1,94 (3H, s); 1,90 (6H, s); 1,81 (3H, s); 1,19 (3H, s); 1,18 (3H, s).
Пример 8
13-O-[[(4S, 5R)-2,4-Дифенил-4,5-дигидрооксазол-5-ил] карбонил] баккатин III
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 390 мг (0,376 ммоль) 13-О-[[(4S,5R)-2,4-дифенил-4,5-дигидрооксазол-5-ил] карбонил] -7-O- (2,2,2-трихлор-трет.бутоксикарбонил)баккатина III в 10 мл этилацетата добавляют 300 мкл (5,26 ммоль) уксусной кислоты и 221 мг (3,38 ммоль) порошка цинка. После 1 часа 15 минут перемешивания при 30oC и анализа путем TCX органическую фазу после фильтрации промывают осмотизированной водой (5 мл), насыщенным водным раствором кислого карбоната натрия (2 х 5 мл), затем снова водой (2 х 5 мл), сушат над MgSO4 и концентрируют под уменьшенным давлением.
Выделяют таким образом 314 мг целевого соединения (выход неочищенного продукта = количественный), которое будет использовано в следующем этапе и которое имеет следующие характеристики:
ЯМР 1H 400 МГц (CDCl3) (δ ч/млн): 8,18 (2H, d, J=7,3 Гц); 8,07 (2H, d, J= 7,4 Гц); 7,64 (1H, t, J=7,4 Гц); 7,60 (1H, t, J=7,3 Гц); 7,52 (2H, t, J= 8,1 Гц); 7,50 (2H, t, J=7,8 Гц); 7,39 (5H, m); 6,27 (1H, s); 6,24 (1H, t, J= 8,5 Гц); 5,67 (1H, d, J=7,1 Гц); 5,59 (1H, d, J=6,9 Гц); 4,96 (1H, d); 4,95 (1H, d, J= 6,9 Гц); 4,29 и 4,15 (2H, 2d, J=8,4 Гц); 3,82 (1H, d, J= 7 Гц); 2,57 (1H, ddd, J=15, 9,6 и 6,8 Гц); 2,48 (1H, d, J=4 Гц); 2,38 (1H, dd, J= 15,3 и 9 Гц); 2,27 (1H, dd, J=15,3 и 8,7 Гц); 2,24 (3H, s); 2,04 (3H, s); 1,89 (3H, s); 1,88 (1H, m); 1,75 (1H, s); 1,67 (3H, s); 1,26 (3H, s); 1,15 (3H, s).
Пример 9
а) Получение паклитаксела из 13-O-[[(4S,5R) -2,4-дифенил-4,5- дигидрооксазол-5-ил] карбонил)-7-O-(2,2,2-трихлор-трет. бутоксикарбонил) баккатина III.
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 15 мг (0,0148 ммоль) 13-O-[[(4S,5R)- 2,4-дифенил-4,5-дигидрооксазол-5-ил] карбонил] -7-O-(2,2,2- трихлор-трет. бутоксикарбонил баккатина III в смеси тетрагидрофурана (0,18 мл) и метанола (0,18 мл) добавляют 90 мкл (0,09 ммоль) 1 М водного раствора HCl и реакционную смесь перемешивают при комнатной температуре в течение 8 часов. После добавления 0,6 мл насыщенного водного раствора кислого карбоната натрия раствор поддерживают гомогенным путем добавления 1 мл тетрагидрофурана и 1 мл воды и реакционную среду перемешивают еще дополнительно 1 час и 30 минут. После добавления 2,5 мл этилацетата и 2,5 мл осмотизированной воды остаточную водную фазу экстрагируют этилацетатом (2,5 мл). Соединенные органические фазы сушат над MgSO4 и концентрируют под уменьшенным давлением.
Получают таким образом 14 мг 7-O-(2,2,2-трихлор-трет. бутоксикарбонил)таксола в неочищенном виде (выход = 93%), который используют без очистки в следующем этапе.
В раствор, перемешиваемый при комнатной температуре, 13 г (0,0128 ммоль) 7-O-(2,2,2-трихлор-трет. бутоксикарбонил)- таксола в 2 мл этилацетата добавляют 30 мкл (0,525 ммоль) уксусной кислоты и 22,5 мг (0,344 ммоль) цинкового порошка. После 2 часов 30 минут перемешивания при комнатной температуре и анализа путем TCX и после разбавления реакционной среды в 3 мл этилацетата органическую фазу промывают осмотизированной водой (1 мл), насыщенным водным раствором кислого карбоната натрия (1 мл), снова водой, сушат над MgSO4 и концентрируют под уменьшенным давлением.
После хроматографии неочищенного продукта на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 6/4) выделяют таким образом 9,5 мг паклитаксела в кристаллизированном состоянии (выход = 89%).
б) из 13-O-[[(4S,5R)-2,4-дифенил-4,5-дигидрооксазол-5-ил]- карбонил]баккатина III
В раствор, перемешиваемый при комнатной температуре и в инертной атмосфере, 290 мг (0,347 ммоль) 13-O-[[(4S,5R)-2,4-дифенил- 4,5-дигидрооксазол-5-ил] карбонил] баккатина III в смеси тетрагидрофурана (4 мл) и метанола (4 мл) добавляют 0,7 мл (0,7 ммоль) 1 М водного раствора HCl и реакционную смесь перемешивают при комнатной температуре в течение 4 часов. После добавления 6 мл насыщенного водного раствора кислого карбоната натрия раствор поддерживают гомогенным путем добавления 10 мл воды и реакционную среду перемешивают 3 часа 30 минут дополнительно. После добавления 20 мл этилацетата и 10 мл осмотизированной воды остаточную водную фазу экстрагируют этилацетатом (20 мл). Соединенные органические фазы сушат над MgSO4 и концентрируют под уменьшенным давлением.
После хроматографии неочищенного продукта на силикагеле (15-40 мкм) (элюант: циклогексан-этилацетат 5/5) выделяют 270 мг паклитаксела в кристаллизированном состоянии (выход = 93%).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУСИНТЕЗА ТАКСАНОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2159237C2 |
| ТАКСАНЫ С БОКОВОЙ ЦЕПЬЮ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ | 1993 |
|
RU2125042C1 |
| С-4 КАРБОНАТСОДЕРЖАЩИЕ ТАКСАНЫ | 2000 |
|
RU2243223C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2137764C1 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2179554C2 |
| ПРОИЗВОДНЫЕ 2-АРИЛИМИНО-2,3-ДИГИДРОТИАЗОЛОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2002 |
|
RU2283838C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСАНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ СИНТЕЗА | 1993 |
|
RU2118958C1 |
| ПРОИЗВОДНЫЕ МИКАНОЛИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2278121C2 |
| 10-ДЕЗАЦЕТОКСИТАКСОЛ ИЛИ ЕГО ПРОИЗВОДНЫЕ | 1992 |
|
RU2114836C1 |
| ФОСФОНООКСИМЕТИЛОВЫЕ ЭФИРЫ ТАКСАНОВЫХ ПРОИЗВОДНЫХ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ПРОТИВООПУХОЛЕВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ РОСТА ОПУХОЛИ У МЛЕКОПИТАЮЩИХ | 1993 |
|
RU2136673C1 |
Описывается способ получения новых производных таксана формулы 3b, в которой R1, R2, R4, R5, R6 и R14 представляют собой независимо друг от друга радикал Q, где Q = H, OH, R, OR, OCOR, OCOOR; R представляет собой независимо друг от друга радикал алкил линейный или разветвленный, радикал арил или аралкил, путем медленного добавления при температуре выше комнатной, предпочтительно при 20oC - 80oC, соответствующего алкоксикарбонилхлорида, замещенного в положении 2, разбавленного в соответствующем растворителе, к интенсивно перемешиваемому раствору 7,10-дигидрокситаксана общей формулы 3а, в которой в положении 7 находятся ОТсВос группа, а R1, R2, R4, R6 и R14 имеют значения, указанные выше, в присутствии пиридина и/или замещенного пиридина, пространственно затрудненного, например 4-пиролидинопиридина или диметиламинопиридина, а также к соединениям 3b и промежуточным соединениям 3а, 3b и 3с. Эти соединения являются новыми промежуточными соединениями таксана формулы 3d, где R1 и R2, R4, R5, R6 и R14 имеют вышеуказанные значения, R10 - радикал ацил формулы O-CO-R, где R имеет вышеуказанные значения, а R13 - радикал-предшественник боковой цепи таксана. Соединения 3d используются в качестве противораковых средств в медицине. Данный способ позволяет получить производные таксана, а именно 10-дезацетилбаккатин III, защищенный в положении 7 с высокой селективностью. 4 c. и 8 з.п.ф-лы, 2 табл. 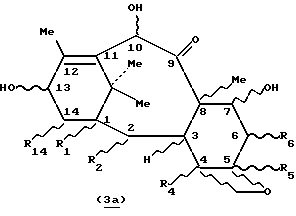

в которой R1, R2, R4, R5, R6 и R14 представляют собой независимо друг от друга радикал Q, где Q = H, OH, R, OR, OCOR, OCOOR;
R - независимо друг от друга радикал алкил линейный или разветвленный, радикал арил или аралкил,
путем медленного добавления при температуре выше комнатной, предпочтительно при 20 - 80oC, соответствующего алкоксикарбонилхлорида, замещенного в положении 2, разбавленного в соответствующем растворителе, к интенсивно перемешиваемому раствору 7,10-дигидрокситаксана общей формулы 3a
в которой R1, R2, R4, R5, R6 и R14 имеют значения, указанные выше,
в присутствии пиридина и/или замещенного пиридина, пространственно затрудненного, например 4-пиролидинопиридина или диметиламинопиридина.
в которой R10 представляет собой атом водорода.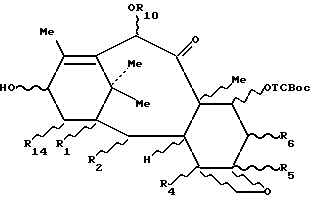
в которой R1, R2, R4, R5, R6 и R14 имеют значения, указанные выше;
R10 - радикал ацил формулы O-CO-R, причем R имеет значения, указанные выше,
путем медленного добавления при комнатной температуре соответствующего ацилхлорида, разбавленного в соответствующем растворителе, в интенсивно перемешиваемый раствор производного 7-(алкоксикарбонилокси-β-замещенного)-10-гидрокситаксана формулы 3b, определенного в пп.1-3, в присутствии пиридина и/или замещенного пространственно затрудненного пиридина, как, например, 4-пиролидинопиридина или диметиламинопиридина.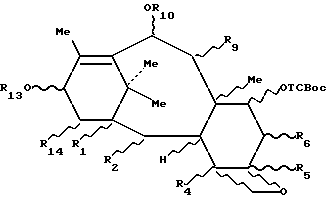
в которой R1, R2, R4, R5, R6, R10 и R14 имеют указанные выше значения;
R13 - радикал-предшественник боковой цепи таксана,
затем путем селективного снятия защиты с гидроксила в положении 7, в случае необходимости с последующим и/или предшествующим раскрытием цикла и/или превращением и/или снятием защиты предшественника боковой цепи, чтобы получить целевой таксан.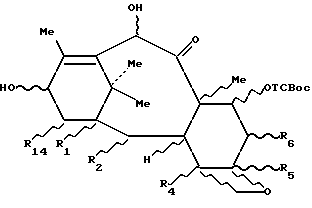
в которой R1, R2, R4, R5, R6 и R14 определены в одном из пп.1 и 2.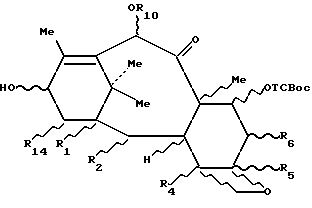
в которой R1, R2, R4, R5, R6 и R14 имеют значения, определенные в одном из пп.1-2, а R10 определен в п.4.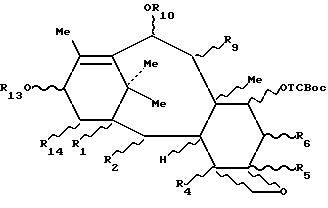
в которой R1, R2, R4, R5, R6, R10 и R14 определены в п.11 формулы изобретения, а R13 представляет собой радикал - предшественник боковой цепи таксана.
| WO 9520582 A1, 03.08.1995 | |||
| ЛАБОРАТОРНЫЙ ПРИБОР ДЛЯ КРАШЕНИЯ ОБРАЗЦОВ ТЕКСТИЛЬНОГО МАТЕРИАЛА | 0 |
|
SU253739A1 |
| Лигатура | 1976 |
|
SU558959A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ТАКСОЛА | 1990 |
|
RU2017724C1 |
Авторы
Даты
2001-02-10—Публикация
1996-12-27—Подача