Настоящее изобретение относится к белкам, выделяемым из тканей животных, в частности из печени млекопитающих, и их применение в онкологии.
В WO 92/10197 заявлены экстракты из органов млекопитающих, в частности печени козы, содержащие, по меньшей мере, три различных белка и отличающиеся необычными фармакологическими и иммунологическими свойствами. Однако в ней не приводится какой-либо информации о той роли, которую они играют, или о последовательности аминокислотных остатков индивидуальных компонентов белков.
Димерный белок размером 23 килодальтон, выделяемый с помощью экстракции 5%-ным раствором хлорной кислоты из печени и почки крысы, описывается в публикации Eur. J. Biochem. 272, 665, 1993. Соответствующая последовательность комплементарной ДНК депонирована в банке данных EMBL и получила при регистрации номер X70825.
Было высказано предположение, что этот белок, который, как указывается, экстрагируется совместно с группой белков высокой мобильности, играет определенную роль в процессе укладки цепи белков, так что его можно считать членом класса так называемых шаперонов.
В WO 93/18146 заявляется белок, экстрагированный из печени кролика и имеющий молекулярный вес 59 килодальтон, который способен образовывать комплексы с шаперонами и белками теплового шока с массой 90 килодальтон.
Было показано, что новый белок, выделенный путем очистки из экстракта, описанного в WO 92/10197, имеет частичную последовательность аминокислотных остатков, приведенную в виде последовательности с номером идентификации N 1.
Благодаря следующим свойствам этот белок применяют в онкологии:
- сыворотка животных после вакцинации белком проявляет цитотоксическую активность по отношению к культурам клеток опухоли человека;
- белок обладает ярко выраженной противоопухолевой активностью при дозах 0,015 мкг/кг у мышей Balb/c, страдающих от аденокарциономы мышей (с26), и у крыс, страдающих от внутриплевральной асцитной опухоли Yoshida;
- при назначении животным, в том числе человеку, белок приводит к увеличению количества антител, способных распознавать раковые клетки человека.
Указанные свойства позволяют объяснить активность, наблюдаемую при проведении клинических испытаний, которые заключаются в назначении экстрактов, приведенных в WO 92/10197, пациентам, пораженным развившимся раком легкого, молочной железы, желудка, толстой кишки и печени.
Белки по настоящему изобретению в значительной степени гомологичны белкам, экстрагированным из печени крыс и приведенным в Eur. J. Biochem. 272, 665, 1993.
Белки, обладающие высокой степенью гомологии с последовательностью с номером идентификации N 1, были также обнаружены в печени различных видов животных, в частности, в печени быка и лошади. Изобретение относится также к указанным гомологичным последовательностям, за исключением известной последовательности из печени крысы.
Таким образом, обнаружено новое семейство белков: члены этого ранее неизвестного семейства отличаются высокой степенью консервативности и гомологии у разных видов млекопитающих, а их молекулярный вес составляет приблизительно от 10 килодальнон до приблизительно 14 килодальтон.
Термин "высокая степень гомологии" означает, что гомология аминокислотных последовательностей составляет около 80% или более, преимущественно 90% или более.
Изобретение далее относится к использованию указанных ранее белков, способных экстрагироваться из печени млекопитающих с помощью хлорной кислоты, в онкологии в качестве терапевтического и/или диагностического средства.
Таким образом, в изобретении заявляются фармацевтические композиции, содержащие белок, имеющий неполную последовательность аминокислотных остатков, соответствующую последовательности с номером идентификации N 1, или белки, которые, по крайней мере, на 80%, предпочтительно на 90%, гомологичны последовательности с номером идентификации N 1.
Фармацевтические композиции по настоящему изобретению назначают парентерально, преимущественно подкожно или внутримышечно, и обычно содержат от 0,1 до 50 мг общего белка в одной единичной дозе. Активную составную часть белка, очищенного обычными способами, можно лиофилизовать в подходящем нетоксичном носителе и поместить в пузырьки или склянки.
Подходящие растворители включают воду и солевые физиологические растворы.
В соответствии с еще одним вариантом осуществления настоящего изобретения, белки по настоящему изобретению или их фрагменты, синтезированные, например, химическим путем, могут использоваться для получения поликлональных или моноклональных антител. Особенно интересные антитела распознают антигены опухоли, а поэтому полезны для диагностических, терапевтических и исследовательских целей. Два из указанных антител были депонированы 27 июля 1993 г. в Европейской коллекции культур клеток животных (ECACC), Porton Down, Salisbury, UK и получили при регистрации номера 930806103 и 930806104.
Указанные антитела используются при проведении иммунологических испытаний нескольких полученных биопсией образцов рака человека и позволяют провести их распознавание.
Белки по настоящему изобретению при назначении пациентам, пораженным вызываемыми опухолями заболеваниями, помимо благотворного воздействия, такого как подавление или регрессия опухолевой массы, уменьшение боли и улучшение общего состояния, приводят к индуцированию антител, обладающих цитотоксическим воздействием на культуры клеток опухоли. Для указанного цитотоксического воздействия необходима цельная сыворотка, не освобожденная от комплементного каскада.
При использовании в терапевтических целях или в качестве вакцины для иммунизации против неопластической трансформации белки по настоящему изобретению могут назначаться подкожно, внутримышечно или внутривенно с дозами в интервале от 0,1 до 30 мг в день на одного пациента. Лечение можно проводить в течение длительного периода времени до тех пор, пока концентрация индуцированных антител не достигнет обычного уровня.
Концентрацию индуцированных антител можно определить обычными способами, применяя, например, иммуноферментные методы. С этой целью в изобретении заявляются диагностические наборы, включающие реагенты, имеющие соответствующие метки, в частности, в качестве антигена белок по настоящему изобретению или его фрагменты, необязательно иммобилизованные на подходящем носителе, антииммуноглобулиновые антитела и соответствующие реагенты, способные обнаружить, например, с помощью колориметрической реакции, комплекс антиген-антитело.
Белки по настоящему изобретению можно назначать вместе с подходящими носителями, играющими роль вспомогательных средств. Подходящие вспомогательные средства можно выбрать, например, из нетоксичных белков, преимущественно ксеногенных белков, в частности, белков тех же видов животных, у которых проводили экстракцию иммуногенного белка.
Белки по настоящему изобретению получают, подвергая сырой экстракт, полученный путем экстракции органов хлорной кислотой, а затем гипертоническими физиологическими растворами (например, 3 M раствором хлорида калия) с последующим диализом, очистке с помощью методов жидкостной хроматографии высокого разрешения и гидрофобной обменной хроматографии (жидкостной экспресс-хроматографии белков), как это далее описывается в примерах.
Белок, выделенный из печени козы, блокируют по N-концу и частично определяют последовательность его аминокислотных остатков после расщепления с помощью CNBr, получая два основных фрагмента с молекулярным весом (определяют по методу MALDI-TOF), соответственно, 10263 и 4063 дальтон, в то время как молекулярный вес до расщепления составляет 14290 дальтон, что согласуется с величиной, полученной электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия.
Изобретение поясняется следующими примерами.
Пример 1
Экстракт из печени козы, полученный как указано в WO 92/10197, и который далее обозначают как UK 101, концентрируют на мембране Amicon PM 10 и затем подвергают диализу по отношению к 0,01 М раствору NaH2PO4/Na2HPO4 с pH 6,5. Полученный продукт очищают методом жидкостной хроматографии высокого разрешения на колонке TSK DEAE 5 PW, уравновешенной указанным буферным раствором; исходный буфер отбирают, а белок, абсорбированный на смоле, элюируют 1 М раствором хлорида натрия. Пик, элюирующийся в исходном буфере, далее очищают методом жидкостной хроматографии высокого разрешения на колонке TSK SW 3000.
После проведения указанных хроматографических очисток получают два основных пика: первый отбрасывают, поскольку он в основном состоит из гликогена; второй, наиболее обогащенный белками с низким молекулярным весом, затем очищают методом жидкостной экспресс-хроматографии белков на колонке Protein-Рас HIC Phenyl 5 PW.
Очистку на указанной колонке гидрофобной обменной хроматографии проводят в следующих условиях: вначале элюируют исходный буфер, 20 мМ Tris HCl с pH 7, содержащий 1 М раствор сульфата аммония, а затем проводят элюирование в линейном градиенте, заканчивая 20 мМ раствором Tris-HCl без сульфата аммония. Исходный буфер отбрасывают, а зону, элюирующуюся в градиенте молярности сульфата аммония от 0,6 до 0,8 М, собирают и подвергают диализу по отношению к воде.
Получают образец, который далее обозначают как UK 114, показывающий белковую полосу размером около 14 килодальтон при проведении электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия и степень чистоты около 90%.
Пример 2
При проведении иммуноцитохимических испытаний используют поликлональные антитела, индуцированные у кроликов, которым еженедельно в течение двух месяцев подкожно вводят вакцину экстракта из печени козла (WO 92/10197) в виде забуференного фосфатом солевого раствора, содержащего полный адъювант Фрейнда.
Моноклональные антитела получают от мышей Balb/c через месяц после еженедельных подкожных инъекций по 100 мкг UK 101 в неполном адъюванте Фрейнда. Слияние с миеломными клетками лейкоцитов, выделенных у животных, вакцинированных против UK 101, проводят обычными способами. Две, из полученных гибридом, депонируют 27 июля 1993 г. в Европейской коллекции культур клеток животных (ЕСАСС), Porton Down, Salisbury, UK и при регистрации присваивают им номера 930806103 и 930806104.
Антитела, секретируемые указанной гибридомой, распознают по настоящему изобретению.
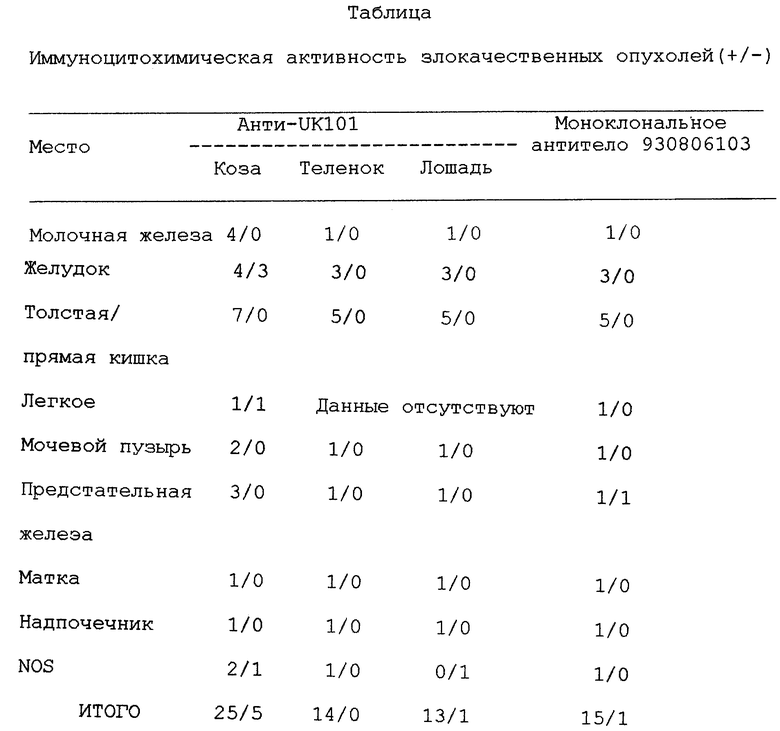
Моно- и поликлональные антитела исследуют с помощью иммуноцитохимических тестов, которые проводят на 30 полученных методом биопсии образцах злокачественных опухолей, выделенных из различных органов, таких как молочная железа, легкое, мочевой пузырь, желудок, толстая кишка/прямая кишка, матка, мягкие ткани, предстательная железа. Ткани фиксируют в 10%-ном забуференном растворе формалина и препараты в парафине окрашивают, используя набор Mistostatin Kit SP, выпускаемый компанией "Zymed Lab. Inc.".
Срезы выдерживают при температуре 4oC в инкубаторе вместе с антителами (0,5 мкг/л иммуноглобулина в забуференном фосфатом солевом растворе, содержащем 1% бычьего сывороточного альбумина) в течение ночи. После промывки срезы в течение 60 минут выдерживают в инкубаторе вместе с антикроличьим свиным биотинилированным иммуноглобулином, а затем еще 60 минут с разбавленным 1: 100 пероксидированным комплексом стрептавидин-биотин. Связывание пероксидазы определяют с помощью реакции 3,3-диаминобензидин/перекись водорода. Положительными считаются ткани, показывающие специфическую реакцию против антител в цитоплазме. Иммунную активность для нормальных тканей оценивают как отрицательную, слегка положительную, положительную (++) и сильно положительную (+++). Результаты приведены в таблице. Иммуноцитохимическая активность с различными поликлональными антителами против экстрактов из печени козы, теленка и лошади обнаруживается в большинстве злокачественных опухолей (82,7% для антител против экстракта из печени лошади и 100% против экстракта из печени теленка). Моноклональное антитело, секретируемое гибридомой с номером 930806103, дает положительные результаты для 93,7% исследованных опухолей.

Настоящее изобретение относится к белкам, имеющим молекулярный вес от приблизительно 10 до приблизительно 14 кДа и частичную аминокислотную последовательность. Последовательности с номером идентификации N 1, которые охарактеризованы в описании. Получение указанных последовательностей возможно путем экстрагирования из козьей печени хлорной кислотой. В данном изобретении описывается также получение фармацевтической композиции, обладающей противоопухолевой активностью для парентерального использования, включающей в качестве активного начала белки по п.1 в смеси с подходящим носителем. 2 с. и 2 з.п., 1 табл.
| WO 9210197 A, 25.06.1992 | |||
| СПОСОБ ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ, ПЕПТИДОВ И ИХ КОМПЛЕКСОВ | 1997 |
|
RU2122549C1 |
| Eur.J.Biochem | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2001-02-20—Публикация
1995-07-12—Подача