Данное изобретение относится к исследованию укороченных форм рецептора фактора роста гепатоцитов (HGF) и представляет собой способ получения их препаратов и фармацевтических наборов, содержащих их.
Протоонкоген МЕТ (Cooper et al, Nature 311, 29-33, 1984; Dean et al, Nature 318, 385-388, 1985, Park et al, PNAS USA 84, 6379-6383, 1987) кодирует трансмембранный гликопротеин (p190MET или Met-рецептор) с уникальными свойствами, представляющий собой гетеродимер, состоящий из двух цепей, соединенных дисульфидной связью, молекулярный вес которых составляет 50 килодальтон (p50α) и 145 килодальтон (p145β) (Giordano et al, Mol. Cell, Biol. 8. 3510-3517, 1988, Giordano et al, Nature 339, 155-156, 1989). Обе цепи обращены на поверхность клетки. β-цепь состоит из участка гидрофобных аминокислот, перекрывающего плазматическую мембрану, и внутриклеточного тирозинкиназного домена (Dean et al. 1985, Gonzatti-Haces et al. PNAS USA 85, 21-25, 1988; Tempest et al, FEBS Lett. 209, 357-361, 1986). Рецептор синтезируется в виде гликозилированного предшественника, имеющего молекулярный вес 170 килодальтон, который энзиматически расщепляется в процессе созревания, давая зрелый гетеродимер (Giordano et al, Oncogene, 4, 1383-1388, 1989; Tempest et al., Br. J. Cancer 58, 3-7, 1988).
Недавно было предложено использовать фактор роста гепатоцитов (HGF) в качестве лиганда для Met рецептора (Bottaro et. al., Science 251, 803-804, 1991; Naldini et al, Oncogene 6, 501-504, 1991; Naldini et al, 1991, EMBO J. , 10, 2867-2878). Известно, что HGF, называемый также гепатопоэтином-A /Miyazawa et al., Biochem. Biphys. Res. Commun. 163, 967 - 973 (1989); Nakamura et al., Nature 342, 440-443, 1989; Zarnegar et al., Cancer Res. 49, 3314, 1989), является самым мощным митогеном для первичных культур гепетоцитов крысы и человека, а также гепатотрофическим фактором, участвующим в процессах регенерации печени in vivo, как у людей, так и грызунов (см. обзор Michalopoulas, FASEB J. 4, 176-187, 1990). У крыс и кроликов HGF обнаружен также в поджелудочной железе, слюнных железах, двенадцатиперстной кишке, щитовидной железе и отдельных областях центральной нервной системы (Tashiro et al. , Proc. Natl. Acad-Sci. USA 87, 3200-3204, 1990; Zarneger et al., Proc. Natl. Acad-Sci. USA 87, 1252-1256, 1990).
Онкоген MET первоначально был идентифицирован с помощью трансфекции с использованием ДНК клеток линии человека, обработанных химическим канцерогеном (Cooper et al., Nature 311, 29-33, 1984). В этой линии клеток ген MET активировался при хромосомной перестройке (Park et. al. , Cell 45, 895 (1986). Обнаружено также, что амплификация и активация гена MET происходит в клетках линии карциномы желудка человека (Giordano et. al., Mol. Cell Biol. 8.3510, 1988) и в фиброобластях мыши, подвергающихся спонтанной трансформации (cooper et. al., EMBO J., 5, 2623, 1986).
В настоящее время мы разработали моноклональные антитела к экстраклеточному домену и использовали для их скрининга нескольких линий клеток человека. Кроме известного p190MET, эти антитела постоянно узнавали два других Met-гетеродимера: комплекс размером 140 килодальтон, локализованный на поверхности клеток, и комплекс размером 130 килодальтон, освобождаемый в культуральную среду. Оба комплекса состоят из α-цепи, неотличимой от p50α, и из укороченной с C-конца β-цепи p85β и p75β соответственно), лишенной домена цитоплазматической киназы. Эти укороченные Met-формы генерируются in vivo путем посттрансляционного протеолитического процессинга. Активация протеинкиназы C приводит к освобождению p130MET в культуральную среду.
Укороченные формы рецепторов фактора роста были обнаружены в некоторых клетках, супернатантах культуры тканей и биологических жидкостях (Beguin et al. , Proc. Natl. Acad. Sci. USA, 85, 637-640; Distefano et al. 1988, Proc. Natl. Acad. Sci. USA 85, 270-274; Johnson et al., 1990 Mol. Cell. Biol., 10, 4728-4736; Mosley et al., 1989, Cell. 59, 335-348; Zabrescky et al., 1991, J. Biol. Chem., 266, 1716-1720). Недавно сообщалось, что растворимые формы рецепторов с отсеченным C-концом способны конкурировать за связывание с лигандом с интактных рецепторов и, образуя неактивные гетеродимеры, могут препятствовать индуцируемой лигандом стимуляции тирозинкиназной активности (Basu et al., 1989, Mol. Cell. Biol., 9, 671-677; Kashles et al., 1991, Mol. Cell. Biol., 11, 1454-1463; Veno et al., 1991, Science, 252, 844-848). Таким образом, данное изобретение обеспечивает белок, состоящий из двух соединенных дисульфидной связью цепей размером 50 кД и 75 или 85 кД, причем белок имеет следующие свойства:
- его α-цепь является α-цепью рецептора фактора роста гепатоцитов (HGF) кодируемого протоонкогеном Met;
- его β-цепь является укороченной с C-конца формой β- цепи указанного рецептора HGF;
- указанный белок связывается с антителами, специфичными к внеклеточному домену β-цепи указанного рецептора HGF;
- указанный белок связывается с HGF; и
-указанный белок не имеет домена цитоплазматической тирозинкиназы.
Согласно изобретению два Met-белка с отсеченным C-концом представляют собой трансмембранную форму (p140MET), имеющую молекулярный вес 140 килодальтон, и растворимый белок с молекулярной массой 130 килодальнтон (p130MET), освобождаемый в культурную среду. Эти укороченные формы могут быть обнаружены в линии клеток GTL-16 карциномы желудка человека, в которых происходит амплификация гена MET, приводящая к суперсинтезу продуктов данного гена, а также в линиях клеток других карцином, имеющих нормальные уровни экспрессии гена MET.
Укороченные белки Met имеют ту же самую гетеродимерную структуру, что и интактный p190MET, состоящий из двух цепей, соединенных дисульфидной связью, α-цепи укороченных форм полностью идентичны α-цепи p190MET; тогда как их β-цепи имеют более низкий молекулярный вес. Молекулярный вес β-цепи белка p140MET составляет приблизительно 85 килодальтон (p85β), а β-цепи белка p130MET - около 75 килодальтон (p75β).
Как p85β, так и p75β имеют отсеченный C-конец. Они не узнаются антителами, действующими на C-концевой нонадекапептид, представленный на основании последовательности гена MET. У них отсутствует цитоплазматический домен тирозинкиназы, содержащий Tyr1235, являющийся основным участком фосфорилирования in vitro, о чем свидетельствует их неспособность к фосфилированию по торизону, как in vivo, так и in vitro. N-концевой домен p85β и p75β идентичен соответствующему домену белка p145β, так как все они узнаются моноклональными антителами, определяющими четыре различных эпитопа, и имеют одинаковые экстраклеточные триптические пептиды.
Полагают, что p85β-цепь представляет собой трансмембранный гликопротеин, который утратил большую часть своего цитоплазматического домена. Исходя из предсказаний аминокислотной последовательности, можно заключить, что отщепление последних 435 C-концевых аминокислот должно приводить к снижению молекулярной массы почти на 50 кД. Это значение согласуется к наблюдаемыми различиями в электрофоретической подвижности интактной и укороченных β-цепей. У p75β отсутствуют цитоплазматический домент и трансмембранный сегмент, так как он освобождается в культуральный супернатант и не связан с клеточной мембраной. К тому же он на 10 кД меньше по сравнению с трансмембранной цепью p85β. Это снижение размера согласуется с потерей сегмента, включающего трансмембранный домен.
Белки, заявленные в данном изобретении, могут быть выделены из культур клеточных линий, в которых экспрессируется ген MET. Типичными представителями таких клеточных линий являются карциномные клеточные линии. Следовательно, в данном изобретении обеспечивается способ получения белка, предусматривающий
1) культивирование клеток, экспрессирующих ген Met в среде;
2) взаимодействие получающейся кондиционной среды с антителами и
3) освобождение и выделение вышеупомянутого белка из образующегося иммунокомплекса, отличающийся тем, что антитело является специфичным к внеклеточному β-цепи рецептора HGF, и указанный белок, который высвобождается и выделяется, является белком изобретения в котором β-цепь имеет мол. массу 75 кД.
В качестве клеток, экспрессирующих ген MET, могут быть использованы клетки любой подходящей клеточной линии. Для этой цели годятся клетки таких клеточных линий, как карцинома желудка, аденокарцинома легких, стоматическая карцинома и карцинома толстой кишки. Предпочтительно использование клеток, суперпродуцирующих ген MET. Культуральной средой может служить любая среда, содержащая усвояемые источники углерода и азота и, желательно, минеральные соли. Для этого пригодна среда RPMI 1640 с добавлением фетальной сыворотки теленка.
Антитела, специфичные к экстраклеточному домену β-цепи тирозинкиназы, кодируемой геном MET, могут быть получены обычным способом. Эти антитела, как правило, являются моноклональными (Kohler and Milstein, Natere 256, 495-497, 1975). Гибридомные клетки, продуцирующие моноклональные антитела, могут быть получены слиянием клеток селезенки, выделенных из иммунизированного животного, с опухолевой клеткой. Иммунизируемым млекопитающим может быть крыса или мышь. Млекопитающее может быть иммунизировано целыми клетками или экстрактами клеток, которые экспрессируют ген MET. Предпочтительно выбирать клетки, обладающие суперэкспрессией гена MET. Продуцируемые гибридомами антитела отбираются по оценке их способности к иммунопреципитации Met белка, экстрагированного из линии клеток, продуцирующих Met белок. Гибридомы могут быть выращены в культуре или введены интраперитонеально для образования асцитной жидкости либо в кровяное русло аллогенного или же иммунокомпромиссного хозяина (хозяина с нарушенной иммунологической реактивностью).
Между антителом и p130MET формируется иммунопреципитат, который присутствует в кондиционной среде. Иммунопреципитат собирается, например, на колонке, такой, как белок-A-сефароза (торговая марка), к которой были привязаны специфичные анти-Met антитела, и перекрестно связывается. P130MET освобождается из иммунокомплекса при обработке низким pH или высокой солью.
Изобретение также обеспечивает способ получения белка, предусматривающий
1) экстрагирование клеток, экспрессирующих ген Met с использованием детергента;
2) взаимодействие экстракта с антителами;
3) высвобождение и выделение указанного белка из образующегося иммунокомплекса; отличающийся тем, что антитело является специфичным к внеклеточному домену β-цепи рецептора HGF, и указанный белок, который высвобождается и выделяется, является белком изобретения, в котором β-цепь имеет мол. массу 85 кД.
Клетки, которые экспрессируют ген MET, и культуральная среда, в которой они выращиваются, такие же, как описано выше. Клетки экстрагируются детергентом, обычно для этого используется неионный детергент, такой, как ТритонХ100 или CHAPS /3-[(3-Холамидопропил)диметиламмонио-1-пропаносульфонат]/. CHAPS производится фирмой Fluka и применяется в виде 1% раствора в HEPS буфере, как описано в Naldini et al., Molecular and Cellular Biology, vol. 11, по 4 (April 1991), pages 1793-1803). Обычно клетки экстрагируются в буфер, к которому могут быть добавлены ингибиторы протеаз, такие, как пепстатин, леупептин, апротинин ингибитор трипсина. Получающийся экстракт связывается с антителами, специфичными к β-цепи тирозинкиназы, кодируемой геном MET, и p140MET освобождается из образовавшегося иммунопреципитата как описано выше.
Белок, соответствующий изобретению, может быть выделен и очищен. Может быть достигнута практически полная очистка этого белка как от примесей целой тирозинкиназы, кодируемой геном MET, так и от других компонентов клеток, экспрессирующих ген MET. Данный белок может быть использован в качестве антагониста HGF. Белок сохраняет способность к связыванию с HGF, но, будучи, лишен тирозинкиназного домена, не способен передавать внутриклеточный митогенный сигнал. Поэтому данный белок может быть использован для лечения опухолей, включая опухоли желудочно-кишечного тракта, печени, щитовидной железы и мозга. Действительно, у большого процента клеток из этих опухолей наблюдается экспрессия HGF рецептора, и для роста этих опухолей требуется HGF. Данный белок также может быть использован в качестве агента, подавляющего регенерацию печени, для лечения гиперплазии печени или аденоматоза.
Белок, заявленный в изобретении, может вводиться пациенту любым удобным парентеральным путем. Выбор способа введения лекарства - подкожно, внутримышечно или внутривенно, дозы и частоты введения зависит от множества факторов. Учитывается, с какой целью принимается препарат, возраст и вес пациента, а также состояние его здоровья. Однако обычно белок назначается в количестве от 10 до 1000 мкг на дозу, лучше от 50 до 500 мкг на дозу для каждого курса лечения.
Белок может быть добавлен к фармацевтическому составу. Фармацевтический состав также содержит фармацевтически приемлемый носитель или растворитель. В зависимости от курса лечения может быть использован любой подходящий носитель или растворитель.
Следующие примеры иллюстрируют изобретение. Они представлены на фигурах.
Фиг. 1 показывает, что укороченная форма Met-белка идентифицируется моноклональными антителами к экстраклеточному домену. На снимках A и B: клетки GTL-16, поверхностно меченые 125I в присутствии лактопероксидазы. Клеточные белки солюбилизировались Тритоном X-100 и иммунопреципитировались различными моноклональными антителами (Mabs), направленными либо с C-концевому пептиду (DR-6, дорожка 1), либо к экстраклеточному домену (DO-24, DN-30, DN-31, дорожки 2, 3, 4) Met-белка. Иммунопреципитировавшие белки разделялись электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-ПААГ) в условиях, препятствующих восстановлению дисульфидных связей (снимок A), или после обработки 2β-меркаптоэтанолом, приводящей к восстановлению этих связей (снимок B). На снимке C: p140MET (дорожка 1) и p190MET комплексы (дорожка 2), полученные после иммунопреципитации моноклональными антителами DO-24, вырезались из полиакриламидного геля (SDS-ПААГ), элюировались в буфере Laemmli, восстанавливались 2β-меркаптоэтанолом и анализировались в SDS-ПААГ в условиях восстановления дисульфидных связей. Гели высушивались и экспонировались для получения авторадиограммы в течение 3 дней.
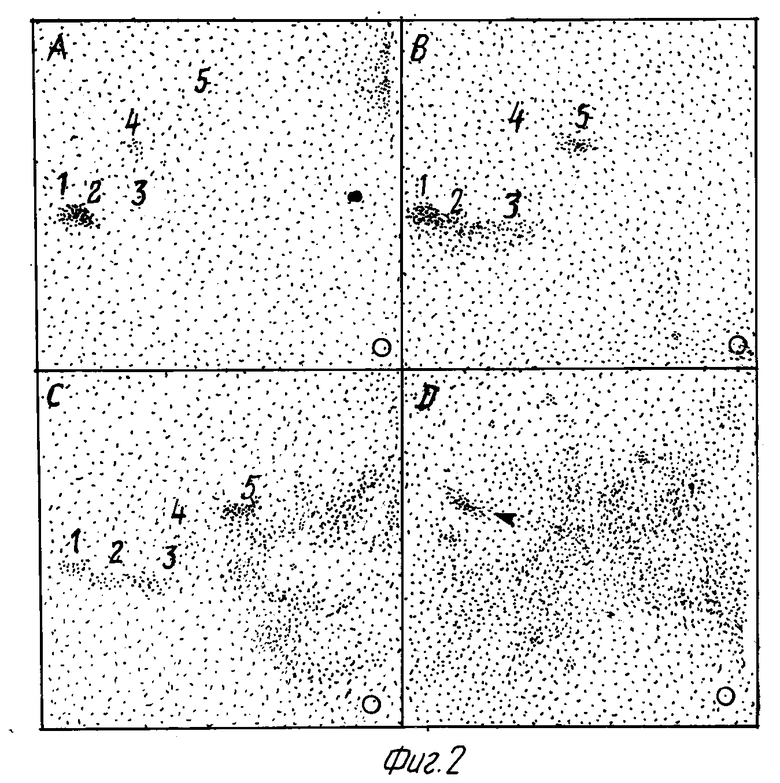
На фиг. 2 приведены двумерные триптические пептидные карты экстраклеточных доменов β-цепей, выделенных из интактных и укороченных Met-рецепторов. После иммунопреципитации моноклональными антителами (Mabs)анти-экстраклеточного домена p145β (снимок A), p85β (снимок B) и p75β (снимок C), выделенные либо из поверхностного радиоиодированных клеток GTL-16, либо из супернатанта радиоиодированных клеток GTL-16, разделялись в SDS-ПААГ. Белки электрофоретически переносились на Immobilon P мембрану и подвергались исчерпывающему триптическому гидролизу. Около 3000 cpm каждого гидролизата помещались в лунку в правом углу, соответствующую аноду, и подвергались электрофорезу при pH 1,9 и восходящей хроматографии в системе пиридин-уксусная кислота - бутанол-вода. Основной триптический пептид (отмеченный на фигуре стрелкой), полученной из α-цепи Met-белка, показан для сравнения (на снимке D). Карты экспонировались в течение 21 недель при -70oC с /усиливающими/ интенсифицирующими экранами. Положение источника на фигуре обозначено кружочком.
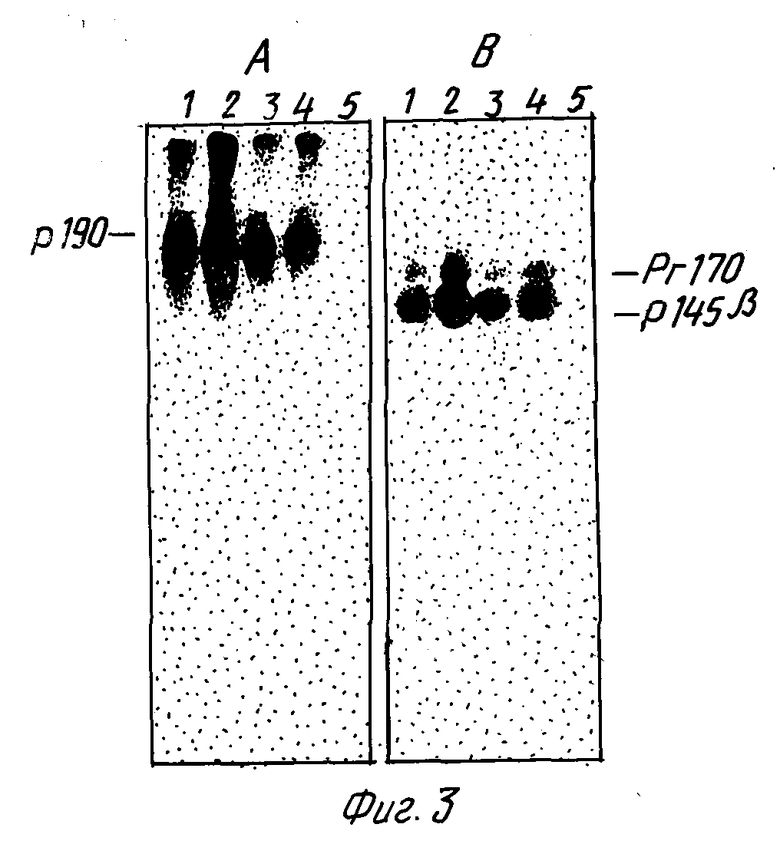
На фиг. 3 показано, что 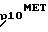 не фосфорилируется in vitro. Белки из GTL-16 клеток, солюбилизированные в неионном детергенте, иммунопреципитировались моноклональными антителами к экстраклеточному домену Met-белка (DL-21, DO-24, DN-30, DN-31, дорожки 1, 2, 3, 4) или моноклональными антителами к неродственному белку (дорожка 5). Промытые иммунокомплексы фосфорилировались в присутствии [γ-32p] ATP и меченые белки разделялись в SDS-ПААГ в условиях, препятствующих восстановлению дисульфидных связей (снимок A), или в условиях восстановления этих связей (в присутствии 2β-меркаптоэтанола, снимок B). Гели высушивались и экспонировались в течение 2 дней для получения авторадиограммы. Видно, что метятся только интактный p90MET или интактная цепь p145β и Pr 170 Met-предшественник.
не фосфорилируется in vitro. Белки из GTL-16 клеток, солюбилизированные в неионном детергенте, иммунопреципитировались моноклональными антителами к экстраклеточному домену Met-белка (DL-21, DO-24, DN-30, DN-31, дорожки 1, 2, 3, 4) или моноклональными антителами к неродственному белку (дорожка 5). Промытые иммунокомплексы фосфорилировались в присутствии [γ-32p] ATP и меченые белки разделялись в SDS-ПААГ в условиях, препятствующих восстановлению дисульфидных связей (снимок A), или в условиях восстановления этих связей (в присутствии 2β-меркаптоэтанола, снимок B). Гели высушивались и экспонировались в течение 2 дней для получения авторадиограммы. Видно, что метятся только интактный p90MET или интактная цепь p145β и Pr 170 Met-предшественник.
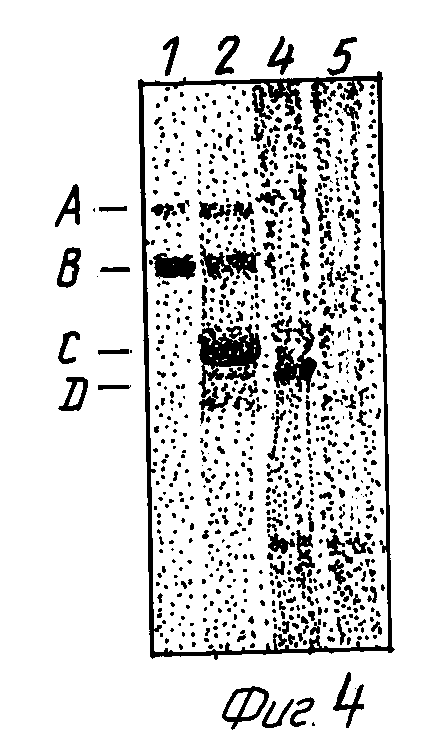
На фиг. 4 показано, что мышиные фибробласты, трансфецированные MET кДНК человека, экспрессируют интактный p190MET, а также укороченные формы. Белки из NIH 3T3 клеток (дорожки 1, 2) или из их кондиционной среды /дорожки 3, 4/, полученные после транскрипции этих клеток полноразмерной кДНК MET, синтезированной на матрице доминантной мРНК размером 9 т.п.н, (тысяч пар нуклеотидов), солюбилизировались кипячением в буфере Laemmli и анализировались методом Вестерн блот-гибридизации в восстанавливающих условиях. Дорожки: 1 и 4, получены с использованием моноклональных антител к C-концевому пептиду Met-белка; 2 и 3 - с моноклональными антителами (DO-24) к Met-экстраклеточному домену. Специфическое связывание детектировалось с помощью усиливающей хемилюминесцентной системы ECLTM, Amersham). Полосы имеют размеры, соответствующие 170 кД Met-предшественниоку (A), интактному p145β (B), укороченному p85β (C) и растворимому p75β (D).
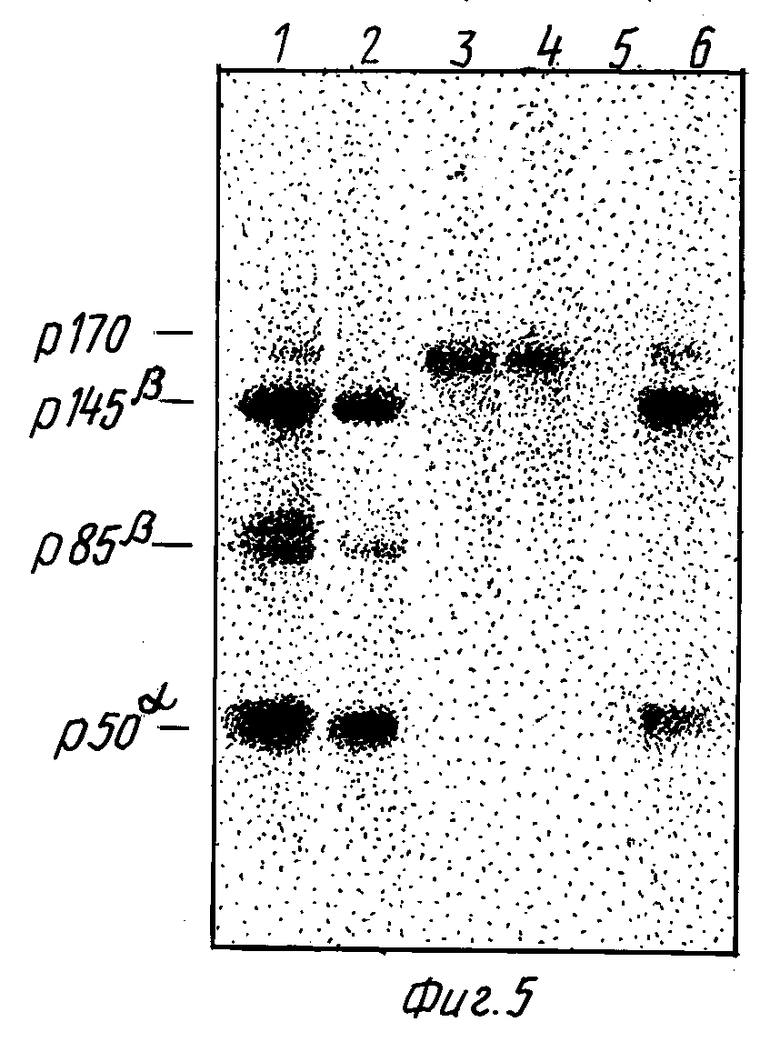
На фиг. 5 показана неравномерная клеточная локализация p190MET и p140MET. Клетки GTL-16 метились [3H] глюкозамином в течение 18 часов. Живые клетки инкубировались 2 часа на льду с моноклональными антителами, а затем лизировались детергентом (дорожки 1, 3 и 5). Или альтернативно клетки вначале лизировались, а затем инкубировались с моноклональными антителами (дорожки 2, 4 и 6). В обоих случаях иммунокомплексы выделялись на колонке белок A-сефароза, и радиомеченные белки анализировались в SDS-ПААГ в восстанавливающих условиях. Использовались следующие антитела: моноклональные антитела, направленные к экстраклеточному домену (DO-24, дорожки 1 и 2) или к C-концевому пептиду Met-белка (DR-6, дорожки 5 и 6), и моноклональные антитела к экстраклеточному домену рецептора для EGF ( дорожки 3 и 4). Гели высушивались и экспонировались в течение 4 дней для получения радиоавтографа.
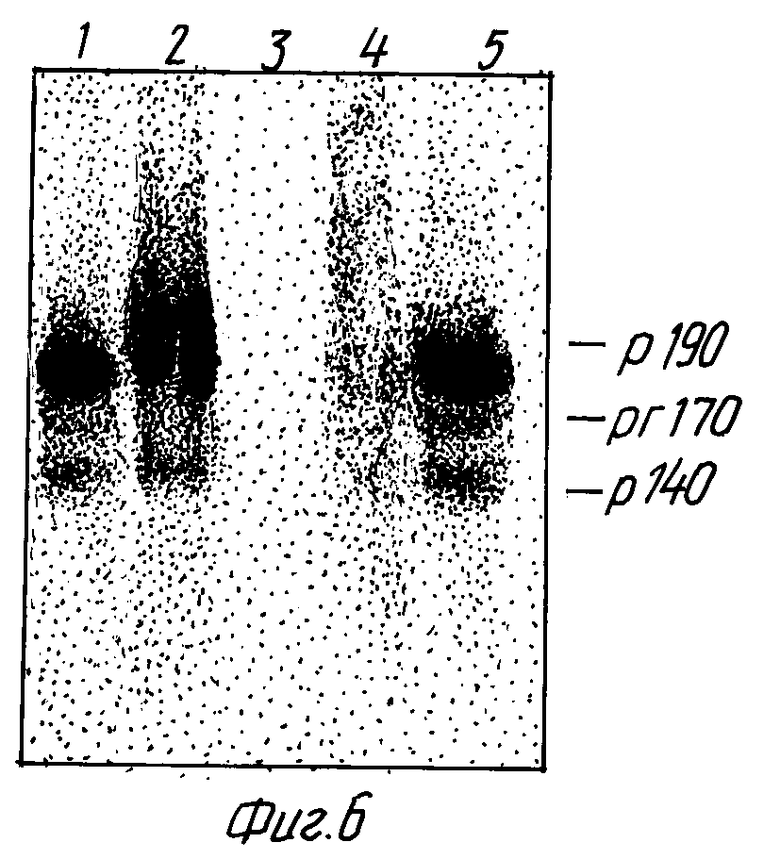
На фиг. 6 показана экспрессия p140MET в различных клеточных линиях человека при физиологических условиях (Вестерн блот). Клеточные белки солюбилизировались в кипящем буфере Laemmli, разделялись в SDS-ПААГ при невосстанавливающих условиях, переносились на нитроцеллюлозный фильтр и последовательно обрабатывались моноклональными антителами DL-21 и [1251] - овечьими α-мышиными Ig. На каждую дорожку наносили 300 мкг клеточного белка; на дорожку GTL-16 нанесено 100 мкг. Использовались следующие клеточные линии: дорожка 1-A549, карцинома легких; дорожка 2: GTL-16, карцинома желудка, дорожка 3: SK-BR3, карцинома молочной железы, дорожка 4: HT-29, карцинома толстой кишки, дорожка 5: KB, стоматологическая карцинома.
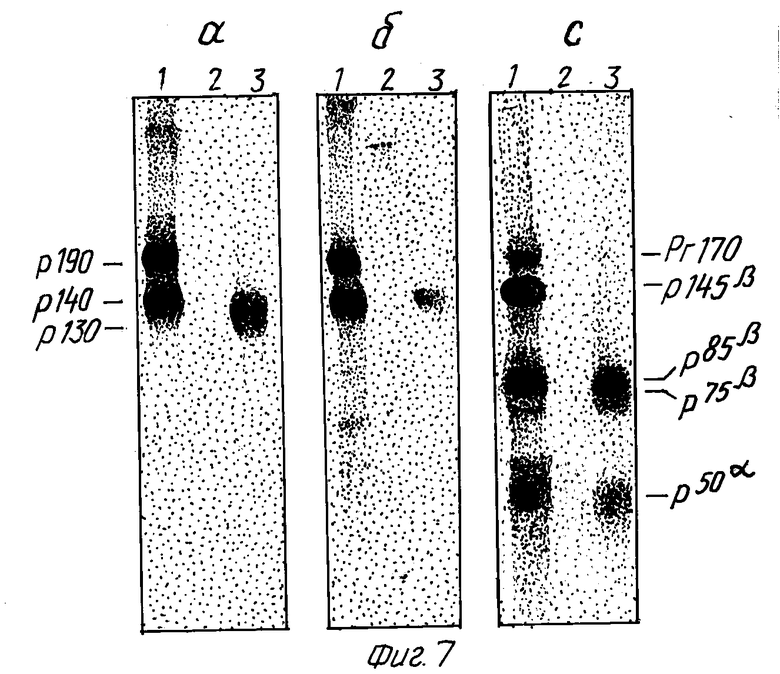
На фиг. 7 показано, что растворимая укороченная форма Met-белка идентифицируется моноклональными антителами к экстраклеточному домену. GTL-16 (снимки A, C) или A549 клетки (снимок B) метились [35S] метионином в течение ночи (100 мкКи/мл), промывались и экстрагировались детергентом. Осветленные клеточные экстракты (дорожка 1) и кондиционная среда (дорожки 2 и 3) осаждались моноклональными антителами к экстраклеточному домену (DO-24, дорожки 1 и 3) или к C-концевому пептиду (DR-6, дорожка 2) Met-белка. Иммунопреципитировавшие белки разделялись в SDS-ПААГ при невосстанавливающих условиях (снимки A, B) или после восстановительной обработки 2β-меркаптоэтанолом (снимок C). Гели флюорографировались, высушивались и экспонировались в течение 3 дней для получения радиоавтографа.
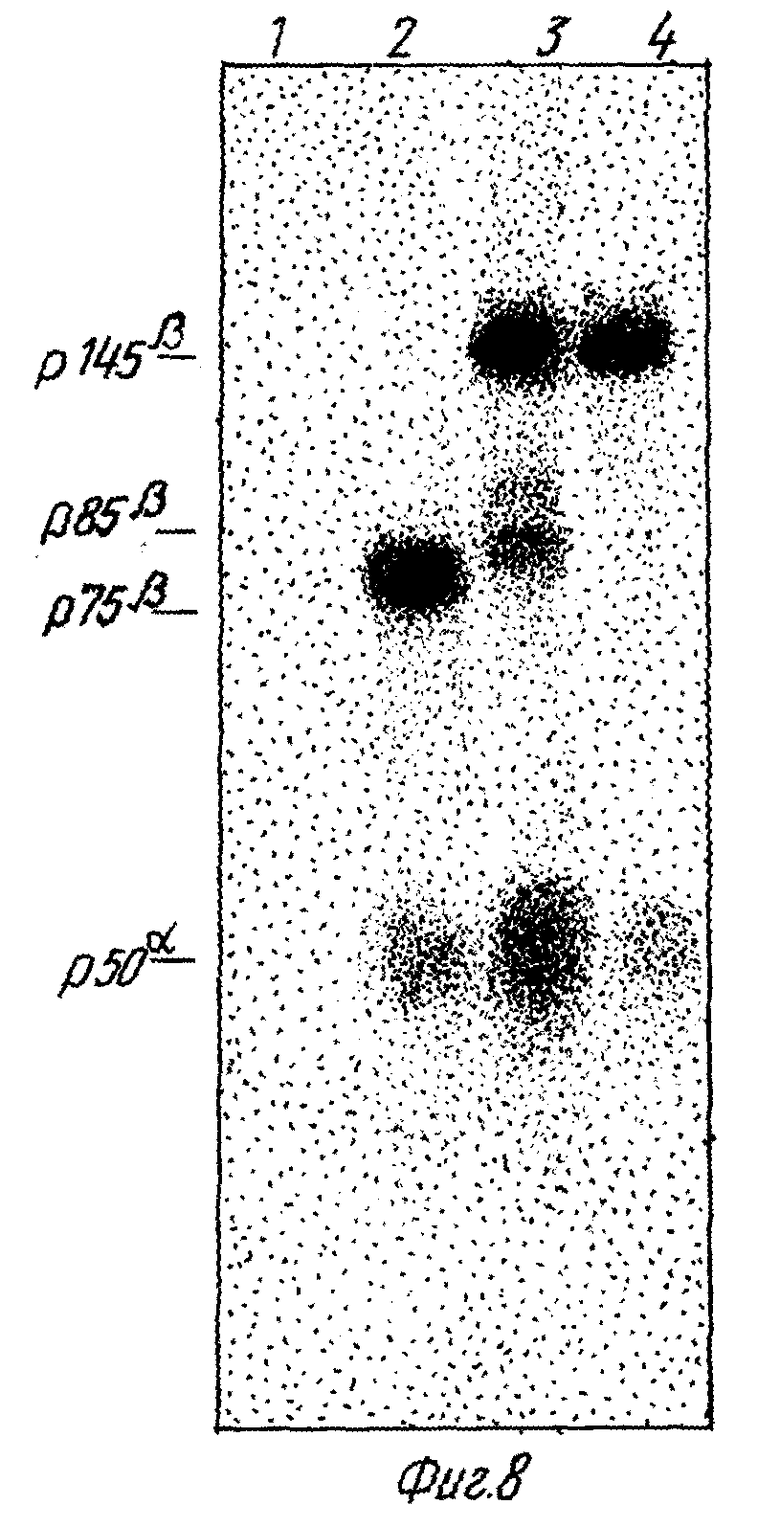
На фиг. 8 показано, что растворимый p130MET генерируется при протеолизе Met-белков, экспонированных на поверхности клетки. Клетки GTL-16 поверхностно метились 125I в присутствии лактопероксидазы. После инкубации в течение 4 часов меченые белки выделялись либо из культуральных супернатантов (дорожки 1 и 2), либо из клеточных экстрактов (дорожки 3 и 4) и иммунопреципитировались моноклональными антителами, направленными к экстраклеточному домену (DO-24, дорожки 2 и 3) или к C-концевому пептиду (DR-6, дорожки 1 и 4) Met-белка. Иммунопреципитировавшие белки разделялись в SDS - ПААГ при восстанавливающих условиях. Гели высушивались и экспонировались в течение 18 часов для получения авторадиограммы.
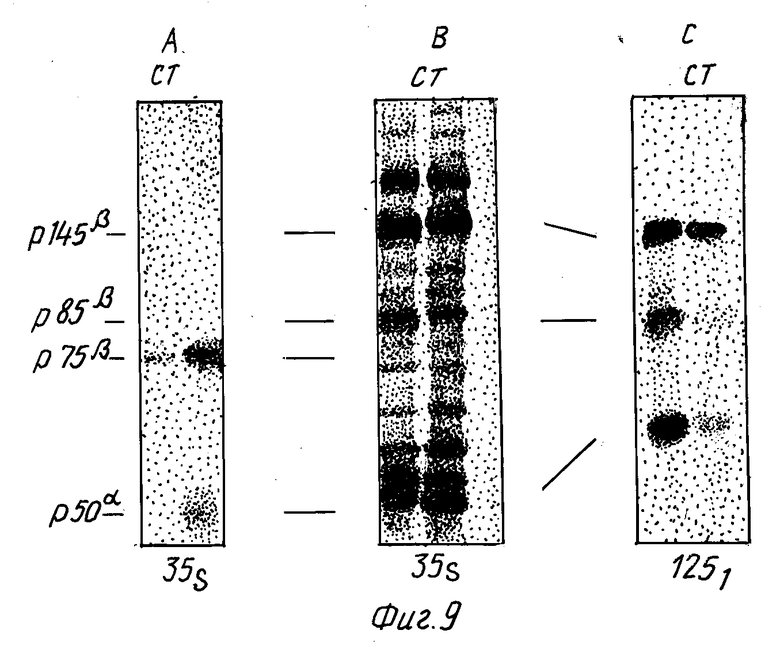
На фиг. 9 показана стимуляция освобождения p130MET с поверхности клетки при активации протеинкиназы C. Клетки GTL-16 метились в течение ночи [35S] метионином (100 мкКи/мл, обрабатывались в течение 2 часов 160 нМ ТРА, растворенной в диметилсульфоксиде (дорожка T), или одним диметилсульфоксидом (дорожка C), промывались и экстрагировались неионным детергентом. Кондиционированная среда (A) и осветленные клеточные экстракты B освобождались моноклональными антителами, направленными к Met-экстраклеточному домену (DO-24). Иммунокомплексы собирались на колонке белок- A-стефароза и анализировались в SDS-ПААГ в восстановительных условиях. Гели флюорографировались, высушивались и экспонировались в течение 6 часов для получения авторадиограммы. Снимок C: клетки GTL-16 обрабатывались TPA (дорожка T) или диметилсульфоксидом (дорожка C), как описано выше, метились 125I с помощью лактопероксидазы, промывались и экстрагировались неионным детергентом. Осветленные клеточные экстракты подвергались иммунопреципитации моноклональными антителами DO-24, и иммунокомплексы анализировались, как описано выше.
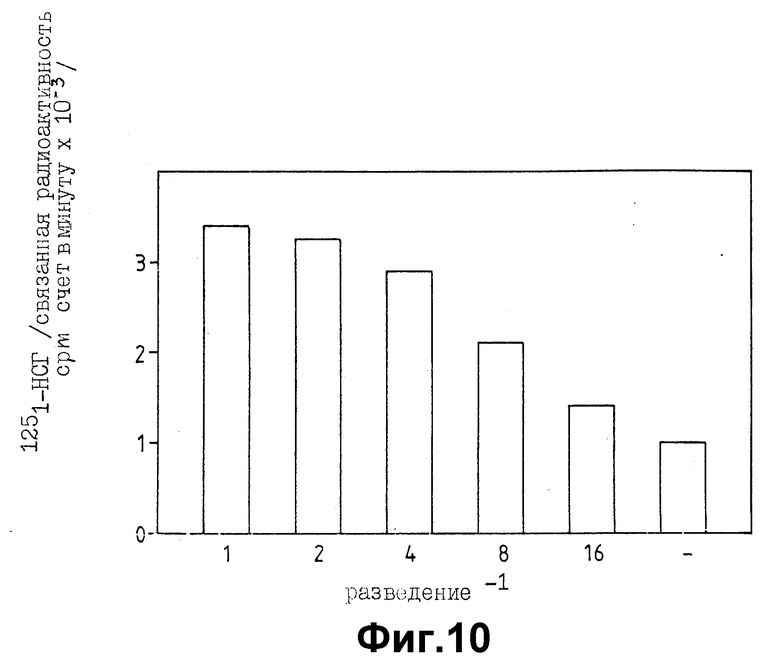
На фиг. 10 показано связывание 125I-HGF растворимым p130MET PVC микротитраторные ячейки покрывались моноклональными антителами DN-30, направленными к экстраклеточному домену Met-белка, и использовались в качестве ловушки для различных концентраций p130MET или кондиционной среды, лишенной p130Met (-). 125I-HGF затем добавлялся, как описано в примере 2 в разделе "Материалы и методы". Платы инкубировались в течение ночи при 4oC, промывались 3 раза и связавшаяся радиоактивность элюировалась 1% SDS и измерялась в γ-счетчике.
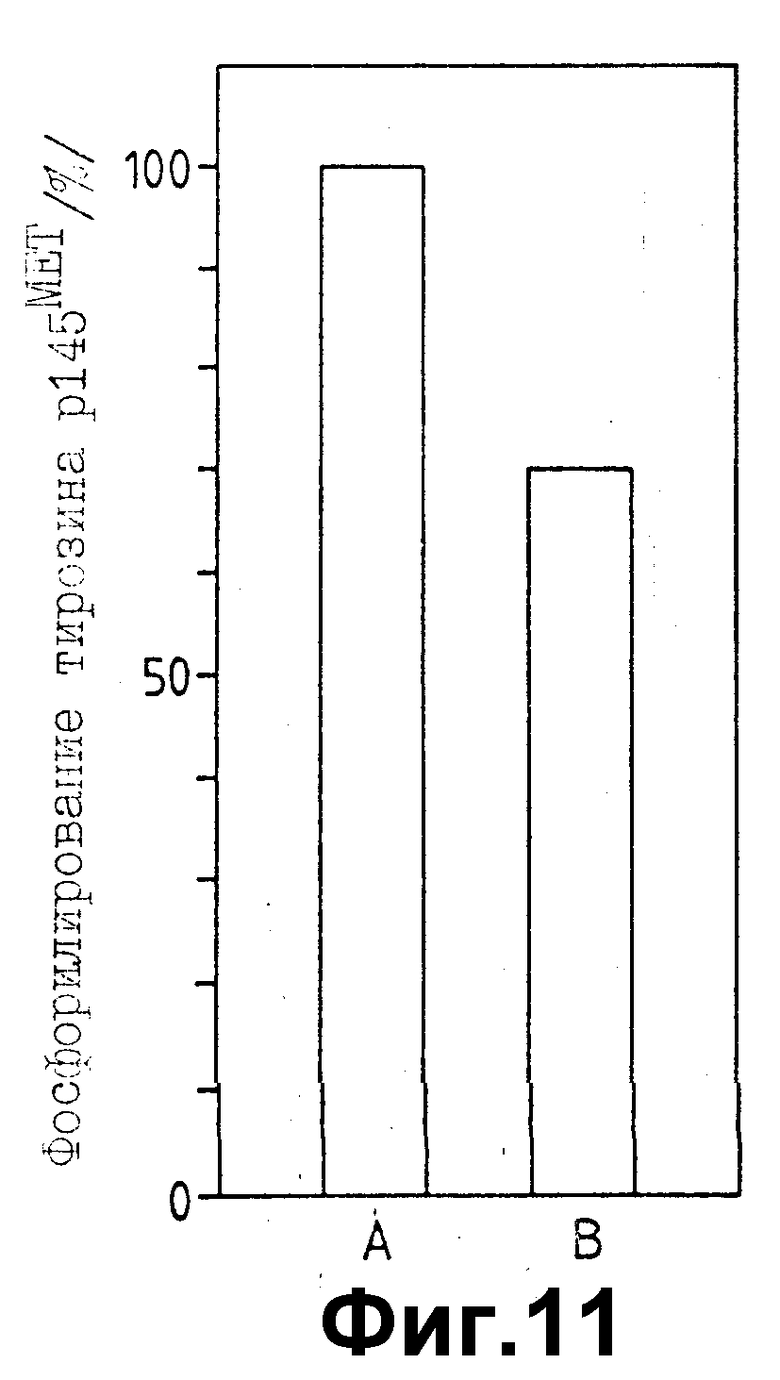
На фиг. 11 показано ингибирование фосфорилирования тирозина HGF рецептора ( p145β субъединицы) растворимым p130MET. Клетки GTL-16 инкубировались с p130MET, частично очищенным с помощью аффинной хроматографии на Лентил Лектине, как описано в примере 22 раздела "Материалы и методы". Относительное количество фосфотирозина, представленного в p145β, оценивалось измерением оптической плотности соответствующей поломы, наблюдаемой на радиограммах Вестерн блотов, проявляемых P-Tyr антителами. На чертеже приведены значения, полученные в одном из типичных экспериментов. A: значения получены с клетками, инкубировавшимися с кондиционной средой, лишенной p130MET; B: клетки, инкубировавшиеся с p130MET, очищенным на Лектил Лектине.
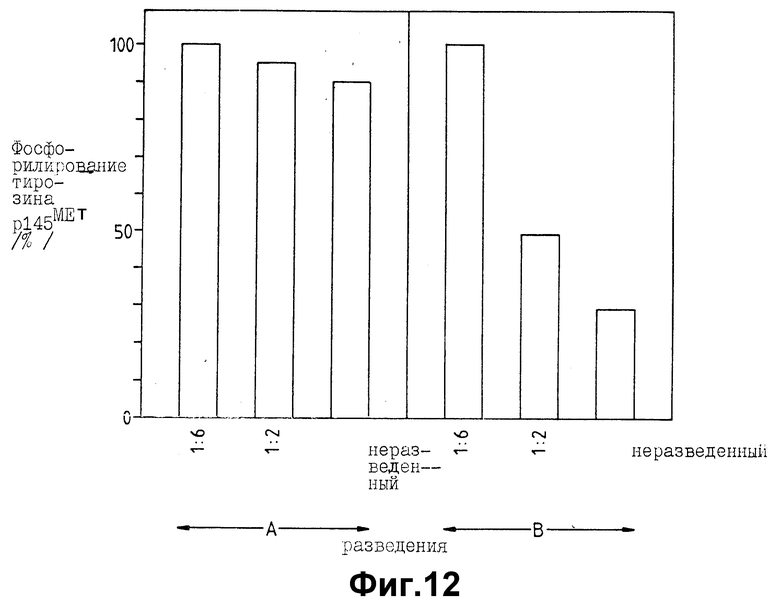
На фиг. 12 показано ингибирование in vitro тирозинкиназной активности Met (HGF рецептора) p145β субъединицы растворимым p130MET. Рецептор осаждался поликлональной анти-Met-сывороткой и инкубировался в течение 5 мин при комнатной температуре с 60 мкл различных разведений кондиционной среды, истощенной по белку p130MET (A), или частично очищенного белка p130MET (B). Киназная реакция проводилась на льду в течение 2 мин в присутствии 10 мкм [γ-32p] ATP и 5 мМ MgCl2. После электрофореза в SDS - ПААГ и авторадиографии киназная активность оценивалась по измерению оптической плотности 32P-меченой полосы на лазерном денситометре. На схеме приведены значения, полученные в типичном эксперименте.
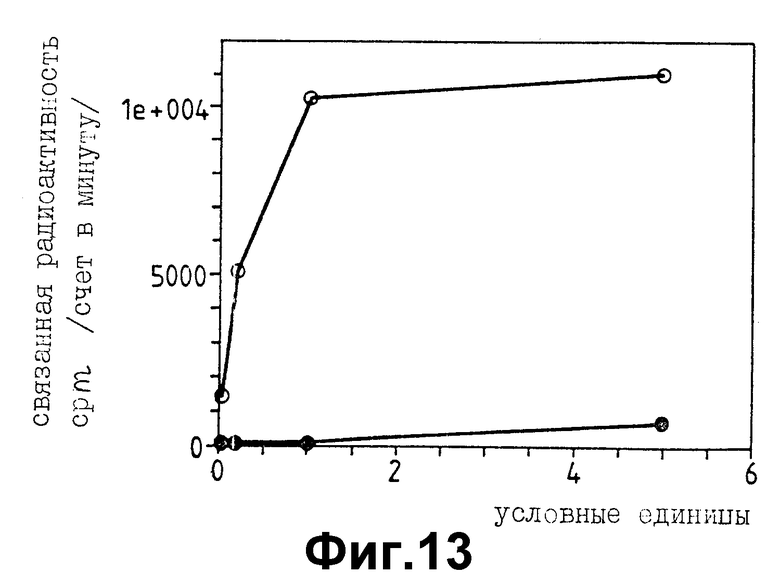
Фиг. 13 иллюстрирует радиоиммунометрическое определение растворимого p130 Met, освобождаемого из клеток GTL-16 в культуральной среду ткани. Белыми кружками обозначены результаты, полученные с использованием супернатанта клеток GNL - 16, черными - RPMI среды (отрицательный контроль).
Пример 1. Материалы и методы.
Клетки.
Все использованные в работе линии представляют собой линии клеток человека. Клетки GTL - 16 - клональная линия, полученная из слабо дифференцированной карциномы желудка (Giordano et al., Bol. Cell. Biol. 8, 3510-3517, 1988). A549 клетки аденокарциномы легких, KB клетки стоматической карциномы, HT-29 клетки карциномы толстой кишки и SK-BP-3 клетки карциномы молочной железы получены из Американской коллекции типовых культур. Клетки выращивались в среде RPMI-1640 с добавлением 10% фетальной сыворотки теленка (Flow Laboratories, Inc. McLean, Va) в атмосфере водяных паров, насыщенных 5% CO2.
Антитела.
Моноклональные антитела к экстраклеточному домену Met-белка получены после иммунизации целых живых GTL-16 клеток, суперэкспрессирующих Met-белок, по методу Kohler и Milstein (Nature 256, 495-497, 1975).
Иммунные клетки селезенки сливали с Ag 8.653 клетками миеломы и гибридные супернатанты отбирали методом иммуноферментного анализа по их отличительной способности к связыванию с GTL - 16 клетками /Prat et al, Cancer Detection, and Prevention, 10, 293-301, 1987). Гибридные супернатанты отбирали по их способности к избирательному связыванию с клетками, суперэкспрессирующими Met-белок, методом твердофазного иммуноферментного анализа (Prat et al, 1985).
Для экспериментов по иммунопреципитации клетки метились в течение 18 часов 35S - метионином, интенсивно промывались и лизировались неионным детергентом Тритоном X100, как ранее описано (Prat et al, Cancer Research, 45, 5799-5807, 1985). Образцы анализировались в 8% SDS - ПААГ и авторадиографировались в течение 1 дня при -70oC с использованием сверхчувствительной рентгенопленки фирмы (Hyper - film) Amersham. Для этих исследований были выбраны четыре различных типа моноклональных антител (DL-21, DN-30, DN-31, DO-24). Эти моноклональные антитела взаимодействуют с различными эпитопами β- цепи на основании реципрокной (взаимной) перекрестной конкуренции. Так как с различными моноклональными антителами были получены одинаковые результаты, мы будем говорить об этой панели, как Mabs анти-экстраклеточного домена. Моноклональные антитела (DR-6) были также получены к пептиду, соответствующему девятнадцати C - концевым аминокислотами (от Ser1372 до Ser1390) последовательности гена MET (EMBL Data-Bank ссылка N X54559). Моноклональные антитела к экстраклеточному домену рецептора эпидермального фактора роста такие же, как описано Honegger et al, EMBO J. 7 (10), 3053-3060, 1988. Неродственные моноклональные антитела использовались в качестве отрицательного контроля.
Иодирование клеточной поверхности, метаболическое мечение и иммунопреципитация.
Радиоиодирование поверхности клеток, катализируемое лактопероксидазой и H2O2, проводилось, как ранее описано (Giordano et al, 1988). Для пульс-чейз экспериментов клетки предварительно обрабатывались средой, не содержащей метионин, в течение 30 мин, пульс-метились 400 мкКи/мл[35S]-метионина в течение 15 мин, дважды промывались полной средой и затем выращивались в течение различных периодов времени. Клетки метились 100 мкКи/мл либо [3H] -глюкозамина, либо [35S]-метионина в течение 18 часов. Все радиоактивные изотопы получены из фирмы Amersham (Amersham Corp., Arlington Heights, Ill). После мечения клетки экстрагировались охлажденным во льду буфером, содержащим 10 мМ Pipers pH 7,6, 100 мМ NaCl, 5 мМ MgCl2 300 мМ сахарозу, 5 мМ ЭДТА (DIM буфер), 1% тритона X100 и ингибиторы протеаз (пепстатин, 50 мкг/мл; леупептин, 500 мкг/мл; апротинин, 1 мкг/мл; 2 мМ PMSF, Sigma; соевый ингибитор трипсина, 500 мкг/мл, Boehringer). Ультрацентрифугированные культуральные супернатанты тканей или клеточные экстракты предварительно очищались на колонке белок-A-сефароза и иммунопреципитировались различными антителами. Иммунопреципитания молекул, экспонированных на поверхности клеток, проводилась инкубированием интактных GTL - 16 клеток с моноклональными антителами перед лизисом детергентом. Иммунокомплексы собирались на колонке белок-A-сефароза, предварительно обработанной аффинно очищенными козлиными анти-мышиными Ig антителами (GαMIg), промывались и элюировались в Laemmli буфере (Nature 230, 680-685, 1970) с или без 2β-меркаптоэтанола. Обработка тетрадеканоил форбол ацетатом /TPA/ проводилась на GTL - 16 клетках, меченых [35S] метионином в течение 18 часов. Клетки промывались свежей RPMI средой и далее инкубировались с диметилсульфоксидом, содержащим или несодержащим (контроль) 160 нМ TPA (Sigma), в течение 2 часов. Чтобы проанализировать действие TPA на Met - белки, экспонированные на поверхности клеток, GTL - 16 клетки обрабатывались TPA, как описано выше, и затем метились 125I с помощью лактопероксидазы. В обоих случаях клеточные белки, солюбилизированные детергентом, или супернананты преципитировались, как описано выше. Белки подвергались электрофорезу в SDS-ПААГ, фиксировались, флюорографировались, когда это было необходимо, высушивались и экспонировались для получения авторадиограммы на пленке Amersham Hyperfilm.
Анализ киназной активности иммунокомплексов.
Белки экстрагировались из GTL - 16 клеток в DIM буфере, 1% тритоне X-100 и преципитировались, как описано выше. Иммунокомплексы, собранные на белок A-сефароза - G α MIg, фосфорилировали в 20 мкл того же буфера в присутствии 2,5 мкКи/ [γ-32p] ATP (специфическая активность 7000 кл/Mm; Amersham) при 30oC в течение 5 мин. Реакцию останавливали добавлением 1 мл холодного физиологического раствора, приготовленного на фосфатном буфере, pH 7,2 содержащего 5 мМ ЭДТА. Образцы центрифугировали и элюировали кипящим буфером Laemmli с или без 2β-меркаптоэтанола. После электрофореза в SDS-ПААГ гели высушивались и экспонировались для получения авторадиограммы на пленке Amersham Hyperfilm с усиливающими экранами.
Пептидное картирование.
Met-β-цепи, полученные из поверхностно радиоиодированных GTL - 16 клеток, фракционировались с помощью электрофореза в SDS - ПААГ и электрофоретически переносились на Immobilonр мембраны (Millipore, Towbin et al, PNAS USA 76, 4350-4353, 1979).
Мембранные фрагменты, содержащие радиоактивные β-цепи, пропитывались 0,5% поливинилпирролидоном в 100 мМ уксусной кислоте при 37oC в течение 30 мин, кратко промывались водой и затем свежеприготовленным 0,05 М NH4HCO3. Триптическая обработка иммобилизованных белков проводилась 10 мкг ТРСК-обработанного трипсина (Worthington) в течение 16 часов при 37oC и затем еще 2 часа при 37oC с добавлением 10 мкг свежего фермента (Hunter et al, PNAS USA 77, 1311-1315, 1980). Гидролизаты наносились на целлюлозные тонкослойные пластинки /13255 Cellulose, Kodak), в угол, соответствующий аноду, и подвергались электрофорезу при pH 1,9 (2,5% муравьиная кислота, 7% ледяная уксусная кислота) на 1200 В. Пластинки затем подвергались восходящей хроматографии (н-бутанол: пиридин: уксусная кислота: вода, 20:30:6:24 (v/v) объем/объем/. Пептиды визуализировались авторадиографически на Amersham Hyperfilm с усиливающими экранами.
Вестерн блоттинг.
Клетки солюбилизировались кипячением в буфере Laemmli с или без восстанавливающего агента 2β-меркаптоэтанола. На каждую дорожку наносили равные количества белков (300 мкг). Образцы анализировали Вестерн блоттингом как описано Towbin et al, 1979. Блоты (зондировали) проявляли гибридомным супернатантом, содержащим DL - 21 моноклональные антитела, и затем 125I-меченым овечьим α- MIg (Amersham).
Авторадиограммы экспонировали с усиливающими экранами в течение 2-3 дней. В качестве маркеров использовали предварительно меченные [14C] метилированием (Amersham) миозин (200 кД), фосфорилазу (92,5 кД), бычий сывороточный альбумин (69 кД), яичный альбумин (43 кД) и карбоангидразу (30 кД).
Трансфекция кДНК МЕТ в NIH 3T3 клетки.
Экспрессия вектора, использованного для этих исследований, основана на том, что плазмида pMT2 содержит основной поздний аденовирусный промотор. Экспресионная плазмида была сконструирована с использованием фрагмента к ДНК размером 4,3 т.п.н., содержащего полную кодирующую последовательность гена MET (Giordano et al, 1989, Nature 339 155-156). Так как эта плазмида не содержит никакого селективного маркера, клетки подвергали котрансфекции с плазмидой p SV2 neo, несущей ген устойчивости к неомицину. Плазмида была котрансфецирована в NIH 3T3 клетки методом липофекции. Через два дня после трансфекции к культуральной среде добавляли аналог неомицина G418 для того, чтобы отобрать устойчивые клоны. Стабильные трансфектанты, экспрессирующие Met - рецепторы, идентифицировали по способности к синтезу Met - рецепторов с помощью Вестерн блот-анализа.
Результаты.
Укороченный p140MET сосуществует вместе с p190MET на поверхности клетки.
Белки, экспонированные на поверхности GTL - 16 клеток, метились 125I с помощью лактопероксидазы. Клетки экстрагировались 1% тритоном и солюбилизированные молекулы преципитировались моноклональными антителами к С-концевому пептиду Met-белка или моноклональными антителами, распознающими различные эпитопы экстраклеточного домена. Иммунопреципитаты анализировались в SDS-ПААГ при невосстановительных и восстановительных условиях. Антитела к C-концевому пептиду преципитировали p190MET гетеродимер (фиг. 1A, дорожка 1), который при восстановлении распадался на p50α и p145β цепи, (фиг. 1B, дорожка 1). Моноклональные антитела к экстраклеточному домену преципитировали вместе с p190MET другие молекулы, мигрирующие с кажущимся молекулярным весом 140 кД (p140MET, фиг. 1A, дорожки 2 - 4). Эти иммунопреципитаты в условиях восстановления распадались на три цепи соответственно 145, 85 и 50 кД (фиг. 1B, дорожки 2 - 4), предполагая, что p140MET представляет собой гетеродимер, состоящий из p85 и p50. Результаты эксперимента, приведенного на фиг. 1C, подтверждают эту интерпретацию гетеродимерной структуры p140MET. Полоса 140 кД, вырезанная из геля, приведенного на снимке A, при повторном форезе в условиях восстановления порождала p85 и p50 (фиг. 1C, дорожка 1). Последний комигрировал с p50α, диссоциированным из комплекса p190MET αβ (фиг. 1C, дорожка 2). Отношение p190MET к p140MET варьировало от 1:1 до 2:1. Аналогичные результаты были получены при исследовании поверхностно иодированных белков из других клеточных линий.
Бидвумерные триптические карты поверхностно иодированных цепей p145β и p85β показывают, что экстраклеточные домены интактной и укороченных цепей Met-белка содержат идентичные пептиды (фиг. 2A, 2B). На основании полученных результатов сделан вывод, что p140MET представляет собой гетеродимер, состоящий из p50β и β-цепи 85 кД (p85β), образующийся из p145β при отсечении C-конца.
Укороченный p140MET не фосфорилируется по тирозину.
С помощью антител, специфичных к C-концевому пептиду p190MET, ранее было показано, что этот белок может быть фосфорилирован in vitro по β-субъединице (Giordano et al, Mol. Cell. Biol. 8, 3510-3517, 1988). Инкубирование иммунопреципитатов, полученных с четырьмя моноклональными антителами, направленными к Met-экстраклеточному домену, в присутствии [γ-32p] АТР приводит к мечению p190MET, но p140MET при этом не метится (фиг. 3A). При восстанавливающих условиях метился только p145β (фиг. 3B). Кроме того, p140MET никогда не проявлялся анти-фосфотирозин антителами в Вестерн блотах GTL-16 белков, тогда как p190MET всегда мог быть визуализирован (Giordano et al, 1988). Эти данные предполагают, что укороченная форма Met-белка лишена тирозиновых остатков, по которым может идти фосфорилирование in vitro или in vivo.
Укороченные p140MET и p130MET возникают при процессировании p190MET.
p140MET может возникать либо при трансляции альтернативно сплайсированной с мРНК, кодирующей только экстраклеточный и трансмембранный домены Met-белка, либо в результате пост-трансляционного процессинга интактной молекулы. Действительно, в GTL-16 клетках обнаружено четыре различных MET транскрипта (Giordano et al, Nature 339, 155-156, 1989; Park et al, Cell 45, 895-907, 1986), но все они имеют область, кодирующую цитоплазматический домен.
Чтобы исследовать происхождение Met-белка с отсеченным C-концом, NIH 3T3 клетки котрансфецировали полноразмерной кДНК MET человека и p SV2 neo. Стабильные трансформанты отбирали с G418 и анализировали по способности к Met-экспрессии. С помощью Нозерна (РНК) блот-анализа положительных клеток обнаружена единственная мРНК ожидаемого размера (приблизительно 4,3 т.п.н.). Клетки солюбилизировали в кипящем буфере Laemmli, и белки исследовали в условиях восстановления методом Вестерн блок-анализа. С помощью антител к C-концевому пептиду Met обнаружен Met-предшественник размером 170 кД и цепь p145β (фиг. 4, дорожка 1). Кроме того, при проявлении антителами, направленными к экстраклеточному домену Met, обнаружена молекула с антигенными свойствами и молекулярным весом, соответствующими усеченной форме p85β (фиг. 4, дорожка 2). Более того, в супернатантах трансфецированных клеток этими антителами выявлена молекула, сопоставимая с растворимым p75β (фиг. 4, дорожка 3). В трансфецированных NIH 3T3 клетках отношение укороченных Met-β-цепей к интактной было выше, чем в клетках человека. Эти данные свидетельствуют о том, что укороченные формы Met возникают при трансляции полноразмерного транскрипта.
Неравномерное клеточное распределение p190MET и p140MET
Чтобы оценить относительные количества p190MET и p140MET в целой клетке и на поверхности клетки, клетки GTL-16 метились [3H]-глюкозамином. Так как гликозилирование затрагивает только общий экстраклеточный домен, два молекулярных вида должны метиться этим изотопом с равной эффективностью. Была проведена избирательная иммунопреципитация молекул, экспонированных на поверхности клеток (см. раздел "Методы"). Количество осаждаемых таким образом белков было сравнимо с количеством белков, иммунопреципитировавших из целого клеточного экстракта. Фиг. 5 показывает, что на поверхности клеток отношение p145β к 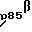 составляет приблизительно 2:1 (фиг. 5, дорожка 1). Напротив, в целом клеточном экстракте p85β составлял не более чем 1/10 от p145β (фиг. 5, дорожка 2). Анти-C-концевые моноклональные антитела осаждали p145 только из клеточных экстрактов (фиг. 5, дорожки 5 и 6). Таким образом, можно считать, что укороченная форма Met преимущественно локализована на поверхности клетки.
составляет приблизительно 2:1 (фиг. 5, дорожка 1). Напротив, в целом клеточном экстракте p85β составлял не более чем 1/10 от p145β (фиг. 5, дорожка 2). Анти-C-концевые моноклональные антитела осаждали p145 только из клеточных экстрактов (фиг. 5, дорожки 5 и 6). Таким образом, можно считать, что укороченная форма Met преимущественно локализована на поверхности клетки.
Так как для осаждения Met-белков, находящихся на поверхности клеток или в целых клеточных экстрактах, использовался один и тот же метод лизиса, этот эксперимент свидетельствует также о том, что потенциальная протеолитическая активность, индуцируемая детергентом, не играет значительной роли в генерировании образования белка p85β
p140MET не является результатом экспериментально индуцированного протеолиза.
Протеолитическое расщепление p190MET могло быть индуцировано при активации эндогенных протеаз во время экстрикции клеток. В качестве внутреннего контроля пост-литического протеолиза мы использовали антитела, специфичные к экстраклеточному домену, способные иммунопреципитировать рецептор эпидермального фактора роста. Этот рецептор экспрессируется в клетках GTL-16 и, как известно, чувствителен к протеолизу (Basu et al, Nature 311, 477 - 480, 1984). Фиг. 5 показывает, что при тех условиях, в которых наблюдается укороченная форма p140MET, осаждаются только интактные молекулы EGF рецептора 175 кД, как из целых клеточных лизатов, так и из лизатов белков, находящихся на поверхности клеток.
Чтобы окончательно исключить возможность возникновения укороченной формы Met-белка в результате протеолитической деградации, индуцированной в процессе экстракции или иммунопреципитации, присутствие этой формы анализировали непосредственно в Вестерн блотах различных линий клеток человека. В этих экспериментах живые клетки солюбилизировались кипящим буфером Laemmli, что приводило к блокированию протеазной активности. Тотальные белки разделялись в SDS-ПААГ при условиях, не приводящих к восстановлению дисульфидных групп, и проявлялись моноклональными антителами, направленными к экстраклеточному домену. В четырех клеточных линиях карциномы, экспрессирующих ген MET, наблюдались обе формы p190MET и p140MET (фиг. 6). Эти данные предполагают, что укороченная форма Met-белка присутствует в живых клетках при физиологических условиях.
Укороченный растворимый белок p130MET освобождается в культуральную среду.
Клетки GTL-16 метаболически метились 35S-метионином и кондиционная среда, осветленная ультрацентрифугированием, осаждалась моноклональными антителами к экстраклеточному домену и анализировалась в SDS-ПААГ. При невосстанавливающих условиях наблюдались молекулы с кажущимся мол. весом 130 кД (p130MET) (фиг. 7A, дорожка 3). При восстановлении эта молекула распадалась на две субъединицы 50 кД (p50) и 75 кД (p75), соответственно (фиг. 7c, дорожка 3). Моноклональные антитела к C-концевому пептиду Met не осаждали из той же среды никаких белков (фиг. 7A и 7C, дорожка 2). Аналогичные результаты были получены с супернатантом, собранным из линии клеток легочной карциномы A549 /фиг. 7B, дорожка 3/.
Для цепи p75β также были созданы карты триптических пептидов. В качестве начального материала для этих экспериментов использовали иммунопреципитаты p130MET, освобождаемого в культуральную среду из поверхностно радиоиодированных клеток. p75β элюировали из SDS-ПААГ гелей после электрофореза в условиях восстановления. На фиг. 3C показано, что меченые триптические пептиды были неотличимы от своих аналогов, полученных из p145β и p85β.
По оценкам киназного анализа иммуно-комплексов in vitro, p130MET лишен киназной активности. Эти данные показывают, что Met-форма, освобождаемая в культуральную среду, представляет собой αβ-комплекс, лишенный цитоплазматического и трансмембранного доменов p145β, и образование этой молекулы не ограничивается GTL-16 клетками.
p130MET образуется при протеолитическом процессе.
Чтобы доказать, что растворимый p130MET образуется из мембранно-связанных Met-белков, был выполнен следующий эксперимент. Клетки GTL-16, адсорбированные на платах культуры тканей, поверхностно метились 125I лактопероксидазным методом и культивировались еще 4 часа. Культуральная среда собиралась и иммунопреципитировалась моноклональными антителами к экстраклеточному домену. Иммунопреципитат при анализе в SDS-ПААГ в условиях восстановления давал p75β и p50β, ожидаемые субъединицы растворимого p130MET (фиг. 8, дорожка 2). Соответствующие клеточные экстракты, обработанные теми же самыми моноклональными антителами, давали p145β, p85β и p50α (фиг. 8, дорожка 3). Моноклональные антитела, направленные к Met-C-концевому пептиду, использовались в качестве контроля. Эти антитела не осаждали никаких белков из культуральной среды (фиг. 8, дорожка 1), а из клеточных экстрактов осаждали только интактные цепи p145β и p50α (фиг. 8, дорожка 4). Эти результаты свидетельствуют о том, что растворимый Met-белок освобождается в культуральную среду при протеолитическом расщеплении мембранно-связанных Met-белков.
Освобождение p130MET стимулируется обработкой ТРА.
Чтобы исследовать, может ли освобождение p130MET модулироваться в живых клетках, протеинкиназа C активировалась обработкой ТРА. Клетки GTL-16, метаболически меченые [35S] метионином, стимулировались 160 нМ ТРА в течение 2 часов.
Клеточные экстракты и супернатанты затем собирались, ультрацентрифугировались и осаждались моноклональными антителами к Met-экстраклеточному домену. Иммунопреципитаты анализировались электорофорезом в SDS-ПААГ в условиях восстановления. После обработки TPA количество p75β, обнаруженное в супернатанте культуры тканей, заметно возросло по сравнению с контролем (фиг. 9A). Количество тотальных клеточных белков p145β и p85β, по-видимому, не изменялось (фиг. 9B). Чтобы проанализировать влияние TPA на Met-белки, экспонированные на поверхности клетки, клетки GTL - 16 обрабатывались TPA и затем метились 125I с помощью лактопероксидазы и иммунопреципитировались. Когда учитывались только поверхностно меченные Met-белки, количество p85β значительно снижалось после обработки TPA. p145β менее подвергался влиянию TPA, чем p85β (фиг. 9C). Таким образом, был сделан вывод, что активация протеинкиназы C ускоряет освобождение экстраклеточного p130MET посредством стимулирования протеолитического процессинга мембранно-связанных p140MET и p190MET форм.
Пример 2. Материалы и методы.
Реагенты.
[γ-32p] ATP (специфическая активность: 7000 Ku mmol-1) и [125I] белок A были получены из фирм Amersham. 125I-HGF был приготовлен, как описано Naldini et al, (1991, EMBO J., 10, 2867-2878/. Кратко метод состоит в следующем: очищенный HGF /1 мкг/ радиометился с носителем свободного Na125I (2 мКи) и иодогеном (Pierce). 200 мкмл иодогена из раствора 100 мкг/мл в хлороформе высушивались в полипропиленовой пропирке в струе азота. Затем добавлялись HGF и 125I в 0,525 M фосфатном буфере, pH 7,4. Реакция оставлялась на 15 минут при 4oC, а затем смесь переносилась в другой виал и оставлялась на льду в течение 10 минут. Носитель BSA добавлялся до конечной концентрации 0,1% в 0,4 M NaCl, 0,1% CHAPS, 20 мМ PO4 буфере, pH 7,4 и меченый лиганд отделялся от свободного Na125I с помощью аффинной хроматографии на колонке гепарин-сефароза (Pierce) объемом 1 мл, предварительно уравновешенной тем же буфером. После интенсивного промывания колонки проводилась элюция 1,3 М NaCl в том же буфере и собирались фракции по 0,5 мл. Фракции, содержащие TCA (TXY) - осаждаемую радиоактивность объединялись и концентрировались на Centrisart (Sartorius) диафильтрационном аппарате с мембраной, не пропускающей белки размером выше 20 кД, и хранились при 4oC. Специфическая активность меченого атома составляла приблизительно 8 • 107 CPM /мкг/ 5700 Kи /ммоль/, что соответствует молярному отношению I/HGF приблизительно 3/1. Таким образом, препарат не содержал значительного количества немеченных молекул.
В работе использовали Лентил лектин сефарозу и сефарозу-белок A фирмы Pharmacia, тритон X-100 фирмы Fluka.
Клетки.
В работе использовали линию клеток GTL - 16, описанных в примере 1. Клетки культивировались в (Flow) среде RPML 1640, содержащей 10% фетальной бычьей сыворотки /Flow (Laboratories, Netherlands) и сохранялись при 37oC в увлажненной атмосфере с 5% CO2.
Антитела.
Фосфотирозиновые антитела были индуцированы к п-амино-бензол-фосфонату и аффинно очищены, как описано ранее (Comoglio ei al., 1984, EMBO J., 3, 483-489). Поликлональная анти-Met сыворотка вырабатывалась у кроликов, иммунизированных синтетическим пептидом VDTRPASFWETS, соответствующим аминокислотной последовательности C-конца, предсказанной на основании последовательности гена MET. Моноклональные антитела DN-30, DN-31 и DO-24 к экстраклеточному домену Met белка были получены из мышей после иммунизации их целыми живыми клетками GTL - 16.
Моноклональными антителами очищались из асцитов осаждением сульфатом аммония и аффинной хроматографией на колонке белок A - сефароза 4B (Pharmacia, Uppsala, Sweden). Очищенные моноклональные антитела DO-24 метились 125I с использованием хлорамина T со специфической активностью 2-4 mKu /мг белка.
Частичная очистка p130MET.
Освобожденная от сыворотки кондиционная среда собиралась от GTL - 16 кофлуэнтных культур ультрацентрифугировалась при 50000 g, концентрировалась десятикратно на аминовых фильтрах (100 K) (сток-раствор). Очистка проводилась с помощью аффинной хроматографии на лентил лектин сефарозе. После достижения аффинного взаимодействия, продолжающегося 2 часа при 4oC, колонка промывалась несколько раз средой RPMI, и гликопротеины элюировались RPMI, содержащей 0,2 M α-метил-D-маннозид (Fluka). После ночного диализа против RPMI из части материала, очищенного аффинной хроматографией, путем исчерпывающей адсорбции на моноклональных антителах DN-31, несолюбилизируемых на сефарозе-белок A, удалялся p130MET. Этот материал использовался в качестве отрицательного контроля. Раствор частично очищенного p130MET стандартизировался так, что концентрация белка составляла 0,4 O.D. единиц (280 нм). Гликопротеин хранился при -20oC.
Двудетерминантный иммуноанализ (DDIA).
96-луночные EL ISA платы (Titertek Immuno Assay-Plate, Flow Laboratories, Netherlands), покрытые моноклональными антителами DN-30 и насыщенные BSA, инкубировались в течение ночи при 4oC с различными концентрациями частично очищенного p130MET и радиомеченного HGF. В методе DDIA, разработанном для оценки количества p130MET, использовались два типа моноклональных антител, направленных к различным эпитопам экстраклеточного домена Met-белков. Очищенные моноклональные антитела DN-30 адсорбировались на 96-луночных ELISA платах, платы затем насыщались и добавлялись различные концентрации грубого супернатанта, собранного из культур клеток GTL - 16. Связывание обнаруживалось радиомечеными моноклональными антителами DO-24, используемыми в качестве меченого вещества. Платы затем интенсивно промывались и связанная радиоактивность элюировалась 1% кипящим SDS и просчитывалась в гамма-счетчике (Autogamma, Packard).
Иммунопреципитация и анализ автофосфорилирования in vitro.
Клетки GTL - 16 дважды промывались холодным PBS и лизировались в IM буфере (10 мМ Pipers, pH 6,8, 100 мМ NaCl; 5 мМ MgCl2, 300 мМ сахароза, 5 мМ ЭДТА) плюс 1% Тритон x-100 и смесь ингибиторов протеаз. Клеточные лизаты центрифугировались на 10000 об/мин при 4oC в течение 30 мин и инкубировались с анти-MET сывороткой, связанной с сефарозой-белок A. Связавшиеся белки промывались несколько раз DIM буфером и инкубировались 5 мин при комнатной температуре с 60 мкл различных разведений лентил лектин элюата GTL - 16 супернатанта, лишенного p130MET или содержащего p130MET. Киназная реакция проводилась на льду в течение 2 минут. 10 мкКи [γ-32p] ATP на образец разбавлялись немеченным ATP до конечной концентрации 100 мкмоль. Киназная реакция останавливалась добавлением 1 мл физиологического раствора на трисбуфере с 10 мМ ЭДТА мкмоль Na3OV4. После короткого центрифугирования белки элюировались в кипящем Laemmli; буфере и подвергались электрофорезу в 8% SDS - ПААГ с последующей авторадиографией в течение 12 часов при -80oC с усиливающимися экранами. Относительное количество фосфата, включенного в p145MET β-субъединицу, оценивалось измерением оптической плотности соответствующей авторадиографической полосы с помощью лазерного денситометра (Pharmacia LKB 2202 Ultroscan).
Вестерн блоттинг.
Клеточный монослой GTL - 16 клеток промывался дважды холодным физиологическим раствором на фосфатном буфере, и клетки солюбилизировались кипячением в буфере Laemmli (Laemmli, U. K., 1970, Nature 230, 680-685). Образцы выравнивались по концентрации белка 300 мкг/лунку, подвергались электрофорезу в 8% SDS - ПААГ и переносились на нитроцеллюлозные фильтры. Блоты проявлялись 10 мкг мл-1 очищенных P-Tyr антител, а затем 125I - меченым белком A, как детально описано (DI Renzo et al., 1986, Eur. J. Biochem. 158, 383-391). Фильтры подвергались авторадиографии в течение 24 часов при -70oC с использованием усиливающих экранов. Относительное количество фосфотирозина, включенного в p145MET β-субъединицу, оценивалось измерением оптической плотности соответствующей авторадиографической полосы с помощью лазерного денситометра.
Результаты. HGF связывается с p130MET.
Фиг. 10 показывает, что возрастающие количества растворимого укороченного p130MET, несолюбилизируемого на микротитраторных лунках, покрытых специфическими антителами, связывают HGF. Связывание насыщаемое и дозо-зависимое.
Ингибирование p130MET фосфорилирования тирозина Met/HGF рецептора in vivo.
Клетки GTL - 16 экспрессируют большое количество HGF рецептора, β-субъединица которого (p145) конститутивно фосфорилируется по тирозину in vivo. Это может быть подтверждено Вестерн блотом тотальных клеточных белков, солюбилизированных ионным детергентом, проанализированных в SDS-ПААГ и зондированных P-Tyr антителами (фиг. 11, A). Обработка этих клеток в течение 10 минут p130MET, очищенным на лентил лактине, индуцировала 30% снижение фосфорилирования тирозина HGF/SF рецептора (фиг. 11, B).
Ингибирование p130MET тирозинкиназной активности Met/HGF рецептора in vitro.
HGF-рецептор иммунопреципитировался из GTL-16 клеток антисывороткой, направленной к синтетическому пептиду, выведенному из C-концевой последовательности белка. Инкубирование иммунных комплексов с p130MET перед киназным анализом приводило к дозозависимому ингибированию автофосфорилирования интактной субъединицы рецептора (p145MET; фиг. 12, B). С теми же концентрациями лентил-лектин элюатов, лишенных p130MET, наблюдался только слабый ингибиторный эффект (фиг. 12, A).
Количественная оценка растворимого p130MET методом DDIA.
p130MET может быть количественно оценен твердофазным двудетерминантным иммуноанализом с использованием тандема моноклональных антител, узнающих различные эпитопы. Фиг. 13 показывает типичную кривую связывания, полученную с p130MET, освобождаемым из GTL - 16 клеток в культуральную среду тканей. Связывание насыщаемое, дозозависимое и специфичное.
Изобретение относится к белку - антагонисту фактора роста гепатоцитов (HGF) и предназначено для использования в биотехнологии и медицине. Белок состоит из двух соединенных дисульфидной связью α- и β-цепей, связывается с HGF и не имеет домена цитоплазматичесной тирозинкиназы. α-цепь является α-цепью рецептора фактора роста гепатоцитов, кодируемого протоонкогеном МЕТ с мол. м. 50 кД. β-цепь является укороченной с С-конца формой β-цепи рецептора HGF с мол. м. 75 или 85 кД. Белок получают путем культивирования клеток, экспрессирующих ген МЕТ. Для выделения из культуральной жидкости белок связывают с антителами, специфичными к внеклеточному домену β-цепи рецептора. Изобретение позволяет получить укороченные формы рецептора фактора роста и использовать их для приготовления фармацевтических препаратов. 2 с. и 2 з. п. ф-лы, 13 ил.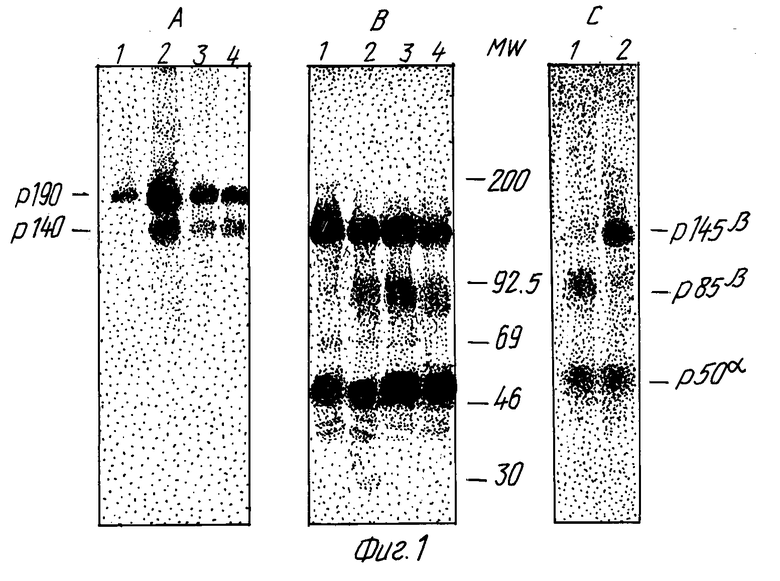
| Nature, 1989, v | |||
| Ручной ткацкий станок | 1922 |
|
SU339A1 |
| Канатное устройство для подъема и перемещения сыпучих и раздробленных тел | 1923 |
|
SU155A1 |
| Science, 1991, v | |||
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
| Дезинтегратор | 1922 |
|
SU803A1 |
| Biol | |||
| Abstr., 1990, v | |||
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Biol | |||
| Abstr., 1988, v | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Cell., 1989, v | |||
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| Способ получения коричневых сернистых красителей | 1922 |
|
SU335A1 |
Авторы
Даты
1998-12-27—Публикация
1992-04-30—Подача