Изобретение относится к фармакологически активным соединениям, которые обладают способностью оказывать влияние на процессы полимеризации и деполимеризации тубулина.
Ряд блокаторов митоза природного происхождения применяют в качестве противоопухолевых средств, либо подвергают в настоящее время клиническому тестированию. Существуют различные классы таких блокаторов митоза, которые либо проявляют свое цитотоксическое действие посредством ингибирования полимеризации микротрубочек в веретенной системе (например, алкалоиды Винка (Vinka alkaloids), колхицин), либо оказывают свое цитотоксическое действие посредством ГТФ-независимого повышения уровня полимеризации тубулина и предотвращения деполимеризации микротрубочек (например, таксол, таксотеры (taxoters)).
Благодаря своим физико-химическим свойствам, остающимся непонятыми до сих пор, и как следствие свойств опухолевых клеток, блокаторы митоза обладают определенной селективностью по отношению к опухолевым клеткам, но все же они оказывают значительное цитотоксическое действие на нетрансформированные клетки. Поиск более селективно действующих соединений, производство которых было бы легче наладить и которые, как соединения класса таксанов, способны ингибировать деполимеризацию микротрубочек, неожиданно привел к открытию сложных эфиров борнеола, как описано в немецком патенте N P 4416374.6 и C 07 C 35/30, 5.05.94 (Шеринг АГ) и немецком патенте N 19513040.5, C 07 D 303/06, 29.03.95 (Шеринг АГ). Структурные модификации соединений данного класса позволили обнаружить значительный потенциал для усовершенствования в отношении воздействия на микротрубочки. Помимо прочего, выдающиеся результаты были получены с помощью классической эстерификации данных борнеолов кислотой типа Sk-H. По проведении синтеза описанных здесь производных таксола, в которых изосериновая цепь таксола замещена Sk, целью явилось исследование возможности достигать повышенной стабильности микротрубочек путем применения соединений данного класса по сравнению с применением таксола.
Далее, в следующих документах описаны соединения, проявляющие фармакологическую активность:
WO-A-9421252;
Bioorg. Med. Chem. Lett., (1994) 4(11), 1381-1384;
EP-A-0534708;
Angew. Chem. Int. Ed. Engl., (1994), 33(1), 15-44;
WO-A-9513053;
WO-A-9519994;
J. Pharm. Sci., (1995), 84(10), 1223-1230;
WO-A-9600724.
Однако соединения, описанные в WO-A-9421252, являются наиболее близкими в данной области.
Неожиданно было обнаружено, что соединения формулы I по данному изобретению по сравнению с таксолом и соединениями, известными в данной области, обладают выгодно отличающимся профилем активности. Помимо очевидно повышенной стабильности микротрубочек, соединения формулы I оказывают дополнительное влияние на процесс полимеризации тубулина.
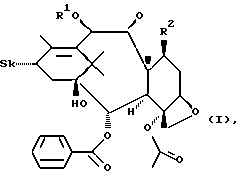
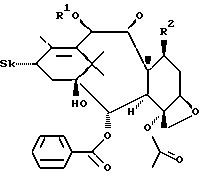
Таксаны по данному изобретению характеризуются общей формулой I.
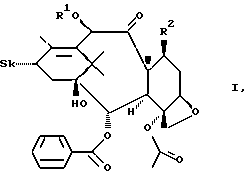
где Sk может представлять собой
R1 может представлять собой водород или C1-C10-ацил;
R2 может представлять собой α-OH,
R3 может представлять собой C1-C10-алкил, X - замещенный фенил, C1-C10-алкокси;
X может представлять собой водород, галоген, -N3 или -CN; и
свободные гидроксигруппы в формуле I могут быть далее функционально модифицированы путем этерификации или эстерификации,
а также их α, β- и γ-циклодекстриновые клатраты, а также соединения общей формулы I, заключенные в липосомы.
Под алкильной группой R3 подразумевают алкильные группы с неразветвленной или разветвленной цепью, содержащие от 1 до 10 атомов углерода, такие как, например, метил, этил, пропил, изопропил, бутил, изобутил, трет.-бутил, пентил, изопентил, неопентил, гептил, гексил и децил. Предпочтительными являются алкильные группы, содержащие от 1 до 4 атомов углерода. Ацильные и алкоксигруппы, содержащиеся в R1 и R3, соответственно, из общей формулы I, содержат от 1 до 10 атомов углерода, причем предпочтительными являются метокси-, этокси-, пропокси-, изопропокси- и трет.-бутоксигруппы, соответственно.
Галоген в обозначении X представляет собой фтор, хлор, бром или иод.
Предпочтительными соединениями общей формулы I являются:
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонилтаксол,
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-эпитаксол,
3'-десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3'-N- метоксикарбонилтаксол и
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-10-дезацетилтаксол.
Изобретение относится также к способу получения борнеольных производных формулы I, причем данный способ характеризуется тем, что спирт общей формулы II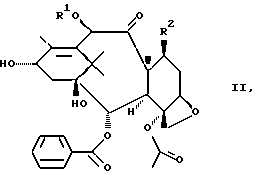
где R1 и R2 определены здесь выше, и гидроксигруппы, содержащиеся в формуле II, необязательно защищены, взаимодействует с соединением общей формулы IIIa, IIIb или IIIс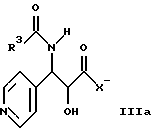
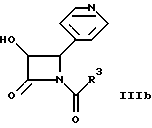
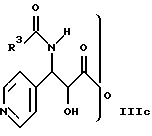
где R3 определен здесь выше, и X' может представлять собой гидрокси, O-алкил или галоген, и где свободные гидроксигруппы защищены путем этерификации, или эстерификации, с получением соединений общей формулы I, в которых свободные гидроксигруппы могут быть далее функционально модифицированы путем этерификации эстерификации.
В целях осуществления эстерификации спиртовой функциональной группы в соединении II проводят депротонирование с помощью основания, такого как, например, гидрид металла (например, гидрид натрия), алкоголят щелочного металла (например, метанолят натрия, трет-бутанолят калия), гексаметилдисилазан щелочного металла (например, гексаметилдисилазан натрия), 1,5-диазабицикло [4.3.0 нон-5-ен (ДБН), 1,8-диазабицикло [5.4.0]ундец-7-ен (ДБУ), триэтиламин, 4-(диметиламино)-пиридин (ДМАП) или 1,4-диазабицикло[2.2.2] октан (ДАБЦО), и проводят реакцию с производным карбоновой кислоты общей формулы III в инертном растворителе, таком как, например, дихлорметан, диэтиловый эфир или тетрагидрофуран, при температуре от -70oC до +50oC. Предпочтительной является реакция с гидридом натрия в качестве основания, циклическим амидом кислоты в качестве производного карбоновой кислоты и тетра-гидрофураном в качестве растворителя при температуре от -10oC до +25oC.
Свободные гидроксигруппы в соединении формулы I могут быть далее функционально модифицированы в соответствии с методиками, известными специалистам в данной области, например путем этерификации или эстерификации. Например, свободные гидроксигруппы могут быть переведены в форму пиридиниевых солей физиологически переносимых кислот, в форму фосфатов и их солей с физиологически переносимыми основаниями или в форму их сложных эфиров или в форму сложных и простых эфиров водорастворимых полимеров. Также могут быть получены простые и сложные эфиры соединений, которые сами по себе способны оказывать ингибирующий эффект на опухоль.
Биологические эффекты и область применения новых производных таксола.
Новые соединения формулы I являются ценными лекарственными средствами. Они воздействуют на тубулин путем вмешательства в процесс полимеризации тубулина и стабилизации образовавшихся микротрубочек и, таким образом, способны оказывать фазоспецифичное воздействие на клеточное деление. Данное воздействие особенно сильно сказывается на быстрорастущих опухолевых клетках, на рост которых существенное влияние оказывают межклеточные регуляторные механизмы. Активные ингредиенты данного типа, в принципе, являются подходящими для лечения заболеваний, при которых могут иметься терапевтические показания для воздействия на процесс клеточного деления.
В качестве примера могут быть упомянуты лечение злокачественных опухолей, малярии, лечение заболеваний, вызываемых грамотрицательными бактериями, а также лечение заболеваний центральной и периферической нервной системы, в основе которых лежат excitotoxic механизмы, такое как, например, лечение острых нейродегенеративных состояний, таких как повышение внутричерепного давления (arise), например в результате инсульта или травматического повреждения головного мозга, лечение хронических нейродегенеративных заболеваний, включая болезнь Альцгеймера, а также лечение бокового амиотрофического склероза.
В качестве примеров применения в лечении злокачественных опухолей может быть упомянуто, например, применение в лечении злокачественных опухолей яичника, желудка, толстой кишки, предстательной железы, молочной железы, легкого, мягких тканей головы и шеи, меланобластомы и острых лимфолейкозов и миелолейкозов.
Вообще, соединения по данному изобретению могут быть применены либо сами по себе, либо, в целях достижения аддитивного или синергического эффекта, в сочетании с другими действующими началами и классами соединений, которые могут быть применены в требующемся курсе лечения.
При рассмотрении лечения опухолей в качестве примера могут быть упомянуты сочетания с
комплексами платины, такими как, например, цисплатин и карбоплатин,
внедряющимися соединениями, например, из класса антрациклинов, такими как, например, доксорубицин, или из класса антрапиразолов, такими как, например, С1-941,
соединениями, которые действуют на тубулин, например из класса алкалоидов Винка, такими как, например, винкристин и винбластин, или из нового класса сложных эфиров борнеола, описанных в P 4416374.6 и 19513040.5, или из класса макролидов, такими как, например, ризоксин, или с другими соединениями, такими как, например, колхицин, комбретастатин А-4 и эпотилон А и В,
ингибиторами ДНК-топоизомеразы, такими как, например, камптотецин, этопозид, топотекан и тенипозид,
фолатными или пиримидиновыми антиметаболитами, такими как, например, лометрексол и гемцитубин,
алкилирующими ДНК соединениями, такими как, например, адозелезин и дистамицин A,
ингибиторами факторов роста (например, ингибиторами PDGF, EGF, TGFb, EGF), такими как, например, антагонисты соматостатина, сурамина (suramin), бомбезина,
ингибиторами тирозиновой протеинкиназы или протеинкиназ A и C, такими как, например, эрбстатин, генистеин, стауроспорин, илмофозин и 8-С1-цАМФ,
антигормональными средствами из класса антигестагенных средств, такими как, например, мифепристон, онапристон, или из класса антиэстрогенных средств, такими как, например, тамоксифен, или из класса антиандрогенных средств, такими как, например, ципротеронацетат,
соединениями, подавляющими метастазирование, например из класса эйкозаноидов, такими как, например, PGI2, PGE1, 6-оксо-PGE1 и их стойкие производные (например, илопрост, цикапрост, берапрост),
антагонистами ионов Ca2+, такими как, например, верапамил, галопамил, флунаризин, дилтиазем, нифедипин и нимодипин,
нейролептическими средствами, такими как, например, хлорпромазин, трифлуоперазин, тиоридазин и перфеназин,
местно-анестезирующими средствами, такими как, например, карбанилат-Ca7, цинхокаин, карбанилат-Ca3, артикаин, карбанилат, лидокаин,
соединениями, подавляющими рост сосудов, такими как, например, анти-VEGF антитела, эндостатин В, интерферон-α, AGM 1470, и
ингибиторами клеточной пролиферации при псориазе, саркоме Капоши и нейробластоме.
Данное изобретение относится также к лекарственным средствам на основе соединений общей формулы I, которые являются фармацевтически приемлемыми, что означает, что соединения нетоксичны в применяемых концентрациях, необязательно в сочетании с традиционными наполнителями, носителями и добавками.
Соединения по данному изобретению могут быть переработаны в соответствии с методиками галеновой фармации, известными сами по себе, в фармацевтические препараты для энтерального, чрескожного, парентерального или местного применения. Они могут быть применены в форме таблеток, драже, желатиновых капсул, гранул, суппозиториев, имплантатов, стерильных водных и масляных растворов для инъекций, суспензий или эмульсий, мазей, кремов и гелей. Таким образом, данное изобретение относится также к применению соединений по данному изобретению в получении лекарственных препаратов.
Активный(е) ингредиент(ы) может быть смешан с наполнителями, которые являются принятыми в галеновой фармации, такими как, например, гуммиарабик, тальк, крахмал, маннитол, метилцеллюлоза, лактоза, поверхностно-активные вещества, такие как Tweens или Myrj, стеарат магния, водные или неводные носители, производные парафинов, увлажняющие и диспергирующие средства, эмульгаторы, консерванты и корригенты для придания вкуса (например, эфирные масла).
Таким образом, данное изобретение относится также к фармацевтическим композициям и лекарственным препаратам, которые в качестве активного ингредиента содержат, по крайней мере, одно соединение по данному изобретению. Разовая доза содержит приблизительно от 0,1 до 100 мг активного(ых) ингредиента(ов). Дозировка соединений по данному изобретению у людей составляет приблизительно от 0,1 до 1000 мг в сутки.
Описание фигур.
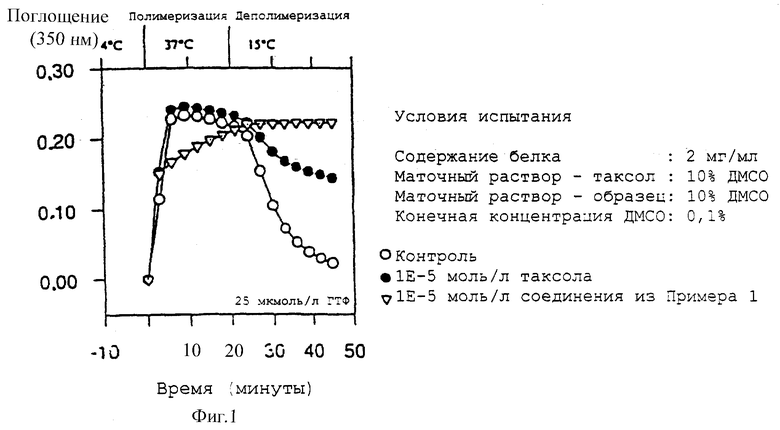
На фиг. 1 показан ход изменения поглощения как функции времени и температуры (3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N- метоксикарбонилтаксол, прикладной пример 2).
На фиг. 2 показан ход изменения поглощения как функции времени и температуры (3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил- 3'-N-метоксикарбонил-7-эпитаксол, прикладной пример 3).
На фиг. 3 показан ход изменения поглощения как функции времени и температуры (3'-десфенил-3'-(4-пиридил)-2,3'-N-бисдебензоил-3'-N- метоксикарбонилтаксол, прикладной пример 4).
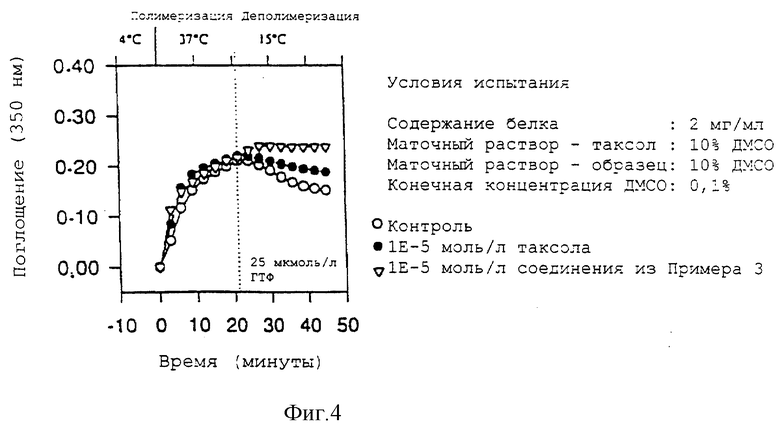
На фиг. 4 показан ход изменения поглощения как функции времени и температуры (3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-10- дезацетилтаксол, прикладной пример 5).
Следующие примеры служат для дальнейшего разъяснения способа получения соединений по данному изобретению.
Пример 1.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N- метоксикарбонилтаксол.
8,6 мкл 1 M раствора фторида тетрабутиламмония в тетрагидрофуране добавляют при 3oC в атмосфере сухого аргона к раствору 3,1 мг (2,9 мкмоль) соединения, полученного в соответствии с примером 1a, в 0,5 мл безводного тетрагидрофурана и реакционную смесь перемешивают в течение 30 минут. Смесь выливают в насыщенный раствор гидрокарбоната натрия и проводят экстракцию путем добавления дихлорметана, органический экстракт концентрируют и остаток очищают по методу хроматографии на половине пластинки для аналитической тонкослойной хроматографии. В качестве подвижной фазы применяют этилацетат, а в качестве элюента применяют смесь дихлорметана и метанола. Выделяют 0,4 мг (0,5 мкмоль, 17%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 1.16 (3H), 1.25 (3H), 1.70 (3H), 1.75 (1H), 1.84 (3H), 1.90 (1H), 2.26 (3H), 2.25-2.38 (2H), 2.38 (3H), 2.48 (1H), 2.56 (1H), 3.62 (3H), 3.81 (1H). 4.19 (1H), 4.31 (1H), 4.40 (1H), 4.71 (1H), 4.95 (1H), 5.37 (1H), 5.66 (1H), 5.69 (1H), 6.28 (1H), 6.31 (1H), 7.40 (2H), 7.51 (2H), 7.61 (1H), 8.11 (2H), 8.66 (2H) ppm.
Пример 1a.
2'-Триизопропилсилил-3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-триэтилсилилтаксол.
12 мг приблизительно 60% дисперсии гидрида натрия добавляют при 3oC в атмосфере сухого аргона к раствору 4,2 мг (6,0 мкмоль) и 11,4 мг соединений, полученных в соответствии с примерами 1б и 1в, в 0,1 мл безводного тетрагидрофурана и смесь нагревают до 30oC и перемешивают в течение 30 минут. Смесь вновь охлаждают до 3oC, добавляют 30% водную уксусную кислоту и несколько раз проводят экстракцию путем добавления диэтилового эфира. Объединенные органические экстракты промывают насыщенным раствором хлорида натрия и сушат над сульфатом магния. После фильтрования и удаления растворителя остаток очищают по методу хроматографии на двух пластинках для аналитической тонкослойной хроматографии. В качестве подвижной фазы применяют смесь н-гексана и этилацетата, а в качестве элюента применяют смесь дихлорметана и метанола. Выделяют 3,7 мг (3,4 мкмоль, 57%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 0.60 (6H), 0.80-1.02 (30H), 1.25 (6H), 1.70 (3H), 1.91 (1H), 2.03 (3H), 2.14 (1H), 2.20 (3H), 2.36 (1H), 2.49 (3H), 2.53 (1H), 3.54 (3H), 3.84 (1H), 4.18 (1H), 4.30 (1H), 4.49 (1H). 4.85 (1H), 4.93 (1H), 5.30 (1H), 5.60 (1H), 5.70 (1H), 6.32 (1H), 6.47 (1H), 7.28 (2H), 7.49 (2H), 7.59 (1H), 8.13 (2H), 8.64 (2H) ppm.
Пример 1б.
7-Триэтилсилилбаккатин III
21 мкл Триэтилхлорсилана и 10,3 мг имидазола добавляют при 3oC в атмосфере сухого аргона к раствору 3,7 мг (6,3 мкмоль) хроматографически очищенного баккатина III (Calbiochem Corp.) в 0,3 мл безводного диметилформамида и реакционную смесь перемешивают в течение одного часа. Смесь выливают в насыщенный раствор гидрокарбоната натрия и несколько раз проводят экстракцию путем добавления диэтилового эфира с последующей промывкой насыщенным раствором хлорида натрия и объединенные органические экстракты концентрируют. Остаток, полученный после фильтрования и удаления растворителя, очищают по методу хроматографии на половине пластинки для аналитической тонкослойной хроматографии. В качестве подвижной фазы применяют смесь н-гексана и этилацетата, а в качестве элюента применяют смесь дихлорметана и метанола. Выделяют 3,0 мг (5,6 мкмоль, 88%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 0.59 (6H),. 0.92 (9H), 1.06 (3H), 1.20 (3H), 1.62 (1H), 1.69 (3H), 1.88 (1H), 2.04 (1H), 2.19 (6H), 2.28 (2H), 2.29 (3H). 2.53 (IH). 3.88 (1H), 4.14 (1H), 4.31 (1H), 4.50 (1H), 4.83 (1H). 4.98 (IH). 5.63 (1H), 6.47 (1H), 7.49 (2H), 7.61 (1H), 8.11 (2H) ppm.
Пример 1в.
(3R, 4S)-1-(Метоксикарбонил)-3-триизопропилсилилокси-4-(4-пиридил)-2-азетидинон.
573 мг 4-диметиламинопиридина и 193 мкл метилового эфиpa хлормуравьиной кислоты добавляют при 3oC в атмосфере сухого аргона к раствору 250 мг (0,78 ммоль) соединения, полученного в соответствии с примером 1 г, в 10 мл безводного дихлорметана и реакционную смесь нагревают до 23oC и перемешивают в течение еще 16 часов. Смесь выливают в насыщенный раствор хлорида аммония, несколько раз проводят экстракцию путем добавления диэтилового эфира с последующей промывкой насыщенным раствором хлорида натрия и объединенные органические экстракты концентрируют. Остаток, полученный после фильтрования и удаления растворителя, очищают по методу хроматографии на приблизительно 150 мл мелкопористого силикагеля, применяя в качестве подвижной фазы смесь н-гексана и этилацетата. Выделяют 251 мг (0,66 ммоль, 85%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 0.82-1.07 (21H), 3.82 (3H), 5.11 (1H), 5.26 (1H), 7.23 (2H), 8.61 (2H) ppm.
Пример 1г.
(3R,4S)-3-Триизопропилсилилокси-4-(4-пиридил)-2-азетидинон
Раствор 67,3 г цериевого нитрата аммония в 700 мл воды добавляют при 3oC в атмосфере аргона к раствору 17,2 г (40,3 ммоль) соединения, полученного в соответствии с примером 1д, в 384 мл безводного ацетонитрила и реакционную смесь перемешивают в течение 30 минут. Смесь выливают в насыщенный раствор гидрокарбоната натрия, несколько раз проводят экстракцию путем добавления этилацетата и объединенные органические экстракты промывают 1% раствором гидроксида натрия и сушат над сульфатом магния. Остаток, полученный после фильтрования и удаления растворителя, очищают по методу хроматографии на приблизительно 800 мл мелкопористого силикагеля, применяя в качестве подвижной фазы смесь н-гексана и этилацетата. Выделяют 7,89 г (24,6 ммоль, 61%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 0.78-1.07 (21H), 4.81 (1H), 5.23 (1H), 6.39 (1H), 7.28 (2H), 8.59 (2H) ppm.
Пример 1д.
(3R, 4S)-1-(4-Метоксифенил)-3-триизопропилсилилокси-4-(4-пиридил)-2-азетидинон.
Раствор 12,6 мл перегнанного непосредственно перед этим диизопропиламина в 70 мл безводного тетрагидрофурана охлаждают до -30oC в атмосфере сухого аргона, добавляют 37,6 мл 2,4 М раствора н-бутиллития в н-гексане и смесь нагревают до 0oC. Через 30 минут смесь охлаждают до -78oC, к ней по каплям добавляют раствор 22,1 г (56,6 ммоль) (1R, 2S)-2-фенил-1-циклогексилтриизопропилсилилоксиацетата, полученного в соответствии с методикой, аналогичной таковой, описанной в Tetrahedron, т. 48, N 34, стр. 6985-7012, 1992, в 70 мл безводного тетрагидрофурана и смесь перемешивают в течение 3 часов. Затем добавляют раствор 15,6 г (73,5 ммоль) альдимина, полученного в соответствии с примером 1е, в 150 мл безводного тетрагидрофурана и смесь нагревают до 23oC в течение 16 часов. Смесь выливают в насыщенный раствор хлорида аммония, несколько раз проводят экстракцию путем добавления этилацетата с последующим промыванием насыщенным раствором хлорида натрия и объединенные органические экстракты концентрируют. Остаток, полученный после фильтрования и удаления растворителя, очищают по методу хроматографии на приблизительно 1,8 л мелкопористого силикагеля, применяя в качестве подвижной фазы смесь н-гексана и этилацетата. Выделяют 17,2 г (40,3 ммоль, 71%) указанного в заголовке соединения.
1H-NMR(CDCl3): d = 0.82-1.12 (21H), 3.76 (3H), 5.12 (1H), 5.29 (1H), 6.80 (2H), 7.19-7.30 (4H), 8.60 (2H) ppm.
Пример 1e.
N-(4-Метоксифенил)-(4-пиридил)альдимин.
7,8 мл пиридин-4-альдегида и 8,4 г сульфата магния добавляют в атмосфере сухого аргона к раствору 10 г (81,1 ммоль) 4-анизидина в 120 мл безводного дихлорметана и смесь перемешивают при 23oC в течение 4 часов. Остаток, полученный после фильтрования и удаления растворителя, перекристаллизовывают из н-гексана. Выделяют 15,9 г (74,9 ммоль, 92%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 3.83 (3H), 6.95 (2H), 7.29 (2H), 7.73 (2H), 8.47 (1H), 8.73 (2H) ppm.
Пример 2.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-эпитаксол (A) и 3'-десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3'-N- метоксикарбонилтаксол (Б)
42 мкл 1 М раствора фторида тетрабутиламмония в тетрагидрофуране добавляют при 3oC в атмосфере сухого аргона к раствору 15 мг (13,9 мкмоль) соединения, полученного в соответствии с примером 1а, в 0,5 мл безводного тетрагидрофурана и реакционную смесь перемешивают в течение 30 минут при 3oC, нагревают до 23oC и перемешивают в течение еще 30 минут. Смесь выливают в насыщенный раствор гидрокарбоната натрия, проводят экстракцию путем добавления дихлорметана, органический экстракт концентрируют и остаток очищают по методу хроматографии на двух пластинках для аналитической тонкослойной хроматографии. В качестве подвижной фазы применяют смесь этилацетата и метанола, а в качестве элюента применяют смесь дихлорметана и метанола.
Выделяют 3,8 мг (4,7 мкмоль, 34%) указанного в заголовке соединения А, 2,4 мг (3,4 мкмоль, 25%) указанного в заголовке соединения Б, а также 1,2 мг (1,5 мкмоль, 11%) соединения, описанного в примере 1.
1H-NMR (CDCl3) of A: d = 1.18 (3H), 1.23 (3H), 1.68 (3H), 1.71 (1H), 1.80 (1H), 1.83 (3H), 2.15-2.48 (4H), 2.21 (3H), 2.49 (3H), 3.56 (3H), 3.71 (1H), 3.92 (1H), 4.37 (2H), 4.63 (1H), 4.71 (1H), 4.91 (1H), 5.37 (1H), 5.67 (1H), 5.76 (1H), 6.34 (1H), 6.81 (1H), 7.33 (2H), 7.51 (2H), 7.61 (1H), 8.16 (2H), 8.63 (2H) ppm.
Пример 3.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N- метоксикарбонил-10-дезацетилтаксол.
20,4 мкл 4 н. соляной кислоты добавляют в атмосфере сухого аргона к раствору 9,0 мг (10,2 мкмоль) соединения А, полученного в соответствии с примером 3а, в 0,8 мл этанола и 0,2 мл тетрагидрофурана и реакционную смесь перемешивают при 23oC в течение одного часа. Добавление соляной кислоты повторяют еще дважды, каждый раз после одночасового периода перемешивания, добавляют насыщенный раствор гидрокарбоната натрия, проводят экстракцию путем добавления дихлорметана, органический экстракт концентрируют и остаток очищают по методу хроматографии на двух пластинках для аналитической тонкослойной хроматографии. В качестве подвижной фазы применяют смесь этилацетата и этанола, а в качестве элюента применяют смесь дихлорметана и метанола. Выделяют 6,5 мг (8,5 мкмоль, 83%) указанного в заголовке соединения.
1H-NMR (CDCl3): d = 1.13 (3H), 1.24 (3H), 1.78 (3H), 1.83 (3H), 1.73-1.96 (3H), 2.25 (2H), 2.37 (3H), 2.60 (1H), 3.62 (3H), 3.92 (1H), 4.14-4.28 (2H), 4.20 (1H), 4.32 (1H), 4.69 (1H), 4.94 (1H), 5.21 (1H), 5.36 (1H), 5.68 (1H), 5.83 (1H), 6.30 (1H), 7.34 (2H), 7.50 (2H), 7.62 (1H), 8.10 (2H), 8.61 (2H) ppm.
Пример 3а.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N- метоксикарбонил-7-тpиэтилсилил-10-дезацетилтаксол (A) и
3'-Десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3' -N-метоксикарбонил-7-триэтилсилил-10-дезацетилтаксол (Б).
Проводят реакцию 25 мг (23 мкмоль) сырого продукта, полученного в соответствии с примером 3б, при -10oC, аналогичную таковой из примера 1, и после завершения и очистки, выделяют 9,0 мг (10,2 мкмоль, 44%) указанного в заголовке соединения А, 2,5 мг (3,2 мкмоль, 14%) указанного в заголовке соединения Б, а также 2,2 мг (2,9 мкмоль, 12%) указанного в заголовке соединения из примера 3.
1H-NMR (CDCl3) of A: d = 0.43-0.67 (6H), 0.94 (9H), 1.13 (3H), 1.24 (3H), 1.70 (1H), 1.76 (3H), 1.87 (3H), 1.93 (1H), 2.24 (2H), 2.36 (3H), 2.48 (1H), 3.62 (3H), 3.87 (1H), 4.18 (1H), 4.29 (1H), 4.34 (1H), 4.68 (1H), 4.91 (1H), 5.12 (1H), 5.36 (1H), 5.63 (1H), 5.77 (1H), 6.29 (1H), 7.33 (2H), 7.49 (2H), 7.60 (1H), 8.10 (2H), 8.60 (2H) ppm.
1H-NMR (CDCl3) of В: d = 0.45-0.64 (6H), 0.94 (9H), 1.02 (3H), 1.25 (4H), 1.67 (1H), 1.72 (3H), 1.82 (3H), 1.88-2.12 (2H), 2.18 (4H), 2.47 (1H), 3.50 (1H), 3.67 (1H), 3.70 (3H), 3.90 (1H), 4.26 (1H), 4.30 (1H), 4.59 (1H), 4.61 (1H), 4.66 (1H), 4.91 (1H), 5.03 (1H), 5.27 (1H), 5.65 (1H), 6.25 (1H), 7.32 (2H), 8.62 (2H) ppm.
Пример 3б.
2'-Триизопропилсилил-3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-триэтилсилил-10-дезацетилтаксол.
0,23 мл гидроксида гидразиния добавляют в атмосфере сухого аргона к раствору 25 мг (23,2 мкмоль) соединения, полученного в соответствии с примером 1а, в 1,2 мл этанола и смесь перемешивают при 23oC в течение 24 часов. Смесь выливают в насыщенный раствор хлорида аммония, несколько раз проводят экстракцию путем добавления этилацетата, а сушку осуществляют над сульфатом магния. Остаток, полученный после фильтрования и удаления растворителя, применяют в дальнейшей реакции без очистки. Выделяют 22 мг (макс. 21 мкмоль, макс. 91%) указанного в заголовке соединения, которое все еще содержит небольшие количества исходного продукта.
Следующие прикладные примеры подтверждают биологическую активность соединений по данному изобретению без ограничения их практического приложения данными примерами.
Прикладной пример 1.
Выделение и очистка тубулина.
Из непосредственно перед этим вскрытых коровьих черепов удаляют головной мозг коровы (каждый массой 330 г) и транспортируют в ледяном буфере РМ4-М. Каждый головной мозг освобождают от мозговых оболочек и всех тромбов и гомогенизируют в достаточном объеме буфера РМ4-М в холодном помещении. Гомогенат 2 коровьих головных мозгов доводят до общего объема 1,0 литра суммарным количеством в 500 мл буфера и подвергают первому центрифугированию (ротор GSA, 15 минут, 4oC, 6500 g). С поверхности супернатанта снимают пленку жира, фильтруют через 4 слоя тонкого муслина, переносят в уравновешенные центрифужные пробирки (420 мл) и вновь центрифугируют (ротор Ti 45, 96000 g, 75 минут, 4oC). Супернатант отделяют от осадка с помощью пипетки и фильтруют через 6 слоев тонкого муслина и добавляют 50 мМ раствор ГТФ в 0,01 М бикарбонатном буфере/ФБР с получением конечной концентрации 1 мМ. Первоначально полимеризацию проводят в уравновешенных, центрифужных пробирках в течение 45 минут на водяной бане, нагретой до 37oC. Образовавшиеся микротрубочки выделяют путем центрифугирования (ротор Ti 45, 27oC, 96000 g, 60 минут), супернатант осторожно удаляют с помощью пипетки и очень нежный опалесцирующий осадок осторожно отделяют от стенки шпателем. Затем к осадку добавляют 40 мл холодного буфера РМ с последующей гомогенизацией с применением небольшого стеклянного гомогенизатора-ступки и инкубацией в течение ночи (от 12 до 16 часов) на льду в уравновешенных центрифужных пробирках в холодном помещении. Продукт деполимеризации удаляют путем центрифугирования в роторе Ti 60 (4oC, 96000 g, 60 минут) и супернатант разбавляют буфером РМ8-М в пропорции 1:1, инкубируют в уравновешенных центрифужных пробирках в течение 45 минут и центрифугируют вновь (ротор Ti 45, 27oC, 96000 g, 60 минут). Супернатант осторожно удаляют с помощью пипетки и очень нежный опалесцирующий осадок осторожно отбирают в 20 мл холодного буфера РМ, осторожно гомогенизируют с применением небольшого стеклянного гомогенизатора-ступки и инкубируют на льду в течение 30 минут. При повторном центрифугировании (ротор Ti 60, 4oC, 96000 g, 60 минут) получают препарат тубулина, содержание белка в котором определяют по Пирсу (Pearce) или с помощью фотометрических измерений при 280 нм. При определении содержания белка применяют разведения выделенного материала в буфере РМ 1:10, 1:20 и 1:40. Буфер РМ обладает собственным значением экстинкции и вычитается как нулевое значение из определенного значения содержания белка. Выделенный материал разбавляют буфером РМ до требуемой концентрации белка (2 мг/мл).
Прикладной пример 2.
Биологический эффект 3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонилтаксола на тубулин.
Измерение уровня полимеризации тубулина и деполимеризации микротрубочек проводят по методу фотометрии. Перед измерением препарат тубулина, полученный в соответствии с прикладным примером 1, оттаивают и дегазируют в течение 15 минут. Фотометр настраивают на длину волны 350 нм. 3 мкл раствора/образца, 6 мкл ГТФ (конечная концентрация 0-25 мкмоль/л) и 291 мкл препарата тубулина (2 мг белка/мл) отбирают с помощью пипетки в сухую и чистую кювету (10 мм). Образец осторожно перемешивают (избегая образования пузырьков воздуха), немедленно помещают в кюветодержатель и процедуру измерения начинают при 37oC. Как только достигается максимальный уровень полимеризации (контрольный растворитель и таксол 1Е-5 моль/л через 20 минут), стимулируют начало деполимеризации путем снижения температуры до 15oC. Процедуру измерения прекращают по завершении процесса деполимеризации и ход изменения поглощения представляют в графической форме как функцию времени и температуры (фиг. 1).
Из фигуры ясно видно, что таксол ускоряет полимеризацию тубулина по сравнению с контролем и подавляет деполимеризацию, тогда как соединение по данному изобретению 3'-десфенил-3'-(4-пиридил)-3'-N- дебензоил-3'-N-метоксикарбонилтаксол ингибирует полимеризацию и стабилизирует образовавшиеся микротрубочки заметно лучше, чем таксол.
Прикладной пример 3.
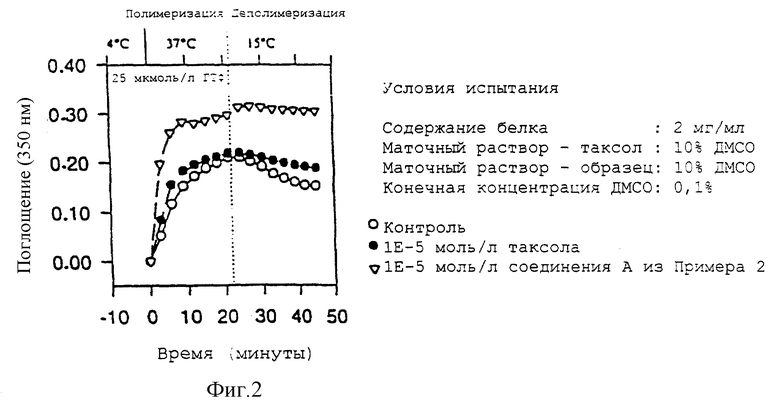
Биологический эффект 3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-эпитаксола на тубулин.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N- метоксикарбонил-7-эпитаксол вызывает гораздо более выраженное ускорение процесса полимеризации тубулина и стабилизирует образовавшиеся микротрубочки заметно лучше, чем таксол. Результаты показаны на фиг. 2.
Прикладной пример 4.
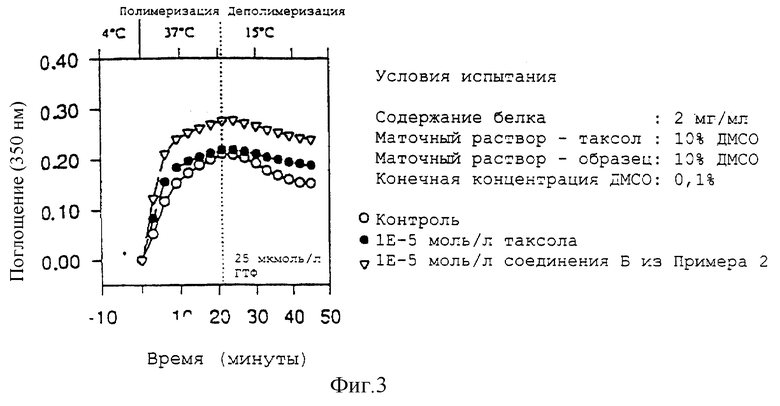
Биологический эффект 3'-десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3'-N-метоксикарбонилтаксола на тубулин.
3'-Десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3'-N-метоксикарбонилтаксол вызывает гораздо более выраженное ускорение процесса полимеризации тубулина и стабилизирует образовавшиеся микротрубочки заметно лучше, чем таксол. Результаты показаны на фиг. 3.
Прикладной пример 5.
Биологический эффект 3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-10-дезацетилтаксола на тубулин.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-10-дезацетилтаксол не отличается от таксола в плане воздействия на процесс полимеризации тубулина, но он стабилизирует образовавшиеся микротрубочки существенно лучше, чем таксол. Результаты показаны на фиг. 4.
Прикладной пример 6.
Антипролиферативный эффект на опухолевые клеточные линии:
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонилтаксола (1),
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-эпитаксола (2),
3'-десфенил-3'-(4-пиридил)-2,3'-N-бис-дебензоил-3'-N-метоксикарбонилтаксола (3) и
3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-10-дезацетилтаксола (4).
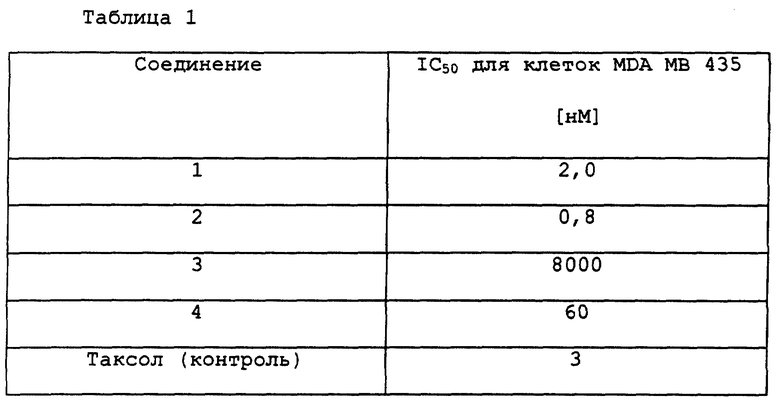
Клетки линии карциномы молочной железы MDA MB 435 (5000 клеток/лунку) помещают на планшеты для микротитрования (сутки 0, среда RPMI, 1% заменимых аминокислот, 1% пирувата, 10% околоплодной сыворотки теленка). На 1 сутки проводят добавление соединения в нескольких концентрациях. Антипролиферативный эффект оценивают на 3 сутки, применяя метод МТТ. По нему определяют значения IC50. Результаты приведены в таблице.
3'-Десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонилтаксол проявляет активность, сходную с таковой таксола, тогда как 3'-десфенил-3'-(4-пиридил)-3'-N-дебензоил-3'-N-метоксикарбонил-7-эпитаксол проявляет существенно повышенную ингибирующую активность по сравнению с таксолом.
Описываются новые таксаны общей формулы I, обладающие фармакологической активностью, где Sk может представлять собой  , R1 может представлять собой водород или C1 - C10-ацил, R2 может представлять собой α-OH, R3 может представлять собой C1 - C10-алкоксигруппу, и свободные гидроксигруппы в формуле I могут быть далее функционально модифицированы путем этерификации. Описывается также способ их получения и лекарственный препарат на их основе. Помимо повышенной стабильности микротрубочек, соединения формулы I оказывают дополнительное влияние на процесс полимеризации тубулина. Могут найти применение для лечения злокачественных опухолей. 3 с. и 5 з.п. ф-лы, 4 ил., 1 табл.
, R1 может представлять собой водород или C1 - C10-ацил, R2 может представлять собой α-OH, R3 может представлять собой C1 - C10-алкоксигруппу, и свободные гидроксигруппы в формуле I могут быть далее функционально модифицированы путем этерификации. Описывается также способ их получения и лекарственный препарат на их основе. Помимо повышенной стабильности микротрубочек, соединения формулы I оказывают дополнительное влияние на процесс полимеризации тубулина. Могут найти применение для лечения злокачественных опухолей. 3 с. и 5 з.п. ф-лы, 4 ил., 1 табл.
где Sk может представлять собой
R1 может представлять собой водород или C1 - C10-ацил;
R2 может представлять собой α-ОН;
R3 может представлять собой C1 - C10-алкоксигруппу,
и свободные гидроксигруппы в I могут быть далее функционально модифицированы путем этерификации.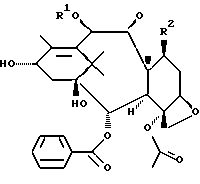
где R1 и R2 имеют указанные значения,
и гидроксигруппы, содержащиеся в II, необязательно защищены, подвергают взаимодействию с соединением общей формулы IIIa, IIIb или IIIc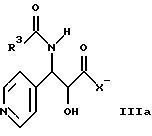
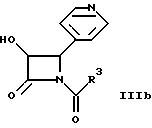
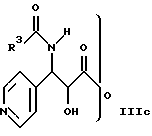
где R3 имеет указанное значение;
X' может представлять собой гидрокси, О-алкил или галоген,
и где свободные гидроксигруппы защищены путем этерификации или эстерификации, с получением соединений общей формулы I, в которых свободно гидроксигруппы могут быть далее функционально модифицированы путем этерификации.
| WO 9421252 A, 25.09.1994 | |||
| Способ определения места повреждения и контроля неоднородностей проводов и кабелей | 1974 |
|
SU534708A1 |
| WO 9513053 A, 18.05.1995 | |||
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ЦЕФЕМА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ | 1988 |
|
RU2017744C1 |
Авторы
Даты
2001-02-27—Публикация
1997-01-31—Подача