Данное изобретение относится к области гетероциклических соединений, обладающих отличными фармакологическими свойствами и к области промежуточных соединений, которые используются для синтеза указанных соединений.
В частности, данное изобретение относится к соединениям общей формулы
где R1 является необязательно замещенным остатком углеводорода, возможно связанным через гетероатом; R2 является необязательно замещенным 5-7-членным гетероциклическим остатком, содержащим в качестве группы, способной образовывать кольцо, карбонильную группу, тиокарбонильную группу, необязательно окисленный атом серы или группу, способную в них превращаться; X - прямая связь или разделяющая группа, содержащая два или менее атомов между циклами Y и W; W и Y независимо представляют необязательно замещенный ароматический углеводородный остаток, необязательно содержащий гетероатом или необязательно замещенный гетероциклический остаток; n = 1-2; а и b, входящие в состав гетероциклического остатка, независимо представляют собой один или два необязательно замещенных атома углерода или гетероатома, с - необязательно замещенный атом углерода или гетероатом; и когда a представляет собой необязательно замещенный атом углерода, R1 и а могут необязательно быть связаны друг с другом, образуя группу формулы
образующую 5-8-членное кольцо.
Система ренин-ангиотензин принимает участие в гомеостатическом функционировании организма, контролируя кровяное давление, объем жидкости, баланс между электролитами и т.д., которые связаны с системой альдостерона. Связь между системой ренин-ангиотензин и повышенным давлением была установлена при производстве ангиотензина II (A II), превращающего ингибиторы энзимов (АСЕ ингибитор), который приводит к получению ангиотензина II, имеющему сильное сосудосужающее действие. Поскольку ангиотензин II сужает кровеносный сосуд, что приводит к повышению кровяного давления через рецепторы ангиотензина II, действующие на клеточные мембраны, вещества противоположного действия, как например, ингибиторы АСЕ можно использовать для лечения гипертонии, которая вызывается ангиотензином. Известно, что ряд аналогов ангиотензина II, такие как саларазин (Sar1, Ile8) A II и подобные обладают возможной активностью противоположной активности ангиотензина II. Однако также известно, что антагонисты - пептиды, назначаемые не перорально, не оказывают пролонгированного действия, а когда назначаются перорально, то действуют неэффективно [M.A. Ondetti and D. W.Cushman, Annual Reports in Medicinal Chemistry, 13, 82-91 (1978)].
С другой стороны для решения проблем, связанных с этими пептидными антагонистами ангиотензина II проводились исследования непептидных антагонистов ангиотензина II. Ранее имидазольные производные, обладающие активностью в качестве антагонистов ангиотензина II были описаны в заявках Японии S56 (1981) - 71073, S56(1981) - 71074, S57(1982) - 98270 и S58 (1983) - 157768, патенте США 4355040 и 4340598 и т.д. Позднее усовершенствованные производные имидазола были описаны в ЕП - 0253310, ЕП - 0291969, ЕП - 0324377, ЕП - 403158, WO - 9100277, заявке Японии S63 (1988) - 23868 и заявке Японии H1 (1989) - 117876; производные пиррола, пиразола и триазола описаны в ЕП - 0323841, ЕП - 0409332 и заявке Японии H1 (1989) - 287071; производные бензимидазола - в патенте США 4880804, ЕП-0392317, ЕП-0399732, ЕП-0400835 и заявке Японии Н3 (1991) - 632264; производные азаиндена - в ЕП-0399731; производные пиримидона - в ЕП-0407342; производные хиназолинона - в ЕП-0441766; в качестве антагонистов ангиотензина II.
Однако для того, чтобы стать полезным для терапии лекарством, антагонисты ангиотензина II должны иметь сильное длительное противоположное ангиотензину II действие при пероральном использовании. Как известно из литературных источников, сильные антагонисты имеют ацидо-группу, например тетразольную или карбоксильную на стороне цепи бифенила, особенно предпочтительна тетразольная группа, а клинический тест соединений, имеющих тетразольную группу, в качестве антигипертонических агентов был проведен [Y. Christen, B. Waeber, J.Nussberqer, R.J.Lee, P.B.M.W.M. Timmermans, and H.R.Brunner, Am.J.Hypertens., 4, 350S (1991)].
Однако известно, что соединения, содержащие цикл тетразола и азидные соединения, легко взрываются, что становится серьезной проблемой для их производства в широком масштабе.
Данное изобретение имеет своей целью получение нового соединения, содержащего гетероциклический остаток, который можно заместить на тетразольную или карбоксильную группу, которое обладает сильным действием, противоположным действию ангиотензина II и противогипертоническим действием при пероральном введении и которое может быть использовано в качестве полезного терапевтического средства.
Авторы данного изобретения полагают, что соединения, блокирующие действие системы ренин-ангиотензин, которые являются клинически полезными для лечения болезней органов кровообращения, таких как гипертоническая болезнь, заболевание сердца (тахикардия, сердечная недостаточность, инфаркт миокарда и др. ), нарушение мозгового кровообращения, нефрит, атеросклероз и др., должны обладать потенциальной активностью, противоположной по действию рецептора ангиотензина II и иметь сильное длительное действие, антагонистическое ангиотензину II, и противогипертоническое действие при пероральном применении. Они провели интенсивные исследования этих соединений, имеющих действие, антагонистическое действию ангиотензина II, в течение длительного времени.
В результате авторы данного изобретения обнаружили, что новые гетероциклические соединения (I) имеют потенциальную активность, противоположную по действию рецептора ангиотензина II, а также обладают сильным длительным действием, противоположным действию ангиотензина II, и противогипертоническим действием при пероральном применении.
В общей формуле (I) примерами углеводородного остатка, обозначенного R1, могут быть алкил, алкенил, алкинил, циклоалкил, арил и аралкил. Предпочтительными среди них являются алкил, алкенил и циклоалкил. Углеводородный остаток может быть связан с циклом через гетероатом или может в свою очередь являться замещенным углеводородным остатком, связанным через гетероатом.
Алкильная группа, представленная R1, может быть прямой или разветвленной низшей алкильной группой, содержащей от 1 до 8 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изо-пентил, гексил, гептил или октил.
Алкенильная группа, представленная R1, может быть прямой или разветвленной низшей алкенильной группой, содержащей от 2 до 8 атомов углерода, например винильная, пропенильная, 2-бутенильная, 3-бутенильная, изобутенильная или 2-октенильная.
Алкинильная группа, изображенная как R1, может быть прямой или разветвленной низшей алкинильной группой, содержащей от 2 до 8 атомов углерода, например этинильная, 2-пропинильная, 2-бутинильная, 2-пентинильная или 2-октинильная.
Циклоалкильная группа, представленная R1, может быть низшей циклоалкильной группой, содержащей от 3 до 6 атомов углерода, например циклопропильная, циклобутильная, циклопентильная или циклогексильная.
Вышеупомянутые алкильная, алкенильная, алкинильная или циклоалкильная группа может быть необязательно замещена, например, гидроксильной группой, аминогруппой [например, амино, N-низший (1-4C)алкиламино или N,N-ди-низший(1- 4C)алкиламино], галоген, низший (1-4C)алкоксигруппа или низшая (1-4C) алкилтиогруппа.
Аралкильная группа, представленная R1, может быть, например, фенил-низший (1-4C)алкил, такой как бензил или фенетил, а арильная группа, представленная R1, является, например, фенилом.
Вышеупомянутая аралкильная или арильная группа может необязательно иметь в ее бензольном кольце в произвольном положении, например, галоген (например, F, Cl или Br), нитро, возможно замещенную аминогруппу [например, амино, N-низший (1-4C)алкил амино, или N,N-ди-низший(1-4C)алкиламино], низший (1-4C)алкокси (например, метокси, или этокси), низший (1-4C)алкилтио (например, метилтио или этилтио) или низший (1-4C) алкил (например, метил или этил).
Среди вышеупомянутых групп, представленных R1, необязательно замещенные алкильные или алкенильные группы (например, низший (1-5C) алкил или низший (2-5C)алкенил, возможно замещенный гидроксилом, аминогруппой, галогеном или низшей (1-4C) алкоксигруппой) являются предпочтительными.
Вышеупомянутая группа R1 может быть необязательно связана через гетероатом [например, азот [N(R9), (R9) означает водород или низший (1-4C)алкил] , кислород или сера [-S(О)m-(m=0 - 2)] и т.д.], среди них возможен замещенный алкил или алкенил, связанный через гетероатом (например, метиламино, этиламино, пропиламино, пропениламино, изопропиламино, аллиламино, бутиламино, изобутиламино, диметиламино, метилэтиламино, метокси, этокси, пропокси, изопропокси, пропенилокси, аллилокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, 2-бутенилокси, 3-бутенилокси, изобутенилокси, пентокси, изопентокси, гексилокси, метилтио, этилтио, пропилтио, изопропилтио, аллилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, 2-бутенилтио, 3-бутенилтио, изобутенилтио, пентилтио, изопентилтио, гексилтио, и т.д.) предпочтительны.
Примерами возможно замещенного ароматического углеводорода или гетероциклических остатков, возможно содержащих гетероатом, которые представлены Y и W, являются остатки ароматических углеводородов, таких как фенил, 4- и 7-членные моноциклические и конденсированные гетероциклические остатки, содержащие один или более атомов N, S и О, например пиридил, пиримидинил, пирадазинил, пиразинил, тиенил, фурил, пирролил, имидазолил, пиразолил, изотиазолил, изооксазолил, бензофуранил, изобензофуранил, индолизинил, изоиндолил, 3H-индолил, индолил, 1H-индазолил, пиринил, 4H-хинолизинил, изохинолил, хинолил, фтализинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил и птеридинил (предпочтительно фенил).
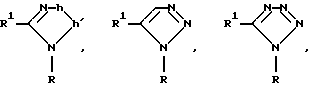
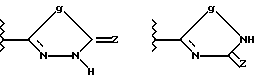
Вышеупомянутый ароматический углеводородный или гетероциклический остатки, возможно содержащие гетероатом, которые представлены в виде Y, имеют заместитель, представленный R2, примерами которого является возможно замещенный 5- и 7-членный (предпочтительно 5- и 6-членный) моноциклический гетероциклический остаток, содержащий один или более атомов N, S и О (предпочтительно N-содержащий гетероциклический остаток, имеющий атом водорода, который может протонироваться) или группу, которая может в него превращаться. Группы, представленные R2, приведены ниже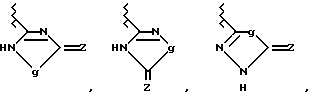


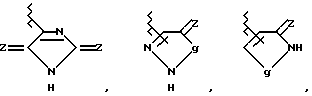






Кроме связи углерод-углерод, как это показано выше, группа, представленная R2, может быть необязательно связана с возможно замещенным ароматическим углеводородным или гетероциклическим остатком, возможно содержащим гетероатом, который представлен как Y, в случае g= -NH - в вышеприведенной формуле, через один из многих существующих атомов азота.
Например, когда R2 является группой формулы
в эту группу входят следующие представители:
Другие примеры групп R2, связанных через атом азота, являются

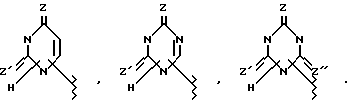
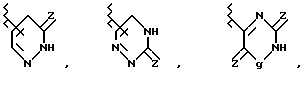
В вышеприведенных формулах q = -CH2-, -NR9-, атом О или  соответственно обозначают карбонильную, тиокарбонильную группы или возможно окисленный атом серы (например, S, S(O) и S(O2) (преимущественно карбонильная или тиокарбонильная группа, более предпочтительно карбонильная группа), m = 0, 1 или 2 и R9 обозначает атом водорода или возможно замещенный низший алкил).
соответственно обозначают карбонильную, тиокарбонильную группы или возможно окисленный атом серы (например, S, S(O) и S(O2) (преимущественно карбонильная или тиокарбонильная группа, более предпочтительно карбонильная группа), m = 0, 1 или 2 и R9 обозначает атом водорода или возможно замещенный низший алкил).
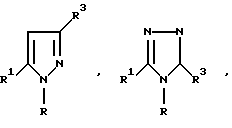
В качестве R2 предпочтительны такие группы, как оксадиазольное или тиадиазольное кольцо, содержащее - NH или -OH группу в качестве протоно-донора и карбонильную группу, тиокарбонильную группу или сульфинильную группу в качестве акцептора протонов одновременно. Когда гетероциклический остаток, представленный R2, возможно образует конденсированный цикл за счет связей заместителей цикла, предпочтительно 5- и 6-членные гетероциклические остатки, более предпочтительно 5-членные циклы. Среди прочих в качестве R2 предпочтительна группа формулы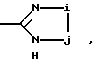
где i = -О- или -S-, j-> = O, > = S или >S(O)m, а m имеет тоже самое значение, что и в формуле обозначенной выше. В том случае, когда Y, например, фенил, R2 может иметь заместители в орто-, мета- или пара-положении, орто-положение предпочтительно.
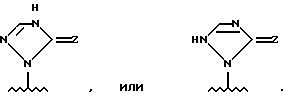
Когда вышеупомянутый гетероциклический остаток (R2) может существовать в таутомерных формах, как это показано ниже, например, в виде трех таутомеров, a', b' и c'

гетероциклический остаток, представленный формулой
включает все вышеупомянутые a', b' и c'.
И вышеупомянутый гетероциклический остаток R2 может быть необязательно замещен группой R10, как это показано ниже.
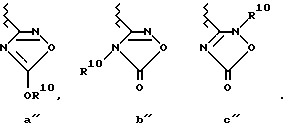
Примерами группы R10, упомянутой выше, являются группы, представленные формулой CH(R4) - OCOR5, [где R4 - водород, прямая или разветвленная низшая C1-6 алкильная группа (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил или неопентил), C2-6 прямая или разветвленная низшая алкенильная группа или C3-8 циклоалкенильная группа (например, циклопентил, циклогексил или циклогептил); R5 - C1-6 прямая или разветвленная низшая алкильная группа (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил или неопентил), C2-6 прямая или разветвленная низшая алкенильная группа, C3-8 циклоалкильная группа (например, циклопентил, циклогексил или циклогептил), C1-3 низшая алкильная группа, замещенная циклоалкильной группой C3-8 (например, циклопентил, циклогексил или циклогептил) или возможная замещенная арильная группа, такая как фенил (например, бензил, пара-хлорбензол, фенетил, циклопентилметил или циклогексилметил), C2-3 низшая алкенильная группа, замещенная циклоалкилом C3-8, или возможна замещенная арильная группа, такая как фенил (например, группа, имеющая алкенильный остаток, такая как винил (например, циннамил), пропенил, аллил или изопропенил, возможна замещенная арильная группа, такая как фенил (например, фенил, пара-толил или нафтил), C1-6 прямая или разветвленная низшая алкоксигруппа (например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси или неопентилокси), C2-8 прямая или разветвленная низшая алкенилоксигруппа (например, аллилокси или изобутенилокси), C3-8 циклоалкилокси группа (например, циклопентилокси, циклогексилокси или циклогептилокси), C1-3 низшая алкоксигруппа, замещенная циклоалкилом C3-8 (например, циклопентил, циклогексил или циклогептил) или возможна замещенная арильная группа, такая как фенил (например, группа, имеющая алкокси остаток, такая как метокси, этокси, н-пропокси или изопропокси, например бензилокси, фенетилокси, циклопентилметокси или циклогексилметилокси), C2-3 низшая алкениллоксигруппа, замещенная циклоалкилом C3-8 (например, циклопентил, циклогексил или циклогептил) или возможен замещенный арил, такой как фенил (например, группа, имеющая алкенилокси остаток, такой как винилокси (например, циннамилокси), пропенилокси, аллилокси или изопропенилокси), арилокси группа, включающая возможно замещенную феноксигруппу (например, фенокси, пара-нитрофенокси или нафтокси) и возможен замещенный алкил (например, низший (C1-4) алкил)или ацил (например, низший (C2-5) алканоил или возможен замещенный бензоил). Примерами R10 являются метил, этил, пропил, трет-бутил, метоксиметил, трифенилметил, цианоэтил, ацетил, пропионил, пивалоилоксиметил, 1-(циклогексилоксикарбонилокси) этил, 5-метил-2-оксо-1,3-диоксолен-4-илметил, ацетоксиметил, пропионилоксиметил, H-бутирилоксиметил, изобутирилоксиметил, 1-(этоксикарбонилокси) этил, 1-(ацетилокси) этил, 1-(изобутирилокси) этил, циклогексилкарбонилоксиметил, бензоилоксиметил, цианнамил и циклопентилкарбонилоксиметил). Такие группы могут включать заместители, которые способны к легкому превращению в первоначальный гетероциклический остаток, представленный формулой
или химическим или биологическим путем, т.е. в физиологических условиях (например, при реакции in vivo, такой как окисление, восстановление или гидролиз, катализируемой энзимами in vivo (то, что называется пролекарством).
Так как упомянутые выше таутомеры гетероциклических остатков (а', b' и c') и гетероциклический остаток (а'', b'' и c''), замещенный R10, включены в гетероциклические остатки, представленные в виде заместителя R2 в данном изобретении, таутомеры и их замещенные соединения различных гетероциклических остатков, описанные ниже, в действительности включены в заместитель R2 данного изобретения. А заместитель R2 может также иметь заместители, отличающиеся от заместителей, представленных R10, которые были описаны ранее, например возможна замещенная алкильная группа (например, метил, и трифенилметил), галоген (например, F, Cl и Br), нитро, циано, низшая C1-4 алкокси, и возможна замещенная аминогруппа (например, амино, метиламино и диметиламино) и другие.
Ароматические углеводородный остаток и гетероциклический остаток возможно содержащий один или более N, О или S атом, может иметь такие заместители, как галоген (например, F, Cl и Br), нитро, циано, низшую C1-4 алкокси, возможно замещенную аминогруппу (например, амино, метиламино и диметиламино).
X показывает, что примыкающее кольцо W (например, фениленовая группа) связана с кольцом Y (например, фенильной группой) прямо или через "спейсер", содержащий два или менее атомов (предпочтительна прямая связь). В качестве "спейсера" может быть любая дивалентная цепь, в которой прямую цепочку составляют один или два атома, и она может иметь боковую цепь, например низший C1-4 алкилен, -CO-, -О-, -S-, - NH-, - CO - NH-, -О- CH2 -, -S-CH2 -, и - CH=CH-.
n означает целое число, равное 1 или - 2 (предпочтительно 1).
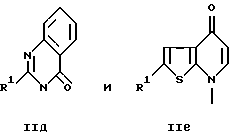
Среди соединений, обозначенных R2, W, X, Y и n, описанных выше, предпочтительны те, которые приведены на следующих формулах:
среди 
предпочтительны соединения, изображенные следующими формулами, например: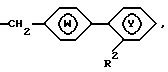

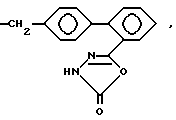
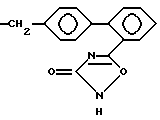
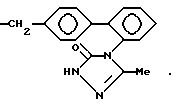
Типичные примеры гетероциклических соединений формулы
где R означает группу формулы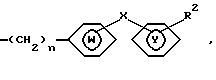
приведены ниже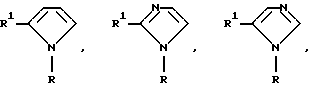





где h и n' каждый означает
>CH2, > = O, > = S, >S-(O)m, -NR9- и -O-,
а m и R9 имеют то же самое значение, что и в формулах, приведенных выше.
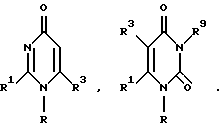
Гетероциклическое соединение, представленное вышеприведенной формулой, может быть замещено кроме группы R группой R3, которая может образовывать анион или группу, которая может в него превращаться.
Примерами группы R3, способной к образованию аниона, или группы, которая может в него превратиться, являются возможно этерифицированный или амидированный карбоксил, тетразолил, амид трифторметансульфокислоты (-NHSO2CF3), фосфорная кислота и серная кислота. Эти группы возможно могут быть защищены возможно замещенной низшей алкильной группой или ацильной группой, и это может быть любая группа, которая может образовывать анион в биологических или физиологических условиях (например, в реакции in vivo, такой как окисление, восстановление или гидролиз энзимами in vivo) или химическим путем.
Примерами возможно этерифицированных или амидированных карбоксильных групп R3 являются группы, представленные формулой -CO-D, [где D обозначает карбоксильную группу, возможно замещенную аминогруппу (например, амино, N-низшую (1-4C) алкиламино и N, N-ди-низший (1-4C)алкиламино) или возможно замещенную алкокси {например, низшая (1-6C) алкокси группа, у которой алкильный остаток возможно замещен на гидроксильную группу, возможно замещенная амино (например, амино, диметиламино, диэтиламино, пиперидино и морфолино), галоген, низшая (1-6C) алкокси, низшая (1-6C) алкилтио или возможно замещенная диоксоленильная (например, 5-метил-2-оксо- 1,3-диоксолен-4-ил) или группы, представленные формулой -O-CH(R4)-OCOR5, [где R4 обозначает водород C1-6, прямой или разветвленный алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изо-бутил, трет-бутил, н-пентил, изопентил и неопентил), C2-6 прямую или разветвленную низшую алкенильную группу или C3-8 циклоалкильную группу (например, циклопентил, циклогексил и циклогептил); R5 - прямая или разветвленная низшая C1-6 алкильная группа (например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, изопентил и неопентил), C2-6 прямая или разветвленная низшая алкенильная группа, C3-8 циклоаллильная группа (например, циклопентил, циклогексил и циклогептил), C1-3 низшая алкильная группа, замещенная циклоалкилом C3-8 (например, циклопентил, циклогексил и циклогептил) или возможно замещенная арильная группа, такая как фенил (например, бензил, пара-хлорбензол, фенетил, циклопентилметил, циклогексилметил), C2-3, низшая алкенильная группа, возможно замещенная циклоалкилом C3-8, или возможно замещенная арильная группа, такая как фенил (например, циннамил и т.д., имеющая такой алкенильный остаток, как винил, пропенил, аллил и изопропенил), арильная группа, такая как возможно замещенный фенил (например, фенил, пара-толил и нафтил), C1-6 прямая или разветвленная низшая алкоксигруппа (например, метокси, этокси н-пропокси, изопропокси, н-бутокси, изопропокси, втор-бутокси, н-пентилокси, изопентилокси и неопентокси), C2-8 прямая или разветвленная низшая алкенилокси группа (например, аллилокси и изобутенилокси), C3-8 циклоаллилокси группа (например, циклопентилокси, циклогексилокси и циклогептилокси), C1-3 низшая алкокси группа, замещенная циклоалкилом C3-8 (например, циклопентил, циклогексил и циклогептил) или арильная группа, такая как возможно замещенный фенил (например, бензилокси, фенетилокси, циклопентилметилокси и циклогексилметилокси, имеющая алкокси остаток, такой как метокси, этокси, н-пропокси и изопропокси), C2-3 низшая алкенилоксигруппа, замещенная циклоалкилом C3-8 (например, циклопентил, циклогексил и циклогептил) или арильная группа, такая как возможно замещенный фенил (например, циннамилокси, имеющий остаток алкенилокси, такой как винилокси, пропенилокси, аллилокси и изопропенилокси) и арилоксигруппа, такая как возможно замещенная фенокси группа (например, фенокси, пара-нитрофенокси и нафтокси)]}]. Примером группы R3 может также являться группа, которая может образовывать анион или группу, которая может в него превращаться (например, тетразолил, амид трифторметансульфокислоты, фосфорная кислота или сульфоновая кислота, возможно защищенные алкилом (например, низший C1-4 алкил) или ацилом (например, низший C2-5 с алканоил и возможно замещенный бензоил).
Примерами R3 являются - COOH и ее соль, - COOMe, -COOEt, -COO трет-Bu, -COOPr, пивалоилметоксикарбонил, 1-(циклогексилоксикарбонилокси) этоксикарбонил, 5-метил-2-оксо-1,3-диоксолен-4- илметоксокарбонил, ацетоксиметиллоксикарбонил, пропионилоксиметоксикарбонил, н-бутирилметоксикарбонил, изобутирилоксиметоксикарбонил, 1-(этоксикарбонилокси)этоксикарбонил, 1-(ацетокси)этоксикарбонил, 1-(изобутирилокси)этоксикарбонил, циклогексилкарбонилоксиметоксикарбонил, бензоилоксиметоксикарбонил, циннамилоксикарбонил и циклопентилкарбонилоксиметоксикарбонил. В качестве таких групп можно использовать любые группы, которые могут образовывать анион (например, COO- и ее производные) или группа, которую можно превратить в него в биологических или физиологических условиях (например, в реакции in vivo, такой как окисление, восстановление или гидролиз, катализируемый энзимами in vivo) или химическим путем. R3 может быть карбоксилом или его пролекарством. R3 может быть также группой, превращаемой в анион in vivo, например биологическим или химическим путем.
Соединение, в котором R3 является группой, которая может образовывать анион или группу, которая может превращаться в него (например, возможно защищенная карбоксильная группа, тетразолильная группа, карбоальдегидная группа, гидроксиметильная группа; цианогруппа) химически (например, путем окисления, восстановлением или гидролизом) полезны в качестве промежуточных продуктов.
Среди групп R3 предпочтительны карбоксильная, этерифицированная карбоксильная (например, метиловый эфир, этиловый эфир или эфир, образованный при связывании группы, представленной вышеупомянутой формулой -O-CH(R4) - OCOR5, к карбонилу) и возможно защищенный тетразолил, карбальдегид и гидроксиметил.
Гетероциклическое соединение, представленное формулой I, может иметь еще заместители, такие как галоген (например, F, Cl и Br), нитро, циано, возможно замещенную аминогруппу [например, амино, N-низшую(1-4C)алкиламино (например, метиламино), N, N-ди-низшую (1-4C)алкиламино (например, диметиламино), N-ариламино (например, фениламино), алициклическую амино (например, морфолино, пиперидино, пиперазино и N-фенилпиперазино)], группы, представленные формулой U-R6, [где U обозначает связь -О-, -S- или -CO-, и R6 обозначает водород, возможно замещенную низшую алкильную группу (например, низшую (1-4C) алкильную группу, замещенную гидроксилом, возможно замещенную аминогруппу (например, амино), галоген, нитро, циано или низшую (1-4C) алкоксигруппу] , группы, представленные формулой -(CH2)1-CO-D', [где D' водород, гидроксильная группа, возможно замещенная аминогруппа (например, амино, N-низший(1-4C)алкиламино и N, N-ди-низший(1-4C) алкиламино) или возможно замещенная алкоксигруппа (например, низшая (1-6C) алкоксигруппа, алкильный остаток которой возможно замещен гидроксильной группой, возможно замещенная амино (например, амино, диметиламино, диэтиламино, пиперидино и морфолино), галоген, низший (1-6C) алкокси, низший (1-6C)алкилтио или возможно замещенный диоксоленил (например, 5-метил-2-оксо-1,3- диоксолен-4-ил) или группы, представленные формулой OCH(R7)OCOR8, [где, R7 обозначает водород, 1-6C прямой или разветвленный низший алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил и неопентил) или 5-7C циклоалкил (циклопентил, циклогексил и циклогептил), R8 обозначает 1-6C прямой или разветвленный низший алкил (например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил и неопентил), 2-8C низшая алкенильная группа (винильная, пропенильная, аллильная, изопропенильная), 5-7C циклоалкильная группа (например, циклопентил, циклогексил и циклогептил), 1-3C низшая алкильная группа, замещенная 5-7C циклоалкильной группой (например, циклопентил, циклогексил и циклогептил) или арильной группой, такой как фенил (например, бензил, пара-хлорбензол, фенетил, циклопентилметил и циклогексилметил), 2-3C низшая алкенильная группа, замещенная циклоалкилом 5-7C (например, циклопентил, циклогексил и циклогептил) или арильной группой, такой как фенил (например, циннамил, имеющий такой алкенильный остаток, как винил, пропенил, аллил или изопропенил), возможно замещенная арильная группа, такая как фенил (например, фенил, пара-толил и нафтил), 1-6C прямая или разветвленная низшая алкоксигруппа (например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентилокси и неопентилокси), 2-8C прямая или разветвленная низшая алкенилокси группа (например, аллилокси и изобутенилокси), 5-7C циклоалкилокси группа (например, циклопентилокси, циклогексилокси и циклогептилокси), 1-3C низшая алкокси группа, замещенная 5-7C циклоалкилом (например, циклопентил, циклогексил и циклогептил) или арильной группой, такой как возможно замещенный фенил (например, бензилокси, фенетилокси, циклопентилметилокси и циклогексилметилокси, имеющий такой алкокси остаток, как метокси, этокси, н-пропокси и изопропокси), 2-3C алкенилокси группа, замещенная 5-7C циклоалкилом (например, циклопентил, циклогексил и циклогептил) или возможно замещенной арильной группой, такой как фенил (например, циннамиокси, имеющая алкенилокси остаток, такой как винилокси, пропенилокси, аллилокси и изопропенилокси) и арилоксигруппа, такая как возможно замещенный фенилокси (например, фенокси, паранитрилфенокси и нафтокси), а l равно 0 или 1] или тетразолил, трифторметансульфокислоты амид, фосфорная кислота или сульфоновая кислота, каждая возможно защищена алкилом (например, низший (1-4C) алкил) или ацилом (например, низший (2-5C) алканоил и возможно замещенный бензоил).
Среди соединений, обозначенных вышеупомянутой формулой (1а), предпочтительны соединения формулы
где R1 обозначает возможно замещенный низший (1-5C) алкил, который может быть связан через гетероатом (например, О, N(Н) и S) (предпочтителен низший (2-4C) алкил), R2 обозначает оксадиазол или тиадиазол, имеющие карбонильную группу, тиокарбонильную группу, необязательно окисленный атом серы или группу, способную превращаться в них, и необязательно защищенные необязательно замещенным низшим (1-4C) алкилом (например, алкил, трифенилметил, метоксиметил, ацетоксиметил, метоксикарбонилоксиметил, этоксикарбонилоксиметил, циклогексилоксикарбонилоксиэтил и пивалоилоксиметил) или ацилом (например, низший (2-5C) алканоил или бензоил), R3 обозначает группы формулы; -CO-D'' [где D'' обозначает гидроксильную группу, аминогруппу, N-низшую(1-4C)алкиламино, N,N-ди-низшую(1-4C)алкиламино или низшую (1-4C) алкокси группу, алкильный остаток которой возможно замещен гидроксилом, аминогруппой, галогеном, низшей (2-6C)алканоилокси группой (например, ацетилокси и пивалоилокси), 1- низший(1-6C) алкоксикарбонилокси (например, метоксикарбонилокси, этоксикарбонилокси и циклогексилоксикарбонилокси) или низшей (1-4C) алкокси группой] или тетразолил возможно защищенный низшей (1-4C)алкил или ацильной группой (например, низший (2-5C)алканоил или бензоил), и изображает гетероциклическое кольцо формулы
Способ получения
Соединения вышеприведенных формул (1) и (1а) могут быть получены, например, методами, приведенными ниже.
Реакция (а)
где R1, R2, W, X, Y, а, b, с и n имеют тот же смысл, что и в формулах приведенных, а L обозначает атом галогена.
Реакция (а), приведенная выше, является реакцией алкилирования с использованием алкилирующего агента в присутствии основания.
Алкилирование проводится при использовании приблизительно 1-3 молей каждого из оснований и алкилирующего агента на моль соединения (III), при использовании в качестве растворителя диметилформамида, диметилацетамида, диметилсульфоксида, ацетонитрила, ацетона или метилэтилкетона.
Примерами оснований являются гидрид натрия, трет-бутоксид калия, карбонат калия и карбонат натрия.
В качестве алкилирующего агента могут быть использованы, например, замещенными галогениды (например, хлориды, бромиды и иодиды) и эфиры замещенной сульфокислоты (например, эфир пара-толуол-сульфокислоты).
Хотя условия проведения реакции зависят от комбинации основания и алкилирующего агента, предпочтительно проводить реакцию при температуре от 0oC до комнатной в течение 1-10 часов.
При алкилировании получается смесь региоизомеров в зависимости от положения атома N. Хотя соотношение компонентов в продуктах реакции зависит от условий протекания реакции и от заместителей у гетероциклического цикла, эти соединения могут быть легко получены в виде чистых продуктов обычными методами выделения и очистки (например, перекристаллизация и колоночная хроматография).
Реакция (b)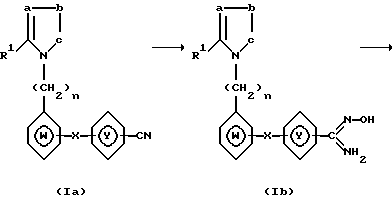

где R1, W, X, Y, а, b, c и n имеют тот же самый смысл, что и ранее).
Вышеупомянутая реакция (b) состоит в получении оксадиазольного соединения (1с) путем превращения цианосоединения (1а) в амидоксим (1b) с последующим замыканием кольца.
Реакция получения соединения (1b) проводится с использованием примерно 2-10 молей гидроксиламина на 1 моль соединения (1а) обычно в органическом растворителе.
Примерами таких растворителей являются амиды (например, диметилформамид и диметилацетамид), сульфоксиды (например, диметилсульфоксид), спирты (например, метанол и этанол), эфиры (например, диоксан и тетрагидрофуран) и галогенированные углеводороды (например, метилен хлорид и хлороформ).
При использовании гидроксиламина реакция проводится в присутствии подходящего основания (например, карбоната калия, карбоната натрия, гидроксида натрия, триэтиламина, метанолята натрия, этанолята натрия и гидрида натрия) при почти эквимолярном соотношении, при использовании соли неорганической кислоты (например, гидрохлорида гидроксил амина или сульфата гидроксил амина) или соли органической кислоты (например, оксалат гидроксил амина). Хотя условия проведения реакции зависят от природы реагентов и растворителя, реакция преимущественно проводится при 50oC - 100oC в течение 2-10 часов, после того, как гидрохлорид гидроксил амина обработан метоксидом натрия в диметилсульфоксиде.
Полученный таким образом амидоксим (1b) затем обрабатывают хлорформиатом (например, метиловым эфиром и этиловым эфиром) в обычном органическом растворителе (например, хлороформ, метиленхлорид, диоксан, тетрагидрофуран, ацетонитрил и пиридин) в присутствии основания (например, триэтиламина, пиридина, карбоната натрия и карбоната калия) с образованием - о - ацильного соединения.
Преимущественно реакция проводится при соотношении этилформиатамидоксим (1b) 2-5 моль/1 моль в присутствии 2-5 молей триэтиламина в тетрагидрофуране при 0oC до комнатной в течение 1-5 часов.
При нагревании полученного о-ацила амидоксима в обычном органическом растворителе образуется циклизованное соединение (1с).
Примерами растворителей являются ароматические углеводороды (например, бензол, толуол и ксилол), эфиры (например, диоксан и тетрагидрофуран) и галогенированные углеводороды (например, дихлорэтан и хлороформ). Предпочтительно, оксадиазол получают при нагревании о-ацил амидоксима с обратным холодильником в течение 1-3 часов в кипящем ксилоле.
Реакция (с)
Реакция (с) состоит в получении оксадиазолона (1d) при гидролизе соединения (Y), являющегося продуктом алкилирования соединения (III) алкилирующим агентом, полученным по реакции (e).
Примерами органических растворителей являются эфиры (например, диоксан и тетрагидрофуран) и спирты (например, метанол и этанол).
В качестве щелочи могут быть использованы гидроксид натрия, гидроксид калия и гидроксид лития.
Предпочтительно соединение (V) реагирует при температуре 0oC до комнатной в течение 0,5-2 часов с 2-10 молями 0,5-1 гидроксида натрия.
Реакция (d)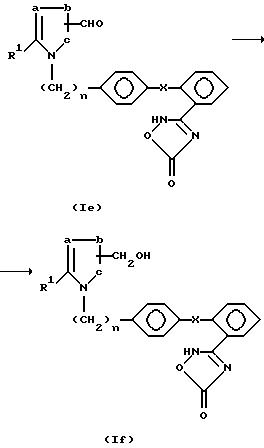
Реакция (d) состоит в получении соединения спирта (1e) при восстановлении альдегида (1f).
Реакция проводится при соотношении 2-5 молей восстановителя на 1 моль соединения (1e) обычно в эфире (например, тетрагидрофуране и диоксане) или спирте (например, метаноле и этаноле).
В качестве восстановителя могут быть использованы комплексы гидридов металлов, как например, боргидрид натрия.
Предпочтительно реакция проводится при добавлении восстановителя к раствору соединения (1e) в метаноле при температуре 0oC - комнатная с последующим перемешиванием в течение 0,5 - 2 часов.
Продукты реакций, полученные по реакциям (a)-(d), как показано выше, могут быть легко выделены обычными способами выделения и очистки, например колоночной хроматографией и перекристаллизацией.
В данном случае эти соединения (I) могут быть превращены обычными способами в соли с физиологически приемлемыми кислотами или основаниями. Например, эти соли включают соли с неорганическими кислотами, такими как соляная кислота, серная кислота и азотная кислота, и в зависимости от соединений соли с органическими кислотами, такими как уксусная кислота, азотная кислота, янтарная кислота и малеиновая кислота, соли со щелочными металлами, такими как натрий и калий и соли со щелочноземельным металлом, таким как кальций.
Исходные соединения могут быть получены следующими способами.
Реакция (e)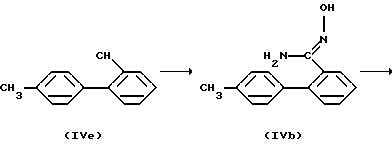

где L имеет то же значение, что и раньше.
Соединение (IVd) получают по реакции (e) превращением соединения (IVa), содержащего циано-группу в альдоксим (IVb) в тех же условиях, что и при проведении реакции (b), с последующей циклизацией альдоксима (IVb), с образованием оксадиазола (IVc), сопровождающееся галогенированием оксадиазола (IVc).
Следующий пример является предпочтительным примером осуществления реакции.
Альдоксим (IVb) получен из соединения (IVa) взаимодействием от 1 до 10 молей ангидрида трихлоруксусной кислоты или гексахлорацетона с 1 молем альдоксима (IVb) в соответствии со способом, описанным в литературе [F. Eloy, et al., Helv. Chim. Acta, 49, 1430 (1966)], с образованием оксадиазола (IVc), затем (IVc) галогенируют таким агентом, как N-бромсукцинимид, или N-бромацетамид (молярное отношение от 1/1 до 1/1,5) в галогенированном углеводороде, (например, четыреххлористом углероде) при температуре от 50oC до температуры кипения растворителя от 1 до 3 часов, в присутствии каталитического количества инициатора (например, перекиси бензоила и азобисизобутиронитрила). Эта реакция может проводиться при облучении светом.
Реакция (f)
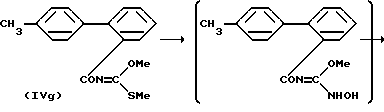


где R13 произвольно замещенная алкильная группа, продемонстрированная вышеупомянутой R10 (например, трифенилметил, метоксиметил и цианоэтил) или трет-бутилдиметилсилильная группа и L имеет то же значение, что и ранее.
Реакция (f) получения оксадиазола (IVh) включает добавление карбоновой кислоты (IVe) к ацилизотиоцианату приемлемым способом, взаимодействие последнего со спиртом, с образованием карбонилтиокарбамата (IVf), метилированию соединения (IVf) с образованием карбоната (IVg), взаимодействие соединения (IVg) с гидроксиламином, с последующей циклизацией при нагревании.
При осуществлении реакции получения карбонилтиокарбамата (IVf) из карбоновой кислоты (IVe) соединение (IVe) вводят в реакцию с галогенирующим агентом (например, хлористым тионилом) (молярное отношение = 1: приблизительно от 2 до 5) в галогенированном углеводороде (например, хлороформе или хлористом метилене) в течение 1-5 часов при температуре от 50oC до температуры кипения применяемого растворителя. Полученный хлорангидрид кислоты вводят в реакцию с 2-5 молями тиоцианата (например, солью натрия или солью калия) в эфире (например, в диоксане и тетрагидрофуране) при температуре от 50oC до температуры кипения применяемого растворителя, в течение 1-3 часов, с образованием изоцианата. Предпочтительно подвергнуть полученный таким образом изотиоцианат нагреванию, совместно с 2-10 молями спирта (например, метанола и этанола) при 50oC до температуры кипения применяемого растворителя в течение от 15 минут до 1 часа.
В реакции получения иминотиокарбоната (IVg) из соединения (IVf) предпочтительно вводить соединение (IVf) в реакцию с метилиодидом (молярное отношение = 1: от 1 до 2) в органическом растворителе (например, метаноле, этаноле, диметилформамиде (ДМФ) и ацетонитриле), в присутствии от 1 до 2 молей, по отношению к одному молю (IVf) основания (например, NaOMe, Na2CO3 и K2CO3) при температуре от комнатной до 50oC в течение 10-24 часов.
При проведении реакции получения оксадиазола (IVh) из соединения (IVg) предпочтительно вводить (IVg) в реакцию с гидроксиламином (молярное отношение=1: приблизительно от 1 до 2) в спирте (например, метаноле или этаноле) при температуре от комнатной до 50oC в течение приблизительно 10-20 часов, с последующим нагреванием реакционной смеси в органическом растворителе (например, толуоле и бензоле) в присутствии приблизительно каталитического количества кислоты (например, п-толуолсульфокислоты) при температуре от 50oC до температуры кипения применяемого растворителя в течение 1-3 часов.
При проведении реакции получения диметилированного соединения (IVi) из соединения (IVh) предпочтительно подвергнуть избыточное количество пиридинийхлорида и (IVh) плавлению в атмосфере азота при температуре около 150-160oC в течение приблизительно от 30 минут до 1 часа.
При проведении реакции получения соединения (IVj) из соединения (IVi) предпочтительно осуществлять взаимодействие соединения (IVi) с алкилирующим агентом, например трифенилметилхлоридом, метоксиметилхлоридом и цианоэтилхлоридом (молярное отношение = 1: около 1 до 2 в органическом растворителе (например, хлороформе, хлористом метилене, диоксане, тетрагидрофуране и пиридине) в присутствии от 1 до 2 молей основания (например, карбоната калия, карбоната натрия, триэтиламина и пиридина) при температуре от 0oC до комнатной температуры в течение от 1 до 3 часов.
Реакция получения соединения (IVk) галогенированием соединения (IVj) может быть осуществлена способом, что и реакция получения соединения (IVd) из соединения (IVc) по реакции (e).
Реакция (g)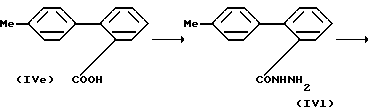


где R13 и L имеют то же самое значение, что и раньше.
Реакция (g) включает превращение карбоновой кислоты (IVe) в семикарбазид (IVm) через гидразид (IVl) приемлемым способом, затем осуществление дегидроциклизации (IVm), с образованием оксадиазола (IVn), в дальнейшем превращение (IVn) приводит к галогеносодержащему соединению (IVp).
При проведении реакции получения гидразида (IVl) из карбоновой кислоты (IVe) (IVe) реагирует приблизительно с 2-5 молями галогенирующего агента (например, оксалилхлоридом и тионилхлоридом) в органическом растворителе, например тетрагидрофуране, хлороформе и метиленхлориде при температуре от комнатной до температуры кипения применяемого растворителя в течение от 1 до 20 часов. В этом случае предпочтительно добавлять каталитическое количество диметилформамида для ускорения реакции. Образующийся галогенангидрид кислоты вводят в реакцию с приблизительно 2-5 молями гидразингидрата в органическом растворителе (например, тетрагидрофуране и диоксане) при температуре от комнатной до 50oC в течение 1-10 часов с образованием соединения (IVl). При проведении реакции получения семикарбазида (IVm) из гидразида (IVl), предпочтительно вводить в реакцию (IVe) с приблизительно 2-5 молями изоцианата (например, натриевой или калиевой солью) в водном растворе в присутствии кислоты (например, соляной или серной кислоты) в количестве, эквивалентном количеству используемого изоцианата при температуре от 0oC до комнатной температуры в течение от 1-5 часов.
При проведении реакции получения оксадиазола (IVn) из семикарбазида (IVm), предпочтительно нагревать (IVm) в органическом растворителе (например, бензоле и ксилоле) при температуре кипения растворителя в течение 5-20 часов.
При проведении реакции получения галогеносодержащего соединения (IVp) из оксадиазола (IVn) ее предпочтительно проводить способом, аналогичным описанному для реакции (f).
Реакция (h)
Реакция (h) получения амида (IVg) проводится по существу тем же способом, что и при проведении реакции (g).
Карбоновую кислоту (IVe) вводят в реакцию с приблизительно 2-5 молями галогенирующего агента (например, оксалилхлорида или тионилхлорида) в органическом растворителе (например, тетрагидрофуране, хлороформе или хлористом метилене) при температуре от комнатной до температуры кипения применяемого растворителя в течение около 1-20 часов. Предпочтительно ускорять эту реакцию добавлением каталитических количеств диметилформамида. Образующийся галогенангидрид кислоты предпочтительно вводить в реакцию с избыточным количеством водного гидроксида аммония в органическом растворителе (например, тетрагидрофуране или диоксане) при температуре от 0oC до комнатной температуры в течение приблизительно 1-10 часов с хорошим выходом производного амида (IVq).
Реакцию получения галогенопроизводного (IVг) из полученного производного амида (IVq) предпочтительно проводить по существу тем же способом, что и в случае реакции (e) или (f).
Соединения (I) и их соли менее токсичны, являются более эффективными ингибиторами против сосудосуживания и гипертензивного действия ангиотензина II, способствует гипотензивному эффекту у животных, особенно у теплокровных, например у человека, собаки, кролика и крысы и, следовательно, они полезны в качестве терапевтических средств не только в случае гипертензии, но также и в случае болезней кровеносной системы, таких как нарушение сердечной деятельности (гипертрофия сердца, сердечная недостаточность, инфаркт сердца или подобные расстройства), кровоизлияние мозга и нефропатия. Соединение (I) также обладает CNS активностью для лечения болезни Альцгеймера и старческого слабоумия и обладает свойствами транквилизатора и антидепрессанта.
В случае применения в качестве терапевтического средства, особенно в случае, отмеченном выше, соединение I и его соли могут вводиться орально, неорально, посредством ингаляции, ректально или местно в качестве фармацевтических составов или форм, например порошков, гранул, таблеток, пилюль, капсул, инъекций, сиропов, эмульсий, элексиров, суспензий или растворов, включая, по крайней мере, одну из разновидностей соединений данного изобретения в чистом виде, или в смеси с фармацевтически приемлемыми переносчиками, адьювантами, наполнителями и/или разбавителями.
Фармацевтические композиции могут быть сформулированы в соответствии с обычными операциями. В настоящей спецификации понятие "неорально" включает подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию или закапывание. Препараты для инъекций, например стерильные пригодные для инъекции водные или масляные суспензии, могут быть получены известным в этой области способом, с применением подходящего дисперсанта, смачивающего или диспергирующего агента. Инъекции могут находиться в виде, например, раствора или суспензии, которые могут быть получены с нетоксичным разбавителем, принимаемым неорально, например в виде водного раствора, или с растворителем, пригодным для получения стерильной инъекции. Пример используемых наполнителей или приемлемых растворителей включают воду, раствор Рингера и изотонический водный соляной раствор. Далее стерильное, нелетучее масло обычно может быть использовано в качестве растворителя или суспендирующего агента. Любое нелетучее масло или жирная кислота может быть использована для этой цели, в том числе природное, синтетическое или искусственное жирное масло или жирная кислота или синтетическое или искусственные моно-, ди- или триглицериды.
Ректальные суппозитории могут быть приготовлены смешиванием лекарства с приемлемым нераздражающим носителем, например кокосовым маслом и полиэтиленгликолем, находящимся при обычной температуре в твердом состоянии, в жидком состоянии при температуре кишечника и плавится в прямой кишке, с освобождением лекарства.
В качестве твердой формы для орального приема могут быть использованы порошки, гранулы, таблетки, пилюли и капсулы, как было отмечено выше. В таких формах, примеры которых приведены выше, активный компонент соединения может быть смешан с по крайней мере одной добавкой, например сахарозой, лактозой, целлюлозным сахаром, маннитом, солодовым сахаром, декстрином, крахмалом, агаром, альгинатом, хитином, хитозаном, пектином, смолой трагаканта, гуммиарабиком, желатином, коллагеном, казеином, альбумином, синтетическим или искусственным полимером или глицеридом. Эти формы могут содержать дальнейшие добавки, например неактивный разбавитель, смазывающее вещество, такое как стеарат магния, предохранительный дизинтегратор, связывающее вещество, загуститель, буфер, подсластитель, вкусовую и ароматизирующую добавку. Таблетки и пилюли могут применяться с покрытием. Примеры жидких препаратов для орального приема включают фармацевтически приемлемые эмульсии, сиропы, эликсиры, суспензии и раствор, который может содержать неактивный разбавитель, например воду, которую обычно применяют в рассматриваемой области.
Доза для каждого пациента назначается в зависимости от его возраста, веса, общего состояния здоровья, пола, промежутка между приемом, способов приема, скорости выведения, комбинаций лекарств и протекания заболеваний, которые ими лечат и других факторов, которые необходимо принимать во внимание.
Доза может изменяться в зависимости от характера болезней, условий их протекания, состояния пациентов и способов приема, при этом предпочтительно, чтобы ежедневная доза составляла от 1 до 50 мг для орального приема или от 1 до 30 мг для внутривенной инъекции, которая может быть принята однократно или может быть разбита на 2-3 приема, при использовании в качестве терапевтического средства от гипертензии взрослого человека.
Рабочие примеры
Следующими формульными примерами, рабочими примерами, экспериментальными примерами и сравнительными примерами данное изобретение иллюстрируется более конкретно и нет необходимости говорить, что они не могут рассматриваться как ограничения данного изобретения.
Когда соединение (1) данного изобретения используется в качестве терапевтического средства для лечения циркулирующих нарушений, таких как гипертония, болезни сердца, церебральный паралич и нефрит, оно может быть использовано, например, в соответствии со следующими прописями.
1. Капсулы
(1) 2-этокси-1-[[2'-(2,5-дигидро-5-оксо-1,2,4- оксадиазол-3-ил)бифенил-4-ил]метил] бензимидазол-7-карбоновая кислота 10 мг
(2) лактоза 90 мг
(3) микрокристаллическая целлюлоза 70 мг
(4) стеарат магния 10 мг
одна капсула 180 мг
(1), (2), (3) и половину (4) перемешивают и гранулируют. К гранулам добавляют остаток (4) и все это помещают в желатиновые капсулы.
2. Таблетки
(1) 2-этокси-1- [[2'-дигидро-5-оксо-1,2,4- оксадиазол-3-ил) бифенил-4-ил] метил] бензимидазол-7-карбоновая кислота 10 мг
(2) лактоза 35 мг
(3) пшеничный крахмал 150 мг
(4) микрокристаллическая целлюлоза 30 мг
(5) стеарат магния 5 мг
одна таблетка 230 мг
(1), (2), (3), две трети (4) и половину (5) перемешивают и гранулируют. К гранулам добавляют остаток (4) и (5), с последующей отливкой полученной смеси под давлением.
3. Инъекции
1) 2-этокси-1-[[2'-(2,5-дигидро-5-оксо- 1,2,4-оксадиазол-3-ил)-бифенил-4-ил]метил бензимидазол-7- карбоновой кислоты динатриевая соль 10 мг
2) инозитол 100 мг
3) бензиловый спирт 20 мг
одна капсула 130 мг
(1), (2) и (3) растворяют в дистиллированной воде для инъекции, до получения полного объема 2 мл, которым заполняют ампулу. Все операции проводят в стерильных условиях.
4. Капсулы
(1) 2-бутил-4-хлоро-5-гидроксиметил-1-[[2'- (2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)бифенил-4-ил] метил] имидазол 10 мг
(2) лактоза 90 мг
(3) микрокристаллическая целлюлоза 70 мг
(4) стеарат магния 10 мг
одна капсула 180 мг
(1), (2), (3) и половину (4) перемешивают и гранулируют. К гранулам добавляют остаток (4) и всем этим заполняют желатиновые капсулы.
5. Таблетки
(1) 2-бутил-4-хлоро-5-гидроксиметил-1-[[2'- (2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил] метил] имидазол 10 мг
(2) лактоза 35 мг
(3) пшеничный крахмал 150 мг
(4) микрокристаллическая целлюлоза 30 мг
(5) стеарат магния 5 мг
одна таблетка 230 мг
(1), (2), (3), две трети (4) и половину (5) перемешивают и гранулируют. К гранулам добавляют остаток (4) и (5) с последующей отливкой смеси под давлением
6. Инъекции
(1) 2-бутил-4-хлоро-5-гидроксиметил-1-[[2'- (2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил] метил]имидазола натриевая соль 10 мг
(2) инозитол 100 мг
(3) бензиловый спирт 20 мг
одна ампула 130 мг
(1), (2) и (3) растворяют в дистиллированной воде для инъекции, с получением общего объема 2 мл, который заливают в ампулу. Все операции проводят в стерильных условиях.
7.
Капсулы (1) 2-этокси-1-[[2'-(2,5-дигидро-5-оксо-1,2,4- тиадиазол-3-ил)бифенил-4-ил]метил] бензимидазол-7-карбоновая кислота 10 мг
(2) лактоза 90 мг
(3) микрокристаллическая целлюлоза 70 мг
4) стеарат магния 10 мг
одна капсула 180 мг
1), (2), (3) и половину (4) перемешивают и гранулируют. К гранулам добавляют остаток (4) и всем этим заполняют желатиновые капсулы.
8. Таблетки
(1) 2-этокси-1-[[2'-(2,5-дигидро-5-оксо-1,2, 4-тиадиазол-3-ил)-бифенил-4-ил]метил] бензимидазол-7-карбоновая кислота 10 мг
(2) лактоза 35 мг
(3) пшеничный крахмал 150 мг
(4) микрокристаллическая целлюлоза 30 мг
(5) стеарат магния 5 мг
одна таблетка 230 мг
(1), (2), (3), две трети (4) и половину (5) перемешивают и гранулируют. К гранулам добавляют остаток (4) и (5), с последующей отливкой смеси под давлением.
9. Инъекции
1) 2-этокси-1-[(2'-(2,5-дигидро-5-оксо-1,2, 4-тиадиазол-3-ил)-бифенил-4-ил]метил] бензимидазол-7-карбоновой кислоты динатриевая соль 10 мг
(2) инозитол 100 мг
(3) бензиловый спирт 20 мг
одна капсула 130 мг
(1), (2) и (3) растворяют в дистиллированной воде для инъекции до получения общего объема 2 мл, которым заполняют ампулу. Все операции проводят в стерильных условиях.
Рабочий пример 1
Этил 2-этил-4,7-дигидро-7-[[2'-(2,5- дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил]метил]-4- оксотиено[2,3-b] пиридин-5-карбоксилат
1а) Этил 7-[[2'-(5- трисхлорометил-1,2,4-оксодиазол-3-ил) бифенил-4-ил] метил]-2- этил-4,7-дигидро-4-оксотиено[2,3-b] пиридин-5-карбоксилат
К охлажденному льдом раствору этил 2-этил-4-гидрокситиено[2,3- b]пиридин-5-карбоксилата (0,25 г) в N,N-диметилформамиде (ДМФ) (7 мл) добавляли в атмосфере азота гидрид натрия (60% в масле; 40 мг) и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли раствор соединения, полученного в Рабочем примере (3c) (0.6 г) в N,N-диметилформамиде (4 мл) и смесь перемешивали в течение двух часов при комнатной температуре. Реакционную смесь концентрировали досуха при пониженном давлении. К остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили, растворитель выпаривали досуха при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, с образованием указанного соединения в виде белого порошка (0,5 г, 83%).
1H-ЯМР (200 МГц, CDCl3) δ: 1,32 (3Н, т), 1,41 (3Н, т), 2,82 (2Н, д-к), 4,40 (2Н, к), 5,22 (2Н, с), 7,23-7,33 (5Н, м), 7,43-7,65 (3Н, м), 7,93-7,98 (1Н, м), 8,39 (1Н, с).
ИК (KBr) см-1: 2975, 1672, 1580, 1493.
1b) Этил 2-этил-4,7-дигидро-7-[[2'-(2,5-дигидро-5-оксо- 1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]-4-оксотиено [2,3-b] пиридин-5-карбоксилат
К охлажденному льдом раствору соединения (0,49 г), полученному в Рабочем примере (1а) в смеси диоксана (8 мл), тетрагидрофурана ТГФ (8 мл) и воды (4 мл) добавляли 1 N NaOH (0,9 мл). После перемешивания в течение 40 минут при охлаждении льдом к смеси добавляли 1 N NaOH (0,4 мл) и смесь перемешивали в течение 20 минут при охлаждении льдом. К реакционной смеси добавляли 1 N-HCl (2,0 мл) и воду, затем смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили, затем растворитель выпаривали досуха при пониженном давлении. Остаток кристаллизовали из метанола, с получением указанного соединения в виде бесцветных кристаллов (0,278 г 68%), т.пл. 243-235oC.
Элементный анализ C27H23N3O5:
Рассчитано, %: C 64,66; H 4,62; N 8,38;
Найдено,%: C 64,70; H 4,70; N 8,33.
1H-ЯМР (200 МГц, DМСО-d6) δ: 1,22 (3Н, т), 1,29 (3Н,т), 2,79 (2Н, д-к), 4,23 (2Н, к), 5,50 (2Н, с), 7,10 (1Н, т), 7,31-7,40 (4Н, м), 7,50-7,73 (4Н, м), 8,77 (1Н, с), 12,37 (1Н, шир.с.)
ИК (KBr) см-1: 3430, 2980, 1782, 1727, 1602, 1542, 1500.
Рабочий пример 2
3-[[2'-(2,5-дигидро-5-оксо-1,2,4- оксадиазол-3-ил)бифенил-4-ил]метил]-2-пропил-4(3Н)-хиназолинон
2а) 3-[[2'-(5-трихлорметил-1,2,4-оксадиазол-3-ил) бифенил- 4-ил]метил] -2-пропил-4-(3Н)-хиназолинон
К охлажденному льдом раствору 2-пропил-4(3Н)-хиназолина (0,283 г) в N,N -диметилформамиде (8 мл) добавили в атмосфере азота гидрид натрия (60% в масле; 60 мг) и при той же температуре смесь перемешивали в течение 30 минут. К реакционной смеси добавляли раствор соединения (0,78 г), полученного в рабочем примере (3 с), в N,N -диметилформамиде (5 мл) и перемешивали в течение 4 часов при комнатной температуре. Реакционную смесь сконцентрировали до сухости при пониженном давлении и к смеси добавили воду с последующей экстракцией этилацетатом. Органический слой промыли водой и высушили, а растворитель упарили до сухости при пониженном давлении. Осадок очистили с помощью колоночной хроматографии на силикагеле и получили указанное соединение в виде бесцветного масла (0,5 г, 62%).
1H-ЯМР (200 МГц, CDCl3) δ: 1,02 (3Н, т), 1,75- 1,94 (2Н, м), 2,75 (2Н, т), 5,44 (2Н, с), 7,16 (2Н, д), 7,22 (2Н, д), 7,41-7,79 (6Н, м), 7,87-7,92 (1Н, м), 8,28-8,32 (1Н, м).
ИК (чистый) см-1: 2960, 1668, 1595, 1567.
2b) 3-[[2'-(2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)- бифенил-4-ил]метил]-2-пропил-4(3Н)-хиназолинон
К смеси соединения (0,42 г), полученного в рабочем примере (2а), со смесью диоксана (6 мл) и воды (1,5 мл) при охлаждении льдом добавили 1N - NaOH (1,0 мл). Смесь при охлаждении льдом перемешали в течение 30 минут. К реакционной смеси добавили 1N HCl (2,0 мл) и воду, а затем смесь проэкстрагировали этилацетатом. Органический слой промыли водой и высушили, а растворитель упарили до сухости при пониженном давлении. Осадок перекристаллизовали из смеси этилацетат-эфир и получили указанное соединение в виде бесцветных кристаллов (0,311 г, 91%), т.пл. 251-253oC.
Элементный анализ для C26H22N4O3:
Вычислено%: C 71,22; H 5,06; N 2,78.
Найдено,%: C 70,93; N 5,04; N 12,72.
1H-ЯМР (200 МГц, DМСО-d6) δ: 0,91 (3Н, т), 1,63-1,82 (2Н, м), 2,74 (2Н, т), 5,45 (2Н, с), 7,24 (2Н, д), 7,31 (2Н, д), 7,49-7,74 (6Н, м), 7,80-7,88 (1Н, м), 8,16-8,20 (1Н, м), 12,38 (1Н, ш, с).
ИК (KBr) см-1: 3120, 2970, 1768, 1638, 1605, 1590.
Рабочий пример 3
2-бутил-4-xлop-5-фopмил-1-[[2'- (2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)бифенил-4- ил]метил]имидазол
3а) 4'-метилбифенил-2-карбоксамидоксим
К раствору гидрохлорида гидроксиламина (17,9 г) в диметилсульфоксиде (120 мл) добавили метанольный раствор метилата натрия, полученного из металлического натрия (5,92 г) и безводного метанола (50 мл). Смесь перемешали 10 минут при комнатной температуре и добавили 2'-циано-4-метилбифенил (10 г). Реакционную смесь перемешали в течение 5 часов при 100oC. Реакционную смесь затем разделили между этилацетатом и водой. Водный раствор экстрагировали этилацетатом. Органические слои объединили, промыли водой и высушили, а затем растворитель выпарили в вакууме. Осадок очистили на хроматографической колонке с силикагелем и получили указанное соединение в виде аморфного продукта (11,2 г, 96%).
1H-ЯМР (200 МГц, CDCl3) δ: 2,39 (3Н, с), 4,42 (2Н, ш с), 7,22 (2Н, д), 7,31-7,50 (5Н, м), 7,56-7,60 (1Н, м).
ИК (KBr) см-1: 3490, 3380, 1642, 1575, 1568.
3b) 5-трихлорметил-3-(4'-метилбифенил-2-ил)-1,2,4-оксадиазол
К раствору соединения (10 г), полученного по рабочему примеру (3а), в бензоле (100 мл) по каплям добавили трихлоруксусный ангидрид и реакционную смесь затем кипятили 2 часа с обратным холодильником. Реакционную смесь охладили и сконцентрировали до сухости. Остаток распределили между эфиром и водой. Водный слой проэкстрагировали эфиром. Органические слои объединили, промыли водой и высушили, а затем растворитель выпарили при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и получили указанное соединение в виде палево-желтого масла (12 г, 77%).
1H-ЯМР (200 МГц, CDCl3) δ: 2,38 (3Н, с), 7,16 (4Н, с), 7,44-7,64 (3Н, м), 7,88-7,93 (1H, м).
ИК (чистый) см-1: 3025, 1600, 1580, 1561, 1508.
3с) 3-(4'-бромметилбифенил-2-ил)-5-трихлорметил-1,2,4-оксадиазол
К раствору соединения (24,8 г), полученного в рабочем примере (3в), в четыреххлористом углероде (300 мл) добавили N-бромсукцинимид (12,5 г) и α,α′ -азобисизобутиронитрил (1,15 г) и смесь прокипятили 2 часа с обратным холодильником. Реакционную смесь охладили и нерастворимые материалы, отфильтровали. Фильтрат растворили в дихлорметане. Органический слой промыли водой и высушили, а растворитель выпарили при пониженном давлении. Остаток перекристаллизовали из эфир-гексановой смеси и получили указанное соединение в виде бесцветных кристаллов (23,0 г, 76%), т.пл. 77-79oC.
Элементный анализ для C16H10N2OBrCl3•0,5H2О:
Рассчитано %: C 43,52; H 2,51; N 6,34;
Найдено %: C 43,76; H 2,33; N 6,31.
1H-ЯМР (200 МГц, CDCl3) δ: 4,52 (2Н, с), 7,23 (2Н, д), 7,38 (2Н, д), 7,44-7,65 (3Н, м), 7,91-7,95 (1Н, м).
ИК (KBr) см-1: 1600, 1560, 1475, 1428, 1332.
(3d) 2-бутил-4-хлор-1-[[2'-(5-трихлорметил-1,2,4- оксадиазол-3-ил) бифенил-4-ил]метил]-5-формилимидазол
К охлажденному раствору металлического натрия (25 мг) в безводном метаноле (2 мл) по каплям добавили раствор 2-бутил-4-хлор-5-формилимидазола (0,2 г) в метаноле (3 мл) в атмосфере азота. Смесь перемешали 1 час при комнатной температуре и сконцентрировали до сухости. К раствору остатка в N, N-диметилформамиде (2 мл) по каплям добавили раствор соединения (0,56 г), полученного в рабочем примере (3с), в N,N-диметилформамиде (3 мл) при охлаждении смеси льдом. Реакционную смесь перемешали 2,5 часа при комнатной температуре и сконцентрировали до сухости при пониженном давлении. К остатку добавили воды и смесь проэкстрагировали этилацетатом. Органический слой промыли водой и высушили, а растворитель выпарили при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и получили указанный продукт в виде бесцветного масла (0,44 г, 76%).
1H-ЯМР (200 МГц, CDCl3) δ: 0,91 (3Н, т), 1,28-1,46 (2Н, м), 1,63-1,78 (2Н, м), 2,65 (2Н, т), 5,59 (2Н, с), 7,05 (2Н, д), 7,23 (2Н, д), 7,41-7,65 (3Н, м), 7,90-7,95 (1Н, м), 9,77 (1Н, с).
ИК (чистый) см-1: 2960, 1670, 1652, 1580, 1565, 1510.
3e) 2-бутил-4-xлop-1-[[2'-(2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил]метил]-5-формилимидазол
К раствору соединения, полученного в рабочем примере (3d), в смеси диоксана (4 мл) и воды (1 мл) добавили 1N - NaOH (0,75 мл) при охлаждении льдом. Смесь при охлаждении льдом перемешали 30 минут. К реакционной смеси добавили 1N-HCl (1 мл) и воду, а затем проэкстрагировали этилацетатом. Органический слой промыли водой, высушили, а растворитель выпарили при пониженном давлении. Остаток перекристаллизовали из смеси эфир-гексан и получили указанное соединение в виде белых кристаллов (0,225 г, 87%), т.пл. 181-183oC.
Элементный анализ для C23H21N4O3Cl•0,2H2O:
Рассчитано, %: C 62,71; H 4,90; N 12,72.
Найдено, %: C 62,71; H 4,79; N 12,62.
1H-ЯМР (200 МГц, CDCl3) δ: 0,91 (3Н, т), 1,29-1,48 (2Н, м), 1,63-1,79 (2Н, м), 2,68 (2Н, т), 5,55 (2Н, с), 7,10 (2Н, д), 7,31 (2Н, д), 7,38-7,67 (3Н, м), 7,80 (1Н, дд), 8,50 (1Н, ш), 9,68 (1Н, с).
ИК (KBr) см-1: 2960, 1772, 1673, 1522, 1490, 1460.
Рабочий пример 4
2-бутил-4-xлop-1-[[2'-(2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил) -бифенил-4-ил]метил]-5-гидроксиметилимидазол
К раствору соединения (0,15 г), полученного в рабочем примере (3с) в смеси метанола (3 мл) и тетрагидрофурана (2 мл), добавили гидроксид натрия (16 мг) и смесь перемешали при комнатной температуре 1 час. К реакционной смеси добавили смесь лед-вода и смесь проэкстрагировали этилацетатом. Органический слой промыли водой, высушили, а растворитель выпарили в вакууме при пониженном давлении. Остаток перекристаллизовали из смеси эфир-гексан и получили указанное соединение в виде белых кристаллов (67 мг, 45%), т.пл. 202-205oC. Элементный анализ для C23H23N4O3Cl•0,1Et2O•0,5H2O:
Рассчитано, %: C 61,73; H 5,53; N 12,30.
Найдено, %: C 61,81; H 5,56; N 12,07.
1H-ЯМР (200 МГц, DМСО-d6) δ: 0,80 (3Н, т), 1,16-1,34 (2Н, м), 1,40-1,55 (2Н, м), 2,45-2,52(2Н, м), 4,34-4,36 (2Н, м), 5,25 (1H, ш), 5,29 (2Н, с), 7,14(2Н, д), 7,30(2Н, д), 7,48-7,72(4Н, м).
ИК (KBr) см-1 3470, 2960, 1755, 1501, 1463.
Рабочий пример 5
5-бутил-3-этoкcикapбoнил-1-[[2'-(2,5- дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил]метил]пиразол
5a) 5-бутил-3-этoкcикapбoнил-1-[[2'-(5-трихлорметил-1,2,4-оксадиазол- 3-ил)бифенил-4-ил]метил]пиразол
К охлаждаемому льдом раствору 3-бутил-5-этоксикарбонил-пиразол (0,3 г) и соединения (0,95 г), полученного в рабочем примере (3с), в безводном тетрагидрофуране (10 мл) в атмосфере азота добавили гидрид натрия (60%, 61 мг). Смесь перемешали 10 минут при комнатной температуре и затем кипятили 3 часа с обратным холодильником. Реакционную смесь охладили, добавили воду и проэкстрагировали этилацетатом. Органический слой промыли водой и высушили, а растворитель выпарили при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и получили указанное соединение в виде палево-желтого масла (0,29 г, 35%).
1H-ЯМР (200 МГц, CDCl3) δ: 0,89 (3Н, т), 1,26-1,44 (2Н, м), 1,40 (3Н, т), 1,50-1,68 (2Н, м), 2,49 (2Н, т), 4,41 (2Н, к), 5,41 (2Н, с), 6,64 (1Н, с), 7,08 (2Н, д) 7,20 (2Н, д), 7,40-7,63 (3Н, м), 7,88-7,92 (1Н, м).
ИК (чистый) см-1: 2950, 1715, 1578, 1565.
5b) 5-бутил-3-этоксикарбонил-1-[[2'-(2,5-дигидро-5-оксо-1,2,4- оксодиазол-3-ил) бифенил-4-ил]метил]пиразол
К раствору соединения (0,27 г), полученного в рабочем примере (5а), в смеси диоксана (4 мл) и воды (1 мл) при охлаждении льдом добавили 1N - NaOH (0,6 мл). Смесь при охлаждении льдом перемешали 20 минут. К реакционной смеси добавили 1N-HCl (0,9 мл) и воду, а затем смесь проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и сконцентрировали до сухости при пониженном давлении. Остаток перекристаллизовали из смеси эфир-гексан и получили указанное соединение в виде бесцветных кристаллов (0,176 г, 80%), т.пл. 166-168oC. Элементный анализ для C25H26N4O4:
Рассчитано, %: C 67,25; H 5,87; N 12,55.
Найдено, %: C 66,99; H 5,91; N 12,45.
1H-ЯМР (200 МГц, CDCl3) δ: 0,91 (3Н, т), 1,28-1,46 (2Н, м), 1,37 (3Н, т), 1,53-1,68 (2Н, м), 2,56(2Н, т), 4,35 (2Н, к), 5,36 (2Н, с), 6,64 (1Н, с), 7,15 (2Н, д), 7,30 (2Н, д), 7,37-7,65 (3Н, м), 7,79-7,83 (1Н, м), 8,49 (1Н, ш).
ИК (KBr) см-1: 2960, 1777, 1725, 1600, 1485.
Рабочий пример 6
2-бутил-4-хлор-1-[[2'-(2,5-дигидро-5- оксо-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]имидазол-5- карбоновая кислота
К раствору соединения (0,27 г), полученного в рабочем примере (3e), в пиридине (5 мл) добавили водный раствор (2,5 мл) перманганата калия (0,147 г). Смесь перемешали три часа при комнатной температуре. 3атем реакционную смесь сконцентрировали до сухости при пониженном давлении. К остатку добавили этилацетат и разбавленную соляную кислоту. Результирующую суспензию отфильтровывали через целит. Фильтрат проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и сконцентрировали до сухости при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и продукт кристаллизовали из смеси этилацетат-изопропиловый эфир с получением указанного соединения в виде бесцветных кристаллов (0,17 г, 61%), т.пл. 188-189oC (разложение). Элементный анализ для C23H21N4O4Cl•0,1AcOEt•2,9H2O:
Рассчитано, %: C 54,69; H 5,41; N 10,90.
Найдено, %: C 54,91; H 5,17; N 10,62.
1H-ЯМР (200 МГц, DМСО-d6) δ: 0,80 (3Н, т), 1,16-1,35 (2Н, м), 1,43-1,58 (2Н, м), 2,46-2,53 (2Н, м), 5,80 (2Н, с), 6,95 (2Н, д), 7,25 (2Н, д), 7,29-7,51 (4Н, м).
ИК (KBr) см-1: 3390, 2960, 1765, 1648, 1590, 1525, 1488.
Рабочий пример 7
2-бутил-4-xлop-1-[[2'-(2,3-дигидро-2-оксо-1,3,4-оксадиазол-5-ил) бифенил-4-ил]метил]имидазол-5-карбальдегид
К охлажденному льдом раствору 2-бутил-4-хлоримидазол-5-карбальдегида (0,19 г) в N,N-диметилформамиде (1 мл) добавили гидрид натрия (60% в масле; 44 мг) и смесь перемешали 10 минут. 3атем к смеси добавили 5-(4'-бромметилбифенил-2-ил)-2,3-дигидро-3-трифенилметил-1,3,4- оксадиазол-2-он (0,57г). Реакционную смесь перемешали 1,5 часа при комнатной температуре, затем разбавили водой и проэкстрагировали этилацетатом. Экстракт промыли водой и высушили. Растворитель выпарили при пониженном давлении и остаток очистили на хроматографической колонке с силикагелем. Полученный таким образом сырой продукт растворили в трифторуксусной кислоте (4 мл) и раствор перемешали при 60oC в течение 30 минут. Трифторуксусную кислоту выпарили при пониженном давлении. Остаток растворили в этилацетате, раствор промыли водным раствором двууглекислого натрия и высушили. Растворитель выпарили при пониженном давлении и остаток очистили на хроматографической колонке с силикагелем. Полученные таким образом сырые кристаллы перекристаллизовали из этилацетат-гексановой смеси и получили указанное соединение в виде бесцветных призм (0,12 г, 27%), т.пл. 178-179oC.
Элементный анализ для C23H21N4ClO3:
Рассчитано, %: C 63,23; H 4,84; N 12,82.
Найдено, %: C 63,07; H 4,87; N 12,69.
1H-ЯМР (200 МГц, CDCl3) δ: 0,90 (3Н, т), 1,28-1,46 (2Н, м), 1,62-1,78 (2Н, м), 2,68 (2н, т), 5,59 (2Н, с), 7,08 (2Н, д), 7,26 (2Н, д), 7,35 (1Н, дд), 7,43-7,60 (2Н, м), 7,79 (1Н, дд), 8,85 (1Н, ш), 9,76 (1Н, с).
ИК (чистый) см-1: 1810, 1775, 1660, 1455, 1340, 1275, 900, 840, 770, 750.
Рабочий пример 8.
2-бутил-4-хлор-1-[[2'-(2,3-дигидро-2-оксо-1,3,4- оксадиазол-5-ил)бифенил-4-ил]метил]-5-имидазолметанол
К раствору соединения (50 мг), полученного в рабочем примере 7, в метаноле (5 мл) добавили боргидрид натрия (4 мг) и смесь перемешали один час при 0oC. Растворитель выпарили при пониженном давлении и pH остатка довели до значения 3-4 1N - HCl. Кристаллический осадок отфильтровали и перекристаллизовали из смеси этилацетат-гексан, получив в результате указанное соединение в виде бесцветных призм (47 мг, 94%) т.кип. 163-164oC.
Элементный анализ для C23H23N4ClO3:
Рассчитано, %: C 62,94; H 5,28; N 12,76
Найдено, %: C 62,76; H 5,16; N 12,54.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (3Н, т), 1,25-1,41(2Н, м), 1,58-1,70 (2Н, м); 2,62 (2Н, т), 4,50 (2Н, с), 5,24 (2Н, с), 7,06 (2Н, д), 7,27 (2Н, д), 7,37 (1Н, дд), 7,43-7,59 (2Н, м), 7,81 (1Н, дд), 9,93 (1Н, ш).
ИК (KBr) см-1: 3400, 1800, 1775, 1455, 1410, 1340, 1260, 1000, 900, 770, 750.
Рабочий пример 9
2-бутил-5-этoкcикapбoнил-3-[[2'-(2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил) бифенил-4-ил]метил]-4(3Н)-пиримидинон
9а) 2-бутил-5-этoкcикapбoнил-3-[[2'-(5-трихлорметил-1,2,4-оксадиазол-3- ил)бифенил-4-ил]метил]-4(3Н)-пиримидинон
К охлаждаемому льдом раствору 2-бутил-5-этоксикарбонил- 4-гидроксипиримидина (0,36 г) в безводном тетрагидрофуране (8 мл) в атмосфере азота добавили гидрид натрия (60% в масле, 65 мг) и смесь перемешали 15 минут при комнатной температуре. К реакционной смеси добавили раствор соединения (1,02 г), полученного в рабочем примере (3 с), в безводном тетрагидрофуране (5 мл) и смесь кипятили с обратным холодильником в течение б часов. Реакционную смесь затем охладили, добавили воду и проэкстрагировали этилацетатом. Органический слой промыли водой и высушили, а растворитель выпарили при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и получили указанное соединение в виде бесцветного масла (0,18 г, 20%).
1H-ЯМР (200 МГц, CDCl3) δ: 0,92 (3Н, т), 1,29-1,47 (2Н, м), 1,39 (3Н, т), 1,64-1,79 (2Н, м), 2,75 (2Н, т), 4,39(2Н, к), 5,38 (2Н, с), 7,19 (2Н, д), 7,25 (2Н, д), 7,41-7,65 (3Н, м), 7,93 (1Н, дд), 8,64 (1Н, с).
ИК (чистый) см-1: 2960, 1748, 1705, 1685, 1580, 1521.
9b) 2-бутил-5-этoкcикapбoнил-3-[[2'-(2,5- дигидро-5-окco-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]-4 (3Н)-пиримидинон
Соединение (0,18 г), полученное в рабочем примере (9а), растворили в смеси диоксана (4 мл) и воды (1 мл). К охлажденному льдом раствору добавили 1N-NaOH (0,4 мл) и реакционную смесь при охлаждении льдом перемешали 30 минут. После добавления 1N - HCl (0,6 мл) и воды реакционную смесь проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и растворитель упарили при пониженном давлении. Остаток очистили на колонке с силикагелем. Полученный таким образом сырой продукт перекристаллизовали из смеси этилацетат-изопропиловый эфир и получили указанное соединение в виде бесцветных кристаллов (62 мг, 42%), т.пл. 151-154oC.
Элементный анализ для C26H26N4O5 • 0,1H2O:
Рассчитано, %: C 65,56; H 5,54; N 11,76.
Найдено, %: C 65,41; H 5,68; N 11,62.
1H-ЯМР (200 МГц, CDCl3) δ: 0,91 (3Н, т), 1,28-1,48 (2Н, м), 1,34 (3Н, т), 1,65-1,80 (2Н, м), 2,79 (2Н, т), 4,31 (2Н, к), 5,30 (2Н, с), 7,22 (2Н, д), 7,32 (2Н, д), 7,37-7,65 (3Н, м), 7,78 (1Н, дд), 8,61 (1Н, с).
ИК (KBr) см-1: 3210, 2960, 1795, 1705, 1660, 1523.
Рабочий пример 10
1-[[2'-(2,5-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)бифенил-4-ил] метил] - 6-пропокси-3-пропилурацил
10а) 6-xлop-1-[[2'-(5-трихлорметил-1, 2,4-оксадиазол-3-ил)бифенил-4-ил] метил]-3-пропилурацил
К охлажденному льдом раствору 6-хлор-3-пропилурацила (0,2 г) в N,N-диметилформамиде (4 мл) в атмосфере азота добавили гидрид натрия (60% в масле; 43 мг). Смесь перемешали 30 минут при комнатной температуре. К реакционной смеси добавили раствор соединения (0,64 г), полученного в рабочем примере (3с), в N,N-диметилформамиде (4 мл). Смесь перемешали 2,5 часа при комнатной температуре. Реакционную смесь сконцентрировали до сухости при пониженном давлении и к остатку добавили воду, а затем проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и сконцентрировали до сухости при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем и получили указанное соединение в виде бесцветного масла (0,43 г, 75%).
1H-ЯМР (200 МГц, CDCl3) δ: 0,95 (3Н, т), 1,56-1,76 (2Н, м), 3,91 (2Н, т), 5,29 (2Н, с), 5,93 (1Н, с), 7,24 (2Н, д), 7,31 (2Н, д), 7,43-7,64 (3Н, м), 7,89-7,93 (1Н, м).
ИК (чистый) см-1: 2960, 1712, 1668, 1608, 1582, 1568, 1508.
10b) 1-[[2'-(2,4-дигидро-5-оксо-1,2,4-оксадиазол-3-ил)- бифенил-4-ил]метил]-6-пропокси-3-пропилурацил
К раствору соединения (0,42 г), полученного в рабочем примере (10а), в смеси диоксана (4 мл) и воды (1 мл) добавили охлажденный льдом 1N - NaOH. Смесь перемешали 30 минут при охлаждении льдом и затем к реакционной смеси добавили 1N-HCl (1,5 мл) и воду и проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и сконцентрировали до сухости при пониженном давлении. Остаток растворили в смеси пропанола (4 мл) и N,N-диметилформамида (4 мл). К охлажденному льдом раствору по каплям добавили раствор пероксида натрия, приготовленного из металлического натрия (72 мг) и пропанола (2 мл), а затем раствор нагревали 1,5 часа при 100-110oC. Реакционную смесь охладили и затем сконцентрировали до сухости при пониженном давлении. К остатку добавили разбавленную соляную кислоту и смесь проэкстрагировали этилацетатом. Органический слой промыли водой, высушили и выпарили до сухости при пониженном давлении. Остаток очистили на хроматографической колонке с силикагелем. Таким образом полученный сырой продукт перекристаллизовали из смеси этилацетат-гексан и получили указанное соединение в виде бесцветных кристаллов (0,223 г, 63%), т.пл. 129-132oC.
Элементный анализ для C25H26N4O5:
Рассчитано, %: C 64,92; H 5,67; N 12,11.
Найдено, %: C 64,82; H 5,77; N 11,91
1H-ЯМР (200 МГц, CDCl3) δ: 0,92 (3Н, т), 1,00 (3Н, т), 1,56-1,73 (2Н, м), 1,74-1,93 (2Н, м), 3,85 (2Н, т), 3,98 (2Н, т), 5,11 (2Н, с), 5,15 (1Н, с), 7,28-7,67 (7Н, м), 7,81-7,86 (1Н, м), 8,15 (1Н, ш с).
ИК (KBr) см-1: 3120, 2970, 1775, 1705, 1638, 1472.
Экспериментальный пример 1
Ингибирование связывания ангиотензина-II с ангиотензиновым рецептором.
Методика
Эксперимент по ингибированию связывания ангиотензина-II (А-II) с соответствующим рецептором проводили, модифицировав методику, описанную Дугласом и др. (Endocrinology, 102, 685-696 (1978)). Фракцию мембран, содержащих А-II-рецептор, приготовляли из кортикального слоя бычьих надпочечников.
Соединение настоящего изобретения (10-6 М или 10-7 М) и 125I-ангиотензин II (125I-АII) (1,85 кБк/50 микролитров) добавляли к фракции рецепторсодержащих мембран, и полученную смесь инкубировали на 1 час при комнатной температуре. Связанный с рецептором и несвязанный 125I-АII разделяли с помощью фильтра (фильтр Whatman GF/B), и измеряли радиоактивность 125I-АII, связанного с рецептором.
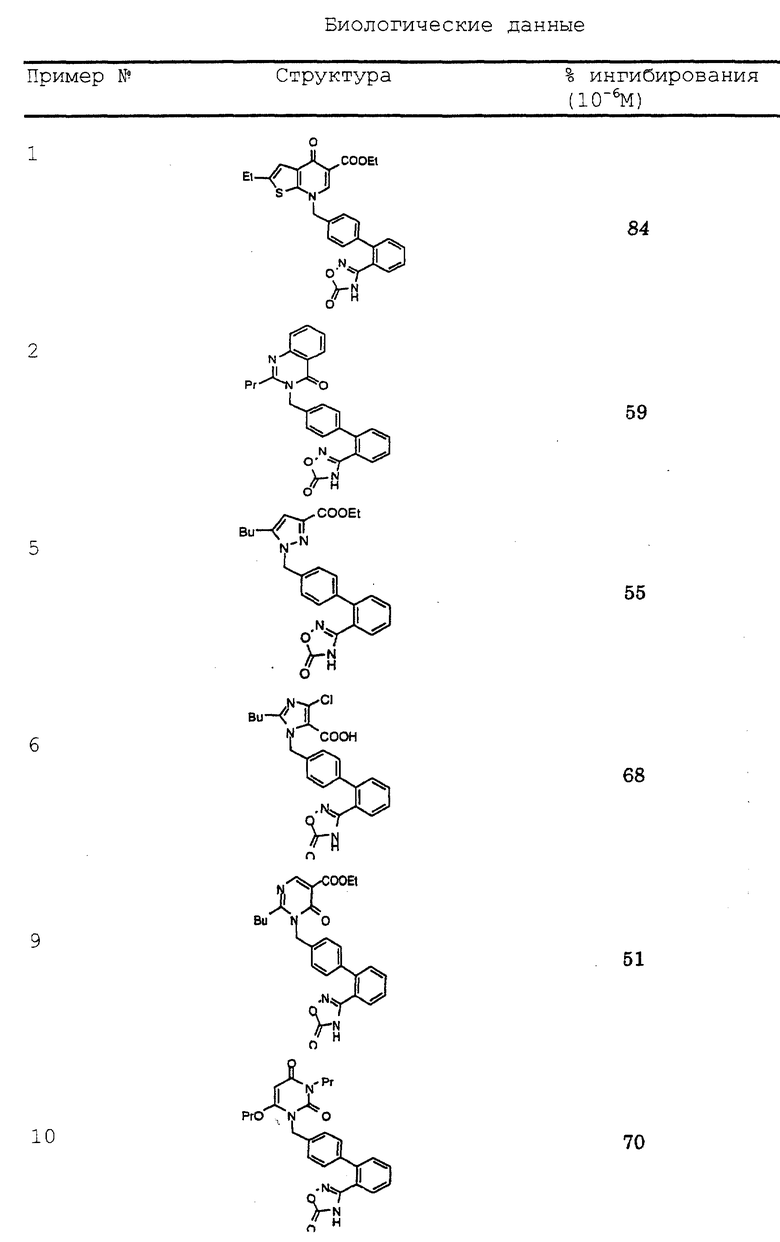
Результаты испытаний представлены в таблице.
Экспериментальный пример 2
Ингибирование соединениями настоящего изобретения вазопрессорного действия AII.
Методика
В качестве подопытных животных использовали крыс Jcl:SD (9-недельные самцы). Накануне проведения эксперимента бедренные артерии и вены анестезированных фенобарбиталом натрия животных были канюлированы. Животным не давали пищу, но позволяли свободно пить воду вплоть до начала эксперимента. В день проведения эксперимента артериальную канюлю соединяли с датчиком кровяного давления и регистрировали среднее кровяное давление с помощью полиграфа. Перед введением лекарства для контроля определяли вазопрессорное действие А-II, вводя его внутривенно (100 нг/г). Лекарства вводили перорально; затем в каждый заранее заданный момент времени внутривенно вводили А-II и аналогичным образом определяли вазопрессорное действие. Процент ингибирования лекарством вызванного А-II вазопрессорного действия оценивали, сравнивая его величины до и после введения лекарства.
Настоящее изобретение относится к гетероциклическому соединению формулы I, где R1 представляет собой алкил, который необязательно присоединен через группу формулы -О-; группа формулы II представляет группу, выбранную из групп формул IIа - IIе, где R1 имеет значения, указанные выше. Соединения, отвечающие вышеприведенной формуле, а также их соли являются антагонистами ангиотензина II, обладают гипотензивным действием и активностью в отношении ЦНС и могут быть использованы в качестве лекарственных средств при лечении циркуляторных заболеваний, таких как гипертензивные заболевания и болезни сердца (например, гипертрофия сердца, сердечная недостаточность, инфаркт сердца), припадков, церебральной апоплексии, нефрита, атеросклероза, болезни Альцгеймера, старческого слабоумия. 3 с. и 6 з.п. ф-лы, 1 табл.




где R1 представляет собой алкил, который необязательно присоединен через группу формулы -O-;
R2 представляет группу, выбранную из:

где q представляет -O-; независимо представляет собой карбонильную группу;
независимо представляет собой карбонильную группу;
группа формулы
представляет группу, выбранную из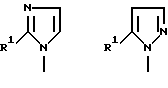

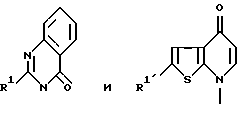
где R1 имеет значения, указанные выше, причем указанная группа необязательно замещена в дополнение к группе R1 галогеном, гидроксиметилом, C1-4-алкилом, карбальдегидной группой или группой R3, которая представляет собой необязательно этерифицированный или амидированный карбоксил,
или его соль.
необязательно замещена в дополнение к группе R1 необязательно этерифицированным или амидорованным карбоксилом.
необязательно замещена в дополнение к группе R1 необязательно этерифицированным карбоксилом.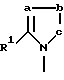
необязательно замещена в дополнение к группе R1 необязательно этерифицированным карбоксилом формулы -CO-D, где D представляет гидрокси, низший (C1-6) алкокси, алкильный фрагмент которого может быть замещен гидрокси, необязательно замещенным амино, галогеном, низшим (C1-6) алкокси, низшим (C1-6) алкилтио или необязательно замещенным диоксоленилом, или группу формулы -O-CH(R4)-OCOR5, где R4 представляет водород, низший (C1-6) алкил, низший (C2-6) алкенил или низший (C3-8) циклоалкил; R5 представляет низший (C1-6) алкил, низший (C2-6) алкенил, низший (C3-8) циклоалкил, низший (C1-3) алкил, замещенный низшим (C3-8) циклоалкилом или арилом, низший (C2-3) алкенил, необязательно замещенный низшим (C3-8) циклоалкилом или арилом, арил, низший (C1-6) алкокси, низший (C2-8) алкенилокси, низший (C3-8) циклоалкилокси, низший (C1-3) алкокси, замещенный низшим (C3-8) циклоалкилом или арилом, низший (C2-3) алкенилокси, замещенный низшим (C3-8) циклоалкилом или арилом, или арилокси.
| 1971 |
|
SU411507A1 | |
| Способ получения бис-(3,5-диарил -пиразолинил-1)-аренов | 1973 |
|
SU477157A1 |
| 0 |
|
SU149543A1 |
Авторы
Даты
2001-06-10—Публикация
1992-06-26—Подача