бладающих ценными фармакологическими свойствами.
Цель изобретения - получение новых производных стероидов, обладающих фармакологическими преимуществами перед известными структурными аналогами того же действия.
П р и м е р 1. (17 R) 4 ,5 -Дигидро 11 -(4-)диметиламино фенил(спиро)эстр-4,9диен-17,2(ЗН)фуран 3-он.
Стадия А:у-Лактон 5 а, 17/3-дигидрокси 11 )8-(4-)диметиламинофенил(3,3-)1,2-этан диил{бисокси)19-нор 17 «-прегн-9-ен-21карбоновой кислоты.
В 60 см 15%-ного раствора бутиллития в гексане (1,6 М) при -70° С вводят 60 см тетрагидрофурана, а затем при -60° С, вводят капля по капле 9,2 см Ы,,Ы,Ы-тетраметилфосфорамидата аллила в растворе в 30 см тетрагидрофурана, перемешивают 45 мин при -10° С, прибавляют 9,95 г циклического 3,3-(1,2-этан диил)ацеталя 11 ;5-(4-)диметиламино(фенил) 5 а-гидрокси эстр-9-ен, 3,17-диона в растворе в 20 см тетрагидрофурана, прибавляют еще 20 см тетрагидрофурана и перемешивают 1 ч при 20° С.
Реакционную смесь выливают в водный раствор хлористого аммония, экстрагируют этиловым эфиром уксусной кислоты., промывают водой, сушат, концентрируют досуха перегонкой под уменьшенным давлением, остаток хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (3:7) и получают 3,9 г сырого целевого продукта, которые растворяют в хлористом метилене, фильтруют, прибавляют изопропилового эфира к фильтрату, удаляют перегонкой хлористьт метилен, отсасывают, промывают и получают 3,45 г целевого продукта, Тпл 198° С.
Вычислено, %: С 73,34; Н 8,14; N 2,76.
C3lH4l05N (мол.м. 507,67)
Найдено, %: С 73,1; Н 8,3; N 2,8.
Стадия Б. Циклический (1,2-этандиил)ацеталь 5, 17/ -дигидрокси 11 /3-(4-)диметиламино(фенил) 17 «-(З-гидроксипропил) эстр-9-ен 3-она.
1,014 г полученного выше продукта растворяют в 30 см тетрагидрофурана, прибавляют фракциями, пропуская азот, и при перемешивании 500 мг алюмогидрида лития, температура поднимается до 35° С, перемешивают 1 ч 30 мин при 20° С, прибавляя капля по капле этиловый эфир уксусной кислоты, а затем - насыщенный водный раствор хлористого аммония, тогда декантируют верхний органический слой и экстрагируют остаток, перемешивая со смесью тетрагидрофуран-этиловый эфир
уксусной кислоты (1:1), промывают соленой водой органические слои, сушат, концентрируют досуха перегонкой под уменьшенным давлением и получают 993 мг сырого
целевого продукта (Тпл 210° С), который употребляется в данном виде в следующей стадии.
Аналитическая проба, полученная после очищения хроматографией на двуокиси
кремния, элюируя смесью этиловый эфир уксусной кислоты - этанол (95:5), а затем кристаллизацией в этаноле, плавится при 234° С.
Вычислено, %; С 72,76; Н 8,86; N 2,73.
(мол.м. 511,7)
Найдено, %: С 72,6; Н 9,0; N 2,7. Стадия В: Смесь циклического(1,2-этандиил)ацеталя (17R) 4, 5 -дигидрр.11 (4-)диметиламино : фенил 5о:- гидрокси(спиро)
зстр-9-ен-17,2 (ЗН)фуран 3-она (соединение А) и (17R)4 ,5 -дигидро 11 (4-)диметиламино фенил(спиро)эстр-4,9-диен-17,2 (ЗН)фуран 3-он (соединение В).
Растворяют 2 г полученного выше продукта в 30 см пиридина, при 3° С, прибавляют 1,52 г хлористого тозила, оставляют 40 ч при 20° С, охлаждают реакционную среду до 3° С, прибавляют воду, а затем раствор бикарбоната натрия, экстрагируют
этиловым эфиром уксусной кислоты, промывают водой, сушат, концентрируют досуха перегонкой под уменьшенным давлением, удаляют пиридин азеотррпной перегонкой с толуолом, хроматографируют остаток на
двуокиси кремния, элюируя смесью циклогексам-этиловый эфир уксусной кислоты (7:3), и получают 395 мг соединения В и 500 мгсоединения А.
ИК-спёктр(хлороформ), смЧ
отсутствие полосы СО, 50Н 3512;
ароматические соединения 1613, 1557 и 1517. ,
Стадия Г: (17В)4,5 -Дигидро 11 (4 диметиламино фенил(спиро) эстр-4,9-диен17,2(ЗН)фуран 3-он (соединение В).
500 мг полученного в стадии В соединения А растворяются в 15 см этанола, прибавляют 10 см водного раствора 2 н, соляной кислоты, оставляют 45 мин при
20° С, прибавляют водный раствор бикарбоната натрия, экстрагируют хлористым метиленом, промывают, сушат, концентрируют досуха перегонкой под уменьшенным давлением и получают 390 мг сырого соединения В.
Очищение соединения В.Соеди няют 395 соединения В, полученного в стадии В, и390 мг полученного выше соединения В, хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (7:3) и получают 645 мг соединения В. . После перекристаллизации в водном этаноле получают 367 мг целевого продукта (Тпл 100° С, мало точная). Соединение В: ИК-спектр(хлороформ), см отсутствие ОН, кетон в 3 1653; , ароматическое со19динение 1612, 1597, 1560 и 1518. Вычислено, %: С 80,7; Н 8.64; N 3,24. C29P37N02 (мол.м. 431,62) Найдено, %; С 80,6; Н 8,8; N 3,2. П р и м е р 2. (17R)11 Д-(4-)Диметиламино фенил(спиро)эстр-4,9-диен-17,2(5Н)фуран 3-он. 1,425 г (Z)11 (4-)диметиламино(фенил) 17 / -гидрокси 17а- (3-гидрокси 1-пропенил)эстр-4-,9-диен-3-она растворяют в 30 см пиридина при 3° С прибавляют 3 г хлори(гого тозила, перемешивают 4 ч при 20° G, охлаждают до 3° С, прибавляют воду, перемешивают 15 мин, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат, концентрируют досуха перегонкой под уменьшенным давлением, делают азеотропную перегонку с толуолом, чтобы хорошо удалить весь пиридин, растворяют остаток в этиловом эфире, фильтруют, концентрируют досуха и получают 1,37 г целевого кристаллического продукта. После перекристаллизации в изопропиловом эфире получают 1,23 г чистого целевого продукта. ИК-спектр (хлороформ), 3 кето Д 1655, 1612; ароматическое соединение 1597, 1562 и 1518. Вычислено: %; С 81,08; Н 8,21; N 3,26. СаэНзвМОз (мол.м. 429,60) Найдено. %: С 81,0; Н 8.3; N3,3 Примерз. (17 R)11 уЗ-(4-)Метилтио фенил(спиро)эстр-4-,9-диен-17,2 (5Н)фуран 3он. Стадия А. Циклический 3,3-(1.2-этан диил)ацеталь5а, Юа-эпокси, 17 -гидрокси 17 «-(3-тетрагидро-2Н-2-пиранилокси)-1-пропинил-эстр-9(11)-ен-3-она. В инертной атмосфере перемешивают 5,06 см реактива НС С-СН20ТНР, 30 см раствора бутиллития в гексане (1,65 М) перемешивают 30 мин при 0° С, и в 40 мин вводят 6,6 г циклического 3,3-(этандиил)ацеталя 5сх, Юа-эпокси эстр-9(11)-ен 3,17-диона в растворе в 55 см тетрагидрофурана, перемешивают 16 ч при 20° С, выливают в 10%-ный водный раствор хлористого аммония, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат, концентрируют досуха перегонкой под уменьшенным давлением, полученный остаток хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (1:1), получают 8,3 г целевого продукта, употребляемого в данном виде в следующей стадии. ИК-спектр (хлороформ), см : свободный ОН при 3601 + маленькое поглощение соединенного ОН, при 1640, присутствие ОТНР. Стадия Б: Циклический 3,3-(1.2-этандиил)ацеталь5 а, 17/ -дигидрокси 11/(4-)метилтио(фенил) 17 а-(3-)тетрагидро 2Н 2-пиронилокси (1-пропинил)эстр-9-ен-3она. Приготовление магнийорганического соединения. В инертной атмосфере перемешиваютЗ г стружек магния, 3 см тетрагидрофурана, доводят до 45° С. прибавляют несколько капель следующего раствора: 20,2 г парамробтиоанизола в растворе в 70 см тетрагидрофурана. После возбуждения реакции продолжают введение этого раствора, чтобы выдерживать температуру при около 50° С, нагревают еще 1 ч при 50° С после конца введения. Получают магнийорганическое соеди- нение с титром в 1,1 Н. Конденсация. В инертной атмосфере перемешивают 80 см раствора магнийорганического соединения, 90 см тетрагидрофурана, 887 мг монохлорида меди, охлаждают до -15° С, вводят в приблизительно 15 мин раствор. 12,2 г циклического (1,2-этандиил) ацеталя 5 а. 10 «.-эпокси 17 Дгидрокси 17 о: -(З)тетрагидро 2Н-2.-пиранилокси(1-пропинил)эстр-9(11)-ен .3-она в 25 см тетрагидрофурана, перемешивают 1 ч при 0° С, выливают в 10%-ный водный раствор хлористого аммония, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат и концентрируют досуха перегонкой под уменьшенным давлением, хроматографируют остаток, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (1:1), получают 15 г сырого, целевого продукта, кристаллизуют 11 г этого продукта в этаноле, содержащем 50% воды, получают 10,2 г целевого продукта (Тпл 160° С). ИК-спектр (хлоррформ), в 17 при 3600 (свободный) + соединенный в 5 при 3510; ароматические соединения при 1596, 1556, 1492, присутствие ОТНР. Стадия В: (г)Циклический(1,2-этан диил) ацеталь 5 и. 17Д-дигидрокси 11/3-(4-)метилтио(фенил) 17 «-(3-)тетрагидро-2Н-2-пиринилокси(1-пропенил)эстр-9-ен-3-она.
594 мг полученного выше циклического 3.3-(1.2-этан диил) ацеталя 5а . 17 Д-дигидрокси 11 Д-(4-)метилтио фенил 17 а- (3-)тетрагидро 2Н-2-пиранилокси 1-пропинил эстр-9-ен 3-она растворяют в 20 см этилового эфира уксусной кислоты, прибавляют 60 мг гидроокиси палладия в 10% на активированном угле, перемешивают 14 ч в атмосфере водорода, удаляют катализатор фильтрацией, концентрируют досуха перегонкой под уменьшенным давлением, полученный остаток хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловь(й эфир уксусной кислоты (1:1), получают 151 мг целевого соединения.
Стадия Г: (Z) 17 jS-гидрокси 17«-(3-гидрокси-1-пропенил) 11 /8-(4-)метилтио(фенил)эстр-4,9-диен 3-он,
2,42 г полученного выше циклического (Z) (1,2-этан диил)ацеталя 5а , 17 дигидрокси 11 б-{4-)метилтио(фенил) 17а -(3-)тетрагидро-2Н-2 -пиранилокСи(1-пропенил): эстр-9-ен-З-она растворяют в 44 см метанола, прибавляют 20 см 2 н. водного раствора соляной кислоты, перемешивают в инертной атмосфере в течение 1 ч 30 мин, разбавляют водой, экстрагируют этиловым эфиром уксусной кислоты, сушат, концентрируют досуха перегонкой под уменьшенным давлением, полученный остаток хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (1:1). Получают 904 мг целевого продукта и 567 кг (Z) 17/б-гидрокси 17 СУ -(3-)тетрагидро-2Н-2-пиранилокси(1пропенил) 1 у5- (4-)метилтио(фенил)эстр-4,9диен-3-она, которые подвергают кислому гидролизу в тех же условиях и получают, после очищения хроматографией, 188 кг целевого продукта.
ПК-спектр (хлороформ), см ОН при 3609 + соединенный, диеном при 1653, 1601; ароматическое соединение 1555 и 1493.
Стадия Д: (17R) 11 (4-)МетИлтио фенил(спиро)эстр-4,9-диен-17,2 (5Н)фуран 3он.
Полученные 1,04 г (Z) 17/ -гидрокси 17 а-(3-гидрокси 1-пропенил) 11 /3-(4-)метилтио(фенил)эстр-4,9-диен-3-она растворяются в 20 см пиридина, прибавляют 2,1 г хлористого тозила, перемешивают 2 ч при 20° С, разбавляют водой и льдом, экстрагируют этиловым эфиром уксусной кислоты, промывают разбавленным водным раствором соляной кислоты, водой, сушат, концентрируют досуха перегонкой под
уменьшенным давлением, полученный остаток хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (6:4), получают 820 мг сырого целевого продукта, который кристаллизуют в смеси хлористого метилена и изопропилового эфира, получают 694 мг целевого продукта.
ИК-спектр (хлороформ), см отсутствие
ОН, дианон 1653 и 1601; ароматические соединения при 1555, 1492.
Вычислено, %: С 77,73; Н 7,45; N 7,41,
Найдено, %: С 77,8; Н 7,6; N 7,1.
П р и м е р 4. (17R)4 ,5 -дигидро 11 /3
-(4-)метилтио фенил(спиро)эстр-4,9-диен-17,2 (ЗН)фуран 3-он.
Стадия А: Циклический (1,2-этан диил)ацеталь 5 а , 17/ -дигидрокси 11/3 -(4-)метилтио(фенил)17 а -(З-)тетрагидро-2Н-2-пиранилокси(пропил) эстр-9-ен 3-она.
2,1 г циклического (1,2-этан диил)ацеталя 5а , 17 Д-дигидрокси 11 (4-)метилтио(фенил) 17 а -(З-)тетрагидро-2Н-2-пиранилокси (1-пропинил} эстр-9-ен 3-она растворяют в 21 смбензола. 21 см этанола, прибавляют 840 мг реактива Вилкинсона хлортрис(трифенилфосфин)родия и подвергают гидрогенизации в течение 16 ч, прибавляют 420 мг реактива Вилкинсона и подвергают гидрогенизации еще 3 ч, концентрируют досуха перегонкой под уменьшенным давлением, хроматиграфируют остаток на двуокиси
кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (6:4), получа- ют 336 мг Этиленового соединения, идентичного с продуктом, полученным в стадии В примера 3, 18& мг смеси этиленового
соединения первоначального продукта и целевого соединения, 1,042 г целевого продукта, употребляемого в данном виде для следующей стадии.
ИК-спектр (хлороформ), смV- ОН при
3600, 3504: ароматические соединения при 1600, 1492.
Стадия Б: 17 гидрокси 17 а-(3-гидрокси пропил) 11 Д-(4-)метилтио(фенил)эстр4,9-диен 3-он.
1,51 г полученного в стадии А циклического (1,2-этан диил) ацеталя 5о: , 17 /3-дигидрокси (4-)метилтио(фенил) 17(3-)тетрагидро-2Н-2-пиранилокси{пропил) эстр-9-ен-З-она растворяют в 25 см метанола, прибавляют 11,5 см разбавленного до 1 /2 водного раствора соляной кислоты, перемешивают в инертной атмосфере при 20° С в течение 30 мин, разбавляют водой, экстрагируют хлористым метиленом, сушат. концентрируют досуха перегонкой под уменьшенным давлением, полученный остаток хроматографируют на двуокиси кремния, элюируют смесью эфир-этиловый эфир уксусной кислоты (1:1), получают 768 мг целевого продукта. ИК-спектр(хлороформ), свободный ОН при 3620 4- связанный при 3410; диенон при 1653 и 1601; ароматические соединения 1555 и 1492. Стадия В; (17R) 4 ,5 -дигидро 11/5 -{4-)метил тио фенил(спиро)эстр-4,9-диен-17,2 (ЗН)фу.ран -3-он. 1,04 г полученного в стадии Б 17/3-гидрокси 17 «-(З-гидрокси пропил) 11)8 -(4-)ме.тилтио(фен ил)эстр-4,9-диен-3-она растворяют в 20 см пиридина, прибавляют 2,1 г хлористого.тозила, перемешивают 1ч при 20° С, разбавляют водой и льдом, экстрагируют этиловым эфиром уксусной KWCлоты, промывают разбавленным водным, раствором соляной кислоты, водой, водным раствором бикарбоната натрия, сушат, концентрируют досуха перегонкой под уменьшенным давлением, кристаллизуют полученный остаток в смеси хлористый метилен-этанол, получают 818 мг целевого продукта Тпл 105° С (неясное). ПК-спектр (хлороформ), -С-0-С-при 1073,1055; диенон при 1653,1602; ароматические соединения 1555, 1493, Вычислено, %: С 77,37; Н 7,88, C28H3402S (мол.м. 434,64) Найдено, %; С 77,1; Н 8,0. П р и м е р 5. (17R) 11 /3 - 2-Метоксифен.ил(спиро)эстр-4-9-диен-17,2 (5Н)фуран 3-он. Стадия А, (Z) Диметил кеталь 5 cf. 10 а-эпокси 17уЗ-гидрокси 17о:-(3-)тетрагидро2Н-2-пиранилокси(1-пропинил)эстр-9(11)ен 3-она. о .400 см раствора бутиллития в гексане (1,6 М) охлаждают до О С, при этой температуре прибавляют 98 г реактива НС ССН20ТНР в180 см тетрагидрофурана и перемешивают 30 мин при 0° С. Капля по капле прибавляют 66.4 г 3,3димеТил кеталя 5 а, 10 о:-эпокси-эстр-9(11)-ен-3,17-диона в растворе в 200 см тетрагидрофурана, перемешивают 2 ч, давая температуре подняться до комнатной, выливают в водный раствор хлористого аммония, экстрагируют этиловым эфиром уксусной кислоты, а затем хлористым метиленом, соединяют органичекие слои, промывают их водой, сушат, а затем удаляют растворители под уменьшенным давлением. Остаток хроматографируют на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты (7:3) с 1% триэтиламина). Получают 53 г сырого продукта, который очищают хроматографически на двуокиси кремния (элюент хлористый метилен - ацетон 95:5 с1 % триэтиламина). Стадия Б: (Z) Диметил кеталь 5а , 10 а-зпокси 17/ -гидрокси 17 о:-(3-)тетрагидро2Н-2-пиранилокси(1-пропенил)эстр-9(11)ен-З-она, В течение 30 мин и при давлении в 1100 мбар подвергают гидрогенизации 2,5 г получен ного в стадии А сырого продукта в 400 см этилового эфира уксусной кислоты в присутствии 25 мг 10%-ного палладия на сернокислом барие и 1 см пиридина. Отфильтровывают катализатор, промывают его этиловым эфиром уксусной кислоты, соединяют органические слои, удаляют растворители под уменьшенным давлением и собирают 2,5 г сырого продукта, которые оч.ищают хроматографией на двуокиси кремния (элюент хлористый метилен - ацетон 95:5). Получают 728 мг целевого продукта. ИК-спектр (СНС1з), см : ОН 3600, 3400 (F) присутствие эпокси. Стадия В: (Z) Диметил кеталь 5 а, 17 /З-дигидрокси 11/3-(2-метокси фенил)17«-{3-)тетрагидро-2Н-2-пиранилокси(1-пропенил) эстр-9-ен-З-она, Приготовление магнийорганического соединения. Действуют как и в стадии Б примера 3, исходя из магния и ортобромоанизола. Получают раствор титром в 0,72 М/л. Конденсация. 3 г полученного в предыдущей стадии продукта растворяют в 60 см тетрагидрофурана в инертной атмосфере, прибавляют 187 мг монохлорида меди, нагревают до 34± 1° С, в 20 мин вводят 26,2 см приготовленного выше магнийорганического соединения и перемешивают 16 ч. Дают температуре подняться до комнатной, выливают в раствор хлористого аммония, перемешивают 15 мин, экстрагируют этиловым эфиром уксусной кислоты, промывают водным раствором хлористого натрия, сушат и концентрируют досуха под уменьшенным давлением. Получают 6,68 г сырого продукта, который очищают хроматографически на двуокиси кремния, элюируя смесью хлористый метилен - ацетон 97:8 с 1 % триэтиламина. ИК-спектр (СНС1з)- свободный ОН 3600, связанный 3450, ароматические соединения 1597, 1584 и 1490. Стадия Г, (Z) 11 у$-(2-Метоксифенил) 17 Д-. гидрокси 17 а-(3-)гидрокси(1-пропенил)эстр-4,9-диен 3-он.
При комнатной температуре растворяют 1,08 г полученного в стадии Б продукта в 10 см этанола, прибавляют 1,08 г гидрогеносульфата калия в 6,5 см воды и перемешивают 5 ч при комнатной температуре. Удаляют этанол, экстрагируют хлористым метиленом, промывают водой органический слой, сушат и концентрируют досуха под уменьшенным давлением. После хроматографии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 1:1) получают 0,703 г целевого продукта.
Стадия Д: (17R) 2 -Метокси фенил(спиро)эстр-4,9-диен-17,2 -(5Н) фуран 3он.
При комнатной температуре растворяют 0,661 г полученного в предыдущей стадии продукта в 13,2 см пиридина, охлаждают до 0° С и прибавляют в 5 мин 1,32 г хлористого тозила, дают дойти до комнатаой температуры, перемешивают 1 ч, заново охлаждают до О С и прибавляют 14 см 6 н. соляной кислоты. Декантируют, экстрагируют водный слой этиловым эфиром уксусной кислоты, промывают водой, сушат и удаляют растворители под уменьшенным давлением. После хроматографии на двуокиси кремния и элюирования циклогексаном - этиловым эфиром уксусной кислоты (8:2) получают 0,459 г целевого продукта.
ИК-спектр (СНС1з), см диенон 1655, 1597; ароматическое соединение 1488
1080, 1040.
П р и м е р 6. (17R) (4-Хлорофенил) 4 , 5 -дигидро спиро эстр-4,9-диен-17,2(ЗН)фуран 3-он.
Стадия А: Диметилацеталь 5 а, 10 огэпокси 17/5- гидрокси 17 а-(3-) тетрагидро 2Н 2-пиранилокси(пропил)эстр-9(11)-ен-3она.
6 г приготовленного как в стадии А примера 5 3,3-диметокси кеталя 5а, 10 а-эпокси 17 Д-гидрокси 17 «-(3-)тетрагидро 2Н-2-пиранилок(Си(1 -пропинил)эстр-9(11)-ен-3-она растворяют в 60 см бензола, а затем подвергают гидрогенизации под давлением в 1860 мбар в присутствии 1,5 г реактива Вилкинсона в течение 7ч, Смесь разбавляют эфиром, фильтруют,концентрируют досуха фильтрат под уменьшенным давлением и собирают 7,7 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент петролейный эфир (Ткип 40-70° С) этиловый эфир уксусной кислоты 4:6). Получают 4,95 г целевого продукта.
ИК-спектр (). см свободный ОН 3620. 3600, 1640.
Стадия Б: Диметил кеталь 11 (4-хлорфенил) 5а , 17/3-дигидрокси 17 о;-(3-)тетрагидро 2Н-2-пиранилокси (пропил)эстр-9(11)-ен-3она.
Приготовление магнийорганического
соединения.,
Действуют как в стадии Б примера 3, исходя из 1,22 г магния и 3 см раствора, приготовленного исходя из 7,65 г парабромхлорбензола в 50 см тетрагидрофурана.
Получают магнийорганическое соединение, титр 0,65 М/л.
Конденсация: Действуют как в стадии Б примера 3, употребляя 23 см раствора магнийорганического соединения, 165 мг монохлорида меди и 2,46 г продукта, полученного в стадии А (предыдущей) в растворе в 12 см тетрагидрофурана. После хроматографии на двуокиси кремния (элюент петролейный
эфир (Ткип - 40-70° С) - этиловый эфир уксусной кислоты 1:1) собирают 2 г целевого продукта, которые употребляют в данном виде в следующей стадии.
ИК-спектр (СНС1з), см: ОН в 5 3478. ОН
в 17 макс. 3620. плечо 3600: полосы арома1599, 1489,
тических соединений
-ОСНз2835. - Стадия В. (4-Хлорфенил)17/3-гидрокси 17 «-(З-гидрокси пропил) эстр-4,9-диен3-он..
15 см 2 н. соляной кислоты прибавляют к 1,99 г полученного в предыдущей стадии продукта в 20 смметанола.
Нагревают в течение 45 мин до 50° С, выливают в водный раствор бикарбоната натрия, экстрагируют этиловым эфиром уксусной кислоты, сушат и концентрируют досуха под уменьшенным давлением. Получают 1,42 г целевого продукта (Тпл 262° С) .после кристаллизации в смеси хлористый метилен - изопропиловый эфир.
ИК-спектр (СНС1)з, см свободный ОН 5 3620 + связанный диенон 1655-1602,
СР полосы ароматических соединений 1570-1490, Вычислено %: С73,53; Н 7,54; С1 8,03.
C27H31CI02 (мол,м. 422,99)
Найдено, %: С 73,3; Н 7,8; С1 8,3.
Стадия Г: (17R) 11j6l Ч4-)Хлорфенил 4. 5 -дигидро(спиро)эстр-4,9-диен-17,2 (ЗН)фуран -3-он.
В инетрной атмосфере растворяют 1 г полученного в стадии В продукта 20 см пиридина, охлаждают до 0-5° С, прибавляют 2,2 г хлористого тозила и перемешивают
1,5 ч при комнатной температуре. Выливают в ледяную воду, перемешивают 15 мин, экстрагируют этиловым эфиром уксусной кислоты, промывают насыщенным водным раствором бикарбоната натрия, отсасывают образованный осадок, сушат и получают 694 мг целевого продукта.
Сушат фильтрат, удаляют растворители под уменьшенным давлением, хроматографируют остаток на двуокиси кремния (элюент циклогексанэтиловый эфир-уксусная кислота 2:1), Тпл 308° С.
Вычислено, %: С 76,66: Н 7,38; С1 8.38.
С27Н31СЮ2 (мол.м. 422,99)
Найдено, %; С 76,7; Н 7,4; С1 9.
П р и м е р 7. (17R)4 V5 -Дигидро 11 /б- 4-метокси фенил(спиро) эстр--4,9-диен17,2 (ЗН)фуран 3-он,
Стадия А; Диметил кеталь 5 а, 17;б-дигидрокси (4-метоксифенил) 17а-{3-)тетрагйдро2Н-2-пиранилоксй(пропил)эстр-9-ен-3-она.
Приготовление магнийорганического соединения. Действуют как и в стадии Б примера 3, исходя из 1,45 г магния и 9,15 г параброманизола в 45 см тетрагидрофурана. Получают магнийорганическое соединение, титр 0,9 М/л.
Конденсация. Действуют как в примере 3, употребляя 15 см магнийорганического соединения, которое приготовлено выше, 15 см тетрагидрофурана, 1.65 MI монохлорида меди и 2,4 г приготовленного в стадии А примера 6 продукта. После хроматографии на двуокиси кремния (элюент петролейный эфир (Ткип 40-70° С) - этиловый эфир уксусной кислоты 1:1), собирают 6 г целевого продукта, употребляемого в данном виде в следующей стадии.
Стадия Б: 17/5-Гидрокси 17а-(3-гидроксипропил) 11/3 -(4-метокСифенил) эстр-4,9диен-3-он.
Действуют как в стадии В примера 6, исходя из 6 г полученного в стадии Б продукта. Получают 5 г сырого целевого продукта, который очищают хроматографически на двуокиси кремния, элюируя смесью хлористый метилен - ацетон (7:3).
Стадия B:(17R)4 ,5-Дигидро 11 Д- 4-метокси фенил(спиро)эстр-4,9-диен-17,2 (ЗН)фуран 3-он..
Действуют как в стадии Г примера 6. исходя из 655 мг полученного в стадии Б продукта и 1,4 г хлористого тозила. После хроматографии получают 650 мг сырого продукта, который перекристаллизовывают в смеси хлористый метилен - изопропиловый эфир. Собирают 500 мг целевого продукта (Тпл 192° С).
Вычислено, %: С 80,34; не. 18.
С28Нз40з (мол.м, 418,58) Найдено, %: С 80,2; Н 8,2. +133,5 ±2,5° (к 1 % СНС1з) П р и м е р 8. (17R) 11 /5- 3-Тиенил(спиро)эстр-4,9-диен-17,2 -(5Н)фуран 3-он.
Стадия А: Циклический (Z) (1,2-этандиил) ацеталь5а:, 10а-эпокси 17а-(3-)тетрагидро 2Н-2-пиранилокси(1-пропенил)эстр-9(11)ен -3-она.
940 мг продукта, приготовленного в стадии А примера 3, растворяют в 20 см этилового эфира уксусной кислоты в присутствии 5 см пиридина. Прибавляют 9 мг 10%-ного палладия на сернокислом барие и гидрогенизируют 24 мин при атмосферном давлении. Отфильтровывают катализатор, прополаскивают этиловым эфиром уксусной кислоты, и концентрируют досуха фильтрат. Получают 965 мг сырого продукта, который хроматографируют на двуокиси кремния (элюент хлористый метилен - этиловый эфир уксусной кислоты 8:2).
Собирают 795 мг целевого продукта. ИК-спектр (СНС1з), см свободный ОН 3600, связанный 3400, Д9-11 1640, эпокси 971.
Стадия Б: Циклический (Z) (1,2-этандиил)ацеталь 5(2, 17 б-дигидрокси 17о:-(3-)тетрагидро 2Н-2-пиранилокси(1-пропенил) 11 /3-(3-тиенил)эстр-9-ен-3-она.
Приготовление магнийорганического соединения. Действуют как в примере 3 (стадия Б), исходя из магния и 3-бромтиофена. Получают раствор титра 0,6 М/л. Конденсация: Суспензию, содержащую 35.2 см полученного выше магнийорганического соединения в 14 см тетрагидрофурана, охлаждают до -20° С, прибавляют 0,210 г монохлорида меди и перемешивают 10 мин. Капля по капле вводят раствор 2,5 г полученного в стадии А продукта в 25 см тетрагидрофурана, выдерживая температуру при -20° С, и перемешивают 1 ч. Дают температуре подняться до комнатной, прибавляют капля по капле 10 см хлористого аммония в насыщенном растворе, выливают реакционную среду в 90 см насыщенного раствора хлористого аммония, перемешивают 15 мин, декантируют и экстрагируют водный слой этиловым эфиром уксусной кислоты. Промыват водой органический слой, сушат его и удаляют растворитбли под уменьшенным давлением.
Получают 4,68 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 6:4, содержащий 1% триэтиламина). Получают 2,107 г целевого продукта (Тпл 158° С).
ИК-спектр (СНС1з), ОН в 5 3501,
Стадия В: (Z) 17 Гидрокси 17а- 3-гидрокси 1-пропенил) 11/ (3-тиенил)эстр-4,9диен -3-он.
В инертной атмосфере растворяют 2,1 г полученного в предыдущей стадии продукта в 42 см этанола, прибавляют 6,3 см 2 н. водного раствора соляной кислоты и перемешивают 3 ч при комнатной температуре. Охлаждают до 5 С, прибавляют постепенно 42 см воды, перемешивают 30 мин, отсасывают осадок, промывают его водой до нейтральности, растворяют его в хлористом метилене, сушат и удаляют растворители под уменьшенным давлением. Получают 1,15 г целевого продукта (Т пл 240° С).
ИК-спектр (СНС1з), см : свободный ОН 3611 и связанный диенон 1657- 1603.
Стадия Г; (17R) 11Д- 3-Тиенйл(спиро)эстр-4,9-диен-17,2 (5Н)-фуран -3-он.
Действуют как и в стадии Г примера 6, употребляя 1,15 г приготовленного в предыдущей стадии продукта, 25 см пиридина, 2,3 г хлористого тозила и 23 см 6 н. соляной кислоты.
Получают 1,03 г сырого продукта, который очищают хроматографически на двуокиси кремния, элюируя хлористым метиленом - ацетоном (98:2), Собирают 0,755 целевого продукта, которые перекристаллизуют в изопропаноле (Тпл 242° С).
Вычислено, %: С 76,49; Н 7,18; S 8,16, ,С2бН28025 (мол.м, 392,565)
Найдено, % :С 76,4; Н 7,3; S 8.0,
Пример9.(17Я)11/Н 4 Ацетилфенил(спиро)эстр-4,9-диен-17,2 (5Н) фуран)3-он.
Стадия А: Циклический (Z) (1,2-этандиил) ацеталь 5 а, 17 8-дигидрокси (4-)2-метил1,3-диоксалан-2-ил-фенил 17 а -{3-)тетрагидро-2Н-2-пиранилокси(1-пропенил)эстр-9ен-З-она.
Приготовление магнийорганического соединения. Действуют как и в стадии Б примера 3, исходя из 1,45 г магния и 12,1 г этилен кеталя парабромацетофенона. Получают суспензию титра 0,8 М.
Конденсация; В инертной атмосфере прибавляют 21 мг монохлорида меди к 8 см охлажденной до 0-5° С суспензии магнийорганического соединения. Перемешивают 15 мин, капля по капле прибавляют 1 г продукта, приготовленного в стадии А примера 8 в растворе в 15 тетрагидрофурана, и перемешивают 1 ч при комнатной температуре. Выливают в водный раствор хлористого аммония, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат и концентрируют досуха. Получают 3.5 г сырого продукта, которые очищают хроматографически (элюент циклогексан - этиловый эфир уксусной кислоты 1;1).
ИК-сггектр{СНС1з),см;ОНв53500,ОН + соединенный 3600, ароматические соединения 1605, 1502.
Стадия Б; (Z) 11yS -(4-Ацетилфенил) 17 / гидрокси 17 т:-(3-)гидрркси (1-пропенил)эстр-4,9-диен-3-он.
2,07 г приготовленного в предьшущей стадии продукта растворяют в 40 см метанола, прибавляют 16 смЗ 2 н. водного раствора соляной кислоты, перемешивают 1,5 ч при 50° С, выливают в водный раствор бикарбоната натрия, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат и концентрируют досуха под уменьшенным давлением. Получают 1,63 г сырого продукта, которые хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен -ацетон (7;3), а затем кристаллизуют в этаноле. Собирают 1,48 г целевого продукта (Тпл 130° С).
ИК-спектр (СНС1з), 1678, -СНз 1359, + ароматическое соединение 1604, 1565, диенон 1657, свободный ОН 3609, связанный ОН 3410.
Вычислено, %; С 77,99; Н 7,67
С29Н34О (мол,м, 444,57)
Найдено, %: С 78,0; Н 7,7.
Стадия В; (17R) 11 4-Aцeтилфeнил(cпиpo)эcтp-4,9-диeн-17,2 -(5Н)фуран 3он,
В инертной атмосфере растворяют 0,404 г полученного в предыдущей стадии проду кта в 16 см пиридина. Охлаждают до 0° С, Г1рибавляют 1,49 г хлористого тозила и перемешивают 2 ч давая дойти до комнатной температуры. Выливают в ледяную воду, перемешивают 15 мин, экстрагируют этиловым эфиром уксусной кислоты, промывают раствором бикарбоната натрия, сушат и упаривают досуха. Получают 0,775 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты 1;1), а затем перекристаллизуют в смеси этанол хлористый метилен. Собирают 0,555 г целевого ггродукта. (Тпл 125-130° С).
ИК-спектр {СНС1з), 1678, СНз 1359, + ароматическое соединение 1604, 1565, диенон 1657.
«Ь +231,5 ±3° (к 1 % СНС1з).
Вычислено, % ; С 81,27; Н 7,52.
С29Нз20з (мол.м. 428,57) .
Найдено, %; С 81,1; Н 7,8.
Примерю. (17R) 11 (4-)Метилтио фенил(спиро)эстр-5(10),9(11)-диен-17,2 (5Н)фуран -3-он и (17 R) 11 Д(4-)метилтио фенил(спиро)эстр-4,9-диен-17Д5Н)фуран}-3-он.
1,5 г продукта, полученного в стадии В примера 3, растворяют в 30 см метагнола и прибавляют 15 см 2 н. соляной кислоты. Заново прибавляют 30 см метанола, 30 см диоксана и перемешивают 2 ч при комнатной температуре. Реакционную среду выливают в воду, экстрагируют хлористым метиленом, концентрируют досуха и получают 1,23 г остатка, которые заново растворяют в 23 см пиридина. Прибавляют 1,91 г хлористого тозила, перемешивают 1 ч с половиной при комнатной температуре, выливают в ледяную воду и экстрагируют этиловым эфиром уксусной кислоты, промывают водным раствором соляной кислоты, а затем водным раствором хлористого натрия, сушат и концентрируют досуха. Собирают 1,12 г сырого продукта, которые хромотографируют на двуокиси кремния (элюент хлористый метилен - этиловый эфир уксусной кислоты 9:1), и получают 98 мг целевого продукта и 863 г соответствующего эстр-4,9-диена (одинакового с продуктом, полученным в примере 3, стадии Д).
ИК-спектр (СНС1з) эстр-5(10),9(11)-диена, 1712, + ароматическое соединение 1590, 1492. С С спироцикла 1626.
ИК-спектр (СНС1з) эстр-4,9-миена, см 1653, сопряженная с 1600, ароматическое соединение 1492.
П р и м е р 11. N-окись (17R) 4,5-дигидро 11 Д-(4-)диметиламино фенил(спиро)эстр4,9-диен-17,2 -(ЗН)фуран 3-она.
1,43 г приготовленного в примере 1 (продукт В) (17 R)4 ,5 -дигидро 11 -4-диметилиламино фенил(спиро)эстр-4,9-диен-17.2 (ЗН)фуран 3-она растворяют в 30 см хлористого метилена, охлаждают до 0-5° С и прибавляют в 15 мин 0,666 г метахлорпербензойной кислоты в 85%-ный раствор в 15см хлористого метилена.
После 1 ч 30 мин перемешивания при 0-5° С реакционную среду выливают в 100см раствора тиосульфата натрия (0,2 н и экстрагируютхлористым метиленом. Промывают водным раствором бикарбоната на-, трия, а затем водой, j;ymaT и удаляют растворители. Собирают 1,8 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент хлористый метилен - метанол 7:3). Получают 1,34т целевого продукта (растворитель содержит хлористый метилен), которые подвергают лиофилизации.
ИК-спектр (СНС1з), смVc 0 1655, и ароматические соединения 1602 - 1498.
{аЬ +12в±2° (к 1 % этанол).
П р и м е р 12. (17R) 4 ,5 -дигидро 11 /3-(4-)1-метилэтил фенил(спиро)эстр-4,9-диен-17,2 -(ЗН)фуран 3-он.
Стадия А: Циклический (1,2-этан диил)ацеталь 5а, 10а-эпокси 17уЗ-гидрокси 17 а (З-)тетрагидро 2Н-2-пиранилокси(пропил)эстр-9(11)ен 3-она.
Действуют как в примере 6 стадии А, употребляя 1 г, приготовленного в примере 3 стадии А, циклического, (1,2-этан диил) ацеталя 17уЗ-гидрокси 5 а, 10 сс-эпокси 7 а-{3-)тетрагидро-2Н-2-пиранилокси(1-пропинил) эстр-9(11)-ен-3-она и 0,25 г катализатора Вилкинсона. Получают 1,28 г целевого продукта.
ИК-спектр (СНС1з), см : ОН свободный 3620, 3605, ОН сильно связанный 3485, 1 643.
Стадия Б: Циклический (1,2-этан диил) ацетальБ а, 17/ -дигидрокси 11 Д4-)1-метилзтил{фенил 17а-(3-)тетрагидро2Н-2-пиранилокси -пропил}эстр-9-ен-3-она.
2,45 г продукта, полученного как в стадии А в растворе в 10 см тетрагидрофурана, охлаждают до 0° С, прибавляют 110 мг монохлорида меди, перемешивают 10 мин. прибавляют в 15 мин 32 см бромида (4изопропил)фенил магнийорганического соединения в растворе 0,66 М/л в тетрагидрофуране. Перемешивают 2 ч при 3± 1° С, выливают в ледяной раствор (водный) хлористого аммония, экстрагируют эфиром, а затем хлористым метиленом, сушат и удаляют растворители под уменьшенным давлением. Получают 4,65 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 5:5) и употребляют в данном виде в следующей фазе.
Стадия В: 17уЗ-Гидрокси 17 а-(3-гидроксипропил) 11 (4-)1-метилэтил(фенил)эстр4,9-диен-З-он.
2,58 г полученного в предыдущей стадии продукта в 20 См этанола с 5 см 2 н, соляной кислоты перемешивают 2 ч при комнатной температуре. Под уменьшенным давлением концентрируют до малого объема, экстрагируют хлористым метиленом, промывают, сушат и удаляют растворители под уменьшенным давлением. Получают 2,2 г целевого продукта, которые очищают хроматографически на двуокиси кремния (элюент н-гексан - этиловый эфир уксусной кислоты 3:7).
ИК-спектр (CHCIa), см свободный ОН 3620 + связанный диенон 1655 - 1601, ароматическое соединение 1590.
Стадия Г: (17R) 4 ,5 -Дигидро 11 /S-{4-)1метилэтил фенил(спиро)эстр-4,9-диен-17,2 (ЗН)фуран 3-он.
При комнатной температуре перемешивают 1 ч 30 мин 1,15 г полученного выше продукта, 20 см пиридина и 2,1 г хлористого тозила. Разбавляют с 50 см воды и льда, медленно прибавляют 20 см концентрированной соляной кислоты, экстрагируют водный слой хлористым метиленом, сушат и удаляют растворители под уменьшенным давлением. Получают 1,686 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент хлористый метилен ацетон 95:5), затем перекристаллизуют в этаноле. Собирают 659 мг целевого продукта. Т „л 114° С.
ИК-спектр (СНС1з), см : сопряженный кетон 1654, ароматическое соединение 1601 1510.
Вычислено, %: С 83,68; Н 8,89,
СзоНз802 (мас.м. 430,635)
Найдено, %: С 83,8; Н 9,1.
П р и м е р 13. (17R) 11 ;б- (3-)Метилтио фенил(спиро)эстр-4,9-диен-17,2-(5Н)фуран 3он.
Стадия А; 1Диклический-(1,2-этан диил) ацеталь 5о, 17/8-дигидрокси 11уЗ-(3-)метилтио(фенил)17а -(3-)1-тетрагидро 2Н-2-пиранилокси(1-пропенил)эстр-9-ен-3-она.
Действуют как в стадии Б примера 8, употребляя 2,5 г продукта, приготовленного в стадии А, примера 8. 110 мг монохлорида меди и 18 см магнийорганического соединения, приготовленного как в примере 3. исходя из 3-бромтиоанизола, и имеющего титр в 1,17 М/л. Получают 3 г целевого продукта,
ИК-спектр (СНС1з), см ; свободный ОН 3600 + связанный 3498 (макс), 3440 (плечо), ароматическое соединение 1587, 1568.
Стадия Б: (Z) 17 3-Гидрокси 17 а-(3-гидрокси 1-пропенил) 11 (3-)метилтио(фенил)эстр-4,9-диен-3-он.
При комнатной температуре перемешивают в течение 2 ч 3 г полученного выше продукта, 30 см этанола и 5 см 2 н. соляной кислоты. Концентрируют до малого объема под уменьшенным давлением, экстрагируют хлористым метиленом, промывают, сушат и удаляют растворители под уменьшенным давлением. Остаток хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 5:5) и собирают 1,083 г целевого продукта (Гпя « 168° С).
ИК-спектр (СНС1з), см ОН 3613 + связанный 3440, диенон 1656 - 1601, ароматическое соединение 1587, 1569, 1474.
Стадия В; (17R)-11)S- (3-)Метилтио фенил(спиро)эстр-4,9-диен-17,2-(5Н)фуран 3он.
Действуют как в стадии Г примера 12, исходя из 1,050 г полученного в предыдущей стадии Б продукта, и-получают 592 мг чистого целевого проду та (Тпл 150° С).
ИК-спектр (СНС1з), диенон 1657 1601, ароматическое соединение 1587, 1569, 1473, -С-О-С 1080 - 1041.
Вычислено, %; С 77,7; Н 7,46; S 7,41.
C28H32S02 (мол,м, 432,62)
Найдено, %: С 77,6; Н 7,4; S 7,1.
П р и м е р 14, (17R) 11 / 4-Хлорфенил(спиро)зстр-4,9-диен-17,2 -(5Н)фуран 3 он.
Стадия А; Циклический (Z)(1,2-этандиил) ацеталь 11 (4-хлорфенил) 5 а, 17/ -дигидрокси 17« -(3-)тетрагидро 2Н-2-пиранилокси(1-пропенил)эстр-9-ен-3-она.
Действуют как и в стадии Б примера 8, исходя из 2,5 г приготовленного в стадии А примера 8 продукта, 160 мг монохлорида меди и 18см раствора магнийорганического соединения, приготовленного как в примере 3, исходя из 4-хлорбромбензола, иимеющего титр в 0,87 М/л. Получают 3,082 г целевого продукта (чистого).
ИК-спектр, см : ОН 3500 + связанный у 3405, ароматическое соединение 1600 1490.
Стадия Б;( 11/3 -(4-Хлорфенил) 17у5-гидрокси 17« -(3-)гидрокси (1-пропенил)эстр4,9-диен-З-он.
При комнатной теспературе перемешивают 3ч 3,05 г продукта, полученного в предыдущей стадии, в 30 см этанола и 30 см воды в присутствии 3 г гйдрогеносульфата калия.
Концентрируют до малого обьема под уменьшенным давлением, разбавляют в воде, экстрагируют хлористым метиленом, сушат и удаляют растворители под уменьшенным давлением. Получают 2,54 г сырого продукта, которые хроматографируют на двуокиси кремния {элюент циклогексан этиловый эфир уксусной кислоты 5:5), а затем кристаллизируют в этиловом эфире уксусной кислоты (Тпл 214° С). ИК-спектр(СНС1з): ОН 3611+связанный диенон 1657 - 1602, ароматическое соединение 1013.
Стадия В: (17R) 11/3 - 4-Хлорфенил(спиро)эстр-4,9-диен 17,2 - (5Н)фуран 3-он. Действуют как в стадии Г примера 12, исходя из 1,03 г продукта, полученного в предыдущей стадии Б, 20 см пиридина, 3 г хлористого тозила и 25 см концентрированной СОЛЯНОЙ кислоты. Получают 726 мг целевого кристаллизованного продукта (Тля 260°С). ИК-спектр (CHCIs). диенон 1654 1602, ароматическое соединение 1572 (плеОчо), 1490, 1081-1039. Вычислено, %: С 77,03; Н 6,94; С1 8.42. C27H29CI02 (мол.м. 420.98) Найдено. %: С 77,0; Н 6,9; С 8.2. Пример 15. (17R) 11 8-(4-)1-Метилэтокси фенил(спиро)эстр-4,9-диен-17,2 (5Н)фуран 3-он. Стадия А. Циклический (Z) (1,2-этан диил) а дата ль 5 а, -дигидрокси 11/3 -{4-)1 -метил этокси(фенил) 17 а-{3-)тетрагидро-2Н-2-пиранилокси-(1-пропенил)эстр-9-ен 3-оиа. Действуют как в стадии Б примера 8, употребляя 2,5 гпродукта, полученного как это указано в стадии А примера 8,110 мг монЬ:йлорида меди и 35 см магнийорганического соединения, полученного как это указано в примере 3, исходя из 1-бром 4-(1-метилэтокси)бензола. Получают 6,764 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты (7:3)с 1% триэтиламина) и собирают 3,173 г целевого продукта. ИК-спектр (СНС1з), ОН в 5 3500; другие ОН 3602 - 3458, (плечо), ароматическое соединение 1608, 1571, 1505. Стадия Б: (Z) 17Д-Гидрокси 17а(3-гйдрокси 1-пропенил)) 11 у$-(4-) 1-метилэтокси(фенил)эстр-4,9-диен-3-он. Действуют как в стадии Б примера 13, исходя из 3,14 г продукта, полученного в предыдущей стадии А. 20 см этанола и 2 см 2 Н, соляной кислоты. Получают 1.257 г чистого целевого продукта. ИК-спектр (СНС1з), см: ОН 3612 + соединенный 0 1656, 1608. ароматическое соединение 1585, (плечо) 1506. Стадия В: (17R) 11 у(4-)1-Метилатокси фенил(спиро)зстр-4,9-диен-17.2 -(5Н)фуран -3-он. Действуют как в стадии Г примера 12, исходя из 1,22 г продукта, полученного в предыдущей стадии Б, 20 см пиридина. 2,1 г хлористого тозила и 25 см концентрированной соляной кислоты. Получают 849 мг чистого продукта, который кристаллизуется в этаноле (Тпл 155° С). Вычислено, %: С 81,04; Н 8,16. СзоНзбОз (мол.м. 444,619) Найдено, %: С 81,2; Н 8,0, П р им е р 16. (17R) 11 (4-)1-{Пирролидинил(спиро)эстр-. 4,9-диен-17.2-(5Н)Фуран 3-он, Стадия А: циклический (Z) (1,2-этан диил)ацеталь 5 «, 17 /З-дигидрокси 11 /3-{4-) пирролидинил(фенил) 17а -(3-)тетрагидро 2Н-2-пиранилокси(1-пропенил)эстр-9-ен 3она. Действуют как в стадии Б примера 8, исходя из 1,71 г продукта, полученного в стадии А примера 8, 180 мг монохлорида меди и 20см бромида 4-{1-пирролидинил)фенил магния, титр 1 М/л. После экстракции эфиром, промывания водой и концентрации под уменьшенным давлением получают 4,39 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 7:3) и собирают 2,3 г целевого продукта, которые употребляют в данном виде в следующей стадии. Стадия Б: (Z) 17 -Гидрокси 17о:-(3-гидрокси 1-пропенил) 11/5 -(4-)1-пирролидинил(фенил)эстр-4,9-диен-3-он. В течение 2 ч 30 мин при комнатной температуре, а затем 30 мин при 50 С перемешивают 2,3 г полученного в стадии А продукта в 25 см метанола с 10 см 2 н. соляной кислоты. Охлаждают, разбавляют водой, подщелачивают, употребляя 20 см 1 н, водного раствора гидроокиси натрия, а затем - раствор бикарбоната натрия. Экстрагируют этиловым эфиром, промывают водой, сушат и удаляют растворители под уменьшенным давлением. Получают 1,825 г целевого продукта. ИК-спектр (СНС1з), ОН 3612 + связанный диенон 1054 , ароматическое соединение+-С С 1614, 1559, 1518. Стадия В: (17R) 11 уЗ - 4-Х1-Пирролидинил(спиро)эстр-4,9-диен-17,2 -(5Н)фуран}-3-он, ; Действуют как в примере 2. исходя из 1,4 г продукта, полученного в предыдущей стадии Б, 30 см пиридина, 3 г хлористого тозила, и производят экстракцию эфиром. Собирают J,25 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан -этиловый эфир уксусной кислоты 85:15). Получают 0,9 г целевого продукта. ИК-спектр (CHCt3), см диенон 1654, 1600, полосы ароматических соединений 1614, 1559, 1517, циклический С-О-С 1081,1040. Вычислено, %; С 81,72; И 8,18; N 3.07. C31H37N02 (мол.м. 455.64) Найдено, %: С 81,6; Н 8,2; N 3.0. Пример 17. (17R) 11 /3 -{2-Тиенил(спиро)эстр-4,9-диен-17,2 -{5Н)фуран1-3-он. Стадия А: Циклический (Z) (1,2-этан диил) ацеталь 5 «, 17/5-дигидрокси 17а-{3-)тетрагидро-2Н-2-пиранилокси(1-пропенил) 11 2-тиенил)эстр-9 ен-З-она. Действуют как в стадии Б примера 8, исходя из 2,5 г продукта, приготовленного как и в стадии А примера 8, 110 мг монохлорида меди и 22,2 см магнийорганического соединения, приготовленного как а примере 3, исходя Из 2-бром тиофена, титр 1,05 М/л. Получают 3,6 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 5:4) и собирают 2,196 г целевого продукта. ИК-спектр (СНС1з), ОН 3600 + связанный 3500, тиофен 1520, 852. Стадия Б: (Z) 17/3-Гидрокси 17а-(3-гидрокси 1-пропенил) 11 /3-(2-тиенил)эстр-4,9диен-3-он. Действуют как в стадии Б примера 13, исходя из 2,1 г полученного выше продукта, 20 см этанола и 2 2 н. соляной кислоты. Получают 1,1 г целевого продукта. ИК-спектр {СНС1з), см ОН 3600 + связанный диенон 1658, 1604, тиофен 1520. Стадия В. (17R) 11р - 2-Тиенил(спиро)эстр-4,9-диен-17,2 -(5Н)фуран 3-он, Действуют как в стадии Г примера 12, исходя из 1,03 г продукта, полученного в предыдущей стадии, 20 см пиридина, 2,1 г хлористого тозила и 25 см концентрированной соляной кислоты. Получают 984 г чистого продукта, которые кристаллизуют в этаноле (Тпл 182° С). Вычислено, %: С 76,49; Н 7,19; S 8,16. C25H28S62 (мол.м. 392,564) Найдено, %; С 76,4; Н 7,3; S 8,1. П р и м е р 18. {17R) 11 /3-4-Этилтир фенил(спиро)эстр-4,9-диен-17,2 (5Н)фурай 3он. Стадия А. Циклический (Z) (1,2-этан диил) ацеталь 5 «, 17 /J-дигидрокси 11/ -(4-)этилтио фенил) 17 а-{3-)тетрагидро-2Н-2-пиранилокси(1-пропенил)эстр-9-ен-3-она. Приготовление магнийорганического соединения. Действуют как в примере 3, исходя из 1,125 г магния и 9,3 г. 1-бром 4-этилтио бензола и получают раствор магнийорганического соединения, титр 0,87 М/л. Конденсация. Действуют как в стадии Б примера 8, употребляя 3 г продукта,полученного в стадии А примера 8, 110 мг монохлорида меди и 30 см полученного выше магнийорганического -соединения. После экстракции хлористым метиленом, промывания, сушки и удаления растворителей под уменьшенным давлением получают 10 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты 5:5), и собирают 3,519 г целевого продукта. ИК-спектр (СНС1з), см: ОН 3600 + связанный 3452, ароматическое соединение 1 592 (f), 1575 (f), 1492 (F). Стадия Б: (Z) 11 /5-(4-)Этилтио(фенил) 17 Д-гидрокси 17 а -(3-)гидрокси(1-пропенил)эстр-4,9-диен-3-он. В течение 30 мин перемешивают 3,474 г продукта, полученного в предыдущей стадии, в 60 см метанола с 2 см хлористого метилена и 5 см 2 н. соляной кислоты. Концентрируют до малого обьема, прибавляют 10 см водного раствора 1 н. гидроокиси натрия и экстрагируют хлористым метиленом. Промывают водой, сушат, удаляют растворители под уменьшенным давлением и получают 2,574 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 3:7), и кристаллизуют полученный остаток в этаноле. Собирают 1,052 г целевого продукта (Тпл ). ИК-спектр (СНС1з), см: ОН 3615 + свя-. занный 1654, 1602, 1556, 1492. Стадия В: (17RJ 11 Д-(4-)Этилтио фенил(спиро)эстр-4,9-диен-17,2 -(5Н)фуран 3он. Действуют как в примере 12 стадии Г, исходя из 600 мг продукта, полученного в предыдущей стадии, 15 пиридина, 1,5 г хлористого тозила. Получают 872 мг сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 5:5), и кристаллизуют в этаноле (Тпл 100° С). Вычислено: С 77,98; Н 7,67; 37,19. СзоНз4025 (мол.м. 446,657) Найдено, % : С 77,9; Н 7,7; S 7,1. Пример 19. (17R) 11 (4)4,5-Дигидро 4,4-диметил 2-оксазолил фенил(спиро)эстр4,9-диен-17,2 -(5Н)фураН 3-он. Стадия А: Циклический (Z) (1,2-этан диил) ацеталь 11/3-(4,5-дигидро) 4,4-диметил-2оксазолил(фенил)5« ,17)8 -дигидрокси 17 а(3-)тетрагидро 2Н-2-пиранилоксй(1-пропенил)эстр-9-ен-3-она. Приготовление магнийорганического соединения. Действуют как в примере 3, исходя из 3,5 г магния и 25 г 2(4-бромфенил)4,5-дигидро 4,4-диметил оксазола и полумают раствор титра 0,74 М/л. Конденсация. Действуют как в примере 3, исходя из 80 см раствора магнийорганического соединения, полученного выше, 800 мгмонохлорида меди и 10 г продукта, приготовленного как в стадии А примера 8. После хромотаграфии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 3:7) получают 14,3 г целевого продукта, употребляемого в данном виде в следующей стадии.
ИК-спектр (СНС1з), 17-ОН 3605 + связанный 3420, 5-ОН 3505,с м 1646, ароматическое соединение 1609, 1563, 1509.
Стадия Б. (Z) 11уб-(4-)4,5-Дигидро4,4-диметил 2-оксазолил(фенил) 17 8-гидрокси 17 «-(З-гидрокси 1-пропенил)эстр-4,9-диен-3он.
В инертной атмосфере растворяют 13,1 г предыдащего продукта в 130 см диоксана и 130 см 2 н. соляной кислоты, перемешивают 1 ч, выливают раствор в водный раствор бикарбоната натрия, экстрагируют этиловым эфиром уксусной кислоты, промывают водой, сушат и удаляют растворители под уменьшенным давлением. Получают 10,3 г сырого продукта, которые перёкристаллизуют в эфире (Трл 269° G).
Стадия В: (17R) (4-)4,5-Дигидро 4,4диметил-2-оксазолил фенил(спиро)эстр-4,9 -диен-17,2 -(5Н)фуран 3-он.
Вводят в суспензию 0,49 г полученного выше продукта в 10 см пиридина, прибавляют 1 г хлористого тозила, перемешивают 2,5 ч, разбавляют ледяной водой, отсасывают осадок и растворяют его в хлористом метилене, отделяют органический слой, сушат его и удаляют растворители под уменьшенным давлением. Остаток хроматографируют на двуокиси кремния (элюент хлористый метилен - этиловый эфир уксусной кислоты 1:1), и получают 0,41 г целевого продукта (Тпл 250° С).
Вычислено, %: С 79,47: Н 7,71; N 2,89.
C32H37N03
Найдено, %: С 79,5: Н 7,8; N 2,8.
П р и м е р 20. (17R) 11 -(4-)2-СДиметиламино)этокси фенил(спиро)эетр-4,9-17,2 (5Н)фуран 3-он.
Стадия А: Циклический (Z) (1,2-этан диил)ацеталь 5 а, 17/3-дигидрокси 11;3-(4-)2 (диметиламино)этокси(фенил) 17 а -(3-) тетрагидро-2Н-2-пиранилокси(1-пропенил)эстр-9-ен-3- на.
Действуют к 1к в стадии Б примера 8, употребляя на 75 5 см раствора; магнийорганического сое/ имения, приготовленного из 4-(М,М-димети i амино этокси) бромбёнзола, имея титр в ),7 М/л, 0,25 г монохлорида меди и 5 г продукта, полученного как в стадии А примера 8. После хроматографии на двуокиси кремния (элюент этиловый
эфир уксусной кислоты- триэтиламин 93:2) получают 2,620 г целевого продукта.
Стадия Б: (Z) 11/3 -(4-)2-Диметиламиноэтокси(фенил) 17/9-гидрокси 17 о:-(3-гидрокси 1-пропенил)эстр-4.9-диен-3-он.
Охлаждают до 0° С раствор, содержащий 2,62 г полученного выше продукта, в 13 см этанола, прибавляют 7,9 см 2 н. соляной кислоты, перемешивают 30 мин, прибавляют 6 см гидроокиси аммония, прибавляют 25 см воды и заново перемешивают 30 мин. Отсасывают образовавшийся осадок, растворяют его в хлористом метилене, сушат и концентрируют под уменьшенным давлением. Получают 1,948 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент этиловый эфир-уксусная кислота 8:2), а затем перекристаллизуют остаток в изопропаноле (Т пл 136 С).
Стадия В: (17R) 11/ -{4- 2ЧДиметиламино)этокси фенил(спиро)эстр- 4,9-диен-17,2(5H)фypaн 3-oн.
Действуют как в стадии Г примера 12, исходя из 2,268 г продукта, приготовленного в предыдущей стадии Б, 45 г пиридина, 4,5 г хлористого тозила и 45 см 6 н.соляной кислоты. После хроматографии (элюент этиловый эфир - уксусная кислота 95:5) и перекристаллизации в изопропаноле получают 0,815 г чистого целевого продукта (Тпл 136° С).
+ 156,5 ±3° (к 0,6% СНС1з).
П р и м е р 21. (17R) 11 б-(4-)2-(Метилтио)этокси фенил(спиро)эстр-4,9-диен-17,2 -(5Н)3-он..
Стадия А: Циклический (1,2-этан диил) ацеталь 5 а, 17/ -дигидрокси -(4-)2-(метилтио)этокси(фенил) 17 а -(З-)тетрагидро2Н-2-пиранилокси(1-пропенил)эстр-9-ен-3 -она.
Приготовление магнийорганического соединения. Действуют как в примере 3, употребляя 0,8 г магния и 6,1 г4-бром2-(метилтио)этокси бензола. Получают раствор титра 0,59 М/л.
Конденсация, Действуют как в стадии Б примера 8, исходя из 0,472 г продукта, приготовленного как в стадии А примера 8, 22 мг монохлорида меди и 8,3 см приготовленного раствора магнийорганического соединения. Получают 0,46 г целевого продукта.
ИК-спектр (СНС1з), 17-ОН 3600 + связанный 5-ОН 3505, ароматическое соединение 1608, 1580, 1507.
Употребляемый на исходе 4-бром2-(метилтио)этокси бензол (стадия А) получен следующим образом. В инертной атмосфере растворяют 73,9 г парабромфенола в 430 см нормального водного раствора гидроокиси натрия, прибавляют в 5 мин 47,3 г 2-хлорэтилметил сульфида и нагревают с рефлюксом 18 ч. Охлаждают, отсасывают образовавшийся хлорид натрия, промывают этанолом, сушат и удаляют растворители под уменьшенным давлением. Остаток забирают водой, экстрагируют эфиром, органический слой промывают нормальным водным раствором гидроокиси натрия, а затем водой, сушат и упаривают досуха. Остаток хроматографируют на двуокиси кремния (элюент гексан - этиловый эфир уксусной кислоты 95:5) и собирают 87 г целевого продукта, которые употребляют в данном виде для приготовления магнийорганического соединения.
Стадия Б: 17 -Гидрокси 17а-{3-гидрокси 1-пропенил) 11 /3 -(4-)2-(метилтио)этокси(фенил)зстр-4,9-диен-3-он.
Действуют как в стадии Б примера 18, употребляя 2,75 г продукта, приготовленного в предыдущей стадии А, 60 см метанола, 10 см хлорида метилена и 6 см 2 н. соляной кислоты. После хроматографии на двуокиси кремния (элюент хлористый метилен - ацетон 85:15) получают 3 г продукта, которые употребляют в данном виде в следующей стадии.
ИК-спектр (СНС1з), см 1710, ароматическое соединение 1607, 1507, 1572.
Стадия В: (17R) 11 /5 -(4-)2-(Метилтио)этокси фенил(спиро)эстр-4,9-диен-17,2 (5Н)фуран -3-он,
Действуют как и в стадии Г примера 12, из 1,4 г приготовленного выше продукта, 28 пиридина, 2,26 г хлористого тозила и 28 см 6 н. соляной кислоты. Получают 1.82 г кристаллизованного целевого продукта.
а Ь 1184,5 ±2° (к 1 % ).
ИК-спектр (СНС1з), 1656, 1608; 866, ароматическое соединение 1508, С-О-С 1082-1042.
.Вычислено, %: С 74,42; Н 7,89; S 6,39.
СзоНзбОзЗ (мол.м. 476.68 с сольватизацией ЕтОН 5%)
Найдено, %: С 74,5; Н 7,9; S 6,4.
П р и м е р 22. (17R) 11 8- 3-Метоксифенил(спиро)эстр-4,9-диен-17,2-(5Н)фуран -3он.
Стадия А: (Z) Диметил кеталь 5 -« , 17 Д-дигидрокси 11уЗ-{3-метокси фенил)17-{3-)тетрагидро-2Н-2-пиранилокси(1-пропёнил) зстр-9-ен-З-он.
Действуют как в примере 5, исходя из 3 г продукта, приготовленного как в примере Б Б, 190 мг монохлорида меди и 19 см раствора магнийорганического соединения, приготовленного исходя из 3-броманизола и имеющего титр в 1 М/л. После хроматографии на двуокиси кремния {элюент циклогексан - этиловый эфир уксусной кислоты 7:3 с 1% триэтиламина) получают 1,522 г целевого продукта.
Стадия Б: (2) 17 уЗ- гидрокси 11а-{3-гидрокси 1-пропенил) 11/3-(3-метоксифенил)эстр-4,9-диен-3-он.
Действуют как в примере 5 Г, исходя из
0 1,5 г полученного выше продукта и 1,5 г бисульфата калия. После хроматографии на двуокиси кремния (элюент н-гексан - этиловый эфир уксусной кислоты 7: 3) получают 0,8 г целевого продукта (Тпл 167-168° С).
5 Стадия В: (17R) 11 /8 - 3-Метоксифенил(спиро)эстр-4,9-диен-17,2 -(5Н)фуран 3он.
Действуют как в стадии Д примера 5, употребляя 0,77 г полученного в предыдущей стадии Б продукта, 20 см пиридина, 2,7 г хлористого тозила и 25 см концентрированной соляной кислоты. После хроматографии на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты 5:5) пол5 учают 0,624 г целевого продукта, которые кристаллизуют в этаноле (Тпл 170° С). Вычислено, %: С 80,73; Н 7.74. С28Нз20з (мол.м. 416,565) Найдено, %: С 80,4; Н 6,9.
Пример 23. (17R) 11 4-метоксифенил(спиро)эстр-4,9-диен-17,2 -(5Н):фуран 3-он.
Стадия А: (Z) Диметил кеталь 5 «. 17 -дигидрокси 11 4-метоксифенил) 17о:-(3-)тетра5 гидро-2Н-2-пиранилокси(1-пропенил)эстр9-ен-З-она.
Действуют как в стадии В примера 5, употребляя на исходе 3 г продукта, приготовленного в стадии Б примера 5, 190 мг
0 монохлорида меди и 19 см раствора магнийорганического соединения, приготовленного исходя из 4-броманизола и имеющего титр в 1 М/л. Послехроматографии на двуокиси кремния (злюент петролей5 ный эфир (Ткип 40-70° С) - этиловый эфир уксусной кислоты 7:3 с 1 % триэтиламина) получают 1.078 г целевого продукта и 0,625 г изомера 5 /З-гидрокси 11 а-(4-метоксифенил) (соответствующий).
Стадия Б: (7.) 17/3-Гидрокси 17а-(3-гидрокси-1-пропенйл) 11 -(4-метоксифенил)эстр-4,9-диен-3-он.
Действуют как в примере 5 стадии Г. 5 исходя из 1 г продукта, полученного, в предыдущей стадии А. и 1 г бисульфата калия. Получают 736 мг сырого продукта, которые употребляют 8 данном виде в следующей стадии.
Стадия В: (17R) 11 /8 - 4-Метоксифенил(спиро)эстр-4,9-диен 17,2 -(5Н)фуран 3он.
Действуют как в стадии Д примера 5, исходя из 736 мг полученного выше продукта, 20 см пиридина, 2,1 г хлористого тозила и 25 см концентрированной соляной кислоты. После хроматографии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 7:3) получают 383 мг целевого продукта, которые кристаллизуют в этаноле.СТпл 185° С).
Пример 24. (17R) 4 ,5 -Дигидро 11/8 2,3-дигидро 1-метил(1Н)индол 5-ил(спиро)эстр-4,9-диен 17,2 -(ЗН)фуран 3-он.
Стадия А: Циклический (1,2-этан диил)ацеталь 11/3- 2,3-дигидро 1-метил(1Н)-индол 5-ил 5 а, 17 /5-дигидрокси 17 с:-(3-)тетрагидро-2Н-2-пиранилокси(пропил) эстр-9-ен-З-она,
Действуют как в стадии Б примера. 12, употребляя на исходе 2,45 г продукта, приготовленного как в стадии А примера 12,110 мг монохлорида меди и 35 см раствора магнийорганического соединения, полученного как и в примере 3, исходя из 5-бром 2-метилиндолина и имея титр в 0,6 М/л. Получают 1,218 г целевого продукта.
Стадия Б: ,3-Дигидро 1-метил(1Н)индол-5-ил 17 у гидрокси 17 о;-(3-гидроксипропил)эстр-4,9-диен-3-он.
Действуют как в стадии В примера 12, исходя из 3,025 г продукта, полученного как это указано в предыдущей стадии, 30 см этанола и 5 см 2 н. соляной кислоты. Собирают 1,658 г целевого продукта,
ИК-спектр (СНС1з), см : свободный ОН 3619 + связанный сопряженный к.етон 1655, ароматическое соединение 1611 1497.
Стадия В: (17R) 4, 5 -Дигидро 11 Д-{2,3дигидро 1-метил (1 Н) индол 5-ил(спиро)эстр4,9-диен-17,2 -(ЗН)фуран 3-он.
Действуют как в стадии Г примера 12, исходя из 1,658 г продукта, полученного в стадии Б, 20 см пиридина, 2,2 г хлористого тозила и 20 см концентрированной соляной кислоты. После хроматографии на двуокиси кремния (элюент циклогексан этиловый эфир уксусной кислоты 7:3) получают 0,729 г чистого целевого продукта.
Вычислено, %: С81,22; Н 8,41; N3,16. C30H37N02 (мол.м. 443,634)
Найдено, %: С 81,0; Н 8,6; N 3,1. .Приме р 25. (17R) 4 , 5 -Дигидро 11 /(4-)3-M етил бутил (тио)фе н ил (спи ро)эстр-4, 9-диен-17,2 -{ЗН)фуран 3-он.
Стадия А: Циклический (1,2-этан диил)ацегаль 5 а, 17/9-дигидрокси 11/9(4- 3метилбутил(тио)фенил 17 а-(3-)тетрагидро 2Н-2-пиранилокси(пропил)эстр-9-ен-3-она. Действуют как в стадии Б примера 12, исходя из 3,5 г продукта, полученного в ста5 дии А примера 12, 1,24 г монохлорида меди и 22 см раствора магнийорганического соединения, полученного как это указано в примере 3, исходя из 4-1(3-метил)бутил тио
бром бензола, титр 1,05 М/л.
0 После хроматографии на двуокиси кремния (элюент хлористый метилен - ацетон 95:5 с 1 % триэтиламина) получают 4,08 г целевого продукта.
ИК-спектр (СНС1з), CMVOH 3620 - 3597
5 + соединенный, ароматическое соединение 1594(f), 1552 (f), 1492 (f).
Стадия Б: 17 8-Гидрокси 17 а- (3-гидрокси пропил)11/ -(4-)3-метил бутил(тио)фенил эстр-4,9-диен-3-он.
0 Действуют как в стадии Б примера 1б, исходя из 4,05 г продукта, полученного выше, 40 см метанола, 12 см 2 н. соляной кислоты. Получают 3,34 г сырого продукта, которые хроматогрэфируют на двуокиси
5 кремния (элюент хлористый метил - этиловый эфир уксусной кислоты 3:7) и собирают 2,3 г чистого целевого продукта,
ИК-спектр (СИС1з). ОН свободный
0 3620 + связанный диенон 1654,1601, ароматическое соединение 1554 - 1492.
Стадия В: (17R) 4 ,5 -Дигидро 11 /3-(4-){;3метилбутил(тио)фенил(спиро)эстр-4,9-диен -17,2 -(ЗН)фуран 3-он,.
5 Действуют как в примере 2, исходя из 2,3 г полученного выше продукта 45 см пиридина, 4,3 г хлористого тозила. Получают 2,14 г сырого продукта, который очищают перекристаллизацией в этаноле (Тпл 200° С).
0П р и м е р 26, (17R)4 , 5 -Дигидро 11
)1-пирролидинил фенил(спиро)эстр-4,9 -диен-17,2 -(ЗН)фуран 3-он.
Стадия А: Циклический (1,2-этан диил) ацеталь 5 а, 17/ -дигидрокси 11 /8-(4-)1-пир5 ролидинил(фенил) 17 а -(3)тетрагидро-2Н-2пиранилокси(1-пропинил)эстр-9-ен-3-она.
Действуют как в стадии Б примера 3, исходя из 3,5 г продукта, полученного как в стадии А примера 3,73 мг монохлорида меди
0 и 23 см раствора магнийорганического соединения, полученного как это указано в примере 3, исходя из М-{4-бромфенил)пирролидина. и имеющего титр в 1,3 М/л,
После хроматографии на двуокиси
5 кремния (элюент хлористый метилен - ацетон (92:8) с 1 % триэтиламина, а затем этиловый эфир уксусной кислоты - н-гексан (5:5) с 2% триэтиламина) получают 3,52 г целевого продукта.. ИК-спектр (СНС1з), см 17-ОН 3599, 5ОН 3508, ароматическое соединение 1615, 1599, 1517. Стадия Б: Циклический(1,2-этан диил)ацеталь 5 а , 17 Д-гидх)кси 11 /8 {4-)1-пирролидинил(фенил)17 а -(3-)тетрагцдро-2Н-2-пиранилокси(пропил)эсгр-9-€н-3-она. Действуют как в примере 4, стадия А, исходя из 2,62 г полученного выше продукта, растворяют в 172 см раствора (1-J) бензола и этанола и 1,048 г реактива Вилкинсона, гидрогенизируя 4 ч 45 мин. Получают 2,1 г целевого продукта. ИК-спектр fCHCIs), см: дублет 3620, 3600, 5 ОН 3505, ароматическое соединение 1614 - 1517. Стадия В: Гидрокси 17 а-(3-гидроксипропил)11 /9 -(4-)1-пирролидинил(фенил)эстр-4,9-диен-3-он. Действуют как в стадии Б примера 4, исходя из 2,09 г полученного выше продукта, 32 см метанола и 10,45 см 2 и. соляной кислоты. После хроматографии на двуокиси кремния (элюент хлористый метилен - метанол 95:5 с 2% триэтиламина) получают 1,31 г целевого продукта. ИК-спектр (СНС1з), диенон 1654 1590, ароматическое соединение 1614, 1559, 1518, ОН 3620 + связанный. ,. Стадия Г: (17R) 4 ,5 -Дигидро 11/ -{4-)1пирролидинил фенил(спиро)эстр-4,9-диен17,2 -(ЗН)фуран 3-он. Действуют как в стадии В примера 4, исходя из 1,28 г продукта, полученного в предыдущей стадии, 20 см пиридина и 2,6 г хлористого тозила. После хроматографии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 75:25 с 2% триэтиламин°а) получают 0,73 г целевого продукта. ИК-спектр (СН С1з), см диенон 1653 (F), 1600 (плечо), ароматическое соединение 1614 (F), 1559, 1518 (F). Вычислено, %: С 81.86; Н 9,27; N 2,69. Сз1Нз9М02(мол.м, 457,66) Найдено. %: С 81,6; Н 9,4; N 2,6. . (Сольватация: 12% циклогексан). П р и м е р 27. (17R) 11)6 -(4-)Метилтио фенил(спиро)эстр-1,3,5(10)-триен-17,2(5Н)фуранЗЗ-ол. Образование фенольного ацетата. Охлаждают до 3° С 0,5 г продукта, полученного в примере 3 Д, в растворе в 10 см хлористого метилена, а затем капля по капле прибавляют 0,5 см уксусного ангидрида, а затем 0,25 см бромида ацетила и перемешивают 50 мин. Реакционную среду разбавляют прибавкой 20 см ледяной воды, прибавляют 5 см 1 Н. водного раствора гидроокиси натрия, перемешивают 30 мин, экстрагируют хлористым метиленом, промывают органический слой, сушат его и удаляют растворители под уменьшенным давлением. ПолучаютО,584 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент н-гексан - этиловый эфир уксусной кислоты 7:3) и собирают 0,241 г целевого ацетата. Омыление. Полученный выше продукт забирают в 3 см этанола, прибавляют 4 капли 1 Н. водного раствора гидроокиси натрия, перемешивают, разбавляют прибавкой 10 см воды, отфильтровывают осадок, промывают его, сушат под уменьшенным давлением и очищают хроматографией на двуокиси кремния (элюент н-гексан - этиловый эфир уксусной кислоты 8:2). Получают 0,205 г целевого продукта. ИК-спектр(СНС1з), ОН 3600, ароматическое соединение 1602, 1582, 1434. П р и м е р 28. (17R) 11/3 -(4-)2-(Метилтио)этокси фенил(спиро)эстр-1,3,5(10)-три- ен 17,2 -(5Н)фуран 3-ол и его ацетат и (17R) 11/8 -(4-)2-(метилтио)этокси фенил(спиро)эстр-5(10)-диен-17,2-(5Н)фуран 3-он. Образование фенольного ацетата. Охлаждают до около 5° С раствор, содержащий 1 г продукта, полученного в примере 21, в 20 см хлористого метилена, прибавляют 1 см уксусного ангидрида и 0,5 см бромистого ацетила, а затем дают температуре подняться до комнатной. Перемешивают 50 мин, выливают в ледяной раствор бикарбоната натрия, перемешивают 10 мин, экстрагируют хлористым метиленом, разделяют органические слои, промывают их водой, сушат и удаляют растворители под уменьшенным давлением. Остаток хроматографируют на двуокиси кремния (элюент гексан - этиловый эфир уксусной кислоты 80:20, а затем 85:15) и получают 0,509 г ацетата (17R) 11/ -(4-)2-(метилтио)этокси фенил(спиро)эстр-1, .3,5 (10)-триен-17.2 -(5Н)фуран 3-ола. ИК-спектр (СНС1з), см-: 1746, сутствие (. средняя полоса 1664, с другой стороны получают 90 мг (17R) 11 /3-(4-)2-(метилтио)этокс|4фенил(спиро)эстр-5(10), 9(11 )-диен-17,2-(5Н)Фуран13-он. ИК-спектр (СНС1з). см-: 17t1, ароматическое соединение 1607, t507, 1507. Омыление. 0,5 г вышеуказанного фенольного ацетата забирают в 7,5 см метанола и 1 см хлористого метилена, а затем капля по капле прибавляют 0,5 см натрового щелока и перемешивают 20 мин при комнатной температуре. Разбавляют водой, подкисляют 2 н, соляной кислотой, экстрагируют хлористым метиленом, промывают водой, сушат и удаляют растворители под уменьшенным давлением; остаток хроматографируют на двуокиси кремния (элюент гексан - этиловый эфир уксусной кислоты 8:2), а затем хлористый метилен и получают 354 мг целевого (17R). 11 /б -(4-)2-метилтио)этокси фенил(спиро)эстр-1,3,5{10)-триен -17,2 -(5Н)фуран 3-ола, которые перекристаллизуют в изопропаноле(Тпл 198° С). ИК-спектр (СНС1з). см фенольный ОН 3599, ароматическое соединение 1610, -п-г / 1086-1037. 1582, 1511, С-О-С а о-84,5± 1,5° (к 0,.8% СНС1з). П р и м е р 29. (17R)2 уЗ-Метил 11Д- (4-)метилтио фенил(спиро)эстр-4,9-диен-17,2 (5Н) -фуран -3-он и соответствующий изомер 2оС -метил и (17К)2,2-диметил 11 /3-{4-)метилтио фенил(спиро}эстр-4,9-диен17,2-(5Н)фураН 3-он. В инертной атмосфере охлаждают до -65° С (-70° С) 2,45 см н-бутиллития в растворе в гексане (1,6 М) и 5 см тетрагидрофурана и прибавляют в 20 мин 0,66 см циклогексил изопропиламина в 5 см тетрагидрофурана, перемешивают 15 мин, прибавляют в 30 мин 1,4 г полученного в примере 3 (17R) (4-) метилтио фенил(спиро)зстр-4,9-диен-17.2 -(5Н)-фуран 3она в суспензии в 15 см тетрагидрофурана, перемешивают 15 мин, прибавляют 0,4 см иодида метила. Дают температуре подняться до комнатной, перемешивают 1 ч, прибавляют 20 см водного раствора хлористого аммония, декантируют, промывают органический слой солевой водой, заново экстрагируют этиловым эфиром уксусной кислоты, сушат и концентрируют досуха. Получают 1,5 г сырого продукта, которые хроматографируют на двуокиси кремния, элюируя смесью петролейный эфир (Ткип 40 /70° С) - этиловый эфир уксусной кислоты (9:1). Собирают 290 мг изомера (17В)2/ -метил 11/S -{4-)метилтио фенил(спиро)эстр-4,9-диен17,2 -(5Н)фуран 3-он, которые перекристаллизуют в изопропиловом эфире (Тш 176° С), 355 мг изомера 2й(-метил, которые перекристаллизуют в изопропиловом эфире (Тпл -164° С), и 65 мг (17Я)2,2-диметил 11/3 -(4- ) метилтио фенил(спиро)эстр-4,9-диен-17,2 (5Н)фуран 3-она. ИК-спектр (), см : изомер 2 р-метил 1656, 1605 и 865, 1654, комплекс макс. 1595, изомер 2 а-метил ароматическое соединение 1492 (плечо), 1607, продукт 2,2-диметил 651, С-С 1603, ароматическое соединение 1492. П р и м е р 30. (E)(17R) Оксим (4)метилтио фенил(сПиро)эстр-4,9-диен-17,2 -(5Н)фуран 3-он и соответствующий изомер (2). В инертной атмосфере нагревают 75 мин с рефлюксом 1,36 r(17R) 11)5-(4-)метилтио фенил(спиро)эстр-4,9-диен-17,2 (5Н)фуранЛЗ-она, полученного в примере 3 в 14 см этанола с 2,6 см пиридина и 0,44 г хлоргидрата гидроксиламина. Дают температуре подняться до комнатной, выливают в 100 см воды, экстрагируют этиловым эфиром уксусной кислоты, промывают органический слой, сушат его и концентрируют досуха под уменьшенным давлением. Получают 1,47 г сырого продукта, которые хроматографируют на двуокиси кремния, элюируя смесью петролейного эфира (Ткип 40-70°С) - этилового эфира уксусной кислоты (8:2). Собирают 805 мг изомера (Е), который растворяется в горячем виде в хлористом мё-i тилене и перекристаллизуется в изопропи- . ловом эфире (Тпл 250° C)v 390 мг изомера (Z), который перекристаллизуется таким же образом (Тпл 266° С), Изомер (Е): ИК-спектр (СНС1з), см: ОН (оксим) 3585 + соединенный сопряженная система + ароматическое соединение 1613 (макс) 1592 (плечо) 1544 и 1491, С- О- С 1081 и 1040. Вычислено, %: С 75,13: Н 7,43: N3,13: S 7.16. C28H33N02S (мол.м. 447,64) Найдено: С 75,0; Н 7,5: N 3,1: S 7,1. Изомер (Z): ИК-спектр (СНС1з), ОН (оксим)3598 + (связанный), сопряженная система + ароматическое соединение 1613 (макс.) 1598, 1555 (f) и 1592 (f|, С-О-С- 1081 и 1040. Найдено, %: С 74,9; Н 7,3: N 2,9: S 7,0. П ример31.(17Я)4,5-Дигидро9а;0 а-эпокси 11J9-(4-)(3-мeтилбyтил)cyльфoнил(спиро)эстр-4-ен-17,2 -(ЗН)фуран 3-он. 0,8 г продукта, полученного в примере 25, растворяют в 20 см хлористого метилена, охлаждают до 0° С, прибавляют маленькими порциями 1,64 г метахлорпербензойной кислоты и перемешивают 1 ч. Прибавляют 0,2 н. раствор тиосульфата натрия, перемешивают 5 мин, выливают в насыщенный водный раствор бикарбоната натрия, экстрагируют хлористым метиленом, промывают
водой, сушат и удаляют растворители под уменьшенным давлением. Получают 0,980 г целевого продукта, которые кристаллизуют в смеси хлористый метилен - изопропиловый эфир (Тпл 203° С),
ИК-спектр (СНС1з), ::С:::0|1669(Р), + ароматическое соединение 1620, 1597,1492,8021317-1144.
Вычислено,%: С 71.34; Н 7,85; S 5,95.
C32H4205S (мол.м. 538,75)
Найдено, %; С 71,2; Н 7,9; 55,7.
П р и м е р 32. (17В)-4-(3-Оксо спиро)зстр4,9-диен-17,2 -(5Н)фуран{11/З-ил) бензоат2амино 2-метил пропила.
Растворяют 4,32 г полученного как в примере 19 (17R) (4-)4,5-дигидро 4,4-диметил 2-оксазолил фенил(спиро)эстр-4,9.диен-17,2 -(5Н1фуран13-она в40см диоксана и 40 см 2 н. соляной кислоты, а затем нагревают 3,5 ч при 60° С. Охлаждают, выливают в ледяной водный раствор бикарбоната натрия, экстрагируют хлористым метиленом, промывают водой, сушат и удаляют растворители под уменьшенным давлением.
Собирают 4,6 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент этиловый эфир уксусной кислоты, а затем этиловый эфир уксусной кислоты - триэтиламин 9:1). После кристаллизации в эфире, а затем в этиловом эфире уксусной кислоты, получают 2.54 г целевого продукта (Тпл 178° С).
. ИК-спектр (СНС1з), см : сопряженный сложный эфир 1715, кетон в 3 1658 + ароматическое соединение 1608. 1569 (плечо). 1504ЫН2(деф).
Вычислено, %: С 76,61; Н 7,83; S 2.79.
Сз2Нз95О4 (мол.м. 501,67)
Найдено,-%: С76.3; Н 7,7; S 2,6.
Пример 33. Этиловый эфир (17R)4-(3оксо спиро)эстр-4,9-диен-17.2 -(5Н)фуpaц(ft -ил)бензойной кислоты и (17R) 4-{3-оксо спиро)эстр-4,9-диен-17.2 -(5Н)-фуран(11 ;5-ил) М-2-гидрокси-1.1-диметилэтил бензамид.
В инертной атмосфере при комнатной температуре перемемешивают 2 ч 2,06 г продукта, полу.енного в примере 32, в суспензии в 50 см этанола и 8 см этанолового раствора этилата натрия (0,7 М). Суспензию выливают в ледяной водный растворсоляной кислоты и экстрагируют хлористым метиленом. Промывают органический слой. сушат его, удаляют растворители под уменьшенным давлением, хроматографируют остаток на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 7:3, а затем этиловый эфир уксусной
кислоты - триэтиламин 9:1 и 6:4). Получают 1.375 г целевого продукта в виде этилового эфира бензойной кислоты (продукт А), который перекристаллизуют в эфире, а потом в этаноле (Тпл 140° С), а затем 182° С, а также 0.385 г целевого продукта N-2-гидрокси (1,1диметилэтил)бензамид (продукт В), которые перекристаллизуют в эфире, а потом в изопропаноле (Тпл 147-157° С).
ИК-спектр продукта А (СНС1з), сопряженный сложный эфир 1711. диенон 1658 + ароматическое соединение 1608. 1570, 1503.
ИК-спектр продукта В (СНС1з). вто5 ричный амид NH 3430, амид N 1526, амид+ С 0 диенон 1655, диенон 1607, ароматическое соединение 1566 - 1498. ОН ,53618.
Пример 34. (17Н)4-Спиро-(3-)оксо
0 эстр-4.9-диен-17,2 -(5Н)фуран(11/3 -ил)бензойная кислота.
Продувают азотом в течение 20 мин суспензию, содержащую 0.3 г про.цукта А, полученного в примере 33, в 3 см этанола и
5 прибавляют 1 см 1 н. водного раствора гидроокиси натрия. Нагревают при 60° С. полтора часа, охлаждают и выливают в разбавленный раствор соляной кислоты. Экстрагируют этиловым эфиром уксусной
0 кислоты, промывают водой, сушат и удаляют растворители под уменьшенным давлением и получают 0,250 г сырого продукта, которые очищают хроматографически на двуокиси кремния (элюент этиловый эфир
5 уксусной кислоты,Тпл ci170° С).
П р и м е р 35. (17Р)13/ -Этил 11 /3-(4-метилтио фенил(спиро)гона 4,9-диен 17,2 (5Н)фуран 3-он.
Стадия А: Циклический (1.2-этан ди0 ил)ацеталь 5 а 10 «-эпокси-13 Д-этил гона 9(11)-енЗ,17-диона.
При комнатной температуре 21,3 см полуторного гидрата гексафторацетона прибавляют к раствору 21,36 г циклического
5 (1.2-этандиил)ацеталя 13 уЗ-этил гон-5(10). 9(11)-ен-17-она в 213см хлористого метилена, охлаждают до 0°/5° С и прибавляют в 5 мин 42.7 см перекиси водорода и перемешивают 2 ч 15 мин в инертной атмосфере.
0 Прибавляют тиосульфат нatpйя, экстрагиpyюt хлористым метиленом, промывают, сушат и удаляют растворители под уменьшенным давлением. Получают 26,41 г целевого продукта.
5 ИК-спектр(СНС1з), см 1730. СН2 в16 1406, 1640.
Стадия Б: Циклический (Z) 3,3-(1,2-этан диил) ацеталь 5 «, 10а-эпокси 1зДэтил 17 /j-гидрокси 17 «-(3-)1-тетрагидро-2Н-2-пиранилокси(1-пропинил)гон-9(11)-ен-3.17-дио на,
Действуют как в стадии А примера 5, исходя из 19,9 г полученного выше продукта и 14,6 см реактива НС С-СН20ТНР. давая действовать 15ч при комнатной температуре. Получают 33,533 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент хлористый метилен - этиловый эфир уксусной кислоты 9:1), и получают 15,498 г целевого продукта.
ИК-спектр (СНС1з), см: ОН- 3599. -С С1640.
Стадия В: Циклический (2)(1,2-этандиил) ацеталь 5 а , Юа-эпокси 13у5-этил-17/3 -гидрокси 17 «-(З-)тетрагидро 2Н-2-пиранилокси(1-пропенил)гон-9(11)-ен-3-она.
В течение 4 ч гидрогенизируют под давлением в 1,2 бар 15,45 г продукта, полученного в стадии В, в 320 см этилового эфира уксусной кислоты и 3,2 см пиридина, в присутствии 154 мг 10%-ного сернокислого бария на палладии. Отфильтровывают катализатор, промывают этиловым эфиром уксусной кислоты и концентрируют досуха. Получают 14,705 г сырого продукта, которые хроматографируют на двуокиси кремния (элюент хлористый метилен - этиловый эфир уксусной кислоты 9:1). Собирают9,819 г целевого продукта.
ИК-спектр (СНаз), см: ОН 3600 (f) соединенный 3420, 1640 (f).
Стадия Г: Циклический (7)(1,2-этан диил) ацеталь 5 «. -дигидро этил 11 (4-метилтио)фенил-17а-{3-)тетрагидро 2Н2-пиранилокси(1-пропенил)гон-9(Т1)-ен-3она.
Действуют как в стадии Б примера 3, исходя из 3,5 г полученного в предыдущей стадии продукта, 178 мг монохлорида меди и 16,3 см раствора магнийорганического соединения парабромтиоаниэола, титр 1,1 М/л. После хроматографии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 7:3) получают 3,46 г целевого продукта.
ИК-спектр (СНС1з), см ОН 3600 (F) + соединенный 3500 (F), ароматическое соединение 1592, 1556, 1492.
Стадия Д: (Z 13/3-Этил 17у$-гидрокси 17 а-(3-гидрокси-1-пропенил)11 уЗ-(4-)метилтио(фенил)гона-4,9-диен-3-она..
В инертной атмосфере прибавляют 17 н. соляной кислоты в суспензию 3,4 г полученного выше продукта в 68 см этанола и перемешивают 1,5 ч при комнатной температуре. Выливают на лед, прибавляют 5 см гидрата окиси аммония, промывают водой, сушат и концентрируют досуха под уменьшенным давлением. Получают 2,961 г
сырого продукта, которые хроматографируют на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислоты 5:5). После кристаллизации в изопропиловом эфире получают 1,816 г целевого продукта (Тпл 186°С).
ИК-спектр(СНС1з), ОН 3616, сопряженный 1652 (F), +ароматическое соединение 1597, 1555, 1492 (F).
Стадия Е: (17R) 13 Д-Этил (4-)метилтио фенил(спиро)гона-4,9 -диен-17,2-(5Н)фуран 3-он.
Действуют как в стадии Д примера 3. исходя из 1,5 г предыдущего продукта, 30 см пиридина, 3 г хлористого тозила и 180 см 2 н. соляной кислоты. Получают 1,981 г сырого продукта, которые подвергают хроматографии на двуокиси кремния (элюент циклогексан - этиловый эфир уксусной кислОты 7:3, а затем 8:2).
ИК-спектр (СНС1з), сопряженный 1653. + ароматическое соединение 1598. 1556. 1491.
Пример 36, (17R) 11 (4-) 2 иметиламино)этокси ф8нил(спиро)эстр-1,3,5(10)-триен-17,2 -(5Н)фуран 3-ол и его ацетат.
Образование фенольного ацетата. Действуют как в примере 28, употребляя на исходе 0,250 г продукта, полученного в примере 20. 0,25 см уксусного ангидрида и 0,2 см ацетилбромида.
После очищения хроматографией получают 0,150 г целевого продукта.
Омыление. Действуют как в примере 28, употребляя на исходе 70 мг полученного выше ацетата в 1,5 см метанола С 0,1 см натрового щелока, и получают 60 мг целевого продукта.
ИК-спектр (СНС1з), ОН 3600; аромасоединение 1610, 1581, 1512,
тическое о
лп
/
J 1086.
Применяя те же действия, получают следующие соединения:
(17R) 4 , 5 -дигидро 11 (4-)метил(диметиламино этил) амино фенил(спиро)эстр4,9-диен-17,2(ЗН)фуран 3-он:
(17R)4 ,5-дигидро (4-)метил(диметиламино этил) амино фенил(спиро)эстр1,3.5(10)-триен-17,2 -(ЗН)фуран 3-ол;
(175)4,5-дигидро-11/(4-)диметиламино фенил(13 а -метил спиро)гона-4,9-диен17,2 -(ЗН)фуран 3-он:
(17R)4 ,5 -дигидро-11/ -(4-)диметиламино фенил(13 а -метил спиро)гона-4,9-диен17,2 -(ЗН)фуран 3-он.
Фармакологическое исследование продуктов.
I. Исследование активности продуктов изобретения на гормонных рецепторах.
Прогестогенный рецептор матки кролика.
Кролики самки, не достигшие половой зрелости, массой около 1 кг, получают накожным способом 25 г эстрадиола. Через 5 дней после применения животные умерщвляются, матки вынимаются, взвешиваются и гомогенизируются при О С, при помощи Поттера тефлон-стекло в буферном растворе TS (Трис 10 мМ, сахароза 0,25 М, HCI рН 7,4 (1г ткани на 50 мл TS). Затем продукт гомогенизации ультра центрифугируется (Ш5000ф X 90 мин) при . Таким образом полученные аликвотные части, находящиеся на поверхности, подвергаются инкубации при 0° С в течение времени t, при постоянной концентрации (Т) насыщенного тритием продукта R (17,21-диметил 19-нор 4,9-прегнадиен 3,20-дион) в присутствии увеличивающихся концентраций (0-2500 х10 М) или холодного R, или холодного прогестерона, или холодного исследуемого продукта. Затем концентрация связанного насыщенного тритием R (В) измеряется в каждом продукте инкубации техникой поглощения уголь-декстран.
Глюкокортиноидные рецепторы загрудинной железы крысы.
У крыс самцов Sprague-Dawley HOPS массой 160-200 г удаляются надпочечники. Через 4-8 дней после этого удаления животные умерщвляются, и загрудинные железы вьжимаются и гомогенизируются при 0° С в буферном растворе (трис 10 мМ, сахароза 0,25 М, дитиотрейтол 2 мМ, HCI рН 7,4) при помощи Поттера политетрафторэтилен стекло (1 гткани на 10мл TS). Затем продукт гомогенизации ультрацентрифугируется (1050000/ X 90 мин) при 0°С. Таким образом полученные аликвотные части, находящиеся на поверхности, подвергаются инкубации при 0° С в течение времени (t) с постоянной концентрацией (Т) насыщенного тритием дексаметазона в присутствии увеличивающихся концентраций (0-2500 10 М), или холодного дексаметазона, или холодного изучаемого продукта. Концентрация связанного обработанного тритием (насыщенного) дексаметазона (В) измеряется затем в каждом продукте инкубации техникой поглощения уголь-декстран.
Вычисление относительного аффинйтета связи (ARL) одинаковое для всех рецепторов (табл. 1).
Чертят две кривые: процентное отношение связанного насыщенного тритием гормона В/Т в зависимости от логарифма
концентрации холодного гормона контроля и B/t в зависимости от логарифма концентрации холодного изучаемого продукта. Определяют прямую уравнения Iso (В/Тмакс + +B/TMHH)/Z
В/Тмакс процентное отношение связанного насыщенного тритием гормона для инкубации этого гормона (насыщенного тритием) при концентрации (Т).
В/Тмин процентное отношение связанного насыщенного тритием гормона для инкубации этого насыщенного тритием гормона при концентрации(Т)в присутствии большого избытка холодного гормона (2500 10 М).
Пересечение прямой (БОИ кривых позволяет оценить концентрации холодного гормона контроля (СН) и холодного изучаемого продукта (СХ), которые тормозят на 50% связь насыщенного тритием гормона на рецепторе.
Относительный аффинитет связи (ARL) изучаемого продукта определяется уравнением
ARL 100
(СХ)
Исследуемые продукты, в частности продукт примера 4, проявляют очень заметный аффинитет для глюкокортикоидных и прогестогенных рецепторов.
Их полученных результатов можно заключить, что продукты могут проявлять агонистические или антагонистические активности глюкокортикоидов и прогестогенов.
II. Антиглюкокортикоидные активности.
Применяемая техника вытекает из известного способа для клеток загрудинной железы мышей.
Клетки загрудинной железы крыс, У которых надпочечники были удалены, подвергаются инкубации при 37° С в течение 3 ч в питательной среде, содержащей 5-10® М дексаметазона в присутствии или в отсутствии изучаемого продукта при различных концентрациях. Прибавляют насыщенный тритием уридин, и продолжают икубацию еще 1 ч. Охлаждают продукт инкубации, обрабатывают его 5%-ным раствором трихлоруксусной кислоты, фильтруют на ватманской бумаге GF/A, промывают три раза при помощи 5%-ного раствора трихлоуксусной кислоты. Определяют радиоактивность, которая удерживается фильтром.
Глюкокортикоиды и, в частности дексаметазон, вызывают уменьшение включения насыщенного тритием уридина. Продукты примеров, 1-4 противодействуют этому эффекту (табл. 2) Если исследуемые продукты употребляются одни, то они не проявляют никакого эффекта типа глюкокортикоида. Исследуемые продукты проявляют очень отмеченную противоглюкокортикоидную активность, и одновременно они лишены глюкокортикоидной активности. Ill, Вызывающая аборт активность у крысы. Определяют день Si беременности присутствием сперматозоидов в вагинальном мазке, В день Зд беременности вводят продукт суспензии в карбоксиметилцеллюлозе. .содержащей 0,5% твина. Животные умерщвляются 72 ч после обработки и матки исследуются для определения состояния беременности. Устанавливают полный аборт на всех животных труппы с продуктами примеров 1-4, введенными в дозах 3 мг/кг. Результаты при дозе 1 мг/кг для продукта примера 3: 100% аборт; мифепристон0% аборт. Токсичность у целевых продуктов способа отсутствует, Ф о р м у л а и 3 о б р е т е и и я Способ получения стероидов, замещенных спирановь1м циклом, общей формулы волнистая линия спироэфира указывает на то, что атом кислорода может находиться в а - или -положении; пунктир в положении 3,4 означает возможную углерод-углеродную связь, отличающийся тем, что соединение общей формулы„ Х., ..иИ он где Ri-R3 имеют указанные значения; К - защитная группа кеталя, или соединение общей формулы СНзЧЗН сн-сн сн,он где RI имеет указанные значения, подвергают взаимодействию.с реагентом циклизации с получением или смеси продуктов общей формулы
СН,
R
где RI-диалкилС1-С4аминофенил, Ci-C/1-алкоксифенил, ацетилфенил, Ci-C4алкилтио, С1-С4-алкилоксифенил, N-Gi-C4алкилдигидроиндол, пирролидинилфенил, Ci-Сб-алкилтиофенил, возможно окисленный;
R2 и Вз вместе образуют углерод-углеродную связь или эпоксигруппу;
м
где Ri и К имеют указанные значения, и продуктов общей формулы (I), которую Хроматографически. разделяют с последующим обезвоживанием продукта формулы (IV) с одновременным снятием кетальной защиты для получения продукта общей формулы (I) или получением продукта общей формулы (О с последующей при необходимости зпоксидацией..
43
44
1715205
Табл и ца2



















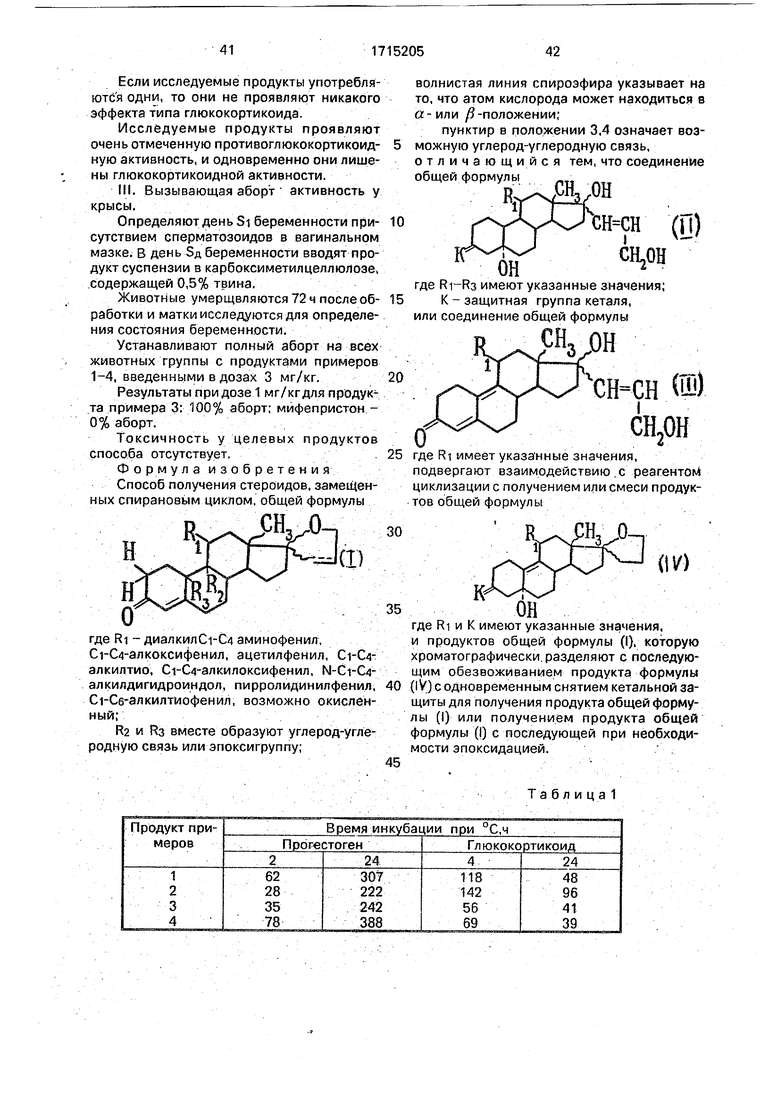
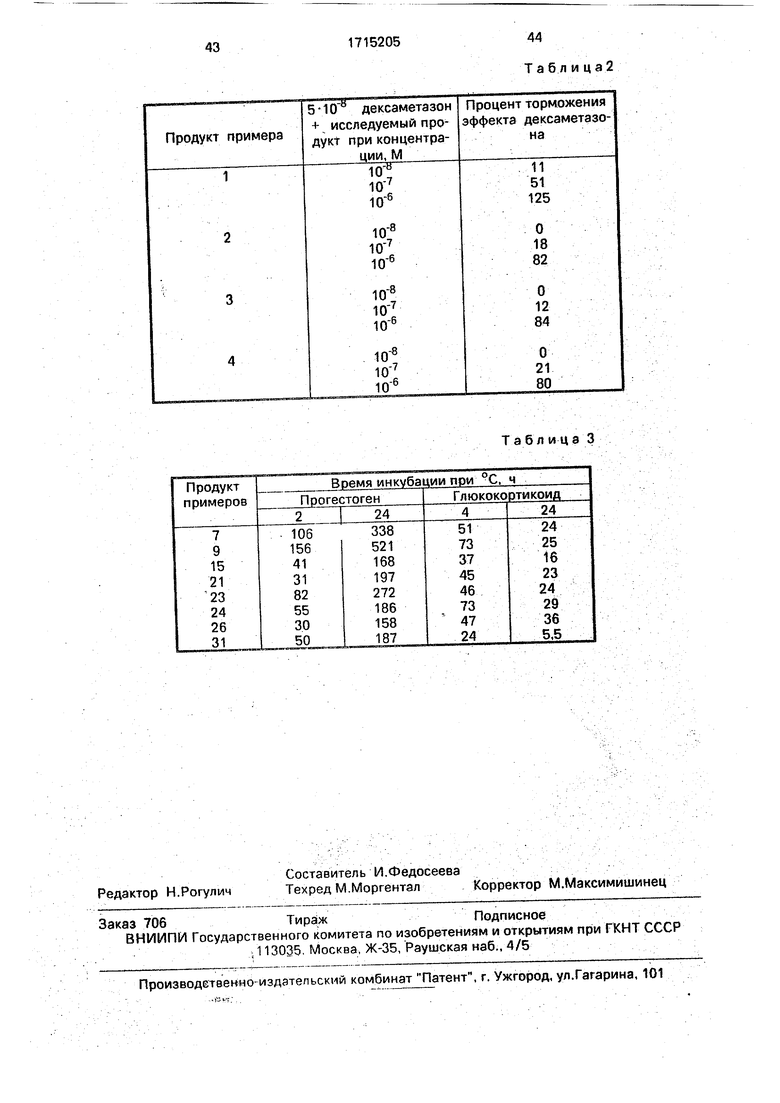
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных стероидов | 1988 |
|
SU1665877A3 |
| ПРОИЗВОДНЫЕ ОМЕГА-ФЕНИЛАЛКАНОВЫХ КИСЛОТ, ПРОЯВЛЯЮЩИЕ АНТИГЛЮКОКОРТИКОИДНЫЕ, АНТИАНДРОГЕННЫЕ И АНТИПРОГЕСТОМИМЕТИЧЕСКИЕ СВОЙСТВА | 1992 |
|
RU2041236C1 |
| Способ получения производных стероидов | 1982 |
|
SU1447289A3 |
| Способ получения производных @ @ 19-норстероидов | 1983 |
|
SU1340593A3 |
| СРЕДСТВО ДЛЯ СИНХРОНИЗАЦИИ РОЖДАЕМОСТИ У СВИНОМАТОК И СПОСОБ СИНХРОНИЗАЦИИ РОЖДАЕМОСТИ | 1991 |
|
RU2037295C1 |
| ПРОИЗВОДНЫЕ 19-НОРСТЕРОИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1992 |
|
RU2111213C1 |
| Способ получения производных аминобензоциклогептена или их солей | 1976 |
|
SU682121A3 |
| Способ получения эфиров-производных циклопропанкарбоновой кислоты | 1981 |
|
SU1428189A3 |
| ПРОИЗВОДНЫЕ 11β-БЕНЗАЛЬДОКСИМ-ЭСТРА-4,9-ДИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2137777C1 |
| СПОСОБ ПОЛУЧЕНИЯ 11-КЕТОСТЕРОИДНОГО ПРОИЗВОДНОГО | 1993 |
|
RU2108340C1 |
Изобретение относится к получению стероидов, замещенных спирановым циклом ф-лыН.. Г -О'где RI - диалкил Ci-C4 аминофенил, С1-С4-алкоксифенил, ацетил фен ил, СтС^-алкилтио, С1-С4-алкилоксифенил, N-C1-C4-aлкилдигиДpoиндoл, пирролиди- нилфенил, С1-Сб -алкилтиофенил, возможно окисленный; На + Ra образуют углерод-углеродную связь или эпоксигруппу; волнистая линия спироэфира указывает на то, что атом кислорода может находиться в а- или ^-положении; пунктир в положении 3, 4 означает возможную углерод-углеродную связь, которые обладают фармакологическими свойствами. Цель изобретения - разработка способа получения указанных соединений. Получение ведут циклизацией 3-кеталь- или' 5 а-гидрокси.Л 9
Т а б л и ц а 3
| Станок для изготовления оптических изделий с асферическими поверхностями вращения второго порядка | 1959 |
|
SU129499A1 |
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| Кинематографический аппарат | 1923 |
|
SU1970A1 |
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
Авторы
Даты
1992-02-23—Публикация
1987-11-24—Подача