СМ
Изобретение относится к способу получения новых производных / -карбо- лина общей формулы ((I)
1где RI - оксадиазолгруппа формулы
1Л..
где К4-С -С -алкил;
или группа общей формулы
COOR
5
где RS низший алкил;
RJ - водород, С,-С -апкил или группа общей формулы
где Rfe - С -С -алкил-,
R - в 5- или 6-положении группа 30 общей формулы
COOR ;
где R-, - низший алкил, С1-С5-алкок- сиалкил или бензил, или пиперидин- карбонилгруппа, которые проявляют действие на центральную нервную систему и поэтому могут быть использованы в качестве психотропных средств в медицине.
Целью изобретения является разра ботка способа получения новых соединений из класса карболина, которые бы обладали более высокой эффективностью по действию на центральную нервную систему по сравнению со структурными аналогами, например, с этиловым эфиром -карболин-3-карбо- новой кислоты.
Пример 1. 1,97 г этилового эфира 6-иод-4-этил-/}-карболин-3-кар- боновой кислоты в атмосфере монооксида углерода в 30 мл бензилового спирта вместе с 1,34 мл трибутиламина нагревают до 100°С. Затем добавляют ацетат палладия (II), хорошо промывают монооксидом углерода и перемешивают 2 ч при . После от
0
5
0
5
0
5
0
5
0
гонки бензилового спирта остаток растворяют в 300 мл метиленхлорида, промьшают последовательно 80 мл 1н. соляной кислоты, 100 мл полунасьш1ен- ного раствора бикарбоната натрия, а также 100 мл насыщенного раствора хлорида натрия, высушивают, отфильт- ровьшают и концентрируют. После перекристаллизации из смеси этанола с петролейным эфиром получают мг этилового .эфира 6-бензилоксикарбо- НШ1-4-этил-/ |-карболин-3-карбоновой кислоты с т.пл. 212-215 С.
Аналогичным образом получают:
этиловый эфир 6-бутоксикарбонил- -4-метил-р-карболин-З-карбоновой кис лоты с т. пл. 179-186°С, выход 30%;
этиповый эфир б-пропоксикарбонил- -4-метил-р-карболин-3-карбоновой кислоты с т. пл. 235-240 с (этанол), выход 25%;
этилрвьй эфир 6-бензилоксикарбонил- -4-метил-/1-карболин-3-карбоновой кислоты, с т. пл. 213-214°С (этанол/тек- сан), выход 65% ,
этиловый эфир 6-бензилоксикарбо-- нил-4-метоксиметил-/ь-карболин-3-кар- боновой кислоты с т. пл. 183-185°С (уксусный эфир/гексан), выход 60%
этиловый эфир 6-бензилоксикарбо- нил- -карболин-3-карбоновой кислоты с т. пл. 265-272°С (диметилформамид), выход 66%i
пиперидид (3 -этил-1 ,2,4- -оксадиазол)-ил J -(4-карболин-6-кар- боновой кислоты с т. пл. 291-295 с, выход 35%;
пиперидид (3 -этил-Г ,2,4- -оксадиазол) -ил -4-метил-(-карболин- -6-карбоновой кислоты, с т. пл. 243- 245 С, выход 88%;
этиловьй эфир 6-(2-метоксиэтил)- -оксикарбонил-/1-карболин-3-карбоновой кислоты с т. пл. 169-174°С (этанол/ гексан);
бутиловый эфир 6-бутоксикарбоннл- -4-метил-/ь-карболин-3-карбоновой кислоты с т. пл. 140-145°С, выход 10%-,.
этиловый эфир 6-бутоксикарбонил-4- -метоксиметил-р-карбонил-3-карбоно- вой кислоты с т. пл. 150-152 С (этанол/гексан) . выход .45%;
этиловьй эфир 3-Г5 -(3 -этил-1 , 2 ,4 -оксадиазол)-ил - -карболин-6- -карбоновой кислоты с т. пл. более (разложение), выход 20%.
Пример 2. 700 мг этилового эфира 6-иод-4-метил-(-карболин-3-карбоновой кислоты в 18 мл пиперидина смешивают с 0,6 мл трибутилами- на и нагревают до 60°С в атмосфере монооксида углерода. При этой темпе- ратуре добавляют 18 мг (о- -толил)-фосфин -палладий(II)-дихлори да, хорошо ополаскивают монооксидом углерода и затем нагревают смесь в течение 2,5 ч при . После разбав ления метиленхлоридом отфильтровывают и выпаривают. Остаток распределяют в смеси метиленхлорида и 1 н, соляной кислоты, органическую фазу про мьшают дважды 1 н, соляной кислотой, разбавленным аммиаком, водой, высушивают, отфильтровывают и концентрируют. После перекристаллизации из уксусного эфира получают 400 мг этилового эфира 6-пиперидино-карбонил- -4-метил- /ь-карболин-3-карбоновой кислоты с т. пл. 212-218 С.
Пример 3. 320 мг этилового эфира 5-бром- /i-карболин-З-карбоновой кислоты в 6 мл бензилового спирта с 0,27 мл трибутиламина нагревают в атмосфере монооксида углерода до 110°С. Затем добавляют 76 мг палла- дий-бис-(три-о-толилфосфин)-дихлори- да и нагревают в атмосфере моноокси- да углерода в течение 4 ч. Затем добавляют еще раз 38 мг катализатора и нагревают в течение 1 ч при в атмобфере моноокЬида углерода. После выпаривания досуха растворяют в диметилформамиде и отфильтровывают от катализатора. После выпаривания остаток хроматографируют на силика- геле смесью хлороформа с метанолом 10:1,5 в качестве элюирующего средст ва. После кристаллизации из смеси уксусного эфира с динзопропиловым эфиром получают 94 мг этилового эфира 5-бензш1оксикарбойил-/ )-карболин- -3-карбоновой кислоты с т. пл. 150- 155 С..
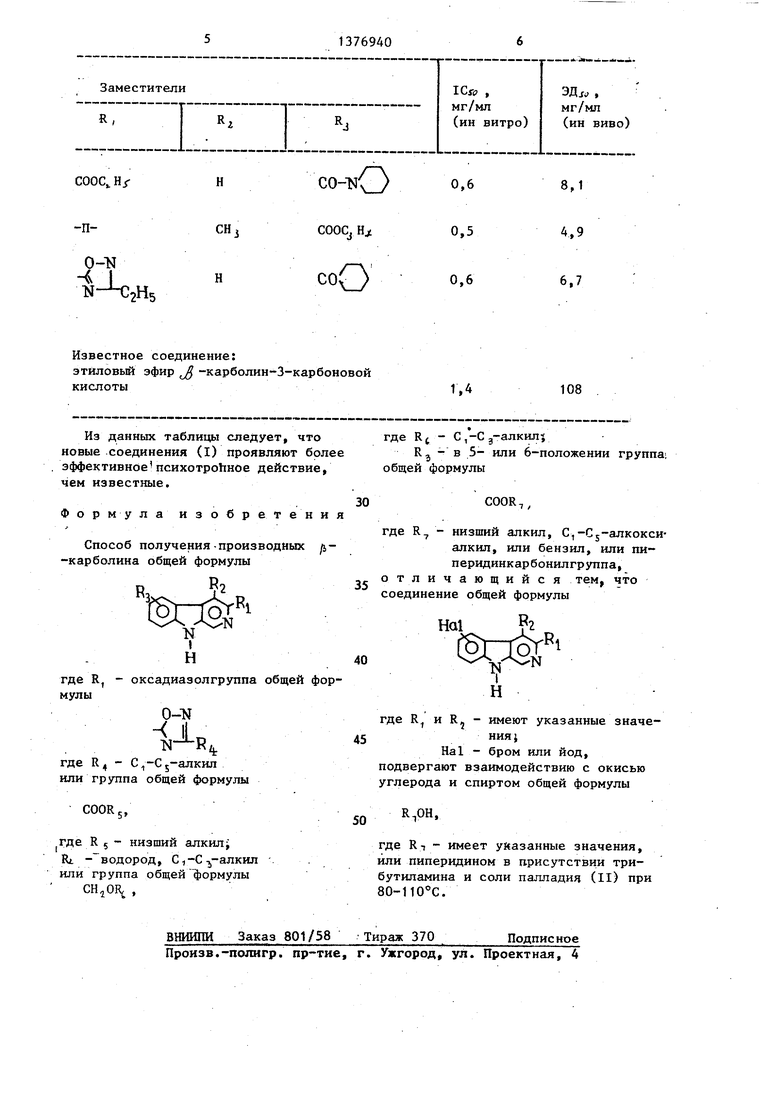
Новые соединения (I) проявляют психотропное действие и не являются токсичными.
Известно, что определенные места в центральной нервной системе позвоночных обладают высоким специфическим сродством к связьшанию 1,4- и 1,5-бенаодиазепинов. Эти места называются бензодиазепиновыми рецепторами (рецепторами к бензодиазепину),
Замещенные /i-карболины формулы (I), хотя они сильно отличаются по своей химической структуре от бензо-
диазепинов, обладают сильным сродст- в.ом и специфичностью к связыванию бензодиазепиновых рецепторов (вытесняют радиоактивно меченный флунит зепам с этих бензодиазепиновых рецепторов) .
Вытесняющая активность новых соединений представлена в таблице в виде 1C JO- и ЭД 5J-значений. ICy -значе- ние указывает концентрацию,которая вызывает 50%-ное вытеснение специфической связи Н-флунитризепама (1,0 нМ, ) в пробах с общим объемом 0,55 мл суспензии мозговой мембраны, например, крыс.
Вытесняющая активность определяется в тесте ин витро следующим образом.
0,5 МП суспензии необработанного основного мозга крыс в 25 мМ КН РО 4, рН 7,1 (5-10 мг ткани/пробу) в течение 40-60 мин инкубируют:при ., вместе с Н-диазепамом (удельная активность 14,4 Ci/ммоль, 19 нМ) или
Н-флунитразепамом (удельная активность 87 Ci/ммоль, 1,0 нМ). После инкубации суспензию фильтруют через стеклянную итту.(стеклянный фильтр) ост аток промывают 2 раза холодным буферным раствором и измеряют радио активность на сцинциллирующем счетчике.
Опыт повторяют затем так, что перед добавкой радиоактивно меченого бензодиазепина добавляется определенное количество или избыточное количество соединения, вытесненную активность которого нужно определить. На основании полученных значений рассчитывается 1C 50 -значение.
Sflj -значение представляет собой дозу испытуемого вещества, которая вызьтает уменьшение специфической связи фпунитразепама с бензодиазепи- новым рецептором в живом мозгу на 50% от контрольного значения.
Тест ин вино проводится следующим образом.
Группам мьшей инъекцируют испытуемые вещества в различных дозах и обычно подкожно. Спустя 15 мин мышам вводят Н-флунитразепам. Спустя следующие 20 мин мышей умерщвляют, удаляют оболочку с переднего мозга и измеряют радиоактивность оболочки пе реднего мозга с помощью сцинцилля- ционного счетчика.ЭД.(;-значение опредляется с помощью кривых доза/действи
Известное соединение:
этиловый эфир -карболин-3-карбоновой
кислоты
1,
108

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных @ -карболина | 1984 |
|
SU1376946A3 |
| Способ получения замещенных @ -карболинов | 1985 |
|
SU1428202A3 |
| Способ получения @ -карболинов | 1981 |
|
SU1318166A3 |
| Способ получения производных @ -карболин-3-карбоновой кислоты | 1980 |
|
SU1114335A3 |
| АНЕЛЛИРОВАННЫЕ β--КАРБОЛИНЫ | 1996 |
|
RU2169148C2 |
| 5- ИЛИ 6-ЗАМЕЩЕННЫЕ СЛОЖНЫЕ ЭФИРЫ β -КАРБОЛИН-3-КАРБОНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПСИХОТРОПНОЙ АКТИВНОСТЬЮ, И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПСИХОТРОПНЫХ ЗАБОЛЕВАНИЙ | 1991 |
|
RU2034845C1 |
| ГЕТАРИЛОКСИ- β КАРБОЛИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1993 |
|
RU2105766C1 |
| Способ получения производных изоксазол- @ -карболина | 1988 |
|
SU1836369A3 |
| Способ получения 4-(полиалкоксифенил)2-пирролидонов | 1975 |
|
SU649312A3 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО С КВИСКВАЛАТ-АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ НА ИХ ОСНОВЕ | 1992 |
|
RU2117663C1 |
Изобретение касается производных /ь- карболина (ПК), в частности соединений общей формулы R, Дг -Шгде R,-C N-CR4 N-0 при кил, -COORj. при R5 -низший алкил; R,-HC,-C,,-aлкил или -CHjOR, при R4-C -C5-aлкнлj .в 5- или 6-поло- жении -COOR, при R -низший алкил, С 1-е у -алкоксиалкил, бензил или пипе- ридинкарбонилгруппа, которые обладают психотропным действием и могут быть использованы в медицине. Педь - изыскание эффективных психотропных веществ указанного класса. Их синтез ведут из галогензамещенного fb-карбо- лина, окиси углерода и соответствующего спирта или пиперидина в присутствии трибутиламина и соли палладия 
Из данных таблицы следует, что новые .соединения (I) проявляют более эффективное психотроЬное действие, чем известные.
Формула изобретения
Способ получения-производных - -карболина общей формулы
где R, - оксадиазолгруппа мулы
0-N
iJLp,
где R - С -С 5-алкил или группа общей формулы
COOR
5
где R 5 низший алкил Ri - водород, С1-Ст,-алкнл или группа общей формулы CH,jOI ,
ВНИИПИ Заказ 801/58 Тираж 370
Произв.-полигр. пр-тие, г. Ужгород, ул. Проектная, 4
где R - С,-Сз-алкил$
R - в 5- или 6-положении группа; общей формулы
COOR-,,
где R - низший алкил, С,-Сз-алкокси- алкил, или бензил, или пи- перидинкарбонилгруппа,
отличающийся тем, что
соединение общей формулы
где R и R, - имеют указанные значения }
Hal - бром или йод, подвергают взаимодействию с окисью углерода и спиртом общей формулы
,
где RT имеет указанные значения, или пиперидином в присутствии три- бутиламина и соли палладия (II) при 80-110°С.
Подписное
| Бюлер К., Пирсон Д | |||
| Органические синтезы | |||
| - М.: Мир, 1973, ч | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ амидирования жидких сульфохлоридов ароматического ряда | 1921 |
|
SU316A1 |
Авторы
Даты
1988-02-23—Публикация
1984-06-07—Подача