Изобретение относится к способу получения новых производных |3 -карболин-3-карбоновой кислоты, Которые могут найти применение в качестве биологически активных веществ. Известно превращение пяти- и шестичленных гетероциклов в ароматические циклы в результате дегидрирования которое осуществляют в присутст вии катализаторов (платина, палладий а также под действием серы, селена, хинонов и других дегидрирукицих агентов. Цель изобретения - разработка спо- соба йолучения новых биологически 15 активных соединений, основанного на известной реакции дегидроароматизации. Поставленная цель достигается способом получения производных/3-карбо- 20 лин-З-карбоновой кислоты общей формулы (I) где R - окси. С,-С -алкокси-, фенок-30 СИ-, бензилокси-, метоксифенокси-, 2-ОКСИЭТОКСИ-, 2,3-диоксипропокси-, аллилОКСИ-, трифторметокси-, хлорфенокси-, дихлорфенокси- 35 или диметиламиноэтоксигруппа;- водород, С,-С5-алкил, -циклоалкил, фенил, или метоксифенил}40R5 - водород, фтор, хлор, -алкил, этоксикарбонил, нитрил, нитро- или метоксигруппа, заключаняцимся в том, что соединение 45 дбщей формулы (П) 50 где R,R и R имеют указанные значения, подвергают дегидрированию с 55 помощью элементарной серы, дихлордицианобензохинона, хлоранила или палладия на угле с последующей в случае 25 необходимости этерификацией соединения I, где R - оксигруппа, спиртом в присутствии бромида меди (II), или хлорокиси фосфора, или соляной или серной кислоты, или алкоголята щелочного металла. Пример и Раствор - 15 г . L-триптофана в 9 мл 9,6 н, NaOH и 6,07 МП 40% формалина нагревают в о. течение 25 ч до 53С. Затем суспензию, полученную в результате реакции, титруют до рН 5,5 21 мл 3 н. НС1 и оставляют:- в холодильнике при 4 С в течение 18 ч. Осадок удаляют фильтрованием и промывают 150 МП холодной воды. Выход тетрагидро- -карболин-3-карбоновой кислоты 14,8 г после сушки в течение 24 ч, т.пл. 295,. 7,5 г полученного .таким образом соединения, 700 мл 99,9% этанола и 21 мл концентрированной НС1 нагревают в сосуде с обратным холодильником в течение 24 ч, выпаривают досуха. Выход этилового эфира тетрагидро- -карболин-3-карбоновой кислоты 7,25г. 7 г сложного эфира добавляют к 100 МП тетрахлорэтана и 10 г хлоранила, смесь нагревают в сосуде с обрйтным холодильником в течение 1 ч 20 мин. После экстрагирования двумя порциями в 30 мл 0,2 н. HG1 водные фазы титруют до рН 9 концентрированным аммиаком и экстрагируют двумя порциями в 300 мл эфира. После выпаривания остаток распределяют между видной фазой с рИ 4,5 и этилацетатом. После выпариваний этилацетата получают 1,5 г этилового эфире 3-карболин-3-карбоновой кислоты, который идентифицируют масс-спектрметроическим анализом, на основании молекулярного веса 240, т.пл. 230-233 С. Пример 3.0,5г/9 -карболин-3-карбоновой кислоты, 30 мп н-пентанола и 5,0 МП концентрированной серной -кислоты смешивают и отстаивают 3 ч в паровой бане. После охлаждения добавляют 30 мп воды и аьашака, чтобы уста:новить рН приблизительно 6. Водную фазу, которую удаляют от пентаноловой фазы, проилвают 5%-шлм раствором бикарбоната натрия. Пентанольную фазу сушат сухим сульфатом магния и выпаривают. Выход н-пентил-карболин-З-карбоксипата 0,4 г, т.пл. 209-210 0. Соединение перекристаллизовывают в ксилоле, получено Oj3 г вещества с т.пл. 216-219 С. 311 Аналогично получают следующие соединения общей формулы I (см.табл.1). Таблица 1 Т.Ш1.,С Выход, % 195-97 200-02 изо-C Hf 191-94 СН2-СН СН2 втор 215-17 нео CjH,, Пример 4. 0,2 г/З-карболин-3-карбоновой кислоты, 1 г фенола и 1 мл оксихлорида фосфора смешивают в колбе Полученную однородную смесь отстаТ вают в течение 2 ч на паровой бане. После охлаждения добавляют 5 мл ледяной воды и смесь перемешивают в течение 4 ч. Затем реакционную смесь нейтрализуют твердым бикарбонатом натрия так, чтобы осадить твердое светло-коричневое вещество. Жидкость удаляют из твердой фазы отсасьшанием и твердую фазу промывают 1%-ным раствором бикарбоната натрия водой и эфиром. Получено О,1 г фенил- -карболин-3-карбоксилата с т.пл. 237-239 0. Аналогично, получают параметоксифешш- -карболин-3-карбоксипат из -кар болин-З-карбоновой кислоты, параме- токсифенола и оксихлорида фосфора. Т.пл. вещества 242-244с. Пример 5. 0,4г 55%-ной суспензии гидрида натрия в минеральном масле добавляют к суспензии 2,1 г Р-карболин-З-карбоновой кислоты в 25 МП диметилформамйда, через 5 минут добавляют 1,2 мл этилхлорацетата. Смесь нагревают в сосуде с обратным холодильником в течение 4 ч и затем в вакууме выпаривают диметилформамвд. После добавления к остатку 100 мп
165-68
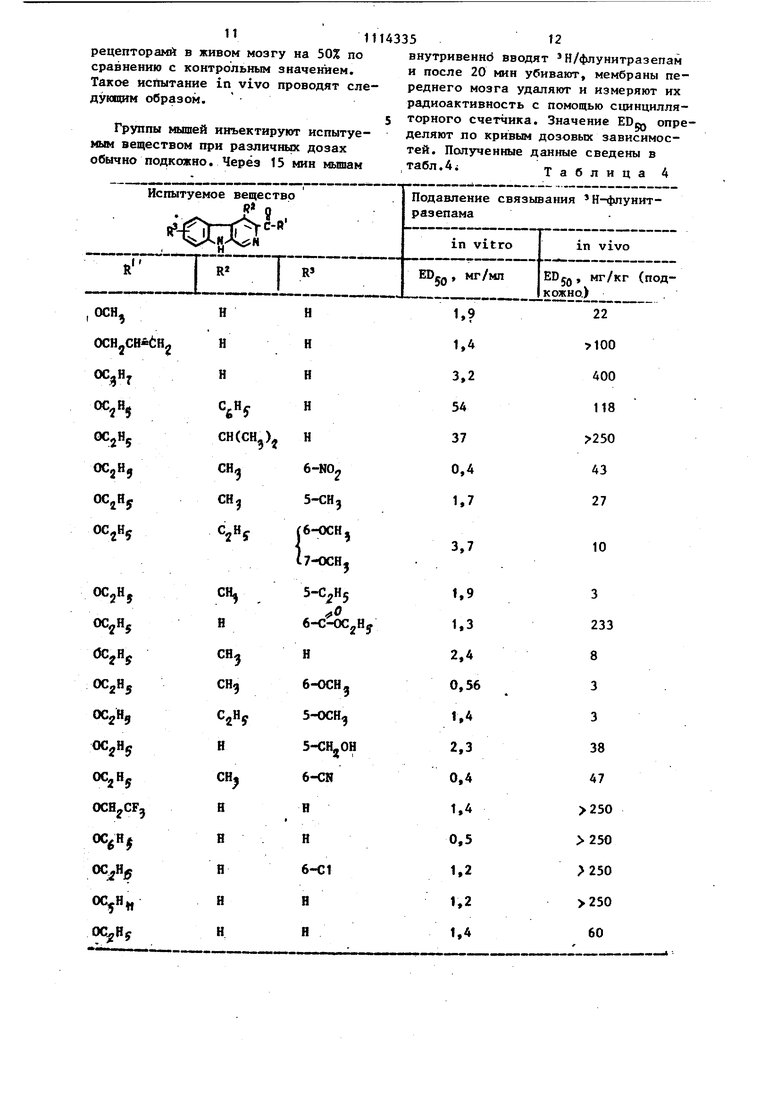
CH2CH2N(CH)2 14 5Л воды смесь экстрагируют хлороформом, получено 1 г карэтоксиметил-/ -карболин-3-карбоксилат с т.пл. 202-203 С (33%). Аналогично получают следующие соединения общей формулы I (см.табл.. 2) . Таблица 2I Выход, I Т.пл., J.J1Пример 6. 10,2г этилового эфира 4-метил-1,2,3,4-тетрагидро- -карболин-З-карбоновой кислоты растворяют (суспендируют) в 300 мп ксилола и смесь кипятят в течение 10 мин в аппарате Дина-Старка, чтобы удалить влагу. После охлаждения до 100-110 С добавляют 2,1 моль -эквивалентна серы и смесь кипятят при нагревании в сосуде с обратным холодильником в течение 5 ч. Затем в вакууме выпаривают ксилол. Остаток растворяют в хлороформе и очищают хроматографией (хлороформ-этанол) на двуокиси кремния, чтобы удалить непрореагировавшую серу. Получают этиловый эфир 4-метил- -ка рболин-3-карбоновой кислоты, т.пл. 235-239с (выход 72%). Пример 7. R -замещенные эфиры -карболин-3-карбоновой кислоты общей формулы I и перечисленные в таблице 3 синтезируют из соответству щих этиловых эфиров 4-замещенной 1,2,3,4-тетрагидро- карболин-З-карбоиовой кислоты аналогично примеру 6. ТаблицаЗ 142-160 (разл.) изо-CjHy, 190-192 н-С Н, 166-169 130 (разл.-) Пример 8. 3,1 г этилового эфира 4-ЭТИЛ-1,2,3,4-тетрагидро- -карболин-3-карбоновой кислоты растворяют в 50 мл сухого толуола, смесь охлаждают до 15°С и после добавления 5 г дшшордицианбензохинона перемеши вают в течение 1 ч при 15 С. После разбавления 150 мл этилацетата реакционную смесь несколько раз экстраги руют 5%-ным водным pf cTBopoM аммиака и промывают до нейтрализации солевым раствором. После высушивания сульфатом натрия, фильтрации и вьтаривания растворителя в вакууме получают 2,95 г этилового эфира 4-этил- -карболйн-З-карбонбвой кислоты, который перекристаллизовьюают из диизопропилового эфира. Получают 2,25 г перекристу ллизованного соединения, которое разлагается при 174-190°С. Лример 9. 6,21 г этилового эфира 4-метил-1,2,3,4-тетрагия1)о- -карболин-3-карбоновой кислоты растворяют в 120 МП теплового мезитилена и после добавления 4,1 г Pd/c (10%) кипятят при нагревании в сосуде с обратным холодильником (165с) в течение 7ч. После охлаждения катализа .тор удаляют фильтрованием, промывают его хлористым метиленом и объединенные фильтраты концентрируют в jeakyуме. После перекристаллизации в ацетоне получают 4,98 г этилового эфира 4-метйл-Р-карбапин-З-карбоновой kHcлоты с т.пл. 234-237 С. Пример 10. А. 1 г этилового эфира R-замещенной р-карбопин-3-карбоковой кислоты суспендируют (растворяют) в 10 МП спирта иНагревают до 5ос в течение 5-24 ч после добав ления 20 мг бромвда меди (II). За ходом реакции следят с помощью тонк9 слойной хроматографии. Дпя того, чтобы выделить полученное соединение добавляют ледяную воду и полученный таким образом осадок удаляют фильтрованием, промывают водой, сушат и перекристаллйзовывают. B,100 мг натрия растворяют в 10мл спирта и добавляют 1 г производного сложного этилового эфира. Реакционную смесь нагревают до 60-80 С. Сцелью выделения полученного соединения добавляют ледяную воду и соединеннее обрабатывают так, как ri способе А. C.Газообразный хлористый водород пропускают в раствор или суспензию 1 г производного сложного этилового эфира в 10 МП спирта при охлаждении льдом до насыщения. Затем реакционную смесь перемешивак)т в течение 6-24 ч при комнатной температуре. Время реакции определяют с помощью тонкослойной хроматографии. Реакционную смесь смешивают с ледяной водой и устанавливают рН 9-10 путем добавления концентрированного аммиака при охлаждении льдом. Осажденный продукт обрабатывают, как в способе А. Таким образом получают следующие соединения, Согласно способу А: пропиловый эфир 4-метил- т карболин-3-карбоновой кислоты, т.пл. 210-213 С, метиловый эфир 4-этил-/5-карболин-3-карбоновой кислотй, т.пл. 208-210 С. Согласно способу С: метиловый эфир 4-пропил- В-карболин-3-карбоновой кислоты, метиловый эфир 4-метил- -карболин-З-карбоновой кислоты, т.пл, 243-246 С, 2-оксиэтйловыЙ эфир 4-метил-(5-карболин-3-карбоновой кислоты, т.пл. 208210 С. Согласно способу В: 2-оксиэтиловый эфир 4-изопропил- -карболин-3-карбоновой кислоты, бензиловый эфир 4-изопропил- -карболин-3-карбоновой кислоты, пропиловый эфир 4-этйл-й-карбалин-З-карбоновой кислотьг, изопропиловый 4-этил- -карболин-3-карбоИовой кислоты, метиловый эфир Л-н-пропил- -карболин-Згкарбоновой кислоты, пропиловый эфир 4-н-прршш- р-карболин-3-карбоновой кислоты,. 2-оксиэтиловый эфир 4-н-пропил- -карбсшин-3-карбоновойкислоты, изопропиловый зфир 4-изопропил- -карболин-3-карбоновой кислоты, метиловый эфир-4-я-бутил-Д-карбОЛИн З-карбоновОй кислоты. 2-оксиэтиловый эфир 4-н-бутил- 3-кар болин-3-карбоновой кислоты, пропиловый эфир 4-н-бутил-/ -карболи -3-карбоновой кислоты, метиловый эфир 4-циклогексил- -карб лин-3-карбоновой кислоты, пропиловый.эфир 4-циклогексил- -кар болин-3-карбоновой кислоты, метиловый эфир 4-фенил-И-карболин-3 -карбоновой кислоты, пропиловый эфир А-ценил- -карболин-3-fcapбoнoвoй кислоты, изопропиловьш эфир 4-фенил- -карболин-3-карбоновой кислоты, бутиловый эфир 4-фенил- -карболин-З -карбоновой кислоты, 2-оксиэтиловый эфир 3-фенил-| -карболин-3-карбоновой кислоты, метиловый эфир 4-н-пентил-/3-карболи -3-карбоновой кислоты. Пример 11, Используют 720 этилового эфира 6-фтор-1 2,3,4-тетр гйдро-/ -карболйй-3-карбоновой кисло ты и 130 МП ксилола. По окончании реакции дегидрирования (около 20 ч, контроль с помощью хроматографии) раствор концентрируют выпариванием в вакууме и остаток хроматографирую на силикагеле смесью хлороформом этанол (95:5). Получают 300 мг этилового эфира 6-фтор- -карболин-З-ка боновой кислоты с Т.Ш1. 284 С (разлагается) . После взаимодействия с соляной кислотой получают гидрохлорид, который плавится при 295с с разложением. Пример 12. 400 мг этиловог эфира 7-нитро-1,2,3,4-тетрагидро- -карболин-3-карбоновой кислоты раст воряют в 40 мл горячего ксилола и после добавления 400 мл палладия на угле (10%) нагревают в сосуде с обратным холодильником в течение 30 ч Катализатор отфильтровывают вакуумфильтром и хорошо промывают теплым ксилолом. Фильтрат концентрируют в вакууме и остаток хроматографируют на силикагеле смесью хлороформ этанол (10:2). Получают 260 мг этилового эфира 7-нитро-уЗ-карболин-З-карбоновой кислоты с т.пл. З21с (с разложением). Пример 13. 2,58 г этилового эфира 5-метил-1,2,3,4-тетрагидро-карбоПия- З-карбоновой кислоты растврряют в 40 мл абсолютизированного толуола, охлаждают до , добавляют 2,72 г дихлордицианбензохинона и перемешивают в течение 1 ч при данной температуре. Затем смесЬ разбавляют этилацетатом, экстрагируют несколько раз путем встряхивания с разбавлением раствором аммиака и с насыщенным раствором поваренной соли, сушат над сульфатом кальция и концентрируют в вакууме. Хроматография на силикагеле смесью хлороформ - этанол дает 1,56 г этилового эфира 5-метил-/3-кар- болин-3-карбоновой кислоты.с т.пл. 221-223 С (с разложением). Пример 14. Аналогично примеру 1 из эфиров 1,2,3,4-тетрагидро- -карболин-3-карбоновой кислоты получают следующие -карболинпроизводные общей формулы I: этиловый эфир 8-метил- -карболин-З-карбоновой кислоты, 80% от теоретического выхода, t.mi. 230-233 С, этиловый эфи{ 7-фтор-й-карболин-З-карбоновоя кислоты, этиловый эфир 6-фтор-Д-карболин-Зкарбоновой кислоты, этиловый эфир 8-фтор-/9-карболин-3-карбоновой кислоты, этиловый эфир 5-циан- -карбапин-З-карбоновой кислоты, т.пл. (разлагаетсяJ, этиловый эфир З-хлор- -карболин-З -карбоновой кислоты, т.пл. 274с (разлагается), этиловый эфир 7-хлор-У -карболин-3-карбоновой кислоты, этиловый эфир 8-хлор- -карболин-Зкарбоновой кислоты, ЭТШ1ОВЫЙ эфир 7-циан-й-карболин-З-карбоновой кислоты, этиловый эфир 5-карбэтокси- -карболин-3-карбоновой кислоты, этиловьй эфир 5-гидроксиметил-й-карбояин-З-карбоновой кислоты, этиловый эфир 8-метшт- -карболин-З-карбоновой кислоты, т.пл. 230-233 0, этиловый эфир 5-нитро- -карболин-З-карбоновой кислоты, этиловый эфир 6-циан- -карболин-З-карбоновой кислоты, этиловый эфир 6-метокси- -карболин-3-карбоновой кислоты, т.пл. 235238С, этнло&ый эфир 6-фтор-4-метил- -карбо - ин-З-карбоновойкислоты, т.пл. 292298°С (разложение), этиловый эфир 5-хлор-6-метокси-/ -карболин-З-карбоновой кислоты, т.пл. 282с (этанол/гексан), этнлЕт|1й эфир 4,6-диметил- -карболин-3-карбоновой кислоты, т.tin. 192197 0. этиловый ир 4-этил-6-метил-й-карбо лин-3-карбоновой кислоты, этиловый эфир 6-метил-4-фенил й-карболин-3-карбойовой кислоты, этиловый эфир А-этил-б-фтор-Й-карбо- лин-3-карб6новой Кислоты, этиловый эфир 6-фтор-4-пропш1-Й-карболин-3-карбоновой кислоты, этиловый эфир 6-фтор-4-фенил-А-карбо ЛИН-3-карбоновой кислоты. Фармакологически активные соедине ния могут использоваться для готовых форм фармацевтических препаратов, например, для пёрорального и паренте рального введения млекопитающим, включающая человека, в соответствии общепринятыми способами фа|)мацевтики Общепринятыми наполнителями являются такие приемлемые в фармацевтическом отношении органические и неорганические вещества носителей для парентерального или кишечного применения, которые не дают вредной реакции с активными соединениями. Примерами таких носителей являются вода, растворы солей, спирты, полиэтйленгликоли, полигидроксиэтоксилиррванно касторовое масло, желатин, лактоза, амилоз-а, стеарат магния, тальк, крем ниевая кислота, мойоглицериды и диглицериды жирной кислоты, сложные эфиры пентаэритритоловой жирной кислоты, гидроксиметилцеллюлоза и поливинил пирроли бн . Фармацевтические препараты могут быть стерилизованны и смешаны при не обходимости с вспомогательным агентами, например, смазочными материала ми, консервантами, стабилизаторами, c вчивaющи №I агентами, эмульгаторами солями для изменения осмотического давления, буфферами и/или окрашивающими веществами и им подобными, которые не оказьшают вредного влияния на активные соединения. Для парентерального применения в основном приемлемы инъекционные раст воры или суспензии, предпочтительно водные растворы с активным соединением, растворенным в полигидроксиэтоксилированной касторовом масле. Ампулы являются удобными единицами дозировки. Для пёрорального применения в основном приемлемы таблетки, драже или капсулы, имеющие тальк и/или углевод 1 ( 3510 ный носитель,или связывающее вещество, ил и им подобные,причем носителем.. предпочтительно является лактоза и/или кукурузный крахмал, и/или картофельный крахмал. Сироп, эликсир или им подобное мйжет использоваться, если применяется подслащенный растворитель. Обычно соединения дозируют по единичным дозам, включакяцим 0,05-10 мг в фармацевтически приемлемый носитель та единицу дозы. Доза соединений, равна 0,1300 мг/день, предпочтительно1-30 мг/ день, при Введении пациентам, например человеку, в качестве лекарства. Фармакологические свойства соединений исследуют путем определения их способности к замещению радиоактивно меченого флунитразепама из таких бензодиазепиновых рецепторов. Замещающую активность соединений определяют по значению и ED-g. Значение ICgQ представляет концентрацию, которая вызывает замещение 50% особого связующего вещества Н-флунитразепама (1,0 нМ, О С) в образцах, включающих общий объем 0,55мл суспензии мозговой мембраны, например, от крыс. Испытание на замещение проводят следующим образом. 0,50 мл суспензии необработанного переднего мозга крысы в 25 мМ КН2РО, рН 7,1 (5-10 мг ткань/образец) инкубируют в течение 40-60 мин при вместе с Н-диазепамом (удельная активность 14,4 Ки/ммолв,1,9 нМ) или Н-фпунитразепамом (удельная активность 87 Ки/ммоль/ 1,0 нМ). После инкубации суспензию фильтруют через стекловолоконные фильтры Whatman GF/C, остаток дважды промывают холодным буфферным раствором и измеряют радиоактивность сцинцнлляторным счетчиком. Испытание повторяют, но перед добавлением радиоактивного меченого бензодиазепина добавляют данное или избыточное количество соединения, замещакхцая способность которого должку быть огфеделена. На основе полученных данных можно рассчитать значение ICjQ . Величина ED j представляет дозу (мг/кг) испытуемого вещества, которая вызывает понижение особого связывания флунитразепама с бенэодиазепиновыми
11111433512
рецепторами в живом мозгу на 50% по внутривеннЬ вводят Н/флунитразепам сравнению с контрольным значением. и после 20 мин убивают, мембраны пеТакое испытание in vivo проводят еле- реднего мозга удаляют и измеряют их дукшщм образом.радиоактивность с помощью сцинцилляГруппы мышей инъектируют испытуемым веществом при различньк дозах обычно подкожно. Через 15 мин мышам
5 торного счетчика. Значение EDg определяют ло кривым дозовых зависимостей. Ползгченные данные сведены в
табл.4 i
Таблица 4





| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных @ -карболина | 1984 |
|
SU1376946A3 |
| Способ получения производных @ -карболина | 1984 |
|
SU1376940A3 |
| Способ получения замещенных @ -карболинов | 1985 |
|
SU1428202A3 |
| Способ получения @ -карболинов | 1981 |
|
SU1318166A3 |
| Способ получения производных изоксазол- @ -карболина | 1988 |
|
SU1836369A3 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНДИОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1994 |
|
RU2140420C1 |
| Способ получения производных карбазола | 1974 |
|
SU511855A3 |
| ПРОИЗВОДНЫЕ ПИРИДО(1,2,3-DE)ХИНОКСАЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1994 |
|
RU2140924C1 |
| Способ получения тетрагидро-бета-карболиновых производных или их фармацевтически приемлемых солей | 1984 |
|
SU1382401A3 |
| ПРОИЗВОДНЫЕ ХИНОКСАЛИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СРЕДСТВО С КВИСКВАЛАТ-АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ НА ИХ ОСНОВЕ | 1992 |
|
RU2117663C1 |
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ -КАРБОЛИН-З-Ю БОНОВОЙ КИСЛОТЫ общей формулы I где R па;, R2 R5 -водород, С -С -алкил, Cy-Cg циклоалкил, фении или метоксифенил; -водород, фтор, хлор, С -Сг-апкнп, этоксикарбоннл. рил, нитро- или метоксигруппа; отличающийся тем, что, соединение общей формулы II где R ,R и R имеют указанные значения, подвергают дегидрированию с помощью элементарной серы, дихлордицианобензохинона, хлоранила или палладия на ; угле с последующей в случае необходимости зтерификацией соединения 1,где R - оксигруппа, спиртом в присутствии бромида меди (II) или хророкиси фосфора, или соляной или серной кислоты, или алкоголята щелочного металла. Приоритет по признакам: СО 00 СП 29.08.79при R-C -Cp-aiiKOKCH-, феНОКСИ-, метоксифеноксигруппа, R и R - водород 22.04.80при R- С -С -алкокси-, 2-этоксигруппа, С -С -алкил, Су-С -циклоалкил, фенил, метоксифенил, R -. водород ,20.06.80 при R- C -Cj-алкоксигруппа, R - водород. С,-С алкил, фенил, R - водород, фтор, хлор, С;,-С2-апкил, зтоксикарбошш, нитрил, нитнитро-, метоксигруппа.
Авторы
Даты
1984-09-15—Публикация
1980-08-28—Подача