Изобретение относится к новым хинолинам, к композициям, содержащим их, и их использованию в качестве фармацевтических препаратов.
В EP-A-0498722 раскрыты амиды хинолина, функционирующие как ингибиторы ангиотензина A2 и эндотелина.
Фосфодиэстеразы (ФДЭ) и фактор некроза опухолей (ФНО), механизм их действия и терапевтическое применение их ингибиторов описаны в WO-A-9636595, WO-A-9636596 и WO-A-9636611, содержание которых включено в настоящее описание в качестве ссылок. В указанных документах раскрыты амиды, применимые как ингибиторы ФДЭ и ФНО.
Настоящее изобретение основано на открытии новых соединений, которые могут использоваться для лечения болезненных состояний, например болезненных состояний с наличием белков, которые опосредуют клеточную активность, например, путем ингибирования фактора некроза опухолей (ФНО), и/или ингибирования фосфодиэстеразы IV. В соответствии с настоящим изобретением, новые соединения имеют формулу (i)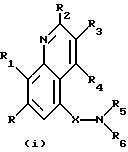
где X обозначает CO или CS;
R обозначает H, галоген или алкил;
R1 обозначает ОН, алкокси, необязательно замещенный одним или более атомами галогена, или тиоалкил;
R2, R3 и R4 могут быть одинаковыми или могут различаться и каждый обозначает H, R7, OR11, COR7, C(=NOR7)R7, алкил-C(=NOR7)R7, галоген, CF3, алкил-C(= NOH)R7, C(= NOH)R7, CN, CO2H, CO2R11, CONH2, CONHR7, CON(R7)2, NR9R10 или CONR12R13, где NR12R13 представляет собой гетероциклическое кольцо (такое как морфолин или пиперидин), необязательно замещенное одним или более R15;
R5 обозначает H, арилалкил, гетероарилалкил, гетероциклоалкил, S(O)mR11 или алкил, необязательно замещенный одним или более заместителями, выбранными из гидрокси, алкокси, CO2R8, SO2NR12R13, CONR12R13, CN, карбонильного кислорода, NR9R10, COR11 и S(O)nR11;
R6 обозначает арил, гетероарил, гетероцикло, арилалкил, гетероарилалкил или гетероциклоалкил;
в R5 и/или R6 арил/гетероарил/гетероцикло-часть необязательно может быть замещена одним или более заместителями алкил-R14 или R14;
R7 обозначает R11, необязательно замещенный в любом положении (одним или более) R16;
R8 обозначает H, алкил, циклоалкил, арилалкил, гетероарилалкил или гетероциклоалкил;
R9 обозначает H, арил, гетероарил, гетероцикло, циклоалкил, алкил, арилалкил, гетероарилалкил, гетероциклоалкил, алкилкарбонил, алкоксикарбонил, арилсульфонил, гетероарилсульфонил, гетероциклосульфонил, арилкарбонил, гетероарилкарбонил, гетероциклокарбонил или алкилсульфонил;
R10 обозначает H, арил, гетероарил, гетероцикло, алкил, циклоалкил, арилалкил, гетероарилалкил или гетероциклоалкил;
R11 обозначает алкил, циклоалкил, арил, гетероарил, гетероцикло, арилалкил, гетероарилалкил или гетероциклоалкил;
R12 и R13 могут быть одинаковыми или различными и обозначают каждый H или R11, или NR12R13 обозначает гетероциклическое кольцо, определенное выше;
R14 обозначает алкил (необязательно замещенный одним или более галогенами), циклоалкил, арил, гетероарил, гетероцикло, гидрокси, алкокси (необязательно замещенный одним или более галогенами), тиоалкил, арилокси, гетероарилокси, гетероциклоокси, арилалкилокси, гетероарилалкилокси, гетероциклоалкилокси, CO2R8, CONR12R13, SO2NR12R13, галоген, -CN, -NR9R10, COR11 и S(O)nR11 или (где это приемлемо) карбонильный кислород;
R15 обозначает алкил, арилалкил или гетероарилалкил;
R16 обозначает алкил, ОН, OR11, NR9R10, CN, CO2H, CO2R11, CONR12R13 или COR11;
m обозначает 1-2; и
n обозначает 0-2;
и их соответствующие фармацевтически приемлемые соли.
Комбинация заместителей и/или переменных возможна лишь в том случае, когда она приводит к получению стабильных соединений.
Подходящие фармацевтически приемлемые соли представляют собой фармацевтически приемлемые соли основания и фармацевтически приемлемые соли добавления кислоты. Некоторые из соединений формулы (i), которые содержат кислотную группу, образуют соли снования. Подходящие фармацевтически приемлемые соли основания включают соли металла, такие как соли щелочного металла, например соли натрия, или соли органического амина, такие как соли, получаемые с этилендиамином.
Некоторые соединения формулы (i), которые содержат аминогруппу, образуют соли добавления кислоты. Подходящие соли добавления кислоты включают фармацевтически приемлемые неганические соли, такие как сульфат, нитрат, фосфат, борат, гидрохлорид и гидробромид, а также фармацевтически приемлемые соли добавления органической кислоты, такие как ацетат, тартрат, малеат, цитрат, сукцинат, бензоат, аскорбат, метансульфонат, α-кетоглутарат, α-глицерофосфат и глюкоза-1-фосфат. Фармацевтически приемлемые соли соединений формулы (i) получают с использованием традиционных методик.
Специалистам в данной области очевидно, что некоторые соединения формулы (i) могут существовать более чем в одной таутомерной форме. Настоящее изобретение относится ко всем таутомерным формам.
Очевидно также, что соединения по настоящему изобретению могут содержать один или более асимметрично замещенных атомов. Наличие одного или более таких асимметричных центров в соединении формулы (i) может приводить к появлению стереоизомеров, и в каждом случае изобретение относится ко всем таким стереоизомерам, включая энантиомеры, диастереоизомеры и их смеси, включая рацемические смеси.
При использовании в контексте настоящего изобретения термина "алкил", независимо от того, используется он сам по себе или как часть другой группы, следует понимать, что он включает алкильные прямые и разветвленные цепи, содержащие до 6 атомов углерода. Термин "алкокси" в контексте настоящего описания обозначает алкил-O-группу, в которой алкильная группа была описана ранее. Термин "арилокси" в контексте настоящего описания обозначает арил-O-группу, в которой арильная группа будет определена ниже. Гетероарилокси обозначает гетероарил-O-группу и гетероциклоокси обозначает гетероцикло-O-группу, в которых соответственно гетероарильная и гетероцикло-группы будут определены ниже. Арилалкилокси обозначает арил-алкил-O-группу. Алкиламино обозначает алкил-N-группу, в которой алкильная группа была ранее описана, ариламино обозначает арил-N- группу и гетероариламино обозначает гетероарил-N-группу (при этом арильная и гетероарильная группы будут определены ниже). Тиоалкил обозначает алкил-S-группу. Циклоалкил включает неароматическую циклическую или полициклическую кольцевую систему, содержащую от примерно 3 до примерно 10 атомов углерода. Циклический алкил может быть необязательно частично ненасыщен. Арил относится к карбоциклическим радикалам, содержащим примерно от 6 до 10 атомов углерода. Арилалкил обозначает арилалкильную группу, в которой арил и алкил определены выше. Гетероарилалкил обозначает гетероарилалкильную группу, и гетероциклоалкил обозначает гетероциклоалкильную группу. Алкилкарбонил обозначает алкил-CO-группу, в которой алкильная группа определена ранее. Арилкарбонил обозначает арил-CO-группу, в которой арильная группа определена ранее. Гетероарилкарбонил обозначает гетероарил-CO-группу, и гетероциклокарбонил обозначает гетероцикло-CO-группу. Арилсульфонил обозначает арил-SO2-группу, в которой арильная группа была описана ранее. Гетероарилсульфонил обозначает гетероарил-SO2-группу, и гетероциклосульфонил обозначает гетероцикло-SO2-группу. Алкоксикарбонил обозначает алкилокси-CO-группу, в которой алкокси-группа определена ранее. Алкилсульфонил обозначает алкил-SO2-группу, в которой алкильная группа была описана ранее. Карбонильный кислород обозначает-CO-группу. Ясно, что карбонильный кислород не может быть заместителем на арильном или гетероарильном кольце. Карбоциклическое кольцо обозначает моноциклическую или полициклическую кольцевую систему, содержащую примерно от 5 до примерно 10 членов, которая может быть насыщена или частично не насыщена. Гетероциклическое кольцо обозначает моноциклическую или полициклическую кольцевую систему, содержащую примерно от 5 до примерно 10 членов (которая может быть насыщена или частично не насыщена), при этом один или более атомов в кольцевой системе отличны от углерода, выбраны из атомов азота, кислорода или серы. Гетероарил обозначает ароматическую моноциклическую или полициклическую углеводородную кольцевую систему, содержащую примерно от 5 до примерно 10 членов, и при этом один или более атомов в кольцевой системе отличны от углерода, выбраны из атомов азота, кислорода или серы; если желательно, атом азота может находиться в форме N-оксида. Гетероцикло обозначает насыщенную или частично насыщенную моноциклическую или полициклическую углеводородную кольцевую систему, содержащую примерно от 5 до примерно 10 членов, и при этом один или более атомов в кольцевой системе отличны от углерода и выбраны из атомов азота, кислорода или серы. Примеры включают морфолин и пиперидин. Галоген обозначает фтор, хлор, бром или йод.
Соединения по настоящему изобретению используются для лечения болезненных состояний, опосредованных фактором некроза опухолей (ФHО). Выражение "болезни или болезненные состояния, опосредованные ФНО" относится к любому и всем болезненным состояниям, в которых играет роль ФНО либо за счет продуцирования самого ФНО, либо в связи с тем, что ФНО вызывает высвобождение других цитокинов, включающих, но не ограниченных ими, ИЛ-1 или ИЛ-6. Болезненное состояние, в котором, например, ИЛ-1 представляет основной компонент и продуцирование и действие которого становятся более выраженными или он начинает секретироваться в ответ на действие ФНО, будет рассматриваться как болезненное состояние, опосредованное ФНО. Поскольку ФНО-β (известный также как лимфотоксин) характеризуется близкой структурной гомологией с ФНО-α (известным также как кахектин) и поскольку каждый из них вызывает сходные биологические реакции и связывается с одним и тем же клеточным рецептором, как ФНО-α, так и ФНО-β будут рассматриваться как подверженные ингибированию соединениями по настоящему изобретению и которые в этой связи обозначаются в настоящем описании общим термином "ФНО", если особо не оговорено иное.
Настоящее изобретение относится к методу опосредования или ингибирования ферментативной активности или каталитической активности ФДЭ IV у млекопитающих, нуждающихся в этом, и ингибирования продуцирования ФНО у млекопитающих, нуждающихся в этом, который включает введение указанному млекопитающему эффективного количества соединения формулы (i) или его фармацевтически приемлемой соли.
Ингибиторы ФДЭ IV используются при лечении различных аллергических и воспалительных заболеваний, которые включают астму, хронический бронхит, хроническую обструкцию дыхательных путей, атопический дерматит, атопическую экзему, крапивницу, аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, воспаление глаз, аллергическую реакцию глаза, эозинофильную гранулему, псориаз, болезнь Бехчета, эритематоз, анафилактоидный пурпурный нефрит, воспаление связок, артрит, ревматоидный артрит и другие артритные состояния, такие как ревматоидный спондилит и остеоартрит, септический шок, сепсис, язвенный колит, болезнь Крона, реперфузионное повреждение миокарда и мозга, хронический гломерулонефрит, эндотоксиновый бактериально-токсический шок и респираторный дистресс-синдром у взрослых. Кроме того, ингибиторы ФДЭ IV применяются при лечении несахарного диабета и состояний, связанных с ингибированием метаболизма в головном мозге, таких как церебральная старость, старческое слабоумие (болезнь Альцгеймера), нарушение памяти, связанное с болезнью Паркинсона, депрессия и деменция, связанная с множественными инфарктами. Ингибиторы ФДЭ IV также используются для лечения состояний, которые облегчаются действием нейропротекторов, таких как остановка сердца, кровоизлияние и перемежающаяся хромота. Ингибиторы ФДЭ IV применяются также при лечении поздней дискинезии, ишемии и болезни Хантингтона. Кроме того, ингибиторы ФДЭ IV могут также применяться в качестве гастропротекторов. Одним из вариантов терапевтических методов по настоящему изобретению является метод лечения астмы.
Вирусы, рассматриваемые с точки зрения возможности лечения по настоящему изобретению, относятся к тем, которые продуцируют ФНО в результате инфекции, или к тем, которые чувствительны к ингибированию, к такому, например, которое возникает при снижении уровня репликации, непосредственно или опосредованно, под действием ингибиторов ФНО формулы (i). Такие вирусы включают, но не ограничиваются ими, ВИЧ-1, ВИЧ-2 и ВИЧ-3, цитомегаловирус (ЦМВ), вирус гриппа, аденовирус и вирусы группы герпеса, включающие, но не ограничивающиеся ими, Herpes zoster и Herpes simplex.
Более конкретно, настоящее изобретение относится к методу лечения млекопитающего, пораженного вирусом иммунодефицита человека (ВИЧ), который включает введение такому млекопитающему эффективного для целей ингибирования ФНО количества соединения формулы (i) или его фармацевтически приемлемой соли.
Соединения по настоящему изобретению могут также использоваться и в ветеринарии для лечения животных, а не только людей, нуждающихся в ингибировании продуцирования ФНО. Заболевания животных, опосредованные ФНО, которые подлежат лечению, терапевтическому или профилактическому, включают болезненные состояния, такие как было указано выше, но в особенности вирусные инфекции. Примеры таких вирусов включают, но не ограничиваются ими, кошачий вирус иммунодефицита (FIV) или другие ретровирусные инфекции, такие как инфекционный вирус анемии лошадей, козлиный вирус артрита, вишна вирус, меди вирус и другие лентивирусы.
Соединения по настоящему изобретению также применяются для лечения паразитарных, дрожжевых и грибковых инфекций, когда такие дрожжи и грибы чувствительны к положительной регуляции под действием ФНО или продуцируют in vivo ФНО. Предпочтительным болезненным состоянием, подверженным рассматриваемому лечению, является грибковый менингит.
Соединения по настоящему изобретению могут также подавлять нейрогенное воспаление посредством повышения уровня цАМФ в сенсорных нейронах. В этой связи они обладают анальгетическим, противокашлевым и антигиперальгезивным действием в случае воспалительных заболеваний, связанных с раздражением и болью.
Соединения формулы (i) находятся предпочтительно в фармацевтически приемлемой форме. Фармацевтически приемлемая форма, кроме прочего, означает фармацевтически приемлемый уровень чистоты, исключая обычные фармацевтические добавки, такие как разбавители и носители, и не включающая материал, который при нормальном уровне дозирования рассматривается как токсичный. Фармацевтически приемлемый уровень чистоты обычно составляет по крайней мере 50%, исключая обычные фармацевтические добавки, предпочтительно 75%, более предпочтительно 90% и еще более предпочтительно 95%.
Настоящее изобретение относится также к способу получения соединения формулы (i), где R1 и др., m и n были определены ранее. Разумеется, что функциональные группы, такие как амино, гидроксильная или карбоксильная группы, присутствующие в различных описанных ниже соединениях, и которые желательно сохранить, могут нуждаться во введении защитных групп перед началом реакции. В таких случаях удаление защитной группы может представлять собой конечную стадию в конкретной последовательности реакций. Подходящие защитные группы для таких функциональных группировок известны специалистам в данной области. Конкретные детали раскрыты в Protective Groups in Organic Synthesis, Wiley Interscience, TW Greene. Таким образом, способ получения соединений формулы (i), в которой R3 содержит -OH, включает удаление защитных групп (например, гидрогенолизом или гидролизом) у соединения формулы (i), где R3 содержит соответствующую группу -OP, где P обозначает подходящую защитную группу (например, бензил или ацетат).
Очевидно, что если требуется определенный стереоизомер формулы (i), он может быть получен с применением традиционной методики разделения, такой как жидкостная хроматография высокого разрешения, или с помощью приведенных в настоящем описании способов синтеза с использованием соответствующего гомохирального исходного материала.
Способ получения соединения формулы (i), где X обозначает CO, включает взаимодействие соответствующей карбоновой кислоты формулы (ii) с подходящим амином формулы (iii)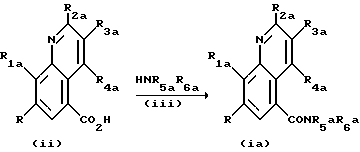
где R1a обозначает R1, определенный в формуле (i), или группу, превращаемую в R1, и R2a-R6a, аналогично обозначает R2-R6 или группу, превращаемую в R2-R6 соответственно; и после этого, если нужно, превращение любой группы R1a в R1 и/или R2a в R2, и/или R3a в R3, и/или R4a в R4, и/или R5a в R5, и/или R6a в R6. Реакция карбоновой кислоты формулы (ii) с амином формулы (iii) может быть проведена в любых подходящих условиях, известных в технике. Предпочтительно перед проведением реакции с амином формулы (iii) карбоновую кислоту превращают в хлорангидрид, смешанный ангидрид или другие активированные промежуточные формы. Предпочтительно реакцию с амином формулы (iii) проводят в присутствии подходящего основания, например амина, такого как триэтиламин, предпочтительно, в соответствующем растворителе, таком как дихлорметан. В некоторых случаях требуется более сильное основание, такое как гидрид натрия, и полярный растворитель, такой как диметилформамид.
Карбоновые кислоты формулы (ii) либо относятся к oписанным ранее соединениям и коммерчески доступны, либо могут быть получены с использованием стандартных методик, известных специалистам в данной области. Так, например, карбоновая кислота формулы (ii) может быть достаточно просто получена из замещенной соответствующим образом аминобензойной кислоты формулы (iv) и кетона (или альдегида) формулы (v) с использованием реакции Скраупа (Z.H. Skraup, Ber. 13: 2086 (1880)). Реакция может быть проведена в стандартных условиях, известных специалистам в данной области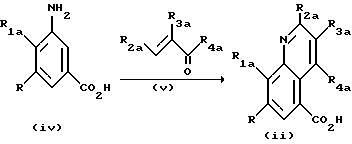
Кислоты формулы (iv) и кетоны (или альдегиды) формулы (v) либо относятся к описанным ранее соединениям и коммерчески доступны, либо могут быть получены с использованием стандартных методик, известных специалистам в данной области.
Кислоты формулы (ii) могут быть получены альтернативным способом карбоксилирования бромидов формулы (vi). Такие реакции карбоксилирования могут быть проведены с использованием любых стандартных условий, известных специалистам в данной области, например, с помощью металлорганического катализа (например, катализа с применением палладия). Бромиды формулы (vi) могут быть получены при бромировании хинолинов формулы (vii) в стандартных условиях, известных в уровне техники, например, при использовании брома в метаноле. Хинолины формулы (vii) либо относятся к описанным ранее соединениям и коммерчески доступны, либо могут быть получены с использованием стандартных методик, известных специалистам в данной области. Так, например, хинолины формулы (vii) могут быть получены реакцией Скраупа соответствующего анилина формулы (viii) с кетоном (или альдегидом) формулы (v). Альтернативный способ получения хинолинов формулы (vii) основан на использовании реакции Комбе ((A. Combes, Bull. Soc. Chim. France 49:39 (1888))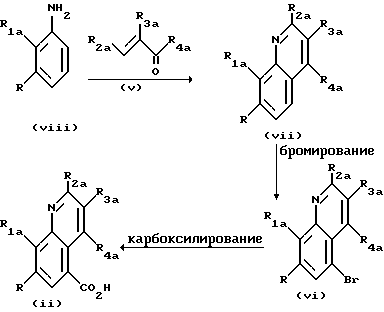
Соединение формулы (ia) может быть также получено реакцией карбоновой кислоты формулы (ii) с амином формулы H2NR6a (ix) с получением соединения формулы (ia), в которой R5a обозначает H, с последующей реакцией с соответствующим агентом формулы R5aY (х), где R1a-R6a были определены ранее и Y обозначает подходящую уходящую группу, такую как галоген. Реакция карбоновой кислоты формулы (ii) с амином формулы (ix) может проводиться в подходящих условиях, известных из уровня техники. Предпочтительно перед проведением реакции с амином формулы (ix) карбоновую кислоту превращают в хлорангидрид, смешанный ангидрид или другое активированное промежуточное соединение. Предпочтительно реакцию проводят в присутствии подходящего основания, например амина, такого как триэтиламин, предпочтительно в соответствующем растворителе, таком как дихлорметан. В некоторых случаях может потребоваться более сильное основание, такое как гидрид натрия, и полярный растворитель, такой как диметилформамид.
Амины формул (iii) и (ix) и агенты формулы (х) либо относятся к описанным ранее соединениям и коммерчески доступны, либо могут быть получены с использованием стандартных методик, известных специалистам в данной области. Реакция соединения формулы (ia), в которой R5 обозначает H, с агентом формулы (х) может быть проведена в любых подходящих условиях, известных в технике. Предпочтительно реакцию проводят с использованием приемлемого основания, такого как гидрид натрия, предпочтительно в приемлемом растворителе, таком как диметилформамид. Агент (х) может представлять собой алкилирующий агент, такой как пропилбромид, ацилирующий агент, такой как бензоилхлорид, или сульфонирующий агент, такой как метансульфонилхлорид.
Соединение формулы (i) может быть также получено взаимопревращением других соединений формулы (i). Так, например, соединение, в котором R3 содержит алкоксигруппу, может быть получено соответствующим алкилированием соединения, в котором R3 содержит гидроксигруппу.
Соединения, в которых R2-R4 содержат CO-алкил, CO-арил, CO-гетероарил, CO-алкиларил, CO-алкилгетероарил, CO-алкилгетероцикло, могут быть получены из соединений, в которых R2-R4 содержaт CN-группу, добавлением металлорганического агента (такого как реактив Гриньяра).
В качестве еще одного примера может быть указан способ получения соединений, в которых R2-R4 содержат оксим, из соединений, в которых R2-R4 содержат карбонильную группу. Указанное превращение может быть осуществлено с использованием стандартных условий, известных специалистам в данной области. Соединения формулы (i), в которых R2-R4 содержат карбонильную группу, могут быть также восстановлены с использованием стандартных условий, известных специалистам в данной области (например, боргидридом натрия в соответствующем растворителе) с получением соединений, в которых R2-R4 содержат спиртовую группу. Соединения, в которых R2-R4 являются алкилами, могут быть получены восстановлением соединений, в которых R2-R4 представляют собой CO-алкил, с использованием стандартных условий, известных специалистам в данной области (например, гидразингидратом в присутствии подходящего основания в приемлемом растворителе). Другие превращения могут быть осуществлены на основе соединений формулы (i), в которых R2-R4 содержат карбонильную группу. Такие превращения включают, не ограничиваясь ими, восстановительное аминирование и алкилирование. Любое из указанных выше превращений может быть проведено либо в конце синтеза, либо с соответствующим промежуточным продуктом.
Соединения формулы (i), в которой X обозначает CS, могут быть получены из соединений формулы (i), в которой X обозначает CO, с использованием стандартных условий, известных специалистам в данной области, например реактива Лауэссона.
Соединение формулы (i) или, где это возможно, его фармацевтически приемлемая соль, и/или его фармацевтически приемлемый сольват могут быть введены сами по себе или предпочтительно в виде фармацевтической композиции, которая также включает фармацевтически приемлемый носитель.
В связи с этим настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы (i) или, где это возможно, его фармацевтически приемлемую соль, и/или его фармацевтически приемлемый сольват и фармацевтически приемлемый носитель.
Активное соединение может быть приготовлено в форме, пригодной для введения любым подходящим способом, при этом выбор предпочтительного способа зависит от конкретного заболевания, которое требуется лечить, а предпочтительной формой является стандартная дозированная форма или форма, которую пациент сам может употреблять в разовой дозировке. Предпочтительно композиции подходят для перорального, ректального, местного, парентерального способов введения, а также через дыхательный путь. Препаративные формы могут быть приготовлены таким образом, чтобы обеспечивать медленное высвобождение активного ингредиента.
Термин "парентеральный", используемый в настоящем изобретении, включает подкожные, внутривенные, внутримышечные, внутригрудинные инъекции, а также инфузионные методики. Кроме лечения заболеваний теплокровных животных, таких как мыши, крысы, лошади, крупный рогатый скот, овцы, собаки, кошки и др., соединения по настоящему изобретению также эффективны для лечения человека.
Композиции по настоящему изобретению могут иметь форму таблеток, капсул, саше, ампул, порошков, гранул, леденцов, суппозиториев, восстанавливаемых порошков или жидких препаратов, таких как стерильные растворы или суспензии для перорального или парентерального введения. Там, где это приемлемо, применяется также местное введение композиций.
Для достижения последовательности введения композиции предпочтительно, чтобы она имела вид единичной дозированной формы.
К таким единичным дозированным формам, пригодным для перорального введения, относятся таблетки и капсулы, которые могут содержать обычные наполнители, такие как связывающие вещества, например, сахарный сироп, аравийскую камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например, микрокристаллическую целлюлозу, лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазочные вещества для приготовления таблеток, например, стеарат магния; разрыхляющие агенты, например, крахмал, поливинилпирролидон, натрий-крахмал-гликолят или микрокристаллическую целлюлозу; или фармацевтически приемлемые смачивающие агенты, такие как лаурилсульфат натрия.
Твердые пероральные композиции могут быть приготовлены с помощью традиционных методов смешивания, наполнения, таблетирования и др. В тех случаях, когда указанные композиции содержат большие количества наполнителей, для распределения активного компонента по всей массе указанной композиции могут применяться операции повторного смешивания.
Такие операции, несомненно, относятся к обычным методикам, известным в технике. Таблетки могут покрываться оболочкой с применением методики, известной в фармацевтической практике, в частности посредством нанесения энтеросолюбильного покрытия.
Пероральные жидкие препараты могут иметь вид, например, эмульсий, спиртов или эликсиров, или они могут быть представлены в виде сухого продукта, пригодного для восстановления водой или другим подходящим носителем перед употреблением. Указанные жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например сорбит, сахарный сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия, гидрогенизированные пищевые жиры; эмульгаторы, например лецитин, сорбитанмоноолеат или аравийская камедь, неводные носители (которые могут включать пищевые жиры), например миндальное масло, фракционированное кокосовое масло, сложные жирные эфиры, такие как сложные эфиры глицерина, пропиленгликоля или этилового спирта; консерванты, например метил- или пропил-п-гидроксибензоат или сорбиновую кислоту; и, если желательно, обычные ароматизаторы или красители.
Композиции могут быть также соответствующим способом приготовлены для целей введения через дыхательный тракт и иметь вид порошка для вдыхания через нос или аэрозоля или раствора для распыления или тонкоизмельченного порошка для инсуффляции, применяемого в качестве отдельного средства самого по себе или в сочетании с инертным носителем, таким как лактоза. В таком случае для частиц активного соединения приемлем диаметр менее 50 мкм, такой как в интервале от 0,1 до 50 мкм, предпочтительно менее 10 мкм, например от 1 до 10 мкм, от 1 до 5 мкм или от 2 до 5 мкм. Там, где это приемлемо, могут включаться небольшие количества других антиастматических средств и бронходилататоров, например симпатомиметических аминов, таких как изопреналин, изоэтарин, салбутамол, фенилэфрин и эфедрин; кортикостeроидов, таких как преднизолон и адреналиновые стимуляторы, такие как АКТГ.
Для целей парентерального введения могут быть приготовлены жидкие единичные дозированные формы с использованием рассматриваемого соединения и стерильного носителя, в котором в зависимости от используемой концентрации может быть суспендировано или растворено активное соединение. В случае приготовления растворов соединение растворяют в воде для инъекции и стерильно фильтруют в подходящий флакон или ампулу и герметично закрывают.
Предпочтительно адъюванты, такие как анестезирующее средство местного действия, консервант и забуферивающий агент, могут быть растворены в растворителе. Для увеличения стабильности композиция может быть заморожена после введения в ампулу, и под вакуумом из нее удаляется вода. Парентеральные суспензии готовят принципиально по той же схеме, за исключением того, что соединение не растворяют, а суспендируют в носителе, тогда как стерилизацию в этом случае уже нельзя провести фильтрованием. Соединение может быть простерилизовано обработкой этиленоксидом перед процессом суспендирования в стерильном носителе. В композицию с целью облегчения равномерного распределения соединения могут быть предпочтительно добавлены поверхностно-активное вещество или смачивающий агент.
Композиции могут содержать от 0,1 до 99 вес.%, предпочтительно, в диапазоне от 10 до 60 вес.% активного агента в зависимости от выбранного способа введения.
Соединения формулы (i) или, где это подходит, его фармацевтически приемлемая соль, и/или его фармацевтически приемлемый сольват могут также вводиться местно в сочетании с традиционными наполнителями для целей местного введения.
Композиции для местного введения могут иметь вид, например, мазей, кремов или лосьонов, пропитанных повязок, гелей, карандашей на гелевой основе, распылителей и аэрозолей, и содержать соответствующие традиционные добавки, такие как консерванты, растворители для облегчения проникновения лекарственного средства и умягчители в случае мазей и кремов. Препараты могут содержать совместимые традиционные носители, такие как мазевые и кремовые основы, и этиловый или олеиловый спирты в случае лосьонов.
Подходящие формы композиций в виде крема, лосьона, геля, карандаша, мази, распылителя или аэрозоля, которые могут использоваться для соединений формулы (i) или, где это подходит, их фармацевтически приемлемых солей, относятся к традиционным препаративным формам, известным в технике, которые описаны, например, в стандартных руководствах (таких как Harry's Cosmeticology, Leonard Hill Books, Remington's Pharmaceutical Sciences; and British and US Pharmacopoeias).
Соответственно соединение формулы (i) или, где это подходит, его фармацевтически приемлемая соль, составляют от примерно 0,5 до примерно 20 вес.% от всей композиции, предпочтительно от примерно 1 до 10 вес.%, например от 2 до 5 вес.%.
Доза соединения, используемая при лечении по настоящему изобретению, может, как и обычно, применяться в зависимости от таких факторов, как тяжесть заболевания, вес больного и относительная эффективность соединения. Однако в качестве основных подходящих единичных доз могут использоваться дозы от 0,1 до 1000 мг, такие как в интервале от 0,5 до 200, от 0,5 до 100 или от 0,5 до 10 мг, например 0,5, 1, 2, 3, 4 или 5 мг; причем такие единичные дозы могут вводиться более чем один раз в день, например 2, 3, 4, 5 или 6 раз в день, но предпочтительно 1 или 2 раза в день, так чтобы общая дневная доза для взрослого пациента весом 70 кг находилась в интервале от примерно 0,1 до примерно 1000 мг, что соответствует дозе в интервале от примерно 0,001 до примерно 20 мг/кг/день, в таком интервале, как от 0,007 до 3, от 0,007 до 1,4, от 0,007 до 0,14 или от 0,01 до 0,5 мг/кг/день, например, в дозе 0,01, 0,02, 0,04, 0,05, 0,06, 0,08, 0,1 или 0,2 мг/кг/день, и такая терапия может продолжаться недели или месяцы.
В тексте настоящего описания термин "фармацевтически приемлемый" включает материалы, пригодные как для лечения человека, так и для целей ветеринарного применения.
Приведенные ниже примеры иллюстрируют настоящее изобретение.
Промежуточный продукт 1
8-Метоксихинолин-5-карбоновая кислота
Смесь 3-амино-4-метоксибензойной кислоты (5,0 г), глицерина (4,16 г) и йода (135 мг) в концентрированной серной кислоте (5 мл) нагревают при 180oC в течение 2 ч. Далее реакционную смесь охлаждают, разбавляют водой (170 мл), подщелачивают до pH 8/9 с помощью 0,88 г аммиака и перемешивают с активированным углем (2,0 г). Затем смесь фильтруют через целит, и фильтрат подкисляют до pH 4/5 с помощью уксусной кислоты. Полученный при фильтровании осадок высушивают в эксикаторе с получением желаемого продукта (4,21 г) в виде рыжевато-коричневого твердого вещества.
Rf в ТСХ составляет 0,35 (1% уксусная кислота, 5% метанол в этилацетате)
Промежуточный продукт 2
8-Mетокси-2-метилхинолин
Смесь 8-гидроксихинальдина (5,0 г) и тетрабутиламмония йодида (1,1 г) в тетрагидрофуране (90 мл) обрабатывают при комнатной температуре гидроксидом натрия (4,5 г) в воде (45 мл). Добавляют метилйодид (3,7 мл), и реакционную смесь перемешивают в течение ночи. ТГФ удаляют в вакууме, и оставшийся раствор распределяют между этилацетатом (100 мл) и водой (100 мл). Водный слой подвергают повторной экстракции этилацетатом и объединяют органические экстракты. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия (100 мл) и насыщенным водным раствором хлорида натрия (100 мл). Органический слой высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме с получением желаемого продукта в виде желтовато-белого твердого вещества (5,85 г).
Rf в ТСХ составляет 0,46 (этилацетат).
Приведенные ниже промежуточные продукты получают аналогичным способом.
Промежуточный продукт 3
8-Mетоксихинолин-2-карбонитрил
Целевое соединение выделяют в виде белого твердого продукта (325 мг).
Rf в ТСХ составляет 0,27 (50% этилацетат в гексане).
Промежуточный продукт 4
2-Бром-8-метоксихинолин
Очистка флэш-хроматографией на силикагеле при проведении элюирования 50% этилацетатом в гексане дает целевое соединение (1,45 г) в виде бледно-желтого кристаллического твердого вещества.
Rf в ТСХ составляет 0,55 (50% этилацетат в гексане).
Промежуточный продукт 5
3-Этил-8-метоксихинолин
Свежеперегнанный 2-этил-акролеин (1,7 мл) добавляют в течение 20 мин к раствору o-анизидина (1,5 г) и йода (20 мг) в 70% серной кислоте (10 мл) и перемешивают при 110oC. Через 2 ч реакционную смесь охлаждают до 0oC и подщелачивают 25% водным раствором гидроксида натрия (pH 13). Водный слой экстрагируют этилацетатом (2 х 100 мл), и объединяют полученные экстракты. Органический слой экстрагируют 2М соляной кислотой (2 х 100 мл), и объединенные кислотные экстракты снова подщелачивают 25% раствором гидроксида натрия. Водный слой экстрагируют этилацетатом (2 х 100 мл), экстракты объединяют, высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток очищают с помощью колоночной хроматографии, проводя элюирование 25-50% этилацетатом в гексане, с получением целевого продукта в виде рыжевато-коричневого масла (0,42 г).
Rf в ТСХ составляет 0,17 (50% этилацетат в гексане)
Промежуточный продукт 6
2-Этил-8-метоксихинолин
К перемешанному раствору 8-метокси-2-метилхинолина (0,25 г) в тетрагидрофуране (4 мл) при -60oC в атмосфере инертного газа добавляют по каплям н-бутиллитий (1 мл, 1,6 М в гексанах). Полученный красный раствор перемешивают при -60oC в течение 15 мин и затем нагревают до -40oC. Добавляют по каплям йодметан (0,27 мл), и реакционную смесь медленно нагревают до комнатной температуры при продолжении перемешивания в течение 12 ч. Реакцию останавливают добавлением солевого раствора (50 мл), и проводят экстракцию дихлорметаном (2 х 50 мл). Органические фазы объединяют, высушивают над сульфатом магния и проводят предварительную адсорбцию на силикагеле. Далее проводят очистку хроматографией на колонке, элюируя этилацетатом, с получением целевого соединения в виде бледно-желтого твердого вещества (0,16 г).
Rf в ТСХ составляет 0,53 (этилацетат).
Промежуточный продукт 7
2-Фтор-8-метоксихинолин
Раствор 3-фтор-2-метоксианилина (5,0 г) в 1,2-дихлорбензоле (50 мл) нагревают до 170oC и обрабатывают п-толуолсульфоновой кислотой (0,7 г). Далее добавляют по каплям в течение 20 мин раствор акролеина (4,0 г) в 1,2-дихлорбензоле (20 мл). Реакционную смесь перемешивают в течение 1 ч при 170oC, после чего охлаждают. Смесь экстрагируют 2N соляной кислотой (3 х 200 мл), и объединенные экстракты промывают дихлорметаном (20 мл), подщелачивают 25% водным раствором гидроксида натрия и экстрагируют этилацетатом (3 х 200 мл). Объединенные экстракты высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем, проводя элюирование 50% этилацетатом в гексане, с получением желаемого продукта (2,6 г) в виде прозрачного масла.
Rf в ТСХ составляет 0,21 (50% этилацетат в гексане).
Промежуточный продукт 8
5-Бром-8-метокси-2-метилхинолин
Раствор 8-метокси-2-метилхинолина (1,0 г) в метаноле (30 мл) обрабатывают при комнатной температуре бромом (0,31 мл). Смесь нагревают при 45oC в течение 2 ч, и останавливают реакцию добавлением 5% водного раствора метабисульфита натрия (50 мл). Раствор подщелачивают 25% водным раствором гидроксида натрия до pH 13, и экстрагируют продукт этилацетатом (2 х 100 мл). Экстракты объединяют, высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток растворяют в этилацетате и пропускают через слой кремнезема. Раствор выпаривают в вакууме с получением желаемого продукта в виде желтовато-белого твердого вещества (0,43 г).
Rf в ТСХ составляет 0,57 (этилацетат).
Приведенные ниже промежуточные продукты получают аналогичным способом.
Промежуточный продукт 9
5-Бром-3-этил-8-метоксихинолин
Целевое соединение выделяют в виде рыжевато-коричневого твердого вещества (0,501 г).
Rf в ТСХ составляет 0,125 (50% этилацетат в гексане).
Промежуточный продукт 10
5-Бром-2-этил-8-метоксихинолин
Целевое соединение выделяют в виде коричневого маслянистого твердого вещества (3,3 г).
Rf в ТСХ составляет 0,67 (15% этилацетат в дихлорметане).
Промежуточный продукт 11
5-Бром-8-метокси-2(трифторметил)хинолин
Целевое соединение (4,15 г) выделяют в виде белого твердого вещества; Т. пл. 84-85oC.
Промежуточный продукт 12
5-Бром-7-фтор-8-метоксихинолин
К раствору 7-фтор-8-метоксихинолина (1,6 г) в ледяной уксусной кислоте (24 мл) добавляют по каплям бром (0,48 мл). Смесь нагревают до 40oC в течение 4 ч, и реакцию останавливают добавлением 5% водного раствора метабисульфита натрия (100 мл). Раствор подщелачивают 25% водным раствором гидроксида натрия до pH 13, и экстрагируют продукт этилацетатом (3 х 150 мл). Экстракты объединяют, высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем, проводя элюирование 25% этилацетатом в гексане, с получением желаемого продукта в виде белого твердого вещества (0,50 г).
Rf в ТСХ составляет 0,46 (50% этилацетат в гексане).
Промежуточный продукт 13
5-Бром-8-метоксихинолин-2-карбонитрил
К раствору промежуточного продукта 3 (310 мг) в ледяной уксусной кислоте (10 мл) добавляют ацетат натрия (690 мл). Затем добавляют по каплям бром (0,1 мл), и смесь перемешивают при комнатной температуре в течение 17 ч. Реакцию останавливают добавлением 5% водного раствора метабисульфита натрия (20 мл), затем смесь подщелачивают 25% водным раствором гидроксида натрия до pH 13 и экстрагируют этилацетатом (3 х 60 мл). Экстракты объединяют, высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем, проводя элюирование 33% этилацетатом в гексане, с получением желаемого продукта в виде белого твердого вещества (365 мг).
Rf в ТСХ составляет 0,63 (50% этилацетат в гексане).
Промежуточный продукт 14
Метил 5-бром-8-метоксихинолин-2-карбоксилата
Очистка с помощью флэш-хроматографии дает целевое соединение (0,48 г) в виде белого твердого вещества.
Rf в ТСХ составляет 0,37 (этилацетат в гексане).
Промежуточный продукт 15
5-Бром-8-дифторметоксихинолин
К суспензии 5-бром-8-гидроксихинолина (2,74 г) в диоксане (150 мл) добавляют водный гидроксид натрия (47%, 15 мл) и бензилтриэтиламмония хлорид (0,25 г). Энергично перемешиваемую смесь нагревают до 75oC, и через реакционную смесь с помощью диффузора пропускают газ хлордифторметан в течение 50 мин. Затем раствор охлаждают до комнатной температуры, и реакционную смесь вливают в воду (250 мл) и экстрагируют этилацетатом (3 х 200 мл). Объединенные органические экстракты промывают водой (2 х 150 мл), высушивают (сульфат магния) и выпаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем, проводя элюирование 50% этилацетатом в гексане, с получением целевого соединения в виде желтого твердого вещества (1,64 г).
Rf в ТСХ составляет 0,70 (50% этилацетат в гексане).
Промежуточный продукт 16
5-Бром-8-дифторметоксихинальдин
Очистка с помощью перекристаллизации из водного метанола дает целевое соединение в виде желтовато-белого твердого вещества (4,8 г).
Rf в ТСХ составляет 0,86 (50% этилацетат в гексане).
Промежуточный продукт 17
8-Метокси-2-метилхинолин-5-карбоновая кислота
Смесь 5-бром-8-метокси-2-метилхинолина (2,0 г), триэтиламина (11 мл), трифенилфосфина (0,79 г) и бис(трифенилфосфин)палладия (II) хлорида (1,56 г) в тетрагидрофуране (200 мл) и воде (90 мл) перемешивают в герметичном реакционном сосуде, и пропускают моноокись углерода до достижения давления 160 фунт/дюйм2 (907027,2 Па). Сосуд нагревают до 80oC и перемешивают в течение 72 ч. Реакционную смесь охлаждают, и в сосуде спускают давление. Смесь фильтруют, и органический растворитель удаляют в вакууме. Водный остаток подщелачивают 1М гидроксидом натрия и промывают этилацетатом (300 мл). Затем водный раствор подкисляют до pH 5 ледяной уксусной кислотой и экстрагируют этилацетатом (2 х 400 мл). Органические экстракты объединяют, высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме с получением целевого продукта (1,0 г) в виде желтовато-белого твердого вещества.
Rf в ТСХ составляет 0,17 (этилацетат).
Приведенные ниже промежуточные продукты получают аналогичным способом.
Промежуточный продукт 18
3-Этил-8-метоксихинолин-5-карбоновая кислота
Целевое соединение получают из 5-бром-3-этил-8-метоксихинолина и выделяют в виде желто-белого твердого вещества (0,6 г).
Rf в ТСХ составляет 0,7 (10% метанол в этилацетате).
Промежуточный продукт 19
2-[(т-Бутилоксикарбонил)(метил)амино]-8-метоксихинолин-5- карбоновая кислота
Целевое соединение (0,311 г) получают из 5-бром-2-[(т- бутилоксикарбонил) (метил)амино]-8-метоксихинолина (1,18 г).
Масс-спектр (EI) 233 [М-Бок+H]+.
Приведенные ниже промежуточные продукты получают аналогичным способом, но при подкислении водной фазы ледяной уксусной кислотой до pH 4-5 целевые соединения выпадают в осадок. Их отделяют фильтрованием и высушивают в вакууме.
Промежуточный продукт 20
8-Дифторметоксихинолин-5-карбоновая кислота
Целевое соединение выделяют в виде бежевого твердого вещества (0,85 г); Т.пл. 280oC (разлож.).
Промежуточный продукт 21
8-Дифторметоксихинальдин-5-карбоновая кислота
Целевое соединение выделяют в виде бежевого твердого вещества (2,9 г).
Rf в ТСХ составляет 0,6 (10% метанол в дихлорметане).
Промежуточный продукт 22
7-Фтор-8-метоксихинолин-5-карбоновая кислота
Целевое соединение выделяют в виде желтовато-белого твердого вещества (0,58 г).
Rf в ТСХ составляет 0,1 (этилацетат).
Промежуточный продукт 23
8-Метокси-2-(пирид-3-ил)-хинолин-3-карбоновая кислота
Целевое соединение получают в виде бежевого порошка (366 мг); Т.пл. 264oC (разлож.)
Приведенные ниже промежуточные продукты получают аналогичным способом, но вместо тетрагидрофурана в качестве растворителя используют диметилформамид.
Промежуточный продукт 24
2-Циано-8-метоксихинолин-5-карбоновая кислота
Целевое соединение выделяют в виде желтовато-белого твердого вещества (0,304 г).
Rf в ТСХ составляет 0,1 (этилацетат).
Промежуточный продукт 25
8-Метокси-2-(трифторметил) хинолин-5-карбоновая кислота
Целевое соединение (3,10 г) получают в виде белого твердого вещества; Т. пл. 248-249oC.
Промежуточный продукт 26
2-Этил-8-метоксихинолин-5-карбоновая кислота
Смесь 5-бром-2-этил-8-метоксихинолина (3,3 г), гидроксида натрия (3,1 г, 46% раствор в воде), трифенилфосфина (0,22 г) и бис(трифенилфосфин)палладия (II) хлорида (0,14 г) в тетрагидрофуране (14 мл) и воде (7 мл) перемешивают в герметичном реакционном сосуде, и пропускают моноокись углерода до достижения давления 160 фунт/дюйм2 (907027,2 Па). Сосуд нагревают до 105oC и перемешивают в течение 24 ч. Реакционной смеси дают охладиться, и спускают в сосуде давление. Смесь фильтруют, и собранный твердый продукт промывают тетрагидрофураном (2 х 10 мл). Твердый продукт растворяют в горячем метаноле (10 мл) и воде (10 мл), и фильтруют раствор для удаления любых оставшихся твердых материалов. Горячий раствор обрабатывают ледяной уксусной кислотой (2 мл) и охлаждают на льду. Отфильтровывают полученный осадок и далее высушивают его в вакууме над силикагелем с получением целевого соединения в виде белого твердого вещества (0,44 г).
Rf в ТСХ составляет 0,2 (этилацетат).
Промежуточный продукт 27
Гидрохлорид 8-метоксихинолин-5-карбонилхлорида
Суспензию 8-метоксихинолин-5-карбоновой кислоты (1,5 г) в дихлорметане (12 мл) охлаждают до 0oC и обрабатывают оксалилхлоридом (1,3 мл), затем ДМФ (8 капель). Реакционной смеси дают нагреться до комнатной температуры, и перемешивают в течение ночи. Растворитель удаляют в вакууме, и осуществляют азеотропную перегонку остатка с толуолом (2 х 10 мл) с получением желаемого продукта (1,61 г) в виде желтовато-белого порошка.
Приведенные ниже хлорангидриды получают аналогичным способом из соответствующей карбоновой кислоты.
Промежуточный продукт 28
Гидрохлорид 8-метокси-2-метилхинолин-5-карбонилхлорида
Целевое соединение выделяют в виде желтовато-белого твердого вещества (0,5 г).
Промежуточный продукт 29
Гидрохлорид 3-этил-8-метоксихинолин-5-карбонилхлорида
Целевое соединение выделяют в виде желтовато-белого твердого вещества (0,68 г); Т.пл. 185-186oC (разлож.)
Промежуточный продукт 30
Гидрохлорид 7-фтор-8-метоксихинолин-5-карбонилхлорида
Целевое соединение выделяют в виде коричневого твердого вещества (0,64 г).
Промежуточный продукт 31
Гидрохлорид 2-циано-8-метоксихинолин-5-карбонилхлорида
Целевое соединение выделяют в виде коричневого твердого вещества (0,32 г).
Промежуточный продукт 32
Гидрохлорид 8-дифторметоксихинолин-5-карбонилхлорида
Целевое соединение выделяют в виде бежевого твердого вещества (853 мг).
Промежуточный продукт 33
Гидрохлорид 2-этил-8-метоксихинолин-5-карбонилхлорида
Целевое соединение выделяют в виде темно-красного маслянистого твердого вещества (0,48 г).
Промежуточный продукт 34
Гидрохлорид 8-метокси-2-(3-пиридил)хинолин-5-карбонилхлорида
Целевое соединение получают в виде бежевого твердого вещества (0,39 г).
Промежуточный продукт 35
Гидрохлорид 8-метокси-2-(трифторметил)хинолин-5-карбонилхлорида
Целевое соединение получают в виде бледно-желтого твердого вещества.
Промежуточный продукт 36
4-амино-3-хлорпиридин
Раствор 4-аминопиридина (4,0 г) в концентрированной соляной кислоте (50 мл) обрабатывают при 80-85oC водным раствором перекиси водорода (13,5%, вес/объем). Раствор охлаждают до 0oC. Через 30 мин раствор осторожно обрабатывают водным раствором гидроксида натрия (50%, вес/объем), поддерживая температуру ниже 15oC. Осадок отфильтровывают и высушивают на воздухе с получением целевого соединения в виде белого твердого вещества (4,9 г).
Rf в ТСХ составляет 0,36 (этилацетат).
Т.пл. 65-67oC.
Промежуточный продукт 37
8-метокси-2-(3-пиридил)хинолин
К перемешиваемой смеси 2-бром-8-метоксихинолина (956 мг), диэтил(3-пиридил)борана (590 мг), тетракис(трифенилфосфин)палладия (0) (250 мг) и тетра-н-бутиламмония йодида (740 мг) в безводном тетрагидрофуране (60 мл) добавляют порошкообразный гидроксид калия (675 мг). Перемешиваемый раствор кипятят с обратным холодильником в атмосфере инертного газа в течение 1,25 ч. Растворитель удаляют в вакууме, а остаток распределяют между дихлорметаном (100 мл) и водой (80 мл). Водную фазу повторно экстрагируют дихлорметаном (2 х 50 мл), и объединенные органические фазы высушивают (сульфат магния), фильтруют через небольшой слой целита и выпаривают в вакууме. Сырой продукт очищают флэш-хроматографией на силикагеле, проводя элюирование этилацетатом, с получением целевого соединения (780 мг) в виде прозрачного масла.
Rf в ТСХ составляет 0,25 (этилацетат).
Промежуточный продукт 38
5-Бром-8-метокси-2-(3-пиридил)хинолин
К перемешиваемому и охлажденному (0-5oC) раствору 8- метокси-2-(3-пиридил)хинолина (780 мг) в метаноле (30 мл) в атмосфере азота добавляют по каплям бром (200 мкл). Реакционную смесь перемешивают в течение 15 мин, и затем останавливают реакцию добавлением 5% водного раствора бисульфита натрия (7 мл). Реакционную смесь выпаривают в вакууме, и остаток распределяют между 0,5N раствором гидроксида натрия (65 мл) и дихлорметаном (75 мл). Водную фазу повторно экстрагируют дихлорметаном (2 х 75 мл), и объединенные органические фазы высушивают (сульфат магния), фильтруют и выпаривают в вакууме. Растирание с диэтиловым эфиром дает целевое соединение (570 мг) в виде бледно-коричневого твердого вещества.
Rf в ТСХ составляет 0,2 (этилацетат).
Промежуточный продукт 39
5-[8-Mетокси-5-[N-(3,5-дихлорпиридин-4-ил)] аминокарбонилхинолин-2-ил] -2-триметилстаннил-2H-тетразол
2-циано-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] -карбоксамид (390 мг) и азид триметилолова (480 мг) в толуоле (20 мл) и тетрагидрофуране (20 мл) кипятят с обратным холодильником в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, отфильтровывают полученный осадок, промывают его толуолом (2 х 5 мл) и высушивают в вакууме при 40oC с получением целевого соединения в виде бледно-желтого твердого вещества (299 мг).
Т.пл. 229-231oC.
Промежуточный продукт 40
Метил 8-гидроксихинолин-2-карбоксилата
Объединяют 8-гидроксихинолин-2-карбоновую кислоту (2,08 г) и тетрагидрофуран (200 мл) и перемешивают, охлаждая на бане со льдом. Затем добавляют диазометан (примерно 16,6 ммоль, раствор в диэтиловом эфире), и все перемешивают в течение 1,5 ч при медленном нагревании до комнатной температуры. Через реакционную смесь продувают азот для вытеснения избытка диазометана, и раствор выпаривают в вакууме с получением целевого соединения (1,6 г).
Rf в ТСХ составляет 0,12 (50% этилацетат в гексане).
Промежуточный продукт 41
Метил 8-метоксихинолин-2-карбоксилата
Объединяют 8-гидроксихинолин-2-карбоксилат (1,6 г), ацетон (15 мл), карбонат калия (1,3 г) и йодометан (0,6 мл) и перемешивают при комнатной температуре в течение 48 ч. Растворители удаляют в вакууме, и полученный белый остаток суспендируют в воде (25 мл), и далее экстрагируют этилацетатом (3 х 25 мл). Объединенные органические слои высушивают (сульфат магния) и растворители удаляют в вакууме с получением целевого соединения в виде белого твердого вещества (1,72 г).
Rf в ТСХ составляет 0,22 (50% этилацетат в гексане).
Промежуточный продукт 42
5-Бром-8-метоксихинолин-2-карбоновая кислота
Метил 5-бром-8-метоксихинолин-2-карбоксилат (1,54 г), тетрагидрофуран (40 мл), воду (40 мл) и моногидрат гидроксида лития (0,436 г) объединяют и перемешивают при комнатной температуре в течение 1,5 ч. Тетрагидрофуран удаляют в вакууме, и полученную водную смесь подкисляют соляной кислотой. Образовавшийся белый осадок собирают фильтрованием и высушивают в вакууме с получением целевого соединения (1,33 г) в виде белого твердого вещества.
Масс-спектр (EI) 296 и 298 [М+Н]+.
Промежуточный продукт 43
5-Бром-2-т-бутилоксикарбониламино-8-метоксихинолин
5-Бром-3-метоксихинолин-2-карбоновую кислоту (2 г), т-бутанол (25 мл) и триэтиламин (1,48 мл) объединяют в атмосфере азота и нагревают до 80oC. Затем к раствору добавляют дифенилфосфорилазид (2,29 мл), и нагревание продолжают в течение 60 ч, при этом к указанному времени появляется осадок. Реакционную смесь выпаривают в вакууме над кремнеземом, очищают флэш-хроматографией с получением целевого соединения (1,21 г) в виде желтовато-белого твердого вещества.
Rf в ТСХ составляет 0,50 (50% этилацетат в гексане).
Промежуточный продукт 44
5-Бром-2[(т-бутилоксикарбонил)(метил)амино]-8-метоксихинолин
5-Бpoм-2-т-бутилoкcикаpбoнилaминo-8-метoкcихинолин (1,21 г) и тетрагидрофуран (20 мл) объединяют при комнатной температуре в атмосфере азота. Затем добавляют гидрид натрия (60% дисперсия в масле, 164 мг), и реакционную смесь перемешивают в течение 2 ч до появления вспенивания и желтого окрашивания. Далее добавляют йодометан (0,43 г), и перемешивание продолжают еще в течение 2 ч, после чего реакционную смесь разбавляют этилацетатом (100 мл), последовательно промывают водой, насыщенным водным раствором бикарбоната натрия и солевым раствором, высушивают (сульфат магния) и выпаривают в вакууме с получением целевого соединения (1,18 г) в виде желтого твердого вещества.
Rf в ТСХ составляет 0,60 (50% этилацетат в гексане).
Промежуточный продукт 45
4-Hитрофенил 2-[(т-бутилоксикарбонил)(метил) амино]-8-метоксихинолин-5-карбоксилат
2-[(т-бутилоксикарбонил)(метил)амино] -8-метоксихинолин-5- карбоновую кислоту (0,311 г), этилдиметиламинопропилкарбодиимида гидрохлорид (0,269 г), 4-нитрофенол (0,195 г), N,N- диметиламинопиридин (20 мг) и дихлорметан (20 мл) объединяют и затем перемешивают при комнатной температуре в течение 17 ч. Реакционную смесь выпаривают в вакууме над кремнеземом, и очищают флэш-хроматографией с получением целевого соединения (0,384 г) в виде бледио-желтого твердого вещества.
Rf в ТСХ составляет 0,50 (50% этилацетат в гексане).
Приведенные ниже промежуточные продукты получают аналогичным способом с использованием соответствующих исходных материалов.
Промежуточный продукт 46
4-Hитрофенил 8-дифторметоксихинальдин-5-карбоксилат
Очистка хроматографией на колонке с элюированием 50% этилацетатом в гексане дает целевое соединение в виде кремообразного твердого вещества (0,63 г).
Rf в ТСХ составляет 0,76 (10% метанол в дихлорметане).
Промежуточный продукт 47
8-т-Бутилдиметилсилилоксихинальдин
8-Гидроксихинальдин (10 г), т-бутилдиметилсилилхлорид (10 г) и имидазол (8,6 г) растворяют в N,N-диметилформамиде (150 мл) и перемешивают при температуре окружающей среды в течение ночи. Затем добавляют еще т-бутилдиметилсилилхлорид (4,7 г) и перемешивают реакционную смесь в течение 30 мин. Далее реакционную смесь разбавляют водой (600 мл) и экстрагируют ее дихлорметаном (3 х 300 мл). Объединенные органические фазы высушивают над сульфатом магния и концентрируют в вакууме с получением целевого соединения в виде оранжевого масла (17 г).
Rf в ТСХ составляет 0,9 (10% метанол в этилацетате).
Промежуточный продукт 48
5-Бром-8-т-бутилдиметилсилилоксихинальдин
К перемешиваемому раствору 8-т-бутилдиметилсилилоксихинальдина (15 г) в хлороформе при -40oC в атмосфере инертного газа добавляют одной порцией N-бромсукцинимид (14 г). Температуру реакционной смеси доводят до комнатной и затем кипятят с обратным холодильником в течение 6 ч. Затем при комнатной температуре к реакционной смеси добавляют еще N-бромсукцинимид (6 г) и продолжают перемешивание в течение 3 дней. Реакционную смесь вливают в 5% водный раствор метабисульфита натрия (300 мл) и проводят экстракцию хлороформом (3 х 300 мл). Объединенные органические фазы высушивают над сульфатом магния и концентрируют в вакууме с получением целевого соединения в виде оранжевого масла (16,4 г).
Rf в ТСХ составляет 0,8 (дихлорметан).
Промежуточный продукт 49
5-Бром-8-гидроксихинальдин
К перемешанному раствору 5-бром-8-т-бутилдиметилсилилоксихинальдина (16,3 г) в тетрагидрофуране (500 мл) добавляют по каплям тетрабутиламмония фторид (54 мл, 1М в тетрагидрофуране). После перемешивания в течение 10 мин реакционную смесь разбавляют дихлорметаном (500 мл) и экстрагируют водой (3 х 200 мл). Органическую фазу высушивают над сульфатом магния и концентрируют в вакууме. Очистка с помощью перекристаллизации из водного метанола дает целевое соединение в виде желтовато-белого твердого вещества (7,7 г).
Rf в ТСХ составляет 0,58 (10% метанол в дихлорметане).
Пример 1
8-Метоксихинолин-5-[N-(пиридин-4-ил)карбоксамид
К раствору 4-аминопиридина (94 мг) и триэтиламина (140 мкл) в дихлорметане (3 мл) при 0oC в атмосфере азота добавляют суспензию гидрохлорида 8-метоксихинолин-5-карбонилхлорида (0,5 г) в дихлорметане (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и затем разбавляют дихлорметаном. Органический раствор промывают насыщенным водным раствором гидрокарбоната натрия (20 мл), водой (5 мл), и водный слой экстрагируют дихлорметаном (25 мл). Объединяют органические экстракты, высушивают их над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток чистят хроматографией на колонке с силикагелем, элюируя 15% метанолом в дихлорметане, с получением целевого соединения в виде желтовато-белого твердого вещества (130 мг).
Rf в ТСХ составляет 0,4 (15% метанол в дихлорметане).
Т.пл. 257-258oC.
Продукты в приведенных ниже примерах получают из гидрохлорида 8-метоксихинолин-5-карбонилхлорида и соответствующего амина с использованием методики, аналогичной описанной выше.
Пример 2
8-Метоксихинолин-5-[N-(тиазол-2-ил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (80 мг).
Rf в ТСХ составляет 0,32 (10% метанол в этилацетате).
Т.пл. 249-251oC.
Пример 3
8-Метоксихинолин-5-[N-(2-трифторметоксифенил)]- карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (125 мг).
Rf в ТСХ составляет 0,54 (10% метанол в этилацетате).
Т.пл. 206-208oC.
Пример 4
8-Метоксихинолин-5-[N-2-(пиперидин-1-ил)фенил]- карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (100 мг).
Rf в ТСХ составляет 0,50 (10% метанол в дихлорметане).
Т.пл. 214-216oC.
Пример 5
8-Метоксихинолин-5-[N-(2-фторфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (90 мг).
Rf в ТСХ составляет 0,41 (10% метанол в этилацетате).
Т.пл. 190-192oC.
Пример 6
8-Метоксихинолин-5-[N-(2-метилфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (630 мг).
Rf в ТСХ составляет 0,46 (10% метанол в дихлорметане).
Т.пл. 215-216oC.
Пример 7
8-Метоксихинолин-5-[N-(2,6-диметилфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (550 мг).
Rf в ТСХ составляет 0,43 (10% метанол в дихлорметане).
Т.пл. 273-275oC.
Пример 8
8-Метоксихинолин-5-[N-(2-хлорфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (490 мг).
Rf в ТСХ составляет 0,47 (5% метанол в дихлорметане).
Т.пл. 196-197oC.
Пример 9
8-Метоксихинолин-5-[N-(2-метоксифенил)карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (150 мг).
Rf в ТСХ составляет 0,60 (10% метанол в дихлорметане).
Пример 10
8-Метоксихинолин-5-[N-(4-метоксифенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (780 мг).
Масс-спектр (EI) 309 [М+H]+
Пример 11
8-Метоксихинолин-5-[N-(2-хлор-6-метилфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (700 мг).
Масс-спектр (EI) 327 [М+H]+
Продукт следующего примера получают из гидрохлорида 8-метокси-2- метилхинолин-5-карбонилхлорида и 2-хлоранилина с использованием методики, аналогичной описанной ранее.
Пример 12
8-метокси-2-метилхинолин-5-[N-(2-хлорфенил)]карбоксамид
Очистка с помощью флэш-хроматографии на кремнеземе при элюировании 50% этилацетатом в дихлорметане дает целевое соединение (50 мг) в виде бледно-коричневого твердого веществa.
Rf в ТСХ составляет 0,4 (50% этилацетат в дихлорметане).
Т.пл. 225-226oC.
Пример 13
8-метоксихинолин-5-[N-(2,3-дихлорпиридин-3-ил)] -карбоксамид
К суспензии гидрида натрия (272 мг, 60% дисперсия в масле) в безводном ДМФ (5 мл) при комнатной температуре в атмосфере азота осторожно добавляют раствор 3-амино-2,5- дихлорпиридина (504 мг) в безводном ДМФ (5 мл). Полученную смесь перемешивают в течение 10 мин, и затем добавляют по каплям раствор гидрохлорида 8-метоксихинолин-5-карбонилхлорида (800 мг) в безводном ДМФ (10 мл). Реакционную смесь перемешивают в течение 2 ч при 50oC и 18 ч при комнатной температуре. Растворитель выпаривают в вакууме, и остаток распределяют между дихлорметаном (50 мл) и насыщенным водным раствором гидрокарбоната натрия (50 мл). Водный слой экстрагируют дихлорметаном (30 мл). Органические экстракты объединяют, промывают насыщенным водным раствором хлорида натрия (10 мл), высушивают над сульфатом магния, фильтруют, и фильтрат выпаривают в вакууме. Остаток чистят хроматографией на колонке с силикагелем, элюируя 10% метанолом в этилацетате, с получением целевого соединения в виде желтовато-белого твердого вещества (230 мг).
Rf в ТСХ составляет 0,30 (10% метанол в этилацетате).
Т.пл. 251-252oC.
Продукты в приведенных ниже примерах получают из гидрохлорида 8-метоксихинолин-5-карбонилхлорида и соответствующего амина с использованием методики, аналогичной описанной выше.
Пример 14
8-Метоксихинолин-5-[N-(пиримидин-4-ил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (130 мг).
Rf в TCX составляет 0,39 (15% метанол в этилацетате).
Т.пл. 225-226oC.
Пример 15
8-Метоксихинолин-5-[N-(3,5-дихлорпиридин-2-ил)] -карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (89 мг).
Пример 16
8-Метоксихинолин-5-[N-(3,5-дихлорпиридин-4- ил)]-карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (452 мг).
Rf в ТСХ составляет 0,45 (10% метанол в дихлорметане).
Т.пл. 258-260oC.
Пример 17
8-Метоксихинолин-5-[N-(4,6-дихлорпиримидин-5-ил)]-карбоксамид
Целевое соединение получают в виде желтовато- белого твердого вещества (264 мг).
Rf в ТСХ составляет 0,39 (10% метанол в этилацетате).
Т.пл. 249-251oC.
Пример 18
8-Метоксихинолин-5-[N-(4-хлорпиридин-4-ил)] карбоксамид
Целевое соединение получают и виде желтовато-белого твердого вещества (40 мг).
Rf в ТСХ составляет 0,35 (10% метанол в дихлорметане).
Т.пл. 232-234oC.
Пример 19
8-Метоксихинолин-5-[N-(2-трифторметилфенил)]карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (470 мг).
Rf в ТСХ составляет 0,50 (15% метанол в этилацетате).
Т.пл. 247-248oC.
Пример 20
8-Метоксихинолин-5-[N-(3-бром-5-метилпиридин-2-ил)]-карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (250 мг).
Rf в ТСХ составляет 0,15 (3% метанол в дихлорметане).
Пример 21
8-Метоксихинолин-5-[N-(2-хлорпиридин-3-ил)] карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (60 мг).
Rf в ТСХ составляет 0,15 (3% метанол в этилацетате).
Продукты в приведенных ниже примерах получают из гидрохлорида 8-метокси-2-метилхинолин-5-карбонилхлорида и соответствующего амина с использованием методики, аналогичной описанной выше.
Пример 22
8-Метокси-2-метилхинолин-5-[N-(3-хлорпиридин-4- ил)]-карбоксамид
Очистка с помощью флэш-хроматографии на кремнеземе при элюировании 10% метанолом в этилацетате дает целевое соединение (190 мг) в виде бледно-желтого твердого вещества.
Rf в ТСХ составляет 0,35 (10% метанол в этилацетате).
Т.пл. 222-223,5oC.
Пример 23
8-Метокси-2-метилхинолин-5-[N-(5-хлорпиримидин-4-ил)] -карбоксамид
Очистка с помощью флэш-хроматографии на кремнеземе при элюировании 10% метанолом в этилацетате и растирании с диэтиловым эфиром дает целевое соединение (110 мг) в виде бледно-желтого твердого вещества.
Rf в ТСХ составляет 0,38 (10% метанол в этилацетате).
Т.пл. 192-193,5oC.
Пример 24
8-Метокси-2-метилхинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (20 мг).
Rf в ТСХ составляет 0,58 (5% метанол в этилацетате).
Т.пл. 273-275oC (разлож.).
Продукты в приведенных ниже примерах получают из соответствующего гидрохлорида хинолинкарбонилхлорида и 4-амино- 3,5-дихлорпиридина с использованием методики, аналогичной описанной в примере 13.
Пример 25
8-Этил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин- 4-ил)]-карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (50 мг).
Rf в ТСХ составляет 0,34 (5% метанол в дихлорметане).
Масс-спектр (EI) 376 [М+H]+
Пример 26
7-Фтор-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]- карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (210 мг).
Rf в ТСХ составляет 0,48 (этилацетат).
Масс-спектр (EI) 366 [М+H]+
Пример 27
2-Циано-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид
Целевое соединение получают в виде желтовато-белого твердого вещества (72 мг).
Rf в ТСХ составляет 0,48 (этилацетат).
Масс-спектр (EI) 373 [М+H]+
Пример 28
2-Этил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] -карбоксамид
Очистка, достигаемая хроматографией на колонке при элюировании этилацетатом, дает целевое соединение в виде твердого вещества абрикосового цвета (0,14 г).
Rf в ТСХ составляет 0,35 (этилацетат).
Т.пл. 256,5-257,5oC.
Пример 29
8-Дифторметоксихинолин-5-[N-(3,5-дихлорпиридин- 4-ил]-карбоксамид
Целевое соединение получают в виде белого твердого вещества (530 мг).
Rf в ТСХ составляет 0,25 (50% этилацетат в гексане).
Т.пл. 200-202oC.
Пример 30
8-Метокси-2-(3-пиридил)хинолин-5-[N-(3,5- дихлорпиридин-4-ил)]карбоксамид
Очистка с помощью флэш-хроматографии на кремнеземе при элюировании 10% метанолом в этилацетате дает целевое соединение (175 мг) в виде белого порошка.
Rf в ТСХ составляет 0,4 (10% метанол в этилацетате).
Т.пл. 258-259oC
Пример 31
8-Метокси-2-(трифторметил)хинолин-5-[N-(3,5- дихлорпиридин-4-ил)]карбоксамид
Целевое соединение (0,94 г) получают в виде белого твердого вещества.
Т.пл. 254-255oC.
Rf в ТСХ составляет 0,24 (50% этилацетат в гексане).
Пример 32
8-Гидроксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] -карбоксамид
Гидрид натрия (1,6 г, 60% дисперсия в масле) промывают диэтиловым эфиром в атмосфере азота и высушивают в вакууме. Добавляют безводный N,N-диметилформамид (20 мл), а затем осторожно добавляют раствор этантиола (3 мл) в ДМФ (3 мл). К смеси добавляют раствор 8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4- ил)]карбоксамида (100 мг) в ДМФ (5 мл), и реакционную смесь кипятят с обратным холодильником в течение 1,5 ч. Растворитель удаляют в вакууме, и остаток распределяют между насыщенным водным раствором хлорида аммония (50 мл) и дихлорметаном (50 мл). Водную фазу повторно экстрагируют дихлорметаном (75 мл), и органические экстракты объединяют. Органическую фазу высушивают над сульфатом магния, фильтруют и фильтрат выпаривают в вакууме. Остаток распределяют между дихлорметаном (20 мл) и 0,5 М водным раствором гидроксида натрия. Водную фазу отделяют и подкисляют до pH 4/5 с помощью ледяной уксусной кислоты. Осадок собирают фильтрованием и высушивают в вакууме с получением целевого соединения в виде желтовато-белого твердого вещества (20 мг).
Масс-спектр (EI) 334 [М]+.
Пример 33
Дигидрохлорид 8-метоксихинолин-5-[N-(3,5- дихлорпиридин-4-ил)] карбоксамида
Раствор 8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамида (114 мг) в метаноле (50 мл) обрабатывают газообразным хлористым водородом в течение 5 мин при 25oC. Раствор выпаривают в вакууме с получением целевого соединения в виде желтовато-белого твердого вещества (133 мг).
Элементный анализ:
Рассчитано, %: C 45,64; H 3,11; N 9,98
Найдено, %: C 44,51; H 3,09; N 9,67.
Пример 34
Дигидробромид 8-метоксихинолин-5-[N-(3,5- дихлорпиридин-4-ил)] карбоксамида
Охлажденный метанол (50 мл) тщательно обрабатывают ацетилбромидом (0,25 мл), и смесь перемешивают при температуре ниже 5oC и течение 30 мин. Раствору дают нагреться до комнатной температуры и добавляют 8-метоксихинолин-5-[N-(3,5-дихлорпиридин- 4-ил)]карбоксамид (105 мг). Через 30 мин раствор выпаривают в вакууме с получением целевого соединения в виде желтовато-белого твердого вещества (148 мг).
Пример 35
Дигидрохлоридная соль 5-(8-метокси-5-[N-(3,5- дихлорпиридин-4-ил)]-аминокарбонилхинолин-2-ил]-2H- тетразола
К перемешиваемой суспензии 5-[8-метокси-5-[N-(3,5- дихлорпиридин-4-ил)] -аминокарбонилхинолин-2-ил]-2-триметилстаннил- 2H-тетразола (150 мг) в тетрагидрофуране (10 мл) при комнатной температуре в атмосфере инертного газа добавляют хлористый водород (0,6 мл, 1М в диэтиловом эфире), и при этом происходит мгновенное растворение. Реакционную смесь перемешивают при комнатной температуре в течение 90 мин, и полученный осадок отфильтровывают, промывают диэтиловым эфиром и высушивают в вакууме при 40oC с получением целевого соединения в виде белого твердого вещества (92 мг).
Т.пл. 242-244oC.
Масс-спектр (EI) 416 [М+H]+ свободное основание.
Пример 36
5-[8-Mетокси-5-[N-(3,5-дихлорпиридин-4-ил)] - аминокарбонилхинолин-2-ил] -2-метилтетразол и 5-[8-метокси-5-[N- (3,5-дихлорпиридин-4-ил)]-аминокарбонилхинолин-2-ил]-1- метилтетразол
5-[8-метокси-5-[N-(3,5-дихлорпиридин-4-ил)] - аминокарбонилхинолин-2-ил] -2-триметилстаннил-2H-тетразол (153 мг) и йодметан (1,0 мл) растворяют в метаноле (2,5 мл) и перемешивают в атмосфере инертного газа при комнатной температуре в течение 5 дней. Растворитель удаляют в вакууме, и полученный твердый продукт суспендируют в диэтиловом эфире, фильтруют и промывают диэтиловым эфиром (3 х 10 мл). Очистка хроматографией на колонке при элюировании 5% метанолом в дихлорметане дает смесь в соотношении 7:1 целевых соединений соответственно в виде белого твердого вещества (55 мг).
Rf в ТСХ составляет 0,71 (10% метанол в дихлорметане).
Т.пл. 273-275oC.
Пример 37
2-Aцетил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид
К перемешиваемому раствору 2-циано-8-метоксихинолин-5- [N-(3,5-дихлорпиридин-4-ил)]карбоксамида (300 мг) в тетрагидрофуране (20 мл) при комнатной температуре в атмосфере инертного газа добавляют метилбромид магния (0,6 мл, 3,0 М в диэтиловом эфире). Далее реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем выливают в солевой раствор (25 мл) и экстрагируют этилацетатом (4 х 25 мл). Объединенные органические фазы высушивают над сульфатом магния и концентрируют в вакууме. Очистка хроматографией на колонке при элюировании 5% метанолом в дихлорметане приводит к получению целевого соединения в виде бледно-желтого твердого вещества (160 мг).
Rf в ТСХ составляет 0,42 (этилацетат).
Т.пл. 257-259oC.
Пример 38
2-(1-Mетоксииминоэтил)-8-метоксихинолин- 5-[N-(3,5-дихлорпиридин-4-ил)карбоксамид
2-Aцетил-8-метоксихинoлин-5-[N-(3,5-дихлopпиpидин-4- ил)] карбоксамид (100 мг), гидрохлорид метоксиламина (75 мг) и пиридин (0,12 мл) в толуоле (50 мл) кипятят с обратным холодильником с ловушкой Дина-Старка (Dean-Stark) в течение 3 дней. Охлажденную реакционную смесь выпаривают досуха в вакууме и пропускают через колонку с кремнеземом, элюируя 66% этилацетатом в гексане, с получением целевого соединения в виде белого твердого вещества (20 мг).
Rf в ТСХ составляет 0,29 (66% этилацетат в гексане).
Т.пл. 273-275oC.
Пример 39
2-(1-Гидроксиэтил)-8-метоксихинолин-5-[N-(3,5-дихлорпиридин- 4-ил)]карбоксамид
К перемешиваемому раствору 2-ацетил-8-метоксихинолин-5-[N- (3,5-дихлорпиридин-4-ил)] карбоксамида (180 мг) в метаноле (10 мл) при температуре окружающей среды добавляют боргидрид натрия (50 мг). Реакционную смесь перемешивают в течение 90 мин, останавливают реакцию добавлением воды (по каплям) и удаляют в вакууме метанол. Остаток распределяют между этилацетатом (4 х 20 мл) и водой (10 мл). Объединенные органические фазы высушивают над сульфатом магния и концентрируют в вакууме. Очистка хроматографией на колонке при элюировании 4% метанолом в дихлорметане дает целевое соединение в виде оранжевого твердого вещества (68 мг).
Rf в ТСХ составляет 0,28 (10% метанол в дихлорметане).
Т.пл. 252-254oC.
Пример 40
2-[(т-Бутилоксикарбонил)-(метил)амино] -8- метоксихинолин-5-[N-(3,5-дихлорпирид-4-ил)]карбоксамид
4- амино-3,5-дихлорпиридин (138 мг) и диметилформамид (10 мл) объединяют в атмосфере азота при комнатной температуре. Добавляют гидрид натрия (60% дисперсия в масле) (51 мг), и перемешивание продолжают в течение 3 ч. Затем добавляют 4-нитрофенил 2-[(т-бутилоксикарбонил)(метил)амино] -8-метоксихинолин-5-карбоксилат (384 мг) в виде раствора в диметилформамиде (10 мл) и продолжают перемешивание в течение 16 ч. Реакционную смесь выпаривают в вакууме над кремнеземом и очищают флэш-хроматографией с получением целевого соединения (217 мг) в виде белого твердого вещества.
Rf в ТСХ составляет 0,20 (50% этилацетат в гексане).
Т.пл. 184-186oC.
В следующем примере продукт получают аналогичным способом с использованием соответствующих исходных материалов.
Пример 41
8-Дифторметоксихинальдин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид
Очистка колоночной хроматографией при элюировании 5% метанолом в дихлорметане и растирание с этилацетатом дают целевое соединение в виде белого твердого вещества (0,3 г).
Rf в ТСХ составляет 0,24 (5% метанол в дихлорметане).
Т.пл. 210-212oC.
Пример 42
2-(N-метил)амино-8-метоксихинолин-5-[N-(3,5- дихлорпирид-4-ил)]карбоксамид
Объединяют и перемешивают при комнатной температуре в течение 5 ч 2-[(т-бутилоксикарбонил)(метил)амино] -8-метоксихинолин-5-[N- (3,5-дихлорпирид-4-ил)]карбоксамид (195 мг), дихлорметан (10 мл) и трифторуксусную кислоту (6 мл). Растворители удаляют в вакууме, и остаток распределяют между дихлорметаном и насыщенным водным раствором бикарбоната натрия. Проводят экстракцию дихлорметаном (3 х 20 мл), который затем выпаривают в вакууме над кремнеземом и очищают флэш-хроматографией с получением целевого соединения (108 мг) в виде белого твердого вещества.
Rf в ТСХ составляет 0,30 (2% гидроксид аммония в этилацетате).
Т.пл. 271-272oC.
Пример 43
2-[(Пиридин-2-ил)карбонил] -8-метоксихинолин-5-[N-(3,5- дихлорпиридин-4-ил)карбоксамид
К перемешиваемому раствору 2-бромпиридина (0,11 мл) в тетрагидрофуране (2 мл) при -78oC в атмосфере инертного газа добавляют по каплям н-бутиллитий (0,87 мл, 1,6 М в гексанах). После перемешивания при указанной температуре в течение 45 мин добавляют по каплям 2-циано-8-метоксихинолин-5-[N-(3,5- дихлорпиридин-4-ил] карбоксамид (0,2 г) в тетрагидрофуране (10 мл), и реакционной смеси дают нагреться до комнатной температуры. После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрируют в вакууме. Остаток распределяют между водой (45 мл) и дихлорметаном (3 х 45 мл). Объединенные органические фазы высушивают над сульфатом магния и концентрируют в вакууме. Очистка хроматографией на колонке при проведении элюции 0,5% триэтиламином и 4,5% метанолом в дихлорметане приводит к получению целевого соединения в виде бледно-оранжевого твердого вещества (0,54 мг).
Rf в ТСХ составляет 0,23 (0,51) триэтиламин/4,5% метанол в дихлорметане).
Т.пл. 185-187oC.
Методы исследований
Методы исследований, используемые для подтверждения ингибирующей активности у соединений формулы (i) в отношении фосфодиэстеразы IV, описаны в литературе (Schilling et al. , Anal. Biochem. 216:154 (1994), Thompson and Strada, Adv. Cycl. Nucl. Res. 8:119 (1979) and Gristwood and Owen, Br. J. Pharmacol. 87:91P (1986)) и представляют собой стандартные методики.
С помощью указанных методов установлено, что соединения формулы (i) проявляют активность на уровне, соответствующем тому, который, как считается, может использоваться при лечении болезненных состояний, связанных с фосфодиэстеразой IV.
Способность соединений формулы (i) ингибировать продуцирование ФНО в моноядерных клетках периферической крови человека (МКПК) измеряют следующим образом. МКПK получают из свежеотобранной крови или "лейкоцитных пленок" с использованием стандартных методик. Клетки помещают в RPMI1640 + 1% сыворотку плода коровы в присутствии и отсутствии ингибиторов. Добавляют ЛПС (100 нг/мл), и культуры ингибируют при 37oC в течение 22 ч в атмосфере, содержащей 95% воздуха/5% CO2. Надосадочные жидкости исследуют на наличие ФНО с помощью метода ИФТФА (ЭЛИЗА) с использованием коммерчески доступных наборов.
Активность in vivo на модели эозинфилии кожи определяют с использованием методов, описанных Хеллевеллом с соавт. (Hellewell et al., Br. J. Pharmacol. 111: 811 (1994) and Br. J. Pharmacol. 110:416 (1993)). Активность на модели легкого измеряют с использованием методик, также описанных в литературе с соавт. (Kallos and Kallos, Int. Archs Allergy Apl. Immunol. 73:77 (1984) and Sanjar et al., Br. J. Pharmacol. 99:679 (1990)).
Описана, кроме того, дополнительная модель легкого, которая позволяет измерить уровень ингибирования на ранней и поздней фазе астматической реакции, а также ингибирование гиперактивности дыхательных путей ((Broadley et al. , Pulmonary Pharmacol. 7: 311 (1994), J. Immunological Methods 190:51 (1996) and British J. Pharmacol. 116:2351 (1995)). Соединения по настоящему изобретению демонстрируют активность в анализе с использованием этой модели.
Сокращения:
ЛПС - липополисахарид (эндотоксин);
ИФТФА (ЭЛИЗА) - иммуноферментный твердофазный анализ.
Дополнительные экспериментальные данные.
Пример 44
8-Mетокси-2-[1-(4-пиридилметокси)иминоэтил]хинолин-5- карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)]амид
Rf в ТСХ составляет 0,27 (дихлорметан:MeOH:триэтаноламин - 189:10:1);
Т.пл. 247oC.
Пример 45
2-{ 1-[4-(Mетоксикарбонил)бензилокси] иминоэтил} -8- метоксихинолин-5-карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)амид
Rf в ТСХ составляет 0,62 ((5% MeOH в дихлорметане + триэтаноламин (капли));
Масс-спектр [(М+H)C9H9O3] 389.
Пример 46
2-{ 1-[4-(Kарбокси)бензилокси] иминоэтил}-8-метоксихинолин- 5-карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)амид
Rf в ТСХ составляет 0,28 (5% MeOH в дихлорметане);
Т.пл. 287oC.
Пример 47
8-Mетокси-2-(1-гидроксииминоэтил] хинолин-5-карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)]амид
Rf в ТСХ составляет 0,35 (дихлорметан:MeOH:AcOH - 94:5:1);
Масс-спектр [М+H] 405.
Пример 48
8-(1,1-Дифторметокси)-2-трифторметилхинолин- 5-карбоновой кислоты (3,5-диметилизоксазол-4-ил)амид
Rf в ТСХ составляет 0,28 (50% EtOAc в гексане);
Т.пл. 252-253oC.
Пример 49
8-Метокси-2-трифторметилхинолин-5-карбоновой кислоты (3,5-диметилизоксаэол-4-ил)амид
Rf в ТСХ составляет 0,47 (EtOAc);
Масс-спектр [М+H] 366.
Пример 50
8-(1,1-Дифторметокси)-2-трифторметилхинолин- 5-карбоновой кислоты (4-хлор-2-метил-2H-пиразол-3-ил)амид
Rf в ТСХ составляет 0,73 (EtOAc);
Т.пл. 197-199oC.
Пример 51
8-Метокси-2-трифторметилхинолин-5-карбоновой кислоты (4-хлор-2-метилпиразол-3-ил)амид
Rf в ТСХ составляет 0,67 (5% MeOH в дихлорметане);
Т.пл. 265-266oC.
Пример 52
2-[(1-Пропиламино)этил] -5-бром-8-метоксихинолин-5- карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)]амид
Rf в ТСХ составляет 0,21 (EtOAc);
Т.пл. 118-120oC.
Пример 53
2-[1-(трет-Бутоксикарбонил)(пропил)амино] этил-5-бром-8-метоксихинолин-5-карбоновой кислоты [N-(3,5- дихлорпирид-4-ил)]амид
Rf в ТСХ составляет 0,43 (1:1 EtOAc:гексан);
Т.пл. 97-98oC.
Пример 54
[5-(3,5-Дихлорпиридин-4-илкарбамоил)-8- метоксихинолин-2-илметил] пропил-карбаминовой кислоты трет-бутиловый эфир
Rf в ТСХ составляет 0,59 (EtOAc);
Т.пл. 115-116oC.
Пример 55
8-Метокси-2-пропиламинометилхинолин-5-карбоновой кислоты (3,5-дихлорпиридин-4-ил)]амид
Rf в ТСХ составляет 0,20 (90% EtOAc/9% MeOH в триэтиламине);
Т.пл. 145oC.
Пример 56
2-[(Ацетилпропиламино)метил] -8-метоксихинолин-5- карбоновой кислоты (3,5-дихлорпиридин-4-ил)амид
Rf в ТСХ составляет 0,35 (10% MeOH в EtOAc);
Масс-спектр [М+H] 461.
Пример 57
3-[5-(3,5-Дихлорпиридин-4-илкарбамоил)-8- метоксихинолин-2-ил]-пропионовой кислоты метиловый эфир
Rf в ТСХ составляет 0,43 (EtOAc);
Т.пл. 230-231oC.
Пример 58
8-Метокси-2-метоксиметилхинолин-5-карбоновой кислоты [N-(3,5-дихлорпирид-4-ил)]амид
Rf в ТСХ составляет 0,3 (10% MeOH в дихлорметане);
Т.пл. 250oC.
Пример 59
2-Циклобутоксиметил-8-метоксихинолин-5- карбоновой кислоты (3,5-дихлорпиридин-4-ил)]амид
Rf в ТСХ составляет 0,29 (EtOAc);
Т.пл. 226-269oC с разл.
Пример 60
3-[5-(3,5-Дихлорпиридин-4-илкарбамоил)-8-метоксихинолин- 2-ил]пропионовая кислота
Rf в ТСХ составляет 0,42 (10% MeOH в EtOAc);
Т.пл. 240oC с разл.
Пример 61
8-Метокси-2-[(пиридин-4-карбонил)амино] -хинолин-5-карбоновой кислоты (3,5-дихлорпиридин-4-ил)амид
Rf в ТСХ составляет 0,3 (10% MeOH в дихлорметане);
Масс-спектр [М+H] 468.
Пример 62
8-Дифторметокси-2-трифторметилхинолин-5- карбоновой кислоты (4-циано-2,6-дифторфенил)амид
Rf в ТСХ составляет 0,43 (гексан: EtOAc - 2:1);
Т.пл. 233-234oC.
Пример 63
4-[(8-Дифторметокси-2-трифторметилхинолин-5- карбонил)-амино] -3,5-дифторбензойной кислоты метиловый эфир
Rf в ТСХ составляет 0,48 (гексан:EtOAc - 2:1);
Т.пл. 210-212oC.
Пример 64
8-Дифторметокси-2-трифторметилхинолин-5- карбоновой кислоты (3-цианопиридин-4-ил)амид
Rf в ТСХ составляет 0,69 (гексан:EtOAc - 2:1);
Т.пл. 233-234oC.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИЦИКЛИЧЕСКИЕ КАРБОКСАМИДЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2176642C2 |
| N-ОКСИДЫ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TNF И PDE-IV | 1999 |
|
RU2205830C2 |
| КАРБОКСАМИДЫ БЕНЗОФУРАНА И ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2162467C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСАМОВОЙ И КАРБОНОВОЙ КИСЛОТЫ, ИМЕЮЩИЕ MMP ИНГИБИРУЮЩУЮ АКТИВНОСТЬ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1998 |
|
RU2210567C2 |
| ПРОИЗВОДНЫЕ БЕНЗАНИЛИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АНТАГОНИЗМ К 5-HT РЕЦЕПТОРАМ | 1992 |
|
RU2077535C1 |
| Способ получения производных дихлоранилина или их физиологически приемлемых солей, или сольватов | 1987 |
|
SU1590042A3 |
| ПРОИЗВОДНЫЕ 3-(5-ТЕТРАЗОЛИЛБЕНЗИЛ)АМИНОПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2136675C1 |
| ЗАМЕЩЕННЫЕ БЕНЗОТИЕНИЛПИПЕРАЗИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2157371C2 |
| АЗАИНДОЛЫ | 2002 |
|
RU2326880C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124503C1 |
Изобретение относится к новым хинолинам формулы I, где X обозначает CO; R обозначает H, галоген; R1 обозначает OH, низший алкокси, необязательно замещенный атомами галогена; R2, R3, R4 обозначают H, R7, OR11, COR7, C(= NOR7)R7, CF3, низший алкил -C(=NOH)R7, CN, NR9R10 или CONR12R13, где NR12R13 представляет собой шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома N, необязательно замещенный одним или более R15; R5 обозначает H; R6 обозначает фенил, шестичленный гетероцикл, содержащий один или два гетероатома, одинаковые или различные, выбранные из азота и кислорода, замещенный R14; R7 обозначает R11, необязательно замещенный R16; R8 обозначает алкил; R9 обозначает H, алкилкарбонил, низший алкоксикарбонил, гетероарилкарбонил; R10 обозначает H, низший алкил; R11 обозначает низший алкил, C3 - C7 циклоалкил, шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома азота, необязательно замещенный R15, фенилалкил; R12 и R13 обозначают H или NR12R13, где NR12R13 обозначает шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома N, необязательно замещенный R15; R14 представляет собой CO2R8, галоген, -CN, низший алкил, необязательно замещенный галогеном, низший алкокси; R15 обозначает низший алкил; R16 обозначает OR11, NR9R10, CO2H, CO2R11, или его фармацевтически приемлемая соль. Изобретение относится к фармацевтической композиции, содержащей соединение формулы I и обладающей ингибирующей активностью в отношении ФДЭ IV и ФНО. 2 с. и 24 з.п. ф-лы.

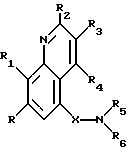
где Х обозначает СО;
R обозначает H, галоген;
R1 обозначает ОН, низший алкокси, необязательно замещенный одним или более атомами галогена;
R2, R3 и R4 могут быть одинаковыми или различными и каждый обозначает H, R7, OR11, COR7, C(= NOR7)R7, CF3, низший алкил-С(=NOН)R7, CN, NR9R10 или CONR12R13, где NR12R13 представляет собой шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома N, необязательно замещенный одним или более R15;
R5 обозначает Н;
R6 обозначает фенил, шестичленный гетероцикл, содержащий один или два гетероатома, одинаковые или различные, выбранные из азота и кислорода, шестичленный гетероцикл необязательно замещенный одним или более заместителями R14;
R7 обозначает R11, необязательно замещенный по любому положению одним или более R16;
R8 обозначает алкил;
R9 обозначает H, алкилкарбонил, низший алкоксикарбонил, гетероарилкарбонил;
R10 обозначает H, низший алкил;
R11 обозначает низший алкил, C3-C7циклоалкил, шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома азота, необязательно замещенный одним или более R15, фенилалкил;
R12 и R13 могут быть одинаковыми или различными и обозначают, каждый, H, или NR12R13, где NR12R13 обозначает шестичленный гетероцикл, содержащий в качестве гетероатома один или два атома N, необязательно замещенный одним или более R15;
R14 представляет собой СО2R8, гaлoгeн, -CN, низший алкил, необязательно замещенный одним или несколько галогенами, низший алкокси;
R15 обозначает низший алкил;
R16 обозначает OR11, NR9R10, СО2Н, CO2R11,
или его фармацевтически приемлемая соль.
R11 не является циклоалкилом.
8-метоксихинолин-5-[N-(тиазол-2-ил)]карбоксамид,
8-метоксихинолин-5-[N-(2-трифторметоксифенил)] карбоксамид,
8-метоксихинолин-5-[N-2-(пиперидин-1-ил)фенил]карбоксамид,
8-метоксихинолин-5-[N-(2-фторфенил)] карбоксамид,
8-метоксихинолин-5-[N-(2-метилфенил)] карбоксамид,
8-метоксихинолин-5-[N-(2,6-диметилфенил)] карбоксамид,
8-метоксихинолин-5-[N-(2-хлорфенил)] карбоксамид,
8-метоксихинолин-5-[N-(2-метоксифенил)] карбоксамил,
8-метоксихинолин-5-[N-(4-метоксифенил)] карбоксамид,
8-метоксихинолин-5-[N-(2-хлор-6-метилфенил)]карбоксамид,
8-метокси-2-метилхинолин-5-[N-(2-хлорфенил)]карбоксамид,
8-метоксихинолин-5-[N-(2,5-дихлорпиридин-3-ил)]карбоксамид,
8-метоксихинолин-5-[N-(пиримидин-4-ил)]карбоксамид,
6-метоксихинолин-5-[N-(3,5-дихлорпиридин-2-ил)]карбоксамид,
8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]карбоксамид,
8-метоксихинолин-5-[N-(4,6-дихлорпиримидин-5-ил)]карбоксамид,
8-метоксихинолин-5-[N-(4-хлорпиридин-4-ил)]карбоксамид,
8-метоксихинолин-5-[N-(2-трифторметилфенил)]карбоксамид,
8-метоксихинолин-5-[N-(3-бром-5-метилпиридин-2-ил)]-карбоксамид,
8-метоксихинолин-5-[N-(2-хлорпиридин-3-ил)]карбоксамид,
8-метокси-2-метилхинолин-5-[N-(3-хлорпиридин-4-ил)]-карбоксамид,
8-метокси-2-метилхинолин-5-[N-(5-хлорпиримидин-4-ил)]-карбоксамид,
8-метокси-2-метилхинолин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
3-этил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
7-фтор-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
2-циано-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
2-этил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)карбоксамид,
8-дифторметоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]кабоксамид,
8-метокси-2-(3-пиридил)хинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид,
8-метокси-2-(трифторметил)хинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид,
8-гидроксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]карбоксамид,
дигидрохлорид 8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]карбоксамида,
дигидробромид 8-метоксихинолин-5-[N(3,5-дихлорпиридин-4-ил)] карбоксамида,
дигидрохлоридная соль 5-[8-метокси-5-[N-(3,5-дихлорпиридин-4-ил)]аминокарбонилхинолин-2-ил]-2Н-тетразола,
5-[8-метокси-5-[N-(3,5-дихлорпиридин-4-ил)] -аминокарбонилхинолин-2-ил] -2-метилтетразол,
5-[8-метокси-5-[N-(3,5-дихлорпиридин-4-ил)] -аминокарбонилхинолин-2-ил] -1-метилтетразол,
2-ацетил-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
2-(1-метоксииминоэтил)-8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)] карбоксамид,
2-(1-гидроксиэтил)-8-метоксихинолин-5-[N(3,5-дихлорпиридин-4-ил)]карбоксамид,
2-[(т-бутилоксикарбонил)-(метил)амино] -8-метоксихинолин-5-[N-(3,5-дихлорпирид-4-ил)]карбоксамид,
8-дифторметоксихинальдин-5-[N-(3,5-дихлорпиридин-4-ил)]-карбоксамид,
2-(N-метил)амино-8-метоксихинолин-5-[N-(3,5-дихлорпирид-4-ил)] карбоксамид,
2-[(пиридин-2-ил)карбонил] -8-метоксихинолин-5-[N-(3,5-дихлорпиридин-4-ил)]карбоксамид.
Приоритет по пунктам:
22.04.97 по пп.1-3, 5, 6 и 9-26;
07.11.96 и 24.12.96 по пп.4 и 8;
20.05.96 по п.7.
| Способ получения триазолилхинолиновых производных или их солей присоединения кислот | 1987 |
|
SU1477247A3 |
| Способ получения тетрагидрохинолинпроизводных | 1980 |
|
SU965354A3 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2001-07-20—Публикация
1997-05-20—Подача