Данное изобретение относится к способу обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Существует непреходящий интерес к оценке долговременного эффекта воздействия ионизирующего излучения на здоровье. В исследованиях, проведенных в 1950-х, годах речь шла главным образом о дозах облучения "ниже летальных". Как вскоре выяснила наука, ниже чем летальные никоим образом не означает безвредные. Для определения неблагоприятного воздействия на здоровье малых доз радиации были использованы плоские пленочные дозиметры как подходящий способ дозиметрического контроля за уровнем радиационного воздействия на индивидуумов. Посредством плоского пленочного дозиметра, который носил индивидуум, определялось количество радиации, которое воздействовало на индивидуум за время, которое он носил плоский пленочный дозиметр. Это устройство имеет практическое применение в том случае, если есть действительная необходимость дозиметрического контроля за уровнем воздействия на индивидуум, например в случае, когда опасность воздействия нетривиальных доз радиации заранее известна.
Тем не менее, индивидуумы часто подвергаются нетривиальным дозам облучения, не будучи под дозиметрическим контролем. Для отсутствия дозиметрического контроля может быть множество причин. Во-первых, присутствие радиации не может быть обнаружено. Это отчасти верно в условиях, когда отсутствуют искусственные источники ионизирующего излучения, например в доме. Тем не менее, как показывает открытие богатой радоном окружающей среды, места, традиционно считавшиеся свободными от радиации, на самом деле таковыми могут не являться. Во-вторых, даже в том случае, если присутствие радиации обнаружено, ее опасность не может быть рассмотрена как достаточно большая для того, чтобы обосновать дозиметрический контроль. Незначительность воздействия определяется, принимая во внимание дозу и частоту воздействия и ощутимую опасность, связанную с таким воздействием. Несмотря на наше нынешнее понимание опасности воздействия выше фонового случайные воздействия радиации на уровне выше фонового, к примеру во время медицинских и стоматологических рентгеновских процедур, не подлежат дозиметрическому контролю. Регулярные воздействия выше фонового считаются уже значительными, и в том случае, если это происходит на рабочем месте, правила требуют, чтобы воздействия контролировались с помощью плоских пленочных дозиметров. Однако подобный контроль не всегда имеет место. Как следствие, уровень прошедшего радиационного воздействия для многих работников не подлежал дозиметрическому контролю.
По приведенным выше причинам точное определение суммарного прошедшего воздействия для большинства индивидуумов в настоящее время невозможно. Следовательно, существует необходимость в разработке способа определения предшествующего воздействия радиации на таких индивидуумов, которые ранее не находились под наблюдением.
Доказано, что радиация вызывает долговременные изменения кроветворных стволовых клеток (Akiyama et al., "Evaluation of four somatic mutation assays as biological dosimeter in humans" in Radiation Research: A Twentieth-Century Perspective, Dewey et al., eds. Vol.II Congress Proceeding, New York: Academic Press, pp.177-182 (1992)). Кроме того, как показали исследования, существует связь между канцерогенезом и уровнем соматических мутаций (McCann et al. "Detection of carcinogens as mutagens in Salmonella/ microsome test: Assay of 300 chemicals", Proc. Nat. Acad. Sci. USA, 73: 950-954 (1976); Clive et al. , "Validation and characterization of the L5178Y/TK. +/- mouse mutagen assay system", Mutation Research, 59: 61-108(1970)). В результате, исследования кумулятивных пожизненных дозиметрических методов сфокусировались на стволовых клетках и материалах, ими продуцируемых.
В процессе деления стволовых клеток получаются красные кровяные клетки, белые кровяные клетки и тромбоциты. Как показано с помощью химических препаратов, количество продуцированных клеток и скорость деления стволовых клеток зависит от потребностей индивидуума. Например, стволовые клетки больного анемией делятся с большей скоростью, а также увеличение продукции красных кровяных клеток влияет на белые кровяные клетки и тромбоциты.
Отдельные исследования посвящены влиянию предшествующего воздействия радиации на уровень предшественников красных кровяных клеток ("RBCp") костного мозга. RBCp - это клетки, продуцируемые стволовыми клетками, которые достаточно дифференцированы, чтобы их можно было различить среди других клеток, продуцируемых стволовыми клетками, но которые еще не покинули костный мозг и не вошли в кровяное русло.
Гонг с соавторами (Gong et al., "A method for determining residual injury in the hematopoietic system of X-irradiated rat", Radiation Research, 37 (3): 467-477 (1969) изучал уровень RPCp, продуцируемых в ответ на анемию, вызванную кровотечением у животных. Реакция на анемию со стороны RPCp костного мозга облученных особей была подавлена по сравнению с необлученными. Исследования также показали, что действие радиации на этот процесс является долговременным. Как функция времени от радиационного воздействия, подавленная реакция на анемию восстанавливается логарифмически при t1/2 у крыс за 30 недель, что составляет одну пятую продолжительности их жизни.
Этот способ, хотя и является по сути пригодным для определения предшествующего воздействия радиации, неудобен для оценки степени воздействия в больших популяциях и у людей. Во-первых, этот способ требует того, чтобы наблюдаемый в результате кровопотери дошел до состояния, индуцирующего реакцию на анемию. Во-вторых, этот способ требует довольно сложной и зачастую болезненной процедуры извлечения костного мозга из кости наблюдаемого. И последнее, поскольку стволовые клетки остаются локализованными в том месте, где они были облучены (Gong et al., "Iron kinetics effects of 88 millirads: partial-versus-total body X-irradiation", Cell Biophysics, 13: 15-27 (1988)), этот способ определяет воздействие радиации только на ту кость, из которой выделен костный мозг. Если предшествующее воздействие в пределах всего тела было неоднородным, этот способ не способен определить точно общую дозу радиации, полученную подопытным в целом.
Похожий способ оценки предшествующего воздействия радиации, описанный в работе Gong et al. "Effects of low-level (1.0 R) X-irradiation on the erythroid respons of the rat bone marrow", Radiation Research, 65: 83-97 (1976), основан на наблюдении того, что у субъектов, не страдающих анемией, количество RBCp увеличивается при увеличении радиационного воздействия. Способ не требует индукции ответа на анемию, а заключается в получении пробы костного мозга, определении количества RBCp в нем, и соотнесения этого количества с увеличенным количеством RBPc, наблюдаемым у облученных особей. Хотя данный способ и не страдает недостатком предыдущего, требующего индукции ответа на анемию, но он по-прежнему требует биопсии костного мозга и не способен обеспечить точной оценки суммарного радиационного воздействия, когда таковое было неодинаковым в разных частях тела.
Уровни RBCp в костном мозге (при кровотечении и без него) как функция от радиационного воздействия были исследованы количественно в работе Gong et al., "The effects of low dose (less than I Rad) X-rays on the erythropoietic marrow", Cell Biophysics, 5: 143-62 (1983) ("Gong (1983)"). Результаты показывают, что оба наблюдаемых эффекта радиации (повышение уровня RBCp вне условий анемии и подавленная реакция на анемию) могут быть точно описаны с помощью линейно-логарифмической кривой доза-ответ. Кроме того, обе методики показали заметный эффект радиации на RBCp, который уменьшается экспоненциально за время с момента воздействия, которое идентично периодам полураспада.
Как минимум, два общих недостатка присущи всем дозиметрическим методам с использованием RBCp: необходимость получения пробы костного мозга и неспособность по этой пробе определить воздействие радиации на все тело в целом. Эти недостатки отсутствуют в том случае, если в роли индикаторов используются не клетки костного мозга, а клетки крови.
Эритроциты и лимфоциты были средоточием многочисленных исследований, посвященных оценке уровня различных соматических мутаций. Результаты этих исследований были суммированы в работе Akiyama et al., "Evaluation of four somatic mutation assays as biological dosimeter in humans" in Radiation Research: A Twentieth- Century Perspective, Dewey et al., eds. Vol. II Congress Proceedings, pp. 177-182, New- York: Academic Press (1992). Способность оценить частоту различных соматических мутаций становится очень важной ввиду растущего интереса к спектру мутационных повреждений, которые могут происходить в соматических клетках млекопитающих и роли этих повреждений в канцерогенезе. В экспериментах с использованием клеточных систем in vitro были получены прямые молекулярные доказательства для большого числа мутационных механизмов, которые ведут к стойким фенотипическим изменениям в соматических клетках. Поскольку многие из этих мутационных механизмов вовлечены в развитие специфических типов опухоли у человека, измерение частоты различных классов мутационных событий в нормальных человеческих клетках in vivo может облегчить оценку риска для здоровья этих событий. К тому же, оценка степени соматических мутаций дает средства для определения предшествующего воздействия радиации.
Работы авторов Wijayalaxmi et al., "Measurement of spontaneous and X-irradiation-induced 6-thio-guanine-resistant human blood lymphocytes using a T-cell cloning technique", Mutation Research, 125: 87-94 (1984) and Sanderson et al., " Mutations in human lymphocytes: effects of X- and UV-irradiation", Mutation Research, 140: 223-227 (1984) посвящены анализу мутации гипоксантин хинин фосфорибозил трансферазы ("HPRT") лимфоцитов. Результаты наблюдений за 127 выжившими после взрыва атомной бомбы показали статистически значимое зависимое от дозы увеличение количества HPRT- недостаточных мутантов. Однако довольно слабая зависимость доза- ответ, 2.3 x 10-6/Грэй, и необходимость взятия в качестве пробы очень большого количества белых кровяных клеток делают методику непригодной для широкомасштабных наблюдений. Кроме того, вследствие селекции, направленной против мутантных лимфоцитов in vivo, эффективность HPRT анализа уменьшается со временем, он пригоден только в течение 1-2 лет после облучения.
Kyoizurni et al., "Spontaneous loss and alteration of antigen receptor expression in mature CD4+ T-cell", J.Exp.Med., 17: 1981-1999 (1990), разработал дозиметрию, основанную на использовании лимфоцитов с мутантными Т-клеточными антигенными рецепторами ("TCR"). Как известно, у большинства нормальных Т-лимфоцитов наблюдается экспрессия поверхностного CD3 комплекса, состоящего из CD3 и TCRαβ цепи гетеродимеров. Поскольку гены TCR являются функциональными гемизиготами, то в случае мутации в α или β TCR генах, CD3 комплекс не может экспрессироваться на клеточной поверхности и такие мутанты выделяются как CD3 - негативные клетки среди CD3-позитивных хэлпериндукторных Т-клеток. Зависимость, около 10-4/Грэй, приблизительно в 10 раз больше, чем для HPRT-мутантов Т-клеток. Другое преимущество анализа состоит в коммерческой доступности моноклональных антител, это означает, что вся процедура может быть выполнена за несколько часов. Однако TCR мутанты имеют период полураспада, равный 2 годам, следовательно, анализ не может использоваться в качестве пожизненного дозиметра. TCR анализ ограничен также неточностями, вносимыми за счет спонтанных TCR мутаций, количество которых увеличивается с возрастом даже без радиационного воздействия.
Недавно Турнер с соавторами (Turner et al., "Mutation in human lymphocytes commonly involve gene duplication and resemble those seen in cancer cells", Proc. Natl. Acad. Sci. USA, 85: 3189-3192 (1988)) разработал анализ мутации в локусе HLA-A у лимфоцитов. В анализе используются моноклональные антитела, специфичные к HLA-A2 или HLA-A3, а также их комплементы для того, чтобы уничтожить нормальные клетки, экспрессирующие HLA-A2 или HLA-A3 антигены на своей поверхности. Мутантные клетки, не имеющие антигена, выживают. Зависимость доза-ответ составляет 3.1х 10-5/Грэй. Период полураспада у этих мутантов, однако, примерно такой же, как у TCR мутантов. Следовательно, анализ HLA-A мутаций также непригоден в качестве пожизненного дозиметра.
Все эти способы, использующие белые кровяные клетки, требуют взятия больших проб крови, поскольку только 0,01% всех кровяных клеток являются белыми клетками крови. Этот недостаток, а также недолговечность действия пробы были частично преодолены в работе Ланглоис с соавторами (Langlois et al., "Measurements of the frequency of human erythrocytes with gene expression loss phenotypes at a glycophorin A locus", Hum. Genet. 74: 353-362 (1986)). Ланглоис определил предшествующее воздействие через потерю экспрессии гена, кодирующего гликофорин A в соматических клетках человека. Гликофорин A ("GPA"), поверхностный сиалогликопротеин эритроцитов, существует в двух аллельных формах, М и N и является продуктом кодоминантно экспрессируемых аллелей на 4 хромосоме. В методе потери экспрессии GPA, каждая пара моноклональных антител, специфичных к отдельным аллельным формам конъюгирует с различными флуоресцентными красителями и используется для мечения связанных эритроцитов от гетерозиготных MN доноров. Поточная цитометрия и сортинг используются для подсчета и выделения редких одноцветных клеток, лишенных экспрессии одной или двух GPA аллелей. Предположительно, эти клетки не имеют экспрессии потому, что они являются потомками мутантных эритроидных клеток предшественников. Анализ GPA выявил процесс постоянного мутирования стволовых клеток в течение примерно 50 лет после момента облучения, что позволяет считать этот анализ в настоящее время единственной системой мутационного анализа, потенциально пригодной для использования в качестве пожизненного дозиметра.
Однако этот анализ имеет ограничения. Один недостаток состоит в неопределенности верхнего предела дозы. Поскольку анализ измеряет присутствие GPA белка и поскольку GPA уменьшается с увеличением дозы облучения, статистическая ошибка также увеличивается с увеличением дозы. При высоких дозах, когда потеря генной экспрессии почти полная и когда ничтожно малое количество клеток экспрессирует GPA, статистические аномалии становятся очень существенными. Другой недостаток заключается в том, что анализ GPA пригоден только для индивидуумов гетерозиготных по MN типу крови, а они составляют лишь 50% человеческой популяции. И еще, анализ GPA требует подсчета 5 миллионов клеток для того, чтобы распознать от 20 до 900 различных GPA клеток в диапазоне радиационного воздействия от 0 до 300 сГр. Вследствие ограничений в технологии клеточной цитометрии, на каждый образец уходит примерно полчаса. Это время подсчета, хотя и небольшое в сравнении со временем подсчета в анализах лимфоцитов, описанных выше, делает анализ GPA непригодным для скрининга больших популяций.
Таким образом, остается необходимость в пожизненном биологическом процессе дозиметрии, основанном на доступной в любой момент жидкости организма, которая была бы одинаково чувствительна к дозам в диапазоне от 0 до 600 сГр и была бы пригодна для скрининга в больших популяциях.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один аспект данного изобретения относится к способу обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих. Этот процесс включает в себя взятие пробы красных кровяных клеток от млекопитающих. Красные кровяные клетки имеют множество трансфериновых рецепторов. Количество трансфериновых рецепторов на красных кровяных клетках обнаруживается и затем соотносится с предшествующим воздействием на млекопитающих радиации или радиомиметических веществ.
Другой аспект данного изобретения относится к способу обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих.Этот процесс включает получение пробы красных кровяных клеток от млекопитающих. Красные кровяные клетки содержат белок, количество которого возрастает с увеличением воздействия на млекопитающих радиации или радиомиметических веществ. Количество этого белка на красных кровяных клетках обнаруживается и затем соотносится с предшествующим воздействием радиации или радиомиметических веществ на млекопитающих.
Данное изобретение также имеет отношение к способу обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих. Этот процесс включает в себя получение пробы красных кровяных клеток от млекопитающих. Красные кровяные клетки содержат большое количество белка, кодируемого нуклеотидной последовательностью внутри локуса ДНК, который содержит ген, кодирующий трансфериновый рецептор. Количество этого белка на красных кровяных клетках пробы обнаруживается и соотносится с предшествующим воздействием радиации или радиомиметических веществ на млекопитающих.
Данное изобретение также указывает способ обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих. Способ включает в себя получение пробы нуклеиновых кислот из клеток, продуцируемых гемопоэтическими стволовыми клетками.
Нуклеиновые кислоты имеют множество мутаций, которые вызывают экспрессию трансфериновых рецепторов у зрелых эритроцитов. Это количество обнаруживается и затем соотносится с предшествующим воздействием радиации или радиомиметических веществ на млекопитающих.
Способы данного изобретения могут быть использованы для обнаружения суммарного количества радиации или радиомиметических веществ, которые воздействовали на млекопитающих в прошлом. Способность точно оценить совокупное пожизненное воздействие радиации на организм является решающим моментом в изучении последствий радиации, особенно это касается риска возникновения раковых заболеваний и других отдаленных последствий. До настоящего момента лишь популяции, находившиеся под воздействием высоких или средних доз радиации, могли быть обследованными, поскольку индивидуумы только из этих популяций находились под дозиметрическим контролем радиационного воздействия. В подобных обследованиях действие низких доз радиации было предсказано посредством экстраполяции эффекта высокой или средней дозы. С появлением данного изобретения исследователи получают возможность точно оценить совокупное пожизненное воздействие и, следовательно, могут непосредственно изучать действие низких доз радиации.
Возможность оценить совокупное воздействие также удобна в случае, когда надо измерить уровень продолжающегося воздействия радиации или радиомиметических веществ. Таким образом, этот способ может быть использован как дозиметрический контроль промышленного, медицинского, военного и даже фонового радиационного воздействия, а также для определения необходимости принятия дополнительных мер предосторожности для уменьшения воздействия.
Определенные особенности способа, предлагаемого в данном изобретении, делают его удобным и отчасти пригодным для изучения совокупного пожизненного воздействия в больших популяциях. Во-первых, способы настоящего изобретения приложимы ко всем индивидуумам и не зависят от принадлежности индивидуума к определенной генетической группе. Во-вторых, тест является подходящим для людей. Он требует всего лишь около 5 мкл крови и не требует предварительных ограничений в диете со стороны тестируемого. Малое количество требуемой крови позволяет проводить тестирование сколь угодно часто. Преимуществом теста является также то, что он не требует специального обращения с пробой, использует стабильные реактивы, имеющие длительный срок хранения, и может проводиться с использованием как свежей крови, так и крови после хранения.
Более того, чувствительность теста, распространяющаяся от 0,1 сГр до 600 сГр и выше, покрывает разброс дозы облучения от фоновой до летальной. Это служит подтверждением тому, что данный способ применим в качестве универсального диагностического теста для всех ядерных событий, от загрязнения окружающей среды до ядерной катастрофы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигурах 1A и 1B приведена аминокислотная последовательность трансферинового рецептора крысы (Rattus norvegicus, GenInfo ID. N 112425) и человека (Homo sapiens, GenInfo ID. N 136378).
На фигуре 2 показан полулогарифмический график увеличения числа клеток, имеющих количество трансфериновых рецепторов, большее чем обычно (т.е. увеличение числа "маркированных клеток") в зависимости от дозы радиации, демонстрирующий действие рентгеновского облучения на количество трансфериновых рецепторов в красных кровяных клетках крыс на 7 неделе после облучения. Этот график представляет математическое выражение: y= a+b (log х) для дозы в пределах от 0,1 до 150 сГр, и y=c + dx + fx2 для дозы в пределах 150-600 сГр, где у есть увеличение числа маркированных клеток (выраженное в процентах), х есть доза, и а, b, с, d и f есть 3,56, 2,31, 8,54, -0,00327 и 0,0000378 соответственно.
Фигура 3 представляет собой график увеличения количества маркированных клеток человека как функцию от дозы рентгеновских лучей. Кривая представляет математическое выражение, приведенное в пояснении к фигуре 2.
Фигура 4 представляет собой полулогарифмический график увеличения процента красных кровяных клеток, имеющих ядро ("RBCp") в соответствии с дозой рентгеновских лучей, демонстрирующий действие рентгеновского облучения на уровень содержащих ядро клеток RBC в костном мозге. Кривая представляет математическое выражение: y = a + b (log х) для дозы от 0,1 до 150 сГр, и y = c + dx + fx2 для дозы от 150 до 600 сГр, где у есть увеличение количества RPCp (в процентах), x есть доза, и a, b, с, d и f есть 3,62, 1,44, 8,53, -0,0087 и 0,0000256 соответственно.
Фигура 5 представляет собой полулогарифмический график зависимости доли эритроцитов, имеющих трансфериновые рецепторы  , от времени после рентгеновского облучения силой 600 сГр у крыс. Верхнее и нижнее SEM (▪) также указаны. Линия получена методом наименьших квадратов по данным стандартной затухающей кривой.
, от времени после рентгеновского облучения силой 600 сГр у крыс. Верхнее и нижнее SEM (▪) также указаны. Линия получена методом наименьших квадратов по данным стандартной затухающей кривой.
Фигура 6 представляет собой график увеличения количества маркированных клеток крысы (□) и человека  как функцию от дозы рентгеновских лучей. Кривая представляет математическое выражение, приведенное в пояснении к фигуре 2.
как функцию от дозы рентгеновских лучей. Кривая представляет математическое выражение, приведенное в пояснении к фигуре 2.
ПОДРОБНОЕ ОПИСАНИЕ
Данное изобретение посвящено способу обнаружения предшествующего воздействия радиации или радиомиметических веществ на млекопитающих. Способ включает в себя получение пробы красных кровяных клеток от млекопитающих. На красных кровяных клетках имеется количество белка, и это количество определяется и затем соотносится с предшествующим воздействием радиации или радиомиметических веществ на млекопитающих.
Этим белком может быть любой белок, количество которого увеличивается с увеличением воздействия на млекопитающих радиации или радиомиметических веществ.
Белки, количество которых увеличивается с увеличением воздействия на млекопитающих радиации или радиомиметических веществ, могут быть идентифицированы множеством различных способов.
Если белок один из тех, что описаны в литературе, и если имеющиеся в продаже моноклональные антитела пригодны для того, чтобы распознать этот белок, например анализ, основанный на иммунофлуоресценции, может быть использован для того, чтобы а) обнаружить белок на поверхности красных кровяных клеток и б) определить количество связанного с клеточной поверхностью флуоресцирующего комплекса вторичное антитело : первичное моноклональное антитело посредством наблюдения флуоресцентной эмиссии спектрофлуорофотометрически. Этот анализ может быть выполнен посредством стандартных методик, например таких, какие описаны в работе Харлоу с соавторами (Harlow et al., ed. , Antibodies: A Laboratory Manual, Cold Spring Harbor, NY: Cold Spring Harbor Press (1988) ("Harlow")), что приведено здесь в ссылке. Стандартизация анализа для определения флуоресцентной эмиссии, приходящейся на белок клеточной поверхности, позволяет косвенно определить количество таких белков клеточной поверхности.
Если белок неизвестен или если белок представляет собой вариантную форму известного белка, такую что связывающая часть белка не распознается посредством имеющихся в продаже моноклональных антител, моноклональные антитела и поликлональные антитела могут быть получены против нового белка, следуя стандартным протоколам, как описано Харлоу, что приведено здесь в ссылке. Эти антитела могут быть использованы, как описано выше, для того, чтобы определить количество белка на клеточной поверхности индуцированного радиацией или радиомиметическим веществом.
Если белок клеточной поверхности представляет собой вариантную форму, это может показать дифференциальный сплайсинг РНК (Cotner et al, Blood 73: 214-221 (1989) и Tyier et al., Nature 293: 406-408 (1981), что приведено здесь в ссылке) или аберрантный белок. Диференциальные виды мРНК могут быть получены путем альтернативного сплайсинга, и абберантный белок будет показывать наличие мутации в нуклеотидной последовательности, кодирующей белок. Дифференциальный сплайсинг мРНК может быть обнаружен при Nothern блот анализе; мутация, присутствующая в кодирующей области гена, транскрибируется в новые виды мРНК, что может быть обнаружено посредством Nothern блот анализа, как описано в книге Самбрук с соавторами (Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd edition, Cold Spring Harbor, NY: Cold Spring Harbor (1989) ("Sambrook")), что приведено здесь в ссылке. Коротко, тотальная РНК, выделенная из облученных и контрольных эритроидных клеток предшественников, разделяется по размеру посредством гель электрофореза. Эта РНК иммобилизуется на нейлоновой мембране и гибридизуется с меченым зондом кДНК. Этот зонд может быть, к примеру, радиоактивно меченым, в этом случае может быть использована авторадиография для получения полос, показывающих количество и размер видов мРНК, комплементарных зонду. Виды мРНК из облученных и необлученных клеток, обнаруженные посредством Nothern анализа, затем сравниваются для того, чтобы определить, транскрибируется ли новый вид мРНК в облученных клетках. Если новые виды мРНК обнаружены, обратно-транскриптазная полимеразная цепная реакция ("RT-PCR") может быть использована для рутинного скрининга изменений в нуклеотидной последовательности. Преимуществом этого анализа является повышенная чувствительность и ускоренное время выполнения.
Например, зонды кДНК к генам, вовлеченным в регуляцию аберрантного трансферинового рецептора на зрелых эритроцитах, могут быть использованы в Nothern анализе для скрининга новых видов мРНК. Эволюционные, уникальные виды мРНК среди РНК, выделенной из облученных клеток, могут быть использованы для рутинного скрининга на предмет наличия этих мутаций. Мутация есть изменение нормальной последовательности ДНК, которое может быть вызвано посредством, например, точковых мутаций, делеций, инсерций, дупликаций, амплификаций генов и транслокаций. Мутация в кодирующей области гена транскрибируется в мРНК, но природа мутации определяется, если новые виды мРНК обнаруживаются посредством Nothern анализа. Например, точковая мутация не была определена посредством Nothern анализа, потому что полный размер кодирующей области остался прежним и потому что Nothern анализ обнаруживает только относительно большие различия в последовательности. Таким образом, полный размер видов мРНК относительно числа нуклеотидов, вовлеченных в мутацию, будет определять, обнаруживаются или нет новые виды мРНК. Следовательно, невозможность определить новые виды мРНК не исключает наличия мутации. Определение любых видов мРНК зависит от транскрипционной активности генов: если ген является молчащим во время анализа, мРНК транскрибироваться не будет. Недавно транскрибированная РНК может быть идентифицирована, например, посредством обычного ядерного транскрипционного анализа, подобно тому, что описан в работах Cairo et al., J.Biol.Chem. 269: 6405-6409 (1994) ("Cairo"), Chan et al., Eur.J.Biochem. 220: 683-692 (1994) ("Chan"), и Ausubel et al., eds., Current Protocols in Molecular Biology, Green and Wiley (1992), что приведено здесь в ссылке. Этот анализ позволяет осуществлять непосредственное измерение и сравнение специфической транскрипции генов в клетках при различных условиях. В данном изобретении, эритроидные или миелоидные клетки предшественники могут быть облучены и в интервалах после облучения ядра могут быть изолированы и анализированы. Коротко, образующиеся транскрипты РНК могут быть мечены (как то радиоактивно мечены) и использованы для обнаружения специфических транскриптов РНК посредством гибридизации с кДНК, иммобилизованными на мембранах. Те кДНК, которые содержат комплементарные последовательности, идентифицируются посредством стандартных методов, таких как авторадиография.
Альтернативно или дополнительно Southern анализ может быть выполнен на ДНК, выделенной из облученных эритроидных клеток предшественников и "нормальных" эритроидных клеток предшественников для скрининга на предмет наличия мутации в гене, кодирующем белок, количество которого увеличивается с увеличением воздействия радиации или радиомиметических веществ, или в родственном гене (Sarnbrook, что приведено здесь в ссылке). Коротко, рестрицированная ДНК разделяется в агарозном геле, иммобилизуется на нейлоновой мембране и гибридизуется с меченой кДНК или олигонуклеотидными зондами. Посредством использования радиоактивно меченного зонда и авторадиографии специфический фрагмент или фрагменты, содержащие комплементарные последовательности, могут быть обнаружены. Мутации будут обнаруживаться появлением уникального полиморфизма длины рестрицированных фрагментов ("RFLPs"). Если обнаруживается, что изменение последовательности ДНК (мутация) сегрегирует совместно с фенотипом, описанным в данном изобретении, тогда при Southern анализе выявляется четкая и воспроизводимая картина полос, представляющих фрагмент(ы) ДНК, содержащие гены дикого типа (нормальные) и мутантные гены. Рестрицированная ДНК может быть также гибридизована с зондами (например, кДНК или олигонуклеотидными зондами) идентифицированных генов, кандидатами, и теми, что еще не обнаружены вовлеченными в регуляцию экспрессии белка данного изобретения. Эволюционные, уникальные RFLPs в ДНК, выделенной из облученных клеток, могут быть использованы как средство для рутинного скрининга на предмет наличия этих мутаций. Если новые RFLPs получены, основанный на PCR анализ может быть применен для рутинного скрининга на предмет наличия этих мутаций. Преимуществом этого анализа является использование максимум 1 мкг ДНК на праймер сэт по сравнению с 30 мкг для Southern анализа. Southern анализ также требует геномной ДНК с высоким молекулярным весом, что не является требованием для анализа, основанного на PCR.
Southern анализ может быть использован для выявления относительно больших различий в последовательности, как обнаружено посредством обработки эндонуклеазами рестрикции. Следовательно, подобно Nothern анализу природа мутации диктует, будет или не будет обнаружен мутантный ген. В случае, если мутации не обнаружены ни Southern ни Nothern анализом, другие методологии могут быть применены для обнаружения изменений последовательности. Методы скрининга мутаций включают, например, анализ неправильно спаренных гетеродуплексов комплементарных нитей ДНК, полученных из последовательности дикого типа и мутантной последовательности, анализ РНКазной защиты, сканирование экзонов, геномное вычитание, и анализы, основанные на полимеразной цепной реакции ("PCR"), такие, как анализ однонитевого конформационного полиморфизма ("SSCP"), аллелеспецифичная PCR, анализы олиголигирования и основанные на транскрипции PCR анализы (Bernstam, Handbook of Gene Level Diagnostics in Clinical Practice, Boca Raton: CRC Press (1992), Landegren, Genetic Analysis Techniques and Applications 9: 3-8 (1992), and Sambrook, что приведено здесь в ссылке).
Каждая мутация, независимо от использованной методологии обнаружения, характеризуется и секвенируется. Природа мутации окончательно определяет методологию рутинного скрининга, и диагностический анализ составляется для быстрого обнаружения, различения и подсчета известных вариаций последовательности. Эти анализы могут включать в себя, например, Nothern и Southern анализы, основанные на транскрипции амплификационные анализы (химический или энзиматический) или основанные на амплификации ДНК анализы (химический или энзиматический). В качестве альтернативы могут быть использованы гибридизационные анализы, такие как сигнальная амплификация отдельной ДНК, в котором зонд несет исключительно высокую специфичную активность мечения, такую, что он может гибридизоваться и позволяет обнаружить неамплифицированнную мишень в малом числе копий (Wilbur et al. In: Molecular Methods for Viral Detection, Academic Press, (1995), что приведено здесь в ссылке). Мутантные гены могут быть анализированы как в виде молекул мРНК, так и в виде геномной ДНК, что не является взаимоисключающим. В этих анализах мутация выступает в роли высокоспецифичного маркера, присутствуя только в тех эритроидных клетках предшественниках, что подвергались воздействию радиации.
В случае отсутствия изменений последовательности как в геномной ДНК, так и в мРНК, могут присутствовать посттранскрипционные изменения. Это может быть проверено посредством анализов ретардации/изменения мобильности в геле, где анализируется комплекс РНК-белок (Leibold et al, Proc. Natl. Acad. Sci. USA 85: 2171-2175 (1988) and Jafftey et al, Nucleic Acid Res. 21: 4627-4631 (1993), что приведено здесь в ссылке). Коротко, эритроидные или миелоидные клетки предшественники облучаются и затем готовятся цитоплазматические лизаты. Затем синтезируются и метятся, к примеру радиоактивно, РНК транскрипты белок-связывающих областей трансферинового рецептора. Реакция связывания выполняется с цитоплазматическими лизатами и меченой РНК. После инкубации материал наносится на неденатурирующий полиакриламидный гель и РНК-связывающие белки обнаруживаются по их способности уменьшать мобильность меченых (например, радиоактивно меченных) РНК, подвергнутых электрофорезу в геле. Гель высушивается, и метка обнаруживается (например, посредством авторадиографии). В случае отсутствия связывающих белков, несвязанная меченая РНК мигрирует через гель свободно и выглядит, как одна полоса. При наличии связывающего белка комплекс РНК : белок движется медленнее, чем полоса, соответствующая одной РНК, и дополнительные полосы обнаруживаются. После обнаружения РНК связывающего белка белок можно очистить, используя стандартные хроматографические методики.
Если увеличение количества белка в ответ на увеличивающееся облучение или радиомиметическое воздействие происходит за счет функциональной мутации, мутантный ген может быть клонирован в системе генной экспрессии (Sambrook, что приведено здесь в ссылке) так, чтобы продуцировалось большое количество аберрантного белка. Этот белок затем можно использовать для получения антител, следуя стандартным методикам (Harlow, что приведено здесь в ссылке), и далее эти антитела могут быть использованы в несложном анализе скринирования на предмет обнаружения и подсчета аберрантного белка на красных кровяных клетках.
Цитогенетический анализ облученных стволовых клеток также может быть выполнен с целью определения физических характеристик хромосом. Этот анализ может быть использован для того, чтобы идентифицировать элементы, которые вызывают увеличение экспрессии белка под воздействием радиации или радиомиметических веществ, такие как амплификация генов, хромосомная транслокация, образование двойных структур, хромосомные делеции и инсерции, или любые другие аберрантные хромосомные структуры. Результатом мутации может быть мутантный белок или ненормальная персистенция нормального белка.
Этим белком может быть трансфериновый рецептор. Трасфериновый рецептор представляет собой поверхностный белок, который связывает железо и делает его доступным клетке в процессе синтеза гемоглобина. Он присутствует на ранних эритроидных клетках всех млекопитающих, но в основном пропадает, как только ретикулоциты дифференцируются в зрелые эритроциты. Однако эритроциты, продуцируемые клетками костного мозга, подверженными воздействию радиации или радиомиметических веществ, сохраняют трансфериновые рецепторы в количестве, которое соотносится с воздействием. Сохранившийся трансферин может быть нормальным, не мутантным трансфериновым рецептором или мутантным трансфериновым рецептором. Под мутантным трансфериновым рецептором понимается любая молекула, сходная с нормальным, не мутантным трансфериновым рецептором, достаточная для того, чтобы взаимодействовать с антителами или зондами, которые реагируют с нормальным, не мутантным трансфериновым рецептором. У крыс нормальный, не мутантный трансферриновый рецептор имеет аминокислотную последовательность, изображенную на фигуре 1A.
Нормальный, не мутантный трансфериновый рецептор человека имеет аминокислотную последовательность, показанную на рисунке 1В, и кодируется человеческим геном 3q26.2-qter, 31 т.н.п., что описано в работе Kuhn et al., Cell 37: 95-103 (1984), что приведено здесь в ссылке.
Этот белок может также быть любым белком, кодируемым нуклеотидной последовательностью внутри локуса, который содержит ген, кодирующий трансфериновый рецептор. Например, предшествующее воздействие радиации или радиомиметических веществ на человека может быть обнаружено посредством использования любого белка, кодируемого геном, содержащимся в человеческом 3q26.2-qter. Примеры таких белков включают те, что идентифицированы в работе McClelland et al., Cell 39:267-274 (1984) ("McClelland"), что приведено здесь в ссылке.
Несмотря на то, что здесь приведены специфические локусы, которые кодируют трансфериновый рецептор человека, это сделано исключительно в целях иллюстрации. Локусы, кодирующие трансфериновый рецептор у других видов млекопитающих, описаны в работе Stearne et al., J. Immunol. 134: 3474-3479 (1985), что приведено здесь в ссылке.
Напротив, локус, кодирующий трансфериновый рецептор млекопитающих, может быть определен посредством скрининга геномных библиотек с использованием протоколов, описанных Самбрук (Sambrook), что приведено здесь в ссылке. В частности, моноклональные антитела могут быть использованы для клонирования систем экспрессии, как описано в работе Kuhn et al., Cell 37: 95-103 (1984) и Rubin et al. , Am. J. Hum. Gene t. 37: 1112-1116 (1985), что приведено здесь в ссылке. Коротко, высокомолекулярная ДНК млекопитающих или плазмидная ДНК, содержащая ген устойчивости к антибиотику (например, lacz), вносится посредством котрансфекции в клетки млекопитающих. Трансфектанты отбираются при инкубации в присутствии антибиотика (например, генетицина), который может быть метаболизирован только клетками, содержащими ген устойчивости к антибиотику (например, lacz). Трансфектанты метятся соответствующим моноклональным антителом и флуоресцированным вторичным антителом. Клеточный сортинг посредством активируемого флуоресценцией клеточного сортера ("FACS") позволяет проводить селекцию тех клеток, которые экспрессируют белок. Эти клетки клонируются, и количество перенесенной ДНК млекопитающих определяется. ДНК из клеточной линии, содержащей наименьший фрагмент ДНК млекопитающих, используется для конструирования фаговой библиотеки. Эта библиотека скринируется посредством гибридизации на фильтре с радиоактивно меченной ДНК млекопитающих для того, чтобы изолировать фаги, несущие ДНК млекопитающих. Находящиеся в них вставки рестрицируются и скринируются на предмет их способности связывать моноклональное антитело. Таким путем локализуется кодирующая область гена. Уникальные фрагменты, находящиеся внутри кодирующей области, радиоактивно метятся и используются в качестве зондов в Nothern анализе для того, чтобы обнаружить и определить размер различных видов мРНК. Скрининг библиотеки к ДНК подтверждает размер мРНК видов. Для того, чтобы определить размер гена и локализовать кодирующую и intervening последовательности, кДНК гибридизуется с рестрицированными фрагментами геномной рекомбинантной фаговой ДНК. Локус гена картируется на хромосоме посредством гибридизации in situ. Это включает в себя радиоактивное мечение зонда кДНК с очень высокой специфической активностью и гибридизацию с клетками, задержанными в метафазе таким образом, что каждая хромосома различима под световом микроскопом. Затем используется авторадиография в связи с окрашиванием хромосом (например, G-бандинг) с целью выявления напрямую, с какой полосой на какой хромосоме гибридизуется проба (Rabin et aL, Am. J. Hum. Genet. 37: 1112-1116 (1985), что приведено здесь в ссылке).
Поскольку локус, кодирующий трансфериновый рецептор, идентифицирован, другие белки, кодируемые генами внутри этого локуса, могут быть определены посредством процедур, описанных Макклелландом (McClelland), что приведено здесь в сылке. Коротко, кДНК секвенируется, и, исходя из этой последовательности определяется аминокислотная последовательность. Затем аминокислотная последовательность анализируется для того, чтобы определить, например, гидрофобные покрывающие мембрану области и цитоплазматические "якоря" трансмембранных рецепторов. Таким образом, структура и вероятная функция белка могут быть предсказаны исходя из его аминокислотной последовательности. Поиски гомологии аминокислотной последовательности также могут быть использованы для того, чтобы определить, имеет ли белок частичную или полную гомологию с другими белками. Белки, кодируемые локусом, кодирующим трансфериновый рецептор у других видов млекопитающих, перечислены в работах Towbridge et al. , Biochem. Pharmacol. 33: 925-930 (1984) и Agthoven et al., Eu. J.Biochem. 140: 433-440 (1994), что приведено здесь в ссылке.
Проба красных кровяных клеток может быть получена посредством любого подходящего способа изъятия крови от млекопитающих, такого как, например, отсасывание через иглу или вскрытие кожи ланцетом. Объем пробы должен быть таким, чтобы в нем содержалось более 1000 красных кровяных клеток. Хотя такой объем пробы даст только очень приблизительное показание предшествующего воздействия, даже такая малая проба может быть достаточной для того, чтобы надежно различить индивидуумов, подвергавшихся воздействию силой 10 сГр и 600 сГр. Предпочтительно, чтобы проба содержала более чем 5000 клеток, еще лучше, от 10000 до 20000 красных кровяных клеток. У большинства млекопитающих только что изъятая кровь содержит около 8 миллионов красных кровяных клеток/мкл. Следовательно, предпочтительно, чтобы минимальный объем только что полученной пробы составлял от 1250 до 2500 пиколитров. Проба может быть получена из пробы большего объема, взятой для других целей, как то для стандартного гематологического анализа. Кровь может быть изъята заранее и храниться в течение некоторого времени перед использованием ее в способе данного изобретения. Продолжительность времени, в течение которого кровь может храниться, прежде чем быть использованной, зависит от условий хранения. Красные кровяные клетки могут храниться при температуре -70oC в течение года или при 4oC в течение 42 дней. Напротив, кровь может храниться при 4oC более 6 недель, что не влияет на результаты метода при использовании забуференного формалина или других стандартных способов фиксации крови, подобных тем, что описаны в книге American Association Blood Banks Technical Manual, 13th edition, Walker, ed (1995), что приведено здесь в ссылке.
Количество белка на красных кровяных клетках из полученной таким образом пробы может быть определено множеством различных способов. Некоторые из них основаны на очистке интересующего белка с последующим определением его количества. Коротко, клетки лизируются, белки отделяются от других клеточных частиц, и интересующий белок отделяется от других белков посредством SDS-PAGE, ELISA, адсорбционной хроматографии, аффинной хроматографии, size-exclusion хроматографии, центрифугирования в градиенте плотности. Количество таким образом отделенного белка может быть подсчитано, например, посредством обработки его меткой, как то флуоресцентной или радиоактивной меткой, и измерения соответствующей эмиссии. В том случае, если белок является трансфериновым рецептором, количество присутствующего отделенного белка может быть определено также посредством спектрофотометрического контроля абсорбции Fe3+.
Другие способы определения количества белка на красных кровяных клетках основаны на селективном маркировании белка, пока он находится на красной кровяной клетке, и подсчете количества присутствующих маркеров. Например, может быть осуществлено взаимодействие пробы с антителом, связывающей частью антитела, или зондом, распознающими белок. По прошествии времени, достаточного для того, чтобы большое количество антител, связывающих частей антител, или зонда связалось с белком на красных кровяных клетках, количество антител, их связывающих частей, или зондов, связанных с белком, определяется. Посредством соотнесения количества связанных антител, их связывающих областей, или зондов с количеством белка на красных кровяных клетках, определяется количество белка на красных кровяных клетках пробы.
Антитела, пригодные для маркирования белка, могут быть моноклональные или поликлональные. Дополнительно могут использоваться фрагменты, половины антител, гибридные производные и зонды.
Получение моноклональных антител может быть осуществлено посредством хорошо известных методик. В основном, этот процесс включает в себя, первым делом, получение иммунных клеток (лимфоцитов) из селезенки млекопитающих (например, мыши), которые были предварительно иммунизированы интересующим антигеном in vivo или in vitro. Затем осуществляется слияние лимфоцитов, секретирующих антитела, с миеломными клетками (мыши) или трансформированными клетками, способными к неограниченной репродукции в клеточной культуре, посредством чего получается бессмертная, иммуноглобулин-секретирующая клеточная линия. Полученные в результате слияния клетки, или гибридомы, культивируются, и получающиеся колонии скринируются на предмет продукции желаемых моноклональных антител. Колонии, продуцирующие такие антитела клонируются, и выращиваются in vivo или in vitro с целью получения больших количеств антитела. Описание теоретической базы и практической методологии слияния таких клеток изложено полностью в работе Kohler et al., "Continuous culteres of fused crlls secreting antibody of predefined specificity", Nature 256: 495 (1975), что приведено здесь в ссылке.
Лимфоциты млекопитающих иммунизируются посредством иммунизации животных (например, мыши) in vivo белком или полипептидом данного изобретения. Такая иммунизация повторяется, при необходимости, с интервалами до нескольких недель с целью получения достаточного титра антител. Вирус вносится в соответствующие растворы или адъюванты. Вслед за последним антигенным форсированием животные умерщвляются и клетки селезенки извлекаются.
Слияние с миеломными клетками млекопитающих или другими партнерами слияния, способными к неограниченной репродукции в клеточной культуре, выполняется посредством стандартных и хорошо известных методик, например посредством использования полиэтилен гликоля ("PEG") или других агентов слияния (смотри Milstein et al., "Derivation of specific antibody-producing tissue culter, " Eur. J. Immunol. 6: 511 (1976), что приведено здесь в ссылке). Эта бессмертная клеточная линия, которая предпочтительно мышиная, но может быть также получена из клеток других видов млекопитающих, включая крысу, человека и другие виды, селектируется по признаку недостатка ферментов, необходимых для утилизации определенного вещества, способности к быстрому росту и хорошей способности к слиянию. Многие из таких клеточных линий известны специалистам, о существовании других регулярно сообщается.
Процедуры получения поликлональных антител также хорошо известны. Обычно такие антитела могут быть получены путем подкожного введения белка или полипептида данного изобретения новозеландским белым кроликам, у которых предварительно была взята кровь для получения преиммунной сыворотки. Антигены могут быть инъецированы в суммарном объеме 100 мкл на место, в шести различных местах. Каждый инъекционный материал должен содержать синтетический сурфактант адъювант плюроник полиолз или пульвелизированный акриламидный гель, содержащий белок или полипептид после SDS-электрофореза в полиакриламидном геле. В течение двух недель после первой инъекции у кроликов берется кровь и периодически три раза каждые шесть недель вводится тот же самый антиген. Через 10 дней после каждого введения антигена собирается проба сыворотки. Поликлональные антитела затем извлекаются из сыворотки посредством аффинной хроматографии с использованием соответствующего антигена для связывания антитела. В заключение, кролики умерщвляются с помощью пентобарбитала 150 мг/кг IV. Эта и другие процедуры получения поликлональных антител изложены в работе Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor, NY: Cold Spring Harbor Press (1988), что приведено здесь в ссылке.
В дополнение к использованию целых антител, приемы данного изобретения охватывают использование связывающих частей этих антител. К таким связывающим частям относятся Fab фрагменты, F(ab)2 фрагменты и Fv фрагменты. Эти фрагменты антител могут быть созданы посредством подходящих процедур, таких как процедура протеолитической фрагментации, как описано в Goding, Monoclonal Antibodies: Principles and Practice, pp. 98-118 New York: Academic Press (1983) ("Coding"), что приведено здесь в ссылке.
С другой стороны, в способах данного изобретения могут быть использованы зонды, существующие в природе или созданные синтетически методами рекомбинантной ДНК или другими биологическими методами. Подходящими зондами являются молекулы, которые связываются с ранее идентифицированными белковыми или нуклеотидными последовательностями. Такими зондами могут быть, например, нативные белки или белки, полученные от мутантных нуклеотидных последовательностей, включая целые мутантные гены и кДНК.
Если белок представлен трансфериновым рецептором, моноклональные антитела для многих видов млекопитающих коммерчески доступны. Например, моноклональные антитела human anti-CD71, rat anti-CD71 и mouse anti-CD71, распознающие человеческий, крысиный и мышиный трансфериновые рецепторы, доступны от Becton- Dickinson (San Jose, CA), Chemicon International, Inc. (Temecula, CA) и BioSource (Camarilla, CA).
Антитела, их связывающие части или зонды используются с целью обнаружения количества белка на красных кровяных клетках пробы. Предпочтительно это достигается посредством мечения антитела, его связывающей части или зонда, взаимодействия меченого антитела, его связывающей части или зонда с пробой, и последующего обнаружения метки.
К подходящим меткам относятся радиоактивные метки, такие как 131I, IIIIn, 99mТс, 32P, 125I, 3H и 14С, флуоресцентные метки, такие как флуоресцеин и родамин, ЯМР (ядерный магнитный резонанс) активные метки, и хемилюминесцеры, такие как люциферин.
Предпочтительно антитело является моноклональным антителом, выбранным из группы, состоящей из радиоактивно меченного антитела, флуоресцентного моноклонального антитела и их смесей. Антитело может быть мечено такими реагентами с использованием известных в науке методик. Например, смотри Wensel et al., Radioimmunoimaging and Radioimmunotherapy, New York: Elsevier 1983), что приведено здесь в ссылке, для методик, относящихся к радиоактивному мечению антител. Смотри также, Colcher et al., "Use of Monoclonal Antibodies as Radiopharmaceuticals for the Localization of Human Carcinoma Xenografts in Athymic Mice", Meth. Enzymol. 121: 802-816 (1986), что приведено здесь в ссылке.
Специфическая активность меченых антител, их фрагментов или зонда зависит от периода полураспада, чистоты изотопа радиоактивной метки и метода, посредством которого метка была включена в антитело, его фрагмент или зонд. В таблице 1 перечислены несколько известных изотопов, их специфические активности и периоды их полураспада. В иммунологических тестах, как правило, чем выше специфическая активность, тем выше чувствительность.
Процедуры мечения антител, их связывающих частей или зондов радиоактивными изотопами, перечисленными в таблице 1, в основном известны. Процедуры мечения тритием описаны в U.S. Patent N 4,302,438, что приведено здесь в ссылке. Процедуры мечения йодом, тритием и 35S, специально адаптированные для мышиных моноклональных антител, описаны Годингом (Coding, pp. 124-126) и другими авторами, ссылки на которых помещены там же, что приведено здесь в ссылке. Другие процедуры получения меченных йодом антител описаны в работах Hunter et al., Nature 144: 945 (1962), David et al" Biochemistry 13: 1014-1021 (1974), и U. S. Patent N 3,867,517 и 4,376,110, что приведено здесь в ссылке. Теоретически, пригодными для радиоактивного мечения элементами являются, например, 123I, 131I, 111In и 99mTc. Процедуры мечения антител йодом описаны в работах Greenwood et al., Biochem. J. 89: 114-123 (1963); Marchalonis, Biochem. J. 113: 299-305 (1969); и Morrison et al., Immunochemistry, 289-297 (1971), что приведено здесь в ссылке. Процедуры мечения 99mTc описаны Rhodes, В. Et al. in Burchiel et al. (eds.), Tumor Imaging: The Radioimmunochemical Detection of Cancer, New York: Masson 111-123 (1982) и другими авторами, ссылки на которых приведены там же, что приведено здесь в ссылке. Процедуры, подходящие для получения антител, меченных 111In, описаны в работах Hnatowich et al., J.Immul. Methods, 65; 147-157 (1983), Hnatowich et al. , J.Applied Radiation, 35: 554-557 (1984) и Buckley.R. Et al., F.E.B.S. 166: 202-204 (1984), что приведено здесь в ссылке.
Антитела, меченные флуорофором и хромофором, их связывающие части или зонды могут быть приготовлены известными в науке стандартными методами. Поскольку антитела и другие белки адсорбируют свет, имеющий длину волны до примерно 310 нм, флуоресцентная доля должна быть выбрана так, чтобы иметь существенную адсорбцию при длинах волн выше 310 нм и предпочтительно выше 400 нм. Разнообразие подходящих флуоресцирующих веществ и хромофоров описано у Stryer, Science, 162:526 (1968) и Brand, L. et al., Annual Review of Biochemistry, 41: 843-868 (1972), что внесено здесь в ссылки. Антитела, их связывающие части или пробы могут быть помечены группами флуоресцентных хромофоров подходящими процедурами, такими, как раскрытые в Патентах США под номерами 3,940,475, 4,289,747 и 4,376,110, что внесено здесь в ссылки.
Одной группой флуоресцирующих веществ, имеющих число желаемых особенностей, описанных выше, являются ксантиновые красители, которые включают флуоресцирующие вещества, полученные из 3,6-дигидрокси-9-фенилксантгидрол и резамины, и родамины, полученные из 3,6- диамино-9-фенилксантгидрол и лиссаним родамин В. Родамин и флуоресцеиновые производные 9-о-карбоксифенилксантгидрола имеют 9-о-карбоксифенильную труппу. Соединения флуоресцеина, имеющие реактивные парные группы, такие как амино и изо-тиоцианатные группы, такие как флуоресцеин изо-тиоцианат и флуорескамин, широко доступны. Другой группой флуоресцирующих соединений являются нафтиламины, имеющие амино группу в α или β позициях.
Антитела или их связывающие части или пробы могут быть помечены флуорохромами или хромофорами способами, описанными Coding (выше, рр. 208-249), что внесено здесь в ссылки. Антитела или их связывающие части или пробы могут быть помечены индикаторными группами, содержащими NMR-активный 19F атом или множество таких атомов, как (i) практически все природно распространенные атомы флуорина являются изотопом 19F и, таким образом, практически все флуорин-содержащие соединения являются NMR-активными; и (ii) многие химически активные полифлуоринированные соединения, такие как трифлуороацетиловый ангидрид коммерчески доступны по относительно низкой цене. Антитела или их связывающие части или пробы могут быть помечены соединениями, присутствие которых может быть определено химически, спектрофотометрически, визуально, электрически или электрохимически, так, например, как при помощи красителей, пигментов, ионов металлов, агентов, связывающих красители, и металлических коллоидов.
В частности, CD71, клон L01.1, полученный при гибридизации клеток мышиной миеломы P3-X63-Ag8.653 с клетками селезенки от мышей BALB/c, иммунизированных бластными клетками из митоген-стимулированных клеток периферической крови в соответствии со способом Judd et al., "Novel surface antigens expressed on dividing cells but absent from non-dividing cells", J.Exp.Med., 11: 579-586 (1979), что внесено здесь в ссылки, помеченный FITC, коммерчески доступен от Becton Dickinson (San Jose, CA), является особенно подходящим при определении рецептора трансферина у человека. Подходящие человеческие, крысиные и мышиные CD71 антитела имеют EMBL/GENBANK входящие номера X01060, M58040 и M29618 соответственно. Эти антитела далее описаны, в смысле получения и использования, у Schneider et al., Nature. 311:675-678 (1984), Roberts et al., Mol. Cell Endocrinol. 14: 531- 542 (1985) и Stearne et al., J. Immunol. 134:3474-3479 (1985), что внесено здесь в ссылки.
Контактирование пробы, содержащей красные кровяные клетки, с антителами, их связывающими частями или пробами может быть произведено в больших объемах, таким образом, как путем смешивания красных кровяных клеток с раствором, содержащим избыток антител, их связывающие части или пробы, и инкубирования смеси в период времени, достаточный для связывания антител, их связывающих частей или проб с белком. Несвязанные (т.е. избыточные) антитела, их связывающие части или пробы далее удаляют, например, диализом, обменной хроматографией, фильтрацией, ультрафильтрацией или центрифугированием. Число связанных антител, их связывающих частей или проб определяют либо непрямо, измерением числа антител, их связывающих частей или проб, или прямо, измерением числа антител, их связывающих частей или проб, оставшихся после клеток, после удаления несвязанных антител, их связывающих частей или проб. В любом случае, если антитела, их связывающие части или пробы помечены, число антител, их связывающих частей или проб определяют путем измерения присутствующей метки, например, флуороскопией или радиометрией. Когда антитела, их связывающие части или пробы не помечены, число антител, их связывающих частей или присутствующих проб может быть определено путем добавления меченого агента, который реагирует с антителами, их связывающими частями или пробами, к пробе крови, содержащей связанные антитела, их связывающие части или пробы. Добавление проводят при условиях, эффективных для реагирования и связывания количества помеченного агента с количеством связанных антител, их связывающих частей или проб. Количество меченого агента, связанного с антителами, их связывающими частями или пробами, подтверждают способами, подходящими для используемой метки. Например, когда агент флуоресцирующий, количество меченого агента может быть подтверждено возбуждением агента и мониторингом эмиссии спектрофотометрически. Подходящие меченые агенты включают меченые lgG, lgM и lgA. Способы получения и использования меченых агентов для определения количества антител, их связывающих частей или проб хорошо известны профессионалам в области. Соотношение между количеством меченого агента и количеством антител, их связывающих частей или проб зависит от числа меченых агентов, которые связываются с каждым антителом, его связывающей частью или пробой. Обычно именно один меченый агент, их связывающая часть или проба связывается с каждым антителом, его связывающей частью или пробой. Следовательно, количество меченого агента обычно эквивалентно количеству антител, их связывающих частей или проб.
Соотношение между количеством антител, их связывающих частей или проб и количеством белка зависит от числа антител, его связывающих частей или проб, которые связываются с каждым белком. Обычно именно одно антитело, его связывающая часть или проба связывается с каждым белком. Следовательно, количество белка обычно эквивалентно количеству антител, их связывающих частей или проб.
Количество белка на красных кровяных клетках может быть общим количеством белка всех красных кровяных клеток в пробе (т.е. суммой количества белка на каждой из красных кровяных клеток, полученной при суммировании всех красных кровяных клеток в пробе). Это количество наиболее легко определяется путем измерения особенностей красных кровяных клеток совместно. Например, когда антитела, количество меченого агента обычно эквивалентно количеству антител, их связывающие части или пробы являются флуоресцентными моноклональными антителами, агрегатное количество белка всех красных кровяных клеток в пробе определяют измерением флуоресценции пробы в большом объеме.
Количество белка на красных кровяных клетках также может быть определено измерением количества белка на каждой красной кровяной клетке в пробе. Один подходящий способ для эффективного клетка-к-клетке измерения использует техники проточной цитометрии, такие, как описаны у Longobardi, Flow Cytometry: First Principles. New York: Wiley-Liss, Inc., pp 75-101 (1992), что внесено здесь в ссылки. Коротко, проточный цитометр оборудован средствами для измерения метки, использованной при метке антител, количество меченого агента обычно эквивалентно количеству антител, их связывающих частей или проб, или на меченых агентах. Предпочтительно метка является флуоресцентной или радиоактивной и более предпочтительно флуоресцентной. Красные кровяные клетки нагнетают в капиллярную трубку, диаметр которой таков, что клетки единственный раз проходят через район определения капиллярной трубки. Район определения экспонируют свету такой длины волны, которая возбуждает метку, флуоресцентную эмиссию определяют через узкополосный эмиссионный фильтр подходящей длины волны. По сравнению с предварительно описанной техникой больших объемов, измерение количества белка на каждой красной кровяной клетке индивидуально снижает ошибки эффекта внутреннего фильтра и поэтому обеспечивает более аккуратную оценку количества белка на красных кровяных клетках в пробе и более аккуратное определение первичной экспозиции радиации. Второй и, возможно, более важной причиной для предпочтения техники клетка-к-клетке является то, что она позволяет подсчитать клетки, несущие белок. Считается, что экспозиция радиации приводит к мутациям, которые вызывают экспрессию белка на клетке. Соответственно, число клеток, экспрессирующих белок, является индикатором степени мутирования. Поэтому, считается, что число клеток, несущих белок, является лучшим индикатором первичной экспозиции, чем общее количество белка, представленного на множестве клеток.
Количество белка на красных кровяных клетках пробы далее сопоставляют с предшествующим воздействием радиации или радиомиметического вещества на млекопитающих. Обычно корреляцию оценивают путем стандартного определения количества белка на красных кровяных клетках млекопитающих, которые были экспонированы известному количеству радиации ("стандартные млекопитающие"). Относительные экспозиции тестируемых млекопитающих и стандартных млекопитающих далее определяют путем сравнения количества белка на красных кровяных клетках тестируемых млекопитающих с таковыми стандартных млекопитающих. Стандартные млекопитающие должны быть из того же вида, что и оцениваемые тестируемые млекопитающие. Количество белка на красных кровяных клетках стандартных млекопитающих может быть определено описанными выше способами. Количество радиации, которому было экспонировано стандартное млекопитающее, может быть определено путем контролирования с рождения окружающих условий и, следовательно, экспозиции радиации стандартных млекопитающих. Это является особенно точным и эффективным способом, когда млекопитающее является крысой или другим млекопитающим, не относящимся к человеку. Однако способ является неприложимым к человеку. Другой способ, подходящий для млекопитающих, но не человека, включает мониторинг ответа на анемический стресс путем продукции RBCp у млекопитающих и сравнения его уменьшения в ответ на экспозицию радиации в соответствии со способами, описанными у Gong et al., "A Method for Determining Residual Injury in the Hematopoietic System of the X-Irradiated Rat", Radiation Research. 37(3): 467-477 (1969) ("Gong (1969")), что внесено здесь в ссылки. Другой способ, подходящий для всех млекопитающих, включая человека, описан Gong et al., "Effects of Low-Level (1.0 R) X-Irradiation on the Erythroid Response of the Rat Bone Marrow", Radiation Research, 65: 83-97 (1976) ("Gong (1976)"), что внесено здесь в ссылки. Коротко, способ основан на наблюдении, что у не анемичных объектов индекс RBCp повышается с увеличением экспозиции радиации. Путем получения пробы костного мозга у индивидуума, определения индекса RBCp и сравнения индекса RBCp с радиационным уровнем, которому был экспонирован индивидуум, используя дозозависимое соотношение, предложенное Gong (1976), можно определить количество радиации, которой было экспонировано стандартное млекопитающее.
С другой стороны, для человеческого анализа стандартных людей предпочтительно отбирают из группы, чья радиационная история документирована, например, записями пленок из научных или диагностических лабораторий, ядерных заводов или рудников тяжелых металлов. Другие люди, подходящие для использования в получении стандартных данных, включают таковых, подвергшихся радиотерапии, и таковых, экспонированных радиации при ядерных происшествиях, таких как взрыв в Чернобыле в 1986 и несчастье в Three Mile Island в 1979.
Стандартная доза против данных, полученных таким образом, может быть использована набором путей для сравнения количества белка с его соответствующей экспозиции радиации. Полезные способы включают интерполярные, графические и математические методы.
Когда количество белка на красных кровяных клетках определяют по количеству белка на каждой красной кровяной клетке в пробе, как, например, проточной цитометрией, как описано выше, сравнение предпочтительно проводят следующими способами.
Сначала определяют количество красных кровяных клеток в пробе, имеющей количество белка в избытке в произвольном числе. Произвольное число находится предпочтительно в пределах между нулем и "контрольным количеством" белка. Будучи использованным здесь, "контрольное количество" белка является количеством белка, которое в норме присутствует на красных кровяных клетках млекопитающих, экспонированных только базовым уровням радиации и радиомиметических химических веществ. Клетка, имеющая количество белка, большее, чем произвольное число, называется "меченой клеткой" для целей этой заявки. Определение количества меченых клеток может быть проведено, например, путем сравнения количества трансфериновых рецепторов на каждой из красных кровяных клеток пробы, определенных на основе клетка-к-клетке, например проточной цитометрии, с произвольным числом, и подсчитывания этих клеток, имеющих количество, большее, чем произвольное число. Сравнение и подсчет могут быть проведены вручную, механически, электрически, электронно или оптически и либо одновременно, либо последовательно. Когда используют проточный цитометр, сравнение и подсчет предпочтительно проводят одновременно проточным цитометром. Например, пороговый прирост может быть подобран таким образом, что сигнал (т. е. флуоресцентная эмиссия) от клеток, соответствующих или меньших, чем произвольное число белков, не амплифицируется, в то время как сигнал, больший, чем таковой, соответствующий произвольному числу, амплифицируется. Поскольку единственной информацией, необходимой для этого способа, является число клеток, имеющих особенность (это присутствие определенного белка, такого как трансфериновый рецептор в количестве, большем, чем произвольное число), этот способ позволяет регистрировать при помощи проточного цитометра результаты, скорее как сумму целых чисел, нежели как серии чисел, которые понижают объем необходимой памяти. Далее, скорость, с которой оперирует проточный цитометр, значительно повышается, поскольку для большинства клеток не существует необходимости стабилизировать сигнал и поскольку число аналого-цифровых преобразований и сохранение данных значительно снижены.
Количество меченых клеток (т.е., красных кровяных клеток в пробе, имеющей количество белка в избытке по сравнению с произвольным числом) далее сопоставляют с предшествующим воздействием радиации или радиомиметическими веществами.
Сначала получают количество меченых клеток (т.е. клеток, имеющих количество белка в избытке по сравнению с тем произвольным числом, которое использовано для определения количества меченых клеток у тестового млекопитающего), например, описанным выше способом проточной цитометрии для одного или более стандартных млекопитающих, экспонированных известному количеству радиации или радиомиметических агентов. Количество радиации, которому было экспонировано каждое стандартное животное, избыточное по сравнению с уровнем окружающей среды, может быть определено путем контролирования окружающей среды и экспозиции радиации стандартного животного с рождения. Это является особенно точным и эффективным способом, когда млекопитающее является крысой. Однако способ является неприложимым к человеку. Другой способ, подходящий для млекопитающих, но не человека, включает мониторинг ответа на анемический стресс (такой, как тяжелая анемия, индуцированная флеботомией) путем продукции RBCp у млекопитающих и сравнения его уменьшения в ответ на экспозицию радиации в соответствии со способами, описанными у Gong (1969). Другой способ, подходящий для всех млекопитающих, включая человека, описан у Gong (1976), и кратко описан выше. Предпочтительно стандартных людей отбирают из группы, чья радиационная история документирована, например, записями пленок из научных или диагностических лабораторий, ядерных заводов или рудников тяжелых металлов. Другие люди, подходящие для использования в получении стандартных данных, включают таковых, подвергшихся радиотерапии, и таковых, экспонированных радиации при ядерных происшествиях, таких как взрыв в Чернобыле в 1986 и несчастье в Three Mile Island в 1979.
Стандартная доза, полученная таким образом, может быть использована несколькими путями для сравнения числа меченых клеток с радиационной экспозицией. Подходящие способы включают интерполярный, графический и математический способы. Когда используют математический способ, уравнение предпочтительно имеет вид y= a+b (log х) для доз между, примерно, 0,1 и 150 cGy. Для доз выше, примерно, 150 cGy уравнение имеет вид y=c+ dx+fx2 предпочтительно. В этих уравнениях у является повышением количества эритроцитов (на сто эритроцитов), имеющих в избытке число трансферинового рецептора в крови индивидуумов, не перенесших радиации (меченые клетки), x является дозой и а, b, с, d и f являются константами, которые могут быть определены эмпирически. Как заметит профессионал в области, необходимо провести только четыре стандартных эксперимента (например, эксперименты, использующие стандартных млекопитающих) для того, чтобы точно определить математическое выражение, описывающее первичную экспозицию как функцию количества меченых клеток для определенного млекопитающего. Для установления значений констант в описанном выше математическом отношении могут быть использованы любые подходящие статистические методологии, такие как, по меньшей мере, анализ квадратов. Когда млекопитающее является крысой или человеком и белок -трансферриновым рецептором, константы а, b, с, d и f, уравнения, имеющего отношение к x и у, составляют предпочтительно 3,56, 2,31, 8,54, -0,00327 и 0,0000378 соответственно.
Когда используют табличный метод для сравнения количества меченых клеток крыс с их соответствующей экспозиции радиации, могут быть использованы данные, представленные в Таблице 2. Альтернативно сравнение может быть проведено c использованием графика, представленного на Фигуре 2. Эти данные были получены от и были сравнены с количествами меченых клеток на 7 неделе после экспозиции. Как детализировано ниже, количество меченых клеток снижается во времени с полужизнью примерно 30 недель от экспозиции у крыс. Следовательно, для точного определения общей дозы в любое время, другое, нежели 7 недель, необходимо провести соответствующую трансформацию, используя подходящее полувремя для млекопитающих. Однако, если чей-то интерес распространяется на знание настоящего уровня гематопоэтического здоровья, лучшим индикатором будет настоящий уровень экспрессии неповрежденного рецептора трансферина, который может быть получен, используя эти данные без трансформации.
Для определения предшествующего воздействия радиации или радиомиметических веществ на человека, количество трансферинового рецептора на красных кровяных клетках, определенное, например, как описано здесь, может быть сравнено с предшествующим воздействием радиации или радиомиметических веществ, используя табличный способ и данные, представленные в Таблице 3. Сравнение может также быть проведено с использованием графика, представленного на Фигуре 3.
Механизм, который приводит к повышению уровней трансфериновых рецепторов на зрелых красных кровяных клетках у млекопитающих, экспонированных радиации или радиомиметическим химическим веществам, как сказано выше и показано в примерах ниже, не был объяснен. Однако, в виду и как описано в последующем обсуждении, которое не направлено на какое-либо лимитирование рамок настоящего изобретения, механизм может быть разъяснен профессионалом в области.
Рецептор трансферина (TR) обнаружен на клеточной поверхности многих типов клеток (Testa et al., Crit.Rev.Oncoq. 4:241-276 (1993) ("Testa"), что внесено здесь в ссылки). Это трансмембранный гомодимерный гликопротеин с молекулярной массой приблизительно 180 кДа (Witt et al., Biochemistry, 17: 3913-3917 (1978), что внесено здесь в ссылки). Он функционирует для доставки железа в клетки через эндоцитозный путь железо-трансфериновых комплексов. Железо необходимо всем клеткам для синтеза ДНК, для электронно-транспортных реакций и в эритроидных клетках для синтеза гемоглобина. Последние исследования показывают, что TR также может иметь другие функции, такие как транспортировка вирусов в клетки (Cotter et al., Proc Natl. Acad. Sci., 87: 4033-4037 (1990) и Franco et al., J.Exp.Med., 175:1195-1205 (1992), что внесено здесь в ссылки).
Обычно рецепторы селективно концентрированы на покрытых углублениях на клеточной поверхности и конститутивно контролируются по мере связывания трансферрина, и затем высвобождаются обратно к клеточной поверхности (Goldstein et al., Annu.Rev.Biol., 1:1 - 39 (1985), что внесено здесь в ссылки). Рецептор является димером, стабилизированным дисульфидными связями и состоящим из 1) цитоплазматического домена, 2) трансмембранного домена и 3) внеклеточного домена.
Ген, кодирующий TR, имеет длину примерно 31 тысяч пар оснований (тыс.п. о. ) и содержит 19 экзонов. Транскрипт мРНК составляет 4.9 тыс.п.о. Клонированная кДНК, покрывающая длину мРНК, содержит 5' некодирующий район из приблизительно 280 нуклеотидов, открытую рамку считывания, кодирующую пептид из 760 аминокислот, и очень длинный 3' некодирующий район из приблизительно 2500 нуклеотидов. 5' некодирующий район кодируется первым экзоном и большая часть 3' некодирующего района кодируется единственным экзоном (Kuhn et al., Cell. 37:95-103 (1984), что внесено здесь в ссылки).
Экспрессия гена TR контролируется, по меньшей мере, двумя различными механизмами. Первым является пролиферативно-зависимая регуляция, которая включает 5' некодирующую последовательность и оперирует, предположительно, через транскрипционные механизмы. Исследования показали, что 5'-фланкирующий район гена TR содержит район из 115 п.о., содержащий ТАТА-бокс и несколько GC-богатых районов, которые проявляют гомологию к промоторным районам, описанным для других генов (Testa, что внесено здесь в ссылки). Регуляторные белки связываются с этим районом для контроля экспрессии гена во время пролиферации клеток (Miskimins, J. Cell Biochem., 49:349-356 (1992), что внесено здесь в ссылки). В дополнение, Касет с соавторами (Caset et al., Nucleic Acids Res. 16: 629-646 (1988), что внесено здесь в ссылки), описали последовательность в 11 п.о., идентичную сегментам других энхансеров, например вируса полиомы. Эта последовательность находится на 74-66 п.о. по направлению вверх от старта мРНК и, предположительно, играет важную роль в контроле транскрипционной активности гена. Белок, который связывается с этой последовательностью, принадлежит семейству белков, которые распознают АР-1 или CRE-связанные последовательности и которые включают белки Jun, Fos, CREB и ATF (Beard et al., Nucleic Acids Res. 19:7117-7123 (1991), что внесено здесь в ссылки). Несмотря на то, что механизмы, ответственные за высокую экспрессию рецептора при пролиферации клеток, не вполне понятны, были объяснены регуляторные механизмы, вовлеченные в стабилизацию мРНК TR.
Вторым механизмом, контролирующим экспрессию гена TR, является железо-зависимая регуляция, включающая последовательность, содержащуюся в 3' некодирующем районе и оперирующую через пост-транскрипционные механизмы. Железо-зависимый элемент ("IRE") в 3' некодирующем районе гена TR играет важную роль в модулировании экспрессии гена через посттранскрипционные механизмы. Этот элемент взаимодействует с цитоплазматическими транс-активными факторами, называемыми IRE-связывающими белками ("IRE-BP"). IRE распознаются специфическими цитоплазматическими белками (IRE-BP), которые в отсутствие железа связываются с высокоаффинными IRE мРНК TR, предотвращая таким образом деградацию мРНК. Далее, когда уровень клеточного железа становится низким, мРНК TR стабилизируется, приводя к увеличению трансляционной активности и увеличению экспрессии TR на клеточной поверхности для изолирования дополнительного железа (Testa), что внесено здесь в ссылки.
3' некодирующий район мРНК человеческого TR содержит два домена, которые формируют специфичную вторичную структуру. Этот регуляторный домен содержит выступающую основную петлю, имеющую около 60 п.о. и пять повторов элементов палиндромной последовательности. Делеции более чем одной из этих последовательностей или точковые мутации основной петли полностью отменяют железо-зависимую регуляцию транскриптов TR (Mullner ei al., Cell. 53:815-825 (1988), что внесено здесь в ссылки).
Полужизнь многих мРНК модулируется в ответ на экзогенный стимул, положение в клеточном цикле или дифференциации. Таким образом, когда железо находится в избытке, мРНК трансферринового рецептора имеет относительно короткую полужизнь (приблизительно 45 минут)(Harford, В: Belasco и Brawerman, eds. , Control of Messenger RNA Stability, New York: Academic Press, pp. 239-266, что внесено здесь в ссылки) по сравнению с относительно длинной полужизнью (более чем 3 часа), когда железа недостаточно (Koeller et al., Proc. Natl. Acad.Sci.USA. 88:7778-7792 (1991), что внесено здесь в ссылки). Деградация мРНК является обычно длительным процессом с несколькими, если таковые существуют, обнаруженными промежуточными типами РНК. Однако Байндер с соавторами (Binder at al., Embo. J., 13:1969-1980 (1994), что внесено здесь в ссылки) сообщает об обрезанном типе РНК TR во время железорегулируемой деградации РНК человеческого TR.
Из-за того, что эритроидные клетки нуждаются в железе для синтеза гемоглобина, они зависят от экспрессии TR. Экспрессия гена TR регулируется поступательно во время созревания эритроида и коррелирует с изменяющимися нуждами в синтезе гемоглобина (Chan, Eur. J. Biochem., 220: 683-692 (1994) и Horton, Exp. Cell Res. 144: 361-366 (1983), что внесено здесь в ссылки). Рецепторы трансферина гиперэкспрессированы в незрелых эритроидных клетках, в которых экспрессия частично транскрипционно регулируется механизмами, которые не отвечают на количество внутриклеточного железа. По мере дифференциации эритроидные клетки теряют их способность пролиферировать по время, когда необходимость в железе находится на его пике, экспрессия TR в этих клетках подобным образом не имеет отношения к их пролиферативному статусу. Скорее вовлечены уникальные механизмы, отличные от неэритроидных клеток. Для усиления поглощения железа мРНК TR в эритроидных клетках может также быть стабилизирована, в дополнение к тому, что мРНК индуцирована транскрипционно. Однако, если посттранскрипционная регуляция была очевидна, потеря ответа на железо могла показывать, что эти механизмы отличны от тех, которые обнаружены в неэритроидных клетках. Таким образом, похоже, что экспрессия TR регулируется разнообразием механизмов, которые зависят от типа клеток и статуса дифференцировки клетки (Chan, что внесено здесь в ссылки). Существует доказательство, предполагающее, что гены TR, экспрессирующиеся в эритроидных клетках, могут проявлять некоторые различия, будучи сравненными с таковыми других типов клеток (Lebman et al., Blood, 59:671-678 (1982), что внесено здесь в ссылки). В дополнение, Котнер с соавторами (Cotner et al., Blood, 73: 214-221 (1989), что внесено здесь в ссылки) показали, что эритроидные клетки синтезируют две формы трансферинового рецептора, и предлагают, что этот феномен может быть отнесен к дифференцированному сплайсингу мРНК или к посттранскрипционным модификациям.
Во время нормальных физиологических путей при поздней стадии эритроидной дифференциации общие клеточные активности синтеза снижаются и выявляются зрелые эритроциты. В норме циркулирующие предшественники эритроидных клеток являются в основном TR-, если сравнивать с таковыми, обнаруженными в костном мозге, которые являются преимущественно TR- (Testa, что внесено здесь в ссылки). Известно, что, либо общее "отключение" синтетической активной в зрелых эритроцитах включает все активности, либо единственный ген или группа генов отключаются индивидуально, хотя Чан (Chan, что внесено здесь в ссылки) предполагает, что более вероятно последнее. Однако механизмы, вовлеченные в гипериндукцию последующей супрессии экспресии гена TR во время процесса эритроидного развития, остаются предметом исследований.
Регуляция экспрессии гена может быть в основном отнесена к специфическому изменению белков с сайтами связывания внутри либо геномной ДНК, либо транскриптов РНК. Далее, клеточная регуляция уровня экспрессии индивидуальных генов часто зависит от способности нуклеиновых кислот связывать белки для модулирования связывающей активности в ответ на сигналы размножения или окружающей среды.
Как указано выше, 1-2% циркулирующих эритроцитов, которые обнаружены в норме, являются TR+ клетками. При гиперэкспрессии TR, однако, обнаружены уровни TR, сходные с таковыми, обнаруженными в клетках-предшественниках эритроидов костного мозга. Присутствие рецептора на клеточной поверхности может быть отнесено к одному из двух механизмов. В первом механизме пептид TR на зрелых эритроцитах отличен от нормального пептида, обнаруженного на клетках-предшественниках эритроидов костного мозга. Далее, экспрессия TR избегает нормального механизма "отключения" и регуляторных путей, и TRы остаются на клеточной поверхности. При втором механизме "отключение" синтетической активности экспрессии TR нарушено так, что TR не распознается и поэтому остается интактным. Эти нарушения могут быть вызваны, например, мутациями внутри района гена TR, кодирующего пептид, или изменениями в сайтах связывания ДНК или РНК, или изменениями в модулировании белков связывания на тех генах, которые регулируют "отключение" гена TR. Способы определения и подсчета дефектного рецептора трансферрина на поверхности клеток были описаны выше.
Соответственно, настоящее изобретение также направлено на способ обнаружения предшествующего воздействия радиации или радиомиметрических веществ на млекопитающих. Способ включает обеспечение пробы нуклеиновых кислот из клеток с ядрами, продуцированных гематопоэтическими стволовыми клетками. Нуклеиновые кислоты имеют число мутаций, которые вызывают экспрессию трансферринового рецептора в зрелых эритроцитах. Определяют количество и далее соотносят с первичным получением радиации или радиомиметрических агентов.
Нуклеиновые кислоты могут быть ДНК или РНК и могут быть из любых клеток с ядром, продуцированных гематопоэтическими стволовыми клетками. Подходящие источники нуклеиновых кислот для использования в практике настоящего изобретения включают, например, предшественники красных кровяных клеток, красные кровяные клетки с ядром, белые кровяные клетки, предшественники белых кровяных клеток, тромбоциты, предшественники тромбоцитов и их смеси. Мутация может быть локализована внутри района гена трансферринового рецептора, кодирующего пептид, который включает открытую рамку считывания и ассоциированные 5' и 3' некодирующие районы, и может быть одной или более точковых мутаций, делеций, инсерций, дупликаций, амплификаций гена, транслокаций или их комбинаций.
Первоначальный скрининг на присутствие мутации в гене TR подвергшихся воздействию радиации стволовых клеток может быть проведен Southern-анализом ДНК, экстрагированной из этих клеток, для определения, являются ли уникальным полиморфизм длины рестрикционных фрагментов ("RFLPS"), генерированный при разрезании эндонуклеазами рестрикции, и гибридизация с мечеными кДНК пробами TR по сравнению с неиррадиированными контрольными стволовыми клетками. Рестрицированная ДНК может также быть гибридизована с кДНК или пробами олигонуклеотидов тех генов, которые идентифицированы как вовлеченные в регуляцию экспрессии TR. Последовательно, уникальные RFLPы в ДНК, экстрагированной из иррадиированных клеток, далее может быть использована в качестве средства для рутинного скринирования на присутствие этих мутаций в нуклеиновых кислотах из клеток, продуцированных стволовыми клетками.
Southern-анализ определит относительно главные различия последовательности, как может быть определено перевариванием с эндонуклеазами рестрикции. При использовании Southern-анализа, в отсутствие наблюдаемых мутаций, могут быть использованы другие методологии для определения изменений последовательности. Они включают, например, пробы защиты РНК-азы, сканирование экзона, геномное вычитывание и методы реакции полимеразной цепи ("PCR"), такие как анализ одноцепочечного конформационного полиморфизма ("SSCP"), олиголигированные пробы и аллель-специфичную PCR.
Каждую определенную мутацию, вне зависимости от использованной методологии определения, затем характеризуют и определяют последовательность. Рутинное скринирование может быть проведено, например, сигнальной амплификацией к последовательности мутированной ДНК, анализом, основанным на Саузерн-габридизации, или анализом на основе химической или энзиматической амплификации. Природа мутации определенно способствует выбору методологии рутинного скрининга.
Сравнение и характеристика транскриптов TR и тех генов, которые вовлечены в регуляцию аберрантных TR на зрелых эритроцитах, с нормальными транскриптами мРНК может быть проведено Northern-анализом общей РНК, экстрагированной из иррадиированных и контрольных стволовых клеток. Активная синтетическая активность, имеющая отношение к экспрессии аберрантного TR в иррадиированных клетках против неиррадиированных клеток, может быть выяснена с использованием анализа ядерной транскрипции in vitro. В зависимости от этих результатов и таковых Northern-анализа, при скрининге проб, направленном на обнаружение мутации, могут быть использованы транскрипты мРНК в Northern-анализе, анализ, основанный на амплификации с использованием обратной транскрипции или анализ, основанный на сигнальной амплификации. Анализы мРНК или геномной ДНК не являются исключительно единственными.
Отсутствие изменений в последовательности либо в геномной ДНК, либо мРНК означает, что могут быть вовлечены пост-транскрипционные изменения. Эти изменения могут быть исследованы пробами подвижности при ретардации геля/подвижке геля РНК-белковых комплексов, когда комплексы содержат мРНК тех генов, которые вовлечены в регуляцию аберрантного TR и соответствующих РНК-связывающих белков.
Как только обнаруживается функциональная мутация, которая привела к продукции дефектного TR, мутированный ген может быть клонирован в системе экспрессии генов с использованием методов клонирования, описанных у Самбрук, что внесено здесь в ссылки, таким образом, что могут быть получены большие количества дефектного белка. Далее белок может быть использован для получения антител по стандартным методикам, таким, как описано выше. Затем антитела используют при простейшем скрининговом анализе для определения и подсчета дефектных пептидов в пробе периферической крови.
Альтернативно или дополнительно может быть использован цитогенетический анализ стволовых клеток, подвергшихся радиации, для определения физических характеристик хромосом. Физические характеристики могут быть использованы для идентификации элементов причины, таких как амплификация гена, хромосомная транслокация, генерирование двойных минут, хромосомные инсерции или делеции, вовлеченные в персистенцию рецептора трансферина на зрелых эритроцитах.
Число мутаций, которые вызывают экспрессию трансферинового рецептора на зрелых эритроцитах, далее сопоставляют с первичной экспозиции млекопитающих радиации или радиомиметрическим агентам. Корреляция может быть подсчитана путем сравнения числа мутаций, определенных в соответствии со способами настоящего изобретения, с числом мутаций, присутствующих в стандартных млекопитающих, экспонированных известному количеству радиации или радиометрических агентов. Эти способы в деталях описаны выше относительно корреляционных количеств рецептора трансферина по отношению к первичной экспозиции радиации.
Способы настоящего изобретения могут быть использованы для обнаружения первичной экспозиции млекопитающих радиации или радиометрическим агентам. Радиометрические агенты - это те агенты, которые имеют мутагенный эффект и включают физические, химические и биологические агенты. Примеры радиометрических агентов включают электромагнитные поля, хром, свинец, ртуть, железо, Т-клеточную лейкемию человека, человеческий вирус папилломы, алкоголь, курение сигарет, диоксин, бензол, иприт, блеомицин, пероксид водорода, неокарциностатин и агенты, раскрытые у Terado et al., Radiat.Res. 135:189-196 (1993) и Lawley, IARC. 125:3-22 (1994), что внесено здесь в ссылки. Несмотря на то, что способы настоящего изобретения не могут дифференцировать между первичной экспозицией радиации и радиометрическим агентам, способы полезны при определении общей экспозиции млекопитающих радиации и агентам, которые имеют мутагенные эффекты, неотличимые от радиации.
Настоящее изобретение далее проиллюстрировано следующими примерами.
ПРИМЕРЫ
Пример 1 - Материалы и Методы.
Взрослые крысы женского пола Sprague-Dawley, каждая весом приблизительно 280 г, были использованы в течение эксперимента и акклиматизированы в течение от одной до двух недель перед использованием в эксперименте.
В качестве источника рентгеновских лучей использовали прибор Westinghouse Coronado Therapeutic machine. Прибор использовали при 200 Kvp, 15 mA, дистанции цель-к-коже 1-2 метра и фильтрационным пучком лучей 2,6 мм A1. Иррадиация и пробная экспозиция производились на здоровых, неанестезированных крысах, помещенных в пластиковые кабины, которые содержали 6-9 особей. Выход рентгеновских лучей контролировали Vietoreen condenser-R chamber, помещенным близко к животным. Дозу, адсорбированную костным мозгом, подсчитывали, используя константу, 1R=0,88 ± 0,05 (среднее ± погрешность) сГр, как показано в ранних исследованиях (Gong et al., "Effects of Low-Level (1,0 R) X-Irradiation on the Erythroid Response of the Rat Bone Marrow", Radiation Research, vol. 65:83-97 (1976), раскрытие которого внесено здесь в ссылки. Коротко, дозу определяли путем внесения пары термолюминесцентных дозиметров ("TLD"), содержащих CaF2 (MN) порошок, запаянный в пластиковую трубку, в бедро убитой крысы, иррадиируя затем одномоментно с TLD в открытый воздух совместно с Victoreen condenser-R chamber и сравнивая результирующие подсчеты.
Были использованы две главные группы крыс, одна - для сопоставления доз рентгеновских лучей с уровнями нормобластов (предшественники красных кровяных клеток ("RBCp") в костном мозге на 7 неделе после иррадиации, и другая - для сопоставления дозы рентгеновских лучей с клетками, несущими трансфериновый рецептор ("TR"), подкласса эритроцитов крови, на 21 неделе после иррадиации. В дополнение двум дополнительным группам животных вводили 600 сГр и анализировали на TR клетки спустя 7 и 30 недель. Данные TR клеток для крыс, экспонированных 600 сГр и анализированных на 6, 21 и 30 недели, использовали для определения уровня восстановления и для установления Т-1/2 восстановления мутаций гематопоэтических стволовых клеток, индуцированных рентгеновскими лучами.
Пример 2 - Подсчет RBCp костного мозга.
Одиннадцать групп крыс из двух исследований, одна описанная (Gong (1983)) и одна новая, 10 групп, иррадиированных рентгеновскими лучами (600, 450, 300, 150, 9, 1.3, 1.0, 0.5, 0.13 и 0.2 сГр) и одна неэкспонированная контрольная группа были использованы для подсчета RBCp (нормобластов) в костном мозге. На 7 пост- иррадиационной неделе крыс забивали, удаляли бедра с каркасов и получали пробы из проксимальных эпифизов скальпелем номер 2. Каждую пробу костного мозга диспергировали в капле сыворотки распыляли на сухие, чистые стеклянные полоски для микроскопа и оставляли с красителем Wright-Giemsa. Пробы из одиннадцати групп крыс анализировали визуально на предмет морфологического клеточного перечисления под световым микроскопом. Для каждой крысы подсчитывали пять стеклянных полос (приблизительно 1000 гемопоэтических клеток каждая) для определения процента нормобластов. Для каждой цели гематопоэтические нуклеированные клетки костного мозга классифицировали как либо эритроидные (RBCp), либо неэритроидные (нейтрофильные и т. д. ). Данные, выраженные как% нуклеированных RBCp общей популяции гемопоэтических клеток, показаны в Таблице 4 и изображены на Фигуре 4.
Пример 3 - Подсчет трансферриновых рецепторов
Шесть групп из пяти крыс каждая иррадиировали 600, 450, 300, 70, 5,7 и 0,1 сГр рентгеновской радиации. Седьмая группа, использованная как контроль, была обработана тем же образом, но не иррадиирована. После двадцать одной недели у каждой крысы были отобраны пять мкл крови (надрезом на хвосте) и разбавлены в 1 мл фосфатного буфера на физиологическом растворе ("PBS"). Были помечены три пробирки и к каждой добавлено 30 мкл PBS. Пятьдесят мкл разведения 1: 100 (PBS) антикрысиных трансфериновых антител и 20 мкл разбавленной крови помещали в пробирку 2. К пробирке 3, контрольной, добавляли 50 мкл вторых антител в разведении 1:100, lgG2a и 20 мкл разбавленной крови. Пустая пробирка (пробирка 1) содержала только 100 мкл PBS. Пробирки инкубировали на льду в течение 60 минут. К каждой пробирке добавляли три мл PBS, затем смешивали и центрифугировали. Супернатанты осторожно сливали и добавляли к пробиркам 2 и 3500 мкл флуоресцеин-конъюгированных антител в разведении 1: 500 (козлиных антимышиных IgG+IgM, FITC) в PBS. После 30 минут инкубации на льду к каждой пробирке добавляли 3 мл PBS, затем смешивали и центрифугировали. Супернатанты осторожно сливали и ресуспендировали осадок в 500 мкл PBS. Пробы наносили на проточный цитометр Becton Dickinson FACSCANTM. Используя головной распылитель для измерения размера клеток и боковой распылитель для оценки гранулярности клеток, проточный цитометр был настроен для мониторинга только популяции эритроцитов. Определяли флуоресценцию каждого эритроцита, захватом 490 нм радиации и выбросом для эритроцитов. Были сделаны пробы 10000 эритроцитов и подсчитаны те, чья флуоресценция была больше, чем таковая контроля (пробирка 3). Числа эритроцитов с белком трансферинового рецептора на их поверхности на 10000 эритроцитов для каждой исследованной крысы сведены в Таблицу 5. Результаты, полученные к 7 неделе после иррадиации с использованием стандартной кривой распада и полувремени восстановления к 30 неделе (Пример 6) и выраженные как увеличение процента количества маркированных клеток представлены в Таблице 2 и на Фигуре 2.
Пример 4 - Статистический Анализ
Для установления статистической значимости повышенного уровня TR клеток в циркулирующей крови иррадиированных крыс использовали анализ варианс ("ANOV"). Процедура обеспечивает объективное сравнение данных для определения значимости явных различий среди различных наборов результатов. Анализ, суммированный в Таблице 6, показывает, что значение F, соотношение "большей вариансы оценки", поделенное на "меньшую вариансу оценки", составляло 213 со степенью допущения 33. Это показывает высоко значимые (P < 0,0001) различия среди групп сравнения. Поэтому эффекты различных доз радиации имеют сильно выраженное влияние на TR клеточность в крови.
Для дальнейшей оценки и более точной документации того, что все 21 из возможных радиационных пар доз (от нуля до 600 сГр) приводили к существенным различиям в уровнях процента клеток TR, к данным был применен тест множественного ранжирования Дункана. Результаты, показанные в Таблице 7, демонстрируют, что все 21 пар доз имели значимо различные проценты клеток TR (P < 005). Эти аналитические методы демонстрируют, что число циркулирующих эритроцитов, имеющих рецепторы трансферрина, может быть использовано как индекс ионизирующей радиации, абсорбированной на костном мозге.
Пример 5 - Взаимодействия между RBCp и TR клетками
Очевидно, что ответы (увеличения) RBCp и TR клеток в ответ на ионизирующую радиацию количественно и качественно схожи, если не существенно идентичны. Каждый параметр, конечно, имеет свою собственную математическую основу и числовой ранг значений. Не является неожиданным, как и хорошо известным, что RBCp является прямым потомком гематопоэтических стволовых клеток ("HSC") и также непосредственным предшественником циркулирующих эритроцитов с TR клетками, представляющих собой специфический класс популяции красных кровяных клеток. Поскольку первичной целью радиационного поражения является HSC (смотрите Пример 6 ниже), эти факты ясно показывают, что протяженность мутагенных эффектов, влияющих на гематопоэтические стволовые клетки, может быть снижена либо степенью увеличения RBCp в костном мозге, либо усилением TR клеточности в крови. Таким образом, избыток либо предшественников красных кровяных клеток (костный мозг), либо TR клеток (кровь) может быть использован как проба или индекс мутагенного статуса HSC. Однако вследствие повсеместного присутствия циркулирующей крови, легкого получения проб, ее гомогенности и ничтожно малого объема, требуемого для анализа на проточном цитометре, проба на TR клеточность может оказаться идеальной для либо выживания индивидуумов, либо для массивного скрининга больших популяций. Также возможно, что, поскольку многие соединения и химические вещества классифицируют как "радиомиметические", предлагаемый способ может быть адаптирован для использования в качестве шкалы для подсчета степени мутирования стволовых клеток, т.е. измерения мутагенных эффектов HSC, выраженных на радиометрической шкале.
Пример 6 - Полужизнь для восстановления мутаций гематопоэтических стволовых клеток.
Результаты анализа TR клеток, проведенного на 7, 21 и 30 недели после экспозиции на пяти иррадиированных 600 сГр крысах, представленные на Фигуре 5, выявили экспоненциальную кривую с уровнем редукции 1/2 повышенного числа TR клеток на 30 неделе. Индуцированные рентгеновскими лучами мутагенные изменения гематопоэтических стволовых клеток, таким образом, имеют полужизнь 30 недель, подсчитанную или выраженную путем понижающихся чисел (возвращение к базальным уровням) TR клеток на 10000 красных клеток в крови. Другие исследования показали сходные значения полужизни для восстановления повреждений, вызванных рентгеновской радиацией у гематопоэтических клеток костного мозга. У Gong (1969), раскрытие которого внесено здесь в ссылки, было установлено Т-1/2 29 недель для супрессированного нормобластического ответа (т. е. повышение выше нормального RBCp в общем скелете) после флеботомии животных, предварительно экспонированных рентгеновским лучам при 150 сГр и наблюдаемых в течение 60 недель. У Gong (1976), раскрытие которого внесено здесь в ссылки, 30 недель были отобраны для Т-1/2 для экспрессии более низкого, чем нормальное повышение RBCp у крыс, экспонированных 0,9 сГр рентгеновских лучей, и далее произведенного кровопускания и последовавших 10 недель.
Из этих наблюдений могут быть сделаны два вывода: (1) Сходные значения Т-1/2 для обоих параметров (дефициты в RBCp ответе у обработанных рентгеновскими лучами крыс с последующей флеботомией и возрастание TR клеток у иррадиированных, но не истекающих кровью животных) означает, что анализы для обоих параметров могут служить как пробы или шкала для оценки мутационного статуса гематопоэтических стволовых клеток. (2) Практически идентичный период Т-1/2, индуцированный 3 значимо различными дозами радиации (0,9, 150 и 600 сГр) показывает, что уровень репарации мутаций HSC является независимым от величины дозы рентгеновского излучения, индуцировавшего изменения.
Пример 7 - Инвариант времени популяции TR клеток у человека.
От пяти доноров были собраны пробы крови. Все не имели случаев экспозиции радиации, кроме случайных обработок при лечении зубов. Для тестирования репродуктивности и стабильности индивидуальных уровней циркулирующих TR клеток отбирали пробы крови у волонтеров в начале и еще один раз 10 дней спустя. Результаты, показанные в Таблице 8, не показывают значительных различий в числе клеток, несущих рецептор трансферрина ("меченые клетки"), между первым и вторым анализом. Средние числа клеток, несущих трансферриновые рецепторы на 10000 циркулирующих эритроцитов составили (среднее ± SD) 1390 ± 23 и 1306 ± 20 соответственно.
Пример 8 - Анализ трансфериновой клеточности у человека.
Пробы крови от шести пациентов, которые проходили или имели недавно завершенный радиационный протокол в Буффало, New York Hospital, ни один из которых не имел истории гематологических злокачественных заболеваний или расстройств, разбавляли (5 мкл/мл) в PBS. Для каждой пробы добавляли 30 мкл PBS к каждой из трех пробирок, помеченных 1, 2 и 3. 50 мкл помеченных FITC античеловеческих антител рецептора трансферина и 20 мкл разбавленной крови помещали в пробирку 2. К пробирке 3, контрольной, добавляли 50 мкл помеченных FITC lgG2a в разведении 1:100 и 20 мкл разбавленной крови. Пробирка 1, объем которой был доведен до 100 мкл PBS, служила слепым контролем. Три пробирки инкубировали на льду в течение 60 минут и к каждой затем добавляли 3 мл PBS. После смешивания пробирки центрифугировали, сливали супернатант и оставшийся осадок ресуспендировали в 500 мкл PBS.
Пробы наносили на проточный цитометр Becton Dickinson FACSCANTM, настроенного на популяцию эритроцитов с использованием головного и бокового распылителей. Флуоресцентную эмиссию 10,000 эритроцитов, возбужденных радиацией при 490 нм, мониторировали при 514 нм. Подсчитывали эритроциты, проявляющие флуоресценцию более, чем таковая слепой пробы. Фракция флуоресцентно помеченных клеток означала фракцию клеток, несущих рецепторы трансферрина на своих мембранах.
Фракция клеток, несущих TR в каждой пробе крови, коррелировавшая с полученной ее донором радиацией, представлена в Таблице 9 и Фигуре 5. Дозировки были оценены из количества терапевтической кобальт-60 рентгеновской радиации, полученной каждым донором, как отмечено в записях лечения доноров. Когда радиация была направлена только на фракцию общего скелетного мозга, оценивали фракцию активного "красного" мозга в месте лечения в поле радиационного пучка. Используя эту оценку, приспосабливали дозировку для получения дозировки всего тела. Например, когда для лечения опухоли груди у пациентки использовали 5200 сГр радиации, было подсчитано, что прилегающие кости, которые содержали 10,2% общего красного костного мозга пациента, были иррадиированы в процессе. Далее, средняя доза для общего красного мозга пациента составила 530 сГр (5200 сГр x 0,102). Число меченых клеток (на 10000 эритроцитов) в этом случае составило 1,260 TR клеток.
Как показывают данные, иррадиированные люди демонстрируют повышенные уровни эритроцитов, несущих рецептор трансферина. Более того, данные показывают, что отношение доза - ответ было достаточно чувствительным при ранге от 10 до 600 сГр для обеспечения практического измерения дозы. Далее, схожесть кривых ответа на дозу у крыс и человека (которые показаны на Фигуре 6) означает, что клеточные ответы на радиацию сопоставимы.
Несмотря на то, что изобретение описано в деталях для целей иллюстрации, очевидно, что такое детальное описание использовано только для иллюстрации, и при этом могут быть сделаны варианты профессионалами в области без изменения сути и пределов изобретения, которое определено следующей формулой изобретения.




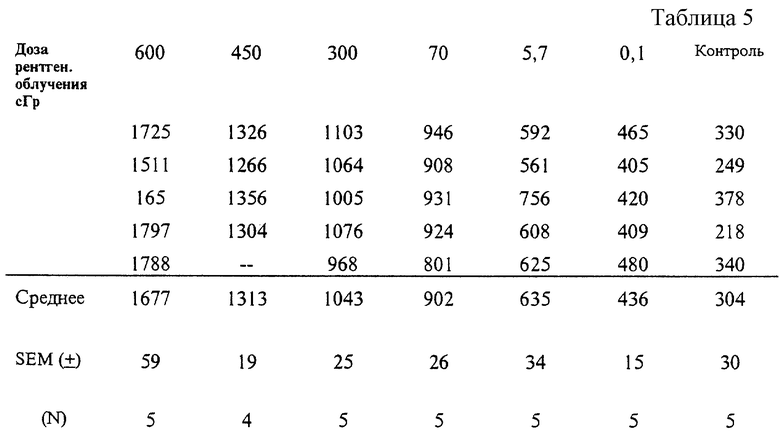











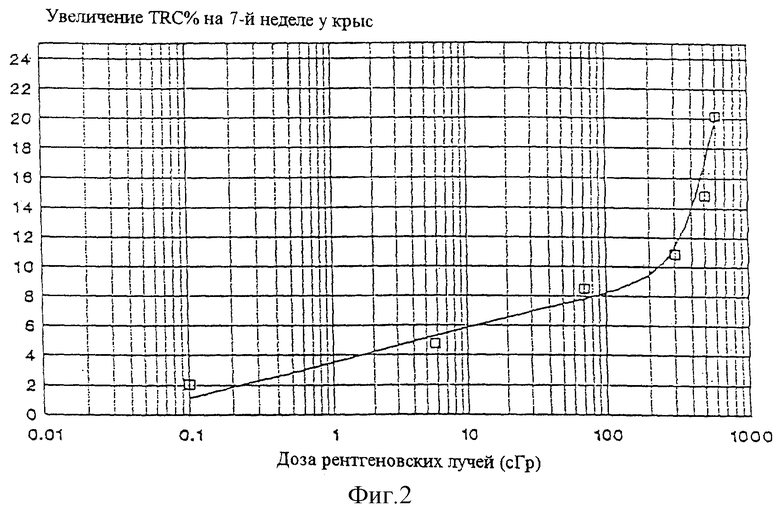
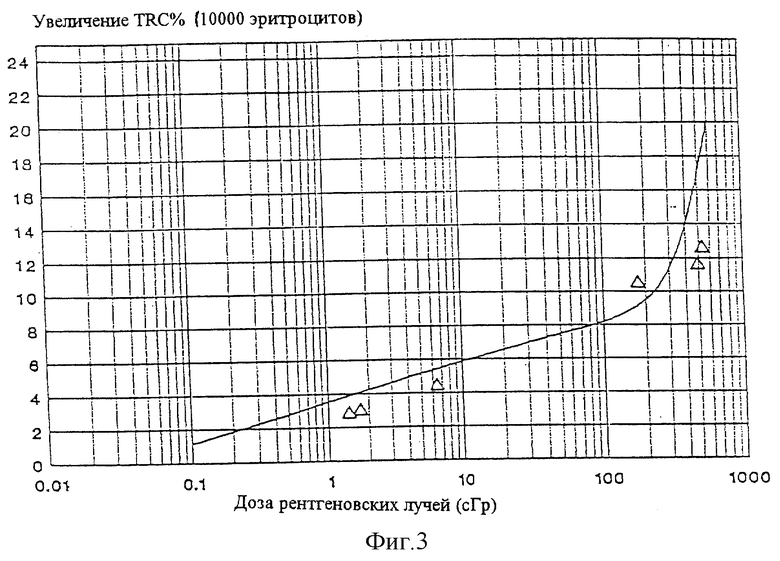
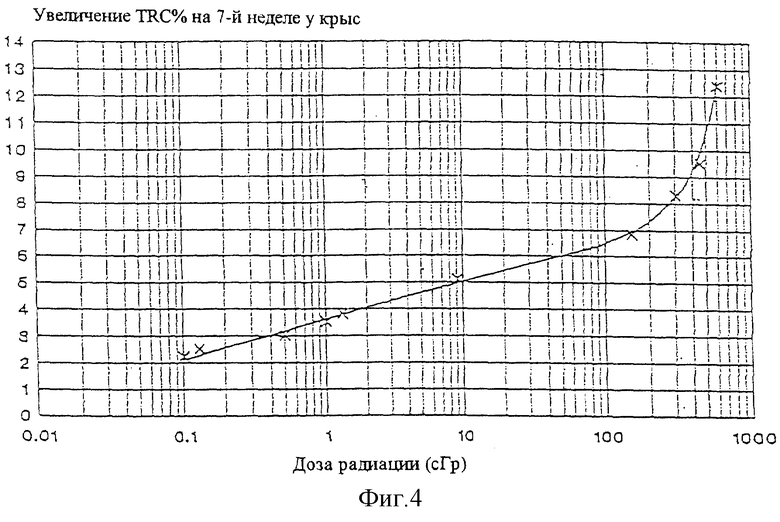
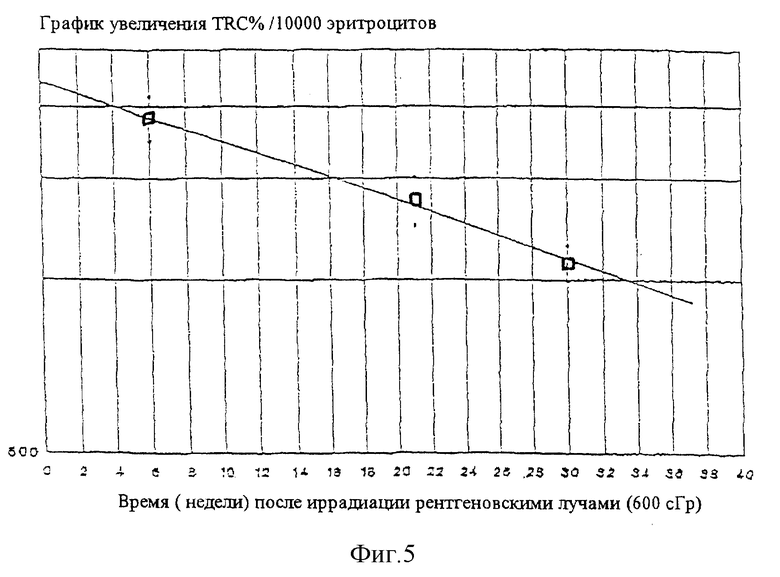
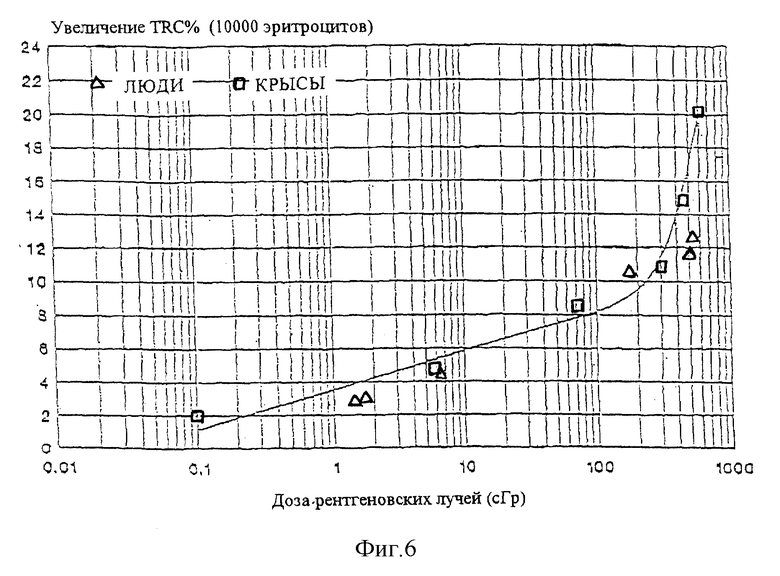
Изобретение относится к области медицины. Сущность изобретения состоит в том, что количество трансфериновых рецепторов на красных кровяных клетках млекопитающих определяется с помощью меченых антител. Количество трансфериновых рецепторов на красных кровяных клетках млекопитающих соотносится с предшествующим воздействием на млекопитающих. 3 c. и 18 з.п. ф-лы, 9 табл., 6 ил.
| US 4447547 A, 08.05.1984 | |||
| Под ред | |||
| проф | |||
| И.И.ИВАНОВА | |||
| Обмен веществ при лучевой болезни | |||
| - М.: Медгиз, 1956, с.209-210, 214-218 | |||
| СПОСОБ ПРОТИВОЛУЧЕВОЙ ЗАЩИТЫ ОРГАНИЗМА ЖИВОТНОГО | 1991 |
|
RU2045966C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ЛИЦ, ПОДВЕРГШИХСЯ РАДИАЦИОННОМУ ОБЛУЧЕНИЮ | 1990 |
|
RU1769593C |
| СПОСОБ ОПРЕДЕЛЕНИЯ НАРУШЕНИЙ ПОРФИРИНОВОГО ОБМЕНА | 1992 |
|
RU2034297C1 |
| Способ диагностики поверхностного гастрита у детей | 1982 |
|
SU1067393A1 |
| Способ определения профилактических свойств лечебной грязи | 1985 |
|
SU1455314A1 |
| СПОСОБ ПОДАВЛЕНИЯ ГУМОРАЛЬНОГО И КЛЕТОЧНОГО ИММУННОГО ОТВЕТА | 1990 |
|
SU1748512A1 |
Авторы
Даты
2001-10-10—Публикация
1996-10-21—Подача