Изобретение относится к области ингибирования протеинкиназы, более конкретно к способам ингибирования тирозинкиназы рецептора эпидермального фактора роста, новым бициклическим производным пиримидина, фармацевтической композиции, обладающей ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, и композиции, обладающей контрацептивным действием.
Поверхностные клеточные рецепторы семейства тирозинкиназных рецепторов эпидермального фактора роста (EGFR) играют роль в ряде заболеваний, например раковых заболеваний. Это семейство состоит из EGF рецептора (также называемого Erb-B1), Erb-B2 рецептора и его существенно активного онкопротеинового мутанта Neu, Erb-В3 рецептора и Erb-B4 рецептора. EGFR имеет в качестве наиболее важных лигандов эпидермальный фактор роста (EGF) и трансформирующий фактор роста альфа (TGF альфа). По-видимому, рецепторы проявляют только минимальные функции у взрослых людей, но возможно вовлекаются в процесс заболевания в значительной части всех видов рака, особенно рака ободочной кишки и груди. Близко родственные рецепторы Erb-B2, Erb-В3 и Erb-B4 имеют в качестве основных лигандов семейство герегулинов, а рецептор сверхэкспрессии и мутации был четко определен как основной фактор риска при плохом прогнозе рака груди. Кроме того, также было показано, что все четыре члена этого семейства рецепторов могут образовывать гетеродимерные сигнальные комплексы с другими членами семейства и что это может привести к синергической трансформирующей способности, если более одного члена семейства проявляет сверхэкспрессию при злокачественной опухоли.
Сверхэкспрессия более чем одного члена семейства, как было показано, является относительно обычной для злокачественных опухолей у людей.
Пролиферативное заболевание кожи псориаз в настоящее время не может успешно лечиться. Его часто лечат противораковыми средствами, такими как метотрексат, который имеет очень серьезные побочные эффекты и который является не очень эффективным при ограниченных токсичностью дозах, которые могут быть использованы. Полагают, что TGF альфа является основным фактором роста, сверхпродуцирующим при псориазе, поскольку у 50% трансгенных мышей, которые сверхэкспрессируют TGF альфа, развивается псориаз. Это наводит на мысль, что хороший ингибитор EGFR сигнализации может быть использован в качестве противопсориазного средства, предпочтительно, но не обязательно, при местном дозировании.
EGF является мощным митогеном для клеток почечных канальцев. Четырехкратное увеличение как EGF секреции мочи, так и EGF и мРНК было отмечено у мышей на ранней стадии диабета, вызванного стрептозойцином. Кроме того, повышенная экспрессия EGFR была отмечена у пациентов с пролиферативным гломерулонефритом (Roychaudhury и др., Pathology, 1993, 25, 327).
Сообщалось, что хронический панкреатит коррелирует с большим увеличением экспрессии как EGFR, так и TGF альфа. (Korc и др., 1994, 35, 1468). У пациентов с более серьезной формой заболевания, обычно при увеличении верхней части поджелудочной железы, также была показана сверхэкспрессия Erb-B2 рецептора (Friess и др., Ann. Surg. 1994, 220, 183).
В процессах созревания бластоцита, имплантации бластоцита в маточный эндометриум и в других случаях переимплантации ткани матки продуцируют EGF и TGF альфа (Taga Nippon Sanka Fujinka Gakkai Zasshi, 1992, 44, 939), имеют повышенные уровни EGFR (Brown и др., Endocrinology, 1989, 124, 2882) и легко могут быть индуцированы на продуцирование гепарин-связующих EGF за счет близости развившегося, но не прекратившего развития бластоцита. (Das и др., Development, 1994, 120, 1071). В свою очередь, бластоцит имеет достаточно высокий уровень TGF альфа и EGFR экспрессии (Adamson, Mol. Reprod. Dev., 1990, 27, 16). Хирургическое удаление подчелюстных желез, основного участка секреции EGF в организме, и лечение анти-EGFR моноклональными антителами, обе меры значительно снижают фертильность мышей (Tsutsumi и др. J. Endocrinology, 1993, 138, 437) за счет успешного снижения имплантации бластоцита.
Известны бис-моно- и бициклические ариловые и гетероариловые соединения, которые можно применять для ингибирования тирозинкиназы рецептора эпидермального фактора роста и/или рецептора фактора роста тромбоцитов (см. заявку WO 92/20642, C 07 C 43/21, A 61 K 31/44, 31/50, 31/495, 26.11.1992 г.).
Задачей изобретения является расширение арсенала возможностей ингибирования тирозинкиназы рецептора эпидермального фактора роста, например Erb-b2, Erb-b3 или Erb-b4.
Поставленная задача решается нижеописанными объектами.
Первым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении млекопитающего путем введения млекопитающему бициклического производного, который заключается в том, что в качестве бициклического производного используют бициклическое
производное пиримидина общей формулы (I)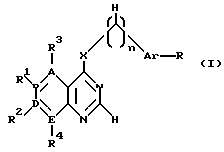
где 1-2 из радикалов A - E означает азот, а остальные радикалы углерод, или два смежных радикала A - E вместе представляют гетероатом из группы азот, сера, при этом A - E вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо,
X - группы NH, NHR5, где R5 означает низший алкил с 1 - 4 атомами углерода,
n - 0, 1 или 2,
R - отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппа, моно- или диалкиламиногруппа с 1-4 атомами углерода в каждой алкильной группе,
Ar - фенил, тиенил,
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1 - 4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1 - 4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1 - 4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1- 4 атомами углерода или алкоксила с 1-4 атомами углерода, б) если E и В означают азот, D и A - углерод, R1 и R4 отсутствуют, R3 - водород, X - NH, n - 0,1 или 2, Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и
Ar тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части, или его фармацевтически приемлемую соль в эффективном количестве.
Предпочтительные признаки предлагаемого способа включены в подпункты 2 - 50 формулы изобретения.
Вторым объектом изобретения являются бициклические производные пиримидина вышеприведенной формулы (I),
где
R - R4, X, Ar, A, B, D, E и n имеют вышеуказанные значения, при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода, б) если E и B означают азот, D и A - углерод, R1 и R4 отсутствуют, R3 - водород, X - NH, n - 0,1 или 2, Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1 - 4 атомами углерода в каждой алкильной части, их отдельные стереоизомеры, рацемат или смесь диастереомеров или их фармацевтические соли или гидраты.
Предпочтительными бициклическими производными пиримидина формулы (I) являются соединения, выбранные из группы, включающей 6-амино-4-(3-броманилино)пиридо[3,2-d] пиримидин; 4-(3- броманилино)-6-метиламинопиридо[3,2-d] пиримидин: 4-(3- броманилино)-6-диметиламинопиридо[3,2-d]пиримидин; 7-амино-4-(3- нитроанилино)пиридо[4,3-d]пиримидин; 7-амино-4-(3-броманилино) пиридо[4,3-d] пиримидин; 7-амино-4-(4-броманилино)пиридо[4,3- d]пиримидин; 7-амино-4-(3-трифторометиланилино)пиридо[4,3- d]пиримидин; 7-ацетиламино-4(3-броманилино)пиридо[4,3- d]пиримидин; 7-ацетамидо-4-бензиламинопиридо [4,3-d] пиримидин; 4-(3-броманилино)-6-диметиламинопиридо[3,4-d)]пиримидин.
Третьим объектом изобретения является фармацевтическая композиция, обладающая ингибирующей тирозинкиназу рецептора эпидермального фактора роста активностью, которая в смеси с фармацевтически приемлемым эксципиентом, разбавителем или носителем включает бициклическое производное пиримидина вышеприведенной общей формулы (I) или его фармацевтическую соль в эффективном количестве.
Четвертым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста при лечении раковых заболеваний, псориаза, панкреатита или почечных заболеваний путем введения млекопитающему бициклического производного пиримидина вышеприведенной общей формулы (I) или его фармацевтически приемлемой соли в эффективном количестве.
Данный способ может также применяться при лечении псориаза, панкреатита или почечных заболеваний.
Пятым объектом изобретения является способ ингибирования тирозинкиназы рецептора эпидермального фактора роста для предотвращения имплантации бластоцита путем введения млекопитающему бициклического производного пиримидина вышеприведенной общей формулы (I) или его фармацевтически приемлемой соли в эффективном количестве.
Шестым объектом изобретения является композиция, обладающая контрацептивным действием, которая включает в смеси с контрацептивно приемлемым эксципиентом, разбавителем или носителем бициклическое производное пиримидина вышеприведенной общей формулы (I) или его фармацевтическую соль в эффективном количестве.
Бициклические производные пиримидина вышеприведенной общей формулы (I) можно получать известными способами, например представленными на схемах I - XIX (см. в конце описания), в которых Ar означает замещенный фенил или тиенил.
Замещение 2-хлора в 2,6-дихлор-3-нитропиперидине проводят с помощью цианида одновалентной меди в N-метил-2-пирролидоне (NМП). Замещение второго хлора в этом нитриле на фторид на этой стадии может быть предпочтительным. Затем проводят мягкое восстановление нитрогруппы в условиях, когда галоген не гидролизуется. Гидролиз нитрила с последующей кристаллизацией орто-формита и хлорирование по типу Вильсмейера приводят к дигалогенпиридопиримидину. Замещение более реактивного 4-хлора на соответствующий амин проводят после замещения 6-галогена на соответствующий нуклеофил для образования конечных продуктов. Данным способом можно получать также соединения, у которых один из R1 или R2 означает водород, а другой является низшим алкоксилом; или один из R1 или R2 является водородом, а другой - аминогруппой: или один из R1 или R2 означает водород, а другой является низшей моно- или диалкиламиногруппой; или один из R1 или R2 означает водород, а другой - низший алкил.
Замещение хлора в 2-хлор-3,5-динитропиридине проводят с помощью цианида меди в NМП. Восстановление нитрогрупп в аминогруппы проводят после гидролиза нитрила в амид. Его циклизуют в пиримидон с помощью ортоформиата, который превращают в хлорид с помощью хлорангидрида ортофосфорной кислоты, или при желании превращают в тиометильное производное путем обработки пентасульфидом фосфора, потом метилйодидом и мягким основанием. Замещение соответствующим амином дает целевое 7-аминосоединение. Аминная функция может быть восстановительно алкилирована или активирована диазотированием аминогруппы в кислых или щелочных условиях, затем восстановлена в гидразид или превращена в низший алкил, простой эфир или в галоген при действии купрата или сочетанием Стилла по методикам, известным специалистам в данной области. Альтернативно, амин может быть восстановительно аминирован с образованием алкиламинной боковой цепи. Данным способом можно также получать соединения, упомянутые выше в связи с описанием схемы I.
Обработка ЛДА (диизопропиламид лития) с последующей обработкой боратом/пероксидом водорода позволяет ввести 3-гидрокси-заместитель. Если пиридин подвергают 2-му металлированию в положении 4, спирт может быть защищен как ТИПС (триизопропилсилиловый) простой эфир, который будет вызывать второе металлирование в положении 5. Могут быть использованы альтернативные нитрования, такие как превращение литиевого промежуточного производного в станнан и обработка тетранитрометаном, или использование NO2BF4 (нитроний-тетрафторборат). C1 - замещение может быть проведено с использованием цианида одновалентной меди или других источников ионов цианида. После гидролиза нитрила и восстановления нитрогруппы может быть использован ортоформиат вместо формамида для циклизации и, возможно, что некоторые циклизации будут требовать замещения F на MeS перед реакцией. Положение 4 активируют хлорированием, а затем вводят амин с боковой цепью. Окончательное замещение может быть выполнено с помощью алкоксидных или аминных нуклеофилов. Данным способом можно также получать соединения, у которых R1 и R2 являются низшими алкоксилами; один из R1 или R2 означает аминогруппу, а другой является низшим алкоксилом; или один из R1 или R2 означает моно- или диалкиламиногруппу, а другой - низший алкоксил.
Применение 6-алкилхинальдиновой кислоты после ионного бромирования в жестких условиях дает ангидрид, который раскрывают аммиаком, рециклизуют в имид и затем проводят разложение по Гофману с потерей активного карбонила. Циклизацию и присоединение циклической боковой цепи обычным образом проводят путем сочетания по Стиллу для введения алкильной группы, радикала R1 и/или R2.
Динитрование 2,6-диоксипиридина проводят для превращения в очень реактивное дихлорсоединение. Динитродихлорпиридин просто замещают цианидом одновалентной меди в ММП, а затем соединение восстанавливают в мягких условиях в диамин. Нитрил гидролизуют до амида, который затем циклизуют в пиридопиримидон, который хлорируют обычным путем. Замещение более реактивного хлора в 4-боковой цепи проводят после замещения 6-хлора алкоксидом. Для получения соединений, у которых R1 или R2 означает моно- или диалкиламино, а другой - низший алкоксил, амин должен быть соответственно алкилирован по методикам, известным специалистам в данной области.
2,4-Диамино-5-цианопиридин может быть циклизован непосредственно во многие производные 4-бензиламинопиридопиримидина при обработке бензиламином и муравьиной кислотой при высокой температуре. Для менее нуклеофильных аминов 2,4-диамино-5-цианопиридин превращают путем обработки этилортоформиатом/уксусным ангидридом, последующей циклизацией с помощью гидросульфид-иона в безводных условиях с получением 7-амино-4-тионо-3Н-пиридо/4,3-d/-пиримидина. S-алкилирование и замещение соответствующим амином дают целевой продукт. Если R2 не является аминогруппой, амин может быть ацилирован или восстановительно алкилирован. Альтернативно, 2,4-диамино-5-цианопиридин может быть гидролизован в соответствующий амид и эта группа может быть циклизована в 7-амино-4-оксо-3Н-пиридо/4,3-d/-пиримидин с помощью ортоформиата. Диазотирование 7-аминогруппы и замещение фтором позволяют ввести другие аминные и алкоксидные нуклеофилы в конце синтеза, после того как заместитель был введен обычным образом. Диазотирование и замена аминогруппы бромом позволяют провести сочетания Стилла в положении 7.
Данным способом можно получать соединения, у которых R2 означает низший алкил, низший алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу.
2-Хлор-5-нитропиридин превращают в соответствующее 2-фторсоединение с помощью фторида калия в диметилсульфоксиде. Восстановление нитрогруппы с последующей обработкой Boc-ангидридом (Boc = трет.-бутоксикарбонил) дает Вос-аминопроизводное, которое металлируют и карбоксилируют в 4-положении. Удаление Boc-группы с помощью трифторуксусной кислоты и циклизация пиримидонового цикла формамидом дают 6-фтор-4-оксо-3H-пиридо(3,4-d)пиримидин. Его хлорируют в положении 4 обычным образом и вводят 4-боковую цепь через замещение соответствующим амином. Замещение 6-фтора соответствующими нуклеофилами приводит к различным конечным продуктам. Если фтор замещают на тиометоксид, то он, в свою очередь, может быть замещен алкильными группами в катализируемых никелем замещениях Гриньяра. Данным способом можно получать соединения, у которых R1 означает низший алкил или алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу.
Нитрование 2-метоксиникотиновой кислоты с последующим замещением активированной метоксигруппы и циклизацией пиримидонового цикла можно проводить в одну стадию с помощью формамидина, или, альтернативно, в две стадии с помощью аммиака с последующей циклизацией с помощью эквивалента формамида. Карбонил превращают в хлорид и замещают боковой цепью обычным способом, а затем селективно восстанавливают нитрогруппу в аминогруппу. Она может быть алкилирована, ацилирована или диазотирована. Диазосоединение может быть превращено в гидроксильное или в бромидное или иодидное соединения, и эти последние могут быть введены в реакцию сочетания Стилла для введения низшего алкила, алкоксила, аминогруппы, моно- или диалкиламиногруппы радикала R1.
Этот путь использует известное металлирование и карбоксилирование 2,6-дифторпиридина с последующим замещением 2-фтор-заместителя. Циклизация пиримидонового кольца с помощью формамида, последующее превращение карбонила в хлорид обычным способом дает хлорфторпиридопиримидин. Арил(алкил)аминная боковая цепь вводится путем замещения более реактивного пиримидинового хлора, затем вводят заместитель R2 путем фторидного замещения. Для введения алкила используют замещение фтора алкоксидом, последний простой эфир расщепляют до пиридона, проводят O- трифлатирование и сочетание Стилла. Данным способом получают соединения, у которых R2 означает низший алкил или алкоксил, аминогруппу, моно- или диалкиламиногруппу.
Эта схема основана на металлировании 2,6-дифторпиридина подобно схеме IX. Первое металлирование используют для введения кислорода, а второе - для введения карбоновой кислоты. Если требуется провести второе металлирование в положении 5, кислород может быть защищен как очень массивный ТИПС-простой эфир и может потребоваться более сильное основание, чем ЛДА. Аммиак вводят в положение 2 при высокой температуре и давлении, циклизуют пиридоновое кольцо, активируют в положении 4 обычным способом, а затем замещают в положении 4 боковой цепью. Замещение 7-фтор-заместителя соответствующим нуклеофилом, последующие превращения, как описано в предыдущих схемах, завершают синтез. Данным способом можно также получать соединения, у которых R1 и R2 означают низший алкоксил, или один из R1 и R2 означает аминогруппу, а другой является низшим алкоксилом, или один из R1 или R2 означает низшую моно- или диалкиламиногруппу, а другой означает низший алкоксил.
Нитрование коммерчески доступной дихлорникотиновой кислоты проводят путем селективного замещения более реактивного хлора в мягких условиях, а затем более жесткого замещения другого хлора в соответствующем порядке. Полученную в результате 6-алкокси-2- амино-5-нитроникотиновую кислоту циклизуют в пиримидон и превращают 4-карбонил в хлорид и замещают обычным образом на подходящий амин, получая 4-амино-7-алкокси-6-нитропиридо(2,3-d) пиримидин. Восстановление нитрогруппы с последующим любым желаемым алкилированием дает целевые продукты.
Реакция подходящей S-алкилизотиурониевой соли с метоксиметилидинмалоно-нитрилом приводит к полностью функционализированному пиримидиновому предшественнику. Первоначально образовавшийся пиримидин может быть замещен по S-этильной группе на R2 до или после гидролиза нитрила, если замещение или окисление позже оказывается проблематичным. Замещение S-этильной группы также может быть достигнуто без окисления для активации серы. Циклизацию второго пиримидинового цикла проводят после активации 4-карбонила осернением и алкилированием. Даже если 7-тиогруппа не была замещена в этот момент, предпочтительно происходит введение 4-амино-боковой цепи. Данным способом можно получать соединения, у которых R2 означает низший алкоксил, низшую моно- или диалкиламиногруппу или аминогруппу.
3H-тиено(3,2-d)пиримид-4-он может быть получен по стандартным методикам из коммерчески доступного этил-3-аминотиофенкарбоксилата и формамида. Превращение карбонила в хлорид по стандартным методикам с последующим замещением подходящим амином дает целевые тиено(3,2-d)пиримидины. Если R2 не является водородом, подходящий электрофил, например нитрогруппа, для заместителей, основанных на аминогруппе или диазотированных производных, или бром для конечных продуктов, получаемых сочетанием Стилла, может быть введен на показанной или более ранней стадии, а затем превращен в R2 путем восстановления или аминирования, например, или с помощью сочетания Стилла, или другими известными специалистам в данной области способами. Данным способом можно также получать соединения, у которых A и B означают углерод, a D и E, взятые вместе, означают атом серы, R1 или R2 означают водород, низший алкил, низший алкоксил, амино или низшую моно- или диалкиламиногруппу.
Тиено(2,3-d)пиримид-4-он получают путем синтеза Гриньяра из 2,5-дитиана и этилцианоацетата с последующей циклизацией с формамидом. Превращение карбонила в хлорид по стандартным методикам с последующим замещением подходящим амином дает целевые тиено(2,3-d)пиримидины.
Для получения пирроло(2,3-d)пиримидина циклизуют пиримидиновый цикл в цианоаминопиррол известными способами. Активация и замещение тиола боковой цепью могут быть проведены до или после возможного электрофильного замещения пиррольного цикла. Данным способом можно также получать соединения, у которых A и B, взятые вместе, означают атом азота, a D и E означают углерод, R1 или R2 означают водород, низший алкил, низший алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу.
Получение пирроло(3,2-d)пиримидина проводится с помощью известной конденсации ортоформиата с подкисленной 4-метильной группой 6-пиримидонов с образованием пирролопиримидина, как показано выше. Боковая цепь может быть введена по стандартным методикам, таким как в схеме 1, и заместитель R2 может быть введен по стандартной методике в химии электрофильного замещения, как описано выше.
Эти соединения могут быть получены при непосредственном замещении галогена в соответствующих 6-хлорпуринах по хорошо известным из уровня техники методикам. Заместитель R1 может быть введен путем легкого электрофильного замещения в активированном положении 8 пуринового цикла с последующими типами превращений, описанных в нижеприведенных примерах. Данным способом можно также получать соединения, у которых A и B, взятые вместе, означают атом азота, D означает углерод, E означает азот, R1, R3 и/или R4 означают водород или низший алкил, a R2 означает водород, низший алкил, низший алкоксил, аминогруппу или низшую моно- или диалкиламиногруппу.
Реакция 6-хлор-4-метилтиопиримидина с ЛДА и потом с диметилформамидом дает соответствующий 5-альдегид, который обрабатывают гидразином, чтобы замкнуть цикл, получая 4-метилтиопиразоло(3,4-d)пиримидин, при замещении которого соответствующим амином получают целевые производные пиразоло (3,4-d)пиримидина. Данным способом можно получать соединения, у которых R1/4 означают водород, низший алкил, если находятся на азоте, или H, низший алкил, низший алкоксил, амино- или низшую моно- или диалкиламиногруппу, если находятся на углероде.
Нитрование пиразол-3-карбоновой кислоты с последующем восстановлением приводит к 4-аминопиразол-3-карбоновой кислоте. Ее циклизуют в пиразоло(3,4-d)пиримид-4-он с помощью соляно-кислого формамидина и проводят замещение карбонила на галоид по стандартным методикам, затем замещают хлор на соответствующий амин, получая целевой пиразоло(4,3-d)пиримидин.
Получение бициклических производных пиримидина вышеприведенной общей формулы (I) поясняется следующими примерами.
ПРИМЕР 1
4-Анилинопиридо(3.2-d)пиримидин мезилат
3Н-Пиридо(3.2-d) пиримидин-4-OH
Раствор 2,00 г (9,91 ммоля) 6-хлор-3-нитропиколинамида в 100 мл смеси этилацетата с метанолом (1:1) гидрируют на 0,40 г 5%-ного палладия-на-угле при 60 фунт/дюйм2 [= 4,219 кг/см2] в течение 6 дней с добавлением свежего катализатора через 2 и 4 дня. После удаления катализатора фильтрованием раствор концентрируют досуха, получают 3-аминопиколинамид в виде оранжевого масла, которое используют непосредственно на следующей стадии. Сырой продукт перемешивают при кипячении с обратным холодильником в 50 мл триэтилорто-формиата в течение 42 часов; в течение этого времени образуется каштановый осадок. После охлаждения твердый продукт отфильтровывают, тщательно промывают петролейным эфиром и сушат в вакууме, получают 1,27 г (87%) 3Н-пиридо(3,2-d)пиримидин-4-она, т.пл. 343 -345oC.
4-Хлорпиридо(3,2-d)пиримидин
Суспензию 1,00 г (6,80 ммоля) указанного выше пиримидона в 30 мл хлорокиси фосфора кипятят с обратным холодильником в течение 4 часов, затем концентрируют досуха при пониженном давлении. Остаток распределяют между дихлорметаном и насыщенным раствором бикарбоната натрия, отделяют и обрабатывают органический слой, получают 0,97 г (86%) 4-хлорпиридо(3,2-d)пиримидина в виде каштанового твердого продукта, т. пл. 335oC (разложение), который используют без дополнительной характеристики.
4-Анилинопиридо(3,2-d)пиримидин-мезилат
Раствор 84 мг 4-хлорпиридо[3,2-d] -пиримидина (0,5 ммоля), 56 мг (0,6 ммоля) анилина и 62 мг триэтиламина (0,6 ммоля) в 2 мл этанола кипятят с обратным холодильником в атмосфере азота в течение 2 часов. Сырую реакционную смесь очищают препаративной ТСХ (тонкослойная хроматография) на пластинах с диоксидом кремния, элюируют один раз 3% метанола в хлороформе. Экстрагируют основную полосу и выпаривают досуха при пониженном давлении, твердый остаток растворяют в 5 мл ацетона, фильтруют и медленно при перемешивании прибавляют 32 мкл (0,5 ммоля) метансульфоновой кислоты. Остаток собирают фильтрованием, промывают ацетоном и сушат в вакуумной печи; получают 91 мг (57%) 4-анилинопиридо(3,2-d)пиримидин-мезилата в виде матовых желтых игл.
1Н-ЯМР (диметилсульфоксид) δ: 11,75 (1H, с. шир); 9,11 (1 Н, дд, J = 1,5, 4,3 Гц); 8,97 (1H, с); 8,32 (1H, дд, J = 1,5; 8,4 Гц); 8,12 (1H, дд, J = 4,3, 8,5 Гц); 7,88 (2H, д, J = 8,2 Гц); 7,49 (2H, т, J = 8,0 Гц); 7,32 (1H, т, J = 7,0 Гц); 2,34 (3H, с).
ПРИМЕР 2
4-Бензиламинопиридо(3,2-d)пиримидин
Раствор 0,10 г (0,60 ммоля) свежеприготовленного 4-хлорпиридо (3,2-d)пиримидина [полученного, как описано в предыдущем эксперименте] и 0,13 мл (1,20 ммоля) бензиламина в 15 мл пропан-2-ола, содержащий следы концентрированной соляной кислоты, нагревают в течение 30 минут при 50oC, затем концентрируют досуха. Остаток распределяют между водой и этилацетатом, органический слой отделяют и обрабатывают, хроматографируют на силикагеле. Этилацетат элюирует головную фракцию, тогда как смесь метанола с этилацетатом (1:9) элюирует 4-(бензиламино)пиридо[3,2-d)пиримидин (0,11 г, 77%).
1Н-ЯМР (дейтер. хлороформ) δ: 8,67 (1 Н, с); 6,50 (1H, дд, J = 4,3, 1,5 Гц); 8,10 (1H, дд, J = 8,5, 1,5 Гц); 7,63 (1H. дд, J = 8,8, 4,3 Гц); 7,55 (1H, шир.); 7,41-7,29 (5Н, м); 4,86 (2H, д, J = 5,9 Гц).
ПРИМЕР 3
4-(3-Броманилино)пиридо[3,2-d]пиримидин
Проводят реакцию полученного, как описано в предыдущем примере, хлорпиридо(3,2-d)пиримидина с 3-броманилином в пропан-2-оле, содержащем следы концентрированной соляной кислоты при 50oC в течение 30 минут, затем продукт хроматографируют на силикагеле и получают с выходом 87% 4-(3-бромфенил) аминопиридо[3,2-d]пиримидин.
1H-ЯМР (дейтер. хлороформ) δ : 9,19 (1H, ш); 8,83 (1H, с); 8,80 (1H, дд, J = 4,3, 1,5 Гц): 8,29 (1H, шир.); 8,19 (1H, дд, J = 8,5, 1,5 Гц); 7,83 (1H, м); 7,76 (1H, дд, J = 8,5; 4,3 Гц); 7,29-7,27 (2H, м).
ПРИМЕР 4
4-(3-Броманилино)-6-фторпиридо[3,2-d]пиримидин
2-Циано-6-фтор-3-нитропиридин
Смесь 10,0 г (0,054 моля) 6-хлор-2-циано-3-нитропиридина и 9,48 г (0,163 моля) фторида калия в 200 мл ацетонитрила кипятят с обратным холодильником в течение 18 часов при перемешивании, затем выливают в воду и экстрагируют этилацетатом. Экстракт промывают водой и обрабатывают, остаток хроматографируют на силикагеле, элюируют смесью этилацетата с петролейным эфиром (3: 7), получают, после удаления растворителя при пониженном давлении, 7,2 г (79%) 2-циано-6-фтор-3-нитропиридина.
1H-ЯМР (дейтер. хлороформ) δ: 8,79 (1H, дд, J = 9,0, 6,0 Гц); 7,48 (1H, дд, J = 9,0, 3,0 Гц).
6-Фтор-3-нитропиридин-2-карбоксамид
Раствор 1,40 г 2-циано-6-фтор-3-нитропиридина (8,39 ммоля) в 30 мл 90%-ной серной кислоты нагревают при 70oC в течение 90 мин, затем охлаждают, выливают на лед и подщелачивают концентрированным аммиаком. Экстракция этилацетатом и обработка дают 0,94 г (61%) 6- фтор-3-нитропиримидин-2-карбоксамида.
1H-ЯМР (дейтер. хлороформ) δ: 8,70 (1H, дд, J = 8,9 Гц, 6,5 Гц); 8,30 и 8,03 (1H, 1H шир. с); 7,62 (1H, дд, J = 8,9, 2,9 Гц).
6-Фтор-3H-пиридо(3,2-d)пиримид-4-он
Раствор 1,50 г (8,10 ммоля) 6-фтор-3-нитропиридин-2- карбоксамида в этилацетате гидрируют на 5%-ном палладии-на-угле (0,30 г) при 60 фунт/дюйм2 (= 4,219 кг/см2) в течение 2 часов. После удаления катализатора фильтрованием растворитель отгоняют при пониженном давлении, получают остаток сырого 3-амино-6- фторпиримидин-2-карбоксамида, который используют непосредственно на следующей стадии. Добавляют 60 мл триэтилортоформиата, после чего смесь нагревают и кипятят с обратным холодильником при перемешивании в течение 18 часов. Охлажденную смесь разбавляют равным объемом петролейного эфира, полученный осадок собирают фильтрованием и тщательно промывают петролейным эфиром, получают 6-фтор-3H-пиридо(3,2-d)пиримид-4-он (1,26 г, 84%).
1H-ЯМР (диметилсульфоксид) δ: 12,72 (1H, шир. с); 8,31 (1H, дд, J = 8,6, 7,7 Гц); 8,20 (1H, с); 7,66 (1H, дд, J = 8,6, 3,0 Гц).
4-(3-Броманилино)-6-фторпиридо(3,2-d)пиримидин
Суспензию 0,2 г (1,21 ммоля) 6-фтор-3H-пиридо(3,2-d)пиримид-4-она в 30 мл хлорокиси фосфора кипятят с обратным холодильником при перемешивании до тех пор, пока она не станет гомогенной (2 часа), а затем еще 1 час. Удаляют избыток хлорокиси фосфора при пониженном давлении, остаток распределяют между дихлорметаном и насыщенным водным раствором дикарбоната натрия. Обработка органической части дает сырой 4-хлор-6-фторпиридо(3,2-d)пиримидин (100%) в виде нестабильного твердого продукта, который используют непосредственно на следующей стадии. Раствор 0,20 г (1,1 ммоля) 4-хлор-6-фторпиридо(3,2-d)пиримидина и 0,12 мл (2,18 ммоля) 3-броманилина в 20 мл пропанола-2, содержащего 1 каплю конц. соляной кислоты, кипятят с обратным холодильником в течение 15 минут, затем охлаждают, выливают в воду и экстрагируют этилацетатом. Экстракт обрабатывают и хромографируют остаток на силикагеле, элюируя смесью этилацетат/петролейный эфир (1:2); после удаления растворителя при пониженном давлении получают 0,18 г (52%) 4-(3-броманилино)-6-фторпиридо (3,2-d)пиримидина.
1H-ЯМР (дейтер. хлороформ) δ : 8,82 (1H, с); 8,65 (1H, шир. с); 8,31 (1H, т, J = 7,4 Гц); 8,27 (1H, шир. с); 7,77 (1H, м); 7,41 (1H, дд, J = 8,9 Гц, 2,2 Гц); 7,29 (2H, шир.с).
ПРИМЕР 5
4-(3-Броманилино)-6-хлорпиридо(3,2-d)пиримидин
6-Хлор-3-нитропиколинамид
Раствор 1,00 г (5,45 ммоля) 6-хлор-3-нитропиколинонитрила в 15 мл 90%-ной серной кислоты нагревают при 70oC в течение 3,5 часов, а затем выливают в ледяную воду. Смесь экстрагируют четыре раза этилацетатом, а затем объединенные экстракты обрабатывают, получая 0,80 г (73%) 6-хлор-3-нитропиколинамида.
1H-ЯМР (диметилсульфоксид) δ: 8,55 (1H, д, J = 8,5 Гц); 8,31 и 8,04 (1H, 1H, 2 шир.с); 7,93 (1H, д, J = 8,5 Гц).
6-Хлор-3H-пиридо(3,2-d)пиримидин-4-он
Раствор 0,30 г 6-хлор-3-нитро-пиколинамида (1,49 ммоля) в 30 мл этилацетата гидрируют при 60 фунт/дюйм2 (= 4,219 кг/см2) на 0,10 г 5%-ного палладия-на-угле в течение 20 минут. После удаления катализатора фильтрованием раствор концентрируют досуха, получают 3-амино-6-хлорпиколинамид в виде желтого масла, которое непосредственно используют на следующей стадии. Его растворяют в 30 мл триэтилортоформиата и смесь кипятят с обратным холодильником в течение 18 часов. Добавляют 30 мл петролейного эфира к охлажденному раствору, отфильтровывают полученный в результате осадок сырого 6-хлор-3H-пиридо(3,2-d)пиримидин-4-она (0,27 г, 99%) и сушат в вакуумной печи.
4-(3-Броманилино)-6-хлорпиридо(3,2-d)примидин
Суспензию вышеуказанного хиназолона (0,20 г; 1,10 ммоля) в 30 мл хлорокиси фосфора кипятят с обратным холодильником в течение 3 часов, затем концентрируют досуха при пониженном давлении. Остаток распределяют между дихлорметаном и насыщенным раствором бикарбоната натрия, обрабатывают органическую часть, получают 0,16 г (73%) 4,6-дихлорпиридо(3,2-d)пиримидина в виде каштанового твердого продукта, который используют непосредственно на следующей стадии. Раствор 0,16 г (0,80 ммоля) сырого дихлорпиридопиримидина и 0,17 мл (1,60 ммоля) 3-броманилина в 25 мл пропанола-2, содержащего следы конц. соляной кислоты, нагревают при 50oC в течение 30 минут. Охлажденную смесь выливают в насыщеный раствор бикарбоната натрия и экстрагируют этилацетатом, экстракт обрабатывают и хроматографируют на силикагеле. Элюирование смесью этилацетата с петролейным эфиром (1:4) дает 3-бромалин, тогда как смесь этилацетат/петролейный эфир (1:1) элюирует 0,17 г (63%) 4-(3-броманилино)-6-хлорпиридо(3,2-d)пиримидина.
H1-ЯМР (дейтер. хлороформ) δ: 8,90 (1H, шир. с); 8,84 (1H, с): 8,30 (1H, дд, J = 2,1, 2,20 Гц); 8,17 (1H, д, J = 8,8 Гц); 7,82-7,78 (1H,м); 7,73 (1H, д, J = 8,8 Гц); 7,32-7,29 (2H, м).
ПРИМЕР 6. 4-(3-Броманилино)-6-аминопиридо(3.2-d)пиримидин
Реакция 0,12 г (0,38 ммоля) 4-(3-броманилино)-6-фторпиридо(3,2-d)пиримидина [описанного в предыдущем эксперименте] с насыщенным раствором аммиака в этаноле в сосуде под давлением при 100oC в течение 18 часов дает 87 мг (72%) 6- амино-4-[3-броманилино]пиродо[3,2-d]пиримидина.
1H-ЯМР (дейтер. хлороформ) δ: 8,76 (1H, шир. с); 8,64 (1H, с); 8,23 (1H, шир. с); 7,93 (1H, д, J = 9,0 Гц); 7,81 (1H, дт, Jd = 7,7 Гц, Jt = 1,8 Гц); 7,28-7,22 (2H, м); 7,00 (1H, д, J = 9,0 Гц); 4,90 (2H, шир. с).
ПРИМЕР 7
4-(3-Броманилино)-6-метиламинопиридо(3,2-d)пиримидин
Реакция 50 мг (0,16 ммоля) 4-(3-броманилино)-6-фторпиридо(3,2-d)пиримидина [описанного в предыдущем эксперименте] с 32 мг (0,47 ммоля) солянокислого метиламина и 70 мкл (0,55 ммоля) триэтиламина в 10 мл этанола в сосуде под давлением при 100oC в течение 18 часов приводит к 43 мг (81%) 6- метиламино-4-(3-броманилино)пиридо[3,2-d]пиримидина.
1H-ЯМР (дейтер. хлороформ) δ : 8,81 (1H, шир. с), 8,61 (1H, с); 8,19 (1H, т, J = 1,8 Гц); 7,86 (1H, д, J = 9,1 Гц); 7,83 (1H, дт, Jd = 7,7 Гц, Jt = 1,8 Гц); 7,28-7,21 (2H, м); 6,92 (1H, к, J = 9,1 Гц); 4,97 (1H, к., J = 5,0 Гц); 3,13 (3H, к., J = 5,0 Гц).
ПРИМЕР 8
4-(3-Броманилино)-6-диметиламинопиридо(3,2-d)пиримидин
Смесь 0,15 г (0,47 ммоля) 4-(3-броманилино)-6-фторпиридо(3,2-d) пиримидина [описанного в предыдущем эксперименте], 0,11 г (1,41 ммоля) солянокислого диметиламина и 0,23 мл (1,64 ммоля) триэтиламина в 15 мл этанола нагревают в сосуде под давлением при 100oC в течение 18 часов. Растворитель отгоняют при пониженном давлении и распределяют остаток между этилацетатом и водой. Обрабатывают органическую часть и остаток хроматографируют на силикагеле. Элюирование этилацетатом/петролейным эфиром (1:1) дает головную фракцию, тогда как этилацетат элюирует 0,14г (86%) 4-(3-броманилино)-6-диметиламинопиридо(3,2-d)пиримидина.
1H-ЯМР (дейтер. хлороформ) δ : 8,72 (1H, шир. с); 8,56 (1H, с); 8,17 (1H, Т, J = 1,9 Гц); 7,85 (1H, д, J = 9,3 Гц); 7,77 (1H, дт, Jd = 7,5 Гц, Jt = 1,9 Гц); 7,27-7,18 (2H, м); 7,08 (1H, д, J = 9,3 Гц); 3,21 (6H, с).
ПРИМЕР 9
4-(3-Броманилино)-6-метоксипиридо(3,2-d)пиримидин
Прибавляют 0,11 г (0,34 ммоля) 4-(3-броманилино)-6- фторпиридо(3,2-d)пиримидина [описанного в предыдущем эксперименте] к раствору метоксида натрия [приготовленному при добавлении металлического натрия (31 мг, 1,38 ммоля) к 15 мл безводного метанола]. После нагревания в сосуде под давлением при 90oC в течение 3 часов раствор концентрируют досуха и остаток распределяют между этилацетатом и водой. Обработка органической части приводит к 92 мг (82%) 4-(3-бромфенил)-амино-6- метоксипиридо(3,2-d)пиримидина.
1H-ЯМР (дейтер. хлороформ) δ : 8,73 (1H, с); 8,66 (1H, шир. с); 8,18 (1H, м); 8,05 (1H, д, J = 8,9 Гц); 7,83-7,80 (1H, м); 7,30-7,24 (2H, м); 7,23 (1H, д, J = 8,9 Гц); 4,12 (3H, с).
ПРИМЕР 10
4-Анилинопиридо(4.3-d)пиримидин 4-N-трет.бутоксикарбониламино)пиридин
К смеси 2 г (21,24 ммоля) 4-аминопиридина, 3,57 г (63,72 ммоля) гидроксида калия, 10 мл воды и 4 мл 2-метил-2-пропанола на льду прибавляют 6,95 г (31,87 ммоля) ди-трет. бутил-дикарбоната. Полученный в результате двухфазный раствор перемешивают при 25oC в течение 1 недели, затем прибавляют 20 мл воды. Раствор экстрагируют 1 раз метиленхлоридом и 2 раза этилацетатом. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении; получают 4,08 г (99%) 4-(N- трет.бутоксикарбониламино)пиридина.
1H-ЯМР (диметилсульфоксид) δ : 9,84 (1H, с); 8,35 (2H, д, J = 6 Гц); 7,44 (2H, д, J =7 Гц); 1,49 (9H, с).
4-(N-трет.бутоксикарбониламино)никотиновая кислота
Медленно прибавляют 24 мл (2,18 М; 52,51 ммоля) н-бутиллития к раствору 4,08 г (21 ммоля) 4-(N-трет.бутоксикарбониламино)пиридина в 50 мл тетрагидрофурана при перемешивании в атмосфере азота при -78oC. Раствору дают нагреться до 0oC, перемешивают 3 часа, затем охлаждают снова до - 78oC и выливают в 100 мл эфира, содержащего сухой лед. Раствор нагревают до комнатной температуры при постоянном перемешивании. Прибавляют воду и нейтрализуют смесь уксусной кислотой. Полученный твердый продукт собирают вакуумным фильтрованием и сушат в вакуумной печи; получают 2,72 г (54%) 4- [N-трет. бутоксикарбониламино]никотиновой кислоты в виде коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 11,75 (1H, шир. с); 8,95 (1H, с): 8,50 (1H, д, J = 6,0 Гц); 8,20 (1H, д, J = 6,0 Гц); 1,49 (9H, с).
4-Аминоникотиновая кислота
Смесь 2,72 г (11,4 ммоля) 4-(N-трет.-бутоксикарбониламино)никотиновой кислоты, 10 мл трифторуксусной кислоты и 20 мл метиленхлорида перемешивают при комнатной температуре в течение 12 часов. Отгоняют летучие компоненты при пониженном давлении и полученную в результате сырую 4-аминоникотиновую кислоту используют непосредственно в следующей реакции.
3H-Пиридо(4.3-d)пиримидин-4-он
Нагревают 2,72 г (11,4 ммоля) сырой аминоникотиновой кислоты в 20 мл формамида при 170oC в течение 12 часов. Отгоняют летучие компоненты при пониженном давлении (0,8 мм рт. ст.). Твердый остаток затем очищают при среднем давлении на колонке с силикагелем, элюируя смесью 10% метанола в хлороформе; получают 780 мг (47%) 3H-пиридо(4,3-d)пиримидин-4-она в виде беловато-желтого твердого вещества.
1H-ЯМР (диметилсульфоксид) δ: 12,64 (1H, шир. с); 9,28 (1H, с); 8,83 (1H, д, J = 5,5 Гц); 8,30 (1H, с); 7,58 (1H, д, J = 5,8 Гц).
3H-Пиридо(4,3-d)пиримидин-4-тион
Прибавляют 2,59 г (5,83 ммоля) пятисернистого фосфора к 780 мг (5,3 ммоля) 3H-пиридо(4,3-d)пиримидин-4-она в 5 мл пиридина. Смесь кипятят с обратным холодильником в течение 5 часов. При охлаждении образуется осадок и надосадочный слой сливают. Твердый продукт суспендируют в 20 мл воды, а затем фильтруют: получают 676 мг (78%) 3H-пиридо(4,3-d)пиримидин-4-тиона в виде черного твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 14,53 (1H, шир. с); 9,65 (1H, с); 8,84 (1H, д, J = 7,0 Гц); 8,32 (1H, с); 7,64 (1H, д, J = 8,0 Гц).
4-Метилтиопиридо(4.3-d)пиримидин
Перемешивают 12 часов при 25oC в атмосфере азота смесь 676 мг (4,14 ммоля) 3H-пиридо(4,3-d)пиримидин-4-тиона, 1,4 мл (10,31 ммоля) триэтиламина, 4 мл диметилсульфоксида и 0,48 мл (7,72 ммоля) иодметана. Смесь выливают в воду и экстрагируют этилацетатом. Органические экстракты сушат над сульфатом магния, отгоняют растворитель при пониженном давлении, получают 1,15 г (выход количественный) 4-метилтиопиридо(4,3-d)пиримидина в виде коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,52 (1H, с); 9,16 (1H, с), 8,95 (1H, д, J = 6 Гц); 7,86 (1H, д, J = 8 Гц); 2,75 (1H, с).
4-Анилинопиридо(4,3-d)пиримидин
Смесь 174 мг (0,97 ммоля) 4-метилтиопиридо(4,3-d)пиримидина и 186,2 мг (1,99 ммоля) анилина в 2 мл этанола кипятят с обратным холодильником в течение 12 часов. При охлаждении до 0oC образуется твердый продукт, который отфильтровывают; получают 34,5 мг (16%) 4-анилинопиридо(4,3-d)пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 10,29 (1H, шир. с); 9,86 (1H, с); 8,82 (1H, д, J = 5,8 Гц); 8,72 (1H, с); 7,85 (2H, д, J = 7,5 Гц); 7,66 (1H, д, J = 5,5 Гц); 7,45 (2H, т, J =8,0 Гц); 7,23 (1H, т, J = 7,3 Гц).
ПРИМЕР 11
4-(3-Броманилино)пиридо(4,3-d)пиримидин
Смесь 171 мг (0,96 ммоля) 4-метилтиопиридо(4,3-d)пиримидина (см. предыдущий эксперимент) и 1 мл 3-броманилина нагревают при 100oC в течение 2 часов. При охлаждении осаждается твердый продукт, его собирают вакуумной фильтрацией, затем перекристаллизовывают из этанола, получая 30 мг (10%) 4-(3- броманилино)пиридо(4,3-d)пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 10,33 (1H, с); 9,86 (1H, с); 8,84 (1H, д, J = 5,8 Гц); 8,79 (1H, с); 8,22 (1H, с); 7,89 (1H, д, J = 7,2 Гц); 7,69 (1H, д, J = 5,8 Гц); 7,40 (2H, дт, J = 8,0 Гц, J = 1,5 Гц).
ПРИМЕР 12
4-(3-Броманилино)-7-фторпиридо(4,3-d)пиримидин
3-Циано-4,6-диаминопиридин
Гидрируют 15,1 г (0,071 моля) сырого 2-бром-3-циано-4,6- диаминопиридина [см. также следующий эксперимент] в 200 мл смеси тетрагидрофуран/метанол (2: 1), содержащей 7,0 г (0,071 моля) ацетата калия и 4 г 5%-ного палладия-на-угле при 55 фунт/дюйм2 [= 3,867 кг/см2 при 20oC в течение 7 дней. После фильтрации через целит, промывки смесью тетрагидрофуран/метанол и удаления растворителей получают твердый продукт, который растворяют в разбавленной соляной кислоте и воде. Устанавливают pH раствора 10 с помощью концентрированного раствора гидроксида натрия и охлаждают; получают 6,58 г (69%) 3-циано-4,6-диаминопиридина в виде твердого желтого продукта, т. пл. 197 - 198oC. При экстракции маточной жидкости 4 раза по 200 мл этилацетата получают дополнительно 2,12 г (22%) продукта.
1H-ЯМР (диметилсульфоксид) δ: 7,91 (1H, с); 6,26 и 6,24 (2H, 2H, шир. с); 5,63 (1H, с).
4,6-Диамино-3-пиридилкарбоксамид
Прибавляют 4,30 г (0,032 моля) 3-циано-4,6-диаминопиридина к 25 мл 90%-ной серной кислоты, затем перемешивают при 60-70oC в течение 3 часов. Полученный раствор прибавляют к холодному концентрированному (40%) раствору гидроксида натрия, получают смесь 4,6-диамино-3-пиридилкарбоксамида и неорганических солей. Аналитически чистый образец получают путем хроматографии на оксиде алюминия [10-50% метанола в хлороформе]; получают светло-желтый твердый продукт.
1H-ЯМР (диметилсульфоксид) δ: 8,15 (1H, с); 6,91 (2H, шир. с); 7,7-6,3 (2H, шир. м); 5,78 (2H, шир. с); 5,56 (1H, с).
7-Амино-4-оксо-3H-пиридо(4,3-d)пиримидин
Нагревают 9,2 г сырого 4,6-диамино-3-пиридилкарбоксамида в очищенном триэтоксиметане [60 мл; перегнан над натрием] при 170oC в течение 1,5 дней. После удаления растворителя остаток растворяют в горячем 2М растворе гидроксида натрия, фильтруют, нейтрализуют конц. соляной кислотой и охлаждают; получают 3,57 г (69% в расчете на нитрил) 7-амино-4-оксо-3H-пиридо(4,3-d)пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 11,79 (1H, шир. с); 8,74 (1H, с); 7,79 (1H, с); 6,67 (2H, шир. с); 6,38 (1H, с).
7-Фтор-4-оксо-3H-пиридо(4,3-d)пиримидин
Раствор 1,00 г (6,17 ммоля) 7-амино-4-оксо-3H-пиридо(4,3- d)пиримидина в 25 мл 60%-ной тетрафтороборной кислоты при 0oC обрабатывают 0,85 г (12,3 ммоля) твердого нитрита натрия, добавляемого порциями в течение 2-х часов, затем перемешивают при 0oC еще 1 час и при 20oC в течение 30 минут. Полученную смесь охлаждают на льду, нейтрализуют насыщенным водным раствором карбоната натрия и экстрагируют 4 раза по 100 мл этилацетата. Экстракт промывают водой, затем фильтруют через силикагель [этилацетат]; получают 0,48 г (47%) 7-фтор-4-оксо-3H-пиридо(4,3-(1)пиримидина в виде твердого крема.
1H-ЯМР (диметилсульфоксид) δ: 12,69 (1H, шир. с); 9,01 (1H, с); 8,31 (1H, с); 7,34 (1H, с).
4-(3-Броманилино)-7-фторпиридо(4,3-d)пиримидин
Суспензию 0,23 г (1,39 ммоля) 7-фтор-4-оксо-3H-пиридо(4,3-d)пиримидина в 10 мл хлорокиси фосфора перемешивают при кипячении с обратным холодильником в течение 3,5 часов, затем концентрируют в вакууме. Полученное масло охлаждают на льду, разбавляют 100 мл метиленхлорида, 40 мл насыщенного водного раствора карбоната натрия и льдом, перемешивают 2 часа при 20oC. Отделяют метиленхлоридный экстракт и водную часть дополнительно экстрагируют 2 раза по 100 мл метиленхлорида, затем сушат объединенные экстракты над сульфатом натрия и фильтруют, получают сырой 4-хлор-7-фторпиридо(4,3-d)пиримидин. Прибавляют 1,26 г 3- броманилина (7,35 ммоля), 20 мг солянокислого 3-броманилина и 5 мл безводного изопропанола, затем полученный раствор концентрируют в вакууме, чтобы удалить метиленхлорид, и перемешивают 1 час при 20oC. При добавлении разбавленного раствора бикарбоната натрия и воды продукт кристаллизуется. После фильтрации, промывки водой и метиленхлоридом получают 297 мг чистого 4-(3-броманилино)-7- фторпиридо(4,3-d)пиримидина (67%) в виде твердого крема.
1H-ЯМР (диметилсульфоксид) δ: 10,38 (1H, шир. с); 9,59 (1H, с); 8,72 (1H, с); 8,17 (1H, с); 7,85 (1H, м); 7,38 (3H, м).
ПРИМЕР 13
7-Амино-4-анилинопиридо(4.3-d)пиримидин
4,6-Диамино-2-бром-3-пианопиридин
Барботируют 2 часа бромистый водород в смесь 16,3 г малононитрила (0,247 моля) и 400 мл толуола при 0oC. Осаждается светло-коричневый продукт. Затем реакционную смесь нагревают 2 часа при 100oC, причем наблюдается интенсивное выделение газа. После охлаждения до комнатной температуры желтый твердый продукт отделяют фильтрованием, промывают толуолом и сушат на воздухе. Смешивают 25,96 г твердого продукта с 500 мл воды, устанавливают pH суспензии 9-10 добавлением 15 мл концентрированного аммиака. После перемешивания при комнатной температуре в течение 1 часа смесь фильтруют. При перекристаллизации из этанола получают твердый желтый продукт. После сушки при 60oC в вакуумной печи получают 12,95 г (49%) 4,6-диамино-2-бром-3-цианопиридина.
1H-ЯМР (диметилсульфоксид) δ: 6,67 (2H, шир. с); 5,59 (1H, с).
2,4-Диамино-5-цианопиридиний-ацетат
Гидрируют 12,77 г (60 ммолей) 4,6-диамино-2-бром-3- цианопиридина в 240 мл смеси тетрагидрофуран/метанол (2:1), содержащей 5,9 г (60 ммолей) ацетата калия и 0,5 г 20%-ного палладия-на-угле, при давлении 18 фунтов/дюйм2 [= 1,266 кг/см2] при 25oC в течение 4 часов. Смесь фильтруют через целит и отгоняют растворитель при пониженном давлении; получают 11,15 г твердого продукта, который перемешивают со 100 мл тетрагидрофурана при комнатной температуре в течение 20 минут. Смесь снова фильтруют и фильтрат выпаривают досуха, получая целевой продукт. После сушки в вакуумной печи собирают 10,65 г (92%) 2,4-диамино-5- цианопиридиний-ацетата в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 7,90 (1H, с); 6,26 (4H, шир. с); 5,62 (1H, с); 1,90 (3H, с).
7-Амино-4-тионо-3H-пиридо(4,3-d)пиримидин
Смесь 0,199 г (1,0 моль) 2,4-диамино-5-цианопиридиний-ацетата, 1,95 мл триэтилортоформиата и 1,95 мл уксусного ангидрида кипятят с обратными холодильником в атмосфере азота при перемешивании в течение 3 часов. Затем отгоняют растворитель и остаток растворяют в 10 мл метанола, содержащего 0,81 г (15 ммолей) метоксида натрия. Через смесь барботируют сероводород в течение 5 минут, затем смесь кипятят с обратным холодильником в течение ночи. После отгонки растворителя остаток растворяют в горячей воде и кипятят с активированным углем. После фильтрации нейтрализуют фильтрат уксусной кислотой, пока он еще горячий, чтобы вызвать образование желтого твердого продукта. После охлаждения собирают твердый продукт фильтрованием и сушат его в вакуумной печи в течение ночи. Выделяют 84 г (51%) 7-амино-4- тионо-3H-пиридо(4,3-d)пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,82 (1H, с); 9,34 (1H, с); (1H, с); 8,37 (1H, с), 7,80 (2H, д, J = 7,5 Гц); 7,38 (2H, т, J = 7,5 Гц), 7,12 (1H, т, J = 7,5 Гц); 6,61 (2H, шир. с); 6,43 (1H, с).
7-Амино-4-метилтиопиридо(4,3-d)пиримидин
Прибавляют 6 мл (43 ммоля) триэтиламина к раствору 0,77 г (4,3 ммоля) 7-амино-4-тионо-3H-пиридо(4,3-d)пиримидина в 7 мл диметилсульфоксида при перемешивании в атмосфере азота при 25oC. После перемешивания двух фаз в течение 20 минут прибавляют 0,26 мл (4,2 ммоля) метилиодида. Через 2 часа реакционную смесь выливают при перемешивании в смесь воды со льдом. Мгновенно образуется твердый продукт. После дополнительного охлаждения при 0oC, отфильтровывают твердый продукт и сушат его в вакуумной печи, получая 0,564 г (68%) 7-амино-4-метилтиопиридо(4,3-d)пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 8,98 (1H, с); 8,71 (1H, с); 6,94 (2H, шир. с); 6,49 (1H, с); 2,63 (3H, с).
7-Амино-4-анилинопиридо(4,3-d)пиримидин
Смесь 0,136 г (0,7 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 0,5 мл (5,5 ммоля) анилина в атмосфере азота кипятят с обратным холодильником при 180oC в течение 2 часов. Реакционную смесь охлаждают до 25oC, при этом образуется осадок. Твердый продукт отфильтровывают и перекристаллизовывают из изопропанола, сушат в вакуумной печи в течение ночи. Выделяют 84 мг (51%) 7-амино-4-анилинопиридо(4,3-d)пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,82 (1H, с); 9,34 (1H, с); 8,37 (1H, с); 7,80 (2H, д, J = 7,5 Гц); 7,38 (2H, т, J = 7,5 Гц); 7,12 (1H, т, J = 7,5 Гц); 6,61 (2H, шир. с); 6,43 (1H, с).
ПРИМЕР 14
7-Амино-4-(3-гидроксианилино)пиридо(4,3-d)пиримидин
Смесь 299 мг (1,56 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 1,60 г (14,7 ммоля) 3-аминофенола перемешивают при 160oC в течение 15 минут. Полученный в результате продукт хроматографируют на силикагеле [9% метанола/метиленхлорид], получают 108 мг (18%) 7-амино-4-(3-гидроксианилино)пиридо(4,3-d)пиримидина в виде светло-оранжевого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,69 (1H, с); 9,44 (1H, шир. с); 9,33 (1H, с); 8,38 (1H, с); 7,37 (1H, т, J = 2,1 Гц); 7,21 (1H, шир. д, J = 8,4 Гц); 7,14 (1H, т, J = 8,0 Гц); 6,59 (2H, шир. с); 6,53 (1H, ддд, J = 7,9; 2,2; 0,8 Гц); 6,43 (1H, с).
ПРИМЕР 15
7-Амино-4-(3-метоксианилино)пиридо(4,3-d)пиримидин
Смесь 226 мг (1,18 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина [описанного в предыдущем эксперименте] и 1,00 мл (8,90 ммоля) м-анизидина перемешивают в атмосфере азота при 190oC в течение 1,5 часов. Полученный продукт хроматографируют на силикагеле [5-7% этанола/этилацетат], получают 136 мг (43%) 7-амино-4-(3- метоксианилино)пиридо[4,3-d]пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,78 (1H, шир, с); 9,34 (1H, с); 8,40 (1H, с); 7,50 (1H, шир. с); 7,44 (1H, д, J = 8,0 Гц); 7,28 (1H, т, J = 8,2 Гц); 6,71 (1H, дд, J = 8,2 и 2,3 Гц); 6,61 (2H, шир. с); 6,45 (1H, с); 3,77 (3H, с).
ПРИМЕР 16
7-Амино-4-(2-метоксианилино)пиридо(4,3-d)пиримидин
Смесь 227 мг (1,18 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 1,00 мл (8,87 ммоля) о-анизидина перемешивают в атмосфере азота при 180oC в течение 2,5 часов. Полученный в результате продукт хроматографируют на силикагеле (5% этанола/этилацетат), получают 147 мг (47%) 7-амино-4-(2-метоксианилино)пиридо[4,3-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,44 (1H, шир. с); 9,25 (1H, с); 8,22 (1H, с); 7,54 (1H, дд, J = 7,7 и 1,4 Гц); 7,24 (1H, ддд, J = 8,1; 7,4; 1,5 Гц); 7,10 (1H, дд, J = 8,2 и 1,2 Гц); 6,98 (1H, дт, J = 1,3 Гц, J = 7,5 Гц); 6,52 (2H, шир. с); 6,41 (1H, с); 3,79 (3H, с).
ПРИМЕР 17
7-Амино-4-(3-аминоанилино)пиридо(4,3-d)пиримидин
Смесь 307 мг (1,60 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина [описанного в предыдущем эксперименте] и 2,00 г (14,5 ммоля) 3-нитроанилина перемешивают при 200oC в течение 1,5 часов и суспендируют сырой продукт в 250 мл смеси метанол/тетрагидрофуран (4:1), гидрируют на 2 г 5%-ного палладия-на-угле при давлении 60 фунт/дюйм2 [= 4,219 кг/см2] и 20oC в течение 24 часов. Раствор фильтруют через целит, тщательно промывают горячим метанолом и затем абсорбируют оксидом алюминия и хроматографируют на оксиде алюминия [4-8% этанола/хлороформ] , чтобы получить 66 мг (16%) 7-амино-4-(3-аминоанилино)пиридо(4,3-d)пиримидина в виде зеленого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,57 (1H, шир. с); 8,33 (1H, с); 7,04 (1H, т, J = 2,0 Гц); 6,99 (1H, т, J = 8,0 Гц); 6,88 (1H, шир. д, J = 8,0 Гц); 6,55 (2H, шир. с); 6,40 (1H, с); 6,34 (1H, дд, J = 7,9 Гц и 1,3 Гц); 5,10 (2H, шир. с).
ПРИМЕР 18
7-Амино-4-(4-аминоанилино)пиридо(4,3-d)пиримидин
7-Амино-4-(4-ацетамидоанилино)пиридо(4,3-d)пиримидин
Смесь 138 мг (0,72 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 1,50 г (10,0 ммоля) 4-аминоацетанилида перемешивают в атмосфере азота при 200oC в течение 1 часа. Полученный продукт хроматографируют на оксиде алюминия (8-10% метанол/метиленхлорид); получают 110 мг (52%) 7-амино-4-(4-ацетамидоанилино)пиридо(4,3-d)пиримидина в виде светло-желтого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,94, 9,79 (1H, 1H, 2 шир. с); 9,31 (1H, с); 8,34 (1H, с); 7,69 (2H, д, J = 8,9 Гц); 7,57 (2H, д, J = 8,9 Гц); 6,57 (2H, шир. с); 6,43 (1H, с); 2,05 (3H, с).
7-Амино-4-(4-аминоанилино)пиридо(4,3-d)пиримидин
Раствор 0,30 г (1,02 ммоля) 7-амино-4-(4-ацетамидоанилино)пиридо (4,3-d)пиримидина в 10 мл 2М водного раствора гидроксида натрия и 10 мл метанола перемешивают при 100oC в течение 7 часов. Полученный в результате продукт хроматографируют на оксиде алюминия [3-4% этанола/хлороформ]; получают 86 мг (33%) 7-амино-4-(4-аминоанилино)пиридо[4,3-d] пиримидина в виде оранжевого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,58 (1H, с): 9,24 (1H, с); 8,25 (1H, с); 7,31 (2H, д, J = 8,6 Гц); 6,58 (2H, д, J = 8,6 Гц); 6,48 (2H, шир. с); 6,39 (1H, с); 5,00 (2H, шир. с).
ПРИМЕР 19
7-Амино-4-(3-диметиламиноанилино)пиридо(4,3-d)пиримидин
Смесь 245 мг (1,28 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 1,60 г (11,8 ммоля) N,N-диметил-1,3-фенилендиамина перемешивают в атмосфере азота при 190oC в течение 1 часа и хроматографируют полученный продукт (дважды) на оксиде алюминия [3% этанола/хлороформ] ; получают 113 мг (32%) 7-амино-4-(3-диметиламиноанилино) пиридо[4,3-d]пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,66 (1H, шир. с); 9,33 (1H, с); 8,36 (1H, с); 7,22 (1H, шир. д, J = 7,8 Гц); 7,16 (2H, м); 6,57 (2H, шир. с); 6,51 (1H, ддд, J = 8,0; 2,3; 1,2 Гц); 6,42 (1H, с); 2,91 (6H, с).
ПРИМЕР 20
7-Амино-4-(4-диметиламиноанилино)пиридо(4,3-d)пиримидин
Смесь 256 мг (1,33 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 1,95 г (14,4 ммоля) N,N-диметил-1,4-фенилендиамина перемешивают в атмосфере азота при 190oC в течение 20 минут. Полученный в результате продукт хроматографируют на оксиде алюминия [3-7% этанола/хлороформ]; получают 198 мг (53%) 7-амино- 4-(4-диметиламиноанилино)пиридо(4,3-d)пиримидина в виде оранжевого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,67 (1H, шир. с): 9,27 (1H, с); 8,27 (1H, с); 7,51 (2H, д, J = 8,9 Гц); 6,75 (2H, д, J = 8,9 Гц); 6,51 (2H, шир. с); 6,39 (1H, с); 2,89 (6H, с).
ПРИМЕР 21
7-Амино-4(2-нитроанилино)пиридо(4,3-d)пиримидин
Смесь 220 мг (1,15 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 2,00 г (14,5 ммоля) 2-нитроанилина нагревают до 100oC, затем в горячий раствор при перемешивании вводят избыток сухого газообразного хлористого водорода и перемешивают смесь при 160oC в течение 20 минут. Полученный в результате продукт нейтрализуют избытком бикарбоната натрия, растворенного в смеси метанола с хлороформом, сушат над силикагелем и хроматографируют на силикагеле [2-4% метанола/метиленхлорид]; получают 108 мг (33%) 7-амино-4-(2-нитроанилино)пиридо(4,3-d)пиримидина в виде желто-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,40 (1H, шир. с); 8,20 (1H, шир. с); 8,12 (1H, шир. с); 8,01 (2H, шир. с); 7,75 (1H, шир. с); 6,70 (2H, шир. с); 6,43 (1H, шир. с).
ПРИМЕР 22
7-Амино-4-(3-нитроанилино)пиридо(4,3-d)пиримидин
Смесь 127 мг (0,66 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина [описанного в предыдущем эксперименте] и 1,70 г (12,3 ммоля) 3-нитроанилина перемешивают в атмосфере азота при 200oC в течение 1,5 часов. Полученный в результате продукт хроматографируют на оксиде алюминия [5-20% этанола/хлороформ] ; получают 81 мг (39%) 7-амино-4-(3-нитроанилино)пиридо(4,3-d)пиримидина в виде коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,17 (1H, шир. с), 9,37 (1H, с); 8,87 (1H, шир. с); 8,48 (1H, с); 8,33 (1H, шир. д, J = 7,5 Гц); 7,95 (1H, ддд, J = 8,2; 2,1: 1,0 Гц); 7,67 (1H, т, J = 8,2 Гц); 6,70 (2H, шир. с); 6,47 (1H, с).
ПРИМЕР 23
7-Амино-4-(3-фторанилино)пиридо(4,3-d)пиримидин
Смесь 215 мг (1,12 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 1,16 г (10,4 ммоля) 3-фторанилина перемешивают при 160oC в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле [6-7% метанола/метиленхлорид], получают 185 мг (65%) 7-амино-4-(3-фторанилино)пиридо(4,3-d)пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,94 (1H, шир. с); 9,36 (1H, с); 8,46 (1H, с); 7,91 (1H, шир. д, J = 11,9 Гц); 7,63 (1H, шир. д, J = 8,1 Гц); 7,41 (1H, дд, J = 15,7 и 7,7 Гц); 6,93 (1H, дт, J = 8,5 Гц, J = 2,4 Гц); 6,68 (2H, шир. с); 6,38 (1H, с).
ПРИМЕР 24
7-Амино-4-(3-хлоранилино)пиридо[4,3-d]пиримидин
Смесь 208 мг (1,08 ммоля) 7-амино-4-метилтиопиридо[4,3-d]- пиримидина и 1,21 г (9,48 ммоля) 3-хлоранилина перемешивают при 150oC в течение 20 минут. Полученный в результате продукт хроматографируют на оксиде алюминия [5-10% метанола/метиленхлорид] ; получают 177 мг (60%) 7-амино-4-(3-хлоранилино)пиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,92 (1H, шир. с); 9,35 (1H, с); 8,45 (1H, с); 8,08 (1H, шир. с); 7,79 (1H, шир. д, J = 8,0 Гц); 7,40 (1H, т, J = 8,1 Гц); 7,16 (1H, дд, J = 7,9 Гц и 1,3 Гц); 6,68 (2H, шир. с); 6,46 (1H, с).
ПРИМЕР 25
7-Амино-4-(3,4-дихлоранилино)пиридо(4,3-d)пиримидин
Смесь 247 мг (1,29 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 1,50 г (9,26 ммоля) 3,4-дихлоранилина перемешивают при 165oC в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле [7-8% метанола/метиленхлорид] ; получают 252 мг (64%) 7-амино-4-(3,4-дихлоранилино)пиридо[4,3-d]пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,97 (1H, шир. с); 9,34 (1H, с); 8,47 (1H, с); 8,29 (1H, шир. с); 7,86 (1H, шир. д, J = 8,6 Гц); 7,62 (1H, д, J = 8,8 Гц); 6,70 (2H, шир. с); 6,46 (1H, с).
ПРИМЕР 26
7-Амино-4-(2-броманилино)пиридо(4,3-d)пиримидин
Смесь 198 мг (1,03 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина [описанного в предыдущем эксперименте] и 1,00 мл (9,18 ммоля) 2-броманилина перемешивают в атмосфере азота при 180oC в течение 2,5 часов; полученный продукт хроматографируют на оксиде алюминия [1% этанола/хлороформ]; получают 108 мг (33%) 7- амино-4-(2-броманилино)пиридо[3,4-d]пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,91 (1H, шир. с); 9,27 (1H, с); 8,20 (1H, с); 7,73 (1H, д, J = 7,9 Гц): 7,50 (1H, м); 7,44 (1H, т, J = 6,9 Гц); 7,25 (1H, м); 6,59 (2H, шир. с); 6,42 (1H, с).
ПРИМЕР 27
7-Амино-4-(3-броманилино)пиридо[4,3-d]пиримидин
Смесь 167 мг (0,87 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 0,75 мл (7,8 ммоля) 3-броманилина перемешивают в атмосфере азота при 190oC в течение 2,5 часов и перекристаллизовывают образовавшийся при охлаждении осадок из изопропанола.
1H-ЯМР (диметилсульфоксид) δ: 9,91 (1H, шир. с); 9,34 (1H, с); 8,45 (1H, с); 8,19 (1H, с); 7,84 (1H, д, J = 8,0 Гц); 7,34 (1H, т, J = 8,0 Гц); 7,29 (1H, д, J = 8,2 Гц); 6,68 (2H, шир. с); 6,45 (1H, с).
ПРИМЕР 28
7-Амино-4-(4-броманилино)пиридо[4,3-d]пиримидин
Смесь 264 мг (1,36 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 1,00 г (5,81 ммоля) 4-броманилина перемешивают в атмосфере азота при 200oC в течение 15 минут. Полученный в результате продукт хроматографируют на силикагеле [10-15% этанола/этилацетат] , получают 200 мг (46%) 7-амино-4-(4-бром-анилино)пиридо[4,3-d]пиримидина в виде светло-желтого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,88 (1H, шир. с); 9,34 (1H, с); 8,40 (1H, с); 7,83 (2H, д, J = 8,8 Гц); 7,55 (2H, д, J = 8,8 Гц); 6,64 (2H, шир. с); 6,44 (1H, с).
ПРИМЕР 29
7-Амино-4-(3-иоданилино)пиридо(4,3-d)пиримидин
Смесь 72 мг (0,37 ммоля) 7-амино-4-метилтиопиридо(4,3-d)пиримидина и 1,25 г (5,71 ммоля) 3-иоданилина перемешивают при 160oC в течение 30 минут. Полученный в результате продукт хроматографируют на силикагеле [5-7% метанола/метиленхлорид]; получают 83 мг (61%) 7-амино-4-(3-иоданилино)пиридо[4,3-d] пиримидина в виде светло-коричневых розеток.
1H-ЯМР (диметилсульфоксид) δ: 9,84 (1H, шир. с); 9,34 (1H, с); 8,44 (1H, с); 8,30 (1H, шир. с); 7,90 (1H, дд, J = 7,9 и 0,8 Гц); 7,47 (1H, д, J = 7,7 Гц); 7,18 (1H, т, J = 8,0 Гц); 6,66 (2H, шир. с); 6,46 (1H, с).
ПРИМЕР 30
7-Амино-4-(2-трифторметиланилино)пиридо[4,3-d]пиримидин
Смесь 300 мг (1,56 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина, 1,00 г (5,06 ммоля) солянокислого 2-аминобензотрифторида и 2,00 г (12,4 ммоля) 2-аминобензотрифторида перемешивают при 160oC в течение 10 минут. Полученный в результате продукт нейтрализуют избытком бикарбоната натрия, растворяют в смеси метанола с хлороформом, сушат над силикагелем и хроматографируют на силикагеле [6-7% метанола/метиленхлорид]; получают 194 мг (41%) 7-амино-4-(2-трифторметиланилино)пиридо[4,3-d] пиримидина в виде твердого крема; т. пл. {метанол/хлороформ/петролейный эфир} = 126-130oC [разложение].
1H-ЯМР (диметилсульфоксид) δ: 10,60 (1H, шир. с); 9,17 (1H, шир. с); 8,13 (1H, шир. с); 7,76 и 7,69 (1H, 1H, м, м); 7,45 (2H, м); 6,66 (2H, шир. с); 6,36 (1H, с).
ПРИМЕР 31
7-Амино-4-(3-трифторметиланилино)пиридо[4,3-d]пиримидин
Смесь 234 мг (1,22 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 3-амино-бензотрифторида (2 мл, 16,0 ммоль) перемешивают в атмосфере азота при 190-200oC в течение 2 часов, затем полученный продукт хроматографируют на силикагеле [5-10% этанола/этилацетат] и затем на оксиде алюминия [5-7% этанола/хлороформ]; получают 157 мг (42%) 7-амино-4-(3-трифторметиланилино)пиридо[4,3-d)] пиримидина в виде твердого крема.
1H-ЯМР (диметилсульфоксид) δ: 10,04 (1H, с); 9,37 (1H, с); 8,46 (1H, с); 8,31 (1H, с); 8,19 (1H, д, J = 8,2 Гц); 7,62 (1H, т, J = 8,0 Гц); 7,45 (1H, д, J = 7,7 Гц); 6,69 (2H, шир. с); 6,47 (1H, с).
ПРИМЕР 32
7-Амино-4-(4-трифторметиланилино)пиридо[4,3-d]пиримидин
Смесь 390 мг (2,03 ммоля) 7-амино-4-метилтиопиридо[4,3-d)]пиримидина, 0,40 г (2,02 ммоля) солянокислого 4-аминобензотрифторида и 1,61 г (10,0 молей) 4-аминобензотрифторида перемешивают в течение 2 минут при 180oC. Полученный продукт нейтрализуют избытком бикарбоната натрия, растворяют в смеси метанола с хлороформом, сушат над оксидом алюминия и хроматографируют на оксиде алюминия [4-7% метанола/хлороформ]; получают 7-амино-4-(4-трифторметиланилино)пиридо[4,3-d] пиримидин (390 мг, 63%) в виде твердого крема. Аналитически чистый материал получают при дополнительной хроматографии на силикагеле [5% метанола/метиленхлорид]; получают светло-желтые иглы.
1H-ЯМР (диметилсульфоксид) δ: 10,09 (1H, шир. с); 9,40 (1H, с); 8,48 (1H, с); 8,13 (2H, д, J = 8,2 Гц); 7,74 (2H, д, J = 8,7 Гц), 6,72 (2H, шир. с); 6,40 (1H, с).
ПРИМЕР 33
4-(3-Броманилино)-7-метиламинопиридо(4,3-d)пиримидин
Смесь 74 мг (0,23 ммоля) 7-фтор-4-(3-броманилино)пиридо[4,3-d]пиримидина, 7 мл (50 ммолей) триэтиламина и 3,0 г (44 ммоля) солянокислого метиламина в 30 мл изопропанола, находящуюся в стальном автоклаве, перемешивают при 95oC (масляная баня) в течение 5 часов. Полученную смесь концентрируют в вакууме, подщелачивают водным раствором карбоната натрия, разбавляют водой и экстрагируют 3 раза по 100 мл этилацетата. Хроматография этого экстракта на силикагеле [3% метанола/метиленхлорид] дает 4-(3-броманилино)-7-метиламино-пиридо [4,3-d] пиримидин (50 мг, 65%) в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,93 (1H, шир. с); 9,37 (1H, с); 8,47 (1H, с); 8,18 (1H, с); 7,84 (1H, д, J = 7,8 Гц); 7,34 (1H, т, J = 7,9 Гц); 7,30 (1H, шир. д, J = 8,1); 7,19 (1H, к, J = 4,7 Гц); 6,35 (1H, с); 2,85 (3H, д, J = 4,8 Гц).
ПРИМЕР 34
4-(3-Броманилино)-7-диметиламинопиридо[4,3-d]пиримидин
Смесь 101 мг (0,32 ммоля) 7-фтор-4-(3-броманилино)пиридо[4,3-d] пиримидина, 4,4 мл триэтиламина (32 ммоля) и 2,58 г (32 ммоля) солянокислого диметиламина в 30 мл изопропанола, находящуюся в стальном автоклаве, перемешивают при 100oC (масляная баня) в течение 4 часов. Полученный раствор концентрируют в вакууме, подщелачивают водным раствором карбоната натрия и разбавляют водой; получают твердый продукт. После фильтрации и перекристаллизации из смеси метанола с хлороформом получают 102 мг (94%) 7-диметиламино-4-(3-броманилино)пиридо[4,3-d]пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,93 (1H, шир. с); 9,42 (1H, с); 8,48 (1H, с); 8,19 (1H, с); 7,85 (1H, д, J = 7,7 Гц); 7,35 (1H, т, J = 7,9 Гц); 7,30 (1H, шир. д, J = 7,8 Гц); 6,53 (1H, с); 3,16 (6H, с).
ПРИМЕР 35
4-[N-(3-Бромфенил)-N-метиламино]-7-метиламинопиридо[4,3-d]пиримидин
Смесь 100 мг (0,31 ммоля) 7-фтор-4-(3-броманилино)пиридо[4,3-d]пиримидина, 4,4 мл (32 ммоля) триэтиламина и 2,12 г (32 ммоля) солянокислого метиламина в 30 мл изопропанола, находящуюся в стальном автоклаве, перемешивают при 100oC (масляная баня) в течение 5 часов. Полученную смесь концентрируют в вакууме, подщелачивают водным раствором карбоната натрия, разбавляют водой и экстрагируют 3 раза по 100 мл этилацетата. Хроматография этого экстракта на силикагеле [1-2% метанола/метиленхлорид] дает 23 мг (21%) 4-[N-(3-бромфенил)-N-метиламино] -7-метиламинопиридо[4,3-d] пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 8,14 (1н, с); 7,79 (1H, с); 7,30 (1H, т, J = 8,0 Гц); 7,20 (1H, ддд, J = 7,8 Гц, 1,8 Гц, 0,8 Гц); 7,03 (1H, шир. к., J = 4,9 Гц); 7,01 (1H, т, J = 1,9 Гц); 6,82 (1H, ддд, J = 7,8 Гц; 1,8 Гц; 0,9 Гц); 6,25 (1H, с); 3,40 (3H, с); 2,73 (3H, д, J = 4,9 Гц).
ПРИМЕР 36
7-Ацетиламино-4-(3-броманилино)пиридо[4,3-d]пиримидин
Смесь 0.154 г (0,49 ммоля) 7-амино-4-(3-броманилино)пиридо[4,3-d]пиримидина, 0,14 мл (1,5 ммоля) уксусного ангидрида, 0,14 мл триэтиламина (1,0 ммоль) и каталитического количества 4-(N,N-диметиламино)пиридина перемешивают в атмосфере азота при комнатной температуре в течение 18 часов. Затем реакцию прекращают добавлением воды со льдом. Собирают темный осадок фильтрованием на воронке Бюхнера и очищают препаративной ТСХ [Rf = 0,25; 7% метанола/хлороформ]. При перекристаллизации из этанола получают 13,5 мг (7,7%) 7-ацетиламино-4-(3-броманилино)пиридо[4,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 10,92 (1H, с); 10,22 (1H, с); 9,64 (1H, с); 8,70 (1H, с); 8,28 (1H, с); 8,21 (1H, с); 7,88 (1H, д, J = 7,7 Гц); 7,41-7,34 (3H, м); 2,16 (3H, с).
ПРИМЕР 37
4-(3-Броманилино)-7-метоксипиридо[4,3-d]пиримидин
Раствор 100 мг (0,31 ммоля) 7-фтор-4-(3-броманилино)пиридо[4,3-d] пиримидина в 30 мл 1М раствора метоксида натрия в метаноле перемешивают при кипячении с обратным холодильником в течение 42 часов. Полученную смесь концентрируют при пониженном давлении, разбавляют водой и нейтрализуют разбавленной соляной кислотой; получают 92 мг (89%) 7-метокси-4-(3-броманилино)пиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,22 (1H, шир. с), 9,57 (1H, с); 8,63 (1H, с); 8,19 (1H, с); 7,86 (1H, шир. д, J = 7,9 Гц); 7,39 (1H, т, J = 7,9 Гц); 7,35 (1H, дд, J = 7,9 Гц, 1,5 Гц); 6,96 (1H, с); 4,00 (3H, с).
ПРИМЕР 38
4-Бензиламинопиридо(4,3-d)пиримидин
Смесь 160,4 мг (0,902 ммоля) 4-метилтиопиридо[4,3-d]пиримидина и 106,3 мг (0,992 ммоля) бензиламина в 2 мл этанола нагревают при 80oC в течение 12 часов, затем растворитель отгоняют при пониженном давлении. Полученный в результате твердый продукт суспендируют в метиленхлориде, фильтруют и полученный в результате твердый продукт очищают препаративной ТСХ на силикагеле, элюируя 5% метанола в хлороформе. После удаления растворителя при пониженном давлении получают 36 мг (17%) 4-бензиламинопиридо[4,3-d]пирмидина.
1H-ЯМР (диметилсульфоксид) δ : 9,60 (1H, с); 9,37 (1H, т, J = 5,8 Гц); 8,72 (1H, д, J = 5,8 Гц); 8,57 (1H, с); 7,54 (1H, д, J = 5,8 Гц); 7,37 (2H, д, J = 7,0 Гц); 7,33 (2H, т, J = 7,3 Гц); 7,25 (1H, т, J = 7,2 Гц); 4,81 (2H, д, J = 5,8 Гц).
ПРИМЕР 39
К смеси 85 мг (0,48 ммоля) 4-метилтиопиридо[4,3-d]пиримидина и 2,5 мл этанола прикапывают 0,13 мл (1,0 ммоль) R-метилбензиламина. Полученную смесь кипятят с обратным холодильником при 80oC в течение 20 часов. Удаляют растворитель при пониженном давлении, получают масло, которое кристаллизуют из метанола; получают 41,6 мг (35%) 4-([R]-1-фенилэтиламино)пиридо[4,3-d]пиримидина; т. пл. 138-138,5oC.
1H-ЯМР (диметилсульфоксид) δ: 9,77 (1H, д, J = 0,7 Гц); 9,00 (1H, д, J = 7,7 Гц); 8,73 (1H, д, J = 5,8 Гц); 8,54 (1H, с); 7,53 (1H, дд, J = 5,8, 0,5 Гц); 7,45 (2H, д, J = 7,2 Гц); 7,33 (1H, т, J = 7,6 Гц); 7,23 (1H, тт, J = 7,5; 1,2 Гц); 5,63 (1H, п, J = 7,2 Гц); 1,61 (3H, т, J = 7,0 Гц).
ПРИМЕР 40
7-Амино-4-бензиламинопиридо[4,3-d]пиримидин
Смесь 8,78 г (45 ммолей) 2,4-диамино-5-цианопиридиний-ацетата, (10,66 г, 0,204 моля) муравьиной кислоты и 45 мл (0,41 моля) бензиламина нагревают при 200oC в атмосфере азота в течение 2 часов. При охлаждении она затвердевает. Прибавляют 500 мл воды и перемешивают смесь твердая смола/вода в течение 20 минут при 0oC. Жидкость декантируют. Твердый продукт промывают водой, затем перекристаллизовывают из 25 мл изопропанола. После сушки в вакуумной печи в течение ночи получают 8,29 г (73%) 7-амино-2- бензиламинопиридо[4,3-d]пиримидина в виде светло-желтого твердого вещества.
1H-ЯМР (диметилсульфоксид) δ: 9,10 (1H, с); 8,85 (1H, т, J = 5,8 Гц); 8,25 (1H, с); 7,21-7,36 (5H, м); 6,46 (2H, шир. с): 6,35 (1H, с); 4,74 (2H, д, J = 6,0 Гц).
ПРИМЕР 41
7-Амино-4-([R]-1-фенилэтиламино)пиридо[4,3-d]пиримидин
Смесь 0,072 мл (0,55 ммоля) [R]-1-фенилэтиламина и 97 мг (0,5 ммоля) 7-амино-4-метилтиопиридо[4,3-d] пиримидина [описанного в предыдущем эксперименте] нагревают при 180oC в атмосфере азота в течение 1,5 часов. Затем охлаждают реакционную смесь до комнатной температуры, получая осадок. Смесь прибавляют к воде и хлороформу, обрабатывают ультразвуком и фильтруют. Разделяют фазы и водную фазу экстрагируют хлороформом. Объединенные экстракты промывают водой, рассолом и сушат над сульфатом магния. Отгоняют растворитель при пониженном давлении и очищают остаток с помощью препаративной ТСХ [5% метанола в хлороформе] и перекристаллизации из хлороформа; получают 14,5 мг (11%) 7-амино-4-([R] -1- фенилэтиламино)пиридо[4,3-d]пиримидина; т. пл. 231,8-232,1oC.
1H-ЯМР (диметилсульфоксид) δ : 9,23 (1H, с); 8,50 (1H, д, J = 8,0 Гц); 8,19 (1H, с); 7,41 (2H, д, J = 7,0 Гц); 7,31 (2H, т, J = 8,0 Гц); 7,21 (1H, тт, J = 7,4 и 1,2 Гц); 6,45 (2H, с); 6,33 (1H, с); 5,56 (1H, п, J = 7,2 Гц); 1,55 (3H, д, J = 7,0 Гц).
ПРИМЕР 42
7-Амино-4-(2-аминобензиламино)пиридо[4,3-d]пиримидин
Смесь 136 мг (0,71 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 1,70 г (13,8 ммоля) в 5 мл изопропанола перемешивают при кипячении с обратным холодильником в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле [7-20% этанола в этилацетате] и оксиде алюминия [6-10% этанола/хлороформ]; получают 89 мг (47%) 7-амино-4-(2-аминобензиламино)пиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,08 (1H, с); 8,68 (1H, т, J = 5,8 Гц); 8,26 (1H, с); 7,05 (1H, д, J = 7,4 Гц); 6,96 (1H, т, J = 7,6 Гц); 6,63 (1H, д, J = 7,9 Гц); 6,51 (1H, т, J = 7,4 Гц); 6,46 (2H, шир. с); 6,35 (1H, с); 5,20 (2H, шир. с); 4,56 (2H, д, J = 5,8 Гц).
ПРИМЕР 43
7-Амино-4-(3-диметиламинобензиламино)пиридо[4,3-d]пиримидин
Смесь 236 мг (1,23 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 1,36 г (9,07 ммоля) 3-диметиламинобензиламина в 5 мл изопропанола перемешивают в атмосфере азота при кипячении с обратным холодильником в течение 1 часа, полученный продукт хроматографируют на силикагеле [10-15% этанола/этилацетат], затем на оксиде алюминия [1% этанола/хлороформ] и получают 145 мг (40%) 7-амино-4-(3-диметиламинобензиламино)пиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,11 (1H, с); 8,79 (1H, т, J = 5,9 Гц); 8,26 (1H, с); 7,11 (1H, дд, J = 8,0 Гц: 7,7 Гц); 6,73 (1H, шир. с); 6,63 (1H, д, J = 7,6 Гц); 6,60 (1H, дд, J = 8,1 и 2,2 Гц); 6,44 (2H, шир. с); 6,35 (1H, с); 4,67 (2H, д, J = 5,8 Гц); 2,86 (6H, с).
ПРИМЕР 44
7-Амино-4-(3-нитробензиламино)пиридо[4,3-d]пиримидин
Смесь 228 мг (1,19 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем примере] и 0,81 r (5,33 ммоля) 3-нитробензиламина перемешивают в атмосфере азота при 150 - 160oC в течение 1,5 часов; полученный в результате продукт хроматографируют на силикагеле [5-10% этанола/этилацетат]; получают 151 мг (43%) 7-амино-4-(3-нитробензиламино)пиридо[4,3-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,11 (1H, с); 8,98 (1H, т, J = 5,5 Гц); 8,26 (1H, с); 8,22 (1H, шир. с); 8,12 (1H, дд, J = 8,0; 1,8 Гц); 7,83 (1H, д, J = 7,7 Гц); 7,63 (1H, т, J = 7,9 Гц); 6,50 (2H, шир. с); 6,38 (1H, с); 4,85 (2H, д, J = 5,8 Гц).
ПРИМЕР 45
7-Амино-4-(3-метоксибензиламино)пиридо[4,3-d]пиримидин
Смесь 136 мг (0,71 ммоля) 7-амино-4-метилтиопирида[4,3-d]пиримидина [описанного в предыдущем примере] и 1,37 г (10,0 ммоля) 3-метоксибензиламина в 3 мл изопропанола перемешивают в атмосфере азота при кипячении с обратным холодильником в течение 3 часов. Выпаривание растворителя и хроматография на силикагеле (5 - 10% этанола/этилацетат) приводят к получению 153 мг (77%) 7-амино-4- (3-метоксибензиламино)пиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,11 (1H, с); 8,83 (1H, т, J = 5,7 Гц); 8,26 (1H, с); 7,24 (1H, дт, J = 0,8 Гц, J = 8,1 Гц); 6,92 (2H, м); 6,81 (1H, дт, J = 8,2 Гц, J = 1,2 Гц); 6,46 (2H, шир. с); 6,37 (1H, с); 4,71 (2H, д, J = 5,8 Гц); 3,73 (3H, с).
ПРИМЕР 46
7-Амино-4-(4-хлорбензиламино)пиридо[4,3-d]пиримидин-мезилат
Осаждают 56 мг (0,20 ммоля) свободного основания [полученного из 2,4-диамино-5-цианопиридиний-ацетата, муравьиной кислоты и 4- хлорбензиламина при 200oC, как описано в предыдущем примере] из ацетонового раствора с помощью 105 мкл (0,23 ммоля) метансульфоновой кислоты; получают полимезилатную соль.
1H-ЯМР (диметилсульфоксид) δ: 10,59 (1H, т, J = 5,6 Гц); 9,24 (1H, с); 8,69 (1H, с); 7,42 (4H, с); 6,42 (1H, с); 5,8 (6H, очень шир. с); 4,89 (2H, д, J = 5,8 Гц); 2,41 (7,5H, с).
ПРИМЕР 47
7-Амино-4-(2-бромбензиламино)пиридо[4,3-d]пиримидин
Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 0,84 г (4,52 ммоля) 2-бромбензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа, полученный продукт хроматографируют на силикагеле [1-5% этанола/этилацетат], получают 175 мг (45%) 7-амино-4-(2-бромбензиламино) пиридо[4,3-d]пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,16 (1H, с); 8,85 (1H, т, J = 5,7 Гц); 8,24 (1H, с); 7,64 (1H, д, J = 7,8 Гц); 7,34 (1H, дд, J = 7,7 и 7,1 Гц); 7,31 (1H, дд, J = 7,7 и 2,4 Гц); 7,21 (1H, ддд, J = 7,8; 6,9; 2,4 Гц); 6,50 (2H, шир. с); 6,39 (1H, с); 4,74 (2H, д, J = 5,7 Гц).
ПРИМЕР 48
7-Амино-4-(3-бромбензиламино)пиридо[4,3-d]пиримидин
Смесь 228 мг (1,19 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина [описанного в предыдущем эксперименте] и 0,84 г (4,52 ммоля) 3-бромбензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле [2-10% этанола/этилацетат] ; получают 203 м (52%) 7-амино-4-[(3- бромфенил)метиламино]-пиридо[4,3-d] пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,09 (1H, с); 8,86 (1H, т, J = 5,8 Гц); 8,26 (1H, с); 7,54 (1H, с); 7,44 (1H, д, J = 7,8 Гц): 7,36 (1H, д, J = 7,6 Гц); 7,29 (1H, т, J = 7,7 Гц); 6,48 (2H, с); 6,37 (1H, с); 4,73 (2H, д, J = 5,8 Гц).
ПРИМЕР 49
7-Амино-4-(4-бромбензиламино)пиридо[4,3-d]пиримидин
Смесь 234 мг (1,22 ммоля) 7-амино-4-метитиопиридо[4,3-d] пиримидина [описанного в предыдущем эксперименте] и 0,84 г (4,52 ммоля) 4-бромбензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле [10% этанола/этилацетат] , получают 192 мг (48%) 7-амино-4-(4-бромбензиламино)пиридо[4,3-d]пиримидина в виде твердого крема.
1H-ЯМР (диметилсульфоксид) δ: 9,09 (1H, с); 8,87 (1H, т, J = 5,7 Гц); 8,25 (1H, с); 7,51 (2H, д, J = 8,3 Гц); 7,31 (2H, д, J = 8,3 Гц); 6,46 (2H, шир. с); 6,37 (1H, с); 4,70 (2H, д, J = 5,8 Гц).
ПРИМЕР 50
7-Амино-4-(2-трифторметилбензиламино)пиридо[4,3-d]пиримидин
Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 0,90 мл (6,42 ммоля) 2-(трифторметил)бензиламина перемешивают в атмосфере азота при 150oC в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле [5% этанола/этилацетат], получают 0,22 г (59%) 7-амино-4-(2- трифторметилбензил)аминопиридо[4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,16 (1H, с); 8,88 (1H, т, J = 5,7 Гц); 8,23 (1H, с); 7,75 (1H, д, J = 7,7 Гц); 7,62 (1H, т, J = 7,5 Гц); 6,51 (2H, шир. с); 6,39 (1H, с); 4,92 (2H, д, J = 5,5 Гц).
ПРИМЕР 51
7-Амино-4-(3-трифторметилбензиламино)пиридо[4,3-d]пиримидин
Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 0,63 мл (4,40 ммоля) 3- (трифторметил)бензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа. Полученный в результате продукт хроматографируют на силикагеле [3-5% этанола/этилацетат], получают 0,24 г (63%) 7-амино-4-[(3-трифторметилфенил)метиламино] пиридо[4,3-d]пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,10 (1H, с); 8,92 (1H, т, J = 5,7 Гц); 8,26 (1H, с); 7,71 (1H, с); 7,66 (1H, д, J = 7,4 Гц); 7,62 (1H, д, J = 7,8 Гц); 7,57 (1H, т, J = 7,6 Гц); 6,49 (2H, шир. с); 6,38 (1H, с); 4,82 (2H, д, J = 5,8 Гц).
ПРИМЕР 52
7-Амино-4-(4-трифторметилбензиламино)пиридо[4,3-d]пиримидин
Смесь 225 мг (1,17 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 0,63 мл (4,42 ммоля) 4-(трифторметил)бензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа. Полученный в результате продукт хроматографируют на оксиде алюминия [5-10% этанола/хлороформ], затем на силикагеле [2-10% этанола/этилацетат] , получают 0,21 г (56%) 7-амино-4-[(4-трифторметилфенил)метиламино]пиридо[4,3-d]пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,12 (1H, с); 8,94 (1H, т, J = 5,8 Гц); 8,24 (1H, с); 7,69 (2H, д, J = 8,1 Гц); 7,56 (2H, д, J = 8,1 Гц); 6,48 (2H, шир. с); 6,38 (1H, с); 4,82 (2H, д, J = 5,8 Гц).
ПРИМЕР 53
7-Амино-4-(тиен-2-ил-метиламино)пиридо[4,3-d]пиримидин-димезилат
Соединение получают из 190 мг (0,98 ммоля) 2,4-диамино-5- циано-пиридиний-ацетата, 0,23 г (4,4 ммоля) муравьиной кислоты и 1,07 мл (10 ммолей) тиенилметиламина, как описано в предыдущем эксперименте. Сырой продукт превращают в димезилатную соль, как описано ранее, и перекристаллизовывают из изопропанола; получают 7-амино-4-(тиен-2-ил-метиламино)пиридо[4,3-d]пиримидин-димезилат с выходом 19%.
1H-ЯМР (диметилсульфоксид) δ: 10,67 (1H, т, J = 5,8 Гц); 9,21 (1H, с); 8,77 (1H, с); 7,48 (1H, дд, J = 5,1 и 1,2 Гц); 7,16 (1H, дд, J = 3,4 и 0,7 Гц); 7,02 (1H, дд, J = 4,8; 3,4 Гц); 6,42 (1H, с); 5,06 (2H, д, J = 5,7 Гц); 2,41 (6H, с).
ПРИМЕР 54
7-Ацетиламино-4-бензиламинопиридо[4,3-d]пиримидин
7-Ацетиламино-4-метилтиопиридо[4,3-d]пиримидин
Прибавляют 0,70 мл (9,84 ммоля) ацетилхлорида к раствору 0,20 г (1,04 ммоля) 7-амино-4-метилтиопиридо[4,3-d] пиримидина [описанного в предыдущем эксперименте] и 1,51 мл триэтиламина (10,8 ммоля) в тетрагидрофуране при 0oC, затем смесь перемешивают при 20oC в течение 4-х часов, прибавляют 50 мл воды, затем раствор экстрагируют 3 раза по 50 мл этилацетатом. Выпаривание и хроматография на оксиде алюминия [1% этанола/хлороформ] дают 0,12 г (49%) 7-ацетиламино-4-метилтиопиридо[4,3-d] пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 11,05 (1H, с); 9,30 (1H, с); 9,02 (1H, с); 8,38 (1H, с); 2,71 (3H, с); 2,18 (3H, с).
7-Ацетиламино-4-бензиламинопиридо[4,3-d]пиримидин
Смесь 0,40 г (1,71 ммоля) 7-ацетиламино-4-метилтиопиридо[4,3-d]пиримидина и 0,8 мл (9,15 ммоля) бензиламина перемешивают в атмосфере азота при 140oC в течение 1 часа, полученный в результате продукт хроматографируют на силикагеле (этилацетат), получают 0,31 г (62%) 7-ацетиламино-4-бензиламинопиридо [4,3-d]пиримидина в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,79 (1H, с); 9,42 (1H, с); 9,23 (1H, т, J = 5,8 Гц); 8,49 (1H, с); 8,18 (1H, с); 7,39 (1H, дт, J = 6,9 Гц, J = 1,7 Гц); 7,34 (1H, тт, J = 7,3 и 1,7 Гц); 7,25 (1H, тт, J = 7,1 и 1,7 Гц); 4,80 (2H, д, J = 5,8 Гц); 2,15 (3H, с).
ПРИМЕР 55
4-Анилинопиридо[3,4-d]пиримидин
4-Карбоксамидоникотиновая кислота
Прибавляют 8,3 г (55,6 ммоля) ангидрида 3,4-пиридиндикарбоновой кислоты к 12 мл конц. аммиака в 60 мл воды, перемешивают при 0oC в течение 5 минут. Во время прибавления образуется паста, которую перемешивают в течение 1 часа при комнатной температуре. Белого цвета пасту продувают азотом в течение 30 минут и разбавляют 10 мл воды при образовании прозрачного раствора. Затем барботируют сернистый ангидрид через раствор в течение 15 минут, понижая его pH до 2. При охлаждении образовавшийся твердый продукт отфильтровывают, промывают водой и сушат в печи; получают 7 г (76%) 4-карбоксамидоникотиновой кислоты в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 8,93 (1H, с); 8,76 (1H, д, J = 5,0 Гц); 8,08 (1H, с); 7,62 (1H, с); 7,45 (1H, J = 5,0 Гц).
Изохинолинимид
Нагревают 280 мг (1,68 ммоля) 4-карбоксамидоникотиновой кислоты примерно при 200oC в течение 5 часов, получают 177,2 мг (71%) имида изохинолиновой кислоты в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 11,68 (1H, с); 9,12-9,03 (2H, м); 7,80 (1H, д, J = 5,1 Гц).
3-Аминоизоникотиновая кислота
Прибавляют 1,71 г брома к 30 мл 10%-ного раствора гидроксида калия при охлаждении на льду. Полученный раствор прибавляют к тонко измельченному изохинолинимиду (1,46 г, 9,86 ммоля). При добавлении смесь начинает пениться. После растворения всего твердого продукта прибавляют 7 мл 15%-ного водного раствора гидроксида калия и нагревают смесь при 80oC в течение 1 минуты, затем охлаждают. Смесь нейтрализуют сернистым ангидридом и охлаждают до 0oC до тех пор, пока не осядет продукт. Твердый продукт собирают фильтрованием и промывают водой, сушат в вакуумной печи: получают 485 мг (36%) 3-аминоизоникотиновой кислоты в виде белого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,5-8,8 (2H, шир. с); 8,20 (1H, с); 7,70 (1H, д, J = 5 Гц); 7,46 (1H, д, J = 5 Гц).
3H-Пиридо[3,4-d]пиримид-4-он
Смесь 485 мг (3,51 ммоля) 3-аминоизоникотиновой кислоты в 3 мл формамида нагревают при 160oC в течение 12 часов. После охлаждения отфильтровывают полученный твердый продукт и промывают его водой, сушат в вакуумной печи; получают 373 мг (72%) 3H- пиридо[3,4-d]пиримид-4-она.
1H-ЯМР (диметилсульфоксид) δ: 12,60 (1H, шир. с); 8,68 (1H, д, J = 5,3 Гц); 8,23 (1H, с); 7,96 (1H, д, J=5,1 Гц).
4-Тиопиридо[3,4-d]пиримидин
К раствору 366 мг (2,49 ммоля) 3H-пиридо[3,4-d]пиримид-4-она в 4 мл пиридина прибавляют 1,25 г (2,74 ммоля) пятисернистого фосфора. Смесь кипятят с обратным холодильником в течение 4 часов в атмосфере азота. Полученную черную смолу растворяют в воде и получают твердый продукт. Его отфильтровывают и промывают водой, сушат в вакуумной печи; получают 369,8 мг (91%) 4-тиопиридо[3,4-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 14,48 (1H, шир. с); 9,13 (1H, с); 8,70 (1H, д, J = 5,4 Гц).
4-Метилтиопиридо[3,4-d]пиримидин
Смесь 369,8 мг (2,26 ммоля) 4-тиопиридо[3,4-d]пиримидина, 0,6 мл (4,5 ммоля) триэтиламина, 2 мл диметилсульфоксида и 0,24 мл (3,96 ммоля) иодметана перемешивают в атмосфере азота при 25oC в течение 12 часов. Смесь выливают в воду и полученный твердый продукт отфильтровывают и сушат в вакуумной печи; получают 222 мг (55%) 4-метилтиопиридо[3,4-d]пиримидина в виде коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 9,51 (1H, с); 9,18 (1H, с); 8,79 (1H, д, J = 8 Гц); 7,97 (1H, д = 8 Гц).
4-Анилинопиридо[3,4-d]пиримидин
Смесь 75 мг (0,42 ммоля) 4-метилтиопиридо[3,4-d]пиримидина и 1 мл анилина нагревают при 100oC в атмосфере азота в течение 2 часов. Затем реакционную смесь хроматографируют на двуокиси кремния, используя жидкостную хроматографию среднего давления и элюируя градиентной системой [от хлороформа до 5% метанола в хлороформе]. Концентрируют фракции при пониженном давлении и полученный твердый продукт перекристаллизовывают из эфира, получая 21,2 мг (23%) 4-анилинопиридо[3,4-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,09 (1H, с); 9,18 (1H, с); 8,74 (1H, д, J = 5,3 Гц); 8,46 (1H, д, J = 5,8 Гц); 7,89 (2H, д, J = 8,5 Гц): 7,45 (2H, т, J = 7,9 Гц); 7,21 (1H, T, J = 7,4).
ПРИМЕР 56
4-(3-Броманилино)пиридо[3,4-d]пиримидин
Смесь 75 мг (0,42 ммоля) 4-метилтиопиридо[3,4-d]пиримидина [см. предыдущий эксперимент] и 1 мл 3-броманилина нагревают в атмосфере азота при 100oC в течение 2 часов. Затем реакционную смесь хроматографируют на двуокиси кремния, используя жидкостную хроматографию среднего давления и элюируя градиентной системой (от хлороформа до 5% метанола в хлороформе). Фракции концентрируют при пониженном давлении и полученный в результате твердый продукт перекристаллизовывают из эфира, получая 66 мг (52,7%) 4-(3- броманилино)пиридо[3,4-d]пиримидина в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,15 (1H, с); 9,21 (1H, с); 8,80 (1H, с); 8,76 (1H, д, J = 5,8 Гц); 8,44 (1H, д, J = 5,6 Гц); 8,25 (1H, с); 7,93 (1H, д, J = 7,7 Гц); 7,45- 7,37 (2H, м).
ПРИМЕР 57
4-(3-Броманилино)-6-фторпиридо[3,4-d]пиримидин
5-[N-(трет.-бутоксикарбонил)амино]-2-фторпиридин
5-Амино-2-фторпиридин получают при гидрировании на палладии-на-угле 2-фтор-5-нитропиридина [полученного из 2-хлор-5-нитропиридина при взаимодействии с фторидом калия в ацетонитриле с тетрафенилбромидом фосфора. При взаимодействии сырого амина с трет.-Boc-ангидридом получают 5-[N-(трет.-бутоксикарбонил)амино]- 2-фторпиридин.
1H-ЯМР (диметилсульфоксид) δ: 8,07 (1H, с); 8,05 (1H, м); 6,89 (1H, дд, J = 9,2; 3,3 Гц); 6,66 (1H, м); 1,52 (9H, с).
5-[N-(трет.-Бутоксикарбонил)амино]-2-фторпиридин-4-карбоновая кислота
При взаимодействии 5,3 г (25 ммолей) 5-[N-(трет.- бутоксикарбонил)амино] -2-фторпиридина последовательно с н- бутиллитием и углекислым газом, как описано в следующем примере, получают 1,60 г (25%) 5-[N-(трет.-бутоксикарбонил)амино]-2- фторпиридин-4-карбоновой кислоты.
1H-ЯМР (диметилсульфоксид) δ: 9,83 (1H, шир. с); 8,84 (1H, с); 7,49 (1H, д, J = 2,9 Гц); 1,47 (9H, с).
5-Амино-2-фторпиридин-4-карбоновая кислота
При взаимодействии 1,0 г (3,9 ммоля) 5-[N-(трет.-бутоксикарбонил)амино]- 2-фторпиридин-4-карбоновой кислоты с трифторуксусной кислотой, как описано выше, получают 0,46 г (74%) 5-амино-2-фторпиридин-4-карбоновой кислоты.
1H-ЯМР (диметилсульфоксид) δ : 7,85 (1H, д, J = 1,5 Гц); 7,23 (1H, д, J = 2,5 Гц).
6-Фтор-3H-пиридо[3,4-d]пиримидин-4-он
При взаимодействии 5-амино-2-фторпиридин-4-карбоновой кислоты с формамидом при 140oC, как описано выше, получают 6-фтор-3H-пиридо[3,4-d]пиримидин-4-он (20%).
1H-ЯМР (диметилсульфоксид) δ : 12,48 (1H, м); 8,74 (1H, с); 8,16 (1H, с); 7,63 (1H, д, J = 3 Гц).
4-(3-Броманилино)-6-фторпиридо[3,4-d]пиримидин
При взаимодействии 0,60 г (3,6 ммоля) 6-фтор-3H-пиридо[3,4-d]пиримидин- 4-она с хлорокисью фосфора с последующей реакцией сырого 4,6-дигалоидного соединения с 3-броманилином получают 0,73 г (63%) 4-(3-броманилино)-6-фторпиридо[3,4-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 10,09 (1H, шир. с); 8,96 (1H, с); 8,75 (1H, с); 8,25 (2H, м); 7,90 (1H, шир. д, J = 6,5 Гц); 7,44-7,34 (2H, м).
ПРИМЕР 58
4-(3-Броманилино)-6-хлорпиридо[3,4-d]пиримидин
5-[N-(трет.-бутоксикарбонил)амино]-2-хлорпиридин
Смесь 12,86 г (0,1 моля) 5-амино-2-хлорпиридина, 24,0 г (0,11 моля) ди-трет.-бутилкарбоната и 12,1 г (1,12 моля) триэтиламина в 150 мл метиленхлорида кипятят с обратным холодильником в течение 12 часов и отфильтровывают осадок. Органический слой промывают водой, сушат над хлоридом кальция и фильтруют через короткую колонку с оксидом алюминия. Удаление растворителя приводит к получению 11,9 г (52%) 5-[N-(трет.-бутоксикарбонил)амино]-2- хлорпиридина.
1H-ЯМР (диметилсульфоксид) δ : 8,31 (1H, д, J = 2,9 Гц); 7,94 (1H, дд, J = 8,6; 2,6 Гц); 7,24 (1H, д, J = 8,7 Гц); 7,15 (1H, м); 1,51 (9H, с).
5-[N-(трет.-Бутоксикарбонил)амино]-2-хлорпиридин-4-карбоновая кислота
Раствор 22,87 г (0,1 моля) 5-[N-(трет.-бутоксикарбонил)амино]-2- хлорпиридина и 47 мл (0,31 моля) тетраметилендиамина в 600 мл безводного эфира охлаждают до -78oC и прибавляют по каплям 30 мл [0,3 моля] 10М гексанового раствора н-бутиллития. Раствору дают нагреться до -10oC, а затем выдерживают при этой температуре 2 часа и повторно охлаждают до -78oC. После этого барботируют сухой углекислый газ и дают нагреться полученной смеси до комнатной температуры (20oC), потом приливают 300 мл воды, содержащей незначительное количество гидроксида аммония. Полученный в результате водный слой промывают этилацетатом, затем медленно подкисляют разбавленной соляной кислотой для осаждения 15,5 г (57%) 5-[М-(трет.-бутоксикарбонил)амино]-2-хлорпиридин-4-карбоновой кислоты.
1H-ЯМР (диметилсульфоксид) δ : 10,00 (1H, с); 9,13 (1H, с); 7,74 (1H, с); 1,47 (9H, с).
5-Амино-2-хлорпиридин-4-карбоновая кислота
Суспензию 1,91 г (7 ммолей) 5-[М-(трет.-бутоксикарбонил)- амино]-2-хлорпиридин-4-карбоновой кислоты в 200 мл метиленхлорида медленно обрабатывают трифторуксусной кислотой до гомогенности (примерно 12 мл). Раствор перемешивают в течение ночи и экстрагируют разбавленной соляной кислотой; получают в виде осадка 1,05 г (выход 87%) 5-амино-2-хлорпиридин-4-карбоновой кислоты.
1H-ЯМР (диметилсульфоксид) δ: 9,01 (2H, м); 8,03 (1H, с); 7,48 (1H, с).
6-Хлор-3H-пиридо[3,4-d]пиримидин-4-он.
Раствор 8,1 г (4,7 ммоля) 5-амино-2-хлорпиридин-4-карбоновой кислоты в 100 мл формамида перемешивают при 140oC в течение 12 часов. Разбавление холодной смеси водой дает в виде осадка 7,3 г (выход 86%) 6-хлор-3H-пиридо[3,4-d]пиримидин-4-она.
1H-ЯМР (диметилсульфоксид) δ : 12,73 (1H, м); 8,90 (1H, д, J = 0,7 Гц); 8,23 (1H, с); 7,97 (1H, д, J = 0,7 Гц).
4.6-Дихлорпиридо[3,4-d]пиримидин
Кипятят с обратным холодильником при перемешивании суспензию 1,82 г (10 ммолей) 6-хлорпиридо[3,4-d]пиримидин-4-она в 10 мл хлорокиси фосфора до полного растворения [примерно 2 часа и еще дополнительно 30 минут]. Избыток реагента удаляют в вакууме, остаток обрабатывают смесью метиленхлорида и охлажденным на льду водным раствором карбоната натрия. Полученный в результате органический слой сушат над сульфатом натрия и выпаривают; получают с количественным выходом сырой нестабильный 4,6- дихлорпиридо[4,3-d]пиримидин, который используют непосредственно в следующей стадии.
1H-ЯМР (диметилсульфоксид) δ : 9,38 (1H, д, J = 0,5 Гц); 9,19 (1H, с); 8,09 (1H, д, J = 0,5 Гц).
4-(3-Броманилино)-6-хлорпиридо[4,3-d]пиримидин
Смесь полученного выше сырого дихлорпиримидина и 3,8 г (22 ммоля) 3-броманилина растворяют в 100 мл изопропанола. Прибавляют одну каплю концентрированной соляной кислоты, чтобы вызвать реакцию, а затем кипятят смесь с обратным холодильником в течение 30 минут, охлаждают и разбавляют водой для осаждения 1,26 г (выход 38%) 4-(3-броманилино)-6-хлорпиридо[3,4-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 10,12 (1H, с), 9,03 (1H, с); 8,77 (1H, с); 8,63 (1H, с); 8,21 (1H, с); 7,89 (1H, д, J = 8,1 Гц); 7,43-7,32 (2H, м).
ПРИМЕР 59
4-(3-Броманилино)-6-метоксипиридо[3,4-d]пиримидин
Обработка 4-(3-броманилино)-6-фторпиридо[3,4-d] пиримидина [см. предыдущий эксперимент] при 100oC в автоклаве с помощью метоксида натрия в метаноле дает 4-(3-броманилино)-6- метоксипиридо[3,4-d]пиримидин.
1H-ЯМР (диметилсульфоксид) δ: 9,93 (1H, с); 8,94 (1H, с); 8,61 (1H, с); 8,26 (1H, шир. с); 7,94 (1H, шир. д. J = 7,6 Гц); 7,88 (1H, с); 7,43-7,32 (2H, м); 4,01 (3H, с).
ПРИМЕР 60
4-(3-Броманилино)-6-метиламинопиридо[3,4-d]пиримидин
Обработка 0,20 г (0,63 ммоля) 4-(3-броманилино)-6-фторпиридо[3,4-d] пиримидина [см. предыдущий эксперимент] при 100oC в автоклаве с помощью метиламина в этаноле с последующей хроматографией на оксиде алюминия [метиленхлорид/метанол = 99:1] дает 0,07 г (34%) 4-(3-броманилино)-6-метиламинопиридо[3,4-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,69 (1H, с); 8,75 (1H, с); 8,41 (1H, с); 8,21 (1H, шир. с); 7,93 (1H, шир. д, J = 7,6 Гц); 7,41-7,28 (2H, м); 7,06 (1H, с); 6,82 (1H, к, J = 5,0 Гц); 4,95 (3H, д, J = 5,0 Гц).
ПРИМЕР 61
4-(3-Броманилино)-6-диметиламинопиридо[3,4-d]пиримидин
Обработка 4-(3-броманилино)-6-фторпиридо[3,4-d]пиримидина (см. предыдущий эксперимент) при 100oC в автоклаве с помощью диметиламина в этаноле дает 4-(3-броманилино)-6- диметиламинопиридо[3,4-d]пиримидин.
1H-ЯМР (диметилсульфоксид) δ : 9,71 (1H, с); 8,83 (1H, с); 8,43 (1H, с); 8,21 (1H, шир. с); 7,94 (1H, шир. д, J = 7,5 Гц); 7,42-7,29 (2H, м); 7,26 (1H, с); 3,17 (6Н, с).
ПРИМЕР 62
4-(Бензиламино)пиридо[4,3-d]пиримидин
Смесь 74 мг (0,41 ммоля) 4-метилтиопиридо[3,4-d]пиримидина [см. предыдущий эксперимент] и 1 мл бензиламина нагревают 2 часа при 100oC. Охлажденную смесь концентрируют при пониженном давлении и очищают сразу препаративной ТСХ на силикагеле, элюируя метиленхлоридом; получают 21,2 мг (20%) 4- (бензиламино)пиридо[3,4-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,21 (1H, т, J = 5,8 Гц); 9,19 (1H, с); 8,63 (1H, д, J = 5,8 Гц); 8,58 (1H, с); 8,20 (1H, д, J = 5,1 Гц); 7,41-7,30 (4H, м); 7,26 (1H, т, J = 7,1 Гц).
ПРИМЕР 63
4-(3-Броманилино)пирило[2,3-d]пиримидин 3
H-Пиридо[2,3-d]пиримидин-4-он
Нагревают 15 г (108,6 ммоля) 2-аминоникотиновой кислоты в 35 мл формамида при 165-170oC в течение 3,5 часов. При охлаждении осаждается твердый продукт. Его отфильтровывают и промывают водой, сушат в вакуумной печи; получают 7,87 г (49,4%) 3H-пиридо[2,3- d]пиримидин-4-она.
1H-ЯМР (диметилсульфоксид) δ: 12,50 (1H, с); 8,97 (1H, дд, J = 1,9 и 4,5 Гц); 8,53 (1H, дд, J = 2,1 и 7,9 Гц); 8,34 (1H, с); 7,57 (1H, дд, J = 4,6 и 8,0 Гц).
4-Тиопиридо[2,3-d]пиримидин
Прибавляют 6 г (13,5 ммоля) пятисернистого фосфора к раствору 2 г (13,5 ммоля) 3H-пиридо[2,3-d] пиримидин-4-она в 50 мл пиридина. Смесь кипятят с обратным холодильником в течение 3 часов. При охлаждении образуется твердый осадок и пиридин декантируют. Твердый продукт суспендируют в 20 мл воды, затем фильтруют и сушат в вакуумной печи; получают 1,72 г (78%) 4- тиопиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,06 (1H, дд, J = 1,9 и 4,3 Гц); 8,90 (1H, дд, J = 1,9 и 8,2 Гц); 8,36 (1H, с); 7,65 (1H, дд, J = 4,3 и 8,2 Гц).
4-Метилтиопиридо[2,3-d]пиримидин
Смесь 100 мг (0,76 ммоля) 4-тиопиридо[2,3-d]пиримидина, 154 мг (1,52 ммоля) триэтиламина, 2 мл диметилсульфоксида и 161 мг (1,14 ммоля) иодметана перемешивают 12 часов при 25oC. Смесь выливают в воду и экстрагируют этилацетатом. Объединенные экстракты промывают водой, рассолом и сушат над сульфатом магния, растворитель отгоняют в вакууме; получают 134 мг (количественный выход) 4-метилтиопиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,25 (1H, дд. J = 1,8 и 4,2 Гц); 9,17 (1H, с); 8,59 (1H, дд, J = 1,9 и 8,2 Гц); 7,75 (1H, дд, J = 4,3 и 8,2 Гц); 2,73 (3H, с).
4-(3-Броманилино)пиридо[2,3-d]пиримидин
Смесь 157 мг (0,89 ммоля) 4-метилтиопиридо[2,3-d]пиримидина и 1 мл 3-броманилина нагревают при 100oC в течение 2 часов. При охлаждении образуется осадок, который отфильтровывают, затем промывают этанолом и сушат на воздухе; получают 55,5 мг (20%) 4- (3-броманилино)пиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 10,13 (1H, с); 9,11 (1H, дд, J = 1,7 и 4,3 Гц); 9,01 (1H, дд, J = 1,7 и 8,2 Гц); 8,81 (1H, с); 8,22 (1H, с); 7,90 (1H, д, J = 7,7 Гц); 7,71 (1H, дд, J = 4,3 и 8,0 Гц); 7,40 (2H, м).
ПРИМЕР 64
4-(3-Броманилино)-7-фторпиридо[2,3-d]пиримидин
2,6-Дифторникотиновая кислота
2,6-Дифторпиридин (7,89 мл, 0,087 ммоля) прибавляют по каплям в атмосфере азота при 78oC к перемешиваемому раствору диизопропиламида лития (59,0 мл 1,5 н. раствора в циклогексане; 0,089 ммоля) в 250 мл ТГФ. После 2 часов при 78oC через раствор пропускают ток сухого углекислого газа, разбавляют смесь водой и промывают этилацетатом. Водную часть нейтрализуют 3 н. соляной кислотой, экстрагируют этилацетатом и обрабатывают, чтобы получить 13,4 г (97%) 2,6-дифторникотиновой кислоты.
1H-ЯМР (диметилсульфоксид) δ: 8,59 (1H, дд, J = 9,2 и 8,2 Гц); 7,30 (1H, дд, J = 8,2 и 2,1 Гц); 4,03 (1H, шир. с).
2,6-Дифторникотинамид
Раствор 7,4 г (0,046 ммоля) 2,6-дифторникотиновой кислоты и 20 мл тионилхлорида в 60 мл 1,2-дихлорэтана, содержащего 1 каплю диметилформамида, кипятят с обратным холодильником в течение 4 часов, затем концентрируют досуха при пониженном давлении. Растворяют осадок в 100 мл эфира, охлаждают до 0oC и обрабатывают, добавляя по каплям 10,0 мл (0,17 ммоля) концентрированного аммиака. Через 10 минут раствор промывают водным раствором бикарбоната натрия и обрабатывают; получают 5,61 г (76%) 2,6- дифторникотинамида.
1H-ЯМР (диметилсульфоксид) δ: 8,70 (1H, дд, J = 9,6 и 8,3 Гц); 7,00 (1H, ддд, J = 8,3; 2,9; 1,1 Гц); 6,71 и 6,55 (1H, 1H, 2 шир. с).
2-Амино-6-фторникотинамид
Раствор 4,68 г (0,029 ммоля) 2,6-дифторникотинамида в 30 мл безводного формамида насыщают аммиаком и оставляют при комнатной температуре на 24 часа. Прибавляют 50 мл воды и отфильтровывают полученный осадок, промывают его водой; получают 1,41 г (31%) 6- амино-2-фторникотинамида: т. пл. 236-237oC.
1H-ЯМР (диметилсульфоксид) δ : 7,89 (1H, дд, J = 10,4 и 8,4 Гц); 7,31 и 7,16 (1H, 1H, 2 шир. с); 6,93 (2H, шир. с); 6,36 (1H, дд, J = 8,4 и 2,4 Гц).
Фильтрат и промывные воды объединяют и исчерпывающе экстрагируют этилацетатом; экстракт хроматографируют на силикагеле. Смесью этилацетат/петролейный эфир (1:1) элюируют предварительную фракцию, тогда как смесь этилацетата с петролейным эфиром (2:1) и затем этилацетат дают 1,57 г (35%) 2-амино-6-фторникотинамида; т. пл. (из смеси этилацетата с петролейным эфиром) 199-200oC.
1H-ЯМР (диметилсульфоксид) δ : 8,13 (1H, дд, J = 10,4 и 8,4 Гц); 7,90, 7,30 (1H, 1H, 2 шир. с); 7,65 (2H, шир. с); 6,23 (1H, дд, J = 8,4 и 2,6 Гц).
Суспензию 0,74 г (4,77 ммоля) 2-амино-6-фторникотинамида в 25 мл триэтилортоформиата кипятят с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры отфильтровывают осадок и тщательно промывают петролейным эфиром; получают 0,76 г (96%) 7-фторпиридо[2,3-d] пиримид-4(3H)-она.
1H-ЯМР (диметилсульфоксид) δ: 12,75 (1H, шир. с); 8,66 (1H, дд, J = 10,4 и 8,4 Гц); 8,38 (1H, с); 7,33 (1H, дд, J = 8,4 и 2,6 Гц).
4-(3-Броманилино)-7-фторпиридо[2,3-d]пиримидин
Суспензию 0,20 г (1,21 ммоля) 7-фторпиридо[2,3-d]пиримид- 4(3H)-она в 10 мл хлорокиси фосфора кипятят с обратным холодильником в течение 2 часов. Затем отгоняют летучие компоненты в вакууме, остаток распределяют между водным раствором бикарбоната натрия и этилацетатом. Органический экстракт обрабатывают, получая сырой 4-хлор-7-фторпиридо[2,3-d]пиримидин, который используют непосредственно на следующей стадии. Раствор 0,20 г этого продукта (1,09 ммоля) и 0,23 мл (2,18 ммоля) 3-броманилина в 1,0 мл пропан-2-ола и 10 мл тетрагидрофурана, содержащий следовые количества концентрированной соляной кислоты, перемешивают 1 час при 20oC, затем концентрируют досуха. Остаток растворяют в этилацетате, промывают водным раствором бикарбоната натрия и обрабатывают; получают масло, которое хроматографируют на силикагеле. Элюирование смесью этилацетат/петролейный эфир (1:5) дает 3-броманилин, тогда как смесь этилацетат/петролейный эфир (1:1) элюирует 0,18 г (47%) 4- (3-броманилино)-7-фторпиридо[2,3-d]пиримидина: т. пл. (из метанола) 211-213oC.
1H-ЯМР (диметилсульфоксид) δ : 10,18 (1H, шир. с); 9,17 (1H, т, J = 8,6 Гц); 8,80 (1H, с); 8,17 (1H, т, J = 1,8 Гц); 7,85 (1H, дт, J = 7,6 Гц; J = 1,8 Гц); 7,53 (1H, дд, J = 8,6 и 2,7 Гц); 7,41-7,34 (2H, м).
ПРИМЕР 65
7-Амино-4-(3-броманилино)пиридо[2,3-d]пиримидин
Раствор 0,20 г (0,63 ммоля) 4-(3-броманилино)-7- фторпиридо[2,3-d]пиримидина в 20 мл этанола насыщают аммиаком и нагревают при 100oC в автоклаве в течение 30 часов. Отгоняют растворитель при пониженном давлении; получают 0,18 г (90%) 7- амино-4-(3-броманилино)пиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 8,97 (1H, шир. с); 8,59 (1H, с); 8,51 (1H, д, J = 9,3 Гц); 8,11 (1H, шир. с); 7,77 (1H, шир, д, J = 6,3 Гц); 7,44 (2H, шир. с); 7,37-7,30 (2H, м); 6,81 (1H, д, J = 9,3 Гц).
ПРИМЕР 66
4-(3-Броманилино)-7-метиламинопиридо[2,3-d]пиримидин
Раствор 0,20 г (0,63 ммоля) 4-(3-броманилино)-7-фторпиридо[2,3-d]пиримидина [см. предыдущий эксперимент], 0,13 г (1,88 ммоля) солянокислого метиламина и 0,30 мл (2,19 ммоля) триэтиламина в 15 мл этанола нагревают при 100oC в автоклаве в течение 18 часов. Растворитель удаляют при пониженном давлении, остаток распределяют между этилацетатом и водой. Обработка органического слоя дает 0,16 г (77%) 4-(3-броманилино)-7-(метиламино)пиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,53 (1H, с); 8,54 (1H, с); 8,41 (1H, д, J = 8,1 Гц), 8,17 (1H, т, J = 1,8 Гц); 7,83 (1H, дд, J = 8,0 Гц и 1,9 Гц); 7,66 (1H, шир. с); 7,32 (1H, т, J = 8,0 Гц); 7,24 (1H, дд, J = 8,0 и 1,8 Гц); 6,77 (1H, д, J = 8,1 Гц); 2,92 (3H, д, J = 4,8 Гц).
ПРИМЕР 67
4-(3-Броманилино)-7-диметиламинопиридо[2,3-d]пиримидин
При взаимодействии 0,12 г (0,38 ммоля) 4-(3-броманилино)-7- фторпиридо[2,3-d] пиримидина [см. предыдущий эксперимент] с 92 мг (1,13 ммоля) солянокислого диметиламина и 0,18 мл (1,32 ммоля) триэтиламина в 15 мл этанола при 100oC в течение 18 часов в автоклаве с последующим выпариванием растворителя и обработкой получают 0,11 г (84%) 4-(3-броманилино)-7-(диметиламино)пиридо [2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,58 (1H, шир. с); 8,56 (1H, д, J = 9,3 Гц); 8,54 (1H, с); 8,18 (1H, т, J = 1,9 Гц); 7,84 (дт, Jd = 8,0 Гц; Jt = 1,9 Гц); 7,33 (1H, дд, J = 8,1 и 8,0 Гц); 7,25 (1H, дт, Jd = 9,3 Гц, Jt = 1,9 Гц); 7,10 (1H, д, J = 9,3 Гц); 3,18 (6H, с).
ПРИМЕР 68
4-(3-Броманилино)-7-метоксипиридо[2,3-d]пиримидин
Раствор 0,26 г (0,81 ммоля) 4-(3-броманилино)-7-фторпиридо[2,3-d] пиримидина и метоксида натрия (приготовленного из 75 мг натрия, 3,26 ммоля) в 15 мл безводного метанола нагревают при 90oC в автоклаве в течение 18 часов. Смесь выливают в воду и экстрагируют этилацетатом; получают 0,23 г (86%) 4-(3-броманилино)-7-метоксипиридо[2,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 9,88 (1H, шир. с); 8,82 (1H, д, J = 8,9 Гц); 8,71 (1H, с); 8,18 (1H, дд, J = 8,0 и 1,9 Гц); 7,36 (1H, дд, J = 8,1 и 8,0 Гц); 7,29 (1H, ддд, J = 8,1; 1,9; 1,9 Гц): 7,15 (1H, д, J = 8,9 Гц); 4,01 (3H, с).
ПРИМЕР 69
4-Бензиламино-7-метиламинопиримидо[4,5-d]пиримидин
S-Этилизотиуроний-иодид
Раствор 3,80 г (50 ммолей) тиомочевины и 4 мл (50 ммолей) иодэтана в 100 мл метанола кипятят с обратным холодильником в течение 24 часов. Отгоняют растворитель при пониженном давлении и оставшееся светло-желтое масло сушат в вакууме; оно самопроизвольно затвердевает. Целевое соединение (13,98 г) получают с количественным выходом.
4-Амино-5-циано-2-этилтиопиримидин
Прибавляют суспензию 2,7 г (50 ммолей) метоксида натрия в 200 мл этанола к смеси 11,58 г (50 ммолей) S-этилизотиомочевино- гидроиодида, 6,1 г (50 ммолей) этоксиметилиденмалононитрила и 250 мл этанола при 25oC. Реакционную смесь кипятят с обратным холодильником в атмосфере азота в течение 2 часов, затем концентрируют раствор на горячей плите до тех пор, пока не появится осадок. После охлаждения отфильтровывают твердый продукт и перемешивают в воде при 25oC. После фильтрации и сушки в вакуумной печи получают 4,02 г (45%) 4-амино-5-циано-2- этилтиопиримидина в виде коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 8,45 (1H, с); 7,90 (2H, шир. с); 3,00 (2H, к, J = 7,3 Гц); 1,27 (3H, т, J = 7,3 Гц).
4-Амино-2-этилтиопиримидин-5-карбоксамид
Прибавляют 4,0 г (22,3 ммоля) 4-амино-5-циано-2-этилтиопиримидина к 4,3 мл концентрированной серной кислоты, маленькими порциями. Затем смесь перемешивают в атмосфере азота при 40oC в течение 1,5 часов. Реакцию прекращают добавлением льда с водой и используют гидроксид аммония для установления pH 9. Твердый продукт собирают фильтрованием и сушат в вакуумной печи в течение ночи. Получают 4-амино-2-этилтиопиримидин-5-карбоксамид (2,58 г, 58%) в виде светло-коричневого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 8,52 (1H, с); 7,98 (2H, шир. с); 7,42 (2H, шир. с); 3,04 (2H, к, J = 7,3 Гц); 1,27 (3H, т, J = 7,3 Гц).
4-Оксо-7-этилтио-3H-пиримидо[4,5-d]пиримидин
Смесь 4,66 г (23,5 ммоля) 4-амино-2-этилтиопиримидин-5- карбоксамида и 150 мл триэтилортоформиата кипятят с обратным холодильником в атмосфере азота в течение 24 часов, затем охлаждают до 25oC. Отфильтровывают коричневый твердый продукт и сушат в вакуумной печи; получают 3,54 г (72%) 4-оксо-7-этилтио-3H- пиримидо[4,5-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ: 12,80 (1H, с); 9,20 (1H, с); 8,45 (1H, с;: 3,18 (1H, к, J = 7,4 Гц); 1,35 (3H, т, J = 7,4 Гц).
4-Тионо-7-этилтио-3H-пиримидо[4.5-d]пиримидин
Смесь 1,33 г (6,7 ммоля) 4-оксо-7-этилтио-3H-пиримидо[4,5-d]пиримидина, 1,48 г (6,6 ммоля) пятисернистого фосфора и 15 мл пиридина кипятят с обратным холодильником в атмосфере азота в течение 3 часов. Затем отгоняют пиридин при пониженном давлении и растворяют остаток в 75 мл 0,5 М раствора гидроксида натрия и кипятят с активированным углем. После фильтрации нейтрализуют фильтрат уксусной кислотой; образуется золотисто-коричневый твердый продукт. Фильтруют на воронке Бюхнера и сушат в вакуумной печи; получают 1,42 г (95%) 4-тионо-7-этилтио-3H-пиримидо[4,5-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,47 (1H, с), 9,46 (1H, с); 3,20 (2H, к, J = 7,3 Гц); 1,35 (3H, т, J = 7,3 Гц).
7-Этилтио-4-метилтиопиримидо[4,5-d]пиримидин
Работают по методике примера 21, описанной для 7-амино-4- метилтиопиридо [4,3-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 9,52 (1H, с); 9,15 (1H, с); 3,23 (2H, к, J = 7,3 Гц); 2,72 (3H, т, J = 7,3 Гц).
4-Бензиламино-7-этилтиопиримидо[4,5-d]пиримидин.
Работают по методике примера 21, описанной для 7-амино-4- анилинопиридо [4,3-d]пиримидина.
4-Бензиламино-7-метиламинопиримидо[4,5-d]пиримидин
Нагревают 4-бензиламино-7-этилтиопиримидо[4,5-d] пиримидин в этаноле, содержащем избыток метиламина, при 150oC в стальном автоклаве в течение 5 часов. Отфильтровывают твердый продукт и сушат его, получая 4-бензиламино-7-метиламинопиримидо[4,5-d]пиримидин.
ПРИМЕР 70
4-Бензиламино-7-гидразинопиримидо[4,5-d]пиримидин
Нагревают 4-бензиламино-7-этилтиопиримидо[4,5-d]пиримидин в этаноле, содержащем избыток гидразина, при 150oC в стальном автоклаве в течение 5 часов. Отфильтровывают твердый продукт и сушат его; получают 4-бензиламино-7-гидразинопиримидо[4,5-d]пиримидин.
ПРИМЕР 71
гидрохлорид 4-(3-Броманилино)тиено[3,2-d]пиримидина
3H-Тиено[3,2-d]пиримид-4-он
Смесь 1 г (6,3 ммоля) метил-3-аминотиофен-2-карбоксилата и 2 г формамида нагревают при 240oC в течение 10 минут. При охлаждении образуется осадок. Его растворяют в этаноле и фильтруют. Фильтрат концентрируют при пониженном давлении и очищают остаток хроматографией на силикагеле, элюируя 10% метанола в метиленхлориде; получают 249 мг (26%) 3H-тиено-[3,2-d]пиримид-4-она в виде твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 12,61 (1H, шир. с); 8,20 (1H, с); 8,17 (1H, д, J = 5 Гц); 7,42 (1H, д, J = 5 Гц).
4-Хлортиено[3,2-d]пиримидин
К раствору 170,3 мкл (2,2 ммоля) диметилформамида и 1,2 мл дихлорэтана при 0oC в атмосфере азота медленно и при перемешивании в течение 10 минут прибавляют 279,2 мг (3,2 ммоля) оксалилхлорида. Прибавляют 152,2 мг (1,0 ммоль) 3H-тиено[3,2-d] пиримид-4-она и кипятят с обратным холодильником в течение 5 часов. Реакционную смесь выливают в воду и экстрагируют метиленхлоридом. Органический слой разгоняют при пониженном давлении, получают 140 мг (82%) 4-хлортиено[3,2-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,05 (1H, с); 8,62 (1H, д, J = 5 Гц); 7,79 (1H, д, J = 5 Гц).
4-(3-Броманилино)тиено[3,2-d]пиримидин-гидрохлорид
Смесь 135 мг (0,79 ммоля) 4-хлортиено[3,2-d]пиримидина и 95 мкл (0,89 ммоля) 3-броманилина в 2 мл 2-метоксиэтанола нагревают при 79oC в течение 30 минут. Отфильтровывают образовавшийся осадок и промывают метиленхлоридом; получают 195,5 мг (72%) гидрохлорида 4-(3-броманилино)тиено[3,2-d]пиримидина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 11,33 (1H, с); 8,94 (1H, с); 8,23 (1H, с); 8,53 (1H, д, J = 5,3 Гц); 8,07 (1H, с); 7,77 (1H, д, J =7,9 Гц); 7,6 (1H, д, J = 5,3 Гц), 7,48 (3H, м).
ПРИМЕР 72
4-Бензиламинотиено[3,2-d]пиримидин
По методике предыдущего эксперимента, из 100 мг (0,586 ммоля) 4-хлортиено [3,2-d]пиримидина и 710 мкл (0,645 ммоля) бензиламина в 2 мл 2-метоксиэтанола получают 37 мг (26%) 4- бензиламинотиено[3,2-d]пиримидина.
1H-ЯМР (диметилсульфоксид) δ : 8,42 (1H, с); 8,12 (1H, д, J = 5,5 Гц); 7,39 (1H, д, J = 5,3 Гц); 7,40-7,30 (4H, м); 7,24 (1H, т, J = 6,8 Гц).
ПРИМЕР 73
4-(3-Броманилино)тиено[2,3-d]пиримидин
Метил-2-аминотиофен-3-карбоксилат
Смесь 3,25 г (32,3 ммоля) метилцианоацетата, 5 г (32,8 ммоля) 1,4-дитиан-2,5-диола, 1 мл (7,71 ммоля) триэтиламина в 50 мл этанола перемешивают при 40oC в течение 1 часа. Охлажденный раствор элюируют через слой двуокиси кремния метиленхлоридом. Фильтрат выпаривают досуха; получают сырой метил-2-аминотиофен-3-карбоксилат, который используют в следующей стадии.
1H-ЯМР (диметилсульфоксид) δ : 7,26 (1H, с); 6,82 (1H, д, J = 5,8 Гц); 6,28 (1H, д, J = 5,8 Гц); 3,69 (3H, с).
3H-Тиено[2,3-d]пиримид-4-он
Нагревают раствор 602,1 мг (3,83 ммоля) метил-2-аминотиофен- 3-карбоксилата в 5 мл формамида при 200oC в течение 12 часов. Полученную в результате смолу растворяют в 10 мл метиленхлорида, затем помещают на слой двуокиси кремния и элюируют 10% метанола в метиленхлориде. Фильтрат выпаривают при пониженном давлении и полученный твердый продукт промывают этанолом; получают 231,4 мг (40%) 3H-тиено[2,3-d]пиримид-4-она в виде оранжевого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 12,50 (1H, шир. с); 7,60 (1H, д, J = 5,8 Гц); 7,41 (1H, д, J = 6,0 Гц).
4-Хлортиено[2,3-d]пиримидин
К раствору 90 мкл диметилформамида и 2 мл метиленхлорида при 0oC в атмосфере азота медленно прибавляют 148 мг (1,2 ммоля) оксалилхлорида и перемешивают 10 минут. К раствору прибавляют 81 мг (0,52 ммоля) 3H-тиено[2,3-d]пиримид-4-она в виде твердого продукта и нагревают струей теплого воздуха до тех пор, пока твердый продукт не растворится. Реакционную смесь перемешивают при 25oC в течение 12 часов в атмосфере азота. Затем выливают ее в воду и экстрагируют метиленхлоридом. Разделяют фазы и сушат органический слой над сульфатом натрия, отгоняют растворитель при пониженном давлении, получая 87,6 мг 97%) 4-хлортиено[2,3-d]пиримидина в виде твердого продукта.
1H-ЯМР (диметилсульфоксид) δ: 8,96 (1H, с); 8,17 (1H, д, J = 6,0 Гц); 7,62 (1H, д, J = 6,0 Гц).
4-(3-Броманилино)тиено[2,3-d]пиримидин-гидрохлорид
Смесь 135 мг (0,79 ммоля) 4-хлортиено[2,3-d]пиримидина и 95 мкл (0,89 ммоля) 3-броманилина в 2 мл 2-метоксиэтанола нагревают при 79oC в течение 30 минут при перемешивании. Отфильтровывают полученный твердый продукт и промывают метиленхлоридом; получают 197 мг (73%) 4-(3-броманилино)тиено [2,3-d] пиримидин-гидрохлорида.
1H-ЯМР (диметилсульфоксид) δ : 9,99 (1H, с); 8,60 (1H, с); 8,23 (1H, с); 7,98 (1H, д, J = 6,0 Гц); 7,88 (1H, д, J = 8,0 Гц); 7,79 (1H, д, J = 6,0 Гц); 7,37 (1H, т, J = 8,0 Гц); 7,30 (1H, д, J = 8,0 Гц).
ПРИМЕР 74
4-Бензиламинопирроло[2,3-d]пиримидин
4-Бензиламинопирроло[2,3-d] пиримидин известен из Chem. Abstr. 1962, 57, 15130 с.
ПРИМЕР 75
N6-(3-Бромфенил)аденин
Смесь 1,0 г (6,47 ммоля) 6-хлорпурина, 0,78 мл (7,12 ммоля) 3-броманилина и 4-х капель концентрированной соляной кислоты в 10 мл изопропанола перемешивают при 80oC в течение 5 часов. При охлаждении образуется осадок. Твердый продукт отфильтровывают, промывают изопропанолом и сушат на воздухе; получают 1,93 г (91%) N6-(3-бромфенил)аденина в виде светло-желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 11,38 (1H, с); 8,75 (1H, с); 7,90 (1H, д, J = 8,0 Гц); 7,38-7,34 (2H, м).
ПРИМЕР 76
N6-Бензиладенин
N6-Бензиладенин является коммерческим продуктом фирмы Олдрич Кемикал Компани, 1001, West Saint Paul Avenue, Milwaukee, Wisconsin 53233.
ПРИМЕР 77
7-Амино-4-(3-метиланилино)пиридо[4,3-d]пиримидин
Смесь 217 мг (1,13 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 1,50 г (14.0 ммоля) м-толуидина перемешивают при 155oC в течение 30 минут. Полученный продукт хроматографируют на силикагеле [5% метанола/метиленхлорид] ; получают 190 мг (67%) 7-амино-4-(3-метиланилино) пиридо[4,3-d]пиримидина в виде светло-желтого продукта.
1H-ЯМР (диметилсульфоксид) δ : 9,81 (1H, шир. с); 9,34 (1H, с); 8,38 (1H, с); 7,60 (2H, с); 7,26 (1H, дд, J = 8,5 Гц, 7,6 Гц); 6,95 (1H, д, J = 7,4 Гц); 6,63 (2H, с): 2,33 (3H, с).
ПРИМЕР 78
7-Амино-4-(4-метоксианилино)пиридо[4,3-d]пиримидин
Смесь 129 мг (0,62 ммоля) 7-амино-4-метилтиопиридо[4,3-d]пиримидина и 0,15 г (1,2 ммоля) 4-метоксианилина в 5 мл этанола нагревают при 40oC в течение 16 часов, затем кипятят с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают при 0oC в течение ночи, собирают твердый продукт фильтрацией в вакууме и перекристаллизовывают из изопропанола: получают 42 мг (25%) 7- амино-4-(4-метоксианилино)пиридо[4,3-d]пиримидина в виде желтого твердого продукта.
1H-ЯМР (диметилсульфоксид) δ : 10,00 (1H, шир. с); 9,31 (1H, с); 8,35 (1H, с); 7,62 (2H, д, J = 9,2 Гц); 6,96 (2H, д, J = 9,2 Гц); 6,70 (2H, шир. с); 6.41 (1H, с); 3,77 (3H, с).
ПРИМЕР 79
4-(3-Броманилино)-6-(пиперидин-1-ил)пиридо[3,4-d]пиримидин
При обработке 4-(3-броманилино)-6-фторпиридо[3,4-d]пиримидина (см. предыдущий эксперимент) при 100oC в автоклаве с помощью пиперидина в этаноле получают 4-(3-броманилино)-6- диметиламинопиридо[3,4-d]пиримидин.
Предлагаемые способы ингибирования тирозинкиназы рецептора эпидермального фактора роста иллюстрируются следующими опытами.
Биологические опыты
Материалы и методы
Очистка тирозинкиназы рецептора эпидермального фактора роста (далее "рецептор EGF")
Тирозинкиназу рецептора человеческого EGF изолируют из клеток A431 человеческой эпидермальной карциномы, которые сверхэкспрессируют рецептор EGF по обычным методикам. Клетки выращивают во вращающихся колбах в питательной среде из 50% среды Дельбукко, модифицированной Иглом, и 50% среды НАМ F-12 (Гибко), содержащей 10% фетальной телячьей сыворотки. Примерно 109 клеток лизируют в двух объемах буфера, содержащего 20 мМ (4N-[2- гидроксиэтил]пиперазин-1-ил)-этансульфоновой кислоты (Гепес), pH 7,4, 5 мМ этиленгликоль-бис-[2-аминоэтиловый простой эфир]-N,N, N',N'-тетраукусной кислоты (ЭГТК), 1% Тритона Х-100, 10% глицерина, 0,1 мМ ортованадата натрия, 5 мМ фторида натрия, 4 мМ пирофосфата, 4 мМ бензамида, 1 мМ дитиореитола, 80 мкг/мл апротинина, 40 мкг/мл лейпептина и 1 мМ фенилметилсульфонилфторида. После центрифугирования при 25000 g в течение 10 минут супернатант (надосадочную жидкость) уравновешивают в течение 2-х часов при 4oC с 10 мл сефарозы агглютинина зародышей пшеницы, которая была предварительно уравновешена с раствором, содержащим 50 мМ Гепес, 10% глицерина, 0,1% Тритона Х-100 и 150 мМ хлорида натрия, pH 7,5 (уравновешивающий буфер). Загрязняющие протеины вымывают из смолы с помощью 1 М раствора хлорида натрия в уравновешивающем буфере, и фермент элюируют 0,5 М раствором N-ацетил-1-D-глюкозамина в уравновешивающем буфере, затем 1 мМ раствором мочевины. Фермент элюируют с помощью раствора 0,1 мг/мл EGF. Рецептор, по-видимому, гомогенный по оценке на полиакриламидных электрофоретических гелях, окрашенных Кумасси-голубым.
Определение концентрации ингибирования (ИК50): анализы ферментов для определения ИК50 проводят в общем объеме 0,1 мл, содержащем 25 мМ Гепес, pH 7,4, 5 мМ хлорида магния, 2 мМ хлорида марганца, 50 мкМ ванадата натрия, 5-10 нг тирозинкиназы рецептора EGF, 200 мкМ пептида в качестве субстрата, (Ac-Lys-His-Lys-Lys- Leu-Ala-Glu-Gly-Ser-Ala-Tyr472-Glu-Glu-Val-NH2), происходящего от аминокислоты (было показано, что Tyr472 является одним из четырех тирозинов в PLC (фосфолипаза C)-гамма-1, который фосфорилируется тирозинкиназой рецептора EGF [Wahl M.I., Nishibe S., Kun J.W., Rhee S.G., Carpenter G. , J. Biol. Chem. (1990), 265, 3944-3948], и пептиды, происходящие из последовательности фермента, окружающего этот участок, являются отличными субстратами для фермента, 10 мкМ АТФ, содержащих 1 мкКю [32P] АТФ, и инкубируют в течение 10 минут при комнатной температуре. Реакцию заканчивают добавлением 2 мл 75 мМ фосфорной кислоты и пропускают через фильтровальный диск диаметром 2,5 см из фосфоцелюлозы для связывания пептида. Фильтр промывают пять раз 75 мМ фосфорной кислотой и помещают в пробирку вместе с 5 мл сцинтиллирующей жидкости (Реди-гель, Бекман) (см. в табл. 1).
Клетки
Фибробласты мыши Swiss 3Т3, клетки А431 человеческой эпидермальной карциномы и MCF-7 [клетки карциномы человеческой молочной железы из Мичиганского ракового фонда] , SK-BR-3 [клетки карциномы человеческой молочной железы], MDA-MB-231- и MDA-MB-468- [клетки карциномы человеческой молочной железы] клетки карциномы груди были получены из Коллекции культур американского типа, Роквилл, Мериленд, и поддерживались в виде монослоев в dMEM [среде Дельбукко, модифицированной Иглом] [F12, 50:50 (Гибко) ВКЦ, содержащей 10% фетальной бычьей сыворотки. Для получения кондиционированной среды, MDA-MB-231-клетки выращивают до слияния во вращающихся колбах емкостью 850 см3 и заменяют среду на 50 мл среды, не содержащей сыворотки. Через 3 дня кондиционированную среду удаляют, замораживают аликвотными порциями и используют как источник герегулина для стимуляции erbB-2, 3, 4.
Антитела
Моноклональные антитела, выведенные к PDGF [фактор роста целевого тромбоцита] рецептору или фосфотирозину, были получены из Upstate Biotechnology, Inc. , Lake Placid, NY. Анти-рр39jun [антитело к c-jun фактору транскрипции, который представляет собой фосфопротеин величиной 39 кДальтон] и антитела рецептора анти-EGF были получены из Oncogene Science, Uniondale, NY.
Иммуноосаждение и Вестерн-блоттинг
Клетки выращивают до 100% слияния в чашках Петри диаметром 100 мм (Корнинг). После обработки клеток в течение 5 минут с помощью или EGF [эпидермальный фактор роста] , PDGF, или bFGF [основной фактор роста фибробластов] [20 нг/мл] или 1 мл кондиционированной среды от клеток MDA-MB-231, среду удаляют и монослой соскабливают в 1 мл охлажденного льдом лизирующего буфера [50 мМ Гепес, pH 7,5, 150 мМ хлорида натрия, 10% глицерина, 1% Тритона Х-100, 1 мМ ЭДТК (этилендиаминтетрауксусная кислота), 1 мМ ЭГТК, 10 мМ пирофосфата натрия, 30 мМ п-нитрофенилфосфата, 1 мМ ортованадата, 50 мМ фторида натрия, 1 мМ фенилметилсульфонилфторида, 10 мкг/мл апротинина и 10 мкг/мл лейпептина] . Лизат переносят в микроцентрифужную пробирку [маленькая центрифуга, у которой имеются пластиковые центрифужные пробирки емкостью 1-2 мл], помещают на 15 минут на лед и 5 минут центрифугируют при 10000 g. Супернатант переносят в чистую микроцентрифужную пробирку и добавляют к этим образцам 5 мкг антитела. Пробирки центрифугируют в течение 2 часов при 4oC, после чего прибавляют 25 мкл протеин-A-сефарозы и продолжают центрифугирование еще по крайней мере 2 часа. Протеин-A-сефарозу промывают 5 раз с помощью раствора, содержащего 50 мМ Гепеса, pH 7,5, 150 мМ хлорида натрия, 10% глицерина и 0,2% азида натрия. Осадки ресуспендируют в 30 мкл буфера Леммли (Laemmli, Nature, т. 727, стр. 680-685, 1970), нагревают при 100oC в течение 5 минут и центрифугируют для получения супернатанта. Полный клеточный экстракт получают при соскабливании клеток, выросших на стенках пластин с шестью ячейками, в 0,2 мл кипящего буфера Леммли. Экстракт переносят в микроцентрифужную пробирку и в течение 5 минут нагревают при 100oC. Весь супернатант от иммуноосаждения или 35 мкл цельного клеточного экстракта наносят на полиакриламидный гель (4-20%) и проводят электрофорез по методу Леммли (Laemmli, 1970). Протеины в геле электрофоретически переносят на нитроцеллюлозу и мембрану промывают один раз раствором, содержащим 10 мМ Трис-буфера, pH 7,2, 150 мМ хлорида натрия, 0,01% Азида (буфер, называемый далее ТНА) и блокируют в течение ночи в ТНА, содержащем 5% бычьего сывороточного альбумина и 1% яичного альбумина (блокирующий буфер). Мембрану подвергают блоттингу в течение 2 часов с первичным антителом [1 мкг/мл в блокирующем буфере] , а затем промывают последовательно 2 раза с помощью ТНА, ТНА, содержащего 0,05% Твин-20 и 0,05% Нони-дет П-40 [коммерчески доступный детергент] , и ТНА. Затем мембраны инкубируют в течение 2 часов в блокирующем буфере, содержащем 0,1 мкКю/мл [125]протеина-A и снова промывают, как указано выше. После сушки блотов их вносят в кассету с пленкой и экспонируют рентгеновскую пленку X-AR в течение 1-7 дней. Протеин A является бактериальным протеином, который специфически связывает некоторые IgG подтипы, и полезен при связывании и выделении комплексов антитело-антиген.
Нозерн-блоттинг
Всю клеточную РНК изолируют из необработанного контроля или обработанных Swiss 3Т3 клеток, используя RNAzol-B [торговое название Tel Test Inc. для набора, используемого для изоляции РНК из тканей] и следуют рекомендациям, приведенным производителем. Загружают в 1%-ный агарозный гель 40-50 мкг РНК и проводят электрофорез в течение 3-4 часов при напряжении 65 вольт. РНК в геле переносится под действием капиллярных сил на нейлоновую мембрану (Гибонд-N, Амерсхам). 40-mer-c-jun-3онд метят [32P] АТФ, используя Т4 нуклеотидкиназу (Промега), и очищают на колонке с G25 сефадексом, следуя процедуре, рекомендованной производителем, Онкоген Сайенс. Гибридизацию проводят в течение ночи при 65oC (c-jun является немедленно-ранним фактором транскрипции; он является одним из компонентов АР-1, тогда как FOS является вторым компонентом АР-1).
Митогенез, опосредованный фактором роста
Выращивают фибробласты Swiss 3Т3 до 90-100% слияния на пластинках с 24 ячейками (1,7 х 1,6 см, плоское дно) и задерживают рост в несодержащей сыворотки среде в течение 18 часов. Лекарство добавляют в определенные ячейки за 2 часа до введения факторов роста, а затем клетки подвергают действию или 20 нг/мл EGF, PDGF или bFGF, или 10% сыворотки в течение 24 часов. Добавляют 2 мкКю [метил-3P]-тимидина в каждую ячейку и инкубируют 2 часа при 37oC. Клетки трипсинизируют и инжектируют в 2 мл охлажденной на льду 15%-ной трихлоруксусной кислоты. Полученный в результате осадок собирают на стекловолокнистых фильтрах, промывают пять раз по 2 мл аликвотами охлажденной на льду 15%-ной трихлоруксусной кислоты, сушат и помещают в сцинтилляционную колбу с 10 мл Реди-геля (Бекман, Ирвин, СА). Определяют радиоактивность с помощью сцинтилляционного счетчика Бекмана ЛС 6800.
Анализ ингибирования роста
Клетки (2 • 104) высевают в пластины с 24 ячейками (1,7 х 1,6 см, плоское дно) в 2 мл среды с добавками или без них различных концентраций лекарства. Пластины инкубируют 3 дня при 37oC во влажной атмосфере, содержащей 5% углекислого газа в воздухе. Рост клеток определяют подсчетом клеток с помощью электронного счетчика клеток Культер Модель AM [Культер Электроник, Инк. ] . Результаты по ингибированию вызванного EGF аутофосфорилирования в клетках А431 эпидермальной карциномы и аутофосфорилирования, вызванного кондиционированной средой, в клетках опухоли груди SKBR-3 соединениями настоящего изобретения сведены в таблице 2.
Противопролиферативные свойства ингибиторов тирозинкиназы [ИК50(нМ)] сведены в таблице 3.
Вышеуказанные гели, более детально описанные в экспериментальной части, демонстрируют эффективность соединений настоящего изобретения при блокировании некоторых EGF-стимулированных митогенных сигнальных превращений в целых клетках. Числа слева от гелей указывают положения стандартов молекулярной массы в килоДальтонах. Полоска меченого контроля показывает степень экспрессии относящегося к росту сигнала в отсутствие EGF стимуляции, тогда как полоска меченого EGF [или PDGF или b-FGF] показывает величину стимулированного фактором роста сигнала. Другие полоски показывают влияние установленных количеств названного лекарства на стимулированную фактором роста активность, измерение которой показывает, что соединения настоящего изобретения обладают мощным действием на целые клетки, согласованным с их способностью ингибировать тирозинкиназную активность рецептор EGF.
Гель с соединением примера 40 детектирует мРНК для c-jun путем гибридизации со специфическим радиомеченым РНК зондом для c-jun. Гель показывает, что EGF, PDGF и b-FGF факторы роста стимулируют продуцирование c-jun в клетках Swiss 3Т3 и что соединение примера 40 блокирует это продуцирование EGF-стимулированными клетками, но не PDGF или b-FGF стимулированными клетками.
Влияние соединения примера 40 на экспрессию р39c-jun, опосредованную фактором роста
Этот гель показывает количество индуцированных c-jun в Swiss 3Т3 клеток под действием фактора роста EGF, PDGF и b-FGF, путем определения с помощью анти-c-jun-специфического моноклонального антитела. Он показывает способность соединения примера 40 блокировать c-jun-экспрессию в Swiss 3Т3 при стимуляции EGF, но не при стимуляции PDGF или b-FGF.
Следует учитывать, что соединения согласно изобретению могут быть использованы в сочетании с другими компонентами для усиления их активности. Такими дополнительными компонентами являются антинеопластические материалы, например доксорубицин, таксол, циспластин и т.п.
Было обнаружено, что соединения согласно изобретению могут ингибировать как Erb-b2, так и Erb-b4 рецепторы и, следовательно, обладают существенно высокой клиничной активностью, целесообразной для сочетания с вышеупомянутыми антинеопластическими агентами.
Для иллюстрации вышеописанных биологических опытов представляются еще фиг. 1-17, по которым даются следующие пояснения.
На фиг. 1 показано влияние соединений примеров 6 и 7 на рецептор EGF аутофосфорилирования при A431 человеческой эпидермальной карциноме.
На фиг. 2 представлено влияние соединения примера 8 на рецептор аутофосфорилирования при A431 человеческой эпидермальной карциноме.
На фиг.3 показано время ингибирования рецептора EGF аутофосфорилирования при A431 соединением примера 27.
На фиг.4 показано влияние соединения примера 27 на рецептор EGF аутофосфорилирования в A431 клетках.
На фиг. 5 представлено ингибирование рецептора EGF аутофосфорилирования при A431 человеческой эпидермальной карциноме соединением примера 40.
На фиг. 6 представлено влияние соединения примера 40 на фосфорилирование тирозина, опосредованное фактором роста, в Swiss 313.
На фиг. 7 представлено влияние соединения примера 40 на зависящую от фактора роста экспрессию c-jun мРНК в фибробластах мыши Swiss 3Т3.
На фиг. 8 представлено влияние соединения примера 40 на экспрессию р39c-jun, опосредованную фактором роста.
На фиг. 9 представлено влияние соединения примера 59 на аутофосфорилирование рецептора EGF при A431 человеческой эпидермальной карциноме.
На фиг. 10 представлено влияние соединения примера 60 на аутофосфорилирование рецептора EGF при A431 человеческой эпидермальной карциноме.
На фиг. 11 представлено влияние соединения примера 61 на аутофосфорилирование рецептора EGF при A431 человеческой эпидермальной карциноме.
На фиг. 12 представлено влияние соединения примера 70 на аутофосфорилирование рецептора EGF при A431 человеческой эпидермальной карциноме.
На фиг. 13 представлен график, показывающий ингибирование рецептора EGF тирозинкиназы соединением примера 27.
На фиг. 14 представлен график, показывающий влияние соединения примера на митогенез, опосредованный фактором роста в фибробластах мыши Swiss 3Т3.
Фиг. 15 представляет собой фотографию линии фибробластов мыши Н1H 3Т3, трансфицированных человеческим EGFR геном, показывающую нормально выровненную морфологию.
Фиг. 16 представляет собой фотографию той же клеточной линии, обработанной 100 нг/мл EGF, показывающую типичную веретенообразную трансформированную морфологию.
Фиг. 17 представляет собой фотографию той же клеточной линии в присутствии одновременно 100 нг/мл EGF и 5 мкмоль соединения примера 27, показывающую морфологию, возвращенную обратно от трансформированного типа к нормальному типу.
Фармацевтические композиции согласно изобретению могут выпускаться в виде разнообразных дозировочных форм для орального или парентерального применения. Дозировочные формы в качестве активных компонентов содержат вышеуказанный ингибитор.
Для получения фармацевтических композиций используют инертные, фармацевтически приемлемые носители, которые могут быть либо твердыми, либо жидкими. Твердая форма препаратов включает порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории. Твердый носитель может представлять собой одно или более веществ, которые также могут действовать как разбавители, вкусовые вещества, солюбилизаторы, придающие скользкость таблеткам агенты, суспендирующие агенты, связующие или дезинтеграторы таблеток; твердый носитель также может быть инкапсулирующим материалом. В порошках носитель представляет собой тонко измельченное твердое вещество, которое смешано с тонко измельченными активными соединениями. В таблетках активные соединения смешаны с носителем, обладающим необходимыми связывающими свойствами, в соответствующих пропорциях, и спрессованы в виде желательной формы и размера. Предпочтительно порошки и таблетки содержат от 5% или 10% до примерно 70% активных ингредиентов. Подходящими твердыми носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатина, трагакант, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, низкоплавкие воски, масло какао и т.п. Термин "препарат" означает совокупность активных соединений с инкапсулирующими материалами в качестве носителя, обеспечивающими образование капсулы, в которой активные компоненты (с другими носителями или без них) окружены носителем, находясь таким образом в ассоциации с ним. То же самое относится к облаткам. Таблетки, порошки, облатки и капсулы могут быть использованы как твердые дозировочные формы, пригодные для орального введения.
Жидкая форма препаратов включает растворы, суспензии и эмульсии. В качестве примера можно указать водные растворы или растворы на основе воды с пропиленгликолем для парентеральной инъекции. Жидкие препараты могут также находиться в виде раствора в водном растворе полиэтиленгликоля. Водные растворы, пригодные для орального применения, можно приготовлять путем растворения активного компонента в воде с добавлением подходящих красителей, вкусовых веществ, стабилизаторов и, если желательно, загущающих агентов. Водные суспензии, пригодные для орального применения, могут быть получены путем диспергирования тонко измельченных активных компонентов в воде вместе с вязким материалом, например природными или синтетическими смолами, камедью, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и другими хорошо известными суспендирующими агентами.
Предпочтительно фармацевтический препарат представляет собой форму единичной дозы. В такой форме препарат может быть разделен на единичные дозы, содержащие соответствующие количества ингибитора или других противораковых соединений, индивидуально или в сочетании, например, в смеси. Форма единичной дозы может находиться в упаковке, причем упаковка содержит отдельные количества препарата, например таблетки, капсулы и порошки, упакованные во флаконы или ампулы. Форма единичной дозы также может быть капсулой, облаткой или таблеткой или она может представлять собой соответствующее количество любых из них в упаковке. Кроме того, форма единичной дозы может быть разделенной формой, содержащей в одной части ингибитор, а в другой части - другие противораковые вещества, такой как, например, разделенная капсула, разделенная упаковка или двухкамерная ампула, флакон и т.п.
Количество ингибитора в единичных дозах препарата можно изменять или регулировать примерно от 0,01 мг/кг до 100,0 мг/кг, предпочтительно от 0,03 мг/кг до менее чем 1,0 мг/кг массы тела.
Фармацевтические композиции предпочтительно приготовляют так, что их можно вводить парентерально или орально. Растворы активных соединений в виде свободных оснований и свободных кислот или фармацевтически приемлемых солей, могут быть приготовлены в воде, смешанной с подходящим поверхостно-активным агентом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть приготовлены в глицерине, жидких полиэтиленгликолях и их смесях или в маслах. При обычных условиях хранения и использования эти препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, пригодные для инъекций, включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсий для инъекций в момент употребления. Во всех случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы она могла легко проходить через шприц. Она должна быть стабильной в условиях производства и хранения и должна быть предохранена от вредного воздействия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропилен-гликоль, жидкий полиэтиленгликоль, и т.п.), их соответствующие смеси и растительные масла. Соответствующую текучесть можно поддерживать, например, путем использования покрытия, такого, как лецитин, путем соблюдения требуемого размера частиц в случае дисперсии и путем использования поверхостно-активных агентов. Предотвращение действия микроорганизмов можно осуществлять с помощью различных антибактериальных и противогрибковых агентов, например парагены, хлорбутанол, фенол, сорбиновая кислота, тимеросаль и т.п. Во многих случаях предпочтительно включать изотонические агенты, например, сахара или хлорид натрия. Пролонгированная абсорбация композиций для инъекций обеспечивается агентами, замедляющими абсорбацию, например желатиной.
Стерильные растворы для инъекций готовят путем введения активных соединений в требующемся количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, по потребности, с последующей стерилизацией путем фильтрования. Обычно дисперсии готовят путем введения различных стерилизованных активных ингредиентов в стерильный эксципиент, который содержит основную диспергирующую среду и необходимые другие ингредиенты, выбираемые из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительными способами получения являются вакуумная сушка и сушка вымораживанием, которые обеспечивают получение порошка активных ингредиентов плюс дополнительный требуемый ингредиент из их предварительно стерильно профильтрованного раствора. Используемое здесь понятие "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбацию агенты, и т.п. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно специалистам в данной области техники. За исключением случаев несовместимости сред или агентов с активным ингредиентом, является возможным применение любых обычных сред или агентов в терапевтических композициях. Дополнительные активные ингредиенты также могут быть включены в композиции.
Особенно предпочтительно приготовлять парентеральные композиции в форме единичной дозы для облегчения введения и однородности дозирования. Термин "форма единичной дозы", используемый здесь, относится к физически дискретным единицам, пригодным в качестве единичных доз для подвергаемых лечению млекопитающих; каждая единица содержит заранее определенное количество активных материалов, рассчитанное для достижения желаемого терапевтического эффекта, в сочетании с требующимся фармацевтическим носителем. Состав новых форм единичных доз согласно изобретению обусловлен и непосредственно зависит от (а) индивидуальных характеристик активных веществ и конкретно ожидаемого терапевтического эффекта и (б) от ограничения, свойственного технологии смешивания таких активных веществ, для лечения пациентов, страдающих вышеуказанными заболеваниями.
Основные активные ингредиенты смешивают для удобного и эффективного введения в эффективных количествах с фармацевтически пригодным носителем в форме единичной дозы, как описано выше. Форма единичной дозы для парентерального введения может, например, содержать основное активное соединение, например ингибитор, в количествах примерно от 0,5 до примерно 100 мг, предпочтительно в пределах 0,1-50 мг. Суточные дозы для парентерального введения млекопитающим находятся в пределах от 0,01 мг/кг до 10 мг/кг массы тела. Предпочтительная суточная доза составляет 0,1-1 мг/кг.
Для оральных доз суточное количество может находиться в пределах от 0,01 мг активного соединения /кг массы тела млекопитающего до 100 мг/кг, предпочтительно 0,1-10 мг/кг массы тела.
Соединения согласно изобретению могут образовывать хорошо известные фармацевтически приемлемые соли, такие как соли щелочных металлов и другие обычные основные соли или соли присоединения кислот и т.п. Указания на основные вещества, следовательно, означают включение этих общеизвестных солей, практически эквивалентных родственному соединению и его гидратам.
Далее, соединения согласно изобретению способны образовывать фармацевтически приемлемые соли присоединения как кислот, так и/или соли присоединения оснований. Все эти формы входят в рамки настоящего изобретения. Фармацевтически приемлемые соли присоединения кислот активных соединений включают соли, производимые от нетоксичных неорганических кислот, таких как соляная кислота, азотная кислота, фосфорная кислота, серная кислота, бромоводородная кислота, иодоводородная кислота, фтороводородная кислота, фосфоновая кислота и т.п., а также соли, производимые от нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты, алкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и т.п. Такие соли, следовательно, включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, бромид, иодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат, малонат, сукцинат, соль пробковой кислоты, себацинат, фумарат, малеат, соль миндальной кислоты, бензоат, хлорбензоат, метилбензоат, динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, тартрат, метансульфонат и т.п. Также пригодными являются соли аминокислот, такие как аргинат и т.п. и глюконат, галак-туронат (см. , например, Berge S.M. и др. "Pharmaceutical Salts" Journal of Pharmaceutical Science, 66, с. 1-19, 1977).
Соли присоединения кислот вышеуказанных основных соединений получают путем контактирования формы свободного основания с достаточным количеством желательной кислоты, получая соль обычным образом. Предпочтительно активное соединение можно превращать в кислую соль путем обработки раствором желательной кислоты так, чтобы результирующее значение pH было ниже 4. Раствор можно пропускать через колонку с C/s-фазой, чтобы абсорбировать соединение, промывать обильным количеством воды, элюировать соединение полярным органическим растворителем, таким как, например, метанол, ацетонитрил и т.п., и выделять путем концентрирования при пониженном давлении с последующей лиофилизацией. Форма свободного основания может быть регенерирована путем введения солевой формы в контакт с основанием и выделения свободного основания обычным образом. Формы свободных оснований отчасти отличаются от их соответствующих солевых форм некоторыми физическими свойствами, такими как растворимость в полярных растворителях, однако в других отношениях, для целей настоящего изобретения, соли эквивалентны соответствующим им свободным основаниям.
Фармацевтически приемлемые соли присоединения оснований представляют собой соли металлов или аминов, таких как щелочные и щелочноземельные металлы и органические амины. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний, кальций и т.п. Примерами пригодных аминов являются N,N-дибензилэтилендиамин, этилендиамин, N- метилглюкамин и прокаин (см. , например, Berge S.M. и др. "Pharmaceutical Salts", Journal of Pharmaceutical Science, 66, с. 1-19, 1977).
Основные соли присоединения вышеуказанных кислых соединений получают путем введения в контакт свободной кислотной формы с достаточным количеством желательного основания с получением соли обычным образом. Предпочтительно активное соединение может быть превращено в основную соль путем обработки водным раствором желательного основания, так чтобы результирующее значение pH было выше 9. Раствор можно пропускать через колонку с C|8-фазой, чтобы абсорбировать соединение, промывать обильным количеством воды, элюировать соединение полярным органическим растворителем, таким как, например, метанол, ацетонитрил и т.п., и выделять путем концентрирования при пониженном давлении с последующей лиофилизацией. Свободная кислотная форма может быть регенерирована путем контактирования солевой формы с кислотой и выделения свободной кислоты обычным образом. Свободные кислотные формы отчасти отличаются от их соответствующей солевой формы некоторыми физическими свойствами, такими как растворимость в полярных растворителях, однако в других отношениях, для целей настоящего изобретения, соли являются эквивалентными соответствующим им свободным кислотам.
Некоторые из соединений настоящего изобретения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Обычно сольватированные формы, включая гидратированные формы, являются эквивалентными несольватированным формам и, следовательно, входят в рамки настоящего изобретения.
Некоторые из соединений настоящего изобретения содержат один или несколько хиральных центров и такой центр может существовать в R(D)- или S(L) - конфигурации. Настоящее изобретение включает все энантиомерные и эпимерные формы, а также их соответствующие смеси.
Предлагаемые фармацевтические композиции иллюстрируются следующими примерами.
Пример 80
Таблетки следующего состава:
60 мг активного вещества, например целевого продукта примера 1,
45 мг крахмала,
35 мг микрокристаллической целлюлозы,
4 мг поливинилпирролидона в виде 10%-ного раствора в воде,
4,5 мг натриевой соли карбоксиметилового крахмала,
0,5 мг стеарата магния,
1,0 мг талька
приготовляют следующим образом.
Активное вещество, крахмал и целлюлозу пропускают через сито с размером отверстий 45 меш, после чего тщательно перемешивают. Получаемый порошок смешивают с раствором поливинилпирролидона, и получаемую смесь пропускают через сито с размером отверстий 14 меш. Получаемые гранулы сушат при 50 - 60oC, после чего пропускают через сито с размером отверстий 18 меш и смешивают со смесью натриевой соли карбоксиметилового крахмала, стеарата, магния и талька, предварительно пропущенной через сито с размером отверстий 60 меш. Получаемую смесь перерабатывают в таблетки весом 150 мг.
Пример 81
Парентеральный препарат состава:
100 мг активного вещества, например, целевого продукта примера 17,
250 мл 0,9%-ного водного хлористого натрия
приготовляют путем интенсивного перемешивания. pH препарата: 7,0.
Пример 82
Инъекционный раствор состава
20,0 г активного вещества, например целевого продукта примера 28,
700 мл пропиленгликоля,
200 мл воды для инъекций смешивают, стерилизуют, наполняют в ампулы емкостью 50 мл, которые герметично закрывают в атмосфере азота.
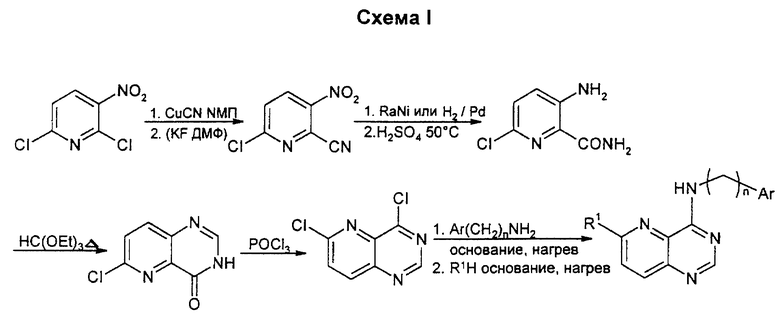
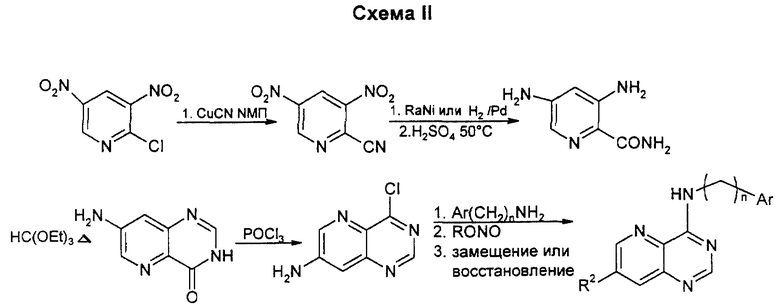
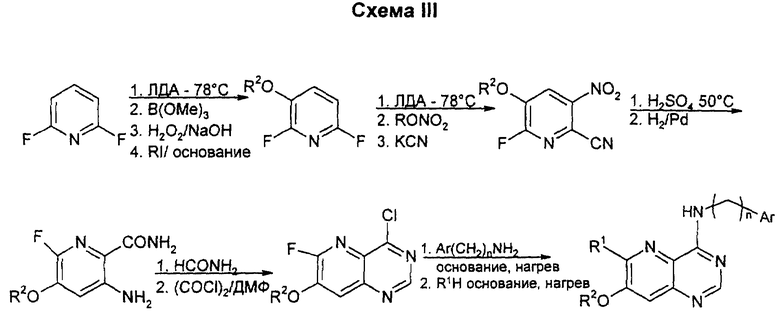
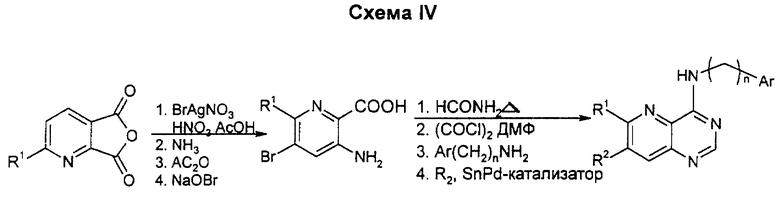
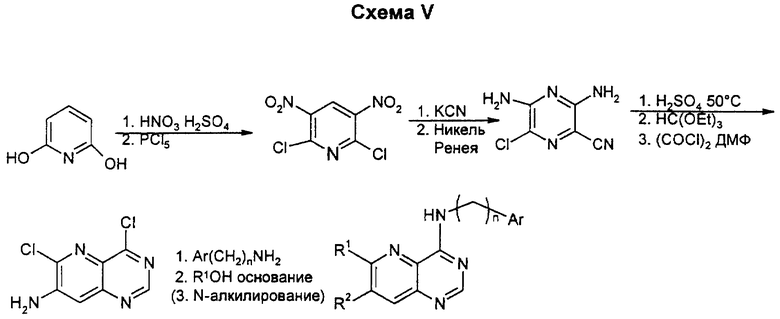
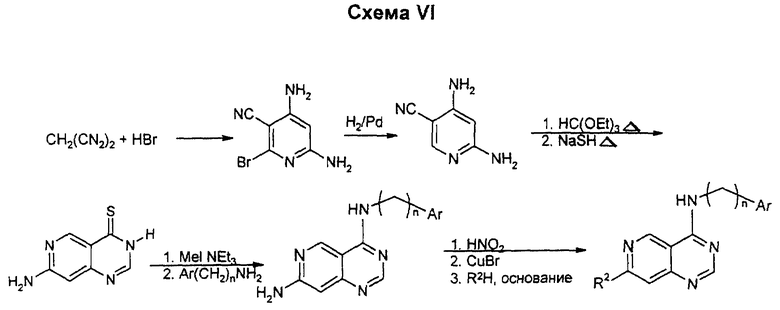
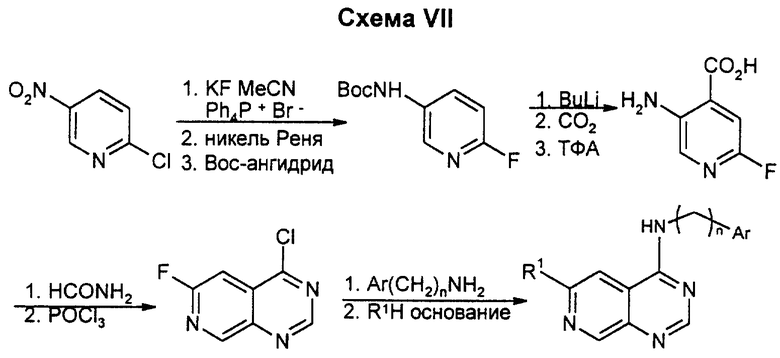
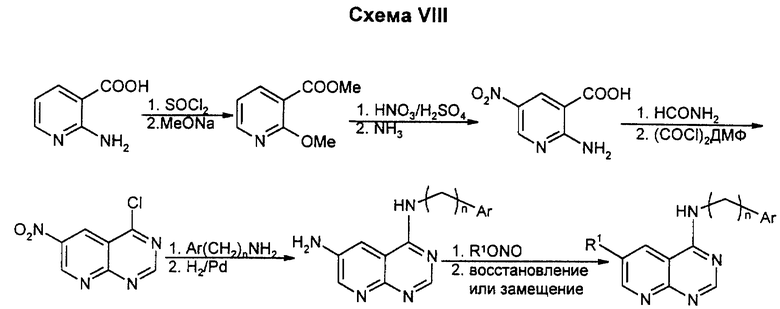
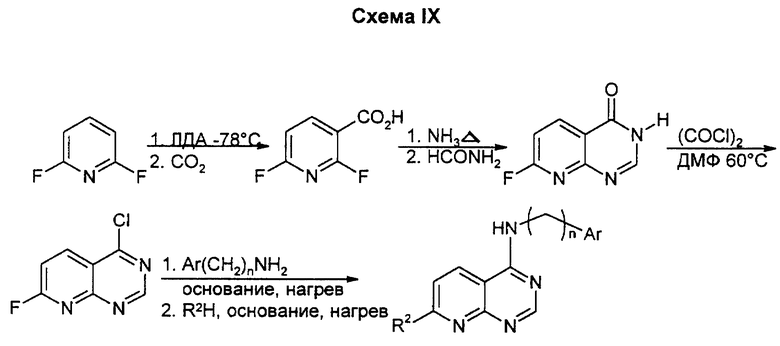
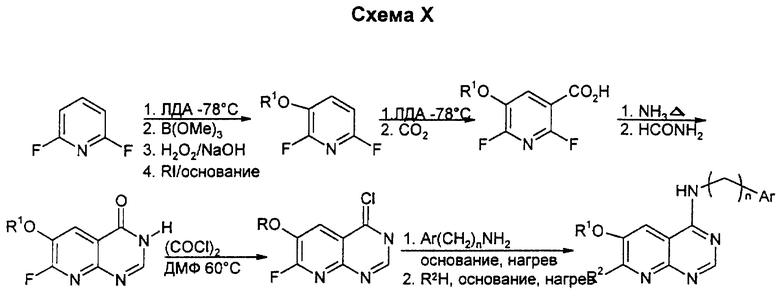
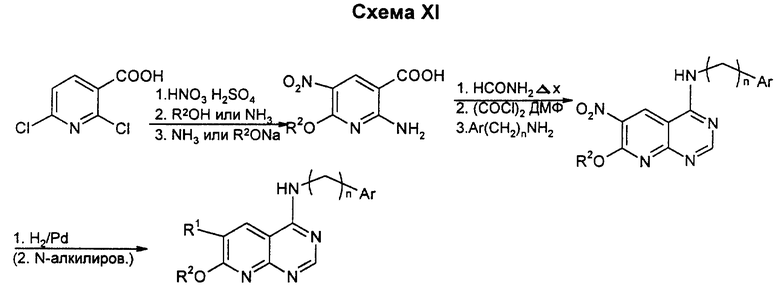
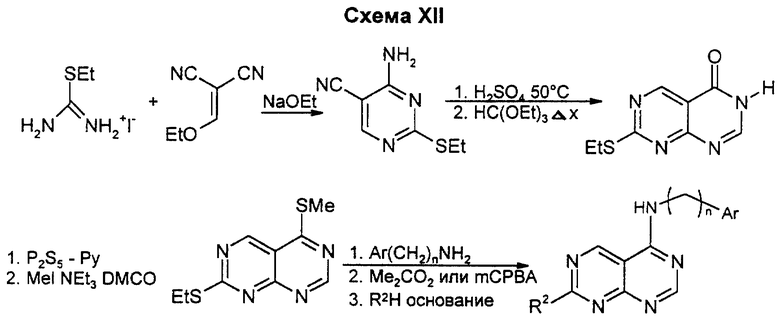
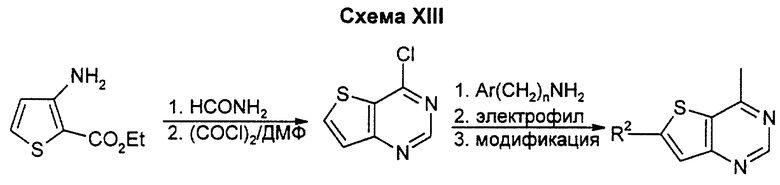
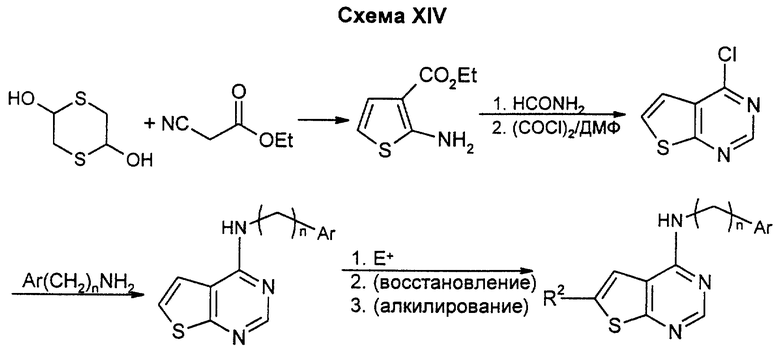
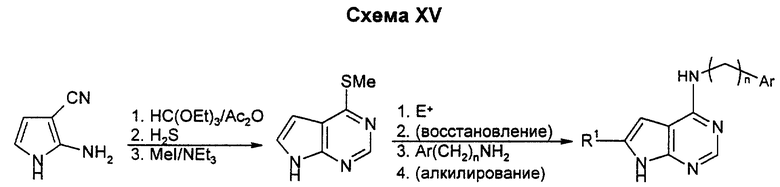
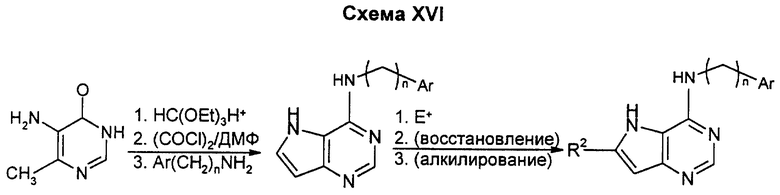
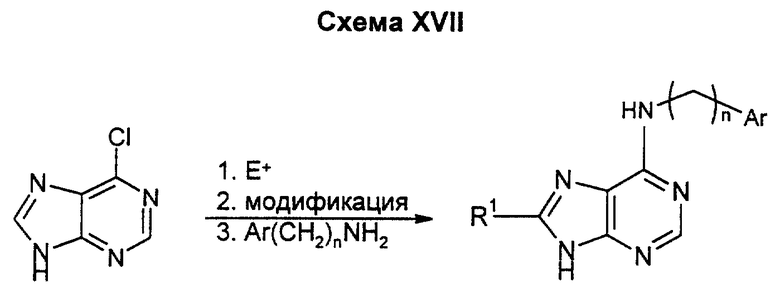
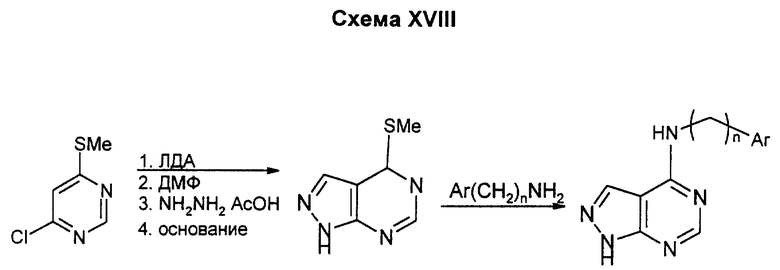
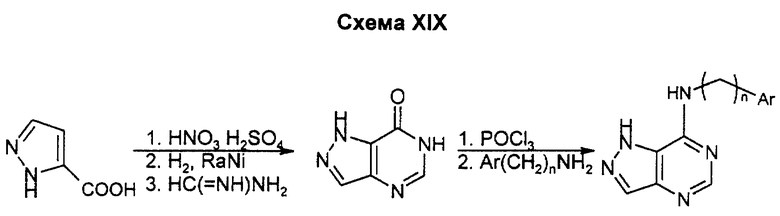


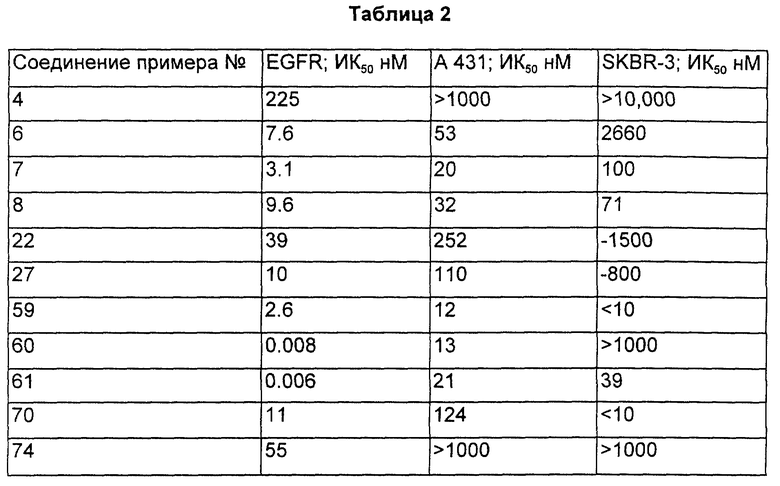

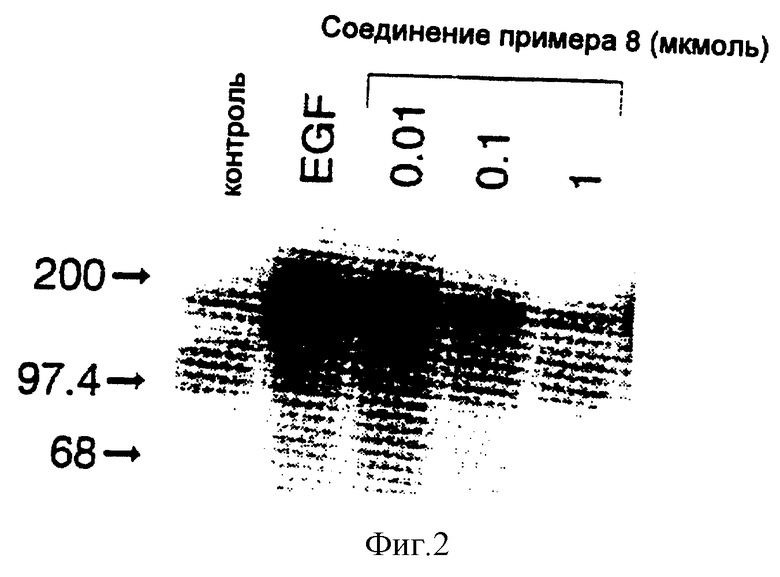
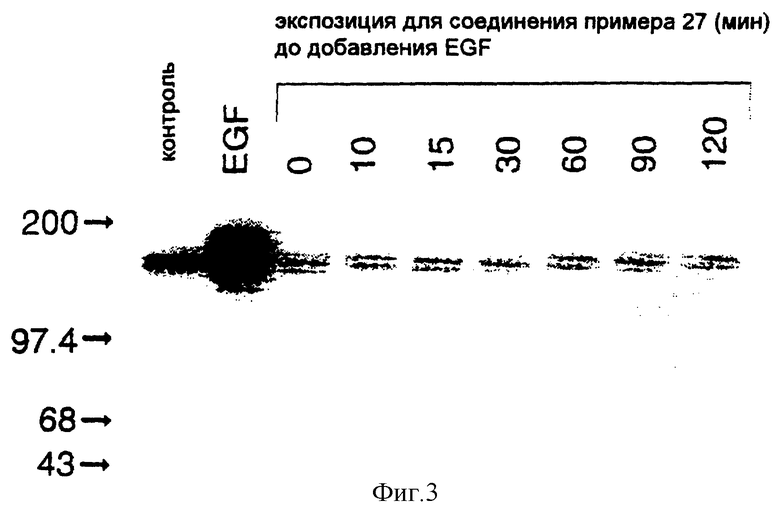
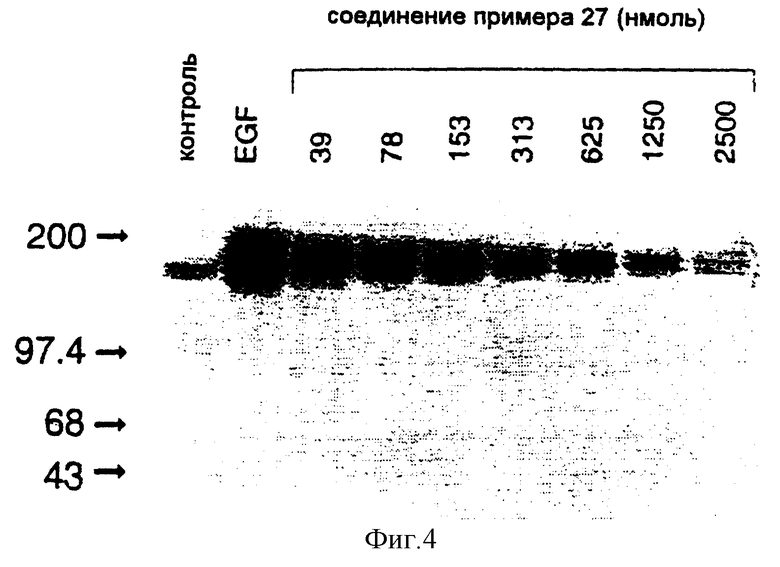
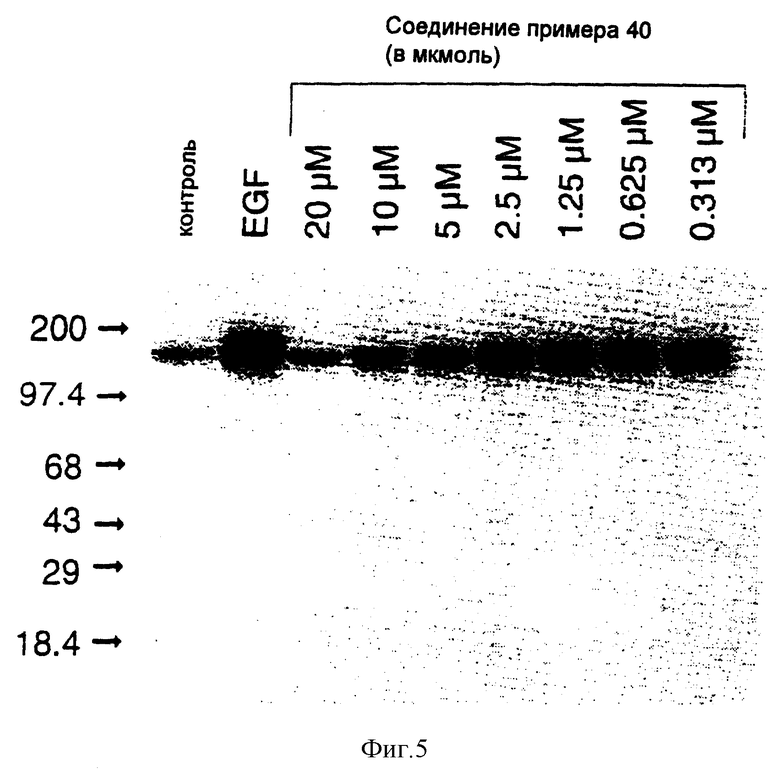
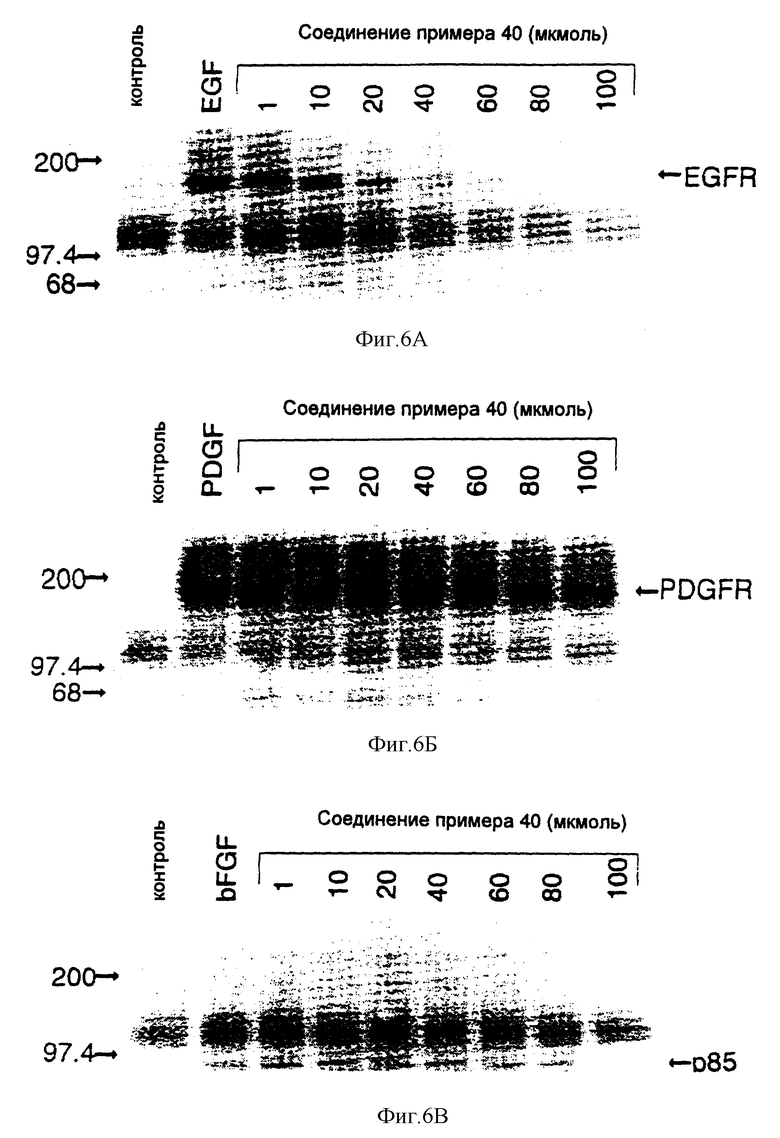
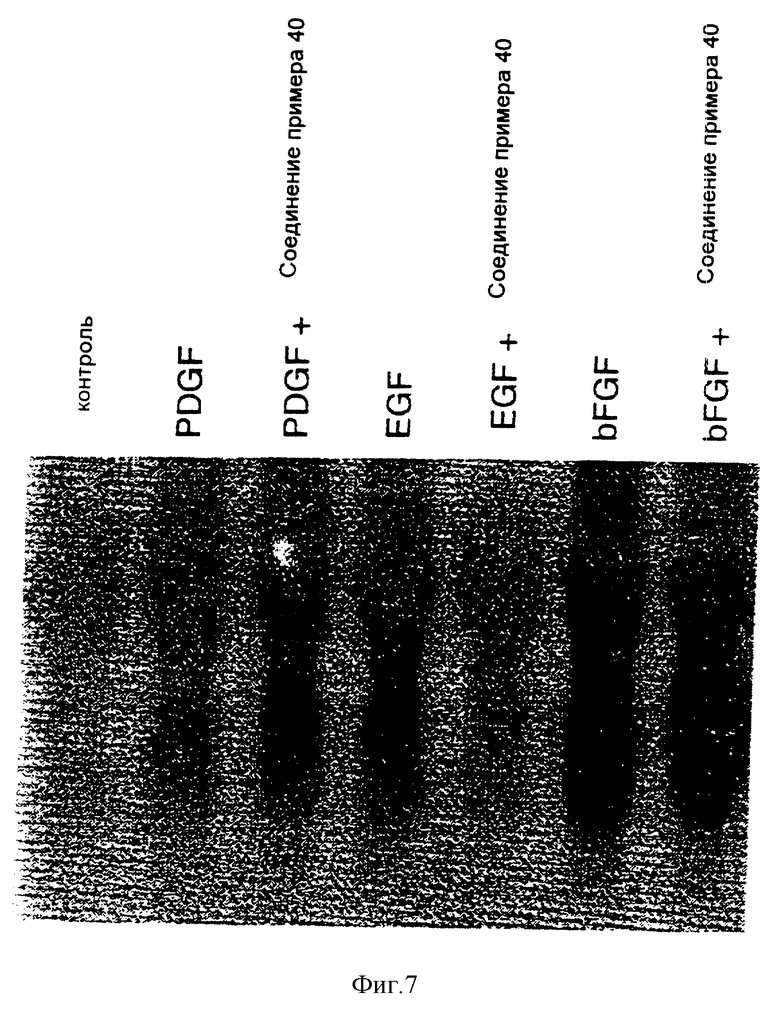
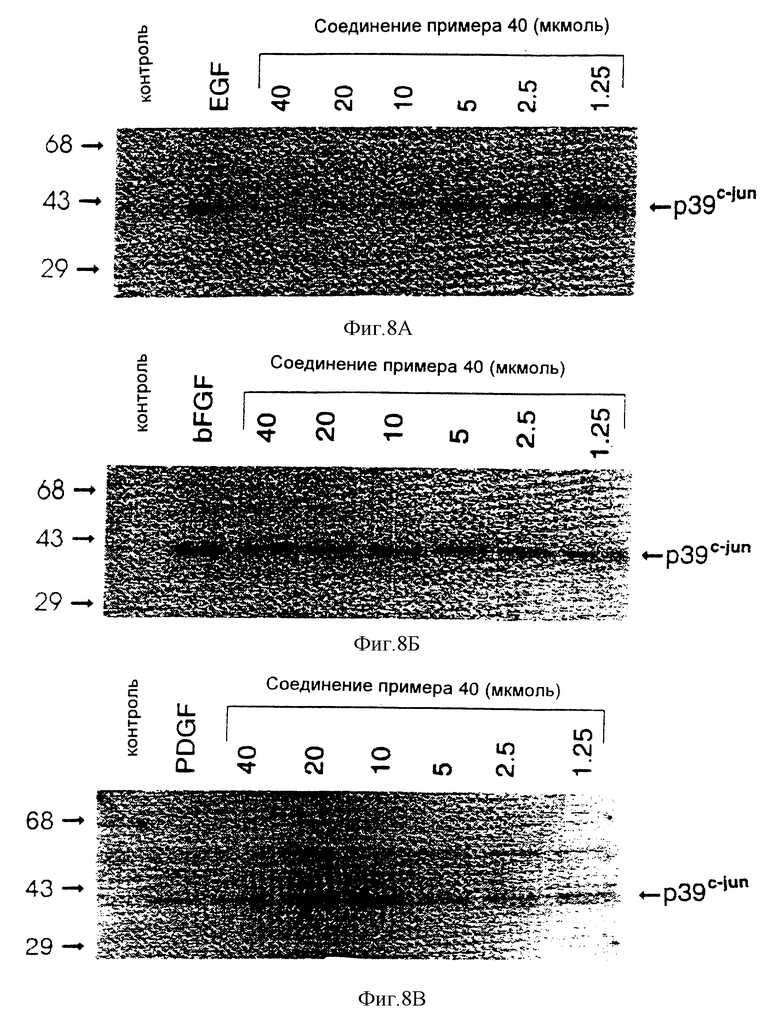
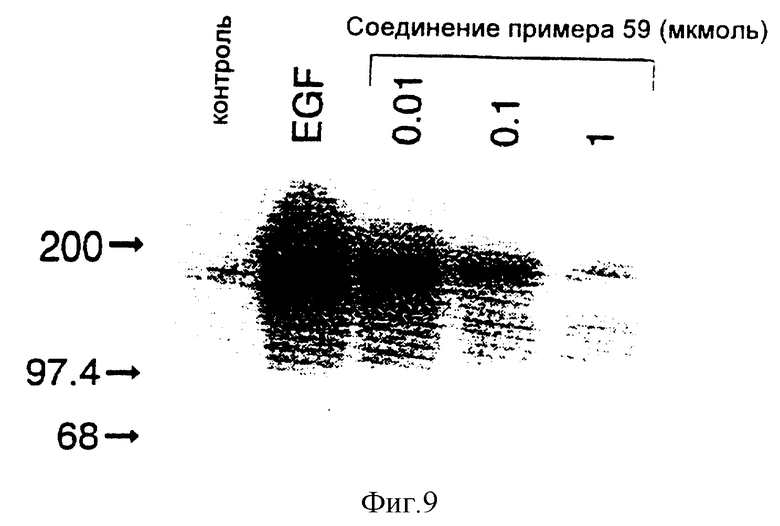
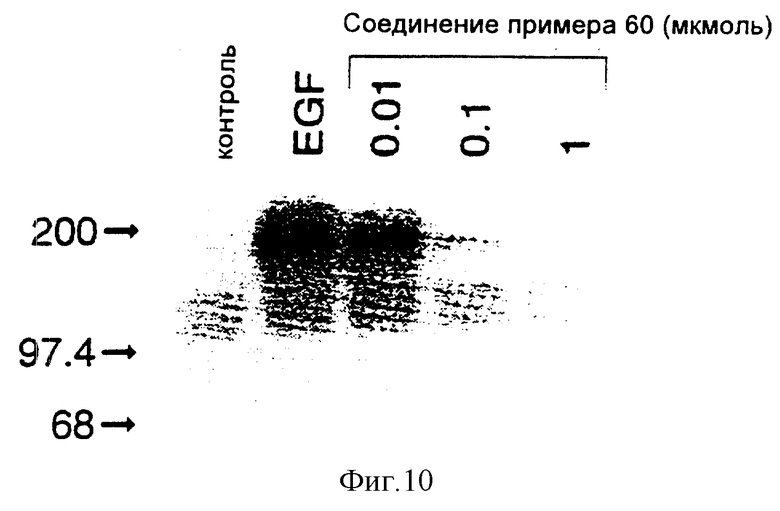
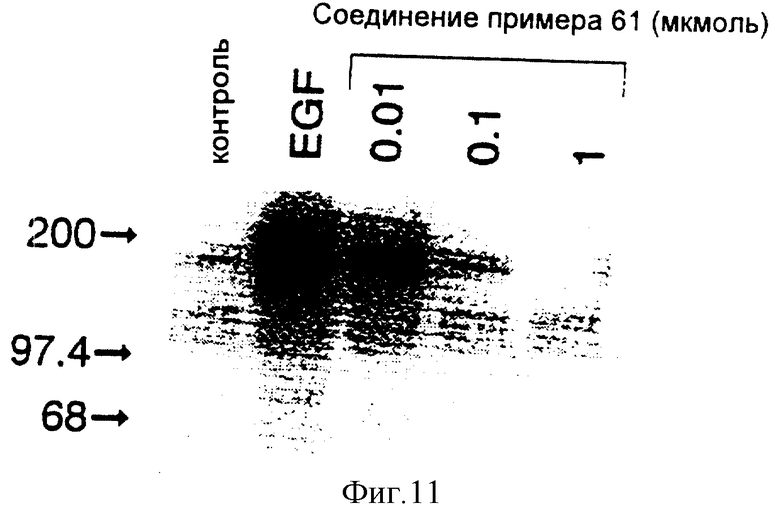
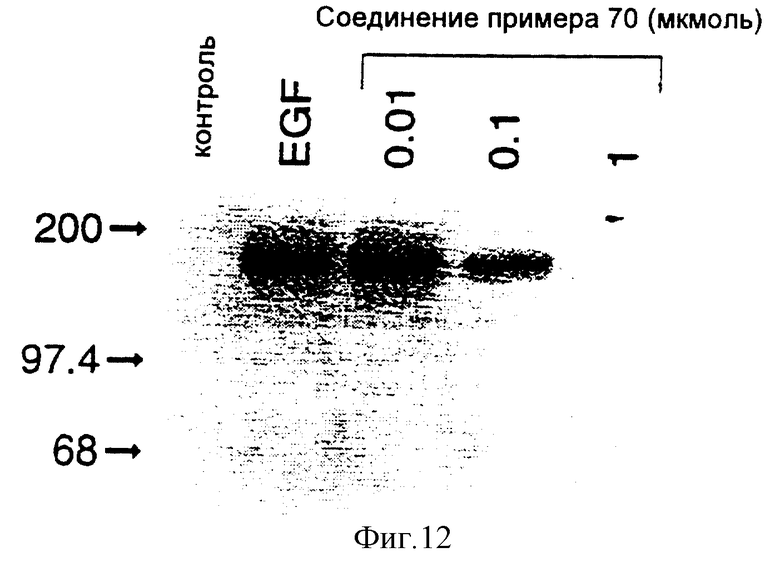
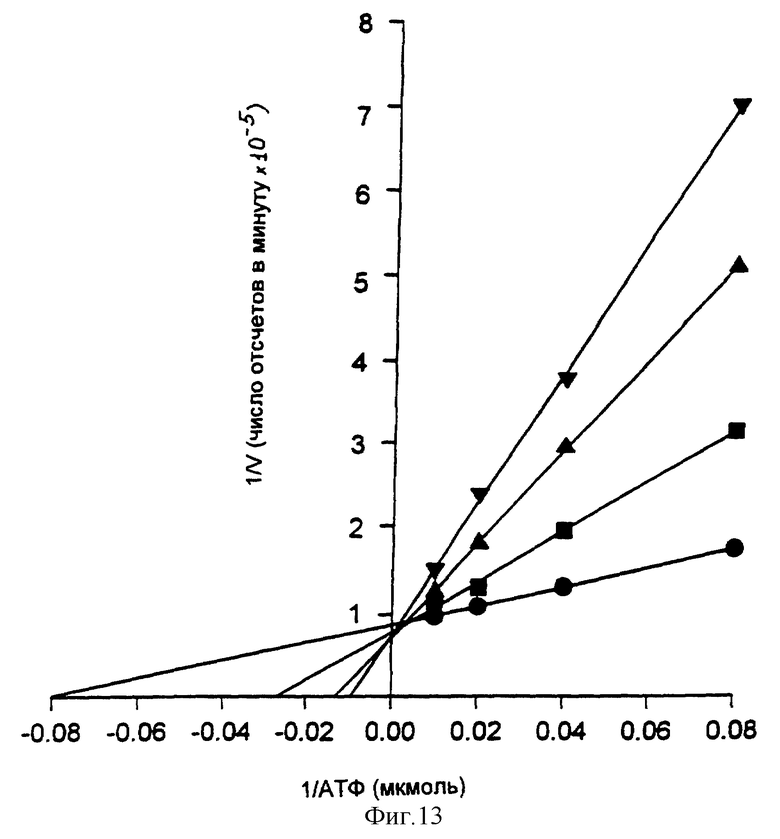
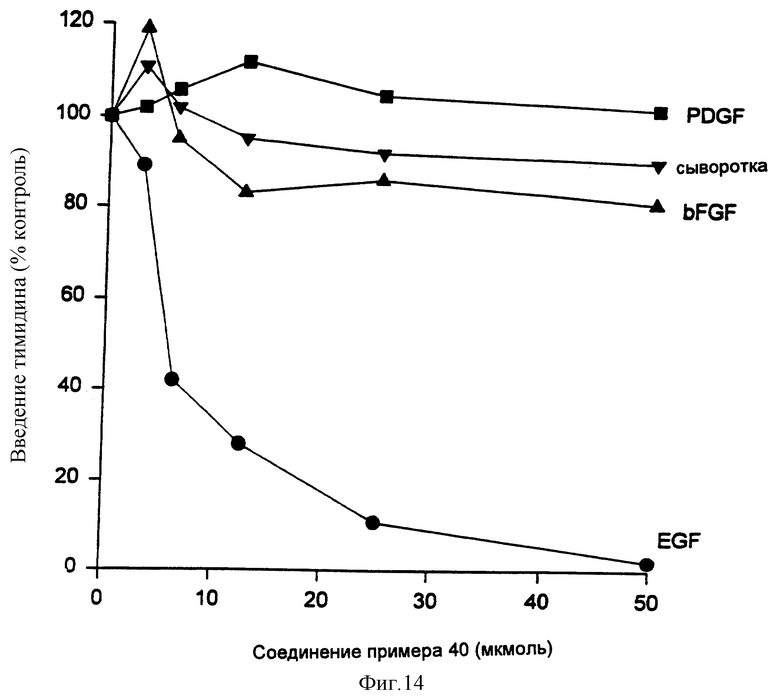



Изобретение относится к новым бициклическим производным пиримидина или их фармацевтически приемлемым солям, способу ингибирования тирозинкиназы рецептора эпидермального фактора роста, в частности при лечении раковых заболеваний, фармацевтической композиции, обладающей ингибирующей тирозинкиназу рецептора фактора эпидермального роста активностью, а также композиции, обладающей контрацептивным действием. Предлагаемые соединения соответствуют общей формуле I, где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо; Х - группы NH, NHR5, где R5 означает низший алкил с 1 - 4 атомами углерода; n = 0, 1 или 2; R отсутствует или означает водород, алкил с 1 - 4 атомами углерода, алкоксил с 1 - 4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1 - 4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1 - 4 атомами углерода в каждой алкильной группе; Ar - фенил, тиенил, R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1 - 4 атомами углерода, алкоксил с 1 - 4 атомами углерода, ацилокси с 1 - 4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1 - 4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1 - 4 атомами углерода, при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1 - 4 атомами углерода или алкоксила с 1 - 4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкил аминогруппы с 1 - 4 атомами углерода в каждой алкильной части, или его фармацевтически приемлемую соль в эффективном количестве. Способ ингибирования заключается во введении млекопитающему указанного выше соединения или его фармацевтически приемлемой соли. Композиции содержат указанное бициклическое соединение в эффективном количестве и, соответственно, фармацевтически или контрацептивно приемлемый эксципиент, разбавитель или носитель. 6 с. и 50 з.п.ф-лы, 3 табл., 17 ил.
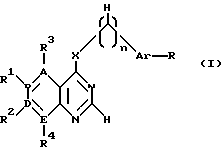
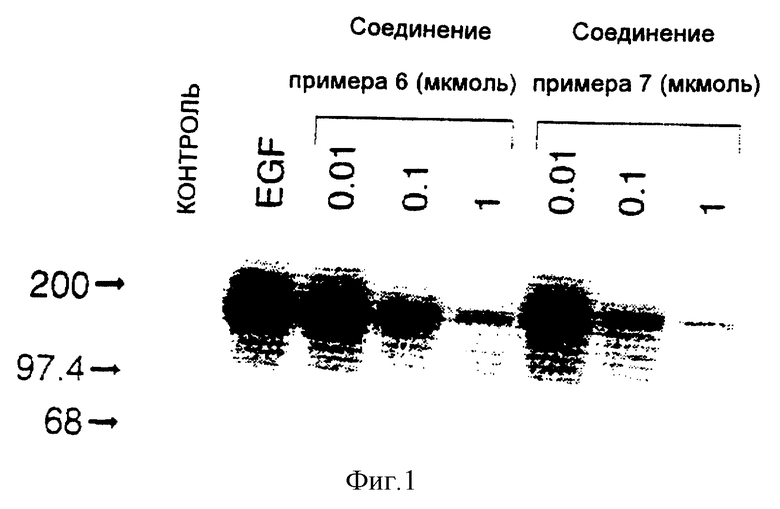
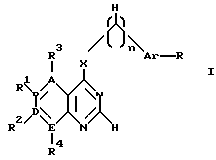
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
Х - группы NH, NHR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R - отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе;
Ar - фенил, тиенил;
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1-4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х-NH, n = 0, 1 или 2, Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
или его фармацевтически приемлемую соль в эффективном количестве.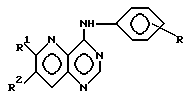
где R, R1 и R2 имеют указанные в п.1 значения.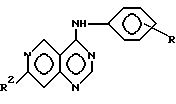
где R и R2 имеют указанные в п.1 значения.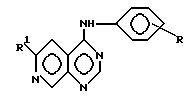
где R и R1 имеют указанные в п.1 значения.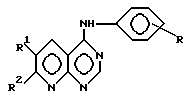
где R, R1 и R2 имеют указанные в п.1 значения.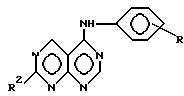
где R и R2 имеют указанные в п.1 значения.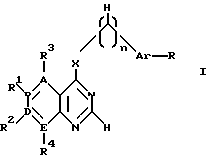
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
Х - группы NH, NHR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R - отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе;
Ar - фенил, тиенил;
R1, R2, R3 и R4 - независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1-4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
их отдельные стереоизомеры, рацемат или смесь диастереомеров или их фармацевтические соли или гидраты.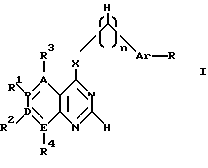
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
X - группы NH, NHR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе;
Ar - фенил, тиенил;
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1-4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
или его фармацевтическую соль в эффективном количестве.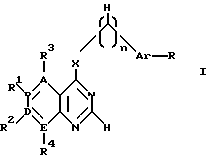
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
Х - группы NH, NНR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе;
Аr - фенил, тиенил;
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1 -4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
или его фармацевтически приемлемую соль в эффективном количестве.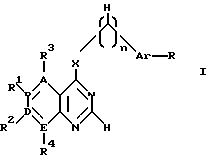
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод, или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
Х - группы NH, NHR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе;
Ar - фенил, тиенил,
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1-4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
или его фармацевтически приемлемую соль в эффективном количестве.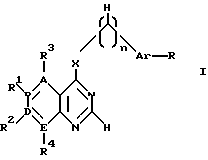
где 1 - 2 из радикалов А - Е означает азот, а остальные радикалы - углерод или два смежных радикала А - Е вместе представляют гетероатом из группы азот, сера, при этом А - Е вместе с прилегающими атомами углерода означают пиридиновое, пиримидиновое, тиенильное, пиррольное, имидазольное кольцо;
Х - группы NH, NHR5, где R5 означает низший алкил с 1-4 атомами углерода;
n = 0, 1 или 2;
R отсутствует или означает водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, нитрогруппу, галоген, перфторалкил с 1-4 атомами углерода, гидроксил, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе,
Ar - фенил, тиенил;
R1, R2, R3 и R4 независимо друг от друга отсутствуют или означают водород, алкил с 1-4 атомами углерода, алкоксил с 1-4 атомами углерода, ацилокси с 1-4 атомами углерода, аминогруппу, моно- или диалкиламиногруппу с 1-4 атомами углерода в каждой алкильной группе, ациламиногруппу с 1-4 атомами углерода,
при этом а) по крайней мере один из радикалов R1 - R4 имеет значение, отличное от водорода, низшего алкила с 1-4 атомами углерода или алкоксила с 1-4 атомами углерода; б) если Е и В означают азот, D и А - углерод, R1 и R4 отсутствуют, R3 - водород, Х - NH, n = 0, 1 или 2, Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Аr - фенил, замещенный галогеном, амино или гидроксилом, или если n означает 1 или 2 и Ar - тиенил, то R2 имеет значение, отличное от водорода, амино или моно- или диалкиламиногруппы с 1-4 атомами углерода в каждой алкильной части,
или его фармацевтическую соль в эффективном количестве.
| Способ получения (2-оксо-1,2,3,5-тетрагидроимидазо[2,1- @ ]хиназолинил)оксиалкиламидов или их фармацевтически приемлемых солей с кислотами | 1986 |
|
SU1493109A3 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| 1967 |
|
SU414386A1 | |
| Устройство для передачи сигналов времени и кодовой информации о текущем времени в составе телевизионных сигналов | 1975 |
|
SU520722A1 |
| Способ получения электрофотографического многоцветного изображения | 1975 |
|
SU566226A1 |
| Быстродействующий жидкостный коммутатор | 1974 |
|
SU496617A2 |
| DE 3824669 A, 25.11.1990. | |||
Авторы
Даты
2001-10-20—Публикация
1995-01-23—Подача