Изобретение относится к области химической фармакологии и фармакодинамики, биохимической медицины, клеточной и молекулярной биологии, иммунофармакологии микроэлементов и может быть использовано в клинической медицине для лечения различных заболеваний, сопровождающихся расстройствами стимулирующей функции иммунной системы, проявляющейся угнетением продукции клеток СД4-хелперов, уменьшением киллерной и фагоцитарной активности.
В настоящее время в клинической фармакологии для иммуностимуляции используют как синтетические, так и органические вещества природного происхождения. Это, как правило, препараты из экстрактов зобной железы, лимфатических узлов, соединительной ткани и селезенки. К таким лекарственным средствам относятся хорошо известные в клинической практике вещества, например тимоген, Т-активин, миелопид, тимоптин и т.д. (Машковский М.Д. "Препараты, корригирующие процессы иммунитета" в кн. "Лекарственные средства", Харьков, "Торсинг", 1997, т. 2, с. 199-207).
В последнее время внимание многочисленных исследователей привлек селен и его соединения, так как доказано, что клеточные и гуморальные иммунные процессы, особенно стимуляция клеточных иммунных реакций, осуществляются при помощи этого микроэлемента. (Кудрин А. В., Скальный А.В., Жаворонков А.А., Скальная М.Г., Громова О.А. в кн. "Иммунофармакология микроэлементов", изд. КМК, М., 2000, с. 222-223, 354-357).
В связи с этим для поддержания активной функции иммунной системы селен в качестве микроэлемента вводят в комплексы витаминных препаратов, например Центрум (Справочник ВИДАЛЬ "Лекарственные препараты в России", М.: АстраФармСервис, 1997, стр.Б-654). Известны также селеносодержащие препараты, полученные на основе биомассы водорослей (патент GB 2203043, 1988 или патент RU 2096037), обладающие общетонизирующим действием, реализация которого связана с непосредственным воздействием соединений селена на иммунную систему. Однако указанные лекарственные вещества имеют недостаточно высокое содержание органического селена, а технология их получения сложна и требует длительного времени.
В патенте (RU 2138271 С1, 1999) предложено средство ПСК (протеоселеновый комплекс), технология производства которого в какой-то степени разрешала предыдущие трудности, однако идентификация структуры этого селенового органического вещества произведена не была.
Представленные данные говорят о том, что современная технология получения селеновых препаратов нового класса, осуществляющих иммуностимулирующую активность, должна основываться на структуре и топологии присутствующих в организме активных, связанных с селеном биомолекул - особенно гликопротеинов, стереохимически соответствующих рецепторам лимфоцитарной иммунной системы организма. (Дж. Плейфер "Наглядная иммунология", М. Медицина, 1999, с. 34 и 35).
В связи с этим создаваемые лекарственные средства нового класса по своему строению и механизму действия должны стереохимически, т. е. биологически и химически, соответствовать тем веществам организма человека, которые непосредственно осуществляют стимулирующую функцию иммунной системы.
Для решения поставленной задачи предлагаются лекарственные вещества, обладающие иммуностимулирующим действием. Они включают низкомолекулярный компонент - протеин, полученный экстракцией из протеиносодержащего растительного сырья органическими растворителями; селен, остаток углевода (например, сахарозы) и различные неорганические ионы, вводимые солевыми водными растворами: катионы кальция, стронция, магния, железа; анионы - цианид, гидрофосфат, дигидроортосиликат, йодид.
Полученные нами разнообразные вещества являются солевыми формами селеногликопротеина.
Сущность изобретения поясняется прилагаемыми к описанию чертежами (см. фиг. 1 - 8).
Получение селеногликопротеина (SeГП)
В качестве исходных продуктов используют зеленую массу белковосодержащих растений, например злаковых, бобовых, листья кукурузы. Экстракцией из растительной массы извлекают протеин. Экстракцию осуществляют эфиром, этиловым спиртом, димексидом. Полученный экстракт выпаривают и производят лиофильную сушку. Порошок растворяют в 60-90%-ном растворе этилового спирта. В раствор вводят селен, полученный термолизом селеномочевины (из расчета 6-12 мкг на 1 мл раствора). Затем к смеси добавляют определенное количество углевода, например сахарозы, и помещают ее в электромагнитное высокочастотное поле (мощность 5•10-3 Вт/см, частота 20-30 МГц). Поле может быть создано, например, в сквидмагнитометрах, применяемых в магнитоэнцефалографии.
Молекула селеногликопротеина - SeГП (фиг. 1) представляет собой две полипептоидные альфа- и бета-цепи протеина, соединенные дисульфидным мостиком по остаткам цистеина (альфа-цепь состоит из остатков 20 аминокислот, бета - из 29 аминокислот). Селен, полученный путем термолиза селеномочевины, входит в боковые алкильные радикалы аминокислот, соединяя некоторые звенья альфа- и/или бета-цепей одной или двух соседних молекул протеина, тем самым дополнительно "сшивая" их. К селенопротеину через основные остатки аминокислот серина и/или тирозина присоединяется сахароза посредством О-гликозидных связей. Молекулярная масса SeГП - 6835. Молярные соотношения протеина, селена, углевода - 1:4:5.
При всех физиологических значениях pH селеногликопротеин ионизирован. Заряженными являются C- и N-концевые группы и связанные с α-углеродными атомами боковые цепи, содержащие карбоксильную или аминогруппу (-COO-, -NH3 +) (фиг. 1).
При взаимодействии селеногликопротеина с водными растворами солей возникают солевые связи между разноименными заряженными группами селеногликопротеина и различными катионами и анионами водных растворов.
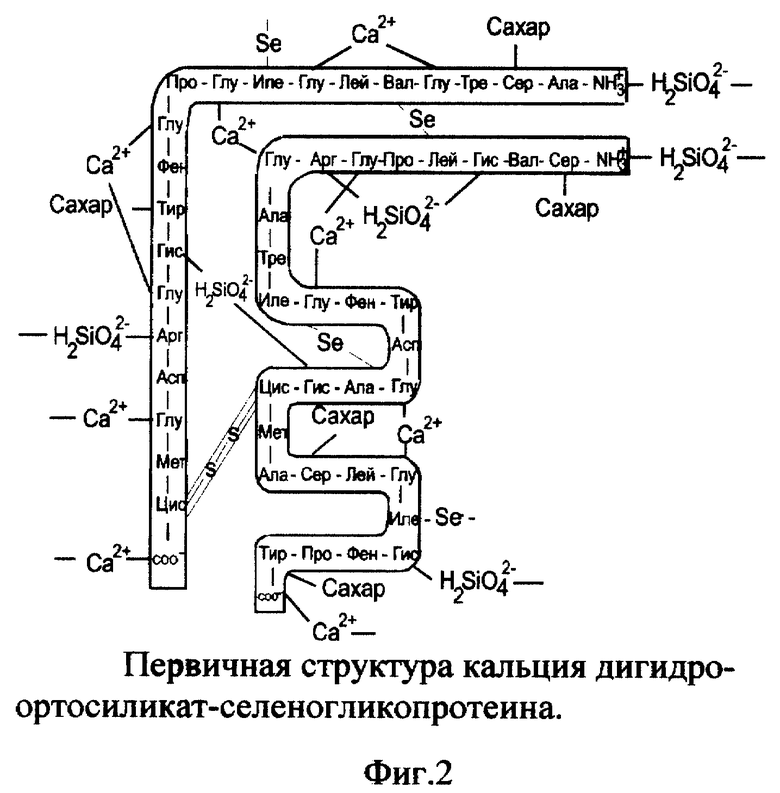
1. Вещество кальция дигидроортосиликат-селеногликопротеин (CaH2SiO4-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты (и возможно пролина) и C-концевым группам присоединены катионы кальция (Ca2+), по аминогруппам (-NH3 +) гистидина, аргинина и N-концевой группе присоединены дигидроортосиликат-анионы (H2SiO4 2-) к α- и/или β-цепям одной молекулы или соседних молекул селеногликопротеина (фиг.2). Молекулярная масса CaH2SiO4-SeГП - 7531, молярные соотношения SeГП:Ca2+:H2SiO4 2- - 1:8:4.
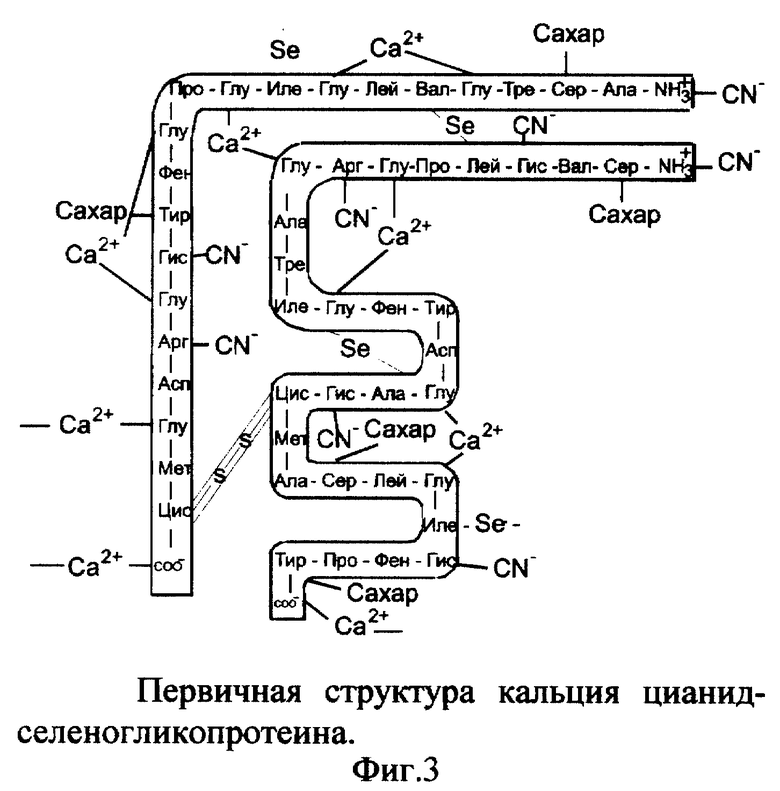
2. Вещество кальция цианид-селеногликопротеин (Ca(CN)2-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты (и возможно пролина) и C-концевым группам присоединены катионы кальция, по аминогруппам (-NH3 -) гистидина, аргинина и N-концевой группе присоединены цианид-анионы (CN-) к α- и/или β-цепям селеногликопротеина (фиг. 3). Молекулярная масса Ca(CN)2-SeГП - 7363, молярные соотношения SeГП:Ca2+:CN- - 1:8:8.
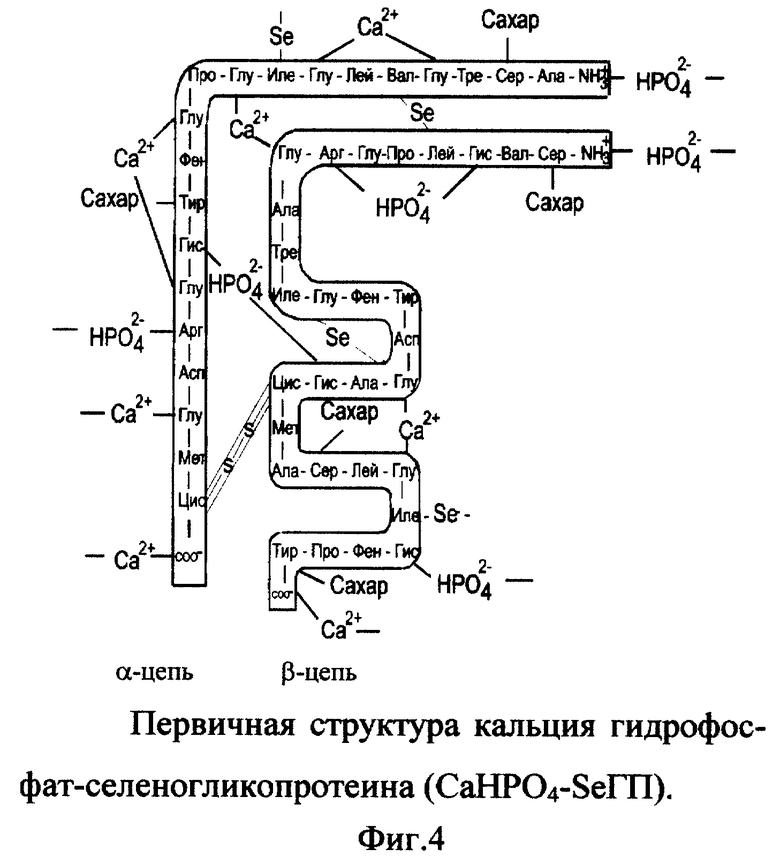
3. Вещество кальция гидрофосфат-селеногликопротеин (CaHPO4-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты (и возможно пролина) и концевого α-углерода присоединены катионы кальция; по аминогруппам (-NH3 +) гистидина, аргинина и N-концевой группе присоединены гидрофосфат-анионы (HPO4 -2 к α- и/или β-цепи одной молекулы или соседних молекул селеногликопротеина (фиг.4). Молекулярная масса CaHPO4-SeГП - 7539. Молярные соотношения SeГП:Ca2+:HPO4 2- - 1:8:4.
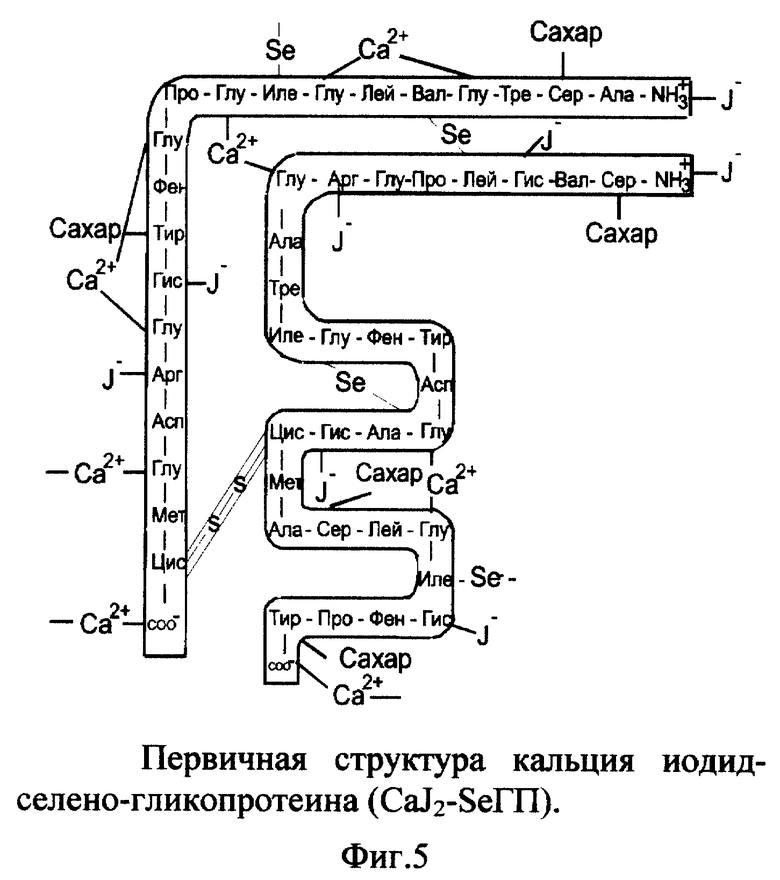
4. Вещество кальция йодид-селеногликопротеин (CaI2-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты (и возможно пролина) и концевого α-углерода присоединены катионы кальция; по аминогруппам (-NH3 -) гистидина, аргинина и N-концевой группе присоединены йодид-анионы (I-) к α- и/или β-цепи (фиг. 5). Молекулярная масса (CaI2-SeГП) - 7409. Молярные соотношения SeГП:Ca2+:I- - 1:8:8.
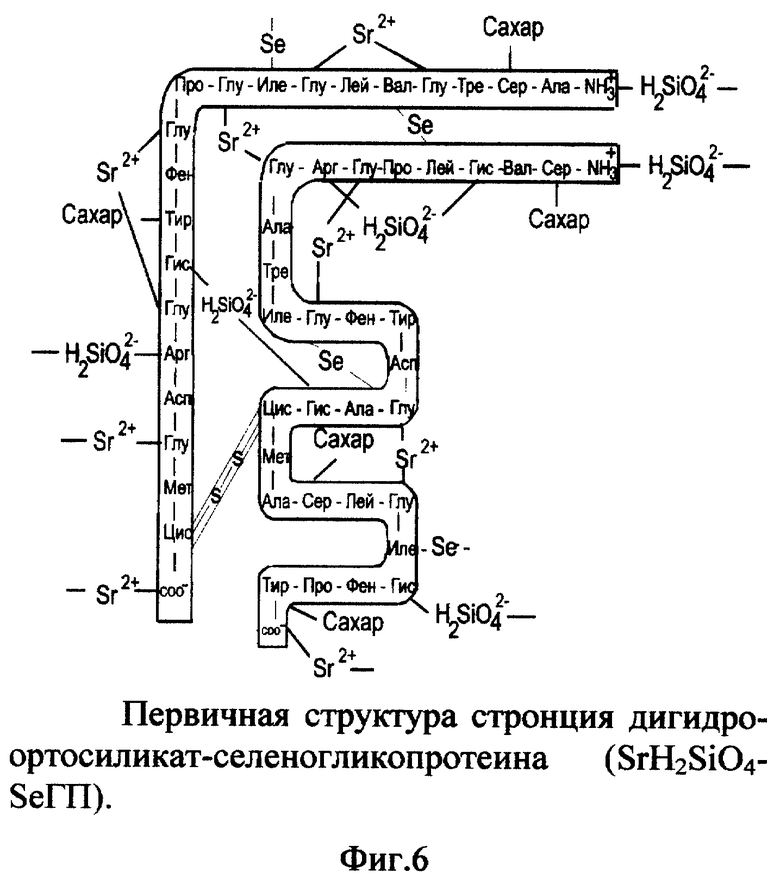
5. Вещество стронция дигидроортосиликат-селеногликопротеин (SrH2SiO4-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты (и возможно пролина) и концевого α-углерода присоединены катионы стронция (Sr2+); по аминогруппам (-NH3 +) гистидина, аргинина и концевой аминогруппе присоединены дигидроортосиликат-анионы (H2SiO4 2-) к α- и/или β-цепи одной молекулы или соседних молекул селеногликопротеина (фиг. 6). Молекулярная масса SrH2SiO4-SeГП - 7915. Молярные соотношения SeГП: Sr2+:H2SiO4 2- - 1:8:4.
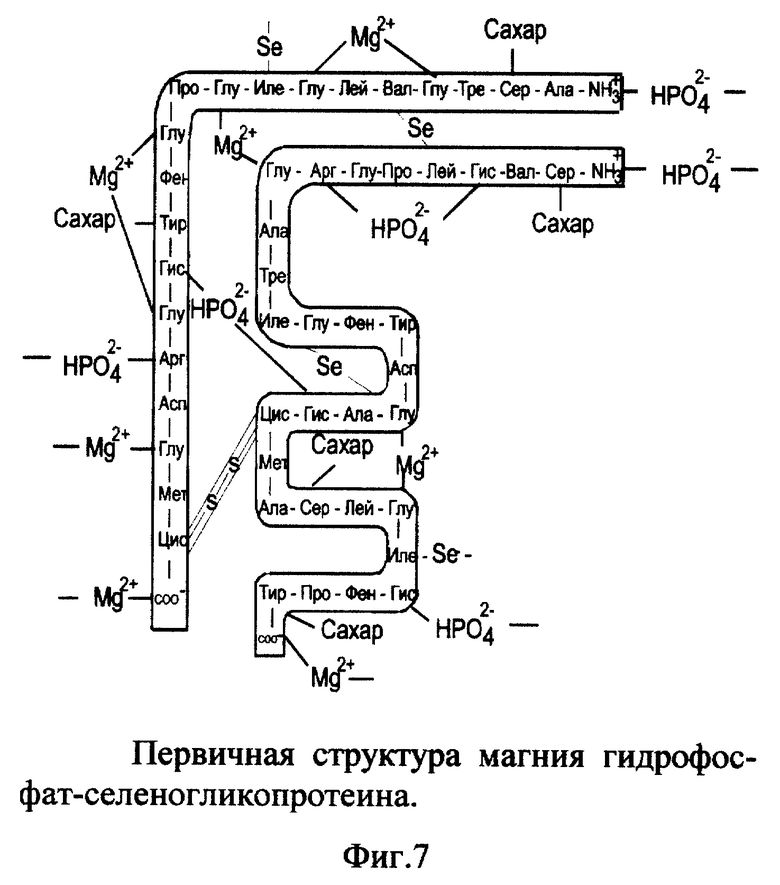
6. Вещество магния гидрофосфат-селеногликопротеин (MgHPO4- SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты и C-концевым группам присоединены катионы магния (Mg2+); по аминогруппам гистидина, аргинина и N-концевой группе присоединены гидрофосфат-анионы (HPO4 2-) к альфа- и/или бета-цепи одной молекулы или соседних молекул селеногликопротеина (фиг.7). Молекулярная масса MgHPO4-SeГП - 7411. Молярные соотношения SeГП:Mg2+:HPO4 2- - 1:8:4.
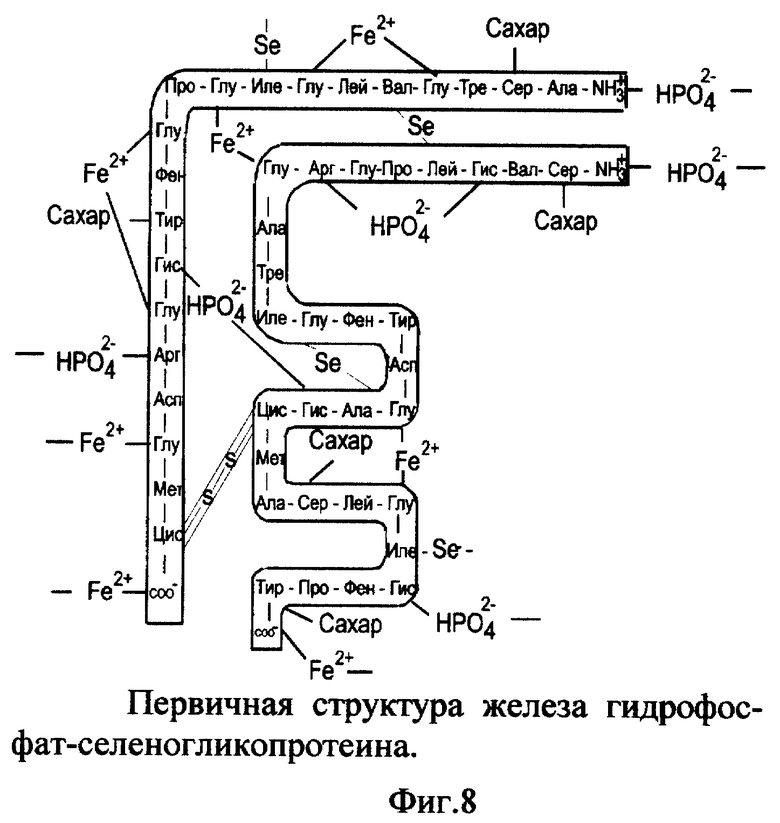
7. Вещество железа гидрофосфат-селеногликопротеин (FeHPO4-SeГП).
Вещество включает ионизированный селеногликопротеин (фиг. 1), к которому по карбоксильным группам (-COO-) глутаминовой кислоты и C-концевым группам присоединены катионы железа (II) (Fe2+); по аминогруппам гистидина, аргинина и N-концевой группе присоединены гидрофосфат-анионы к альфа- и/или бета- цепи одной молекулы или соседних молекул селеногликопротеина (фиг. 8). Молекулярная масса FeHPO4-SeГП - 7667. Молярные соотношения SeГП:Fe2+:HPO4 2- - 1:8:4.
Примеры получения селеновых гликопротеиновых элементоорганических веществ - Se-ГПЭОВ (солевых форм)
Пример 1. Способ получения кальция дигидроортосиликат-селеногликопротеина (CaH2SiO4-SeГП).
К селеногликопротеину добавляют необходимое количество водного раствора ортосиликата кальция, предварительно подвергнутого электролизу и гидролизу. Смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•10-3 Вт/см2, частота 20-30 МГц).
Пример 2. Способ получения кальция цианид-селеногликопротеина (Ca(CN)2-SeГП).
К селеногликопротеину добавляют необходимое количество водного раствора цианида кальция, предварительно подвергнутого электролизу. Смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•10-3 Вт/см2, частота 20-30 МГц).
Пример 3. Способ получения кальция гидрофосфат-селеногликопротеина (CaHPO4-SeГП).
К селеногликопротеину добавляют необходимое количество гидрофосфата кальция, предварительно подвергнутого электролизу. Смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•10-3 Вт/см, частота 20-30 МГц).
Пример 4. Способ получения кальция йодид-селеногликопротеина (CaI2-SeГП).
К селеногликопротеину добавляют определенное количество водного раствора иодида кальция предварительно подвергнутого электролизу. Подобную смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•10-3 Вт/см2, частота 20-30 МГц).
Пример 5. Способ получения стронция дигидроортосиликат- селеногликопротеина (SrH2SiO4-SeГП).
К селеногликопротеину добавляют определенное количество водного раствора ортосиликата стронция, предварительно подвергнутого электролизу и гидролизу. Смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•10-3 Вт/см2, частота 20-30 МГц).
Пример 6. Способ получения магния гидрофосфат-селеногликопротена (MgHPO4-SeГП).
К селеногликопротеину добавляют необходимое количество ионов магния, полученных при электролизе глицерофосфата магния и необходимое количество гидрофосфат-анионов, полученных при электролизе гидрофосфата кальция. Смесь выдерживают в электромагнитном высокочастотном поле (мощность 5•102 Вт/см2, частота 20-30 МГц).
Пример 7. Способ получения железа гидрофосфат-селеногликопротеина (FeHPO4-SeГП).
К селеногликопротеину добавляют необходимое количество ионов железа, полученных при электролизе тетрагидрата ацетата железа, и необходимое количество гидрофосфат-анионов, полученных при электролизе гидрофосфата кальция. Смесь выдерживают в электромагнитном поле (мощность 5•10-3 Вт/см2, частота 20-30 МГц).
Se-ГПЭОВ включают в себя асимметричную белковую молекулу с альфа-спиралью и бета-структурой. Гидрофобный конец молекулы Se-ГПЭОВ переходит в альфа-спираль, бета-структура молекулы Se-ГПЭОВ извита соответствующим образом и на внешней стороне аминокислотной цепочки, как и на внутренней, имеются одновременно селенидные и дисульфидные связи, обеспечивающие пространственную устойчивость и в то же время гибкость данной молекулы.
В состав всей молекулы Se-ГПЭОВ входит 15 аминокислот. Соответственно вышеизложенной технологии могут быть получены молекулы разнообразных селеновых гликопротеиновых элементоорганических веществ с различным числом аминокислот и относительно низким молекулярным весом.
Острую токсичность препарата исследовали при внутрибрюшинном введении Se-ГПЭОВ в дозе 250 мг/кг мышам (возраст 6 недель, вес 28-30 г). Значение ЛД составило 700 мг/кг.
При исследовании общей токсичности мышам вводили Se-ГПЭОВ в дозе 100 мг/кг в день внутрибрюшинно непрерывно в течение 10 дней. Снижение веса и каких-либо других нарушений при этом не наблюдали, в последующем при наблюдении этих мышей в течение трех месяцев отклонений от нормы не выявлено.
В результате проведенных исследований установлено, что Se-ГПЭОВ являются органическими соединениями, обладают иммуностимулирующими свойствами, нетоксичны, полностью растворимы в воде и биологических жидкостях - крови, лимфе и ликворе. В 1 мл Se-ГПЭОВ содержится в зависимости от количества аминокислот в лиганде от 20 до 30 мг субстанции и 6 мкг селена.
Доза вводимого препарата зависит от клинического состояния больного, его возраста, веса, а также способа введения. Эффективная терапевтическая суточная доза для больного составляет от 6 до 150 мг активного вещества, которое вводят одномоментно или дробно.
Способ активации и стимуляции иммунной системы осуществляют следующим образом.
Полученный препарат Se-ГПЭОВ представляет собой раствор активного вещества в 60 - 90%-ном этиловом спирте, 1 мл которого содержит 20-30 мг лекарственной субстанции. Se-ГПЭОВ вводят перорально, внутримышечно, внутривенно, внутриартериально, а также наружно в виде суспензии в масляном растворе или в виде мази с масляно-спиртовым наполнителем.
При пероральном введении необходимую дозу рассчитывают следующим образом:
в 20 каплях раствора содержится 20-30 мг лекарственной субстанции;
в 10 каплях (1/2 мл) содержится 10-15 мг препарата;
в 5 каплях (1/4 мл) содержится 5-7,5 мг препарата;
в 3 каплях (1/7 мл) содержится 3,3 мг препарата.
При внутримышечном, внутривенном или внутриартериальном введении препарат растворяют в физиологическом растворе для лучшей диссоциации в соотношении 1:10 при использовании 60%-ного спирта или 1:15 при 90%-ном спирте.
Например: детям до 6 лет при клинической патологии средней степени тяжести препарат вводят однократно в виде инъекции от 0,1 до 0,5 мл в день, при тяжелой степени патологии указанную дозу вводят два раза в день. При проведении интенсивной терапии препарат вводят внутримышечно или внутривенно (внутриартериально) по 1,0-2,0 мл соответственно с добавлением 10 или 20 мл физиологического раствора. В случае перорального введения в зависимости от возраста, веса и степени поражения - от 0,5 до 3,0 мл, причем препарат растворяют в 1/3 стакана кипяченой слегка теплой воды (36-38oC). Длительность лечения может колебаться от 1 до 3 месяцев, в случае тяжело протекающей патологии курс лечения повторяют с интервалом 1-2 месяца до выраженного клинического эффекта. В период проведения лечения контролируют иммунологический статус больного по развернутой клинической формуле и иммунограмме.
При применении иммуностимулирующих селеновых гликопротеиновых элементоорганических веществ (солевых форм) наблюдается активная стимуляция иммунной системы, проявляющаяся улучшением клинического самочувствия больных и нормализацией иммунитета - увеличением продукции клеток СД4 Т-хелперов, а также возрастанием киллерной и фагоцитарной активности.
Изобретение относится к медицине, фармакологии микроэлементов и молекулярной биологии и может быть использовано для лечения заболеваний, связанных с угнетением продукции клеток CD4-хелперов, уменьшением киллерной и фагоцитарной активности. Сущность изобретения заключается в получении селеновых гликопротеиновых элементоорганических веществ с иммуностимулирующими свойствами. Вещества включают в себя низкомолекулярный компонент - протеин, селен, остаток углевода и различные неорганические ионы, вводимые солевыми водными растворами: катионы кальция, стронция, магния, железа, анионы - цианид, гидрофосфат, дигидроортосиликат, йодид. Техническим результатом является получение лекарственного вещества, при применении которого наблюдается увеличение продукции клеток CD4 Т-хелперов, возрастание киллерной и фагоцитарной активности 4 с.п. ф-лы, 8 ил.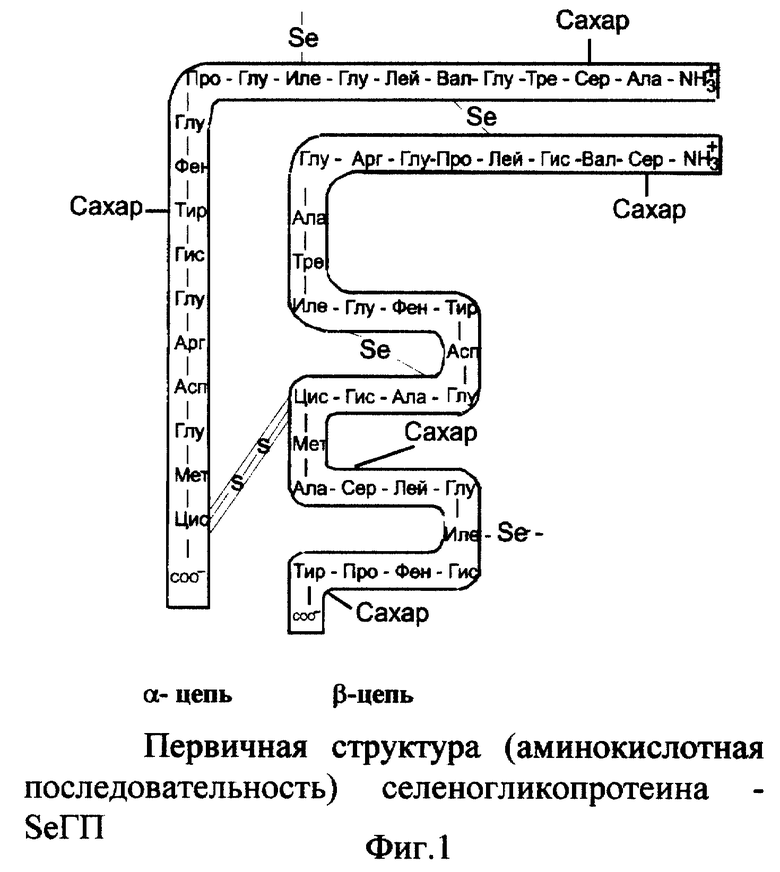
| ИММУНОКОРРЕГИРУЮЩЕЕ СРЕДСТВО И СПОСОБ ИММУНОКОРРЕКЦИИ | 1999 |
|
RU2138271C1 |
| 2000 |
|
RU2161035C1 | |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| US 4761490 А, 02.08.1988 | |||
| US 4564634 А, 14.01.1986 | |||
| US 6001825 А, 14.12.1999 | |||
| Центробежный насос | 1950 |
|
SU91762A1 |
| US 4461725 A, 24.07.1984. | |||
Авторы
Даты
2001-12-20—Публикация
2001-01-22—Подача