Изобретение относится к генетической инженерии и может быть использовано в ветеринарной вирусологии для выявления инфекционных заболеваний, а именно болезни Ауески (Aujezsky's disease), вызываемой вирусом (Suid herpesvirus I, SHV-1).
До настоящего времени основным методом диагностики болезни Ауески являлась длительная и достаточно трудоемкая процедура биопробы на кроликах и изоляции вируса в чувствительной культуре клеток. Более перспективным методом диагностики является метод гибридизации нуклеиновых кислот, основанный на использовании ДНК-зондов.
Известен способ выявления вируса болезни Ауески в пробах биоматериала от свиньи, основанный на использовании ДНК-зонда, при конструировании которого Hind111-фрагмент ДНК вируса клонировали в плазмиду, а мечение ДНК осуществляли ник-трансляцией радиоактивным фосфором (см. McFarlane R.G., Thawley D. G. . DNA hybridisation procedure to detect pseudorabies virns DNA in swine tissue.// Amer. J. Vet. Res.-1985.-V.46, N 5.-P.1133-1136).
Однако зонды, меченные радиоактивной меткой, нестабильны (период полураспада составляет около двух недель), и проведение анализов с их использованием небезопасно для персонала лабораторий.
Известен способ выявления вируса, основанные на использовании ДНК-зонда, при конструировании которого фрагменты ДНК вируса клонировали в плазмиду. При этом мечение полученного зонда проводили нерадиоактивным способом - путем введения биотина с последующим выявлением ДНК вируса в фиксированных формалином и залитых в парафин срезах тканей (Belak К., Funa К., Kelly R., Belak S. Rapid diagnosis of Aujezsky's disease in pigs by improved in situ hybridization using biotinilated probes on paraffin embedded tissue sections// J. Veter. Med, Reihe В.- 1989. - V. 36, 1.-P. 4793).
Однако методика постановки реакции с использованием такого зонда предусматривает трудоемкую процедуру подготовки тканей: фиксацию формалином и заливку их парафином.
Наиболее близким решением, принятым за прототип, является известный способ выявления ДНК вируса болезни Ауески сельскохозяйственных животных, наиболее близкий к заявляемому по технической сущности и достигаемому эффекту. Способ включает клонирование Hind111 и Pstl фрагментов ДНК в плазмидный вектор pBR325. Мечение полученного зонда осуществляют ник-трансляцией с био-11-dUTP. Однако полученный таким методом нерадиоактивно меченный ДНК-зонд обладает недостаточно высокой чувствительностью выявления ДНК вируса - 10-100 пкг (Chan V. T.W., Fleming K.A., McGee J.O'D. Detection of subprogram quantities of specific DNA sequences on blot hybridization with biotinylated probes.//Nucl. Acids Res.- 1985.-V.13, N22.-P.8083-8091).
Сущность изобретения заключается в конструировании рекомбинантного зонда на основе двунитиевого вектора путем клонирования Pstl-фрагмента вирусного генома длиной 300 п.н. в плазмиду pUC18. В качестве метки используется биотин, который вводится в ДНК-зонд путем химической модификации ДНК по цитозиновым звеньям.
Технический результат изобретения заключается в проведении анализа на наличие вируса болезни Ауески в пробах от животных с высокой чувствительностью и специфичностью.
Пример 1. Выделение ДНК вируса болезни Ауески сельскохозяйственных животных из инфицированной культуры клеток RK13 и из проб от животных. Клетки осаждают центрифугированием, к супернатанту добавляют 50%-ный ПЭГ до концентрации 6% и 5М NaCl до концентрации 2,8%. Смесь оставляют на ночь при 4oС, затем центрифугируют. Осадок ресуспендируют в ТЕ-буфере, добавляют IМ трис-НСl рН 8,0 до 0,01М, 0,1М ЭДТА до 1мМ, 5М NaCI до 0,15М, SDS до 1%, протеиназу К до концентрации 0,1 мг/мл и выдерживают при 37oС в течение 3 ч. После этого к смеси добавляют равный объем 52%-ной сахарозы и ведут депротеинизацию раствора с помощью фенола и хлороформа. На конечной стадии вирусную ДНК очищают на колонке (0,9х21 см) с Sepharose CL 4В и осаждают этанолом.
При выделении вирусной ДНК из проб от животных к образцу добавляют IM трис-НСI рН 8,0 до 0,01М, 0,1М ЭДТА до 1мМ, NaCI до 0,15М, SDS до 1%, протеиназу до 0,1 мг/мл и выдерживают при 37oС в течение 3 ч. Далее вирусную ДНК выделяют, обрабатывая пробы фенолом и хлороформом и осаждая этанолом.
Пример 2. Клонирование фрагментов ДНК вируса болезни Ауески в плазмиде pUC18. ДНК, выделенную из вируса, расщепляют рестриктазой PstI. Этой же рестриктазой расщепляют ДНК плазмиды pUC18. Гидролизаты ДНК вируса и плазмиды соединяют и проводят сшивку ДНК-лигазой фага Т4. Продуктами сшивки трансформируют E. coIi JM 103. Отбор клонов проводят по фенотипу: белый фенотип имеют клоны, содержащие плазмиду pUC18 со вставками. ДНК позитивных клонов анализируют рестрикционным анализом. Клон 16РН содержит вставку фрагмента ДНК вируса длиной 300 п.н. Для проверки специфичности сконструированного зонда проводят выделение ДНК из нового "урожая" вируса, фиксируют ее на нитроцеллюлозном фильтре и проводят гибридизацию с зондом 16РН, меченным радиоактивным фосфором. В качестве контролей используют фиксированные на фильтре ДНК вируса инфекционного ринотрахеита, аденовируса крупного рогатого скота, ДНК из тимуса теленка и препарат из неинфицированной культуры клеток RK13, в которой размножали вирус болезни Ауески. Зонд 16РН активно гибридизуется только с ДНК вируса болезни Ауески.
Пример 3. Нерадиоактивное мечение ДНК-зонда pUC18-SHVl-16PH. К 30-40 мкг ДНК pUC18-SHVl-16PH в 50 мкл дистиллированной воды добавляют 50 мкл IМ аминооксибутиламина и прогревают смесь на кипящей водяной бане 7 мин с последующим охлаждением во льду. Процедуру повторяют еще раз, затем раствор наносят на колонку (1 мл) со смолой Sephadex G-50 и ведут гель-фильтрацию ДНК в дистиллированной воде. К ДНК после гель фильтрации (объем 150-170 мкл) добавляют IM NaHCO3 до концентрации 0,1М и 30 мкл 0,1М раствора N-гидроксисуксинимидного эфира аминокапроил-биотина ("активированного биотина"). Смесь выдерживают при комнатной температуре 1,5 ч, затем отделяют биотинилированную ДНК от избытка эфира биотина гель фильтрацией на Sephadex G-50. Выход меченой ДНК составляет 70-80 %, она электрофоретически однородна в 1%-ном агарозном геле.
Пример 4. Гибридизация биотинилированного ДНК-зонда с вирусной ДНК. Вирусную ДНК, выделенную из инфицированной культуры клеток, наносят точками на капроновые фильтры и ведут гибридизацию с биотин-меченным ДНК-зондом pUC18-SHVl-16PH в концентрации 200 нг/мл. Раствор для предгибридизации и гибридизации содержит 6xSSC, 5хДенхардта, 0,5% SDS, 100 мкг/мл денатурированной ДНК лосося. Гибридизацию ведут 16 ч при 60oС, фильтры отмывают 2 раза в 2xSSC, 0,1% SDS и 2 раза в 0,2xSSC, 0,1% SDS при температуре гибридизации.
Пример 5. Выявление биотинилированного ДНК-зонда на фильтрах после гибридизации. После гибридизации с биотинилированным ДНК-зондом и отмывки от зонда фильтры обрабатывают блокирующим буфером в течение 30 мин при комнатной температуре (блокирующий буфер: 0,1 М трис-НСl рН 7,5; 0,1 М NaCl; 3mM MgCl2; 0,5% твин-20). После стадии блокирования фильтр помещают на 5 мин в реакционный буфер, затем переносят его на чистый лист лавсана и смачивают разбавленным в 1000 раз конъюгатом стрептавидина со щелочной фосфатазой. На фильтр размером 10х10 см необходимо 2 мл разбавленного в 1000 раз реакционным буфером конъюгата (реакционный буфер: 0,1 М трис-НСl рН 7,5; 0,1 М NaCI, 3mM MgCl2, 0,05% твин-20). Фильтр накрывают вторым листом лавсана, убирают пузырьки воздуха между листами и оставляют на 30 мин, затем отмывают от избытка конъюгата 3 раза по 5 мин блокирующим буфером и 1 раз 5 мин АР-буфером (АР-буфер: 0,1М трис-НСl рН 9,5, 0,1 М NaCl, 5 mM MgCl2). После этого фильтр помещают в раствор красителей для фосфатазы, который готовят непосредственно перед использованием следующим образом: навески 2,5 мг 5-бром-3-индолилфосфата и 4 мг нитротетразолевого синего растворяют каждую отдельно в 50 мкл диметилформамида, растворы переносят в пробирку с 15 мл АР-буфера и перемешивают. Окраска пятен или полос, содержащих биотиновые производные ДНК, развивается в течение нескольких часов в темноте.
Таким образом, сконструирован ДНК-зонд pUC18-SHVl-16PH на основе плазмидной ДНК pUC18 путем клонирования Pstl- фрагмента вирусного генома длиной 300 п. н. Нерадиоактивно меченный двунитевой ДНК-зонд содержит биотиновые звенья, ковалентно связанные с цитозиновыми основаниями.
Проведены исследования по определению чувствительности и специфичности биотинилированного ДНК-зонда pUC18-SHVl-16PH, полученного на основе двунитиевой плазмидной ДНК в сравнении с ДНК-зондом, меченным радиоактивным фосфором. Оба зонда содержали один и тот же фрагмент вирусного генома. Гибридизацию с зондами вели на ДНК вируса болезни Ауески, выделенной из инфицированной культуры клеток. В качестве контроля аналогичные опыты проводили с ДНК вируса инфекционного ринотрахеита и аденовируса крупного рогатого скота 1-го типа. Результаты опытов представлены в таблице 1.
Приведенные в таблице данные показывают, что чувствительность выявления вирусной ДНК с помощью биотинилированного плазмидного ДНК-зонда pUC18-SHVl-16PH составляет 1-10 пкг, что в 10 раз превышает чувствительность аналогичного ДНК-зонда, меченного радиоактивным фосфором. Полученный ДНК-зонд специфичен к ДНК вируса болезни Ауески сельскохозяйственных животных и не гибридизуется с другими вирусными ДНК.
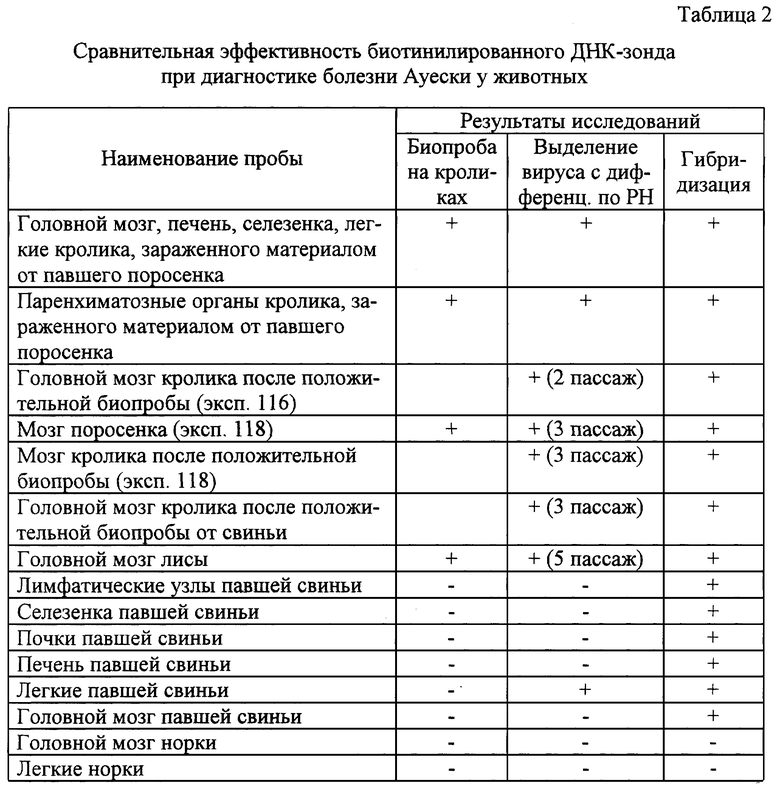
Заявленный способ выявления вируса болезни Ауески был испытан на пробах биоматериала от больных животных (см. таблицу 2).
В работе использовали (с учетом положительных или отрицательных результатов биопробы и вирусологических исследований): суспензии внутренних органов кролика, двух павших поросят с признаками болезни Ауески, проб внутренних органов павшей свиньи, мозг и легкие норок с признаками поражения центральной нервной системы при жизни, а также лисы после положительных или отрицательных результатов анализа. Всего тремя методами исследовали 15 проб.
Результаты экспериментов показали, что созданный ДНК-зонд позволяет выявлять ДНК вируса у инфицированных животных и может использоваться для диагностики заболевания. Так, результаты гибридизации полностью совпали с результатами выделения вируса в культуре клеток и биопробы при исследовании 5 проб, полученных от павших поросят, лисы, а также внутренних органов кроликов, зараженных биоматериалом от них. При этом были получены наиболее сильные сигналы гибридизации.
Результаты исследования проб биоматериала от норки (мозг, легкие) были отрицательными по всем методам. В дальнейшем у этих животных в зверосовхозе установили другой диагноз - фузариотоксикоз.
При исследовании 6 проб внутренних органов свиньи, павшей с признаками поражения центральной нервной системы, результаты биопробы были отрицательными по всем пробам, вирус удалось изолировать только из легких, но все исследуемые пробы дали положительный сигнал в гибридизации. По всей вероятности, это связано со способностью метода молекулярной гибридизации - выявлять не только инфекционные (способные реплицироваться в чувствительной системе), но и неинфекционные частицы вируса.
Таким образом, сконструирован плазмидный (биотинилированный) ДНК- зонд, специфичный к ДНК вируса болезни Ауески.
Проведены испытания данного способа выявления вируса болезни Ауески на пробах от животных. Они показали достаточно высокую чувствительность и специфичность метода при выявлении ДНК вируса. Этот способ может применяться для диагностики вируса болезни Ауески в животноводческих хозяйствах, при этом время анализа составляет 30 часов, что по срокам постановки диагноза превосходит метод выделения вируса в культуре клеток в 36 раз, а метод биопробы на кроликах - в 18 раз.
Данный способ может быть использован в ветеринарной практике для экспресс-диагностики различных форм проявления болезни Ауески во время эпизоотии как в хозяйствах промышленного типа, так и в частных. Использование ДНК-зонда, полученного таким способом, более чем на 1 порядок повышает чувствительность выявления вирусной ДНК по сравнению с двунитиевым ДНК-зондом, полученным на основе клонирования Hind111-фрагмента в плазмиду pBR325, и является более перспективным для проведения гибридизационного анализа.

Изобретение относится к генетической инженерии и может быть использовано в ветеринарной вирусологии для выявления заболеваний сельскохозяйственных животных, а именно: болезни Ауески. Фрагмент ДНК вируса болезни Ауески клонируют в векторную плазмиду рUC18. Полученную конструкцию метят биотином путем химической модификации ДНК по цитозиновым звеньям. Изобретение позволяет повысить уровень чувствительности выявления вирусной ДНК по сравнению с известными методиками. 2 табл.
Способ выявления вируса болезни Ауески сельскохозяйственных животных, предусматривающий выделение вирусной ДНК, конструирование ДНК-зонда, мечение ДНК-зонда биотином, гибридизацию на фильтре ДНК-зонда с вирусной ДНК с последующим выявлением вирусной ДНК по появлению окрашенных пятен, отличающийся тем, что ДНК-зонд конструируют путем клонирования Pstl-фрагмента вирусного генома длиной 300 п. н. в плазмидный вектор рUC18, а мечение зонда биотином осуществляют путем модификации цитозиновых звеньев.
| СПОСОБ ИЗВЛЕЧЕНИЯ РТУТИ И ДРУГИХ ЦВЕТНЫХ МЕТАЛЛОВ ИЗ ОТРАБОТАННЫХ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ И/ИЛИ ОТХОДОВ ИХ ПРОИЗВОДСТВА | 1993 |
|
RU2116364C1 |
Авторы
Даты
2002-02-27—Публикация
2000-05-06—Подача