Настоящее изобретение относится к производным 2-цианоимино-имидазола, обладающим ингибирующим действием в отношении фосфодиэстеразы IV (РВЕ) и цитокина, и их получению; оно также относится к композициям, содержащим их, а также к их применению в качестве лекарственных средств.
В WО 95/05386, опубликованной 23 февраля 1995, Smithkline Веесhаm Соrроrаtiоn, описаны производные фенэтиламина, такие как N-[2-(3-циклопентилокси-3-метоксифенил)этил] имидодикарбамид и N'-циано-1-[2-(3-циклопентилокси-4-метоксифенил)этил] карбоксимидамид, полезные для лечения болезненных состояний, связанных с фосфодиэстеразой IV. В этой заявке дано общее описание производных фенэтиламина, содержащие цианогуанидиновую часть.
Соединения настоящего изобретения отличаются по строению от известных ингибиторов РDЕ IV, поскольку они обязательно содержат 2-цианоиминоимидазольную часть. Они могут быть использованы в терапии для лечения болезненных состояний, связанных с аномальной ферментативной или каталитической активностью РDЕ IV, и/или болезненных состояний, связанных с вредным избытком цитокинов, в частности, аллергических, атопических и воспалительных заболеваний. Соединения настоящего изобретения также обладают незначительным побочным действием на желудочно-кишечный тракт, которое часто связано с ингибиторами РDЕ IV.
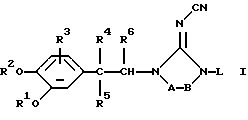
Настоящее изобретение относится к производным 2-цианоиминоимидазола формулы (I)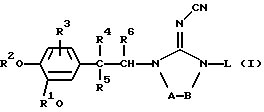
их N-оксидным формам, фармацевтически приемлемым солям присоединения кислот или оснований и стереохимически изомерным формам,
где каждый R1 и R2 независимо, представляет водород; С1-6-алкил; дифторметил; трифторметил; С3-6-циклоалкил; насыщенный 5-, 6- или 7-членный гетероцикл, содержащий один или два гетероатома, выбранных из атомов кислорода, серы или азота; инданил; 6,7-дигидро-5H-циклопентапиридинил; бицикло [2.2.1] -2-гептенил; бицикло [2.2.1] -гептанил; С1-6-алкилсульфонил; арилсульфонил; или С1-10-алкил, замещенный одним или двумя заместителями, каждый из которых выбирают, независимо, из арила, пиридинила, тиенила, фуранила, инданила, 6,7-дигидро-5H-циклопентапиридинила, С3-7-циклоалкила и насыщенного 5-, 6- или 7-членного гетероцикла, содержащего один или два гетероатома, выбранных из атомов кислорода, серы или азота;
R3 представляет водород, галоген или С1-6-алкилокси;
R4 представляет водород; галоген; С1-6-алкил; трифторметил; С3-6-циклоалкил; карбоксил; C1-4-алкилоксикарбонил; С3-6-циклоалкиламинокарбонил; арил; Неt1; или С1-6-алкил, замещенный циано, амино, гидрокси, С1-4-алкилкарбониламино, арилом или Неt1; или
R4 представляет радикал формулы
-O-R7 (а-1); или
-NН-R8 (а-2);
где R7 представляет водород; С1-6-алкил; С1-6-алкил, замещенный гидрокси, карбоксилом, С1-4-алкилоксикарбонилом, амино, моно- или ди(С1-4-алкил)амино, Неt1 или арилом;
R8 представляет водород; С1-6-алкил; С1-4-алкилкарбонил; С1-6-алкил, замещенный гидрокси, карбоксилом, C1-4-алкилоксикарбонилом, амино, моно- или ди(С1-4-алкил)амино, Неt1 или арилом;
R5 представляет водород, галоген, гидрокси, С1-6-алкил или С1-6-алкилокси; или
R4 и R5 вместе могут образовывать двухвалентный радикал формулы
-(СН2)n- (b-1);
-СН2-СН2-O-СН2-СН2- (b-2);
-СН2-СН2-N(R9)-СН2-СН2- (b-3); или
-СН2-СН=СН-СН2- (b-4);
где n равен 2, 3, 4 или 5;
R9 представляет водород, С1-6-алкил, С1-6-алкилсульфонил или п-толуолсульфонил;
R6 представляет водород или С1-4-алкил; или
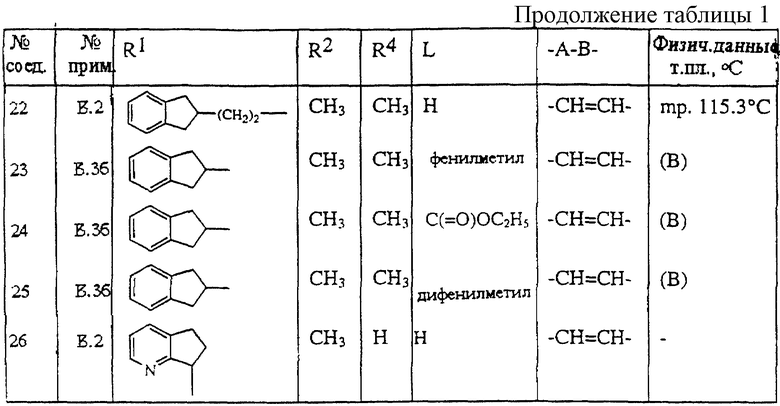
R4 и R6, вместе, могут образовывать двухвалентный радикал формулы -(СН2)m-;
где m равен 1, 2, 3 или 4;
-А-В- представляет двухвалентный радикал формулы
-СR10=СR11- (с-1); или
-СНR10-СНR11 (с-2);
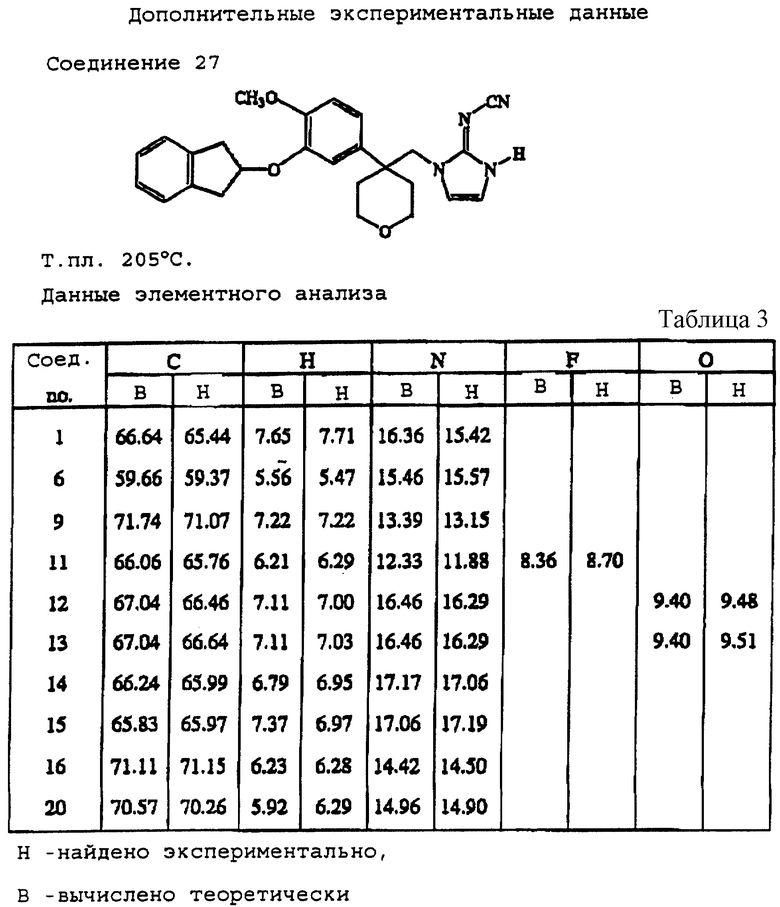
где каждый R10 и R11 представляет, независимо, водород или С1-4-алкил; и
L представляет водород; С1-6-алкил; С1-6-алкилкарбонил; С1-6-алкилоксикарбонил; С1-6-алкил, замещенный одним или двумя заместителями, выбранными из группы, включающей гидрокси, С1-4-алкилокси, С1-4-алкилоксикарбонила, моно- и ди(С1-4-алкил)амино, арила и Неt2; С3-6-алкенил; С3-6-алкенил, замещенный арилом; пиперидинил; пиперидинил, замещенный С1-4-алкилом или арил-С1-4-алкилом; С1-6-алкилсульфонил или арилсульфонил;
арил представляет фенил или фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена, гидрокси, С1-4-алкила, С1-4-алкилокси, С3-6-циклоалкила, трифторметила, амино, нитро, карбоксила, С1-4-алкилоксикарбонила и С1-4-алкилкарбонил-амино;
Неt1 представляет пиридинил; пиридинил, замещенный С1-4-алкилом; фуранил; фуранил, замещенный С1-4-алкилом; тиенил; тиенил, замещенный С1-4-алкилкарбониламино; гидроксипиридинил, гидроксипиридинил, замещенный С1-4-алкилом или С1-4-алкокси-С1-4-алкилом; имидазолил; имидазолил, замещенный С1-4-алкилом; тиазолил; тиазолил, замещенный C1-4-алкилом; оксазолил; оксазолил, замещенный С1-4-алкилом; изохинолинил; изохинолинил, замещенный С1-4-алкилом; хинолинонил; хинолинонил, замещенный С1-4-алкилом; морфолинил; пиперидинил; пиперидинил, замещенный C1-4-алкилом, С1-4-алкилоксикарбонилом или арил-С1-4-алкилом; пиперазинил; пиперазинил, замещенный С1-4-алкилом, C1-4-алкилоксикарбонилом или арил-С1-4-алкилом; и
Неt2 представляет морфолинил; пиперидинил; пиперидинил, замещенный С1-4-алкилом или арил-С1-4-алкилом; пиперазинил; пиперазинил, замещенный С1-4-алкилом или арил-С1-4-алкилом; пиридинил; пиридинил, замещенный С1-4-алкилом; фуранил, фуранил, замещенный С1-4-алкилом; тиенил или тиенил, замещенный С1-4-алкилом или С1-4-алкилкарбониламино.
Некоторые из соединений формулы (I) могут существовать также в таутомерных формах. Предполагается, что такие формы, хотя они специально не указаны в приведенной выше формуле (I), включены в объем настоящего изобретения. В частности, соединения формулы (I), в которых L представляет водород, могут существовать в соответствующей таутомерной форме.
В R1 и R2 насыщенные 5-, 6- или 7-членные гетероциклы, содержащие один или два гетероатома, выбранных из атомов кислорода, серы или азота, можно подходящим образом выбрать среди таких гетероциклов, как, например, тетрагидрофуранил, диоксоланил, пирролидинил, морфолинил, пиперидинил, пиперазинил и тетрагидропиранил. Указанные гетероциклические радикалы присоединены к атому кислорода или С1-10-радикалу через любой атом углерода или, в соответствующем случае, при помощи атома азота.
Также в R1 и R2 термин "6,7-дигидро-5H-циклопентапиридинил", называемый также 6,7-дигидро-5H-пиридинилом, предназначен для обозначения 6,7-дигидро-5H-циклопента[b] пиридина или 6, 7-дигидро-5H-циклопента[с]пиридинила, которые могут присоединяться к остальной части молекулы через любой из алифатических или ароматических атомов углерода.
Используемый здесь термин "галоген" является общим для обозначения фтора, хлора, брома и иода; термин "С1-4-алкил" относится к линейным или разветвленным насыщенным углеводородам с 1-4 атомами углерода и включает такие радикалы, как, например, метил, этил, 1-метилэтил, 1,1-диметилэтил, пропил, 2-метилпропил и бутил; термин "С1-6-алкил" включает С1-4-алкил и его более высокие гомологи с 5 или 6 атомами углерода, такие как, например, 2-метилбутил, пентил, гексил и подобные; термин "С1-6-алкил" включает С2-6-алкил и более низкие гомологи с 1 атомом углерода, такие как, например, метил; С1-10-алкил включает С1-6-алкил и более высокие гомологи с 7-10 атомами углерода, такие как, например, гептил, октил, нонил, децил, 1-метилгексил, 2-метилгептил и подобные; термин "С3-6-алкенил" определяет линейные и разветвленные углеводородные радикалы, содержащие одну двойную связь и имеющие от 3 до 6 атомов углерода, такие как, например, 2-пропенил, 3-бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил и подобные; и причем атом углерода указанного С3-6-алкенила, соединяющийся с атомом азота, предпочтительно, является насыщенным; термин "С3-6-циклоалкил" является общим для циклопропила, циклобутила, циклопентила и циклогексила; термин "С3-7-циклоалкил" включает С3-6-циклоалкил и циклогептил; термин "С1-4-алкандиил" включает линейные и разветвленные насыщенные двухвалентные углеводородные радикалы с 1-4 атомами углерода, такие как, например, метилен, 1,2-этандиил, 1,1-этандиил, 1,3-пропандиил, 1,2-пропандиил, 1,4-бутандиил, 2-метил-1,3-пропандиил и подобные.
Используемый здесь в вышеуказанных определениях и далее термин "гало-С1-4-алкандиил" определяет моно- или полигалогензамещенный С1-4-алкандиил, в частности, С1-4-алкандиил, замещенный одним или несколькими атомами фтора.
Фармацевтически приемлемые соли присоединения кислот, упомянутые выше, представляют формы солей присоединения кислот, которые обычно получают обработкой соединений формулы (I) в форме основания соответствующими кислотами, например, неорганическими кислотами, такими как галогенводородная кислота, например, хлористоводородная или бромистоводородная, серная, азотная, фосфорная или подобными кислотами; или органическими кислотами, такими как, например, уксусная, оксиуксусная, пропановая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные. И наоборот, указанные формы солей присоединения кислот можно превратить в формы свободных оснований обработкой соответствующим основанием.
Соединения формулы (I), содержащие кислотный протон, также можно превратить в их нетоксичные соли присоединения металла или амина обработкой соответствующими органическими или неорганическими основаниями. Подходящими солевыми формами являются, например, аммониевые соли, соли щелочных и щелочноземельных металлов, например, литиевые, натриевые, калиевые, магниевые, кальциевые соли и т.п., соли органических оснований, например, соли бензатина, N-метил-D-глюкамина, гидрабамина и соли аминокислот, таких как, например, аргинин, лизин и подобные.
Термин "соль присоединения" включает также гидраты и сольватные формы, которые могут образовывать соединения формулы (I). Примерами таких форм являются, например, гидраты, алкоголяты и т.п.
N-оксидные формы соединений формулы (I) включают те соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида.
Термин "стехиометрически изомерные формы", используемый здесь, определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если нет иных упоминаний и указаний, химические названия соединений обозначают смеси всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию, а =N-СN и замещенные С3-6-алкенильные группы могут иметь Е- или Z-конфигурацию.
Далее термин "соединения формулы (I)" включает также N-оксидные формы, фармацевтически приемлемые соли присоединения кислот или оснований и все стереоизомерные формы.
Некоторые из соединений формулы (I) и некоторые из промежуточных соединений по настоящему изобретению могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений можно получить, используя хорошо известные методики.
Например, диастереоизомеры можно разделить с помощью физических методов, таких как селективная кристаллизация или с помощью хроматографических способов, например, противоточным распределением, жидкостной хроматографией и подобными. Энантиомеры можно получить из рацемических смесей, превращая сначала указанные рацемические смеси с помощью подходящих разделяющих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; с последующим физическим разделением указанных смесей диастереомерных солей или соединений с помощью, например, селективной кристаллизации или хроматографических методов, например, жидкостной хроматографии и подобными способами; и, наконец, превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы можно также получить из стереохимически чистых изомерных форм соответствующих промежуточных соединений и исходных веществ при условии, что соответствующие реакции проходят стереоспецифически. Чистые и смешанные стереохимически изомерные формы соединений формулы (I) включены в объем настоящего изобретения.
Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной неподвижной фазы.
Особой группой соединений являются те соединения формулы (I), в которых каждый из R1 и R2 представляет, независимо, водород; С1-6-алкил; дифторметил, трифторметил; С3-6-алкил; насыщенный 5-, 6- или 7-членный гетероцикл, содержащий один или два гетероатома, выбираемых из атомов кислорода, серы или азота; инданил; бицикло[2.2.1] -2-гептенил; бицикло[2.2.1]гептанил; С1-6-алкилсульфонил; арилсульфонил; или С1-10-алкил, замещенный одним или двумя заместителями, каждый из которых, независимо, выбирают из арила, пиридинила, тиенила, фуранила, С3-7-циклоалкила и насыщенного 5-, 6- или 7-членного гетероцикла, содержащего один или два гетероатома, выбранных из атомов кислорода, серы или азота.
Представляющими интерес соединениями являются те соединения формулы (I), в которых каждый из R1 и R2 представляет, независимо, С1-6-алкил; С3-6-циклоалкил; дифторметил; насыщенный 5-, 6- или 7-членный гетероцикл, содержащий один или два гетероатома, выбранных из атомов кислорода, серы или азота, представляющий, предпочтительно, тетрагидрофуранил; инданил или С1-10-алкил, замещенный арилом, инданилом, 6,7-дигидро-5H-циклопентапиридинилом или С3-6-циклоалкилом.
Также интересны те соединения формулы (I), в которых R5 представляет водород, а R4 представляет водород, гидрокси или С1-6-алкил, в особенности, когда R4 представляет метил.
Другой интересной группой являются те соединения формулы (I), в которых L представляет водород, С1-6-алкилоксикарбонил или С1-6-алкил, замещенный одним или двумя фенильными кольцами.
Особого внимания заслуживают те соединения формулы (I), в которых R1 представляет циклопентил, тетрагидрофуранил, циклопропилметил, 5-фенилпентил, 2-инданилэтил, 6,7-дигидро-5H-циклопента[b]пиридинил или инданил; а R2 представляет метил или дифторметил.
Предпочтительными соединениями являются соединения, в которых R3, R5, R6, R10, R11 и L представляют водород.
Наиболее предпочтительными соединениями являются [1-[2-[4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси] -фенил]-пропил]-1,3-дигидро-2H-имидазол-2-илиден] цианамид и [1-[2-[4-(метокси)-3-[(1,3-дигидро-2H-инден-2-ил)окси] -фенил]пропил]-1, 3-дигидро-2H-имидазол-2-илиден]цианамид; их N-оксиды, их стереохимически изомерные формы и их фармацевтически приемлемые соли присоединения.
Везде, где упоминаются далее R1-R11, Y, -А-В- и L, они имеют значения, указанные в определении формулы (I), если нет других указаний.
Соединения формулы (I), в которых -А-В- представляет радикал формулы (с-1), а L представляет водород, причем указанные соединения изображаются формулой (I-а-1), можно удобно получить циклизацией промежуточного соединения формулы (II) или его функционального производного в присутствии подходящей кислоты, такой как, например, хлористоводородная кислота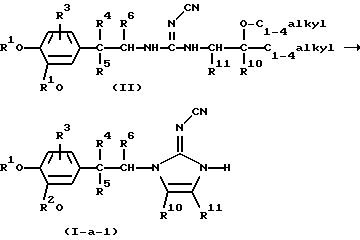
Указанную циклизацию можно осуществить в инертном для реакции растворителе, таком как, например, тетрагидрофуран или 1,4-диоксан или в их смеси. Перемешивание и нагревание могут увеличить скорость реакции.
В этом и приведенных далее способах получения продукты реакции можно выделить из реакционной среды, и, при необходимости, дополнительно очистить известными способами в данной области, такими как, например, экстракция, кристаллизация, растирание и хроматография.
В частности, соединения формулы (I-а-1), в которых R5 представляет гидрокси, причем указанные соединения представлены формулой (I-а-1-1), можно получить циклизацией промежуточного соединения формулы (II-1), где Р представляет водород, или, предпочтительно, является защитной триметилсилильной группой, или его функционального производного по способу, аналогичному описанному для получения соединения формулы (I-а-1) из промежуточного соединения формулы (II)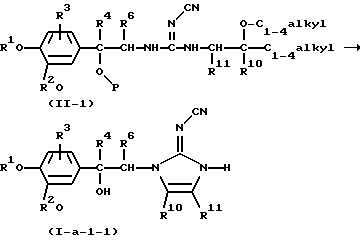
Соединения формулы (I), в которых -А-В- представляет радикал формулы (с-2), а L представляет водород, причем указанные соединения представлены формулой (I-а-2), можно получить циклизацией промежуточного соединения формулы (III) или его функционального производного в присутствии подходящего реагента, такого как, например, диметилцианокарбонимидодитиоат или дифенил-N-цианокарбонимидат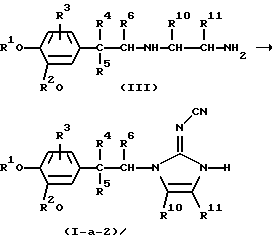
С другой стороны, соединения формулы (I) можно получить при взаимодействии металлоорганического промежуточного соединения формулы (IV), где М представляет соответствующий ион металла или ион металлокомплекса, такой как, например, Li+, (МgВr)+, В(ОН)2 + или Sn(СН3)3 +, в инертном для реакции растворителе с подходящим производным 2-цианоиминоимидазола формулы (V), где W1 представляет реакционноспособную уходящую группу, такую как, например, галоген. В случае, когда R4 и R5 объединяются вместе и образуют радикал формулы (b-1), (b-2), (b-3) или (b-4), W1 может представлять также цианидную группу, при условии, что промежуточное соединение формулы (IV) является реактивом Гриньяра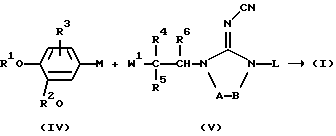
Указанную реакцию можно осуществлять в инертном для реакции растворителе, таком как, например, диметоксиэтан, тетрагидрофуран или диэтиловый эфир. Перемешивание и нагревание могут ускорить реакцию. В случае, когда в указанной реакции используют промежуточные соединения формулы (V), в которых L заменяют подходящей защитной группой, соединения формулы (I), в которых L представляет водород, причем указанные соединения представлены соединениями формулы (1-а), можно получить с использованием известных в данной области реакций отщепления защитных групп.
Соединения формулы (I) можно также превращать одно в другое в соответствии с известными в данной области методиками превращения функциональных групп.
Например, соединения формулы (I), в которых L отличается от водорода, причем указанные соединения представлены формулой (I-b), можно получить взаимодействием соединения формулы (I-а) с L'-W2 (VI), где L' имеет те же значения, что и L в формуле (I), но не является водородом, и W2 представляет реакционноспособную уходящую группу, такую как, например, атом галогена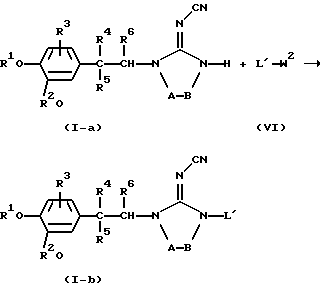
Для превращения соединений формулы (I-а) в соединения формулы (I-b) можно использовать также известные в данной области реакции присоединения.
Соединения формулы (I) можно также превратить в соответствующие N-оксидные формы в соответствии с известными методами для превращения трехвалентного азота в его N-оксидную форму. Указанные реакции N-окисления, вообще, можно осуществлять взаимодействием исходного вещества формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с подходящим органическим или неорганическим пероксидом. Подходящими неорганическими пероксидами являются, например, пероксид водорода, пероксиды щелочных металлов или щелочноземельных металлов, например, пероксид натрия, пероксид калия; подходящими органическими пероксидами могут являться пероксикислоты, такие как, например, пероксибензойная кислота или галогензамещенная пероксибензойная кислота, например, 3-хлорбензойная пероксикислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие жирные спирты, например, этанол и т.п., углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан и смеси таких растворителей.
Вышеупомянутые промежуточные соединения можно получить известными способами.
В частности, промежуточные соединения формулы (II) можно получить сначала взаимодействием амина формулы (VII) с диметилцианокарбонимидодитиоатом или дифенилцианокарбонимидатом или его функциональным производным. Указанное взаимодействие можно удобно осуществить в инертном для реакции растворителе, таком как, например, дихлорметан, бензол или толуол, необязательно, при охлаждении на ледяной бане и в присутствии основания, такого как, например, N, N-диэтилэтанамин или бикарбонат натрия. Полученное таким образом промежуточное соединение затем можно ввести во взаимодействие с промежуточным соединением формулы (VIII) или его функциональным производным с образованием промежуточного соединения формулы (II). Указанное взаимодействие можно удобным образом осуществить в инертном для реакции растворителе, таком как, например, 1,4-диоксан, в присутствии основания, такого как, например, N,N-диэтилэтанамин, и, необязательно, в присутствии катализатора, такого как, например, N, N-диметилпиридинамин. Перемешивание и повышенная температура могут увеличить скорость реакции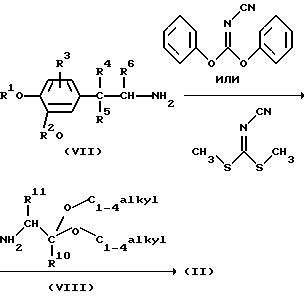
Альтернативно, вышеописанное взаимодействие можно осуществить в обратном порядке, т. е. сначала ввести в реакцию промежуточное соединение формулы (VIII) с диметилцианокарбонимидодитиоатом или дифенилцианокарбонимидатом или его функциональным производным, а затем полученное таким образом промежуточное соединение ввести во взаимодействие с амином формулы (VII).
Промежуточные соединения формулы (III), в которых R11 представляет водород, причем указанные промежуточные соединения представлены формулой (III-1), можно получить сначала взаимодействием амина формулы (VII) с цианопроизводным формулы (IX), где W3 представляет подходящую уходящую группу, такую как, например, галоген, в присутствии основания, такого как, например, карбонат натрия, в инертном для реакции растворителе, таком как, например, N, N-диметилформамид. Затем цианидную группу в полученном таким образом промежуточном соединении можно восстановить с использованием подходящего восстановителя, такого как, например, алюмогидрид лития или водород, в присутствии катализатора, такого как, например, никель Ренея, получая таким образом промежуточное соединение формулы (III-1)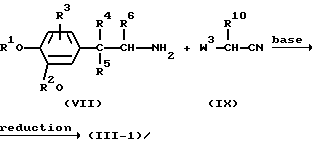
Некоторые из промежуточных соединений формулы (VII) описаны в WО 92/00968, WО 93/15044 и WО 93/15045.
В частности, промежуточные соединения формулы (VII) можно получить взаимодействием промежуточного соединения формулы (X), в котором W4 представляет подходящую уходящую группу, такую как, например, галоген, с промежуточным соединением формулы (XI), где М представляет соответствующий ион металла или ион металлокомплекса, такой как, например, Li+ или (МgВr)+, и Р представляет подходящую защитную группу, такую как, например, (1,1-диметилэтил)оксикарбонил. У полученного таким образом промежуточного соединения формулы (VII) с защитной группой затем можно отщепить защитную группу хорошо известными в технике способами, например, кислотным гидролизом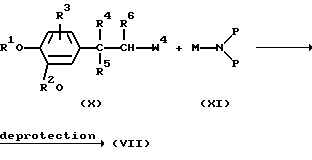
Промежуточные соединения формулы (VII), в которых R6 представляет водород, причем указанные промежуточные соединения представлены формулой (VII-1), можно получить восстановлением ненасыщенной связи углерод-азот в промежуточных соединениях формулы (XII) подходящим восстановителем, таким как, например, борантетрагидрофурановый комплекс, алюмогидрид лития или водород, в присутствии катализатора, такого как, например, никель Ренея. Цианидную группу в промежуточных соединениях формулы (XII) можно также заменить ее функциональным производным, таким как, например, оксимная группа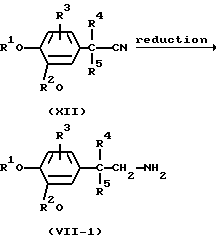
Некоторые из промежуточных соединений формулы (XII) описаны в WО 92/00968, WО 93/15044 и WО 93/15045.
В частности, промежуточные соединения формулы (XII), в которых R5 представляет защищенную гидроксильную группу, а R4 представляет водород, причем указанные промежуточные соединения представлены формулой (ХII-1), можно удобным образом получить взаимодействием альдегида формулы (XIII) с реагентом формулы (XIV) или его функциональным производным, в которых Р представляет защитную группу, такую как, например, триметилсилил и т.п., в инертном для реакции растворителе, таком как, например, дихлорметан и в присутствии каталитического количества ZnI2 или его функционального производного. Указанные промежуточные соединения формулы (ХII-1) затем можно ввести во взаимодействие, как описано выше, и получить форму соединения формулы (I), в котором R5 представляет гидрокси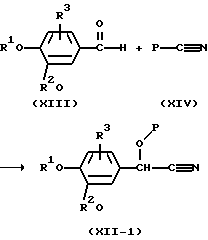
Альдегиды формулы (XIII) можно удобно получить по способу, аналогичному описанному Мitsunobu Оyо в Synthesis, 1-28, 1981.
Некоторые соединения формулы (I) и некоторые промежуточные соединения по настоящему изобретению имеют, по меньшей мере, один асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений можно получить с помощью методик, известных в данной области. Например, диастереоизомеры можно разделить с помощью физических методов, таких как селективная кристаллизация или хроматографическими методами, например, противоточным распределением, жидкостной хроматографией и подобными способами. Энантиомеры можно получить из рацемических смесей превращением сначала указанных рацемических смесей с помощью подходящих разделяющих агентов, таких как, например, хиральные кислоты в смеси диастереомерных солей или соединений; с последующим физическим разделением указанных смесей диастереомерных солей или соединений с помощью, например, селективной кристаллизации или хроматографических методов, например, жидкостной хроматографии и подобных методов; и, в заключение, превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры.
Чистые стереохимически изомерные формы соединений формулы (I) можно также получить из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ при условии, что реакции превращения проходят стереоспецифически. Предполагается, что стереохимически чистые и смешанные изомерные формы соединений формулы (I) входят в объем настоящего изобретения.
Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые соли присоединения кислот и оснований и их стереохимически изомерные формы являются сильными ингибиторами изоферментов фосфодиэстераз (РDЕ) семейства IV (цАМФ-специфическое семейство).
цАМФ (циклический аденозин-3',5'-монофосфат) является ключевым вторичным мессенджером, концентрация которого влияет на деятельность специфических клеток через активацию ферментов, таких как киназы. Известно, что РDЕ IV гидролизует цАМФ до его соответствующего неактивного метаболита 5'-монофосфата. Следовательно, ингибирование РDЕ IV ведет к повышению уровня цАМФ в специфических клетках, таких как респираторные гладкомышечные клетки, и во многих клетках зоны воспаления, т.е., некоторых лимфоцитах, например, базофилах, нейтрофилах и эозинофилах, моноцитах и тучных клетках. Полагают, что ряд аллергических, атопических и воспалительных заболеваний вызывается концентрациями РDЕ IY, превышающими нормальные, результатом чего являются низкий уровень цАМФ и гиперчувствительность испытавших это влияние клеток к возбудительным раздражителям. (Примерами указанной гиперчувствительности являются, например, избыточное выделение гистамина из базофилов и тучных клеток или избыточное образование пероксидных анион-радикалов эозинофилами.) Следовательно, соединения настоящего изобретения, обладающие свойствами значительно ингибировать фосфодиэстеразу IV, считаются полезными для облегчения и/или лечения аллергических, атопических и воспалительных заболеваний. Функциональное действие ингибиторов РDЕ IV состоит, например, в релаксации респираторных гладкомышечных клеток, увеличении просвета бронхов, ингибировании агрегации тромбоцитов и ингибировании высвобождения медиаторов лейкоцитами. Примерами аллергических заболеваний являются бронхиальная астма, хейлит, конъюнктивит, контактный дерматит и экзема, болезненная чувствительность кишечника, сухая экзема, крапивница, васкулит, вульвит; примерами атонических заболеваний являются дерматит и экзема, winterfeet, астма, аллергический ринит; и родственные болезни, например, псориаз и другие гиперпролиферативные заболевания.
Таким образом, настоящее изобретение также относится к соединениям формулы (I), определенным выше, для применения в медицине, в частности, для применения в качестве лекарственного средства для лечения атопических заболеваний или в качестве антиастматического средства. Итак, соединения настоящего изобретения можно применять для производства лекарственных средств для лечения атонических или астматических заболеваний, в особенности - атопического дерматита.
Ингибирующее действие на РDЕ IV соединений формулы (I) может быть продемонстрировано в тесте "Ингибирование рекомбинантной человеческой мононуклеарной лимфоцитарной (МNL) фосфодиэстеразы типа IV В, продуцированной в клетках насекомых с бакуловирусным вектором". Некоторые тесты in vivo и in vitro можно использовать для демонстрации полезности соединений формулы (I) для лечения описанных аллергических, атопических и воспалительных заболеваний. Такими тестами являются, например, "Бронхостеноз трахеи морской свинки in vitro", "Бронхостеноз трахеи морской свинки in vitro" и тест in vivo "Воспаление наружного уха у мышей, индуцированное арахидоновой кислотой", "Воспаление уха у мышей, вызванное ТРА" и "Аллергическая реакция замедленного типа у мышей".
Кроме того, соединения настоящего изобретения обладают очень слабым ингибирующем действием в отношении изоферментов фосфодиэстераз семейства III (семейство, инигибируемое сGМР). Ингибирование, в частности, РDЕ III ведет к повышению содержания цАМФ в сердечной мышце, что вызывает воздействие на сократительную способность сердца, а также на релаксацию сердца. Ясно, что при лечении описанных аллергических, атопических и воспалительных заболеваний действие на сердечно-сосудистую систему нежелательно. Следовательно, так как соединения настоящего изобретения ингибируют РDЕ IV при значительно меньших концентрациях, чем те, при которых они ингибируют РDЕ III, их можно терапевтически использовать, избегая сердечно-сосудистых побочных действий.
Известные ингибиторы РDЕ IV часто оказывают вредное побочное действие на желудочно-кишечный тракт. Большинство из соединений настоящего изобретения оказывают слабое воздействие на желудочно-кишечный тракт, что можно показать в тесте "Опорожнение желудка от калорийной пищи у крыс".
Используемые здесь обозначения "РDЕ III" и "РDЕ IV" относятся к классификации J. А. Веаvо аnd D.Н. Rеifsnydеr, ТIРS Rеviеws, Арril 1990, рр. 150-155.
Соединения настоящего изобретения также обладают ингибирующим действием на цитокины. Цитокином является любой секретируемый полипептид, который воздействует на функцию других клеток посредством модуляции взаимодействий между клетками при иммунной и воспалительной реакциях. Примерами цитокинов являются монокины и лимфокины, и они могут продуцироваться многими различными клетками. Например, монокин вообще рассматривается как продуцируемый и секретируемый моноядерной клеткой, такой как макрофаг и/или моноцит, но монокины продуцируются многими другими клетками, такими как естественные клетки-киллеры, фибробласты, базофилы, нейтрофилы, эндотелиальные клетки, астроциты головного мозга, стромальные клетки костного мозга, эпидермальные кератиноциты и β-лимфоциты. Лимфокины обычно рассматривают как продуцируемые лимфоцитами. Примерами цитокинов являются интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), интерлейкин-8 (IL-8), фактор некроза опухоли альфа (α-ФНО) и фактор некроза опухоли бета (β-ФНО).
Цитокином, который особенно желательно ингибировать, является α-ФНО. Избыточное или нерегулируемое продуцирование ФНО является причиной передачи или обострения ряда заболеваний, в том числе, ревматоидного артрита, ревматоидного спондилита, остеоартрита, подагрического артрита и других артритных состояний; сепсиса, септического шока, грам-отрицательного сепсиса, токсического шока, респираторного дистрессного синдрома взрослых, церебральной малярии, хронического воспаления легких, силикоза, саркоидоза легких, костно-резорбционных болезней, повреждения при реперфузии, реакции "трансплантат против хозяина", отторжении аллотрансплантатов, лихорадки и миалгии вследствие инфекционной болезни, такой как грипп, кахексии, возникающей вследствие инфекции или злокачественной опухоли, кахексии, возникающей вследствие синдрома приобретенного иммунодефицита (СПИДа), АIDS-АRС (СПИД-ассоциированного комплекса), образования келоида, образования рубцовой ткани, болезни Крона, неспецифического язвенного колита или изжоги.
Ингибирующее цитокины действие соединений формулы (I), такое как ингибирование продуцирования α-ФНО, можно показать в тесте in vivo "Продуцирование цитокинов в культурах человеческой цельной крови".
Кроме того, ожидается, что соединения настоящего изобретения не проявят или проявят слабые побочные действия эндокринологического характера. Это можно показать, например, в тесте "Тестостерон in vivo", тесте "Ингибирование активности ароматазы in vitro" и тесте "Ингибирование активности ароматазы in vivo".
С учетом полезных свойств ингибирования РDЕ IV и цитокинов обсуждаемые соединения можно вводить в состав различных фармацевтических композиций для целей введения, содержащих фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения формулы (I). Чтобы получить фармацевтические композиции данного изобретения, терапевтически эффективное количество определенного соединения в форме соли присоединения основания или кислоты, в качестве активного ингредиента, соединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может быть в самых разных формах, в зависимости от формы препарата, нужного для введения. Эти фармацевтические композиции, желательно, находятся в форме стандартных доз, подходящих, предпочтительно, для перорального, ректального, местного, чрескожного введения, введения ингаляцией или парентеральной инъекцией. Например, при получении композиций в пероральной дозированной форме можно использовать обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и подобные - для жидких пероральных препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, дезинтеграторы и подобные вещества - в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения таблетки и капсулы представляют наиболее предпочтительную стандартную форму лекарственных средств для перорального введения, в которой используются, очевидно, твердые фармацевтические носители. В случае парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере, в большей части, хотя могут включаться другие ингредиенты, например, улучшающие растворение. Можно получить, например, растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также получить суспензии для инъекций, в которых можно использовать подходящие жидкие носители, суспендирующие средства и подобные вещества. В композициях, подходящих для чрескожного введения, носитель содержит, необязательно, агент, увеличивающий проникновение, и/или подходящее смачивающее вещество, соединенное, необязательно, с подходящими добавками любого характера в незначительном количестве, не оказывающими какого-либо вредного действия на кожу. Указанные добавки могут облегчить введение в кожу и/или могут быть полезны для приготовления нужных композиций. Эти композиции можно вводить различными способами, например, в виде трансдермального пластыря, в виде мазков или в виде мази. В качестве подходящих композиций для местного применения можно назвать все композиции, обычно используемые для местного введения лекарственных средств, например, кремы, желе, повязки, шампуни, настои, пасты, мази, помады, порошки и т.п. Можно применять указанные композиции с помощью аэрозоля, например, с таким пропеллентом, как азот, диоксид углерода, фреон, или без пропеллента, например, с пульверизатором, в виде капель, лосьонов, или в полутвердом состоянии, таком как загущенная композиция, которую можно наносить с помощью помазка. В частности, полутвердые композиции, такие как помады, кремы, желе, мази и подобные, будет удобно использовать.
Для улучшения растворимости и/или повышения устойчивости соединений формулы (I) в фармацевтических композициях может быть преимущественно использовать α-,β- или γ-циклодекстрины, или их производные, в частности, гидроксиалкилзамещенные циклодекстрины, например, 2-гидроксипропил-β-циклодекстрин. Также растворимость и/или устойчивость соединений формулы (I) в фармацевтических композициях могут улучшить сорастворители, такие как спирты. При получении водных композиций более подходящими являются, очевидно, соли присоединения обсуждаемых соединений из-за их повышенной растворимости в воде.
Особенно предпочтительно, составлять вышеописанные фармацевтические композиции в единичной дозированной форме для легкости введения и унифицирования дозировки. Стандартная лекарственная форма относится к физически дискретным элементам, подходящим в качестве стандартных доз, причем каждый элемент содержит заранее установленное количество активного ингредиента, рассчитанное для получения желаемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе, таблетки с насечками или с покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций и подобные формы, и упаковки, содержащие их множество.
Настоящее изобретение также относится к способу лечения теплокровных животных, страдающих от болезненных состояний, связанных с аномальной ферментативной или каталитической активностью РDЕ IV, и/или болезненных состояний, связанных с физиологически вредным избытком цитокинов, в частности, от аллергических, атопических и воспалительных заболеваний, определеннее, от астматических и атопических заболеваний, и наиболее определенно, от атопического дерматита. Указанный способ включает введение терапевтически эффективного количества соединения формулы (I) или его N-оксидной формы, фармацевтически приемлемой соли присоединения кислоты или основания, или стереохимически изомерной формы в смеси с фармацевтически приемлемым носителем.
Вообще, предполагается, что эффективное суточное количество может составлять от 0,01 мг/кг до 10 мг на кг массы тела. Очевидно, что указанное эффективное суточное количество можно уменьшить или увеличить в зависимости от реакции пациента и/или в зависимости от оценки врача, предписывающего соединения данного изобретения. Интервал для эффективного суточного количества, указанный выше, следовательно, представляет только руководство к действию и ни в коей мере не предназначен для ограничения объема применения изобретения.
Приведенные далее примеры предназначаются для иллюстрации, а не для ограничения объема настоящего изобретения.
Экспериментальная часть
У некоторых соединений формулы (I) абсолютная стереохимическая конфигурация не определялась. В этих случаях стереохимическая изомерная форма, которую выделили первой, обозначается "А", а вторая "В", без дополнительного упоминания о точной стереохимической конфигурации.
Далее в тексте "ТГФ" обозначает тетрагидрофуран, "КТ" обозначает комнатную температуру, "ДМФА" обозначает N,N-диметилформамид и "ДИПЭ" обозначает диизопропиловый эфир.
А. Получение промежуточных соединений
Пример А.1
а) Карбонат калия (0,0569 моль) в токе N2 добавляют по каплям к смеси 4-дифторметокси-3-гидроксибензальдегида (0,053 моль) и (тетрагидро-3-фуранол)-4-метилбензол-сульфоната (15,35 г) в ДМФА (100 мл). Реакционную смесь перемешивают в течение 4 часов при 100oС. Смесь охлаждают и добавляют по каплям раствор (тетрагидро-3-фуранол)-4-метилбензолсульфоната (3,98 г) в ДМФА (40 мл), реакционную смесь перемешивают в течение 3 часов при 100oС и затем в течение ночи при КТ. Растворитель выпаривают, а остаток промывают насыщенным водным раствором Na2СО3 и затем экстрагируют ДИПЭ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 17,77 г (±)-4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси]бензальдегида (промежуточное соединение 1).
в) Раствор борогидрида натрия (0,0177 моль) добавляют частями к раствору промежуточного соединения 1 (0,0532 моль) в метаноле (100 мл) и реакционную смесь перемешивают в течение 1 часа при КТ. Растворитель выпаривают, остаток промывают водой и экстрагируют СН2Сl2. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в открытой колонке на силикагеле (элюент: СН2Сl2 с 2-пропаноном, 96/4 и 90/10; СН2Сl2 с СН3ОН, 96/4). Чистые фракции собирают и выпаривают растворитель, получая 11,3 г (81%) (±)-4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси] бензолметанола (промежуточное соединение 2).
с) Раствор промежуточного соединения 2 (0,039 моль) в толуоле (45 мл) добавляют по каплям к смеси SОСl2 (0,059 моль) и ДМФА (0,0019 моль) в толуоле (75 мл) и перемешивают при 40oС. Полученную реакционную смесь перемешивают при 40oС до тех пор, пока не прекратится выделение газообразного НСl. Растворитель выпаривают, а остаток промывают насыщенным водным раствором NaНСО3 и экстрагируют СН2Сl2. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 10,59 г (96%) (±)-4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси] бензолметанола (промежуточное соединение 3).
d) Смесь KCN (0,076 моль) в Н2О (4 мл), нагретую до 80oС, добавляют по каплям к смеси промежуточного соединения 3 (0,038 моль) в ДМФА (82,4 моль), перемешиваемый при 60oС. Полученную реакционную смесь перемешивают в течение 30 минут при 60oС. Реакционную смесь охлаждают, промывают водой и экстрагируют ДИПЭ. Экстракт сушат, фильтруют и упаривают фильтрат, получают 8,23 г (80%) (±)-4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси]бензолацетонитрила (промежуточное соединение 4).
Аналогичным способом получают:
3-(циклопропилметокси)-4-метоксибензолацетонитрил (промежуточное соединение 5);
3-[1,3-дигидро-2H-инден-2-ил)окси]-4-метоксибензолацетонитрил (промежуточное соединение 6);
(±)-4-метокси-3-[(тетрагидро-3-фуранил)окси]бензолацетонитрил (промежуточное соединение 7);
4-метокси-3-[(5-фенилпентил)окси] бензолацетонитрил (промежуточное соединение 8);
4-(дифторметокси)-3-[(5-фенилпентил)окси] бензолацетонитрил (промежуточное соединение 23).
Пример А.2
а) Литиевую соль N-(1-метилэтил)-2-пропанамина (0,0325 моль; 1 М в ТГФ) добавляют по каплям в токе N2 к промежуточному соединению 4 (0,0309 моль) в ТГФ (70 мл) и охлаждают до -78oС. Смесь перемешивают в течение 30 минут при -78oС. Добавляют по каплям метаниодид (0,034 моль) и реакционную смесь перемешивают в течение 2 часов при КТ. Смесь гасят насыщенным водным раствором NH4Сl и экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в короткой открытой колонке на силикагеле (элюент: СН2Сl2), затем ВЭЖХ на силикагеле (элюент: гексан с этилацетатом, 3/2). Собирают чистые фракции и выпаривают растворитель, получая 4,64 г (53%) (±)-4-(дифторметокси)-альфа-метил-3-[(тетрагидро-3-фуранил)окси]бензолацетонитрила (промежуточное соединение 9).
в) Смесь промежуточного соединения 9 (0,0129 моль) в СН3ОН/NН3 (100 мл) гидрируют при КТ с никелем Ренея (3 г) в качестве катализатора. После поглощения водорода катализатор отфильтровывают, фильтрат упаривают и получают 3,66 г (98%) (±)-4-(дифторметокси)-β-метил-3-[(тетрагидро-3-фуранил)окси] бензолэтанамина (промежуточное соединение 10).
с) Смесь промежуточного соединения 10 (0,0158 моль) и дифенил-N-цианокарбонимидата (0,0158 моль) в этаноле (60 мл) перемешивают в течение ночи при КТ. Растворитель выпаривают и очищают остаток хроматографией в открытой колонке на силикагеле (элюент: гексан с этилацетатом 3/2 и СН2Сl2 с СН3ОН - 96/4, 90/10 и 85/5). Чистые фракции собирают и выпаривают растворитель, получая 5,11 г (74%) (±)-фенил-N-циано-N-[2-[4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси]-фенил]пропил]карбамимидата (промежуточное соединение 11).
d) Смесь 2,2-диметоксиэтанамина (0,0129 моль), N, N-диэтилэтанамина (0,023 моль) и N,N-диметил-4-пиридинамина (0,0059 моль) в 1,4-диоксане (30 мл) добавляют к раствору промежуточного соединения 11 (0,0117 моль) в 1,4-диоксане (10 мл) при перемешивании при КТ. Реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель испаряют, а остаток промывают водой и 1 N NаОН, затем экстрагируют СН2Сl2. Отделенный органический слой очищают хроматографией в открытой колонке на силикагеле (элюент: СН2Сl2 с СН3ОН, 96/4). Чистые фракции собирают и выпаривают растворитель, получая 4,97 г (95%) (±)-N''-циано-N-[2[4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси] фенил] -пропил]-N'-(2,2-диметоксиэтил)гуанидина (промежуточное соединение 12).
Подобным способом получают:
(±)-N"-циано-N-[2-[3-(циклопентилокси)-4-метоксифенил] -пропил] -N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 13);
(±)-N"-циано-N-[2-[3-(циклопентилокси)-4-(дифторметокси) фенил] пропил] -N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 14);
(±)-N"-циано-N-[2-[3-(циклопентилокси)-4-(дифторметокси) фенил] этил]-N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 15);
(±)-N"-циано-N-[2-[3-(циклопропилметокси)-4-(дифторметокси) фенил] пропил]-N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 16);
(±)-N"-циано-N-[2-[3-(1,3-дигидро-2H-инден-2-ил)окси] -4-метоксифенил] пропил]-N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 17);
(±)-N"-циано-N-[2-[3-(циклопропилметокси)-4-метоксифенил] пропил]-N'-(2, 2-диметоксиэтил) гуанидин (промежуточное соединение 18);
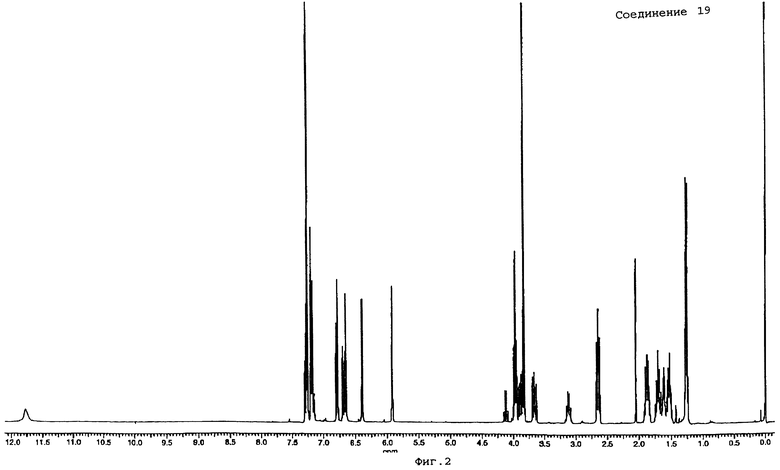
(±)-N"-циано-N-(2,2-диметоксиэтил)-N'-[2-[4-метокси-3-[(5-фенилпентил)окси]фенил]пропил]гуанидин (промежуточное соединение 19);
(±)-N"-циано-N-(2,2-диметоксиэтил)-N'-[2-[4-метокси-3-[(тетрагидро-3-фуранил)окси]фенил]пропил]гуанидин (промежуточное соединение 20);
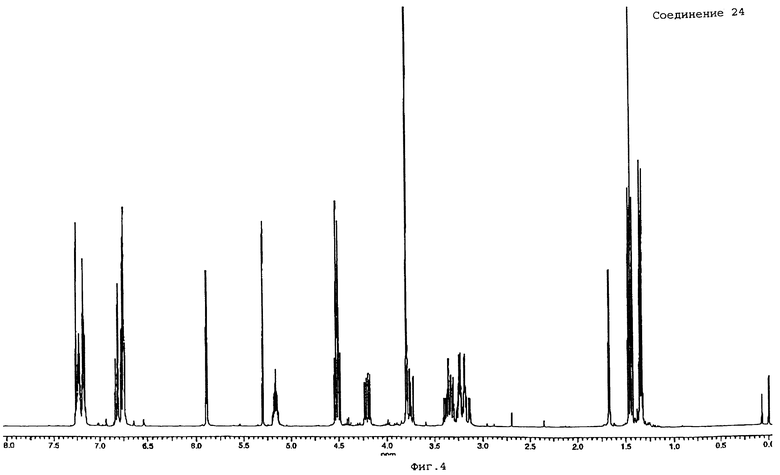
N"-циано-N'-(2,2-диметоксиэтил)-N-[2-[4-(дифторметокси)-3-[5-фенилпентил)окси]фенил]пропил]гуанидин (промежуточное соединение 24);
N"-циано-N'-[2-[3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метоксифенил]этил] -N-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 25);
(±)-N"-циано-N-[2-[3-[2-(2,3-дигидро-1H-инден-2-ил)-этокси] -4-метоксифенил]пропил]-N'-(2,2-диметоксиэтил) гуанидин (промежуточное соединение 27);
(±)-N"-циано-N-[2-[3-(2,3-дигидро-1H-инден-2-ил)окси] -4-метоксифенил]-2-[(тетрагидро-2H-пиран-2-ил)окси] этил] -N'-(2,2-диметоксиэтил)гуанидин (промежуточное соединение 28).
Пример А.3
а) Смесь (±)-3-(циклопентилокси)-4-метокси-β-метилбензолэтанамина (0,029 моль), хлорацетонитрила (0,0146 моль) и карбоната натрия (0,0219 моль) в ДМФА (200 мл) перемешивают в течение 5 часов при 60oС. Реакционную смесь фильтруют и фильтрат упаривают. Остаток промывают водой, затем экстрагируют 2-метокси-2-метилпропаном. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в открытой колонке на силикагеле (элюент: СН2Сl2; СН2Сl2 с 2-пропаноном, 96/4 и 90/10; затем СН2Сl2 с СН3ОН, 80/20). Чистые фракции собирают и выпаривают растворитель, получают 3,24 г (77%) (±)-[[2-[3-(циклопентилокси)-4-метоксифенил]пропил] амино]-ацетонитрила (промежуточное соединение 21).
в) Смесь промежуточного соединения 21 (0,0117 моль) в NН3/СН3ОН (60 мл) гидрируют при КТ с никелем Ренея (2 г) в качестве катализатора. После поглощения Н2 катализатор отфильтровывают и фильтрат упаривают. Остаток обрабатывают 10% водным раствором НСl и эту смесь экстрагируют этилацетатом. Слои разделяют. Водную фазу подщелачивают и затем экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получают 2,71 г (75%) (±)-N-[2-[3-(циклопентилокси)-4-метоксифенил]-пропил]-1,2-этандиамина (промежуточное соединение 22).
Пример А.4
а) Смесь 6,7-дигидро-5H-циклопента[b]пиридин-7-ола-(0,03544 моль), 3-гидрокси-4-метоксибензальдегида (0,0322 моль) и трифенилфосфина (0,0322 моль) в ТГФ (100 мл) перемешивают при 5oС в атмосфере N2. Добавляют по каплям бис(1-метилэтил)диазендикарбоксилат (0,0322 моль) и полученную реакционную смесь перемешивают в течение 12 часов при КТ. Растворитель выпаривают и к остатку добавляют СН2Сl2. Смесь промывают водой, сушат, фильтруют и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (элюент: СН2Сl2 с СН3ОН от 100/0 до 98,5/1,5). Собирают нужные фракции и выпаривают растворитель. Остаток растворяют в 2-пропаноле и превращают в соль хлористоводородной кислоты (1:1) с помощью НСl в 2-пропаноле. Выпаривают растворитель. Остаток перемешивают в ДИПЭ, отфильтровывают и сушат, получая 8,2 г (83%) гидрохлорида 3-[(5,6-дигидро-7H-пиридин-7-ил)окси]-4-метоксибензальдегида (промежуточное соединение 34).
б) Раствор триметилсиланкарбонитрила (0,1472 моль) в СН2Сl2 (60 мл) добавляют по каплям к смеси 3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метоксибензальдегида (0,1227 моль) и иодида цинка (0,0061 моль) в СН2Сl2 (240 мл). Полученную реакционную смесь перемешивают в течение одного часа при КТ. Сырую реакционную смесь промывают водой и рассолом, затем экстрагируют СН2Сl2. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток кристаллизуют из ДИПЭ. Осадок отфильтровывают и сушат, получая 37,39 г (83%) (±)-3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метокси-α-[(триметилсилил)окси]бензолацетонитрила (промежуточное соединение 29).
в) Промежуточное соединение 29 (0,1116 моль) растворяют в метаноле и добавляют НСl (3 N, 25 мл). Смесь перемешивают в течение 5 минут. Выпаривают большую часть растворителя и добавляют СН2Сl2. Органический слой отделяют, промывают насыщенным водным раствором NаНСО3, сушат, фильтруют и выпаривают растворитель. Остаток растворяют в СН2СI2 (350 мл). Добавляют 3,4-дигидро-2H-пиран (0,2231 моль) и 4-метилбензолсульфоновую кислоту (каталитическое количество), полученную в результате реакционную смесь перемешивают в течение ночи при КТ. Смесь промывают насыщенным водным раствором NаНСО3, сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в короткой открытой колонке на силикагеле (элюент: гексан с этилацетатом, 9/1, затем 8/2). Собирают нужные фракции, выпаривают растворитель и получают 28,01 г (66%) (±)-3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метокси-α-[(тетрагидро-2H-пиран-2-ил)окси]бензолацетонитрила (промежуточное соединение 30).
Пример А.5
а) Раствор бис(1,1-диметилэтил)дикарбоната (1,268 моль) в СН2Сl2 (1800 мл) добавляют по каплям к раствору (±)-3-[(2,3-дигидро-1H-инден-2-ил)окси] -4-метокси-β-метилбензолэтанамина (1, 208 моль) в СН2Сl2 (1800 мл). Смесь перемешивают при КТ в течение 2 часов. Растворитель выпаривают. Остаток перемешивают в гексане, отфильтровывают и сушат, получают 420 г (±)-1,1-диметилэтил [2-[3-[(2,3-дигидро-2H-инден-2-ил)окси] -4-метоксифенил] пропил] -карбамата (промежуточное соединение 31).
в) Промежуточное соединение 31 (1,056 моль) очищают и выделяют хроматографией в хиральной колонке на Сhiralpack АD (элюент: гексан с С2Н5OН и СН3ОН, 90/10/10). Собирают группу нужных фракций и выпаривают растворитель, получая 268 г 1,1-диметилэтил-В-[2-[3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метоксифенил)пропил]карбамата (промежуточное соединение 32).
с) Смесь из промежуточного соединения 32 (0,67 моль) в НСl (670 мл; 6 N) и метанола (2700 мл) перемешивают и кипятят с обратным холодильником в течение 90 минут. Растворитель выпаривают. Остаток растворяют в СН2Сl2. Органический раствор промывают Н2О (1000 мл) и насыщенным раствором NаНСО3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель, получая 158 г (99%) (В)-3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метокси-β-метилбензолэтанамина (промежуточное соединение 33).
Затем промежуточное соединение 33 вводят во взаимодействие по методике, описанной в примере А.2,b - А. 2, d, с образованием (В)-N"-циано-N-[2-[3-[(2,3-дигидро-1H-инден-2-ил)окси] -4-метоксифенил] пропил] -N'-(2,2-диметоксиэтил)гуанидина (промежуточное соединение 26).
В. Получение соединений формулы (I)
Пример В.1
Смесь промежуточного соединения 22 (0,0068 моль) и диметилцианокарбонимидодитиоата (0,0068 моль) в этаноле (20 мл) перемешивают и кипятят с обратным холодильником в течение 2 суток. Выпаривают растворитель, а остаток очищают сначала хроматографией в короткой открытой колонке на силикагеле (элюент: СН2Сl2, СН2Сl2 с СН3ОН, 96/4 и 90/10), а затем дважды ВЭЖХ (1 элюент - СН2Сl2 с СН3ОН, 90/10 и 2 элюент - СН2Сl2 с СН3ОН, 96/4). Чистые фракции собирают и выпаривают растворитель, получая 0,3 г (13%) (±)-[1-[2-[3-(циклопентилокси)-4-метоксифенил] пропил] -2-имидазолидинилиден] цианамида (соединение 1).
Пример В.2
К раствору промежуточного соединения 12 (0,0108 моль) в 1,4-диоксане (20 мл) при перемешивании и охлаждении на ледяной бане добавляют по каплям 0,5 N НС1 (0,0162 моль). Реакционную смесь перемешивают в течение 2 суток при КТ. (Другой вариант - 1,4-диоксан можно заменить ТГФ и реакционную смесь вместо перемешивания в течение 2 суток при КТ можно кипятить с обратным холодильником в течение 1 часа.) Реакционную смесь обрабатывают водой, подщелачивают разбавленным раствором NаОН, затем экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в открытой колонке на силикагеле (элюент: СН2Сl2 с 2-пропаноном, 96/4; СН2Сl2 с СН3ОН, 96/4) и дважды ВЭЖХ на силикагеле (1 элюент СН2Сl2 с СН3ОН, 96/4 и 2 элюент СН2Сl2 с СН3ОН, 97/3). Чистые фракции собирают и выпаривают растворитель, получая 0,64 г (15%) (±)-[1-[2-[4-(дифторметокси)-3-[(тетрагидро-3-фуранил)окси] -фенил] пропил]-1,3-дигидро-2H-имидазол-2-илиден]цианамида (соединение 2; т.пл. 67,8oС).
Пример В.3
а) Соединение 7 (0,00644 моль) разделяют на энантиомеры хроматогорафией в хиральной колонке Сhiralpack АD (20 мкм, 250 г, 5 см, скорость потока: 60 мл/мин; элюент: гексан/этанол/метанол, 80/15/5). Собирают две группы нужных фракций. Выпаривают растворитель из первой (А) группы фракций. Остаток перемешивают в ДИПЭ, отфильтровывают, промывают ДИПЭ и сушат. Затем остаток очищают колоночной хроматографией на силикагеле Кrоmаsil (200 г, 5 мкм; элюент: СН2Сl2 с СН3ОН, 100/0, через 30 минут - 90/10).
Чистые фракции собирают и выпаривают растворитель. Остаток перемешивают в ДИПЭ, отфильтровывают, промывают ДИПЭ, затем сушат, получая 0,39 г (50%) (+)-(А)-[1-[2-[3-[2,3-дигидро-1H-инден-2-ил)окси] -4-метоксифенил] пропил]-1H-имидазол-2-ил]цианамида;
[α]
Выпаривают растворитель у второй (В) группы фракций. Остаток перемешивают в ДИПЭ, отфильтровывают, промывают ДИПЭ и затем сушат. Остаток очищают колоночной хроматографией на силикагеле Kromasil (200 г, 5 мкм; элюент: СН2Сl2 с СН3ОН, 100/0, через 30 минут - 90/10). Чистые фракции собирают и выпаривают растворитель. Остаток перемешивают в ДИПЭ, отфильтровывают, промывают ДИПЭ, затем сушат, получая 0,5 г (90%) (-)-(В)-[1-[2-[3-[(2,3-дигидро-1H-инден-2-ил)окси] -4-метоксифенил] пропил] -1H-имидазол-2-ил]-цианамида; [α]
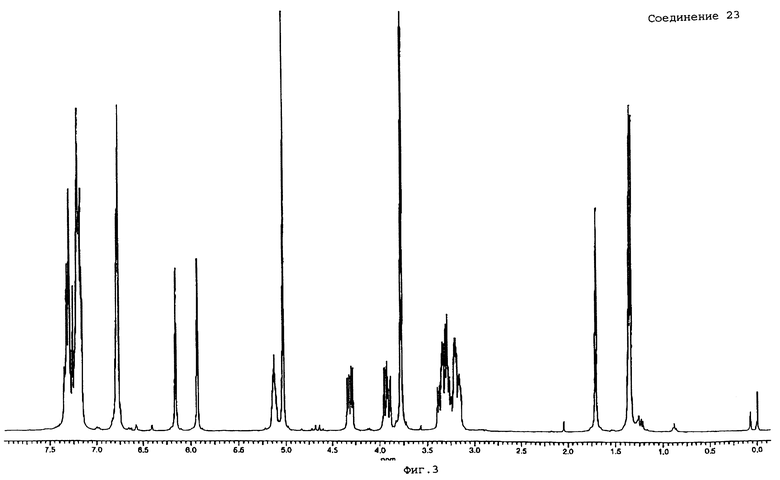
в) Смесь соединения 17 (0,0026 моль) с ДМФА (40 мл) перемешивают при 0oС. Добавляют гидрид натрия (0,0028 моль; 60%) и смесь перемешивают в течение 30 минут при 0oС и в течение 30 минут при КТ. Добавляют по каплям раствор бромметилбензола (0,0028 моль) в ДМФА (10 мл) и полученную реакционную смесь перемешивают в течение 3 часов при КТ. Выпаривают растворитель, добавляют толуол и проводят азеотропную отгонку на роторном испарителе. Остаток растворяют в СН2Сl2. Добавляют воду. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией в короткой колонке на силикагеле (элюент СН2Сl2 с СН3ОН, 98/2). Собирают нужные фракции, выпаривают растворитель, получая 0,7 г (63%) (В)-[1-[2-[3-[2,3-дигидро-1H-инден-2-ил)окси] -4-метоксифенил] пропил]-3-фенилметил-1Н-имидазол-2-ил] цианамида (соединение 23).
Пример В.4
К раствору промежуточного соединения 28 (0,0179 моль) в 1,4-ТГФ (250 мл) при перемешивании и охлаждении на ледяной бане добавляют по каплям НС1 (0,0268 моль; 0,5 N). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 1,5 часов, а затем охлаждают на ледяной бане. Смесь обрабатывают водой и этилацетатом, подщелачивают твердым Na2СО3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке на силикагеле (элюент: СН2Сl2 с СН3ОН, 97/3, затем 95/5). Собирают группу чистых нужных фракций. Выпаривают растворитель, а остаток кристаллизуют из СН3СN, отфильтровывают и сушат, получая (35%) (±)-[1-[2-[3-[(2,3-дигидро-1H-инден-2-ил)окси]-4-метоксифенил]-2-гидроксиэтил]-1,3-дигидро-2H-имидазол-2-илиден]цианамида (соединение 21).
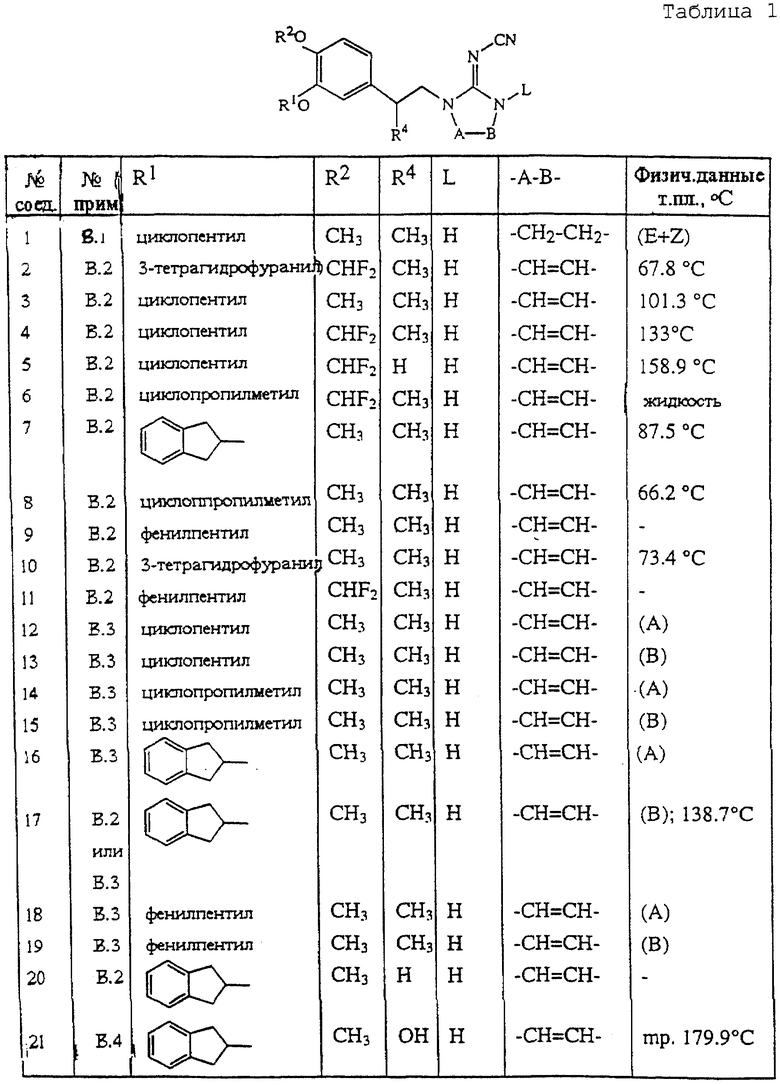
В табл. 1 приведен перечень соединений формулы (I), которые получают по одному из приведенных выше примеров.
В. Фармакологические примеры
Пример С. 1: Ингибирование рекомбинантной человеческой моноядерной лимфоцитарной (МNL) фосфодиэстеразы типа IV В, продуцируемой в клетках насекомых с бакуловирусным вектором
Облегчающее и/или лечебное действие определенных соединений при аллергических и атопических заболеваниях оценивают с помощью системы тестов in vitro для определения ингибирующего действия на рекомбинантную человеческую МNL-фосфодиэстеразу типа IV В.
Через 72 часа после заражения рекомбинантным бакуловирусом клетки насекомых собирают и осаждают при 500 g в течение 5 минут. Клетки лизируют в 10 мл буфера для лизиса, содержащего 20 мМ трис, 10 мМ ЕGТА, 2 мМ Na2ЭДТК, 1% тритона-Х-100, 1 мМ Nа3VO4, 10 мМ NаF, 2 мкг/мл лейпептина, пепстатина и апротинина, 0,3 мкг/мл бензамидина и 100 мкг/мл ТФХК, рН 7,5. После 5-минутной выдержки на льду растворенные клетки центрифугируют при 4000 об/мин в течение 15 минут при 4oС. Полученный супернатант фильтруют через 0,45-мкм фильтр (Мillipore) и вносят в ТВS-буфер (50 мМ трис, 150 мМ NаСl, рН 7,4).
Супернатант, содержащий фосфодиэстеразу типа IV В, загружают затем в 5-мл колонку с гелем, обладающим анти-FLАG-М2 сродством, предварительно активированную 5 мл 100-мМ глицина, рН 3,5 и уравновешенную 20 мл 50 мМ трис, 150 мМ NаСl, рН 7,4. После промывания колонки уравновешивающим буфером элюируют РDЕ IV во фракциях по 1,5 мл, содержащих 37,5 мкл 1 М трис, рН 8. Фракции диализуют в течение ночи против 20 мМ трис, 2 мМ Na2ЭДТК и 400 мМ NаСl, рН 7,5 и испытывают на активность РDЕ IV. Определение осуществляют на основе SDS РАGЕ и Вестерн-блоттинга (анти FLАG-М2). Активные фракции объединяют, помещают в 10% глицерин и хранят при -70oС.
Смесь для инкубации (рН 8) (200 мкл) содержит 20 мМ трис, 10 мМ сульфата магния, 0,8 мкМ 3Н-цАМФ (310 мКЮ/ммоль) и фосфодиэстеразу типа IV в количестве, зависящем от ферментативной активности. Выбирают концентрацию белка, которая показывает линейное возрастание фосфодиэстеразной активности в течение периода инкубации максимум 10 минут при 37oС и когда гидролизуется менее 10% исходного субстрата.
При испытании действия различных соединений на фосфодиэстеразную активность среду без цАМФ инкубируют с соединением (соединениями) или его носителем (ДМСО, конечная концентрация 1%) в течение 5 минут. Ферментативную реакцию инициируют добавлением 3Н-цАМФ и останавливают через 10 минут, перенося титрационный микропланшет на водяную баню при 100oС на 5 минут. После охлаждения до комнатной температуры добавляют щелочную фосфатазу (0,25 мкг/мл), и смесь инкубируют при 37oС в течение 20 мин. Затем 100 мкл смеси помещают в титрационный микропланшет с фильтром GF-В (Мillipore), наполненный 300 мкл суспензии DЕАЕ-сефадекса-А25. Планшет промывают 3 раза 75 мкл 20 мМ трис, рН 7,5, и собирают фильтраты для подсчета в сцинтилляционном счетчике Расkаrd Тор Соunt.
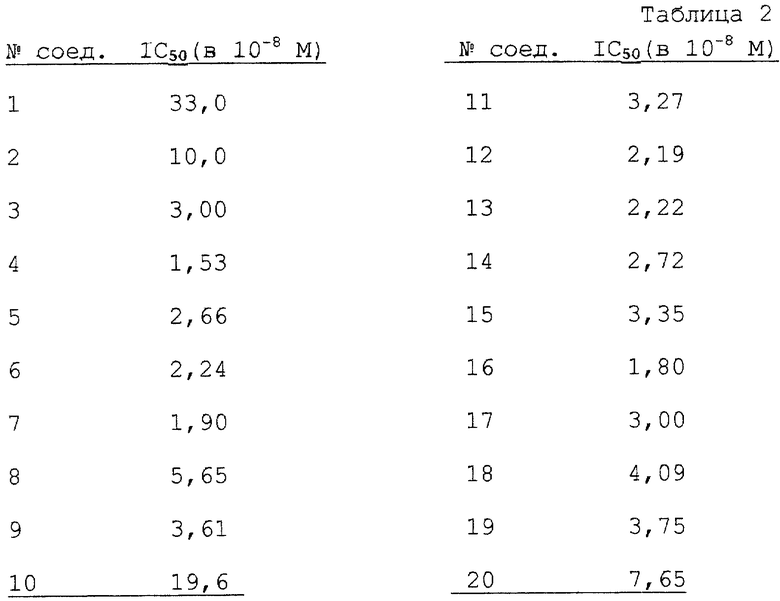
Ингибирующее действие соединений настоящего изобретения на рекомбинантную человеческую МNL-фосфодиэстеразу РDЕ IV В определяют при различных концентрациях конкретных соединений. Величины IC50 (выраженные в М) вычислены графически из полученных таким образом показателей ингибирования и представлены в табл. 2.
D. Примеры композиций
Приведенные ниже препаративные формы являются примерами типичных фармацевтических композиций, подходящих для системного или местного введения животному и человеку в соответствии с настоящим изобретением.
Обозначение "Активный ингредиент" (а. и.), используемое в этих примерах, относится к соединению формулы (I) или его фармацевтически приемлемой соли присоединения.
Пример D.1. Таблетки с пленочным покрытием
Получение сердцевины таблеток
Смесь 100 г а.и., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона примерно в 200 мл воды. Влажную порошкообразную смесь просеивают, сушат и снова просеивают. Затем добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все хорошо перемешивают, прессуют в таблетки и получают 10000 таблеток, причем каждая содержит по 10 мг активного ингредиента.
Покрытие
К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому, затем к этому добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя, и все гомогенизируют. Сердцевины таблеток покрывают полученной таким образом смесью на установке для нанесения покрытия.
Пример D.2. 2%-ный крем для местного применения
К раствору 200 мг гидроксипропил-β-циклодекстрина в очищенной воде добавляют при перемешивании 20 мг а.и. Добавляют соляную кислоту до полного растворения, а затем добавляют гидроксид натрия до рН 6,0. Добавляют при перемешивании 50 мг глицерина и 35 мг полисорбата 60, смесь нагревают до 70oС, Полученную смесь при медленном перемешивании добавляют к смеси 100 мг минерального масла, 20 мг стеарилового спирта, 20 мг цетилового спирта, 20 мг моностеарата глицерина и 15 мг сорбата 60, имеющей температуру 70oС. После охлаждения до температуры ниже 25oС добавляют остальную очищенную воду, q.s. ad 1 г, и смесь перемешивают до однородного состояния.
Изобретение относится к новым производным 2-цианоиминоимидазола общей формулы (I), где R1 и R2 представляют водород, С1-С6-алкил, дифторметил, трифторметил, С3-С6-циклоалкил, насыщенный 5-членный гетероцикл, содержащий один атом кислорода, инданил, 6,7-дигидро-5Н-циклопентапиридинил, или С1-С6-алкил, замещенный фенилом, инданилом или С3-С6-циклоалкилом, R3 представляет водород, R4 представляет водород, галоген, С1-С6-алкил, трифторметил или R4 представляет радикал формулы -O-R7, где R7 представляет водород, R5 представляет водород или R4 и R5, взятые вместе, могут образовывать двухвалентный радикал формулы -СН2-СН2-О-СН2-СН2-, R6 представляет водород или С1-С6-алкил, -А-В- представляет двухвалентный радикал формулы -СR10= СR11- или СНR10-СНR11, где каждый R10 и R11 независимо представляет водород или С1-С6-алкил, L представляет водород, С1-С6-алкил, С1-С6-алкилоксикарбонил, С1-С6-алкил, замещенный одним или двумя фенилами. Также раскрыты способы получения указанных соединений, фармацевтическая композиция на их основе, обладающая ингибирующим действием в отношении фосфодиэстеразы IV, и способ получения композиции. Изобретение может быть использовано в медицине для лечения аллергических, атопических и воспалительных заболеваний. 6 c. и 6 з.п. ф-лы, 4 ил., 3 табл.
их N-оксидная форма, их фармацевтически приемлемые соли присоединения кислоты или основания или их стереохимически изомерная форма,
где R1 и R2 каждый независимо представляет водород, С1 - С6алкил, дифторметил, трифторметил, С3 - С6циклоалкил, насыщенный 5-членный гетероцикл, содержащий один атом кислорода, инданил, 6,7-дигидро-5Н-циклопентапиридинил, или С1 - С6алкил, замещенный фенилом, инданилом или С3 - С7циклоалкилом;
R3 представляет водород;
R4 представляет водород, галоген, С1 - С6алкил, трифторметил или R4 представляет радикал формулы -О-R7 (а-1), где R7представляет водород;
R5 представляет водород или R4 и R5, взятые вместе, могут образовывать двухвалентный радикал формулы -СН2-СН2-O-СН2-СН2- (b-2);
R6 представляет водород или С1 - С4алкил;
-А-В представляет двухвалентный радикал формулы -СR10= СR11- (с-1) или -СНR10-СНR11- (с-2), где каждый R10 и R11 независимо представляет водород или С1 - С4алкил;
L представляет водород, С1 - С6алкил, С1 - С6алкилоксикарбонил; С1 - С6алкил, замещенный одним или двумя фенилами.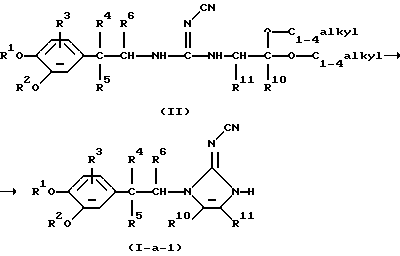
или его функционального производного,
в котором R1-R6, R10 и R11 имеют значения, указанные в п. 1,
в инертном для реакции растворителе и в присутствии подходящей кислоты с получением соединения формулы I-а-1; и, если желательно, превращение соединений формулы I одно в другое известными способами превращения и затем, если желательно, превращение соединения формулы I в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, напротив, превращение соли присоединения кислоты в свободное основание обработкой щелочью, или превращение соли присоединения основания в свободную кислоту обработкой кислотой; и, если желательно, получение их стереохимически изомерных форм или N-оксидных форм.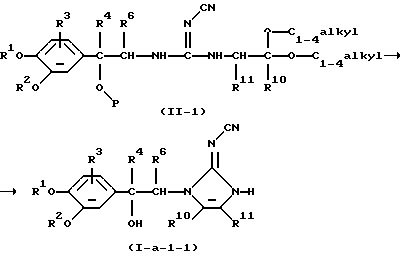
где R1-R4, R6, R10 и R11 имеют значения, определенные в п. 1;
Р представляет водород или триметилсилильную защитную группу,
или его функционального производного,
в инертном для реакции растворителе и в присутствии подходящей кислоты с получением соединения формулы I-а-1-1 и, если желательно, превращение соединений формулы I одно в другое известными способами превращения и затем, если желательно, превращение соединения формулы I в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, напротив, превращение соли присоединения кислоты в свободное основание обработкой щелочью, или превращение соли присоединения основания в свободную кислоту обработкой кислотой и, если желательно, получение их стереохимически изомерных форм или N-оксидных форм.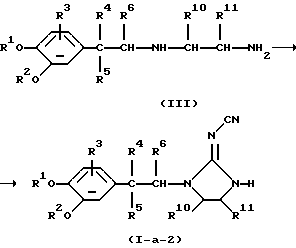
или его функционального производного,
в котором R1-R6, R10 и R11 имеют значения, указанные в п. 1,
в инертном для реакции растворителе и в присутствии диметилцианокарбонимидодитиоата или дифенил-N-цианокарбонимидата с получением соединения формулы I-а-2, и, если желательно, превращение соединений формулы I одно в другое известными способами превращения и затем, если желательно, превращение соединения формулы I в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, напротив, превращение соли присоединения кислоты в свободное основание обработкой щелочью, или превращение соли присоединения основания в свободную кислоту обработкой кислотой и, если желательно, получение их стереохимически изомерных форм или N-оксидных форм.
| Способ получения производных 2-ариламино-2-имидазолина или их солей | 1975 |
|
SU548207A3 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2002-03-27—Публикация
1997-09-24—Подача