Изобретение касается процесса катализируемого пентафторидом сурьмы присоединения фторуглеводородов по двойной связи углерод-углерод фторолефинов.
ПРЕДПОСЫЛКИ
Описаны процессы присоединения 1,1,1-трифторэтана к фторированным олефинам, катализируемые пентафторидом сурьмы (смотри G.G. Belen'kii and L.S. German, Soviet Scientific Reviews, Sect. В., pp. 195-6, M.E. Volpin ed. (Harwood Academic Publishers, 1984). Также описаны процессы присоединения трифторметанов, в том числе СНF3, к определенным фторированным олефинам в присутствии катализатора хлоридфторида алюминия (смотри Заявка на Патент США No. 06/000,720 и Международная Заявка No. PCT/US96/10872). Фторсодержащие углеводороды могут быть получены обоими способами.
Фторсодержащие углеводороды используются в качестве хладагентов, средств пожаротушения, теплоносителей, пропеллентов, пенообразователей, газообразных диэлектриков, носителей стерилизующих веществ, сред для полимеризации, средств для химической чистки, переносчиков жидкости, полирующих абразивных средств, осушителей и рабочих сред энергетических циклов. Существует заинтересованность в развитии более эффективных процессов производства фторсодержащих углеводородов.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Процесс предусматривает образование аддуктов формулы RR1R2CCR1R2F или (FR1R2CCRR2CH2)2, где R выбирается из группы, состоящей из СН3, CH2F, C2H4F и F(СF3)nСН2СН2, где n - целое число от 1 до 10, каждый из R1 независимо выбирается из группы, состоящей из Н, Cl, F и СF3, и каждый из R2 выбирается из группы, состоящей из Н, F и СF3. Процесс включает взаимодействие насыщенного соединения формулы RF с олефином формулы R1R2C=CR1R2 в жидкой среде в присутствии катализатора пентафторида сурьмы при условии, что, если образуется (FR1R2CCR1R2CH2)2, насыщенным соединением является СН3СНF2 или CH2FCH2F и присутствует безводный HF.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Это изобретение обеспечивает процесс присоединения в жидкой среде (а) насыщенных соединений формулы RF, где R выбирают из группы, состоящей из СН3, CH2F, C2H4F и F(CF2)nCH2CH2, где n является целым числом от 1 до 10, к (б) олефинам формулы R1R2C=CR1R2, где каждый из R1 независимо выбирается из группы, состоящей из Н, C1, F и СF3, и каждый из R2 независимо выбирается из группы, состоящей из Н, F и СF3, с образованием аддуктов формулы RR1R2CCR1R2F или (FR1R2CCR1R2CH2)2 в присутствии катализатора пентафторида сурьмы (в том случае, если образуется (FR1R2CCR1R2CH2)2, насыщенным соединением является СН3СНF2 или CH2FCH2F и присутствует безводный HF).
Примеры олефинов формулы R1R2C=CR1R2, которые могут быть использованы в процессе, описываемом данным изобретением, включают CF2=CF2, CF3CF=CF2, CClF=CF2, CClF=CClF, CHF=CF2, CH2=CF2, СF3СН=СF2, CHF=CFCF3 и СН2=С(СF3)СF3. Некоторые из этих олефинов продаются, другие могут быть получены известными способами.
Примеры насыщенных соединений формулы RF, которые могут быть использованы в процессе, описываемом данным изобретением, включают СН3F, CH2F2 и СН3СНF2.
В процессе настоящего изобретения могут быть использованы растворители или разбавители. Растворитель или разбавитель выбирают таким образом, чтобы он не вступал в реакцию или не дезактивировал катализатор пентафторид сурьмы. Соответствующие растворители или разбавители могут быть выбраны из группы, состоящей из перфторалканов или перфторэфиров (например, перфторциклобутан); циклического димера гексафторпропена (т.е. изомеры перфтордиметилциклобутана); перфторэфиров или перфтортретичных аминов. Предпочтительным с точки зрения его легкой доступности специалистам является циклический димер гексафторпропена.
В одном воплощении изобретения образуется взаимно однозначный аддукт насыщенного соединения и олефина. При этом следует отметить, что насыщенные соединения формулы F(CF2)nCH2CH2F могут быть сами получены как взаимно однозначные аддукты. Например, реакцию присоединения CH2FCH2F к CF2=CF2 можно использовать для получения F(CF2)2CH2CH2F.
Во втором воплощении этого изобретения присоединение фторсодержащих углеводородов СН3СНF2 и/или FCH2CH2F к олефинам формулы R1R2C=CR1R2 в присутствии пентафторида сурьмы может быть проведено в присутствии безводного HF. Молярное соотношение HF:SbF5 составляет от 10:1 до 40:1, предпочтительно 20: 1. Продуктом реакции присоединения или аддуктом является (FR1R2ССR1R2CH2)2. Не желая быть связанными теорией, полагают, что при использования СН3СНF2 перед взаимодействием с олефином он изомеризуется в FCH2CH2F.
Если продукт реакции присоединения (аддукт) содержит хлор, то хлор может быть удален либо взаимодействием с HF в присутствии катализатора фторирования (например, Сr2O3), либо взаимодействием с водородом в присутствии катализатора гидрирования (например, палладия на углероде). Аддукт, таким образом, превращают из хлорфторсодержащего углеводорода во фторсодержащий углеводород.
Температура, используемая в процессе настоящего изобретения, обычно варьирует от примерно -10oС до примерно 100oС. Предпочтительна температура от примерно 0oС до 80oС.
Время реакции не является критическим и обычно варьирует от примерно 5 с до примерно 24 ч. Обычно достаточно примерно от 1 до 16 ч.
Давление, используемое в данной реакции, не является критическим. Реакцию обычно проводят при давлении в интервале от 0 до 300 psig (101 кПа - 2169 кПа). Обычно используют аутогенные давления; однако в случае использования тетрафторэтилена из соображений безопасности давление не должно возрастать выше 300 psig.
При гетерогенных условиях для протекания реакции часто требуется некоторая степень перемешивания.
Поскольку катализатор чувствителен к действию воды, реактивы и оборудование перед использованием должны быть высушены.
Соотношение катализатора и олефина обычно варьирует от примерно 0,01:1 до примерно 0,5:1; предпочтителен интервал от 0,1:1 до примерно 0,5:1.
Соотношение насыщенного соединения и олефина составляет предпочтительно, по меньшей мере, 1:1, если образуется RR1R2CCR1R2F, и предпочтительно, по меньшей мере, 2:1, если образуется (FR1R2CCR1R2CH2)2. Известными являются воплощения, которые используют насыщенные соединения как растворители, так что они присутствуют в существенном избытке.
Реакцию можно проводить периодическим (порционным), полупериодическим (полупорционным), полунепрерывным и непрерывным способами в одном или более реакционных сосудах. В лабораторных условиях реакцию можно проводить в трубке для вибровстряхивателя, в которую перед запаиванием реакционного сосуда и началом реакции помещают все реагенты. Кроме того, реакцию можно проводить в автоклавах, оборудованных встряхивателем. Продукты могут быть выделены стандартными химико-технологическими методами, например фракционной перегонкой.
Без дальнейшего уточнения полагают, что специалисты в данной области смогут, используя приведенное здесь описание, применять настоящее изобретение в наиболее полном объеме. Следующие характерные воплощения должны быть, следовательно, истолкованы как исключительно иллюстративные и не связывающие остальную часть открытия вообще каким-либо образом.
ПРИМЕРЫ
Пример 1
CH2F2+CF2=CF2-->CH2FCF2CF3
В 250 мл стальной автоклав загружали дифторметан (39,0 г, 0,75 моль), пентафторид сурьмы (45 г, 0,2 моль) и тетрафторэтилен (30,0 г, 0,3 моль). Реакционную смесь перемешивали 8 ч при 50oС, добавляли тетрафторэтилен (30,0 г, 0,3 моль) и перемешивали еще 8 ч при 50oС. Газообразные продукты реакции конденсировали в ловушке, затем перегоняли для получения CH2FCF2CF3 (75 г, 80% выход), т.к. 0-1oС.
19F ЯМР (δ, ppm, относительно СF3СO2Н) CH2FCCF2 BCF3 A:А 8,5, В 51,5, С 167,6, JF A-C 9 Гц, JF B -H 12 Гц, JF C -H 45 Гц. 1Н ЯМР (δ, ppm, относительно TMS): 5,26 (СН2).
Сравнительный пример А
CH2F2+CF2=CF2 --> реакция не идет
В 400 мл трубку для встряхивания из никелевого сплава HastelloyTM добавляли дифторметан (26 г), хлоридфторид алюминия (AlClxFy, где х+у=3,5 г) и тетрафторэтилен (30 г). Хлоридфторид алюминия получали взаимодействием АlСl3 с CCl3F согласно методу, описанному в Патенте США No. 5162594, столбец 4, строки 35-57. Реакционную смесь перемешивали 12 ч при 25oС. Никакого взаимодействия отмечено не было.
Пример 2
СH2F2+СF2=СFСF3 --> CH2FCF(CF3)2
В стальной автоклав на 250 мл вносили дифторметан (39,0 г, 0,75 моль), пентафторид сурьмы (45 г, 0,2 моль) и перфторпропилен (66 г, 0,44 моль). Реакционную смесь перемешивали 20 ч при 80oС. Продукты реакции конденсировали в ловушке, затем перегоняли для получения CH2FCF(CF3)2 (80 г, 90% выход), т.к. 22-24oС.
19F ЯМР (δ) CH2FCCFB(CF3 A)2: FA 0,5, FB 114, FC 167,5, JF A -F B 7 Гц, JF A -F C 9,5 Гц, JF C -F B 12,5 Гц, JF A -H 11 Гц. 1Н ЯМР (δ): 5,25 (CH2), JF C -H 45 Гц, JF B -H 16 Гц.
Масс-спектр (m/z, распределение, %): 201 (М-Н)+ 0,03, 183 (М-F)+ 2,04, 163 (C4HF6)+ 1,4, 150 (С3F6)+ 34,4, 133 (C3H2F5)+ 3,4, 131 (C3F5)+ 6,3, 119 (C2F5)+ 4,4, 114 (C3H2F4)+ 229, 113 (C3HF4)+ 27,3, 100 (C2F4)+ 22,6, 69 (CF3)+ 100.
Пример 3
СН3F+CF2=CF2 --> СН3СF2СF3
В 400 мл трубку для встряхивания из никелевого сплава HastelloyTM вносили фторметан (35,0 г), пентафторид сурьмы (15 г) и тетрафторэтилен (50 г). Реакционную смесь перемешивали 6 ч при 25oС, после чего перемешивали 10 ч при 50oС. Продукты реакции конденсировали в ловушке, охлаждаемой сухим льдом, затем перегоняли, получая CH3CF2CF3 с выходом 99% (HFC-245cb, 45 г), т.к. (-13) - (-12)oС. Выход HFC-245cb составил 67%.
Сравнительный пример Б
СНF3+CF2=CF2 --> ПТФЭ
В 400 мл трубку для встряхивания из никелевого сплава HastelloyTM добавляли трифторметан (21 г), пентафторид сурьмы (7 г) и тетрафторэтилен (30 г). Реакционную смесь перемешивали 12 ч при 25oС. Единственным выделенным продуктом реакции являлся политетрафторэтилен (ПТФЭ, 15 г).
ПРИМЕР 4
CH3F+CF2CFCF3 --> (CF3)2CHF+(СР3)2СFСН3+(СF3)2СFС(СН3)3+(СF3)2СFC2Н5
В 400 мл трубку для встряхивания из никелевого сплава Hastelloyтм добавляли фторметан (20 г), пентафторид сурьмы (15 г) и гексафторпропилен (75 г). Реакционную смесь перемешивали 14 ч при 50oС. Продукты реакции конденсировали в ловушке, охлаждаемой сухим льдом, затем перегоняли, получая смесь (68 г), содержащую согласно 1Н и 19F ЯМР 66% (СF3)2СНF, 11% (СF3)2СFСН3, 5% (СF3)2СFС2Н5, 9% (СF3)2СFС(СН3)3. Выход (СF3)2СFСН3 составлял 4%. ПРИМЕР 5
СН3F+CClF=CF2 --> СlСF2СF2CH3+СF3СF2СН3+СF3ССlFСН3
В 400 мл трубку для встряхивания из никелевого сплава HastelloyTM добавляли фторметан (17 г), пентафторид сурьмы (15 г) и хлортрифторэтилен (59 г). Реакционную смесь перемешивали 12 ч при 50oС. Продукты реакции конденсировали в ловушке, охлаждаемой сухим льдом, затем перегоняли, получая смесь (12 г), содержащую, согласно 1Н и 19F ЯМР, 87,5% СlСF2СF2СН3, 6,5% CF3CF2CH3, 4% СF3СFСlСН3 и 1% неидентифицированного продукта. Выход хлорфторпропанов составлял 17,4%.
ПРИМЕР 6
СН3F+CHF=CF2 --> СН3СНFСF3+CH2FCF3.
В 400 мл трубку для встряхивания из никелевого сплава Hastelloyтм добавляли фторметан (10 г), пентафторид сурьмы (10 г) и трифторэтилен (24 г). Реакционную смесь перемешивали 14 ч при 25oС. Продукты реакции конденсировали в ловушке, охлаждаемой сухим льдом, затем перегоняли, получая смесь (12 г, т. к. 0-2oС), содержащую согласно 1Н и 19F ЯМР 90% СН3СНFСF3 и 10% CH2FCF3. Выход СН3СНFСF3 составлял 38,6%.
ПРИМЕР 7
CH2F2+CClF=CClF --> CH2ClCF2CF2Cl
В 250 мл стальной автоклав вносили дифторметан (18 л, 0,7 моль), пентафторид сурьмы (22 г, 0,1 моль) и 1,2-дихлордифторэтилен (26,6 г, 0,2 моль). Реакционную смесь перемешивали 8 ч при комнатной температуре, затем нагревали автоклав на кипящей водяной бане. Продукты реакции конденсировали в ловушке, охлажденной до -78oС. Избыток дифторметана отделяли перегонкой. Остаток промывали водой, высушивали и перегоняли, получая CH2ClCF2CF2Cl с выходом 32% (12 г, т.к. 62-64oС).
19F ЯМР(δ) CH2ClCF2 BCF2 ACl: -50 s (2FA); 41,5 t (2FB), 1Н ЯМР(δ): 3,8; J[H-F B]14 Гц.
Масс-спектр (m/z, распределение, %): 184 (М+, С3Н2Сl2F4 +, 0,5); 165 (M-F, C3H2Cl2F3 +, 0,3); 149 (М-Сl, C3H2ClF4 +, 17,7); 99 (C2H2ClF2 +, 100); 85 (ССlF2 +, 100); 85 (CClF2 +, 33); 64 (C2H2F2 +, 12).
ПРИМЕР 8
СН3СНF2+CF2=CF2-->CH3CHFCF2CF3+CH2FCH2CF2CF3
В 250 мл стальной автоклав вносили 1,1-дифторэтан (53 г, 0,8 моль), пентафторид сурьмы (44 г, 0,2 моль) и тетрафторэтилен (8,5 л, 0,3 моль). Реакционную смесь перемешивали 10 ч при температуре 40-50oС. Продукты реакции пропускали через склянку для промывки газов, содержащую воду, и конденсировали в охлажденной до -78oС ловушке. Избыток 1,1-дифторэтана отделяли перегонкой. Остаток промывали водой, высушивали и перегоняли с образованием смеси с 40% выходом (20 г, т.к. 23-27oC), содержащей СН3СНFСF2СF3 (89%) и CH2FCH2CF2CF3 (11%).
19F ЯМР (δ) CН3 1CH2FDCFAFBCF3 C: 7,5 (3FA); 55 (FA, FB, система АВ); 120 (FD); JF C -F D 10 Гц; JF A -F B 230 Гц; J[F A (F) B -F D ] 16 Гц; J[F A (F B ) -H 1 ] 7 Гц; J[F A (F B ) -H 2 ] 17 Гц;
J[F D -H 2 ] 45 Гц. 1Н ЯМР (δ): 1,7 (Н1); 5,25 (Н2); J[H 1 -H 2 ] 7 Гц.
19F ЯМР (δ) СН2 1FCCH2 2СF2 BCF3 A: 11,5 (3FA); 42,5 (2FB); 147,5 (FC); 55 (FB); J(F B -F C ) 5 Гц; J(F B -H 1 ) 18 Гц; J(F C -H 2 ) 45 Гц; J(F C -H 1 ) 28 Гц.
ПРИМЕР 9
CH3CHF2+CF2=CF2 --> (СF3СF2)2(СН2)2+CF3CF=CHCH2CF2CF3
Безводный HF (80 мл), 1,1-дифторэтан (11 г, 0,2 моль), пентафторид сурьмы (45 г, 0,2 моль) и тетрафторэтилен (40 г, 0,4 моль) загружали в 250 мл стальной автоклав. Реакционную смесь перемешивали при комнатной температуре 8 ч, затем нагревали автоклав в кипящей водяной бане. Продукты реакции собирали в склянку для промывки газов, содержащую воду. Отделяли органический слой, промывали водой, высушивали и перегоняли, получая смесь с 50% выходом (27 г, т.к. 46-58oС), содержащую СF3СF2СН2СН2СF2СF3 (70%) и СF3СF= СНСН2СF2СF3 (30%). Реакционная смесь также содержала небольшое количество 1-перфторэтил-2,2,3,3-тетрафторциклобутана.
19F ЯМР (δ) СF3СF2СН2СН2СF2СF3: 11 (СF3); 44,5 (CF2); JH-F 16 Гц.
1Н ЯМР (δ): 2,5 m (2CH2).
Масс-спектр (m/z, распределение, %): 247 (M-F, С6Н4F9 +, 0,1); 227 (С6Н3F8 +, 9,7); 197 (C5H4F7 +, 18,9); 177 (C5H3F6 +, 29,6); 157 (C5H2F5 +, 6,7); 127 (C4H3F4 +, 24,3); 119 (C2F5 +, 5,6); 113 (С3НF4 +, 31,3); 100 (C2F4 +, 3,9); 77 (С3Н3F2 +, 43,3); 69 (СF3 +, 68,4).
19F ЯМР (δ) CF3 ACFB= CH2CH2 1CF2 CCF3 D: -1,2 (3Fa); 10,5 (3FD); 42,5 (2FC); 55 (FB); J(FA-FB) 10 Гц. 1Н ЯМР (δ) 3,1 (2Н1); 5,8 (1H2); J(H2-FB) 30 Гц; J(H1-H2) 7,5 Гц; J(H1-FC) 10 Гц. Спектр комбинационного рассеяния (ν, см-1 ): 1728.
Масс-спектр (m/z, распределение, %): 246 (М+, C6H3F9 +, 9,6); 227 (С6Н3F8 +, 8,5); 207 (C6H2F7 +, 2,3); 177 (C5Н3F6 +, 7); 157 (C5H2F5 +, 0,7); 127 (C4H3F4 +, 66); 119 (С2F5 +, 2,6); 113 (C3HF4 +, 20,3); 77 (C3H3F2 +, 100); 69 (СF3 +, 68,4).
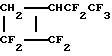
Масс-спектр (m/z, распределение, %): 227 (MF+, С6H3F8 +, 0,8); 207 (C6H2F7 +, 1,6); 177 (C5H3F6 + , 1,8); 157 (C5H2F5 +, 1,9); 127 (C4H3F4 +, 4,5); 113 (C3HF4 +, 9,7); 100 (C2F4 +, 13); 77 (C3H3F2 +, 12); 69 (СF3 +, 10,6); 64 (C2H2F2 +, 100).
Сравнительный пример В
(CH3)2CHF+CF2=CF2 --> Смола
В 400 мл трубку для встряхивания из никелевого сплава Hastelloyтм добавляли изопропилфторид (25 г), пентафторид сурьмы (25 г) и тетрафторэтилен (40 г). Реакционную смесь встряхивали 12 ч при 25oС. Выделялся только смолистый продукт.
Сравнительный пример Г
СF3СН2F+CF2=CF2 --> ПТФЭ
В 400 мл трубку для встряхивания из никелевого сплава HastelloyTM добавляли 1,1,1,2-тетрафторэтан (50 г), пентафторид сурьмы (5 г) и тетрафторэтилен (40 г). Реакционную смесь встряхивали 12 ч при 50oС. Выделенным продуктом являлся политетрафторэтилен (ПТФЭ, 10 г) вместе с регенерированным СF3СН2F (46 г).
Сравнительный пример Д
HCF2CF2CH2F+CF2=CF2 --> ПТФЭ
В 400 мл трубку для встряхивания из никелевого сплава Hastelloyтм добавляли 1,1,2,2,3-пентафторпропан (55 г), пентафторид сурьмы (20 г) и тетрафторэтилен (30 г). Реакционную смесь перемешивали 12 ч при 50oС. Выделенным продуктом являлся политетрафторэтилен (ПТФЭ, 20 г) вместе с регенерированным HCF2CF2CH2F (32 г).
Сравнительный пример Е
CH2F2+CF2=CF2 --> CH2FCF2CF3+CF2=CF2 --> ПТФЭ
В 400 мл трубку для встряхивания из никелевого сплава Hastelloyтм добавляли дифторметан (55 г), пентафторид сурьмы (20 г) и тетрафторэтилен (ТФЭ, 50 г). Реакционную смесь встряхивали 12 ч при 50oС. В это время к реакционной смеси добавляли еще ТФЭ (50 г) и продолжали встряхивание еще 12 ч при 50oС. Выделенным продуктом являлся политетрафторэтилен (ПТФЭ, 20 г) вместе с регенерированным СF3СF2СН2F (32 г).
Изобретение относится к способу получения аддуктов фторсодержащих углеводородов и олефинов, имеющих формулу RR1R2CCR1F или (FR1R2CCR1R2CH2)2, где R выбирается из группы, состоящей из СН3, CH2F, C2H4F, F(CF2)nСН2СН2, где n - целое число от 1 до 10, каждый из R1 независимо выбирается из группы, состоящей из Н, C1, F и СF3, и каждый из R2 независимо выбирается из группы, состоящей из Н, F и СF3. Процесс включает взаимодействие насыщенного соединения формулы RF с олефином формулы R1R2C=CR1R2 в жидкой среде в присутствии катализатора пентафторида сурьмы при условии, что, если образуется (FR1R2CCR1R2CH2)2, насыщенным соединением является СН3СНF2 или FCH2CH2F и присутствует безводный HF. В результате улучшается выход вышеуказанных аддуктов.
Способ получения аддуктов фторсодержащих углеводородов и олефинов, имеющих формулу RR1R2CCR1R2F или (FR1R2CCR1R2CH2)2, где R выбирается из группы, состоящей из СН3, CH2F, C2H4F, F(CF2)nCH2CH2, где n - целое число от 1 до 10, каждый из R1 независимо выбирается из группы, состоящей из Н, C1, F и СF3 , и каждый из R2 независимо выбирается из группы, состоящей из Н, F и СF3, включающий взаимодействие насыщенного соединения формулы RF с олефином формулы R1R2C= CR1R2 в жидкой среде в присутствии катализатора пентафторида сурьмы; при условии, что если образуется (FR1R2CCR1R2CH2)2, насыщенным соединением является СН3СHF2 или FCH2CH2F, и присутствует безводный HF.
| HASZELDINE ET AL | |||
| Reaction of hexafluoropropene with halogenoalkanes | |||
| Journal of fluorine chemistry | |||
| vol | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОИДЭТАНОВ | 1992 |
|
RU2039034C1 |
Авторы
Даты
2002-04-10—Публикация
1997-03-24—Подача