Изобретение касается использования мутеинов специфических цитокинов дикого типа, являющихся также антагонистами рецепторов последних, в качестве иммуногенов для извлечения антител против цитокина дикого типа, причем эти антитела способны нейтрализовать биологическую активность цитокина дикого типа в заболеваниях, вызываемых избыточным продуцированием цитокина.
Известно, например, что интерлейкин 6 (hIL-6) человека представляет собой полипептид из 184 аминокислот, относящийся к классу спиральных цитокинов. Интерлейкин 6 является мультифункциональным цитокином, продуцируемым различными типами клеток. Он действует как фактор дифференцировки и роста на клетки различных типов, например, клетки иммунной системы, гепатоциты, почечные клетки, гемопоэтические стволовые клетки, кератиноциты и нейроны. Однако избыточное продуцирование hIL-6 вызывает ряд заболеваний, таких, как хронические аутоиммунные нарушения, системная красная волчанка, миелома/плазмоцитома, постклимактерический остеопороз и раковая кахексия.
Таким образом, существует необходимость в этой специфической области противодействовать избыточному продуцированию цитокина дикого типа в общем и hIL-6, в частности, как в смысле предотвращения, так и в смысле лечения вызываемых нарушений.
Применение данного изобретения позволяет удовлетворить эту потребность и в то же время предоставляет другие преимущества, которые становятся очевидными из следующего далее описания.
Фактически, целью данного изобретения является использование мутантов цитокина дикого типа для приготовления фармацевтических соединений для лечения или предотвращения заболеваний, вызываемых сверхсинтезом этого специфического цитокина дикого типа.
Следующей целью данного изобретения являются фармацевтические соединения для лечения заболеваний, вызываемых избыточным образованием цитокина дикого типа, или вакцины для предотвращения этих заболеваний, содержащие в качестве активного начала по меньшей мере один мутант цитокина дикого типа.
Фармацевтические составы согласно данному изобретению могут быть приготовлены согласно известным способам, которые требуют, например, присутствия фармацевтически приемлемого носителя. Примеры таких носителей и способы приготовления могут быть найдены в Remington's Pharmaceutical Sciences. Для приготовления фармацевтически приемлемого состава, пригодного для эффективного введения, эти составы должны содержать эффективное количество активного начала в соответствии с данным изобретением. Фармацевтические составы данного изобретения вводят индивидууму в количествах, адекватных для заболевания, веса, пола и возраста данного индивидуума. Другие факторы включают в себя способ введения.
Фармацевтические составы согласно данному изобретению могут вводиться в широком диапазоне способов, например, подкожно, накожно, перорально или внутримышечной инъекцией.
Фармацевтические составы согласно данному изобретению, содержащие в качестве активного ингредиента по меньшей мере один мутеин цитокина дикого типа, могут вводиться при терапевтических дозах в широком разнообразии форм, в общепринятых применяемых для введения носителях.
Например, они могут вводиться в дозах для перорального введения в форме таблеток, капсул, пилюль, порошков, гранул, эликсиров, мазей, растворов, суспензий, сиропов и эмульсий или инъекцией. Таким же образом, составы в соответствии с данным изобретением могут вводиться внутривенно, внутрибрюшинно, подкожно, местно с покрытием или без него, или внутримышечно. Все указанные выше формы лекарства хорошо известны специалистам в области фармацевтики. В любом случае следует использовать эффективное, но нетоксичное количество активного ингредиента в соответствии с данным изобретением.
Суточная доза этого активного ингредиента может меняться в широком диапазоне между 0,01 и 1000 мг на взрослого в день. Эффективное количество активного начала согласно данному изобретению обычно обеспечивается при дозе между приблизительно 0,001 мг/кг и приблизительно 100 мг/кг веса тела в день.
Согласно данному изобретению, активное начало, которое приготовлено из мутеинов специфического цитокина дикого типа, может быть в типичном случае введено в смеси с подходящими разбавителями, наполнителями или фармацевтическими носителями (обычно называемыми общим термином "носители"), выбранными с учетом формы желаемого введения.
Приготовление вакцин в соответствии с данным изобретением известно специалистам в данной области. Как правило, эти вакцины готовят в инъецируемой форме, либо в виде растворов, либо в виде суспензий. Препарат может быть эмульгирован или активная форма препарата может быть инкапсулирована в липосомы. Активный иммуногенный ингредиент часто смешивают с фармацевтически приемлемыми наполнителями, которые совместимы с активным ингредиентом. Подходящими наполнителями являются, например, вода, декстроза, глицерин, этанол или т.п. и их комбинации. Кроме того, если желательно, вакцина может содержать небольшие количества дополнительных веществ, таких как, например, смачивающие или эмульгирующие агенты, забуферивающие рН агенты и/или адъюванты, для увеличения эффективности вакцины.
Вакцины согласно данному изобретению предпочтительно вводят парентерально, например, посредством внутримышечной или подкожной инъекции. Другие готовые формы, пригодные для других способов введения, включают суппозитории и пероральные препараты. Эти соединения содержат от 10 до 95% активного ингредиента, предпочтительно между 25 и 70%.
До этого момента давалось общее описание данного изобретения. Теперь при помощи следующих далее примеров будет дано более подробное описание с указанием конкретных ситуаций, на которые может ссылаться данное изобретение и на которые может быть нацелено данное изобретение, что будет способствовать более ясному пониманию целей, особенностей, преимуществ и возможных применений данного изобретения.
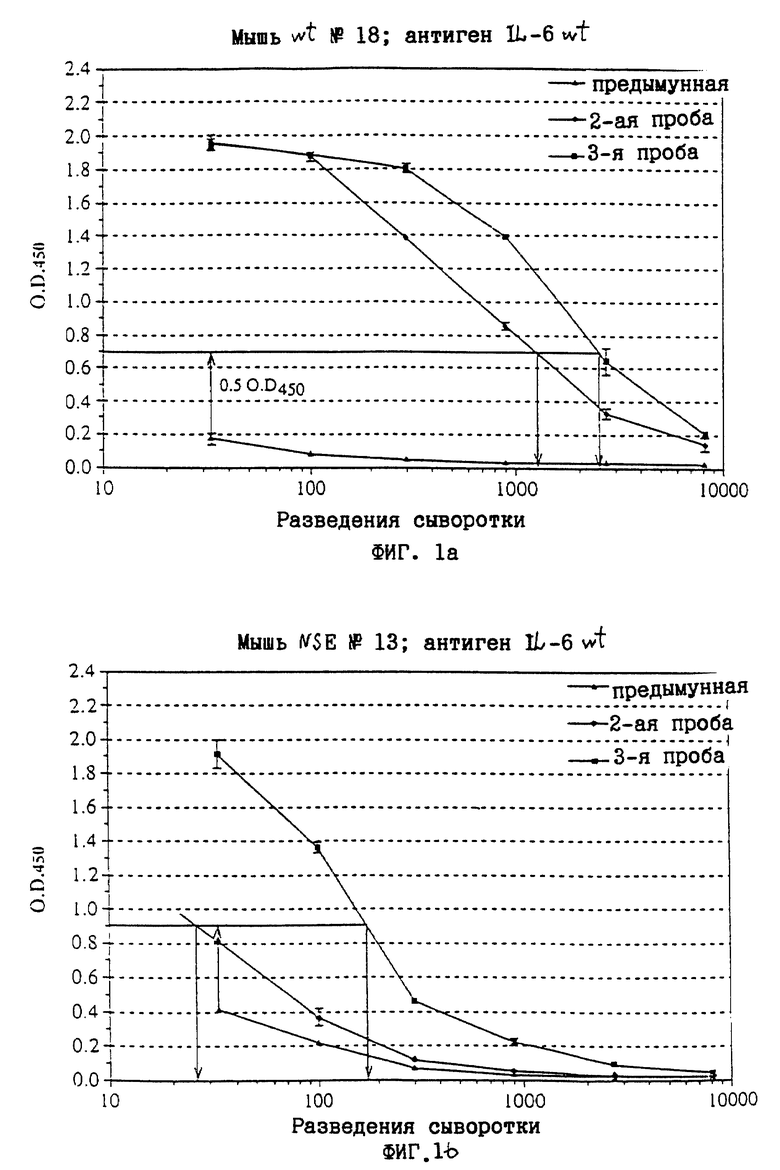
Фиг. 1а и 1b показывают результаты эксперимента с иммунизацией нормальных и трансгенных NSE/hIL-6 мышей hIL-6 дикого типа.
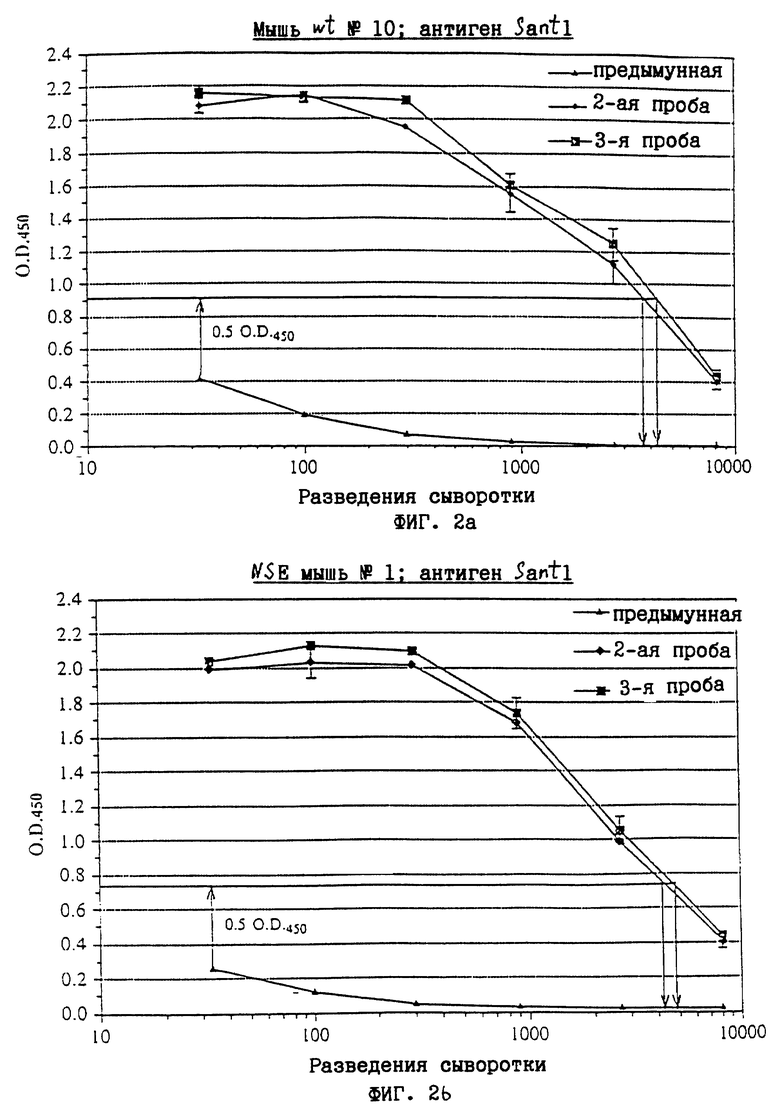
Фиг. 2а и 2b показывают результаты эксперимента с иммунизацией мутантной формой, коротко называемой Santl (содержащей мутации Туr 31 Asp, Gly 35 Phe, Ser 118 Arg, Val 121 Asp, Gln 175 Ile, Ser 176 Arg, Gln 183 Ala и являющейся антагонистом hIL-6), в нормальных и в трансгенных NSE/hIL-6 мышах.
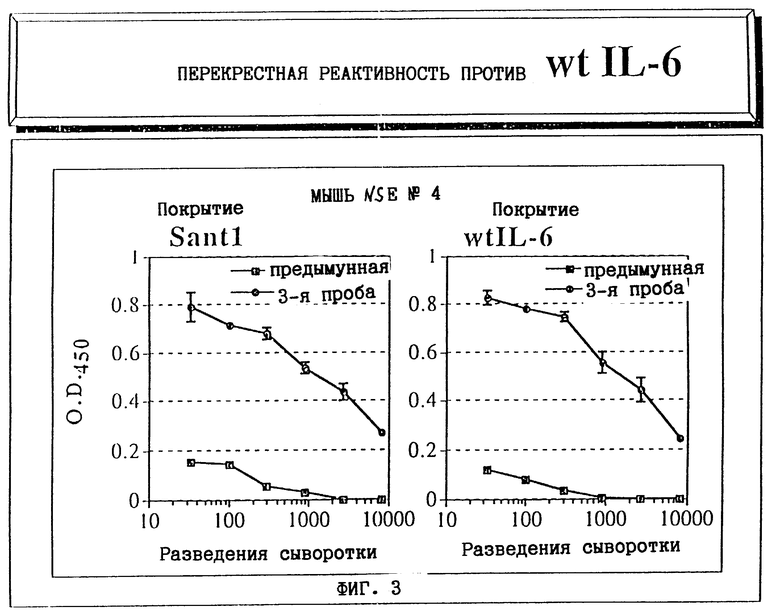
Фиг. 3 показывает результаты эксперимента, имеющего целью проверку, способны или нет антитела, вырабатываемые в мышах против Santl, узнавать также интерлейкин-6 дикого типа.
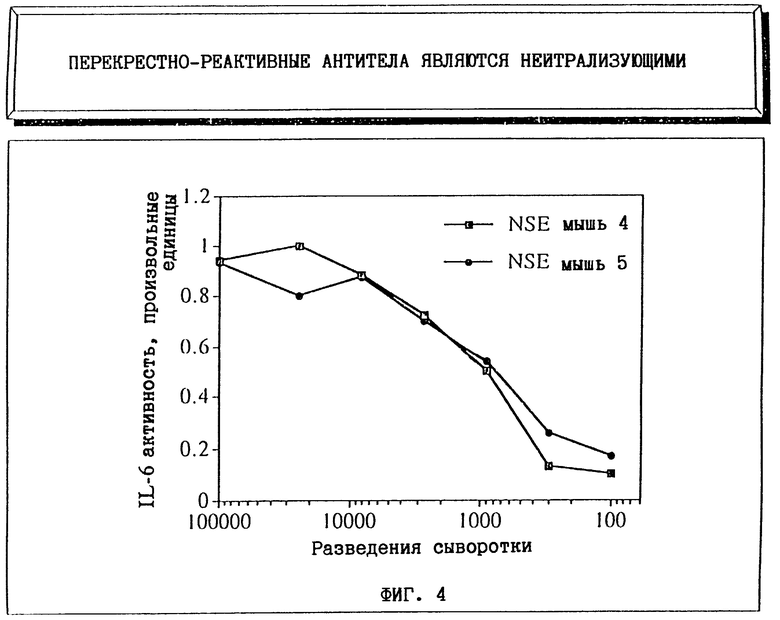
Фиг. 4 показывает результаты эксперимента, целью которого была проверка, способны или нет антитела, вырабатываемые в трансгенных NSE/hIL-6 мышах, иммунизированных мутантом Santl интерлейкина-6 дикого типа, нейтрализовать биологическую активность человеческого интерлейкина-6 дикого типа.
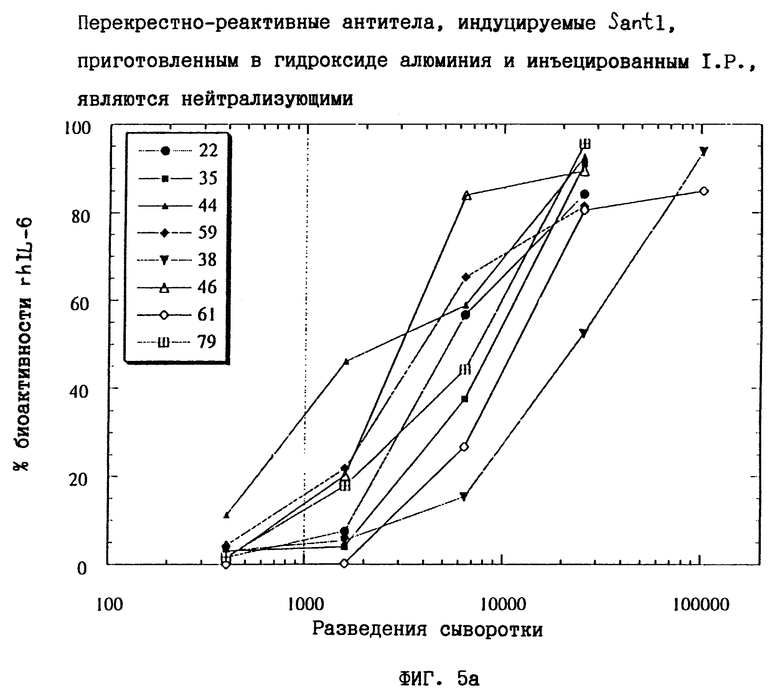
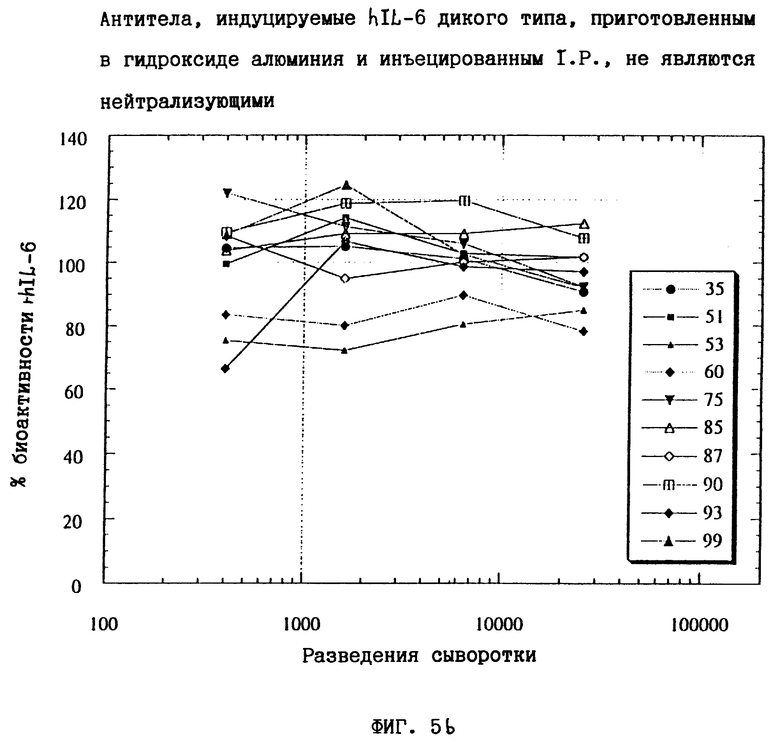
Фиг. 5а и 5b показывают результаты экспериментов, проведенных в примере 7.
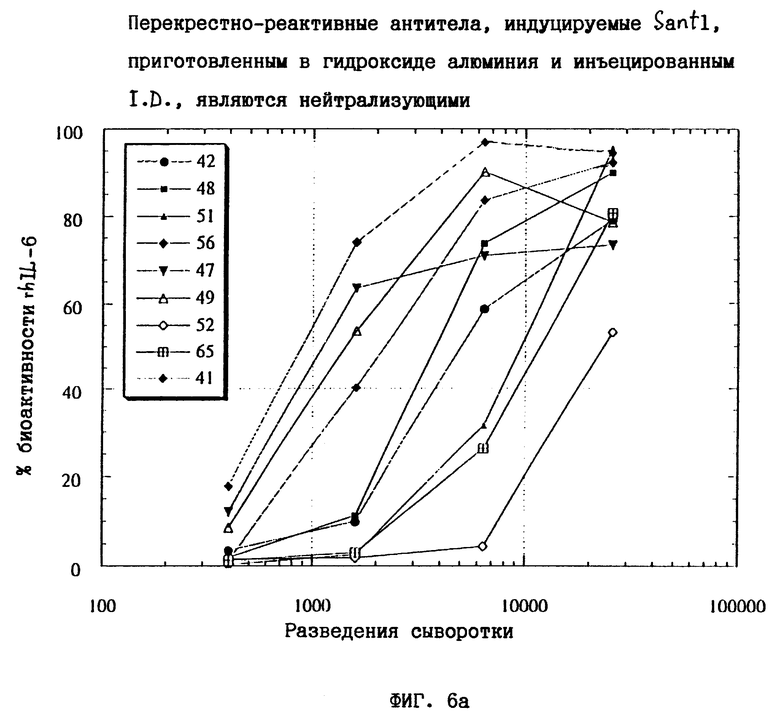
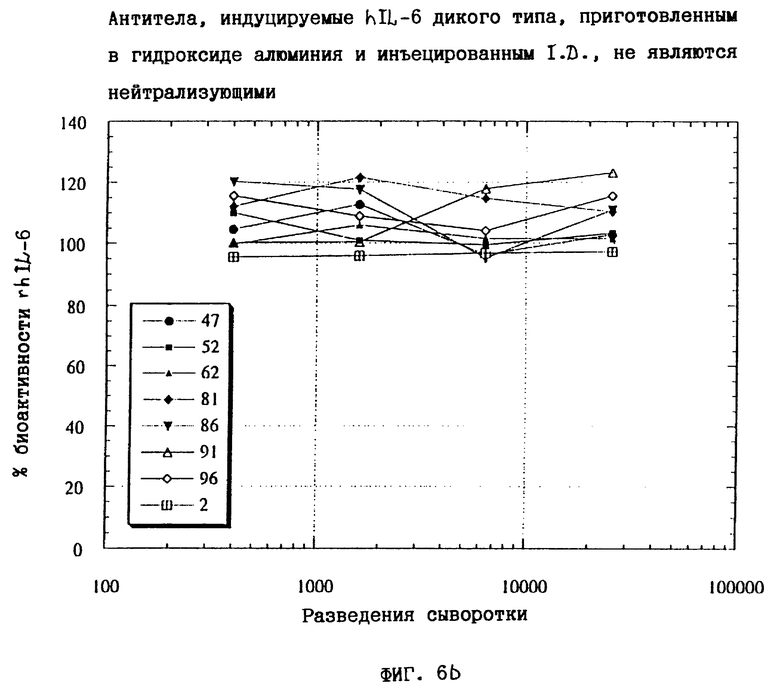
Фиг. 6а и 6b показывают результаты экспериментов, проведенных в примере 11.
Пример 1
Иммунизация NSE/hIL-6 трансгенных мышей, с иммунной толерантностью в отношении hIL-6, с использованием hIL-6 и Santl
В геном NSE/hIL-6 трансгенных мышей была интегрирована кДНК человеческого интерлейкина-6, находящаяся под контролем промотора гена крысиной нейроспецифической энолазы.
Теория толерантности проверялась попыткой иммунизации вышеупомянутых NSE/hIL-6 трансгенных мышей (группы из 5 мышей) рекомбинантным человеческим IL-6; в качестве контроля использовали сиблингов, рожденных в том же самом выводке, но не имеющих трансгена. Группу из пяти NSE/hIL-6 трансгенных мышей иммунизировали также мутантной формой IL-6, называемой Santl (которая не имеет остаточной биологической активности на клетках человека и ведет себя как антагонист рецептора hIL-6), которая содержала семь указанных ниже мутаций: Туr 31 Asp, Gly 35 Phe, Ser 118 Arg, Val 121 Asp, Gln 175 Ile, Ser 176 Arg, Gln 183 Ala. В этом случае использовали в качестве контроля также пять сиблингов из того же выводка, не содержащих трансген. Протокол иммунизации был следующим: при времени 0 брали пробу крови (предиммунную пробу) последовательно из каждого животного, как трансгенного, так и нетрансгенного, и затем каждое животное иммунизировали внутрибрюшинно (I.P.) 100 мкг антигена (wthIL-6 или Santl), в соответствии с группой мышей в присутствии полного адъюванта Фрейнда (ПАФ). Спустя 10 дней после первой иммунизации, брали пробу крови (пробу 1). Спустя 20 дней после первой иммунизации, проводили вторую иммунизацию (первый бустер), опять с использованием 100 мкг антигена, в присутствии неполного адъюванта Фрейнда (НАФ) с последующим взятием второй пробы крови (пробы 2) спустя 10 дней (30 дней от первой иммунизации). Наконец, спустя 40 дней после первой иммунизации, проводили третью иммунизацию (второй бустер), опять с использованием 100 мкг антигена, в присутствии НАФ с последующим взятием пробы крови (пробы 3) спустя 10 дней (50 дней от первой иммунизации). Соответствующую сыворотку получали из каждой из проб крови в соответствии с известными в данной области способами.
В этой точке эксперимента использовали способ ELISA (твердофазный иммуноферментный анализ) для определения, присутствуют или отсутствуют антитела, направленные против использованного для иммунизации антигена, в сыворотке, полученной из второй и третьей проб. Для этого тот же самый антиген, который использовали для иммунизации, связывали нековалентно с дном лунок в культуральных планшетах, специально производимых для экспериментов такого типа (планшеты ELISA). Иммобилизация антигена происходила при инкубировании 100 мкл раствора антигена, растворенного при концентрации 10 мкл/мл в 1•PBS, в течение 14 часов при комнатной температуре в каждой из лунок, которые должны были быть покрытыми (операция, называемая "покрытие"). После иммобилизации антигена пластик в этих лунках покрывали белками путем инкубирования раствора 0,8% БСА (бычьего сывороточного альбумина) в 1•PBS в течение 4 часов при комнатной температуре в каждой из лунок (операция, называемая "блокирование"). После удаления "блокирующего" раствора 100 мкл каждой сыворотки, разведенной подходящим образом, инкубировали отдельно в каждой лунке в течение 90 минут при комнатной температуре: во время этой стадии, если в сыворотке имеются антитела против антигена, иммобилизованного на дне лунки, они будут связывать сам антиген и, в свою очередь, будут связываться с дном лунки. После инкубационного периода 90 минут сыворотки удаляли из лунок и после достаточного промывания к каждой лунке добавляли 100 мкл 0,8% БСА в 1•PBS, содержащем кроличьи антитела, направленные против мышиных антител, и инкубирование продолжали в течение 50 минут при комнатной температуре. Во время этой стадии, если мышиные антитела узнавали и связывали антиген, иммобилизованный на дне лунки, то эти мышиные антитела будут узнаваться и связываться кроличьими антителами, которые, в свою очередь, будут иммобилизованы на дне лунки. Кроме того, кроличьи антитела, направленные против мышиных антител (используемые в разведенном виде при отношении 1:100 в PBS/БСА для описываемого выше эксперимента), производимые и распределяемые компанией DAKO, ковалентно связаны с ферментом пероксидазой хрена. После инкубирования в течение 50 минут раствор, содержащий кроличьи антитела, удаляли, и лунки достаточно хорошо промывали. В этой точке к каждой лунке добавляли 100 мкл раствора, содержащего субстрат (ТМБ: 3,3; 5,5'-тетраметилбензидин-дихлорид) для пероксидазы хрена. Фермент превращает этот субстрат в продукт, который поглощает видимый свет при 450 нм; таким образом, количество превращения может быть рассчитано посредством спектрофотометрического измерения поглощения света при 450 нм в каждой отдельной лунке с использованием планшет-ридера EL1SA. Если эксперимент проведен точно, поглощение (то есть количество поглощенного света) пропорционально количеству фермента, которое, в свою очередь, пропорционально количеству кроличьих антител, которое, в свою очередь, пропорционально количеству мышиных антител, направленных против антигена, исходно присутствующему в сыворотке. Таким образом, измерение поглощения дает оценку количества мышиного антитела, направленного против антигена, присутствующего в сыворотке. Это верно, если мышиное антитело против этого антигена является фактором, лимитирующим цепь реакций, описанных выше. Таким образом, для получения подходящих условий рекомендуется проведение ряда разведений (от 1:33 до 1:8100) для каждой испытуемой сыворотки, так, чтобы для каждой сыворотки были получены определенные разведения, в которых количество мышиного антитела для антигена, использованного для иммунизации, будет достаточно высоким для точного измерения, но недостаточно высоким для насыщения системы.
Результаты эксперимента с иммунизацией IL-6 дикого типа иллюстрируются на фиг. 1а и 1b для типичной нормальной мыши и для типичной NSE/hIL-6 трансгенной мыши. Как можно видеть из фиг. 1а, нормальная мышь вырабатывала большое количество антител против wtIL-6, так много, что можно было детектировать сигнал, даже когда сыворотка была разведена 1:8100. Напротив, как можно видеть из фиг. 1b, трансгенная мышь вырабатывала гораздо меньшее количество антител: фактически сигнал исчезал, когда сыворотка из второй пробы была разведена в соотношении 1:300 и когда сыворотка из третьей пробы была разведена в соотношении 1:2700. Для проведения объективных измерений, сравнимых для всех животных, разведение сыворотки, которое дает регистрируемый результат 0,5 O.D.450 над самым высоким результатом предиммунной сыворотки из того же самого животного, было названо, как это принято, "титром". Фиг. 1а и 1b показывают, как рассчитывают титр второй и третьей проб для нормальных мышей и для NSE/hIL-6 трансгенных мышей, соответственно.
Фиг. 2а и 2b показывают результаты эксперимента по иммунизации, в котором использовали мутантную форму IL-6, Santl, для иммунизации типичной нормальной мыши и типичной NSE/hlL-6 трансгенной мыши, соответственно. В каждом случае обе мыши вырабатывали большое количество антител против Santl. Фактически, можно детектировать относительно сильный сигнал даже при разведении сыворотки 1: 8100. Фиг. 2а и 2b показывают, как рассчитывают титры второй и третьей проб для нормальной мыши и для трансгенной мыши.
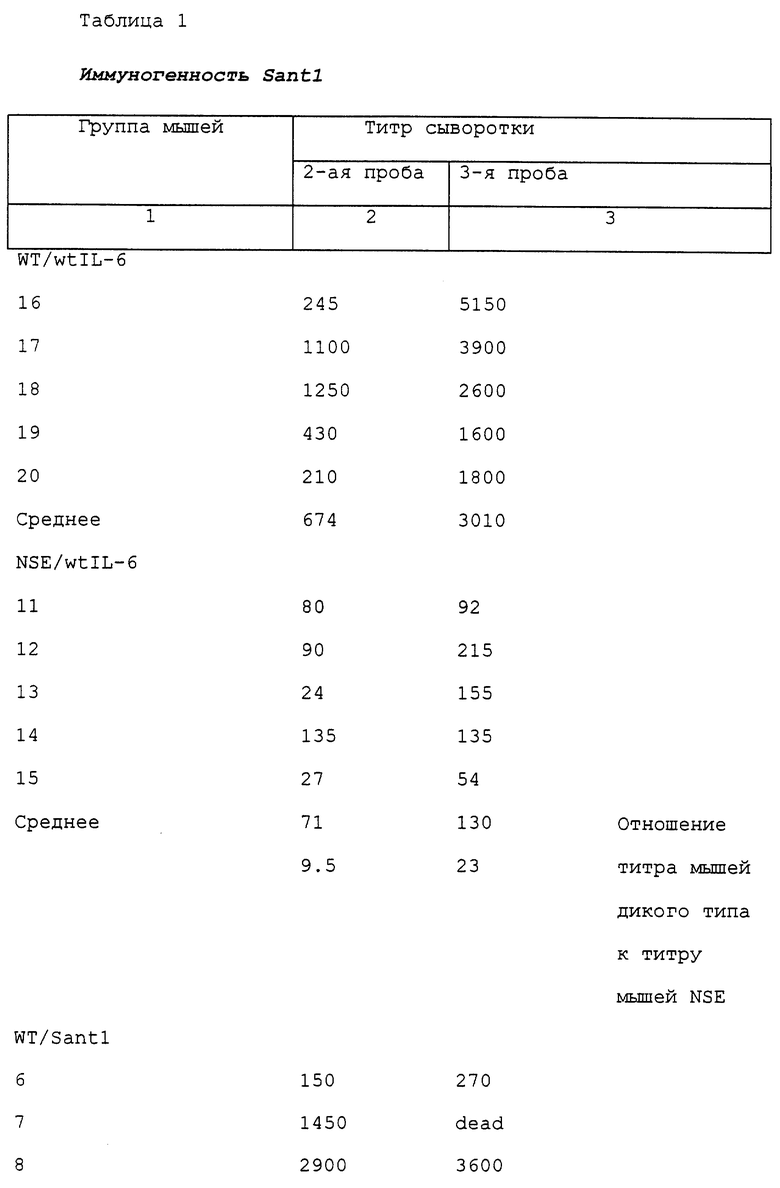
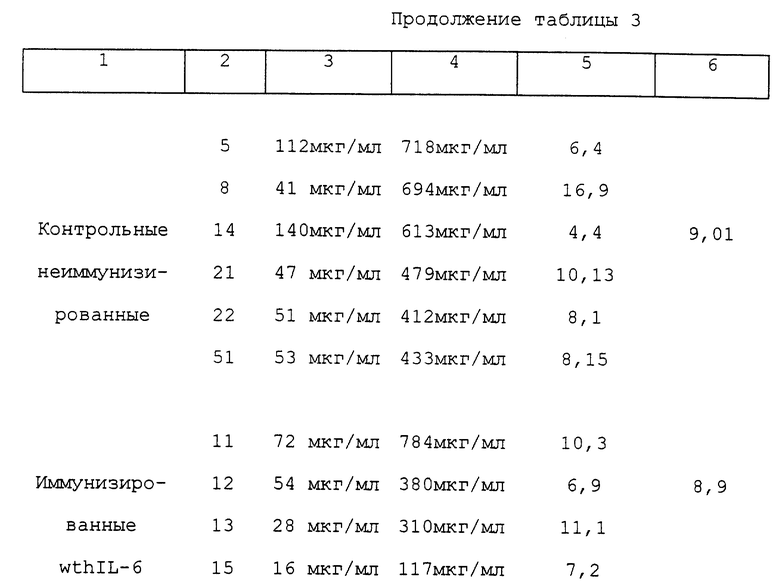
Таблица 1 суммирует данные по титрам (рассчитанные, как описано выше) для второй и третьей проб для всех мышей, инокулированных во время этого эксперимента.
Что касается мышей, инокулированных антигеном wtIL-6, можно видеть, что независимо от вариаций между отдельными животными, в среднем нетрансгенные мыши вырабатывали ответную реакцию в виде образования антител против wtIL-6 в 10-20 раз более сильную, чем реакция, полученная в NSE/IL-6 трансгенных мышах, что является доказательством того факта, что трансгенные мыши развивали иммунную толерантность к hlL-6 человека.
Напротив, что касается мышей, инокулированных антигеном Santl, можно видеть, что, опять независимо от вариаций между отдельными животными, в среднем нетрансгенные мыши вырабатывали ответную реакцию в виде образования антител, равноценную реакции, полученной в NSE/hIL-6 трансгенных мышах, что позволяет предположить, что семь мутаций, которые были введены в полученный из hIL-6 Santl, делали мутант Santl полностью чужеродным белком для иммунной системы, которая в противном случае проявляет толерантность к hIL-6.
Пример 2
Антитела, вырабатываемые в сыворотке NSE/hIL-6 мышей, иммунизированных Santl, способны узнавать не только Santl, но также hIL-6 дикого типа
Проводили испытание, способны ли антитела, вырабатываемые мышами против Santl, узнавать не только сам Santl, но также hIL-6 дикого типа (wthIL-6). Эту гипотезу проверяли также с использованием теста ELISA. После подтверждения факта, что антитела, вырабатываемые в NSE/hIL-6 трансгенных мышах, иммунизированных Santl, способны узнавать и связывать тот же самый Santl, иммобилизованный на дне лунок планшета ELISA, во втором эксперименте IL-6 дикого типа связывали нековалентно со дном лунок планшета ELISA. После стадии, в которой пластик лунок насыщали БСА, к лункам добавляли разведения сыворотки из мышей, иммунизированных Santl, для проверки присутствия или отсутствия антител, способных узнавать wtIL-6. Например, фиг. 3 показывает результаты эксперимента для NSE/hIL-6 трансгенных мышей. Как можно видеть, ответные реакции в виде образования антител, полученные для Santl и для IL-6 дикого типа, являются очень похожими. Другими словами, можно детектировать присутствие антител, связавшихся с wtIL-6, иммобилизованным на дне лунок в сыворотке третьей пробы даже при ее разведении до соотношения 1:8100. Следует отметить, что при иммунизации NSE/hIL-6 трансгенных мышей непосредственно IL-6 дикого типа ответ в виде антител, направленных на сам IL-6 дикого типа, гораздо ниже: фактически невозможно детектировать антитела против wtIL-6 в сыворотке, разведенной до 1:8100 (см. фиг.1). Другие NSE/hIL-6 трансгенные мыши обнаружили ответную реакцию, сходную с ответом мыши, представленным в этом примере.
Пример 3
Антитела, вырабатываемые в NSE/hIL-6 мышах, иммунизированных Santl, способны также нейтрализовать биологическую активность hIL-6 дикого типа
Целью было испытание, способны или нет антитела, выработанные NSE/hIL-6 трансгенными мышами, иммунизированными Santl, но способные узнавать IL-6 дикого типа, также нейтрализовать биологическую активность самого IL-6 дикого типа.
Биологической активностью IL-6 дикого типа, рассматриваемой здесь, была способность стимулировать транскрипцию промотором гена С-реактивного белка в клетках гепатомы человека Нер3В. Эффективность стимуляции транскрипции измеряли в соответствии с известными способами (Gregory, В., Savino, R. and Ciliberto, G., J. Immunological Methods, 170, 47-56, 1994). Клетки гепатомы человека Нер3В стимулировали 4 нг/мл IL-6 дикого типа в присутствии серийных разведений сыворотки, полученной в третьей пробе из двух NSE/hIL-6; трансгенных мышей 4 и 5 (обеих иммунизировали Santl). Результаты этого эксперимента даны на фиг. 4. Можно видеть, что обе сыворотки, разведенные 1:100, почти полностью ингибируют биологическую активность hIL-6 дикого типа при 4 нг/мл на клетках гепатомы человека.
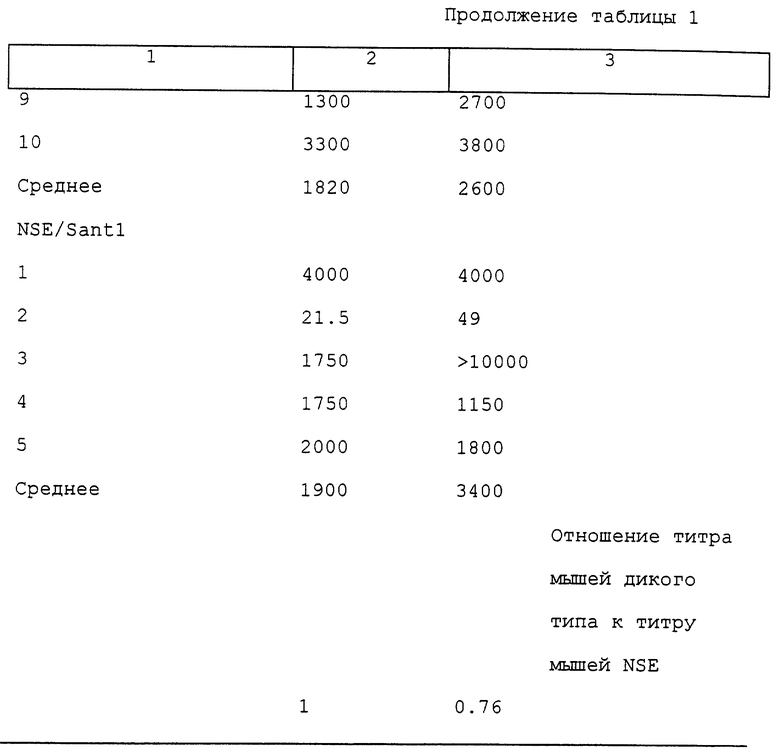
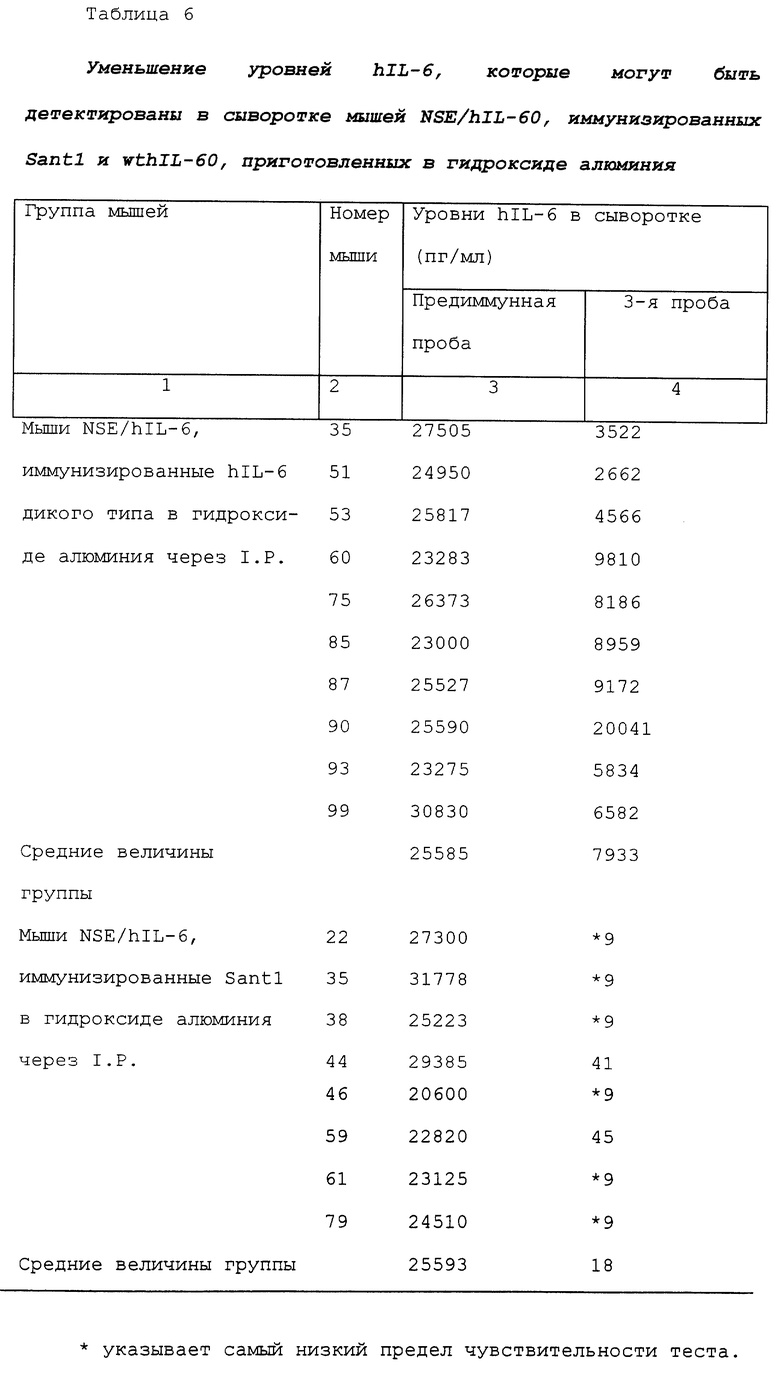
В этой точке исследования проводили для проверки, способна ли перекрестная реактивность антител против hIL-6 дикого типа изменять уровни hIL-6 дикого типа, измеренные в сыворотке NSE/hIL-6 трансгенных мышей, иммунизированных Santl. Уровни hiL-6 измеряли в соответствии со стандартными способами посредством "сэндвич"-теста ELISA, с применением коммерчески доступного набора, производимого компанией "R and D Systems", в строгом соответствии с инструкциями изготовителя. Уровни hIL-6, найденные как в предиммунной пробе, так и в третьей пробе, измеряли для четырех трансгенных мышей, иммунизированных Santl. Результаты суммированы в таблице 2. Как можно видеть, иммунизация с использованием Santl, вызывающая также появление сильного ответа в виде антител, узнающих как сам Santl, так и wtIL-6, вызывает также среднее уменьшение более чем в 500 раз, уровней hIL-6, которые могут быть детектированы в сыворотке NSE/hIL-6 мышей при помощи "сэндвич"-теста ELISA с набором, производимым R and D Systems.
Пример 4
Антитела, вырабатываемые в NSE/hIL-6 мышах, вакцинированных Santl, способны нейтрализовать биологическую активность hIL-6 дикого типа также и in vivo
Хорошо известно, что IL-6 индуцирует образование ряда белков (называемых "белками острой фазы") печенью. Сывороточный Амилоид А, здесь называемый SAA, обнаруживает интенсивное и быстрое увеличение во время острых событий.
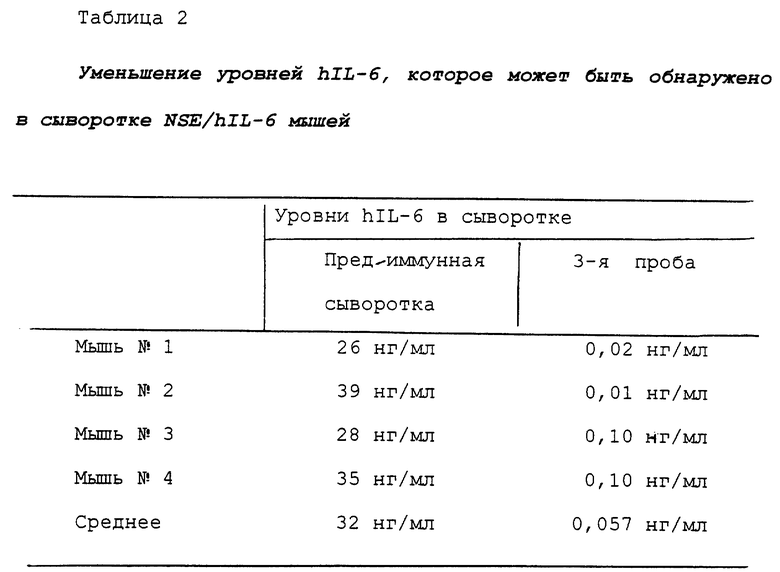
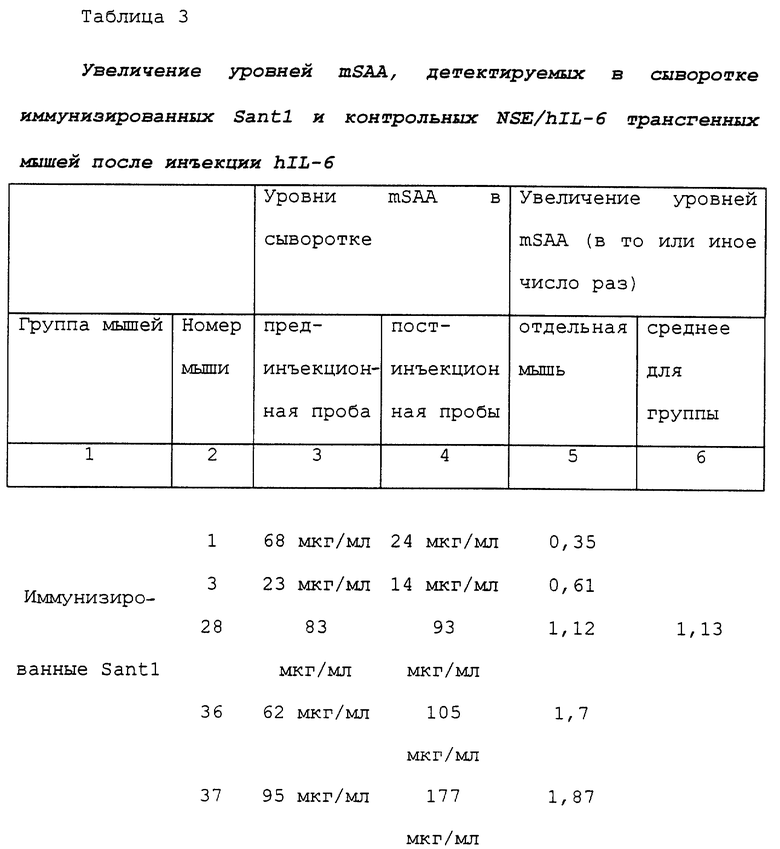
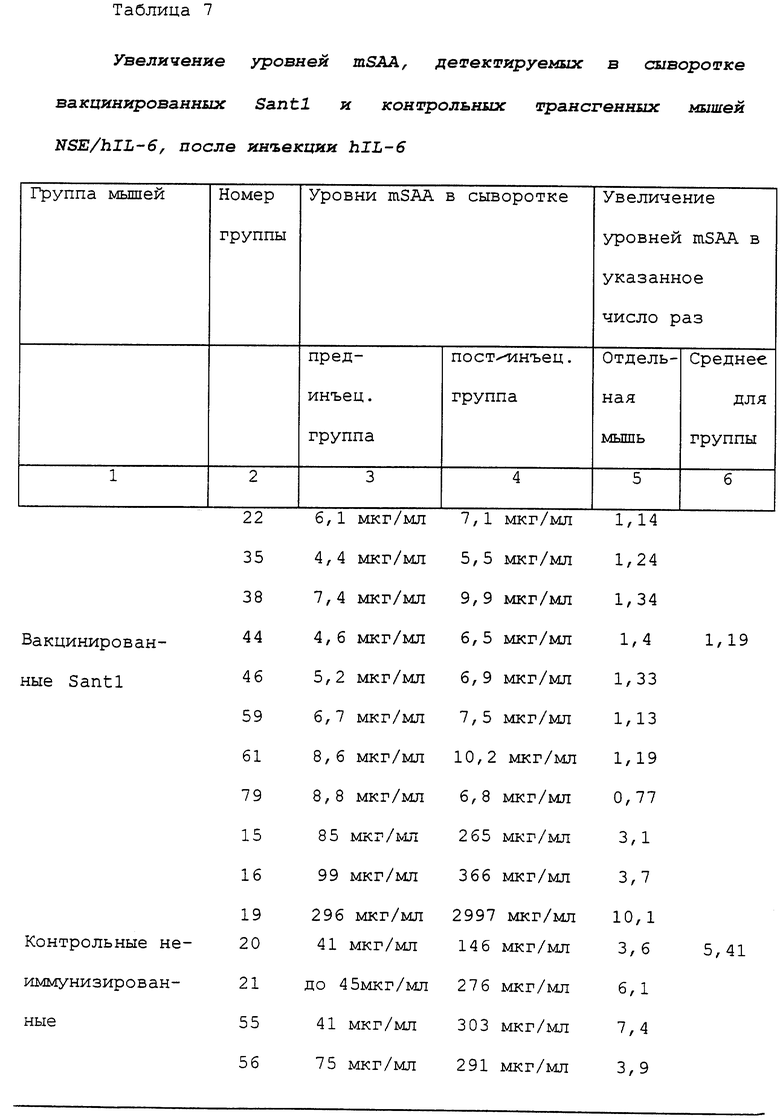
Целью было испытание, способны ли антитела, вырабатываемые NSE/hIL-6 трансгенными мышами, вакцинированными Santl и способные перекрестно реагировать с wtIL-6, также нейтрализовать биологическую активность hIL-6 дикого типа iv vivo, измеренную как ингибирование увеличения мышиного SAA (mSAA) после инъекции hIL-6. Для этой цели брали пробу крови (называемую прединъекционной пробой) из неиммунизированных (контрольных) мышей NSE/hIL-6, из иммунизированных wtIL-6, из иммунизированных Santl NSE/hlL-6 трансгенных мышей. После восстановления от взятия крови животных инъецировали внутрибрюшинно 10 мкг wthIL-6. Спустя 9 часов после инъекции, брали вторую пробу крови (называемую здесь постинъекционной пробой) из обеих групп животных. Уровни mSAA измеряли как в прединъекционной пробе, так и в постинъекционной пробе в соответствии с известными в данной области способами при помощи "сэндвич"-теста ELISA с применением коммерчески доступного набора, производимого компанией "Biosource International", в строгом соответствии с инструкциями изготовителя. Результаты суммированы в таблице 3. Как можно видеть, независимо от вариаций между отдельными животными, в среднем в неиммунизированных мышах инъекция 10 мкг hIL-6 определила значительное увеличение уровней SAA в сыворотке, увеличение, которое отсутствовало в вакцинированных Santl мышах, инъецированных тем же количеством hIL-6. Таким образом, вакцинация Santl, вызывающая также появление сильной ответной реакции в виде антител, которые узнают как сам Santl, так и wthIL-6 и способны нейтрализовать биологическую активность wthIL-6 in vitro на клетках гепатомы человека, предотвращает in vivo увеличение уровней mSAA, индуцируемое инъекцией hIL-6, другими словами, она нейтрализует биологическую активность hIL-6 также и in vivo. Следует отметить, что иммунизация hIL-6 дикого типа индуцирует образование низкого количества антител против hIL-6 (см. пример 1), и она неспособна предотвращать in vivo увеличение уровней mSAA, индуцируемое инъекцией hIL-6, поскольку мыши, иммунизированные hIL-6 дикого типа, обнаруживают увеличение уровней SAA в сыворотке, сравнимое с увеличением, наблюдаемым в неиммунизированных контрольных мышах.
Пример 5
Иммунизация NSE/hIL-6 трансгенных мышей hiL-6 и Santl, приготовленных в другом адъюванте, гидроксиде алюминия
Хорошо известно, что различные антигены ведут себя по-разному при приготовлении их в различных адъювантах (Gupta, R. К. and Siber, G. R., Vaccine, 13, 1263-1276, 1995). Полный (или неполный) адъювант Фрейнда, использованный в примере 1, не может использоваться в человеке вследствие побочных эффектов, главным образом, местных реакций в месте инъекции, таких, как образование гранулемы и кисты (Gupta, R. К. and Siber, G. R., Vaccine, 13, 1263-1276, 1995). Целью было определение, можно ли выработать сходную иммунную реакцию с высоким титром антител против Santl и также против wthIL-6 в NSE/hIL-6 трансгенных мышах с применением адъюванта, обычно применяемого для вакцинации людей. Для этой цели был выбран гидроксид алюминия, поскольку в настоящее время он является общепринятым адъювантом для использования в случае человека и имеет превосходные зарегистрированные показатели безопасности (Gupta, R. К. and Siber, G.R., accine, 13, 1263-1276, 1995).
Группы по 8-10 NSE/hIL-6 трансгенных мышей (плюс десять нетрансгенных сиблингов, родившихся в тех же самых выводках, использовали в качестве контролей) иммунизировали внутрибрюшинно 100 мкг антигена (либо Santl, либо hIL-6 дикого типа), приготовленного в гидроксиде алюминия при концентрации 1 мг/мл в общем объеме 100 мкл (100 мкг гидроксида алюминия) для каждой инъекции, с применением протокола иммунизации, идентичного описанному в примере 1. Затем вторую пробу крови (взятую после второй инъекции или первого бустера) и третью пробу крови (взятую после третьей инъекции или второго бустера) тестировали на присутствие антител против антигена, использованного для иммунизации, при помощи ELISA, описанного в примере 1.
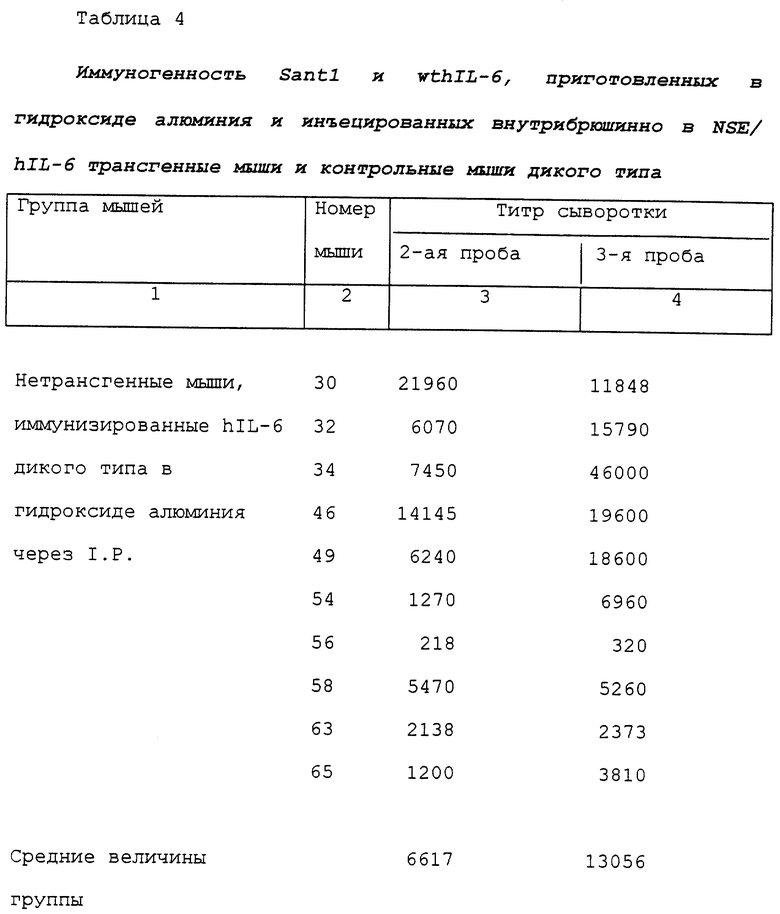
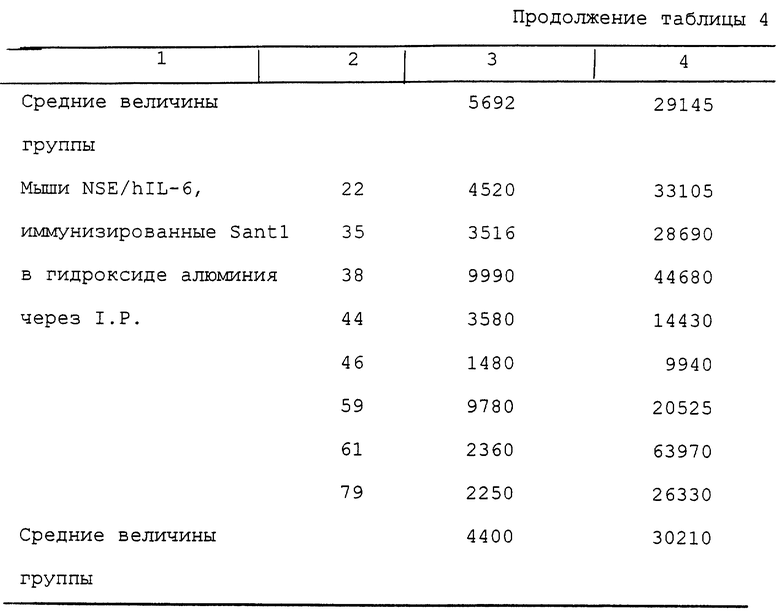
Для проведения объективных измерений, сравнимых для всех животных, разведение сыворотки, которое дает показатель 0,5 O.D.450 над наивысшим показателем, регистрируемым для предиммунной сыворотки из того же животного, было названо, как принято, "титром". Титр измеряли, как показано на фиг. 1а, 1b, 2а и 2b, для нормальных и трансгенных мышей, иммунизированных hIL-6 дикого типа и Santl. Результаты представлены в таблице 4.
В общем, количество антител против антигена, полученное в этом эксперименте по иммунизации (титр), выше по сравнению с количеством антител, полученным в эксперименте по иммунизации, описанном в примере 1; действительно, в данной области известен факт, что адъюванты с алюминием являются лучшими адъювантами для индукции сывороточных антител (Gupta, R.K. and Siber, G.R., Vaccine, 13, 1263-1276, 1995). Более конкретно, что касается мышей, иммунизированных антигеном wthIL-6, может быть видно опять, что (независимо от вариаций между отдельными животными) в среднем нетрансгенные мыши развивали ответную реакцию в виде образования антител против wthIL-6, в 12-18 раз более сильную, чем реакция, полученная в NSE/hIL-6 трансгенных мышах, что является доказательством того, что трансгенные мыши выработали иммунную толерантность в отношении человеческого IL-6 также и в том случае, когда этот антиген инъецировали в гидроксиде алюминия в качестве адъюванта. В противоположность этому, что касается мышей, иммунизированных Santl, приготовленным в гидроксиде алюминия, можно видеть, что также и в этом случае в среднем нетрансгенные мыши развивали ответную реакцию в виде антител, равноценную реакции, полученной в NSE/hIL-6 трансгенных мышах, как это было в эксперименте по иммунизации, описанном в примере 1, что позволяет предполагать, что семь мутаций (которые были введены в произведенный из hIL-6 Santl) превращали этот мутант в полностью чужеродный белок и при приготовлении в гидроксиде алюминия.
Пример 6
Антитела, выработанные в сыворотке мышей NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, способны узнавать не только Santl, но также hIL-6 дикого типа
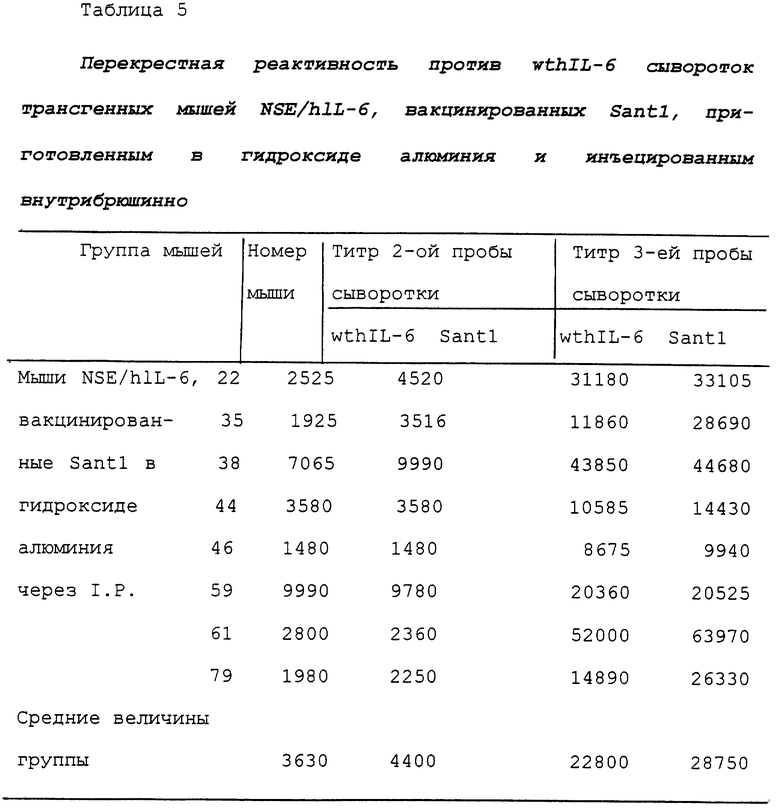
Испытывали, способны ли антитела, выработанные против Santl, в мышах NSE, вакцинированных Santl, приготовленным в гидроксиде алюминия, перекрестно реагировать с hIL-6 дикого типа (wthlL-6). Тест также проводили при помощи ELISA с использованием способов, описанных в примере 2. Титр антител рассчитывали, как описано ранее и как показано на фиг. 1а, 1b, 2a и 2b, и полученные результаты представлены в таблице 5.
В этом случае также, если для иммунизации использовали гидроксид алюминия, титры антител против Santl и против hIL-6 дикого типа являются одинаковыми. Следует также отметить, что при иммунизации трансгенных мышей NSE/hlL-6 hIL-6 дикого типа, образование антител против самого hIL -6 дикого типа гораздо ниже: например, в третьей пробе крови средний титр против wthIL-6 равен 737 в группе мышей NSE/hlL-6, иммунизированных wthIL-6 (см. пример 5), в сравнении со средним титром против wthlL-6 22800 (в 13 раз выше) в группе мышей NSE/hIL-6, вакцинированных Santl.
Пример 7
Антитела, выработанные в мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, также способны нейтрализовать биологическую активность hIL-6 дикого типа
Целью было определение, способны ли антитела, выработанные в трансгенных мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, но способные узнавать hIL-6 дикого типа, также нейтрализовать биологическую активность самого hIL-6 дикого типа.
Рассматриваемой биологической активностью IL-6 дикого типа была способность стимулировать транскрипцию промотором гена С-реактивного белка в клетках гепатомы человека Нер3В. Эффективность стимуляции транскрипции измеряли известными в данной области способами (Gregory, В., Savino, R. and Ciliberto, G., J. Immunological Methods, 170, 47-56, 1994). Клетки гепатомы человека Нер3В стимулировали 4 нг/мл hIL-6 дикого типа, и эту степень стимуляции брали за 100% или 4 нг/мл hIL-6 дикого типа в присутствии серийных разведений сыворотки, полученной из третьей пробы крови из мышей NSE/hIL-6, иммунизированных как Santl, так и hIL-6 дикого типа; в последних случаях степень стимуляции транскрипции выражали в виде процента стимуляции, полученной в клетках, инкубированных с 4 нг/мл только hIL-6 дикого типа. Результаты этого эксперимента представлены на фиг. 5а и 5b. Можно видеть, что сыворотка всех мышей, разведенная 1:400, почти полностью ингибирует биологическую активность hlL-6 дикого типа при 4 нг/мл на клетках гепатомы человека. Таким образом, способность нейтрализовать биологическую активность экзогенно добавленного hlL-6 на клетках гепатомы человека была даже более высокой для сывороток животных, иммунизированных с гидроксидом алюминия, чем в случае животных, иммунизированных CFA (см. пример 3 и сравни фиг.5а с фиг. 4). При иммунизации трансгенных мышей NSE/hIL-6 hlL-6 дикого типа очень низкое количество антител против hlL-6, полученное в этом случае, недостаточно для ингибирования биологической активности hlL-6 дикого типа на клетках гепатомы человека (см. фиг.5).
Также и в этом случае проводили исследования для выяснения, способно ли наличие перекрестно реактивного иммунного ответа против hlL-6 дикого типа изменять уровни hlL-6 дикого типа в сыворотке трансгенных мышей NSE/hIL-6, иммунизированных как Santl, так и hlL-6 дикого типа. Уровни hlL-6 измеряли, как описано в примере 3, как в предиммунной пробе, так и в третьей пробе обеих групп мышей. Результаты суммированы в таблице 6. Как можно видеть, вакцинация с использованием Santl, приготовленным в гидроксиде алюминия, в также вызывающим сильное образование антител, которые узнают как сам Santl, так и hlL-6 дикого типа, вызывает также среднее уменьшение приблизительно в 1400 раз уровней hlL-6, которые могут быть определены в сыворотке трансгенных мышей NSE/hIL-6. Иммунизация с использованием самого hlL-6 дикого типа, приготовленного в том же самом адъюванте, вызывает только незначительное уменьшение (в 3 раза по сравнению с 1400-кратным) уровней hIL-6, которые могут быть детектированы в сыворотке.
Пример 8
Антитела, вырабатываемые в мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, способны нейтрализовать биологическую активность hIL-6 дикого типа также и in vivo
Целью было испытание, способны ли также антитела, выработанные в трансгенных мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, но способные узнавать wthIL-6, нейтрализовать биологическую активность hIL-6 дикого типа in vivo, измеренную как увеличение уровней мышиного SAA (mSAA) в сыворотке, индуцируемое в мышах инъекцией hIL-6, как описано в примере 4. Эксперимент проводили, как описано в примере 4, на неиммунизированных (контрольных) мышах NSE/hIL-6 и на мышах NSE/hIL-6, иммунизированных Santl, приготовленным в гидроксиде алюминия. Результаты суммированы в таблице 7. Как можно видеть, независимо от вариаций между отдельными животными, в среднем опять в неиммунизированных мышах инъекция 10 мкг hIL-6 определяла 5-6-кратное увеличение уровней SAA в сыворотке.
Увеличения не получали в мышах, вакцинированных Santl, приготовленным в гидроксиде алюминия, инъецированных тем же количеством hIL-6.
Таким образом, вакцинация Santl, также вызывающая появление сильного гуморального ответа, образования антител, которые узнают как сам Santl, так и wthIL-6 и которые способны нейтрализовать биологическую активность hIL-6 in vitro на клетках гепатомы человека, предотвращает in vivo увеличение уровней mSAA, индуцируемое инъекцией hIL-6, другими словами, она нейтрализует биологическую активность hIL-6 также и in vivo.
Пример 9
Вакцинация трансгенных мышей NSE/hIL-6 hIL-6 и Santl, приготовленными в гидроксиде алюминия, через интрадермальный путь введения
Примеры 5, 6, 7 и 8, приведенные выше, показывают, что можно получить в животных, в противном случае толерантных к wthIL-6, сильный гуморальный ответ в виде образования антител против самого hIL-6, которые способны нейтрализовать биологическую активность hIL-6 как in vitro, так и in vivo, путем использования мутантной формы hIL-6 (Santl), приготовленной в адъюванте (гидроксиде алюминия), совместимом с применением для человека. Однако в эксперименте по иммунизации, описанном в примере 5, антиген инъецировали внутрибрюшинно, т. е. способом, который не является обычным способом для иммунизации человека. Следующей целью было выяснение, можно ли подобный иммунный ответ, с высоким титром антител против Santl и также против wthIL-6 получить в трансгенных мышах NSE/hIL-6 с использованием пути введения, применяемого для вакцинации человека.
Группы из 8-9 трансгенных мышей NSE/hIL-6 (плюс десять нетрансгенных сиблингов, родившихся в тех же самых выводках, используемых в качестве контролей) иммунизировали интрадермально (I. D.), способом введения, который соответствует подкожному (S.C.) способу введения, применяемому для человека в настоящее время для введения различных вакцин, как описано в современной литературе в данной области знаний. Для каждой инъекции опять использовали 100 мкг антигена (либо Santl, либо hIL-6 дикого типа), приготовленного в гидроксиде алюминия при концентрации 1 мг/мл в общем объеме 100 мкл (100 мкг гидроксида алюминия), с применением протокола иммунизации, идентичного протоколу, описанному в примере 1. Затем вторую пробу (взятую после второй инъекции или первого бустера) и третью пробу крови (взятую после третьей инъекции или второго бустера) тестировали на присутствие антител против антигена, использованного для иммунизации, при помощи способа ELISA, идентичного уже описанному в примере 1.
Для проведения объективных измерений, сравнимых для всех животных, разведение сыворотки, которое дает регистрируемый показатель 0,5 O.D.450 над наивысшим показателем предиммунной сыворотки из того же животного, называли титром, как это принято. Титр измеряли, как показано на фиг. 1a, 1b, 2а и 2b, как для нормальных, так и для трансгенных мышей, иммунизированных Santl. Результаты представлены в таблице 8.
Что касается мышей, иммунизированных антигеном hIL-6 дикого типа, опять можно видеть, что (независимо от вариаций между отдельными животными) в среднем нетрансгенные мыши развивали гуморальный ответ против wthIL-6, в 40-50 раз более высокий, чем ответ, полученный в трансгенных мышах NSE/hlL-6, что является доказательством того, что трансгенные мыши выработали иммунную толерантность к IL-6 человека также при инъекции этого антигена, приготовленного в гидроксиде алюминия, интрадермальной инъекцией. В противоположность этому, что касается мышей, иммунизированных Santl, приготовленным в гидроксиде алюминия, можно видеть, что также и в этом случае в среднем нетрансгенные мыши вырабатывали гуморальный ответ, равноценный ответу, полученному в трансгенных мышах NSE/hlL-6, как это было в экспериментах по иммунизации, описанных в примерах 1 и 5, что позволяет предположить, что семь замен (которые при введении в hIL-6 давали Santl) делали этот мутантный белок полностью чужеродным белком также и при приготовлении в гидроксиде и инъекции интрадермальным путем.
Пример 10
Антитела, выработанные в сыворотке мышей NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия, способны узнавать не только Santl, но также hIL-6 дикого типа
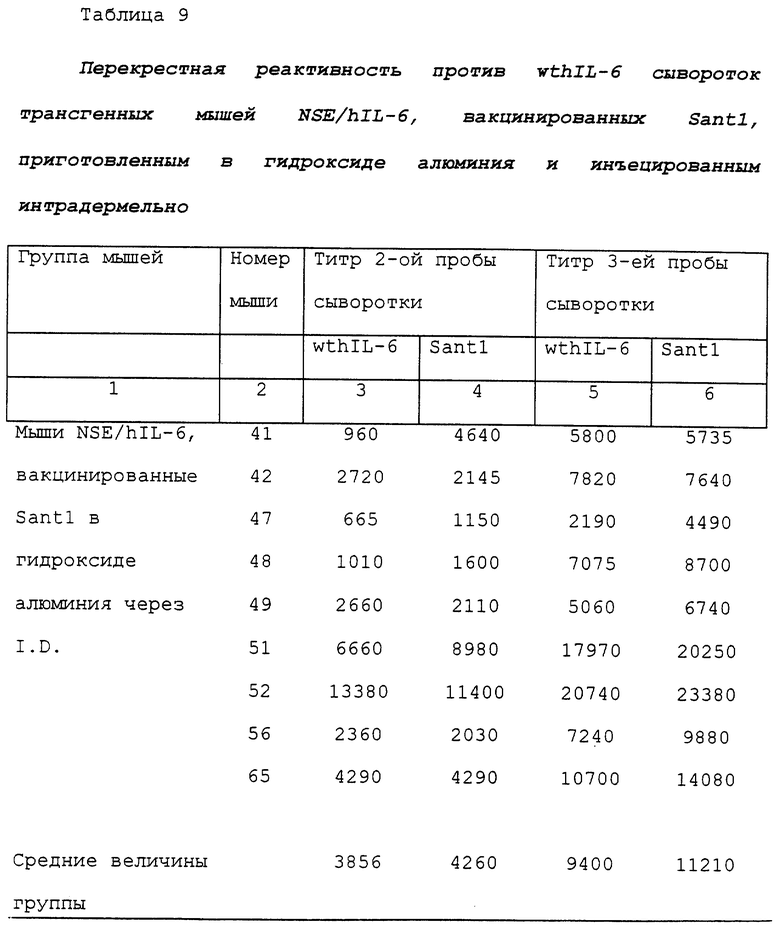
В этом примере определяли, способны ли антитела, выработанные в мышах NSE, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально, перекрестно реагировать с hIL-6 дикого типа (wthIL-6). Испытание проводили также при помощи ELISA с использованием способов, описанных в примере 2. Титр антител рассчитывали, как описано ранее и как показано на фиг. 1а, 1b, 2а и 2b, и полученные данные представлены в таблице 9.
В этом случае также при использовании гидроксида алюминия в качестве адъюванта для иммунизации через интрадермальный путь введения титры антител против Santl и hIL-6 дикого типа были очень сходными. Следует еще раз отметить, что при иммунизации трансгенных NSE/hIL-6 мышей hIL-6 дикого типа образование антител, направленных против самого hIL-6 дикого типа, гораздо ниже: например, в третьей пробе крови средний титр против wthIL-6 равен 139 в группе мышей NSE/hIL-6, иммунизированных wthIL-6 (см. пример 9), по сравнению со средним титром против wthIL-6, равным 9400 (в 70 раз более высоким), в группе мышей NSE/hIL-6, иммунизированных Santl.
Пример 11
Антитела, выработанные в мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным внутридермально, способны также нейтрализовать биологическую активность hIL-6 дикого типа
Целью было выяснение, способны ли также антитела, выработанные в трансгенных мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально, нейтрализовать биологическую активность самого hIL-6 дикого типа.
В этом примере биологической активностью IL-6 дикого типа также была способность стимулировать транскрипцию промотором гена С-реактивного белка в клетках гепатомы человека Нер3В. Эффективность стимуляции транскрипции измеряли известными в данной области способами (Gregory. В., Savino, R., and Ciliberto, G., J. Immunological Methods, 170, 47-56, 1994). Как и в примере 7, клетки гепатомы человека Нер3В стимулировали 4 нг/мл hIL-6 дикого типа, и эту степень стимуляции брали за 100%, или 4 нг/мл hIL-6 дикого типа в присутствии серийных разведений сыворотки, полученной из третьей пробы крови из мышей NSE/hIL-6, иммунизированных интрадермально как Santl, так и hIL-6 дикого типа; в последних случаях степень стимуляции транскрипции выражали в виде процента стимуляции, полученной в клетках, инкубированных с 4 нг/мл только hIL-6 дикого типа. Результаты этого эксперимента представлены на фиг. 6а и 6b. Можно видеть, что сыворотка всех мышей, разведенная 1:400, ингибирует более 80% биологической активности hIL-6 дикого типа при 4 нг/мл на клетках гепатомы человека. Следует опять отметить, что при иммунизации трансгенных NSE/hIL-6 мышей hIL-6 дикого типа очень низкое количество полученных антител против hIL-6 является недостаточным для ингибирования биологической активности hIL-6 на клетках гепатомы человека (см. фиг.6b).
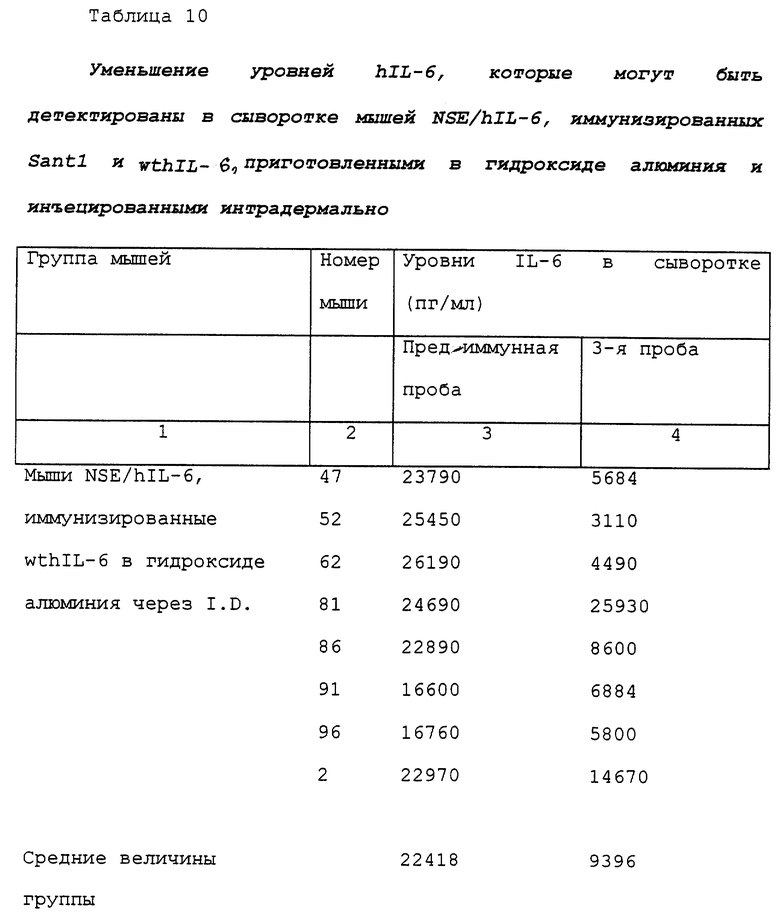
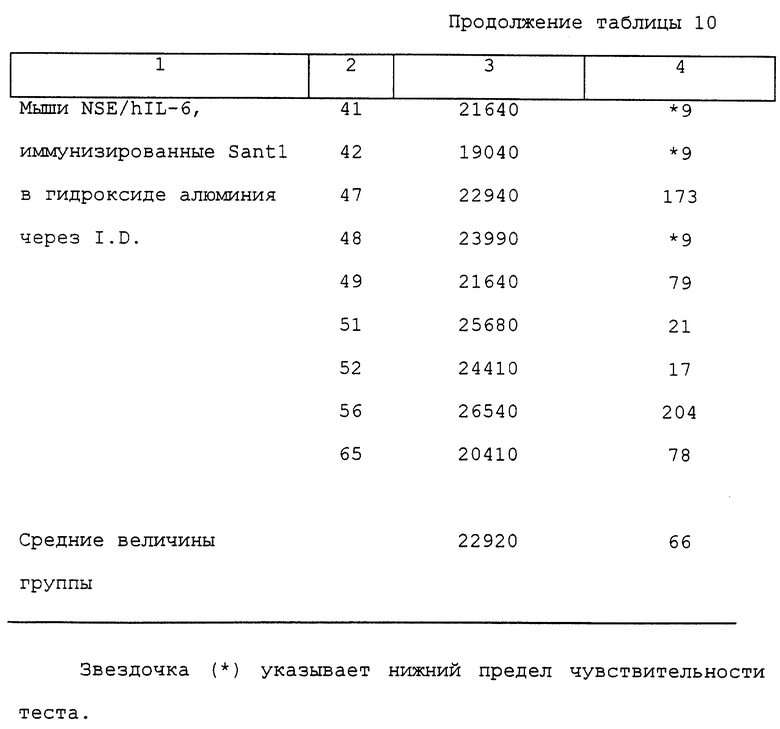
Также и в этом случае проводили исследования для выяснения, способен ли перекрестно-реактивный иммунный ответ против hIL-6 дикого типа изменять уровни hIL-6 дикого типа, измеренные в сыворотке трансгенных мышей NSE/hIL-6, иммунизированных как Santl, так и hIL-6 дикого типа. Уровни hIL-6 измеряли, как описано в примере 3, как в предиммунной пробе, так и в третьей пробе обеих групп мышей. Результаты суммированы в таблице 10. Как можно видеть, вакцинация с использованием Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально, также вызывающая появление сильного гуморального ответа в виде образования антител, которые узнают как сам Santl, так и hIL-6 дикого типа, вызывает также среднее уменьшение приблизительно в 350 раз уровней hIL-6, которые могут быть обнаружены в сыворотке трансгенных мышей NSE/hIL-6. Напротив, иммунизация с использованием самого hIL-6, приготовленного в том же самом адъюванте, вызывала лишь маргинальное уменьшение (в 2,4 раза в сравнении с 350-кратным) уровней hIL-6, которое можно было обнаружить в сыворотке.
Пример 12
Антитела, выработанные в мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально, способны нейтрализовать биологическую активность wthIL-6 также и in vivo.
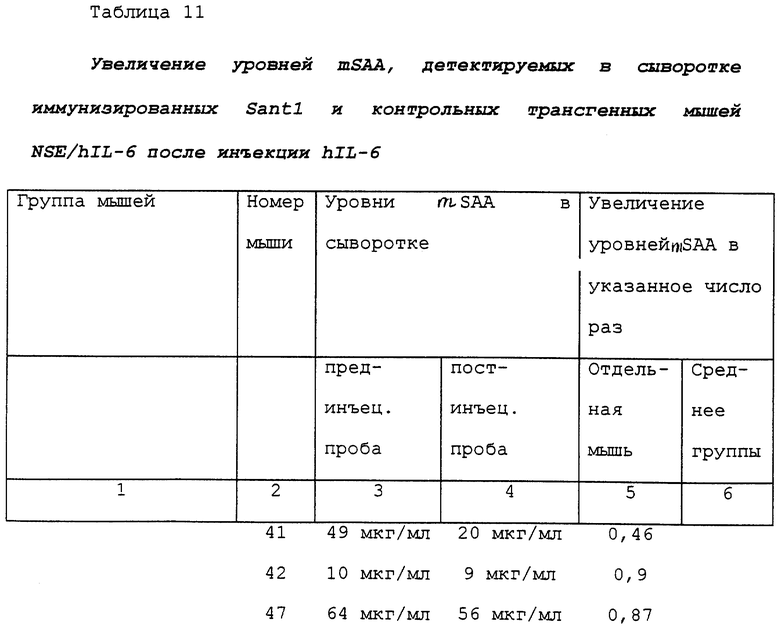
Целью было испытание, способны ли также антитела, вырабатываемые трансгенными мышами NSE/hIL-6, вакцинированными Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально, нейтрализовать одну из биологических активностей hIL-6 дикого типа in vivo, т.е. увеличение уровней мышиного SAA (mSAA), нормально индуцируемое в мышах инъекцией hIL-6, как описано в примере 4. Эксперимент проводили, как описано в примере 4, на мышах NSE/hIL-6, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально. Полученные величины сравнивали с контрольными неиммунизированными мышами экспериментов, описанных в примерах 4 (таблица 3) и 8 (таблица 7). Результаты суммированы в таблице 11. Как можно видеть, независимо от вариаций между отдельными животными, в среднем опять 7-кратное увеличение уровней SAA, индуцируемое инъекций hIL-6 в неиммунизированных мышах, отсутствовало в мышах, вакцинированных Santl, приготовленным в гидроксиде алюминия и инъецированным интрадермально.
Таким образом, вакцинация Santl, проводимая с адъювантом и путем введения, совместимыми с использованием для человека, а также вызывающая появление сильного гуморального ответа в виде образования антител, которые узнают как сам Santl, так и wthIL-6 и которые способны нейтрализовать биологическую активность wthIL-6 in vitro на клетках гепатомы человека, предотвращает in vivo увеличение уровней mSAA, индуцируемое инъекцией hIL-6, другими словами, нейтрализует биологическую активность hIL-6 in vivo.





Изобретение относится к области медицины и касается применения мутеина интерлейкина-6 (IL-6) человека для предотвращения патологического состояния, вызванного избыточной продукцией IL-6. Сущность изобретения состоит в использовании мутеинов специфического цитокина дикого типа, являющихся также антагонистами рецептора последнего, в качестве иммуногенов для индуцирования образования антител, направленных против этого цитокина дикого типа и способных нейтрализовать его, в заболеваниях, вызываемых его избыточным синтезом. Преимущество изобретения заключается в предотвращении состояний, связанных с избыточной продукцией IL-6. 2 с. и 9 з.п. ф-лы, 11 табл., 6 ил.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Экономайзер | 0 |
|
SU94A1 |
| Экономайзер | 0 |
|
SU94A1 |
| LEEBEEK et al. | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Biol | |||
| chem | |||
| , 1992, v.267, № 21, pp | |||
| Упругий буферно-тяговой аппарат для вагонов со сквозной упряжью | 1929 |
|
SU14832A1 |
Авторы
Даты
2002-05-10—Публикация
1996-08-22—Подача