Изобретение относится к медицине, в частности к иммунологии, и может быть использовано в клинической практике как метод стимулирующего воздействия на биологические процессы, протекающие в клетках и тканях.
Способность лимфоцитов участвовать в осуществлении иммунных реакций в организме определяется уровнем их функциональной активности, которая оценивается по спонтанной и митоген-индуцированной пролиферации лимфоцитов.
Известен способ стимуляции функциональной активности лимфоцитов переменным магнитным полем с частотой 100 Гц и индукцией магнитного поля 50х10-3 Тл и 1 Тл, действующим на клетки селезенки in vitro в течение 30 и 60 минут (Н. Е. Щебникова, А.С. Соловьев - Тезисы доклада. Материалы Международной конференции "Экология и жизнь - 2000". Великий Новгород, 2000, с. 57).
В последние годы в клинической практике начали широко использовать плазменные потоки. В качестве плазмообразующего газа используется гелий или аргон. Поток низкотемпературной плазмы используется при лечении трофических язв, рожистого воспаления, поверхностных гнойных и ожоговых ран. Положительный эффект плазмы связывают с усилением восстановительных процессов в ранах. Важную роль в восстановительных процессах играют клетки иммунной системы (Бабаева А.Г. Кроветворные и лимфоидные органы. //Структурные основы адаптации и компенсации нарушенных функций /Под редакцией Д.С. Саркисова. - М.: Медицина, 1987. - С.328-342).
Сущность способа повышения функциональной активности лимфоцитов заключается в том, что клетки селезенки помещают в среду RPMI-1640, дополнительно содержащую 5% инактивированную человеческую сыворотку 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Hepes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина, и подвергают воздействию гелиевой плазмы, полученной при силе тока 30 А, напряжении 20 В и расходе газа 2 л/мин. Воздействие осуществляют в течение 20 секунд с расстояния 20 см от сопла плазмотрона.
Такие оптимальные параметры были нами установлены в предварительных опытах. Другие параметры расхода газа, силы тока и напряжения, а также расстояния от сопла плазмотрона до объекта и время воздействия либо не изменяло функциональную активность лимфоцитов, либо оказывало супрессирующее действие. Добавки к среде RPMI-1640 обеспечивали жизнеспособность лимфоцитов. Соотношение компонентов являлось оптимальным.
Гелиевая плазма обеспечивает более быстрое усиление митоген-индуцированной пролиферации лимфоцитов по сравнению с действием аргоновой плазмы При действии гелиевой плазмы повышается и спонтанная пролиферация лимфоцитов, тогда как аргоновая плазма, действующая на клетки селезенки, приводит к угнетению спонтанной пролиферации лимфоцитов.
Способ осуществляется следующим образом.
В качестве источника лимфоцитов используют клетки селезенки мышей-гибридов (СВА х C57B1/6)F1, полученных из питомника АМН "Столбовая". Забор лимфоидных органов производят с соблюдением правил асептики и антисептики. Мышей забивают путем цервикальной дислокации. Доноров лимфоидных клеток после забоя обрабатывают 2% раствором хлорамина, а затем 96o этиловым спиртом. Стерильно извлекают селезенку, очищают от жировой и соединительной ткани, помешают в охлажденную среду 199 и тщательно раздавливают в стеклянном гомогенизаторе. Взвесь лимфоцитов фильтруют через мелкоячеистый капрон, центрифугируют в течение 7 мин при 1000 об/мин, сливают супернатант, осадок ресуспендируют в необходимом объеме среды RPMI-1640, дополненной 5% инактивированной человеческой сывороткой 4 группы, 2 мМ 1-глютамина, 2 мМ буфера Hepes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина. Жизнеспособность лимфоцитов определяют в камере Горяева в смеси 0,1% растворов трипанового синего и эозина.
Под световым микроскопом МБИ-3 подсчитывают число живых лимфоцитов. Мертвых клеток должно быть не более 8-10%.
В опытах используют плазменную установку СУПР-М и физиотерапевтический плазмотрон. 20х106 исследуемых клеток селезенки вносят в пластиковые флаконы в объеме 1 мл среды RPMI-1640, дополнительно содержащей 5% инактивированной человеческой сыворотки 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Hepes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина. Облучение лимфоцитов проводят гелиевой плазмой при силе тока 30 А, напряжении 20 В с расстояния 20 см от сопла плазмотрона.
Расход гелия составляет 2 л/ мин. Клетки селезенки подвергают воздействию плазменного потока в течение 20 секунд. Все манипуляции проводят на льду для исключения теплового эффекта.
Функциональную активность лимфоцитов оценивали по уровню их спонтанной и ФГА-индуцированной пролиферации в реакции бласттрансформации.
Реакцию бласттрансформации выполняют в микромодификации (Хоробрых В.В. и др. , 1983). Разведение митогена ФГА (Difko) готовят в среде RPMI-1640. Опимальную концентрацию митогена определяют в предварительных опытах. Она составила 31 мкг/мл среды культивирования. 5х105 исследуемых клеток селезенки вносят в лунки микропластин (Linbro) в объеме 100 мкл и добавляют к ним 100 мкл митогена или среды RPMI-1640. Микропластины инкубируют в термостате при 37oС в течение 72 часов в атмосфере с содержанием 5% СО2.
За 16 часов до окончания инкубации в лунки вносят 1 мк Ku 3Н-тимидина в объеме 50 мкл среды RPMI-1640. Затем с помощью 12-канального устройства пробы переносят на фильтры (Сынпор-3, Чехия), последовательно промывают лунки физиологическим раствором, 5%-ной трихлоруксусной кислотой и 96o спиртом.
Фильтры высушивают, помещают в сцинтилляционную жидкость ЖС-8 и регистрируют число импульсов в минуту на бета-спектрометре.
Для статистической обработки полученных результатов применяли параметрический метод определения достоверности с вычислением t-критерия Стьюдента.
Пример 1.
В опыт были взяты 3 самца-гибрида (СВА х C57B1/6)F1. Мыши забиты путем цервикальной дислокации, стерильно извлечены селезенки. Взвесь лимфоцитов профильтровали через мелкоячеистый капрон, центрифугировали при 1000 оборотах/мин в течение 7 минут. Затем слили супернатант и осадок ресуспендировали в 2 мл среды RPMI-1640, дополненной 5% инактивированной человеческой сывороткой 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Hepes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина. Жизнеспособность лимфоцитов определяли в камере Горяева в смеси 0,1% растворов трипанового синего и эозина 20х106 клеток селезенки вносили в пластиковые флаконы в объеме 1 мл среды RPMI-1640, дополненной 5% инактивированной человеческой сывороткой 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Hepes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина. Лимфоциты подвергали воздействию гелиевой плазмы, полученной при силе тока 30 А, напряжении 20 В и расходе газа 2 л/мин. Воздействие на лимфоциты осуществляли в течение 20 секунд с расстояния 20 см от сопла плазмотрона. Контролем явились клетки селезенки, не подвергавшиеся воздействию гелиевой плазмы Все манипуляции проводили на льду для исключения теплового эффекта 5х105 исследуемых клеток селезенки внесли в лунки микропластин (Linbro) в обьме 100 мкл и добавили к ним 100 мкл митогена ФГА или среды RPMI-1640. Регистрацию клеточного ответа осуществляли по включению 3Н-тимидина в ДНК пролиферируюших клеток.
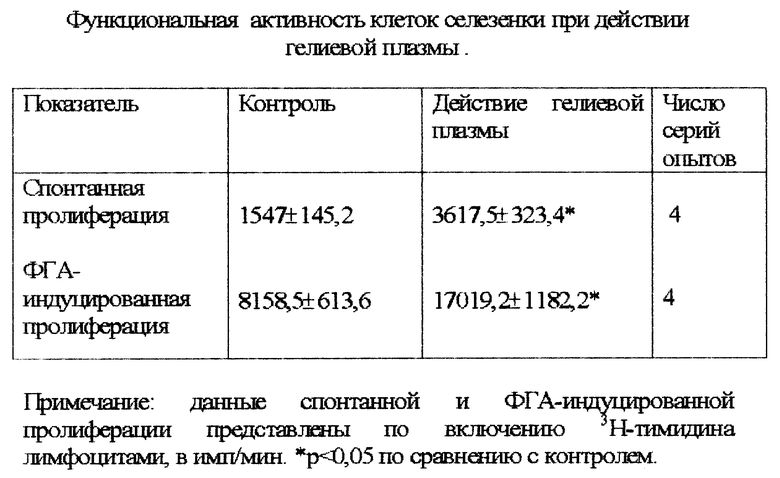
Эксперименты показали, что облучение клеток селезенки гелиевой плазмой в течение 20 секунд приводило к повышению спонтанной и ФГА-индуцированной пролиферации лимфоцитов (таблица).
Испытание способа проводили на 12 самцах-гибридах (СВАхС57В1/6)F1. В каждой серии опытов клетки селезенки пулировали от 3-4 животных 20х106 клеток селезенки вносили в пластиковые флаконы в объеме 1 мл среды RPMI-1640, дополненной 5% инактивированной человеческой сывороткой 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Hеpes, 5х10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина.
Выделяли следующие группы:
1. Контрольная группа - клетки селезенки, не подвергавшиеся воздействию гелиевой плазмы.
2. Подопытная группа - клетки селезенки, подвергавшиеся воздействию гелиевой плазмы в течение 20 секунд.
После облучения изучали функциональную активность лимфоцитов в реакции бласттрансформации. Проведенные исследования показали, что воздействие гелиевой плазмы на лимфоциты усиливает их спонтанную и ФГА-индуцированную пролиферацию.
Результаты опытов представлены в таблице.
Использование предлагаемого способа стимуляции функциональной активности лимфоцитов обеспечивает следующие преимущества:
1. По сравнению с другими способами стимуляции функциональной активности лимфоцитов эффект достигается в результате очень короткого времени действия фактора (20 сек).
2. Способ позволяет локально воздействовать на функциональную активность лимфоцитов как в культуре клеток, так и в пределах целостного организма.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТИМУЛЯЦИИ ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ | 2000 |
|
RU2167196C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРИРОДНЫХ ЦИТОКИНОВ | 1999 |
|
RU2149643C1 |
| ИММУНОМОДУЛЯТОР | 2018 |
|
RU2691143C1 |
| ИММУНОМОДУЛЯТОР | 2019 |
|
RU2702114C1 |
| СПОСОБ ТЕРАПИИ ОСТРОЙ ПНЕВМОНИИ | 1995 |
|
RU2118159C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНДИЦИОННОЙ СРЕДЫ, ОБЛАДАЮЩЕЙ КОЛОНИЕСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2003 |
|
RU2270022C2 |
| СПОСОБ ТЕРАПИИ ПОЛЛИНОЗА | 1996 |
|
RU2139742C1 |
| СПОСОБ ТЕРАПИИ ХРОНИЧЕСКИХ ТОНЗИЛЛИТОВ И ФАРИНГИТОВ | 1996 |
|
RU2123362C1 |
| ИММУНОДЕПРЕССАНТ | 1989 |
|
RU2045265C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ТЕРАПИИ ПЕРЕИМПЛАНТИТА | 2001 |
|
RU2189805C1 |
Изобретение относится к медицине, в частности к иммунологии. Способ осуществляется путем воздействия гелиевой плазмы, полученной при силе тока 30 А, напряжении 20 В и расходе газа 2 л/мин, на клетки селезенки, помещенные в среду RPMI-1640. Среда дополнительно содержит 5% инактивированную человеческую сыворотку 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Нереs, 5•10-5 М 2-меркаптоэтанола и 50 мкг/мл гентамицина. Воздействие осуществляют в течение 20 с с расстояния 20 см от сопла плазмотрона. Способ позволяет локально воздействовать на функциональную активность лимфоцитов как в культуре клеток, так и в пределах целостного организма, при этом эффект достигается за короткое время. Способ может быть использован в клинической практике как метод стимулирующего воздействия на биологические процессы, протекающие в клетках и тканях. 1 табл.
Способ повышения функциональной активности лимфоцитов, находящихся в среде RPMI-1640, дополнительно содержащей 5% инактивированную человеческую сыворотку 4 группы, 2 мМ 1-глютамина, 10 мМ буфера Нереs, 5•10-5 М 2-меркаптоэтанола, 50 мкг/мл гентамицина, путем воздействия физическим фактором, отличающийся тем, что в качестве физического фактора используют гелиевую плазму, полученную при силе тока 30 А, напряжении 20 В и расходе газа 2 л/мин, и осуществляют воздействие на лимфоциты в течение 20 с с расстояния 20 см от сопла плазмотрона.
| СПОСОБ ЛЕЧЕНИЯ ТРОФИЧЕСКИХ ЯЗВ | 1993 |
|
RU2067010C1 |
| СПОСОБ ПОДГОТОВКИ ТРАНСПЛАНТАТА ДЛЯ СВОБОДНОЙ АУТОДЕРМОПЛАСТИКИ ОЖОГОВОЙ РАНЫ | 1996 |
|
RU2134134C1 |
| RU 94023932, 27.06.1996. | |||
Авторы
Даты
2002-05-20—Публикация
2000-12-09—Подача