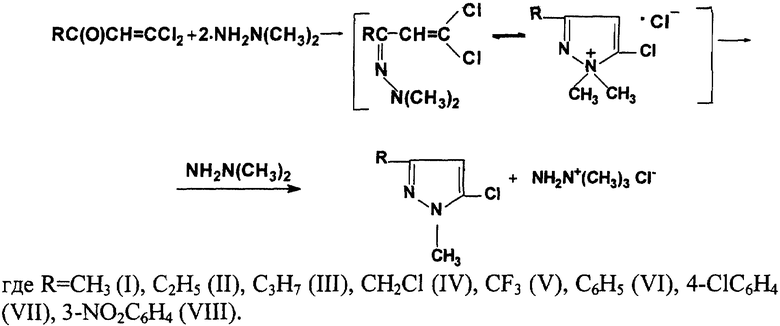
Изобретение относится к производным 1-метил-5-хлорпиразола формулы
где R= СН3 (I), С2Н5 (II), С3Н7 (III), CH2Cl (IV), СF3 (V), С6H5 (VI), 4-СlС6Н4 (VII), 3-N02С6Н4 (VIII),
и способу их получения.
1-Метил-3-алкил-, арил-, хлоралкил-, перфторалкил-5-хлорпиразолы перспективны для создания медицинских препаратов, красителей, флуоресцентов [Химическая энциклопедия. Т. 3. С. 1034. Москва. Б. Росс. Энциклопедия 1992] , инсектицидов [Suzuki Fumio, Iwakawa Isato Toshiaki, Igeei Takachi, Oguchi Tosihiko. Jp. Kokai. Tokyo Koho Jp. 06, 56,792 [94 56,792] С.А. 122 31573f], инсектоакарицидов [А.Ф.Гранов. Успехи химии. 1999. Т. 68. 8. С. 773-784; A. Pawer, A.A. Patil. Indian J. Chem. 1994. 33В, Р. 156], и перспективных биологически активных соединений [D.E. Butler, Н.А. De Ward. J.Org.Chem. 1971. V. 36. Р. 2542-2547; Nazarinia M., Sharifian A., Shafiee A. J. Heterocycl. Chem. 1995. 32(2), 223-5]. Так, например, 1,3-диметил-5-хлорпиразол является исходным продуктом для получения противоклещевого препарата нового поколения - фенпироксимата [А.Ф.Гранов. Успехи химии. 1999. Т. 68. 8. С. 773-784; A. Pawer, A. A. Patil. Indian J. Chem. 1994. 33В. 156 (1994)]. 1-Метил-3-алкил-5-хлорпиразолы используются для получения ряда пиразолодиазоцинов, пиразолодиазепинов - соединений с антидепрессантной и др. активностью или полупродуктов для их получения [US 3823157 А (Н.А. De Wald, С. Road, A. Arbor et al. ) 09.06.1974] , [DE 2423642 С (Parke Davis & CO)]. 1-Метил-3-алкил-5-хлорпиразолы вовлекаются в реакции ацилирования с целью получения 4-ацильных производных, входящих в состав фунгицидных композиций [RU 2072991 С1 (Рон-Пуленк Агрошими), 10.02.1977].
В литературе известны из данного ряда заявляемых соединений 3-метил-, 3-этил-, 3-пропил-, 3-изопропил-, 3-бутил- и 3-фенил-1-метил-5-хлорпиразолы и известно четыре способа их получения [Химическая энциклопедия. Т. 3, С. 1034. Москва: Б. Росс. Энциклопедия 1992; А. Michaelis, H. Dorn. Ber. 1907. В. 23. Р. 179; Liebigs Ann. Chem. 1907. В. 352. Р. 169; K.Auwers, F.Niemyer. J. Prakt. Chem., 1925, В. 110. Р. 153; C.L.Habraken, J.A.Moove. J.Org.Chem. 1965. V. 30. P. 1892-1896; D.E. Butler, Н.А. De Ward. J.Org.Chem. 1971. V. 36. P. 2542-2547; M.J. Fray, D.J. Bull, К. Cooper, MJ. Parry, M.H. Stefaniak. J. Med. Chem. 1995. V. 38. N 18. Р. 3524-3535].
Способ 1. 3-Метил- и 3-фенил-1-метил-5-хлорпиразолы получены в результате двухстадийного процесса, на первой стадии которого проводят обработку соответствующих 3-метил-, 3-фенилпиразолонов-5 хлорокисью фосфора в бензоле при 140-200oС в течение 10 часов в запаянной трубке с целью получения 3-метил(фенил)-5-хлорпиразолов. На второй стадии полученные хлорпиразолы последовательно обрабатывают йодистым метилом (4 часа, в запаянной трубке при 100oС) и щелочью и выделяют 5-хлор-1-метил-3-метил или 3-фенилпиразолы с низкими выходами [А. Michaelis, H. Dorn. Ber. 1907. В. 23. Р. 179; Liebigs Ann. Chem. 1907. В. 352. Р. 169; K.Auwers, F.Niemyer. J. Prakt. Chem., 1925, В. 110. Р. 153].
Способ 2. 3-Метил- и 3-фенилпиразолоны-5 на первой стадии вводят в реакцию с йодистым метилом при длительном нагревании (8 часов, 100oС), а затем на второй стадии выделившиеся 1-метил-3-метил(фенил)пиразолоны-5 нагревают с хлорокисью фосфора при 160oС в течение 8 часов, выделяя целевые продукты с низким выходом и недостаточной степени чистоты. Для их очистки требуется двукратная перекристаллизация [A. Michaelis, H. Dorn. Ber. 1907. В. 23. Р. 179; Liebigs Ann. Chem. 1907. В. 352. Р. 169; K.Auwers, F.Niemyer. J. Prakt. Chem., 1925, B. 110. P. 153].
Наиболее близкими к заявляемому способу являются способы 3 и 4.
Способ 3. На первой стадии вводят в реакцию ацил- или бензоилуксусные эфиры с метилгидразином и образующиеся при этом пиразолоны-5 обрабатывают хлорокисью фосфора, выделяя целевые продукты с примесью изомеров и низким выходом [A. Michaelis, H. Dorn. Ber. 1907. В. 23. Р. 179; Liebigs Ann. Chem. 1907. В. 352. 169; K.Auwers, F.Niemyer. J. Prakt. Chem., 1925, В. 110. Р. 153; C. L. Habraken, J.A.Moove. J.Org.Chem. 1965. V. 30. P. 1892-1896; M.J. Fray, D.J. Bull, K. Cooper, M.J. Parry, M.H. Stefaniak. J. Med. Chem. 1995. V. 38. N 18. Р. 3524-3535].
Способ 4. На первой стадии вводят в реакцию метиловые эфиры алкилацетиленкарбоновой кислоты с метилгидразином при низкой температуре (0oС) и образующиеся при этом 1,3-диалкилпиразолоны-5 кипятят с хлорокисью фосфора 24 часа [D.E. Butler, H.A. De Ward. J.Org.Chem. 1971. V. 36. Р. 2542-2547].
Основными недостатками известных способов являются:
1. Ограниченная доступность 3-R-пиразолонов. В то время как 3-метил- и 3-фенилпиразолоны доступные продукты, их получение из гидразина и соответственно ацетоуксусного или бензоилуксусного эфира (получаются при взаимодействии этилового эфира уксусной кислоты и соответствующих галоидных ацилов в присутствии щелочных металлов - калия или натрия) освоено в промышленности, для получения пиразолонов с другими заместителями требуется разработка методов синтеза исходных веществ. Реакционные процессы получения ацилуксусных эфиров с участием хлорангидридов хлоруксусных кислот, в частности монохлоруксусной кислоты, этилацетата и щелочного металла не удается провести в разработанных условиях из-за участия в реакции связи C-Hа1 алкильного радикала. Для получения других исходных эфиров ацилацетатов из галоидных ацилов и этилацетата также следует разработать методические приемы.
2. В то же время 1-метил-3-R-пиразолоны-5 при реакции метилгидразина с ацилуксусными эфирами получаются с низким выходом и неоднородного изомерного состава.
3. Также следует подчеркнуть, что получение 1-метил-3-алкилпиразолонов-5 (II, III) реакцией метилгидразина с метиловыми эфирами алкилацетиленкарбоновых кислот ограниченно доступностью алкилацетиленовых кислот.
4. Многостадийность процесса. На первой стадии синтезируется соответствующий ацилуксусный эфир или эфир алкилацетиленкарбоновой кислоты, на их основе - пиразолон, затем в результате последующих преобразований (две стадии в методах 1 и 2 и одна в методах 3 и 4 синтезируют целевые продукты: а) действуя последовательно хлорирующим затем метилирующим агентом (йодистым метилом, диметилсульфатом и др.) и основанием; б) метилируют пиразолон, а затем продукт обрабатывают хлорокисью фосфора, выделяя 5-хлор-1-метил-3-метил- или 3-фенилпиразолы с низким выходом; в) реакцией метиловых эфиров алкилацетиленкарбоновых кислот или ацилуксусных эфиров с метилгидразином получают 1-метил-3-алкилпиразолон, на который действуют хлорирующим агентом.
5. Сложное оборудование. Для получения хлорпиразола требуется специальная аппаратура поскольку, применяющаяся в реакционном процессе хлорокись фосфора является агрессивным, токсическим, высоколетучим низкокипящим соединением, а для протекания процесса хлорирования требуется высокая температура и повышенное давление.
6. Высокая энергоемкость процесса. Длительное время всех реакционных стадий, осуществляемых при нагревании, приводит к большим затратам энергии и времени.
7. Кроме того, для синтеза целевых пиразолов требуется выделение чистых полупродуктов на каждой стадии, что существенно повышает материалоемкость, энергоемкость и трудоемкость процесса.
8. И, наконец, не исключается возможность получения разных изомеров, а именно 1-метил-3-R-5-хлорпиразолов и 1-метил-3-хлор-5-R-пиразолов при метилировании 3-метил(фенил)-5-хлорпиразолов метилирующими агентами.
Таким образом, в литературе описаны 1-метил-3-метил-, 3-этил-, 3-пропил-, 3-изопропил-, бутил- и 3-фенил-5-хлорпиразолы. Однако для 1-метил-3-этил-, 3-пропил- и 3-бутил-5-хлорпиразолов приведены лишь температуры кипения, а для 1-метил-3-изопропил-5-хлорпиразола только данные спектра ПМР. Другие физико-химические показатели, подтверждающие их строение, не были известны.
Известные способы получения этих важных в практическом отношении 5-хлорпиразолов непригодны для крупномасштабного и промышленного осуществления вследствие их сложности, многостадийности, малого выхода конечных продуктов и сложности их очистки.
Цель изобретения:
1. Создание новых производных 1-метил-5-хлорпиразолов, перспективных биологически активных веществ.
2. Создание нового оригинального технологичного, одностадийного, основанного на доступных продуктах способа получения 5-хлор-1-метил-3-алкил-, арил-, хлоралкил-, перфторалкилпиразолов.
3. Улучшение охраны окружающей среды за счет исключения из процесса синтеза целевых продуктов агрессивных реагентов, температуры и давления; за счет использования в процессе, а следовательно, утилизации крупнотоннажного отхода промышленности - 1,1-диметилгидразина.
Поставленная цель достигается тем, что алкил-, арил-, хлоралкил-, перфторалкил-2,2-дихлорвинилкетоны вводят в реакцию с диметилгидразином в среде органического растворителя: гексана, бензола, низшего спирта, эфира или ацетонитрила, в соотношении 1:2. Процесс проводят при комнатной температуре. После окончания экзотермической реакции выделение целевых продуктов проводят известными приемами.
Химизм процесса представлен на схеме в конце текста.
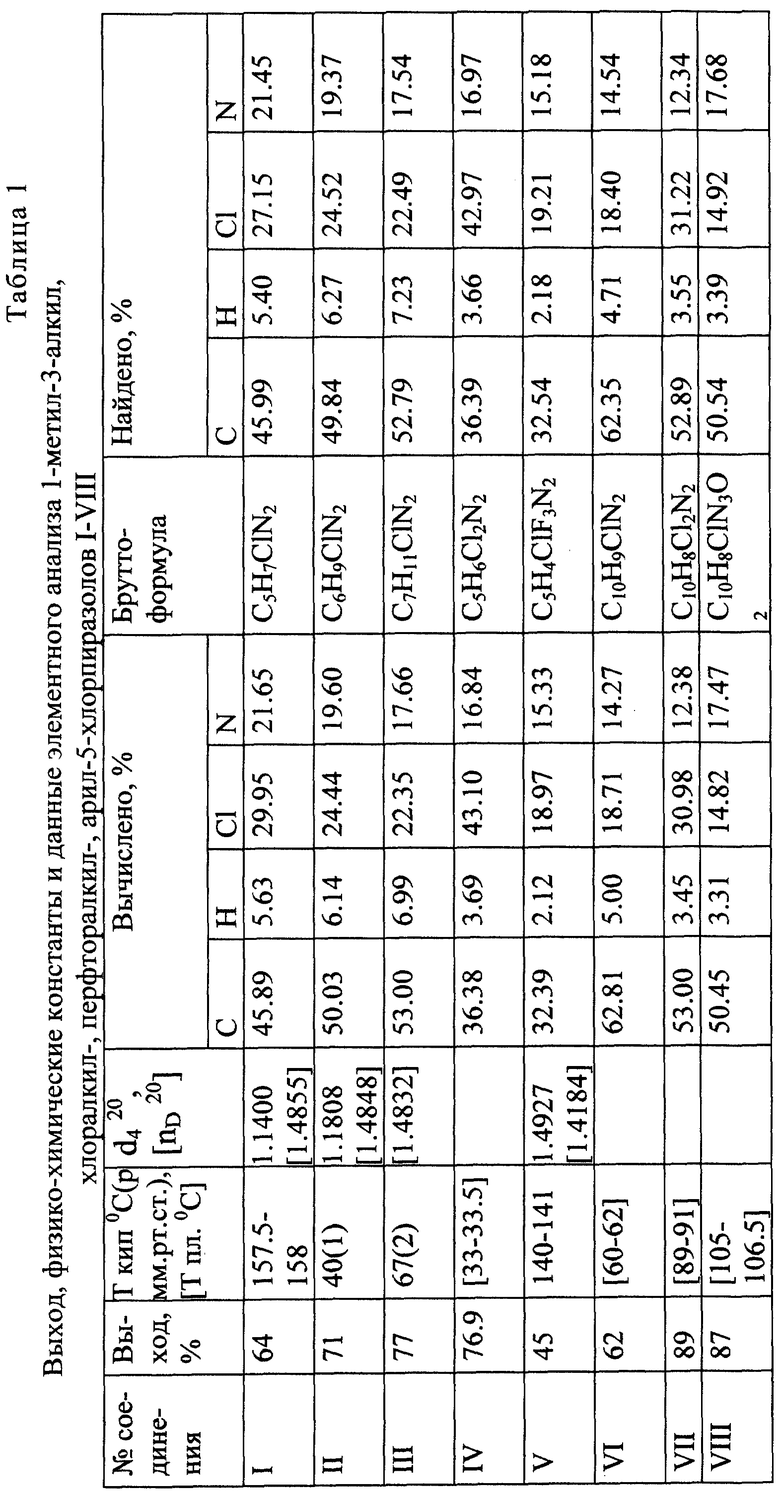
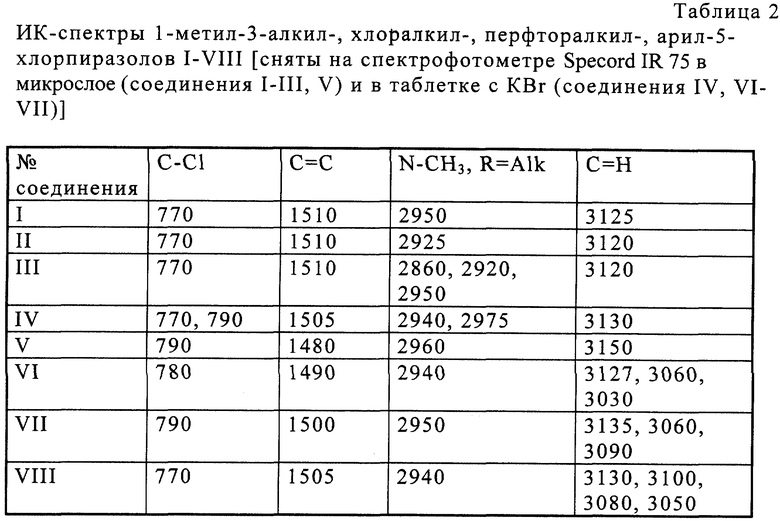
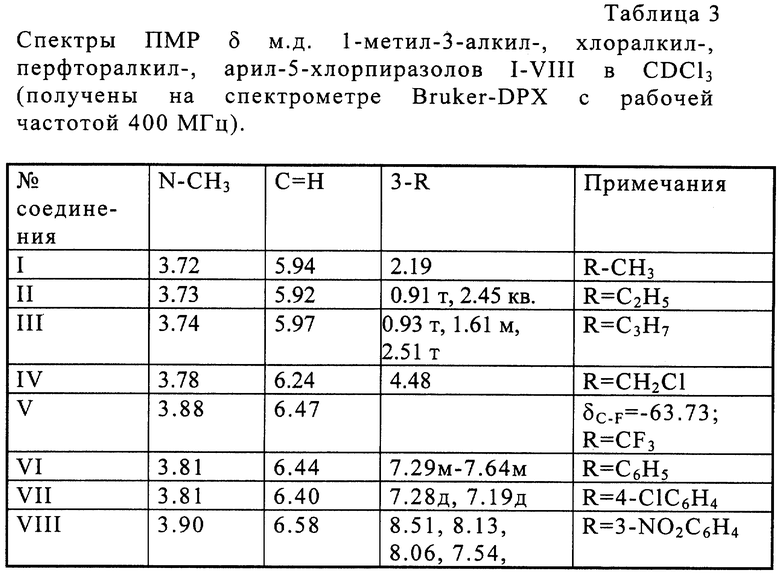
В результате осуществления процесса получены 1-метил-3-алкил-, хлоралкил-, перфторалкил-, арил-5-хлорпиразолы I-VIII со стабильным высоким выходом. Строение пиразолов доказано физико-химическими методами и подтверждено элементным анализом. Физико-химические данные пиразолов I-VIII приведены в таблицах 1-3, т. пл. и т кип. пиразолов I и VI соответствуют литературным данным.
Изобретение иллюстрируется следующими примерами.
Пример 1. 1,3-Диметил-5-хлорпиразол (I).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл сухого гексана. К раствору медленно прикапывают 13.9 г (0.1 г-моля) 4,4-дихлорбут-3-ен-2-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 1-2 часа. Выпавший в осадок триметилгидразинийхлорид отфильтровывают и сушат в вакууме над Р2О5. Выход соли 9.68 г (87.5%). Т пл. 261-262oС.
Найдено,%: С 32.58; Н 10.24; С1 31.97; N 25.37.
С3Н11СlN2.
Вычислено,%: С 32.58; Н 10.03; С1 32.06; N 25.33.
ИК-спектр (в КВr), см-1: 3200, 3100, 3005, 2700 (NH), 2950 (СН3), 1480, 1630 (C-N).
ПМР-спектр в СД3ОД, δ, м.д.: 3.41 (NСН3).
Из фильтрата перегонкой получают с выходом 8.36 г (64%) целевого пиразола I. Т. кип. 156-157.5oС (лит. : т. кип. 158oС, nD 17.6=1.4841, d4 17.6= 1.1367: K.Auwers, F.Niemyer. J. Prakt. Chem., 1925, В. 110. Р. 153; т. кип. 153-155oС: C. L. Habraken, J.A.Moove. J. Org. Chem. 1965. V. 30. Р. 1892-1896).
При проведении реакции N,N-диметилгидразина с метил-2,2-дихлорвинилкетоном при соотношении реагентов 2:1 в бензоле, эфире, ацетонитриле, низших спиртах - метаноле, этаноле, изопропаноле - в аналогичных условиях также получен пиразол (I) с выходом 63-68%.
Аналогично получены пиразолы II-VIII. Выход и физико-химические свойства целевых продуктов приведены в таблицах 1-3.
Пример 2. 1,3-Диметил-5-хлорпиразол (I).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл этанола. К раствору медленно прикапывают 13.9 г (0.1 г-моля) 4,4-дихлорбут-3-ен-2-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 1-12 часов. Спирт отгоняют в вакууме или упаривают. Остаток разбавляют эфиром и отмывают от триметилгидразинийхлорида водой. Эфирный раствор сушат и перегоняют. Получают с выходом 64% (8,40 г) целевой пиразол I.
Аналогично получены пиразолы II-VIII.
Пример 3. 1,3-Диметил-5-хлорпиразол (I).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл этанола. К раствору медленно прикапывают 13.9 г (0.1 г-моля) 4,4-дихлорбут-3-ен-2-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 0.5 часа. Спирт отгоняют в вакууме или упаривают. Остаток разбавляют эфиром и отмывают от триметилгидразинийхлорида водой. Эфирный раствор сушат и перегоняют. Получают с выходом 63% (8,39 г) целевой пиразол I.
Аналогично получены пиразолы II-VIII.
Пример 4. Получение 1-метил-3-фенил-5-хлорпиразола (VI).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл сухого эфира. К раствору медленно, не допуская перегревания реакционной массы, прикапывают 20.2 г (0.1 г-моля) 1-фенил-3,3-дихлорпроп-2-ен-1-она. При этом наблюдается саморазогревание и выпадение в осадок триметилгидразинийхлорида. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 0.5-2 часа. Выпавший в осадок триметилгидразинийхлорид отфильтровывают и сушат в вакууме над Р205. Выход соли 87%.
Из фильтрата после отгонки эфира выделяют целевой продукт. Дополнительную очистку его осуществляют перекристаллизацией из петролейного эфира или гексана. Выход 60% (5.46 г). Т. пл. 61-62oС (лит.: 60-62oС, A. Michaelis, H. Dorn. Ber. 1907. В. 23. Р. 169).
При проведении реакции N,N-диметилгидразина с фенил-2,2-дихлорвинилкетоном при соотношении реагентов 2:1 в бензоле, гексане, ацетонитриле, низших спиртах - метаноле, изопропаноле -в аналогичных условиях также получен пиразол VI с выходом 60-63%.
Аналогично получены пиразолы I-V, VII, VIII.
Пример 5. Получение 1-метил-3-фенил-5-хлорпиразола (VI).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл сухого эфира. К раствору медленно, не допуская перегревания реакционной массы, прикапывают 20.2 г (0.1 г-моля) 1-фенил-3,3-дихлорпроп-2-ен-1-она. При этом наблюдается саморазогревание и выпадение в осадок триметилгидразинийхлорида. После окончания экзотермической реакции смесь выдерживают 0.5 часа и выпавший в осадок триметилгидразинийхлорид отфильтровывают и сушат в вакууме над Р205. Выход соли 84%.
Из фильтрата после отгонки эфира выделяют целевой продукт. Дополнительную очистку его осуществляют перекристаллизацией из петролейного эфира или гексана. Выход 58% (5.5 г).
Аналогично при проведении процесса в течение 0.5 часа получены пиразолы II-V, VII, VIII.
Пример 6. Получение 1-метил-3-этил-5-хлорпиразола (II).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 7.54 г (0.125 г-моля) N,N-диметилгидразина в 50-100 мл метанола. К раствору медленно, не допуская перегревания реакционной массы, прикапывают 8.72 г (0.0627 г-моля) 4,4-дихлорпент-3-ен-2-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 0.5-2 часа. Растворитель удаляют в вакууме. Триметилгидразиний хлорид отделяют от целевого продукта, промывая остаток холодной водой и экстрагируя пиразол кипящим петролейным эфиром или гексаном. Выход соли 80%.
Органический раствор разгоняют. Выход пиразола II 71% (6.4 г). Т. кип. 186oС. [лит.: т. кип. 82-83oС (28 мм рт.ст.): D.E. Butler, H.A. De Ward. J. Org. Chem. 1971. V. 36. Р. 2542-2547); другие физико-химические характеристики в работе не приводятся).
При проведении реакции N,N-диметилгидразина с 4,4-дихлорпент-3-ен-2-оном при соотношении реагентов 2: 1 в эфире, бензоле, гексане, ацетонитриле, низших спиртах - этаноле, изопропаноле - в аналогичных условиях также получен пиразол (II) с выходом 60-73%.
Аналогично получены пиразолы I, III-VIII.
Пример 7. Получение 1-метил-3-пропил-5-хлорпиразола (III).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл изопропанола. К раствору медленно, не допуская перегревания реакционной массы, прикапывают 16.7 г (0.1 г-моля) 1,1-дихлоргекс-1-ен-3-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 0.5-2 часа. Растворитель удаляют в вакууме. Триметилгидразинийхлорид отделяют от целевого продукта, промывая осадок холодной водой или экстрагируя пиразол кипящим петролейным эфиром или гексаном. Выход соли 80%.
Выход пиразола 76.9% (13 г). Т. кип. 67oС (7 мм рт.ст.) [лит.: т. кип. 78-79oС (10 мм рт.ст.): D.E. Butler, H.A. De Ward. J.Org.Chem. 1971. V. 36. Р. 2542-2547); другие физико-химические характеристики в работе не приводятся).
Аналогично получены пиразолы I, II, IV-VIII.
При проведении реакции N,N-диметилгидразина с пропил-2,2-дихлорвинилкетоном при соотношении реагентов 2:1 в эфире, бензоле, гексане, ацетонитриле, низших спиртах - метаноле, этаноле - в аналогичных условиях также получен пиразол (III) с выходом 60-63%.
Пример 8. Получение 1-метил-3-хлорметил-5-хлорпиразола (IV).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 12.0 г (0.2 г-моля) N,N-диметилгидразина в 50-100 мл бензола. К раствору медленно, не допуская перегревания реакционной массы, прикапывают 17.3 г (0.1 г-моля) 1,4,4-трихлорбут-3-ен-2-она. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 0.5-2 часа. Выпавший в осадок триметилгидразинийхлорид отделяют от целевого продукта фильтрованием. Выход соли 80%. Фильтрат упаривают, осадок пиразола промывают холодной водой и перекристаллизовывают из петролейного эфира или гексана.
Выход пиразола 76.9% (13 г). Т. пл. 33-33.5oС.
Аналогично получены пиразолы I-III, V-VIII.
При проведении реакции N,N-диметилгидразина с хлорметил-2,2-дихлорвинилкетоном при соотношении реагентов 2:1 в эфире, гексане, ацетонитриле, низших спиртах - метаноле, этаноле, изопропаноле - в аналогичных условиях также получен пиразол IV с выходом 76-83%.
Пример 9. 1-Метил-3-трифторметил-5-хлорпиразол (V).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 7.44 г (0.1238 г-моля) N,N-диметилгидразина в 40-50 мл сухого ацетонитрила. К раствору медленно прикапывают 10.97 г (0.0619 г-моля) 1,1,1-трифтор-4,4-дихлорбут-3-ен-2-она. При этом наблюдается саморазогревание и выпадение в осадок триметилгидразиний хлорида. После окончания экзотермической реакции реакционную смесь выдерживают при перемешивании 1-2 часа. Выпавший в осадок триметилгидразинийхлорид отфильтровывали и сушили в вакууме над Р2О5. Выход соли 80%. Из фильтрата после отгонки растворителей выделяют с выходом 56,4% (5.46 г) целевой пиразол.
Аналогично получены пиразолы I-IV, VI-VIII.
При проведении реакции N,N-диметилгидразина с трифторметил-2,2-дихлорвинилкетоном при соотношении реагентов 2:1 в эфире, гексане, бензоле, низших спиртах - метаноле, этаноле, изопропаноле - в аналогичных условиях также получен пиразол (V) с выходом 58-60%.
Пример 10. 1-Метил-3-(4-хлорфенил)-5-хлорпиразол (VII).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 4.6 г (0.02 г-моля) 4-хлорфенил-2,2-дихлорвинилкетона в 50 мл сухого эфира, к раствору добавляют 2.4 г (0.04 г-моля) N, N-диметилгидразина. После окончания экзотермической реакции смесь перемешивают еще 2 часа. Выпавший в осадок триметилгидразинийхлорид отфильтровывают и сушат над Р2O5. Выход соли 80%. Из фильтрата после отгонки растворителя выделяют с выходом 89% (3.9 г) целевого пиразола.
Аналогично получены пиразолы I-VI, VIII.
При проведении реакции 4-хлорфенил-2,2-дихлорвинилкетона с N,N-диметилгидразином при соотношении реагентов 2:1 в ацетонитриле, гексане, бензоле, низших спиртах - метаноле, этаноле, изопропаноле - в аналогичных условиях также получен пиразол (VII) с выходом 86-92%.
Пример 11. 1-Метил-3-(3-нитрофенил)-5-хлорпиразол (VIII).
В трехгорлой колбе, снабженной мешалкой, обратным холодильником и капельной воронкой, растворяют 4.8 г (0.02 г-моля) 3-нитрофенил-2,2-дихлорвинилкетона в 50 мл сухого эфира, к раствору добавляют 2.4 г (0.04 г-моля) N,N-диметилгидразина. После окончания экзотермической реакции смесь перемешивают еще 2 часа. Выпавший в осадок триметилгидразинийхлорид отфильтровывают и сушат над Р2О5. Выход соли 86%. Из фильтрата после отгонки растворителя выделяют с выходом 87% (4.0 г) целевого пиразола.
Аналогично получены пиразолы I-VII.
При проведении реакции 3-нитрофенил-2,2-дихлорвинилкетона с N,N-диметилгидразином при соотношении реагентов 2:1 в ацетонитриле, гексане, бензоле, низших спиртах - метаноле, этаноле, изопропаноле - в аналогичных условиях также получен пиразол (VIII) с выходом 86-92%.
Таким образом, получены 1-метил-3-алкил-, арил-, хлоралкил-, перфторалкил-5-хлорпиразолы I-VIII, в том числе и неизвестные ранее (IV-VII, VIII) высокой степени чистоты и с хорошими выходами и разработан новый способ получения 1-метил-3-алкил-, арил-, перфторалкил- и хлоралкилпиразолов.
В Иркутском государственном медицинском университете исследована токсичность и биологическая активность 1-метил-3-(4-хлорфенил)-5-хлорпиразола (VII) (шифр ВМ-1-01), 1-метил-3-(3-нитрофенил)-5-хлорпиразола (VIII) (шифр ВМ-2-01), 1-метил-3-хлорметил-5-хлорпиразола (IV) (шифр ВМ-3-01) и 1-метил-3-трифторметил-5-хлорпиразола (V) (шифр ВМ-05-01). Испытания проводили на 11 музейных штаммах бактерий и бацилл. Высокую антибактериальную активность проявили препараты ВМ-2-01 в отношении P. mirabilis в дозе 4 мг и ВМ-3-01 в отношении Р. aeruginosa, В. subtilis, В. anthracoides.
Токсичность определяли при внутрижелудочном введении препаратов беспородным белым мышам массой 20-22 г. Наибольшую токсичность показало соединение ВМ-3-01, LD50 которого составила 400 мг/кг, что соответствует по квалификации второму классу токсичности вещества. Соединения ВМ-1-01 и ВМ-2-01 в этой дозе не токсичны, не токсичны они в дозе в 4 раза большей, что позволяет их отнести к малотоксичным соединениям. Точное значение дозы LD50 не было определено из-за недостаточного количества веществ.
Новые химические соединения - 1-метил-3-арил-, хлоралкил-, перфторалкил-5-хлорпиразолы (IV, V, VII, VIII) могут найти назначение как полупродукты для синтеза новых производных пиразола - технически ценных продуктов и биологически активных соединений, перспективных для создания антибактериальных средств.
Предложенный способ получения производных 1-метил-5-хлорпиразолов в одну стадию из 2,2-дихлорвинилалкил-, хлоралкил-, перфторалкил-, арилкетонов и N, N-диметилгидразина при мольном соотношении реагентов 1:2 является новым и существенно отличается от известных способов.
1. До настоящего времени 1,1-диметилгидразин не применялся для получения пиразолов. Известно, что при реакциях карбонильных соединений, в том числе и непредельных, с 1,1-диметилгидразоном получены соответствующие гидразоны [Ю. П.Китаев, Б.И.Бузыкин. Гидразоны. Москва: Наука, 1974].
2. При реакции 1,1-диметилгидразина с ближайшими аналогами 2,2-дихлорвинилкетонов - 2,2-дибромвинилфенил(тиенил)кетонами [В.Н.Елохина, А.С.Нахманович, Л. И.Ларина, О.В.Шишкин, В.Н.Баумер, В.А.Лопырев. Синтез 1-[1-бром-2-бензоил(2-теноил)винил] -1,1-диметилгидразинийбромидов из 1-бром-2-бензоил(2-теноил)ацетиленов и 1,1-диметилгидразина. Изв. РАН. Сер. хим. 1999. 8. Стр. 1536-1538] наблюдается образование четвертичной соли диметилгидразина - 1-[1-бром-2-бензоил(2-теноил)винил]-1,1-диметилгидразинийбромида.
3. Из известных свойств 2,2-дихлорвинилкетонов не следует со всей очевидностью, что их взаимодействие с диметилгидразином может привести к получению пиразолов. Известно, что монозамещенные гидразины (фенил-, 2,4-динитрофенилгидразин) при реакции с 2,2-дихлорвинилкетонами образуют продукты с участием только карбонильной группы кетона - соответствующие гидразоны [A. E. Pohland, W.R.Benson. β-Chlorovinylketones. Chemical Reviews. 1966. V. 66. N 2. 161-197; А.Н.Мирскова, Г.Г.Левковская, М.Г.Воронков. Изв. АН СССР. Сер. хим. 1981. Вып. 6. С. 1349-1353].
В результате осуществления предлагаемого изобретения достигаются следующие преимущества:
1. Получены новые химические соединения, производные 1-метил-5-хлорпиразола, перспективные биологически активные вещества и технически ценные продукты, полупродукты для их синтеза.
2. Предлагаемый способ прост в исполнении, не требует специального оборудования, давления, нагревания, дорогостоящих растворителей.
3. Выделение целевых продуктов высокой степени чистоты осуществляется легко, известными приемами.
4. Процесс стабилен и хорошо воспроизводится.
5. Процесс одностадиен.
6. Образующийся одновременно с целевыми продуктами триметилгидразинийхлорид - кристаллическая, водорастворимая четвертичная соль диметилгидразина, из которой диметилгидразин может быть регенерирован, в то же время триметилгидразинийхлорид может найти дальнейшее применение в других процессах, а также в сельском хозяйстве, поскольку является системным почвенным фунгицидом.
7. Способ основан на доступном сырье: 2,2-дихлорвинилкетонах, способ получения которых хорошо разработан и основан на промышленном крупнотоннажном сырье - хлористых ацилах, хлористом винилидене и алюминии хлористом - и позволяет получать алкил-, арил-, хлоралкил-, перфтордихлорвинилкетоны с хорошим выходом [А.С.Атавин, А.Н.Мирскова, Г.Г.Левковская. Ж ОрХ.1994. Т. 9. 3. С. 318-321; А.Е.Pohland, W.R. Benson. Chem. Reviews. 1966. V. 66. N 2. Р. 161-197].
8. Продукты образуются одного изомерного состава.
Таким образом, получен ряд новых производных 1-метил-5-хлорпиразолов и предложен новый одностадийный метод синтеза производных 1-метил-5-хлорпиразолов, основанный на доступном и крупнотоннажном промышленном сырье, не требующий применения специального оборудования, катализаторов, простой в исполнении, который может быть легко осуществлен в промышленном масштабе.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКОКСИКАРБОНИЛ-4-ГИДРОКСИ-2-МЕТИЛ-2Н-1,2-БЕНЗОТИАЗИН-1,1-ДИОКСИДОВ | 1993 |
|
RU2109738C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛ-5-ГЕПТЕН-2-ОНА | 1995 |
|
RU2078075C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТИЛ-1,4-НАФТОХИНОНА | 1990 |
|
RU2022958C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРАТА 3-(2,2,2-ТРИМЕТИЛГИДРАЗИНИЙ) ПРОПИОНАТА | 1995 |
|
RU2114822C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(4-ГИДРОКСИФЕНИЛ)ЭТАНОЛА | 1998 |
|
RU2151137C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАМЕТИЛСИЛАНА | 1993 |
|
RU2044739C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1-ПРОПЕНИЛ)АЦЕТАМИДА | 1998 |
|
RU2132326C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИГИДРАТА 1,1,1,5,5,5-ГЕКСАФТОРАЦЕТИЛАЦЕТОНА | 2009 |
|
RU2417212C1 |
| 3'-ФОСФАТ, N, P-НЕЗАЩИЩЕННЫЕ ФОСФОТИОАТНЫЕ ОЛИГОДЕЗОКСНУКЛЕОТИДЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ ФОСФОТИОАТНЫХ, ОЛИГОНУКЛЕОТИДНЫХ РЕАГЕНТОВ ДЛЯ БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ, ФОСФОТИОАТНЫЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ 3'- И/ИЛИ 5'-СВЯЗАННЫЕ ХИМИЧЕСКИЕ ГРУППИРОВКИ В КАЧЕСТВЕ ФОСФОТИОАТНЫХ ОЛИГОНУКЛЕОТИДНЫХ РЕАГЕНТОВ ДЛЯ БИОТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2069214C1 |
| ГИПОХОЛЕСТЕРИНЕМИЧЕСКОЕ СРЕДСТВО | 1992 |
|
RU2034540C1 |
Изобретение относится к новым производным 1-метил-5-хлорпиразола общей формулы, где R представляет CH2Cl, CF3, 4-CLC6H4, 3-NO2C6H4, которые проявляют антибактериальную активность. Кроме того, предложен способа получения производных 1-метил-5-хлорпиразола, в которых R представляет СН3, С2Н5, С3Н7, СН2Сl, СF3, С6Н5, 4-ClC6Н4, 3-NO2C6H4, путем взаимодействия соответствующего производного 2,2-дихлордивинилкетона формулы RC(O)CH=CCl2, где R имеет вышеуказанные значения, с диметилгидразином при их мольном соотношении 1: 2 соответственно в среде органического растворителя при комнатной температуре в течение 0,5-12 ч. Технический результат: получены простым одностадийным способом на основе доступного сырья производные 1-метил-5-хлорпиразола, в том числе и новые соединения, которые являются перспективными биологически активными веществами и техническим ценными продуктами для создания медицинских препаратов, красителей, инсектицидов. 2 c.п. ф-лы, 3 табл. 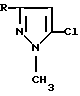
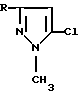
где R представляет CH2Cl, CF3, 4-СlC6H4, 3-NO2C6H4.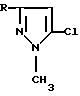
где R представляет СН3,С2Н5, С3Н7, СН2Сl,СF3, С6Н5, 4-СlC6Н4, 3-NO2C6H4, отличающийся тем, что соответствующее производное 2,2-дихлорвинилкетона формулы
RC(O)CH=CCl2,
где R имеет вышеуказанные значения,
подвергают взаимодействию с N,N-диметилгидразином при мольном соотношении 1: 2 соответственно в среде органического растворителя при комнатной температуре в течение 0,5 - 12 ч.
| DONALD E | |||
| BUTLER et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Chem., vl | |||
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| Способ очищения сырого кокаина | 1925 |
|
SU2542A1 |
| US 3823157 A, 09.06.1974, примеры 4-5, 7-8 | |||
| ПОДВЕСНОЕ УСТРОЙСТВО ДЛЯ КРЕПЛЕНИЯ МЕДИЦИНСКОГО УСТРОЙСТВА К ПО СУЩЕСТВУ ГОРИЗОНТАЛЬНОЙ ИЛИ К ПО СУЩЕСТВУ ВЕРТИКАЛЬНОЙ ОПОРНОЙ КОНСТРУКЦИИ | 2007 |
|
RU2423642C2 |
| ПРОИЗВОДНЫЕ 3-ФЕНИЛПИРАЗОЛА, СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ФЕНИЛПИРАЗОЛА И ФУНГИЦИДНАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2072991C1 |
| M.J | |||
| FRAY, D.J | |||
| BUIL, et | |||
| al, J | |||
| Med.Chem., 1995, v | |||
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
| ЯЩИК ДЛЯ УКЛАДКИ ЩЕТИНЫ ПО СОРТАМ | 1925 |
|
SU3524A1 |
| Abstr., v | |||
| Аппарат для радиометрической съемки | 1922 |
|
SU124A1 |
| СТАНОК ДЛЯ ЗАКАЛКИ ДЕТАЛЕЙ | 0 |
|
SU285944A1 |
Авторы
Даты
2002-08-10—Публикация
1999-11-11—Подача