Изобретение относится к ветеринарной вирусологии, касается способа индикации антигена (АГ) вируса чумы плотоядных (ВЧП) в клиническом материале и может быть использовано для экспресс-диагностики заболевания, вызываемого этим вирусом.
Чума плотоядных (ЧП) - остро протекающая высококонтагиозная болезнь плотоядных, характеризующаяся лихорадкой, острым катаром слизистых оболочек, пневмониями, кожной экзантемой и поражением нервной системы, многообразие форм проявления которой и зачастую стертая симптоматика затрудняют постановку диагноза. Для подтверждения последнего используют лабораторные способы исследования, направленные на выявление антигенов ВЧП.
Известны способы индикации вируса и вирусоспецифического АГ в клиническом материале с помощью реакций ИФ, ИФА, РСК и РДП (1). Однако одни из них (РСК и РДП) малочувствительны и позволяют выделять АГ преимущественно в органах больных животных, что исключает возможность их использования для ранней диагностики, другие (ИФ и ИФА) требуют специального оборудования и пока не нашли применения в ветеринарной лабораторной практике.
В качестве предпочтительного аналога нами рассматривается способ выявления ВЧП в реакции агглютинации латексных частиц, сенсибилизированных иммуноглобулинами к ВЧП, с использованием в качестве АГ фильтрата клинического материала после его последовательной обработки деионизированной водой и поверхностно-активным веществом, а в качестве контрольного препарата - несенсибилизированных латексных частиц с блокированными глицином функциональными группами (2). Известный способ прост в осуществлении, обеспечивает получение результатов в течение 4-5 часов, достаточно специфичен, но использование поверхностно-активного вещества на стадии предварительной обработки клинического материала снижает концентрацию вируса и вирусоспецифического АГ, что отрицательно сказывается на чувствительности способа.
Цель изобретения - повышение чувствительности при упрощении способа.
Поставленная цель достигается использованием в качестве второго компонента в реакции агглютинации латексных частиц, сенсибилизированных иммуноглобулинами к ВЧП, надосадка, полученного центрифугированием клинического материала после предварительного замораживания при температуре -10oС с последующим после размораживания разведением фосфатным буфером (рН 8,6-8,8) в соотношении 1:5 и центрифугированием.
Сущность способа поясняется примерами.
Пример 1. Отобранный клинический материал (фекалии или отделяемое носа и глаз) замораживают при -10oС, после размораживания разводят 0,01М фосфатным буфером с рН 8,6-8,8 в соотношениях 1:5 и 1:2 соответственно, центрифугируют при 3000-4000 об/мин. в течение 8-10 минут. Из надосадочной жидкости отбирают 25 мкл и титруют в 0,01М фосфатном буфере (рН 8,6-8,8) с двукратным шагом до 1:200. Надосадочную жидкость используют в качестве второго компонента в реакции агглютинации латексных частиц, сенсибилизированных иммуноглобулинами к ВЧП. Иммуноглобулины из сыворотки крови выделяют высаливанием насыщенным раствором сульфата аммония. Латексные частицы суспендируют в 0,015М фосфатном буфере (рН 7,8-8,2) до концентрации 0,2% и при постоянном помешивании по каплям добавляют препарат иммуноглобулинов из расчета 100 мкл на 1 мл суспензии латекса. Смесь инкубируют в течение 4 часов при комнатной температуре (+18-20oС) и в течение 18 часов в холодильнике при температуре +4oС при постоянном помешивании. Сенсибилизированный латекс отделяют от жидкой фазы центрифугированием при 3000g, двукратно отмывают 0,015М фосфатным буфером (рН 7,4-7,6). Свободные альдегидные группы на поверхности латексных частиц блокируют глицином путем инкубирования сенсибилизированного латексного препарата в 1%-ном растворе глицина в 0,015М фосфатном буфере (рН 7,4-7,6). Готовый препарат двукратно отмывают 0,015М фосфатным буфером и однократно бидистиллированной водой путем центрифугирования. Контроли: 1) латексные частицы, сенсибилизированные иммуноглобулинами, полученными из сыворотки крови здорового невакцинированного животного - в реакции агглютинации латекса (РАЛ) с клиническим материалом; 2) латексные частицы, сенсибилизированные иммуноглобулинами, полученными из сыворотки крови здорового невакцинированного животного - в РАЛ с 0,01М фосфатным буфером; 3) латексные частицы, сенсибилизированные иммуноглобулинами к ВЧП - в РАЛ с 0,01М фосфатным буфером.
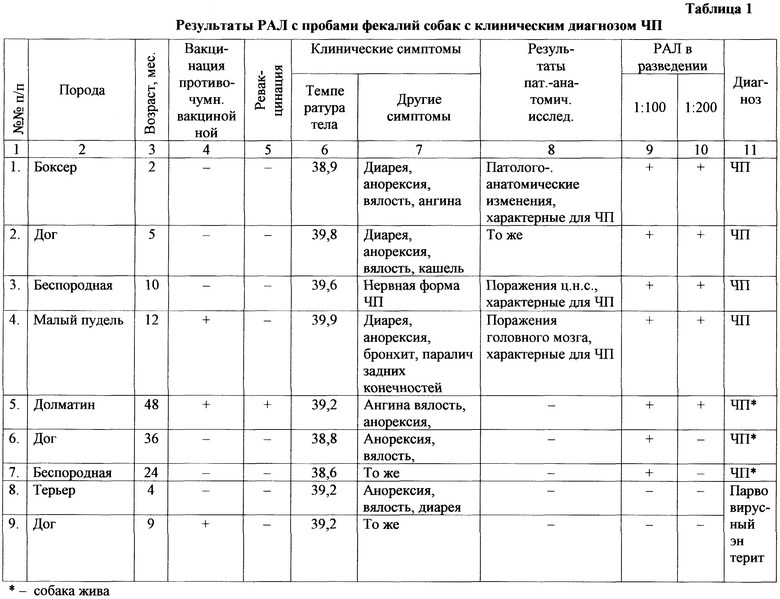
Пример 2. У 9 собак с клиническим диагнозом ЧП отбирают клинический материал - фекалии, которые исследуют в соответствии с предлагаемым способом, как в примере 1.
Результаты представлены в таблице 1.
Как видно из таблицы 1, в 7 случаях первоначальный диагноз ЧП подтверждается выявлением АГ ВЧП, а в 4 случаях - и характерной патолого-анатомической картиной. В 2 случаях диагноз не подтверждается выявлением АГ ВЧП. После уточнения диагноза в последних случаях (парвовирусный энтерит) и соответствующего лечения собаки выздоравливают.
Пример 3. У 30 клинически здоровых собак отбирают пробы фекалий, которые исследуют в соответствии с предлагаемым способом, как в примере 1.
Результаты представлены в таблице 2.
Как видно из таблицы 2, у 5 собак выявляют АГ ВЧП в разведении патологического материала 1:50, что указывает или на наличие субклинического течения заболевания, или на вирусоносительство у клинически здоровых собак. В течение месяца наблюдения 3 собаки из 5 заболевают выраженной формой ЧП.
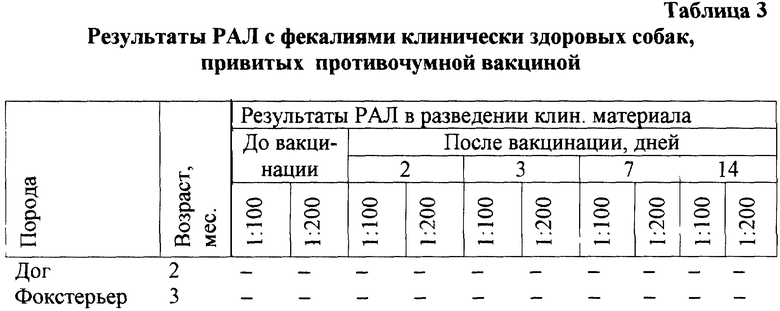
Пример 4. У 2 клинически здоровых собак, привитых противочумной вакциной ВНИИВВМ (штамм "ЭПМ"), серия 17, отбирают пробы фекалий, которые исследуют в соответствии с предлагаемым способом, как в примере 1.
Результаты представлены в таблице 3.
Как видно из таблицы 3, у клинически здоровых собак, привитых противочумной вакциной, в течение 2-недельного срока получен отрицательный результат РАЛ в обоих разведениях клинического материала.
Таким образом, приведенные примеры показывают, что предлагаемый способ позволяет эффективно диагностировать ЧП.
Наиболее существенным преимуществом предлагаемого способа АГ ВЧП является простота выполнения, минимум затрат рабочего времени и высокая частота выделения АГ.
Предлагаемый способ индикации АГ ВЧП отличается от известных тем, что экономически эффективен, прост в выполнении, обеспечивает высокую вероятность индикации АГ ВЧП в пробах клинического материала после замораживания-размораживания.
Источники информации
1. В.Н.Сюрин, А.Я.Самуйленко, В.В.Соловьев, Н.В.Фомина. Вирусные болезни животных. - М.: ВНИТИБП, 1998. - С.279-280.
2. А.Л.Лазовская, З.Г.Воробьева. Диагностика чумы плотоядных. //Ветеринария. - 1996. - 2. - С.53.

Изобретение может быть использовано в ветеринарной вирусологии для экспресс-диагностики чумы плотоядных. Способ представляет собой реакцию агглютинации латексных частиц, сенсибилизированных иммуноглобулинами к вирусу чумы плотоядных, где в качестве второго компонента реакции используют надосадок, полученный из клинического материала. Способ более прост и позволяет повысить вероятность индикации антигена вируса чумы плотоядных. 3 табл.
Способ индикации антигена вируса чумы плотоядных, включающий реакцию агглютинации латексных частиц, сенсибилизированных иммуноглобулинами к вирусу чумы плотоядных, где в качестве контрольного препарата используют латексные частицы, сенсибилизированные иммуноглобулинами здорового невакцинированного животного, отличающийся тем, что в качестве второго компонента реакции агглютинации латексных частиц используют надосадок, полученный после замораживания клинического материала при температуре -10oС с последующим после размораживания разведением фосфатным буфером (рН=8.6-8.8) в соотношении 1:1.5 и центрифугированием.
| RU 95101421, 20.03.1997 | |||
| СПОСОБ ПРОВЕДЕНИЯ ТОЧЕЧНОГО ТВЕРДОФАЗНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА АНТИГЕНА ВИРУСА ЧУМЫ ПЛОТОЯДНЫХ | 1993 |
|
RU2118823C1 |
| НАБОР ЭРИТРОЦИТАРНЫХ ДИАГНОСТИКУМОВ ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ К ВИРУСУ ЧУМЫ ПЛОТОЯДНЫХ В РЕАКЦИИ НЕПРЯМОЙ ГЕМАГГЛЮТИНАЦИИ | 1996 |
|
RU2119671C1 |
Авторы
Даты
2002-08-10—Публикация
2001-01-29—Подача