Изобретение относится к химии и химической технологии, а более конкретно к синтезу представителей нового класса макрогетероциклических соединений, тетраазааналогов хлорина, а именно β, β, β′, β′-тетраметилтриаренотетраазахлоринов.
Известен незамещенный тетраазахлорин (TAX) - дигидротетраазапорфин, в электронном спектре поглощения которого имеется интенсивная длинноволновая полоса при 678 нм [Е.А. Макарова, Г.В. Королева, Е.А. Лукьянец. Ж. общей химии, 69, 1356 (1999)]. Гидрирование β, β′-связи одного из пиррольных фрагментов тетраазапорфина (ТАП) приводит к батохромному смещению длинноволновой полосы на 60 нм без значительного изменения интенсивности. TAX устойчив к окислению на воздухе в твердом виде и в растворах в нейтральных органических растворителях как при комнатной температуре, так и при нагревании, в полярных же органических растворителях (ДМФА, пиридин) наблюдается его частичное окисление уже при комнатной температуре.
С целью получения TAX с более длинноволновым поглощением и более устойчивых к окислению по сравнению с незамещенным соединением нами синтезированы конденсированные аналоги TAX - β, β, β′, β′-тетраметилтриаренотетраазахлорины, производные TAX со стабилизированной путем исчерпывающего метилирования С-С-связью. Метод получения состоит в смешанной конденсации тетраметилсукцинонитрила (ТМСН), весьма доступного продукта термического разложения азоизобутиронитрила, с соответствующими фталогенами, прежде всего динитрилами ароматических о-дикарбоновых кислот, а также их ангидридами или имидами. Конденсированные аналоги TAX не описаны. Известно [J.A. Elvidge, R.P. Linstead. J. Chem. Soc., 1955, 3536; В. Н. Копраненков, А.М. Цыганкова, Е.А. Лукьянец. Анилинокрас. пром., 1979, вып. 5, стр.1], что при смешанной конденсации сукцинонитрила с фталонитрилом наряду с фталоцианином образуется трибензотетраазапорфин из-за неустойчивости образующегося в процессе синтеза трибензо-ТАХ к окислению.
Смешанная конденсация фталонитрила с ТМСН проводилась либо кипячением их смеси с солями металлов (NiCl2, CuCl, VCl3 и др.) в высококипящих органических растворителях (хинолин, сульфолан, диметиламиноэтанол, нитробензол и т. д. ), либо в растворах спиртов в присутствии соответствующего алкоголята лития. Показано, при кипячении фталонитрила и ТМСН (соотношение 1:1) в диметиламиноэтаноле в присутствии диметиламиноэтилата лития образуется с небольшим выходом (около 2%) β, β, β′, β′-тетраметилтрибензотетраазахлорин наряду с фталоцианином, который является основным продуктом реакции.
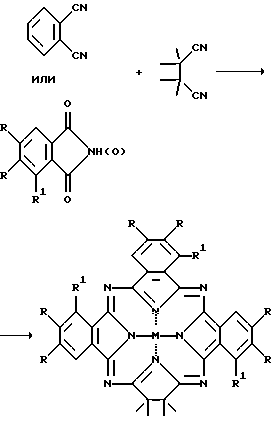
M = HН, Cu, Ni, VО;
R = R1 = H;
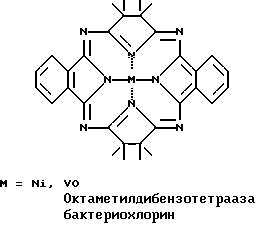
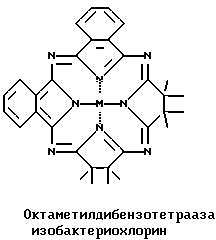
При взаимодействии эквимолярных количеств ТМСН и фталонитрила с VСl3 в кипящем хинолине образуется смесь VOPc и трех новых соединений: VO β, β, β′, β′-тетраметилтрибензо-ТАХ с выходом 15% и длинноволновым λмакс. 763 нм, VO октаметилдибензотетраазабактериохлорин с выходом ~1% и λмакс. 898 нм и VO октаметилдибензотетраазаизобактериохлорин с выходом ~1% и λмакс./ 721 нм, которые были разделены хроматографически на силикагеле.
Металлические комплексы тетраметилтрибензо-ТАХ образуются также при использовании в качестве фталогена других производных фталевой кислоты, а именно ангидрида или имида, в присутствии мочевины и в качестве растворителя хинолина или сульфолана. Соотношение ТМСН и фталогена составляет от 1:2 до 2:1.
Показано также, что при взаимодействии ТМСН с производными 2,3-нафталиндикарбоновой кислоты (ангидридом, имидом или их 1-фенилзамещенными аналогами) в кипящем хинолине или сульфолане в присутствии солей металлов (VCl3, NiCl2) и каталитического количества молибдата аммония образуется смесь соответствующих металлических комплексов 2,3-нафталоцианина и β, β, β′, β′-тетраметилтри-2,3-нафто-ТАХ (~ 8%) с λмакс. 871 нм для 1-фенилзамещенного VO комплекса и 819 нм для 1-фенилзамещенного Ni комплекса. Следует отметить, что в случае NiCl2 в электронном спектре реакционной смеси наблюдается полоса с λмакс. 900 нм, принадлежащая, по-видимому, Ni комплексу октаметилди-2,3-(1-фенилнафто)тетраазабактериохлорина, не выделенному, однако, в чистом виде.
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1.
Тетраметилсукцинонитрил (ТМСН).
Кипятят 10 г азоизобутиронитрила в 250 мл толуола. По окончании реакции реакционную массу охлаждают, разбавляют 300 мл гексана и оставляют на ночь в холодильнике. Выпавший осадок отфильтровывают, промывают гексаном, сушат на воздухе. Получают 7.5 г (87%) ТМСН с т. пл. 156-158oС (гексан).
β, β, β′, β′-Тетраметилтрибензотетраазахлорин.
Растворяют 0.09 г (13 ммоль) лития при нагревании в 32 мл диметиламиноэтанола, охлаждают до комнатной температуры и добавляют смесь 0.41 г (3.2 ммоль) фталонитрила и 0.44 г (3,2 ммоль) ТМСН. Реакционную массу медленно нагревают при перемешивании до кипения и продолжают кипячение, добавляя постепенно по 0.4 г (2.8 ммоль) ТМСН, охлаждают, разбавляют 200 мл воды, выпавший осадок отфильтровывают, промывают последовательно горячей водой, 50% водным этанолом, этанолом, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета этанолом для удаления примесей, затем трихлорбензолом. Далее экстракт упаривают в вакууме и хроматографируют на силикагеле вначале гексаном для удаления трихлорбензола, затем хлороформом. Собирают голубую фракцию и получают 0.009 г (1.6%) β, β, β′, β′-тетраметилтрибензотетраазахлорина.
Спектр ЯМР 1Н (CDCl3), δ, м, д.: 1.96 (с., 12Н, СН3), 7.88 (дд., 2Н, = СН-), 8.16 (т., 2Н, =СН-), 8.22 (т., 2Н, =СН-), 9,04 (дд., 2Н, =СН-), 9.32 (д., 2Н, =СН-), 9.38 (д., 2Н, =СН-).
Электронный спектр поглощения, λмакс, нм (lgε), хлорбензол: 748 (5.07), 711 (4.32), 680 (4,19), 634 пл. (4.17), 606 (4.58), 584 пл. (4.37), 341 (4.81).
Пример 2.
β, β, β′, β′-Тетраметилтрибензотетраазахлорин никеля.
Смесь 0.5 г (3.7 ммоль) ТМСН, 0.47 г (3.7 ммоль) фталонитрила, 0.47 г (3.7 ммоль) безводного NiCl2 и 0.003 г молибдата аммония (MОA) в 5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета гексаном, затем дихлорбензолом. Гексановый экстракт упаривают, остаток хроматографируют на силикагеле смесью гексан-этилацетат (10:1) и выделяют две фракции: первая фракция 10 мг (0.9%) β, β, β′, β′-октаметилдибензотетраазабактериохлорина никеля, Rf 0.51 (Silufol, гексан-этилацетат, 10:1), λмакс. (относительная интенсивность) в хлороформе 843 (1.0), 801 (0.33), 761 (0.16), 540 (0.42), 330 (0.33), и вторая фракция 12 мг (1.1%) β, β, β′, β′- октаметилдибензотетраазаизобактериохлорина никеля, Rf 0.40 (Silufol, гексан-этилацетат, 10:1) λмакс. (относительная интенсивность) в хлороформе 675 (1.0), 649 (0.30), 631 (0.23), 312 (0.29). Дихлорбензольный экстракт упаривают в вакууме, хроматографируют на силикагеле бензолом и получают 0.14 г (19%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, Rf 0.37 (Silufol, бензол).
Найдено, %: С 66.52; Н 4.63; N 17.65.
C32H24N8Ni.
Вычислено, %: С 66.42; Н 4.18; N 19.38.
Электронный спектр поглощения, λмакс., нм (lgε), хлорбензол: 727 (5.03), 692пл. (4.32), 667 (4.36), 593 (4.81), 572пл. (4.15), 552пл. (3.97), 415 (3.64), 325 (4.49).
Пример 3.
Смесь 0.5 г (3.7 ммоль) ТМСН, 1.06 г (8.3 ммоль) фталонитрила, 0.71 г (5.5 ммоль) безводного NiCl2 и 0.003 г МОА в 5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета дихлорбензолом. Экстракт упаривают в вакууме, хроматографируют на силикагеле бензолом и получают 0.11 г (7.0%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2.
Пример 4.
Смесь 1.0 г (7.4 ммоль) ТМСН, 0.47 г (3.7 ммоль) фталонитрила, 0.63 г (4.9 ммоль) безводного NiCl2 и 0.003 г МОА в 5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу обрабатывают как описано в примере 2 и получают 0.07 г (9.9%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2. Из гексанового экстракта выделяют 0.023 г (2.1%) смеси октаметилдибензотетраазабактериохлорина никеля и октаметилдибензотетраазаизобактериохлорина никеля.
Пример 5.
Смесь 0.25 г (1.8 ммоль) ТМСН, 0.24 г (1.8 ммоль) фталонитрила, 0.24 г (1.8 ммоль) безводного NiCl2 и 0.002 г МОА в 3 мл диметиламиноэтанола кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют водой, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. После экстракции дихлорбензолом и хроматографии бензолом на силикагеле получают 0.011 г (3%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2.
Пример 6.
Смесь 1,0г (7.4 ммоль) ТМСН, 0.94г (7.4 ммоль) фталонитрила, 0.95г (7.4 ммоль) безводного NiCl2 и 0.003 г МОА в смеси 7 мл нитробензола и 0.5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют гексаном, выпавший осадок отфильтровывают, промывают последовательно гексаном, горячим 50% водным этанолом, сушат на воздухе. После экстракции дихлорбензолом и хроматографии бензолом на силикагеле получают 0.10 г (7%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2.
Пример 7.
Смесь 1.0 г (7.4 ммоль) ТМСН, 1.08 г (7.4 ммоль) фталимида, 0.95 г (7.4 ммоль) безводного NiCl2, 0,88 г (14,7 ммоль) мочевины и 0.003 г МОА в 5 мл сульфолана кипятят при перемешивании. По окончании реакции реакционную массу обрабатывают как описано в примере 3 и получают 0.11 г (7.4%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2.
Пример 8.
Смесь 1.0 г (7.4 ммоль) ТМСН, 1,08 г (7.4 ммоль) фталевого ангидрида, 0.95 г (7.4 ммоль) безводного NiCl2, 1.33 г (22.2 ммоль) мочевины и 0.003 г МОА в 5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу обрабатывают как описано в примере 3 и получают 0.094 г (6.3%) β, β, β′, β′-тетраметилтрибензотетраазахлорина никеля, спектрально идентичного полученному в примере 2.
Пример 9.
β, β, β′, β′-Тетраметилтрибензотетраазахлорин меди.
Смесь 0.5 г (3.7 ммоль) ТМСН, 0.47 г (3.7 ммоль) фталонитрила, 0.39 г (3.7 ммоль) однохлористой меди и 0.003 г МОА в 3 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета дихлорбензолом 10 ч. Экстракт упаривают в вакууме до объема 10 мл, хроматографируют на силикагеле бензолом и получают 0.43 г (5.4%) β, β, β′, β′-тетраметилтрибензотетраазахлорина меди.
Найдено, %: С 64.96; Н 3.85; N 17.64.
С32Н24N8Сu.
Вычислено, %: С 65.80; Н 4.14; N 19.18.
Электронный спектр поглощения, λмакс., нм (относительная интенсивность), хлорбензол: 733 (1.0), 671 (0.22), 598 (0.53), 325 (0.59).
Пример 10.
β, β, β′, β′-Тетраметилтрибензотетраазахлорин ванадила.
Смесь 0.53 г (3.9 ммоль) ТМСН, 0.50 г (3.9 ммоль) фталонитрила, 0.41 г (2.6 ммоль) безводного VCl3 и 0.003 г МОА в 3 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета гексаном, затем хлорбензолом. Гексановый экстракт упаривают, остаток хроматографируют на силикагеле смесью гексан-этилацетат (10:1) и выделяют две фракции: первая фракция 8 мг (1.0%) октаметилдибензотетраазабактериохлорина ванадила, Rf 0.3 (Silufol, гексан-этилацетат, 10:1), λмакс. (относительная интенсивность) в хлороформе 891 (1.0), 840 (0.43), 802 (0.32), 573 (0.44), 335 (0.56) и вторая фракция 10 мг (1.3%) октаметилдибензотетраазаизобактериохлорина ванадила, Rf 0.22 (Silufol, гексан-этилацетат, 10:1) λмакс. (относительная интенсивность) в хлороформе 717 (1.0), 658 (0.24), 631 (0.20), 320 (0.49). Хлорбензольный экстракт упаривают в вакууме до объема 10 мл, хроматографируют на силикагеле бензолом и получают 0.12 г (15.6%) β, β, β′, β′-тетраметилтрибензотетраазахлорина ванадила, Rf 0.26 (Silufol, бензол).
Найдено, %: С 66.51; Н 4.18; N 18,65.
С32Н24N8OV.
Вычислено, %: С 65.40; Н 4,12; N 19,08.
Электронный спектр поглощения, λмакс., нм (lgε), хлорбензол: 763 (5.04), 724 (4.32), 697 (4.31), 625 (4.64), 333 (4.62).
Пример 11.
Раствор 0.53 г (3.9 ммоль) ТМСН и 0.50 г (3,9 ммоль) фталонитрила в 5 мл хинолина прибавляют к перемешиваемой и нагретой до кипения смеси 0.41 г (2.6 ммоль) безводного VCl3 и 0.003 г МОА в 2 мл хинолина и далее продолжают кипячение. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета хлорбензолом, затем растворитель упаривают в вакууме до объема 10 мл, хроматографирутот на силикагеле бензолом и получают 0.16 г (20.9%) β, β, β′, β′-тетраметилтрибензотетраазахлорина ванадила, спектрально идентичного полученному в примере 10.
Пример 12.
Раствор 0.8 г (5.9 ммоль) ТМСН и 0.50 г (3.9 ммоль) фталонитрила в 5 мл сульфолана прибавляют к перемешиваемой и нагретой до кипения смеси 0.61 г (3.9 ммоль) безводного VСl3 и 0.003 г МОА в 3 мл сульфолана и далее продолжают кипячение. По окончании реакции реакционную массу охлаждают, разбавляют водой, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета хлорбензолом, затем растворитель упаривают в вакууме до объема 10 мл, хроматографируют на силикагеле бензолом и получают 0.14 г (18.3%) β, β, β′, β′-тетраметилтрибензотетраазахлорина ванадила, спектрально идентичного полученному в примере 10.
Пример 13.
β, β, β′, β′-Тетраметилтри-2,3-нафтотетраазахлорин никеля.
Смесь 0.5 г (3.7 ммоль) ТМСН, 0.72 г (3.7 ммоль) имида нафталин-2,3-дикарбоновой кислоты, 0.48 г (3.7 ммоль) безводного NiCl2, 0,44 г (7,4 ммоль) мочевины и 0.003 г МОА в 5 мл сульфолана кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток тщательно растирают, после чего экстрагируют в аппарате Сокслета этанолом, ацетоном, затем трихлорбензолом. Трихлорбензольный экстракт фильтруют через слой окиси алюминия, упаривают в вакууме до объема 5 мл, разбавляют 100 мл гексана, выпавший осадок отфильтровывают, промывают гексаном и получают 0.07 г (7.9%) β, β, β′, β′-тетраметилтри-2,3-нафтотетраазахлорина никеля.
Найдено, %: C 71.44; H 4.28; N 15.10.
C44H30N8Ni
Вычислено, %: C 72.45; H 4.15; N 15.36.
Электронный спектр поглощения, λмакс., нм (относительная интенсивность), хлорбензол: 811 (1.0), 687 (0.39), 310 (0.85).
Пример 14.
β, β, β′, β′-Тетраметилтри-2,3-(1-фенилнафто)тетраазахлорин никеля.
Смесь 0.5 г (3.7 ммоль) ТМСН, 1 г (3.7 ммоль) имида 1-фенилнафталин-2,3-дикарбоновой кислоты, 0.48 г (3.7 ммоль) безводного NiCl2, 0,44 г (7,4 ммоль) мочевины и 0.003 г МОА в 5 мл сульфолана кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток хроматографируют на окиси алюминия смесью гексан-хлороформ (1:2), собирают зеленую фракцию с Rf (Alufol, гексан - хлороформ, 1:2), получают 0.06 г (5%) β, β, β′, β′-тетраметилтри-2,3-(1-фенилнафто)тетраазахлорина никеля.
Масс-спектр, m/z: 957 (M+).
Электронный спектр поглощения, λмакс., нм (относительная интенсивность), хлороформ: 819 (1.0), 694 (0.39), 313 (0.78).
Пример 15.
Смесь 1.5 г (11 ммоль) ТМСН, 3 г (11 ммоль) ангидрида 1-фенилнафталин-2,3-дикарбоновой кислоты, 1.43 г (11 ммоль) безводного NiСl2, 1,32 г (22 ммоль) мочевины и 0.006 г МОА в 10 мл сульфолана кипятят при перемешивании. По окончании реакции реакционную массу обрабатывают как описано в примере 14 и получают 0.2 г (5.7%) β, β, β′, β′-тетраметилтри-2,3-(1-фенилнафто)тетраазахлорина никеля, спектрально идентичного полученному в примере 14.
Пример 16.
β, β, β′, β′-Тетраметилтри-2,3-(1-фенилнафто)тетраазахлорин ванадила.
Смесь 0.5 г (3.7 ммоль) ТМСН, 1 г (3.7 ммоль) имида 1-фенилнафталин-2,3-дикарбоновой кислоты, 0.58 г (3.7 ммоль) безводного VCl3, 0,44 г (7,4 ммоль) мочевины и 0.003 г МОА в 5 мл хинолина кипятят при перемешивании. По окончании реакции реакционную массу охлаждают, разбавляют 100 мл 50% водного этанола, выпавший осадок отфильтровывают, промывают последовательно горячей водой, горячим 50% водным ацетоном, сушат на воздухе. Остаток хроматографируют на силикагеле смесью бензол-гексан (2:1), собирают зеленую фракцию с Rf 0.43 (Silufol, бензол-гексан, 2:1) и получают 0.05 г (4.2%) β, β, β′, β′-тетраметилтри-2,3-(1-фенилнафто)тетраазахлорина ванадила.
Электронный спектр поглощения, λмакс., нм (относительная интенсивность), хлороформ: 871 (1.0), 825 (0.54),747 (0.35), 328 (0.74).
Благодаря особенностям молекулярного строения, в частности наличию двух четвертичных атомов углерода с метильными группами вне плоскости молекулы, полученные соединения обладают хорошей растворимостью в органических растворителях и в полимерных матрицах.
Они устойчивы к окислению на воздухе в твердом виде и в растворах в органических растворителях, в том числе в полярных, как при комнатной температуре, так и при нагревании, что подтверждается сохранением спектра поглощения их растворов в течение длительного времени.
Синтезированные соединения в электронных спектрах поглощения имеют интенсивные полосы в красной и ближней инфракрасной области спектра. Введение в молекулу незамещенного TAX трех бензольных колец приводит к значительному батохромному сдвигу длинноволновой полосы Q - до 752, 727 и 763 нм в хлороформе для тетраметилтрибензо-ТАХ и его Ni и VO комплексов соответственно с некоторым увеличением ее интенсивности по сравнению с TAX, не вызывая при этом значительных изменений спектра в УФ области.
В случае три-2,3-нафто-ТАХ батохромный сдвиг длинноволновой полосы составляет около 170 нм по сравнению с TAX - у Ni и VO комплексов тетраметилтри-2,3-(1-фенилнафто)-ТАХ она расположена при 819 и 871 нм соответственно.
Хорошая растворимость и стабильность в растворах и в полимерной матрице позволяет использовать все полученные соединения в качестве функциональных красителей, в частности в качестве поглощающих компонентов оптических фильтров ближнего ИК диапазона. Так, из β, β, β′, β′-тетраметилтрибензотетраазахлорина и его никелевого и ванадильного комплексов, имеющих в электронных спектрах поглощения в толуольных растворах и в полиметилметакрилате длинноволновые полосы с максимумами при 750, 727 и 763 нм соответственно, изготовлены жидкостные и твердотельные оптические фильтры отрезающего типа на спектральный диапазон от 720 до 780 нм, от 700 до 760 нм и от 730 до 800 нм. Из β, β, β′, β′-тетраметилтри-2,3-(1-фенилнафто)тетраазахлорина никеля с длинноволновым максимумом при 820 нм, изготовлены аналогичные фильтры на область от 790 до 850 нм.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТАЛЬНЫХ ТЕТРААЗАХЛОРИНОВ | 2012 |
|
RU2479586C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОЗАМЕЩЕННЫХ ФТАЛОЦИАНИНОВ | 1999 |
|
RU2181736C2 |
| ОКТА-4,5-КАРБОКСИФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2193563C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФТАЛОЦИАНИНА ХЛОРАЛЮМИНИЯ | 1999 |
|
RU2164233C1 |
| 6-N, 6-N-ДИБЕНЗОИЛ-9-(2,3-АНГИДРО- β -D-РИБОФУРАНОЗИЛ)АДЕНИН В КАЧЕСТВЕ ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ В СИНТЕЗЕ ДИНАТРИЕВОЙ СОЛИ АДЕНИЛИЛ(2` - 5`)АДЕНИЛИЛ(2` - 5`)-9-(2,3-АНГИДРО- b - D -РИБОФУРАНОЗИЛ)АДЕНИНА | 1989 |
|
SU1626662A1 |
| АЛКИЛТИОЗАМЕЩЕННЫЕ ФТАЛОЦИАНИНЫ, ИХ ЛЕКАРСТВЕННЫЕ ФОРМЫ И СПОСОБ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2007 |
|
RU2340615C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1998 |
|
RU2164136C2 |
| ИТТЕРБИЕВЫЕ КОМПЛЕКСЫ ТЕТРАПИРАЗОЛИЛПОРФИРИНОВ КАК ФЛУОРЕСЦЕНТНЫЕ МЕТКИ ДЛЯ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2008 |
|
RU2372099C1 |
| 5,6-БИС-(1',2':3',4'-ДИ-О-ИЗОПРОПИЛИДЕН-α-D-ГАЛАКТОПИРАНОЗО-6'-ИЛ)-1,3-ДИИМИНОИЗОИНДОЛИН | 2009 |
|
RU2409586C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(2-ХЛОРЭТИЛ)-3-ЦИКЛОГЕКСИЛ-1-НИТРОЗОМОЧЕВИНЫ | 2001 |
|
RU2192413C1 |
Описываются новые β, β, β′, β′ - тетраметилтриаренотатраазахлорины общей формулы I, где М = НН, Cu, Ni, VO; R = R1 = Н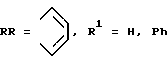
и три способа их получения, основанные на конденсации смеси тетраметилсукциононитрила с производными о-фталевой или нафталин-2,3-дикарбоновой кислоты. Полученные соединения отличаются интенсивным поглощением в ближнем ИК-диапазоне спектра, хорошей растворимостью и стабильностью в органических растворителях и в полимерных матрицах и могут быть использованы в качестве функциональных красителей, например в качестве поглощающих компонентов оптических фильтров ближнего ИК-диапазона. 3 з.п. ф-лы.
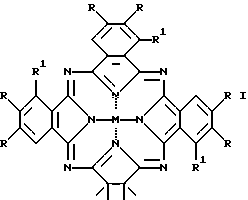
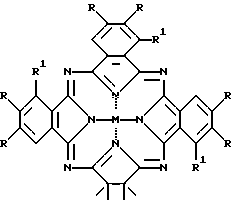
где M = HH, Cu, Ni, VO;
R = R1 = H;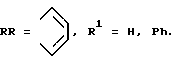
2. Способ получения безметального соединения по п.1, где М = НН, R = R1 = H, заключающийся в конденсации смеси тетраметилсукцинонитрила с фталонитрилом в присутствии диметиламиноэтилата лития в диметиламиноэтаноле.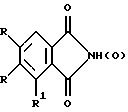
где R = R1 = H;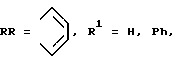
в присутствии хлоридов никеля или ванадия, мочевины и каталитических количеств молибдата аммония в хинолине или сульфолане.
| Подшипниковый узел | 1974 |
|
SU484027A1 |
| Способ получения гептенов | 1969 |
|
SU488397A3 |
| МАКАРОВА Е.А., КОРОЛЕВА Г.В | |||
| и др | |||
| Журнал общей химии, 69, 1356, 1999. | |||
Авторы
Даты
2002-08-27—Публикация
2000-10-04—Подача