Настоящее изобретение относится к органическому синтезу, в частности, оно касается способа получения 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины, известной в фармацевтике как противоопухолевый препарат ломустин.
Наиболее близким к способу, предлагаемому в настоящем изобретении, по технологической сущности является известный 3-стадийный способ [J. Org. Chem. , т. 46. 12, 2479-2489, 1981 г.], заключающийся в том, что на первой стадии циклогексилизоцианат (I) обрабатывают моноэтаноламином (II) в среде серного эфира в течение 12 часов, затем полученную 1-(2-оксиэтил)-3-циклогексилмочевину (III)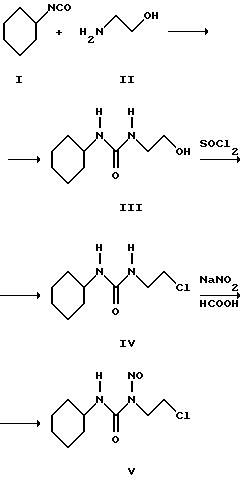
перекристаллизовывают и кипятят в среде хлористого тионила с образованием хлорэтильного производного (IV), которое подвергают нитрозированию сухим нитритом натрия в среде практически безводной (98-99%) муравьиной кислоты. Выход целевого продукта по описанному способу составляет 26,7%.
Недостатками известного способа являются:
I. На 1-й стадии:
1. Использование взрывоопасного растворителя - серного эфира, что совершенно неприемлемо для производственных условий.
2. Большая продолжительность процесса - 12 часов.
3. Необходимость очистки продукта реакции III, что усложняет технологию, и приводит к увеличению расходных норм сырья.
II. На 2-й cтaдии:
1. Кипячение в среде хлористого тионила, приводящее к осмолению, чем обусловлен низкий выход продукта реакции IV - 41%.
2. Сильно загрязненный продукт IV требует сложной очистки (колонка с силикагелем с последующей кристаллизацией).
III. На 3-й стадии:
1. Нитрозирование проводят в практически безводной (98-99%-ной) муравьиной кислоте, что обеспечить в производственных условиях весьма затруднительно.
2. Образование изомера целевого продукта - 1-(2-хлорэтил)-3-циклогексил-3-нитрозомочевины, превращение которого в целевой продукт не предусмотрено.
IV. На 4-й стадии:
1. Кристаллизацию целевого продукта осуществляют из взрывоопасных растворителей - смеси серного и петролейного эфиров, что крайне нежелательно для производственных условий.
Все вышеприведенные недостатки делают описанный процесс технологически сложным и обуславливают довольно низкий выход целевого продукта - 26,7%.
Задачей предлагаемого изобретения является разработка такой технологии получения 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины по описанной схеме, которая бы обеспечивала увеличение выхода целевого продукта при одновременном упрощении процесса.
Поставленная задача решается тем, что в описанном способе получения соединения V по 3-стадийной схеме первую стадию проводят в среде ацетонитрила; продукт III непосредственно направляют на 2 стадию, которую осуществляют в среде толуола в присутствии хлористого цинка, а процесс нитрозирования сухим нитритом натрия проводят в 75-85%-ной водной муравьиной кислоте; образующуюся смесь изомеров обрабатывают концентрированной НС1; кристаллизацию технического продукта V проводят из смеси растворителей - ацетон - ацетонитрил.
Выход целевого продукта V по описанной технологии составляет 51,7%, качество его соответствует требованиям к фармакопейному продукту.
Нижеследующий пример характеризует предлагаемое изобретение.
Пример.
Стадия 1. Получение 1-(2-оксиэтил)-3-циклогексилмочевины.
К охлаждаемой до 0-5oС смеси 31,16 г 98% (30,54 г 100%; 0,5 Мол) моноэтаноламина в 750 мл ацетонитрила при перемешивании прикапывают 64,5 мл (63,21 г - 99% или 62,59 г 100%; 0,5 Мол) циклогексилизоцианата. По окончании прибавления реакционную смесь выдерживают 4 часа, выпавший осадок отфильтровывают, промывают 50 мл ацетонитрила и сушат.
Получают 88,7 г (95%) 1-(2-оксиэтил)-3-циклогексилмочевины в виде кристаллов белого цвета с т. пл. 99-102oС.
Стадия 2. Получение 1-(2-хлорэтил)-3 -циклогексилмочевины.
К перемешиваемой смеси 84 г (0,45 Мол) 1-(2-оксиэтил)-3-циклогексилмочевины, 9,0 г 98% (8,82 г 100%) ZnCl2; и 1350 мл толуола при температуре 20oС прикапывают 50,3 мл (0,675 Мол) хлористого тионила. Реакционную массу нагревают до 80oС и выдерживают при этой температуре 1 час. Затем в вакууме отгоняют смесь хлористого тионила и толуола до прекращения погона. К остатку добавляют 300 мл воды и перемешивают 1 час. Выделившийся осадок отфильтровывают, промывают водой и сушат.
Получают 73,79 г (80%) 1-(2-хлорэтил)-3-циклогексилмочевины в виде кристаллов белого цвета с т. пл. 116-118oС.
Стадия 3. Получение 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины.
К перемешиваемой смеси 73,44 г 1-(2-хлорэтил)-3-циклогексилмочевины и 1075 мл 85%-ной водной муравьиной кислоты порциями добавляют 73,44 г сухого нитрита натрия, поддерживая температуру не выше 5oС. Реакционную массу, представляющую собой смесь изомеров: 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины и 1-(2-хлорэтил)-3-циклогексил-3-нитрозомочевины, выдерживают при этой температуре 2 часа, добавляют 537 мл концентрированной НСl, выдерживают 1 час и разбавляют 1075 мл воды. Осадок отфильтровывают, промывают водой и сушат.
Получают 93,5 г (85%) технического ломустина с т. пл. 89-90,5oС.
Кристаллизацией из смеси ацетон - ацетонитрил (1:2) с выходом 80% получают фармакопейный продукт (температура плавления - 90,0-91,0oС, хлориды - менее 0,05%, содержание основного вещества - 98,85%, что соответствует требованиям, предьявляемым к субстанции "Ломустин" Британской Фармакопеей 2000 г.).
Таким образом, предлагаемый способ позволяет:
1. На 1-й стадии:
исключить использование взрывоопасного растворителя, значительно сократить продолжительность процесса с 12 до 4 часов, исключить очистку продукта реакции III.
2. На 2-й стадии:
исключить кипячение в среде хлористого тионила, повысить выход продукта IV с 41% до 80%, исключить необходимость сложной очистки.
3. На 3-й стадии:
сделать стадию более технологичной за счет проведения процесса в 75-85%-ной водной муравьиной кислоте, исключить 2-й изомер - 1-(2-хлорэтил)-3-циклогексил-3-нитрозомочевину - за счет применения концентрированной НСl.
4. Исключить на стадии кристаллизации целевого продукта применение взрывоопасной смеси растворителей.
Все вышеприведенные усовершенствования позволяют повысить в два раза выход целевого продукта при значительном упрощении технологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения N-(2-хлорэтил)-N'-циклогексил-N-нитрозомочевины | 2022 |
|
RU2797412C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-[БИС-(2-ХЛОРЭТИЛ)АМИНО]ТЕТРАГИДРО-2Н-1,3,2-ОКСАЗАФОСФОРИН-2-ОКСИДА, МОНОГИДРАТА | 2001 |
|
RU2196775C2 |
| СПОСОБ СИНТЕЗА 2-[3-(2-ХЛОРЭТИЛ)-3-НИТРОЗОУРЕИДО]-1,3-ПРОПАНДИОЛА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2018 |
|
RU2678846C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА МЕТИЛОВОГО ЭФИРА 4-МЕТИЛ-3-[2-(Н-ПРОПИЛАМИНО)ПРОПИОНИЛАМИНО]ТИОФЕН-2-КАРБОНОВОЙ КИСЛОТЫ | 2001 |
|
RU2184730C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 4-(4-АМИНОФЕНИЛ)МАСЛЯНОЙ КИСЛОТЫ | 2014 |
|
RU2567555C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ | 1997 |
|
RU2135458C1 |
| Способ получения водорастворимых производ-НыХ НиТРОзОМОчЕВиНы | 1977 |
|
SU849999A3 |
| Способ получения 1,3-бис-(2-хлорэтил)-1-нитрозомочевины | 1989 |
|
SU1660356A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-(ФЕНИЛАМИНО)ФЕНИЛУКСУСНОЙ КИСЛОТЫ | 1999 |
|
RU2172309C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННОГО ДИФЕНИЛАМИНА | 1999 |
|
RU2178784C2 |
Изобретение касается способа получения 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины, известной в фармацевтике, как противоопухолевый препарат ломустин. По предлагаемому способу ломустин получают в несколько стадий: взаимодействие циклогексилизоцианата с моноэтаноламином в среде ацетонитрила с направлением продукта реакции непосредственно на следующую стадию обработки продукта реакции хлористым тионилом в среде толуола в присутствии катализатора - хлористого цинка; взаимодействие полученного хлорэтильного производного с нитритом натрия в 75-85%-ной водной муравьиной кислоте, с последующей обработкой образующейся смеси изомеров соляной кислотой и кристаллизация целевого продукта из смеси ацетон - ацетонитрил. Способ позволяет увеличить выход целевого продукта фармакопейного качества до 51,7% и упростить процесс.
Способ получения 1-(2-хлорэтил)-3-циклогексил-1-нитрозомочевины, состоящий из стадий взаимодействия циклогексилизоцианата с моноэтаноламином, последующей обработки продукта реакции хлористым тионилом и взаимодействия полученного хлорэтильного производного с нитритом натрия в муравьиной кислоте с выделением целевого продукта и последующей кристаллизацией, отличающийся тем, что первую стадию осуществляют в среде ацетонитрила с направлением продукта реакции непосредственно на следующую стадию; обработку хлористым тионилом проводят в среде толуола в присутствии катализатора - хлористого цинка; взаимодействие полученного продукта с нитритом натрия осуществляют в 75-85%-ной водной муравьиной кислоте с последующей обработкой образующейся смеси изомеров соляной кислотой; кристаллизацию целевого продукта проводят из смеси ацетон - ацетонитрил.
| J.WILLIAM LOWN ET AL., Synthesis and Reactions of Deuterated 2-(Alkylimino)-3-nitrosooxazolidines, 3-alkyl-1-(2-Hydroxyethyl)-1-nitrosoureas, and Related Compounds as Possible Intermediates in the Aqueous Decomposition of 3-Alkyl-1-(2-chloroethyl)-1-nitrosoureas | |||
| J | |||
| Org | |||
| Chem., 1981, т.46, № 12, с | |||
| Способ освобождения пустотных приборов от остаточных пустот | 1924 |
|
SU2479A1 |
| JOHSTON THOMAS P.ET AL., The synthesis of potential anticancer agents | |||
| XXXVI | |||
| N-nitrosoureas | |||
| II.Haloalkyl derivatives | |||
| Реферативный журнал Химия, 1967, 18(I), Ж 139, с | |||
| Солесос | 1922 |
|
SU29A1 |
| WO 8200642 A1, 04.03.1982 | |||
| ПРЕДМЕТ МЕБЕЛИ С ВЫДВИЖНОЙ ДЕТАЛЬЮ | 2011 |
|
RU2560038C2 |
| Способ получения производных нитрозомочевины | 1978 |
|
SU908247A3 |
| SU 1711456 A, 27.08.1996. | |||
Авторы
Даты
2002-11-10—Публикация
2001-03-12—Подача