Изобретение относится к медицине, а именно к фармакологии, и касается средств, обладающих антимутагенным действием.
Профилактика мутагенных последствий является одной из наиболее актуальных проблем медицины. Ее реализация предусматривает как мероприятия, направленные на ограничение контакта человека с мутагенами, так и разработку средств защиты наследственности от мутагенных воздействий (1).
Индукция мутаций - сложный, многоэтапный процесс, составляющими которого является поступление, распределение, биопревращение и выведение генетически активного агента, его накопление в области клетки и молекулы-мишени, взаимодействие с ДНК и влияние на репарационные и репликационные системы. Влияние на любой из перечисленных этапов образования мутаций может модифицировать действие мутагена. На этой основе созданы практически все существующие к настоящему времени классификации антимутагенов (2). Антимутагенные свойства выявлены у многих природных и синтетических соединений: витаминов, аминокислот, естественных метаболитов, пищевых добавок, лекарств и других веществ органической и неорганической природы.
Однако большинство работ по изучению антимутагенеза выполнено in vitro, чаще на микроорганизмах, что значительно снижает прогностическую ценность этих сведений, затрудняет трактовку экспериментальных данных и их экстраполяцию на человека.
В последнее десятилетие стремительно возрос интерес к проблеме антимутагенеза и интенсифицировались исследования в данной области. В проведенных работах установлена зависимость выраженности антимутагенного эффекта от схемы использования антимутагена, от специфичности действующего мутагенного фактора.
Изыскание антимутагенов в каждом конкретном случае является самостоятельной фармакологической задачей.
Наиболее близким к предлагаемому антимутагенному средству (прототипом) является интерферон. Установлено, что γ-интерферон снижает на 1/3 суммарный уровень хромосомных аберраций, индуцированных в клетках костного мозга мышей через 24 ч после введения 20 мг/кг циклофосфана (3).
Попытки найти более сильные антимутагенные средства в условиях воздействия широко используемого в онкологической практике препарата циклофосфана привели к тому, что у препарата с уже известными свойствами йодантипирина в вышеуказанных условиях были обнаружены антимутагенные свойства.
Одно из направлений поиска новых антимутагенных средств - изучение препаратов с уже известными эффектами в качестве препаратов, обладающих антимутагенным действием.
Задачей, решаемой предлагаемым изобретением, является расширение арсенала средств с антимутагенным действием.
Поставленная задача достигается тем, что в качестве антимутагенного средства используют йодантипирин.
Использование йодантипирина в качестве антимутагенного средства стало возможным благодаря проведенным экспериментальным исследованиям защитного действия йодантипирина на геном клеток костного мозга мышей линии CBA/Calac в условиях введения наиболее распространенного индуктора мутагенеза - циклофосфана. Проведенные исследования выявили новое (антимутагенное) свойство йодантипирина.
Известно, что йодантипирин (1-фенил-2,3-диметил-4-йодпиразолон) является активным индуктором β-интерферона "позднего типа", обладает противовоспалительными, антивирусными и иммуномодулирующими свойствами наряду с отсутствием эмбриотоксического, иммунотоксического и аллергенного действия. Наибольшая активность препарата проявляется в отношении неполиомиелитных энтеровирусов Коксаки и Есно, вирусов везикулярного стоматита, клещевого энцефалита, гриппа и парагриппа. Рекомендуется для лечения и профилактики клещевого энцефалита, гриппа, при комплексной терапии урогенитального хламидиоза (4, 5).
Эксперименты проводили на 230 мышах-самцах линии CBA/Calac в возрасте 2 мес массой 18-20 г (питомник "Рассвет", Томск, сертификат имеется). В качестве индуктора мутагенеза использовали циклофосфан (ЦФ) (Саранский комбинат "Биохимия"), который ex tempore растворяли в стерильном изотоническом растворе хлорида натрия и вводили внутрибрюшинно однократно в дозах 10 мг/кг, 20 мг/кг, 40 мг/кг и 1/2 МПД (125 мг/кг), рассчитанной методом графического пробит-анализа (6) при наблюдении за животными в течение 30 дней. Йодантипирин (ЙА) (АООТ, Асфарма) в дозе 150 мг/кг растворяли в 1% крахмальном геле и вводили внутрижелудочно в объеме 0,2 мл через зонд трехкратно за 2 сут до введения мутагена, сочетая последнее введение модификатора с инъекцией ЦФ (2).
Животных забивали под эфирным наркозом дислокацией шейных позвонков. Материал для исследования забирали через 6 и 24 ч, а также на 2, 3, 4, 5, 7, 10-е сут после сочетанного введения препаратов. Сравнение показателей подопытных животных проводили с соответствующими значениями у интактных мышей (фон), а также у животных, получивших только ЦФ (позитивный контроль).
Препараты метафазных хромосом клеток костного мозга готовили общепринятым суховоздушным способом, как описано ранее (7), с использованием колхицина из расчета 2,5 мг/кг с целью накопления метафаз. При цитогенетическом анализе (10х10, микроскоп Биолам И) учитывали клетки со структурными нарушениями хромосом (одиночные и парные фрагменты, хромосомные обмены, клетки со множественными повреждениями хромосом - более 5 хромосомных аберраций в клетке), регистрировали метафазы с изменением числа хромосом. Гены регистрировали, но в качестве аберраций не учитывали. На каждое животное анализировали по 50 метафазных пластинок с хорошим разбросом хромосом, в каждой группе исследовали 5-6 животных, фоновая группа составляла 10 особей.
Определение общего количества клеток (ОКК) костного мозга, подсчет миелограмм (8), оценку числа эритроцитов с микроядрами в периферической крови (9) осуществляли общепринятыми методами. Полученные данные обрабатывали методом вариационной статистики, используя пакет статических программ Statgrafics.
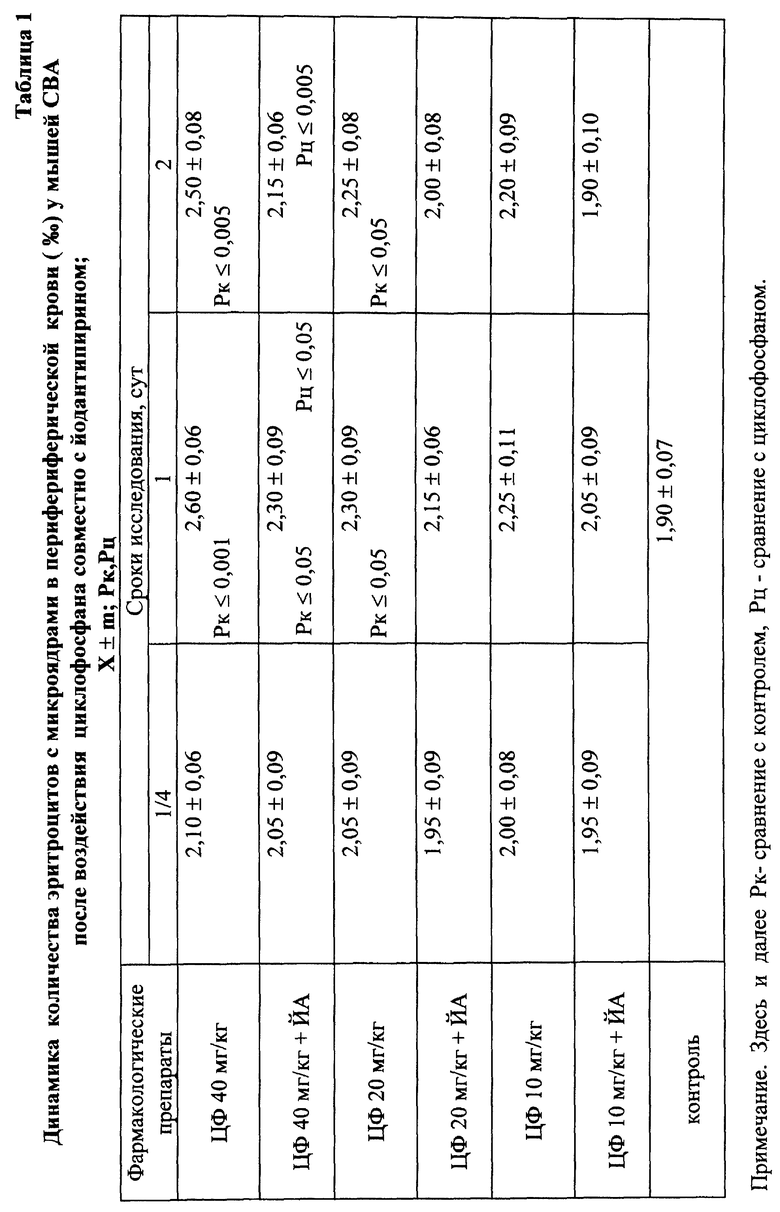
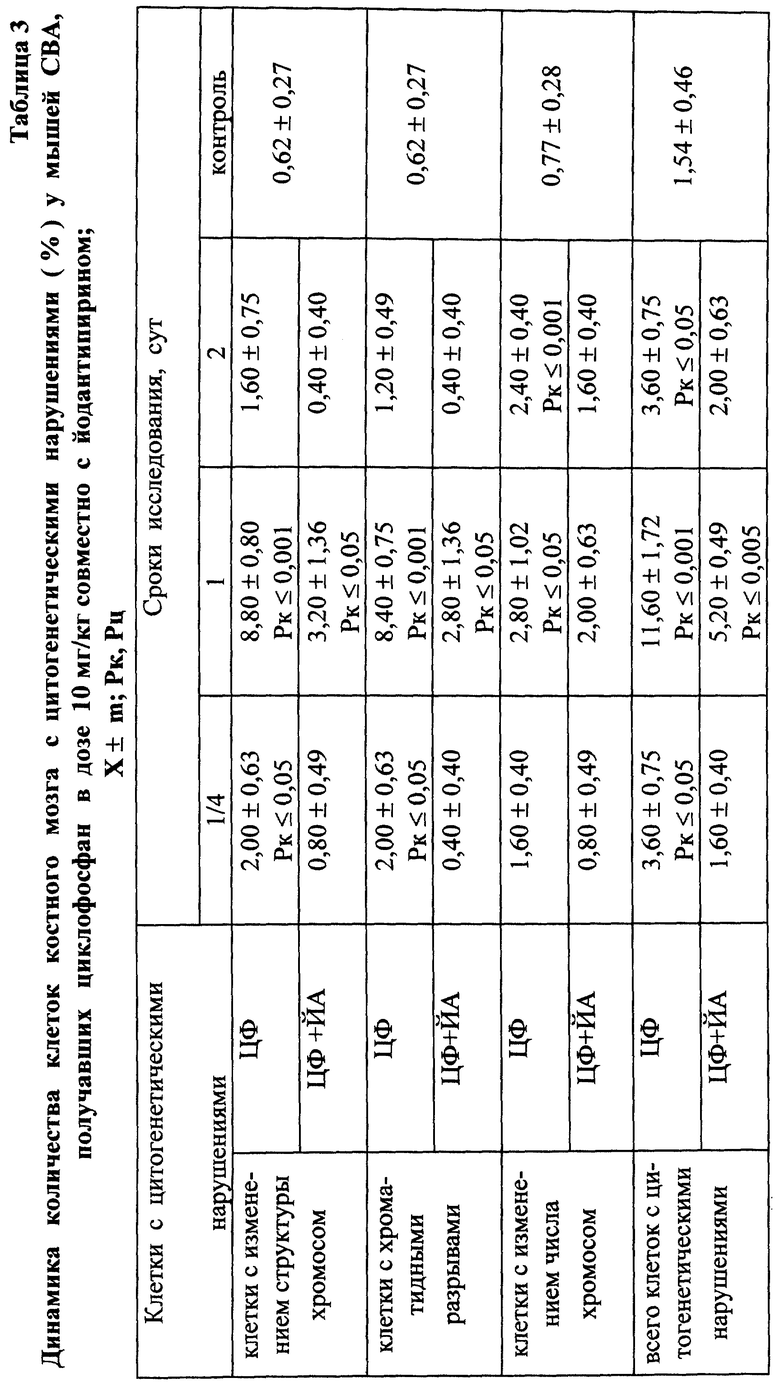
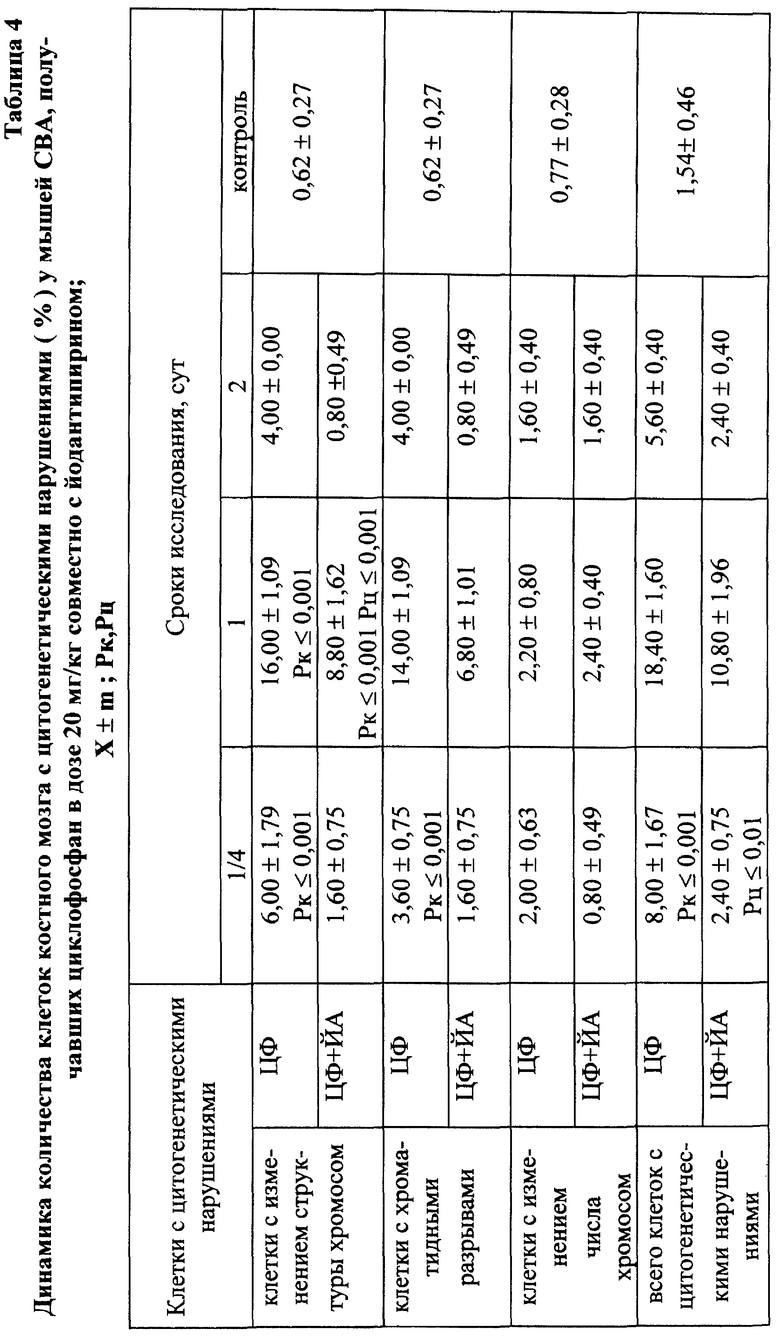
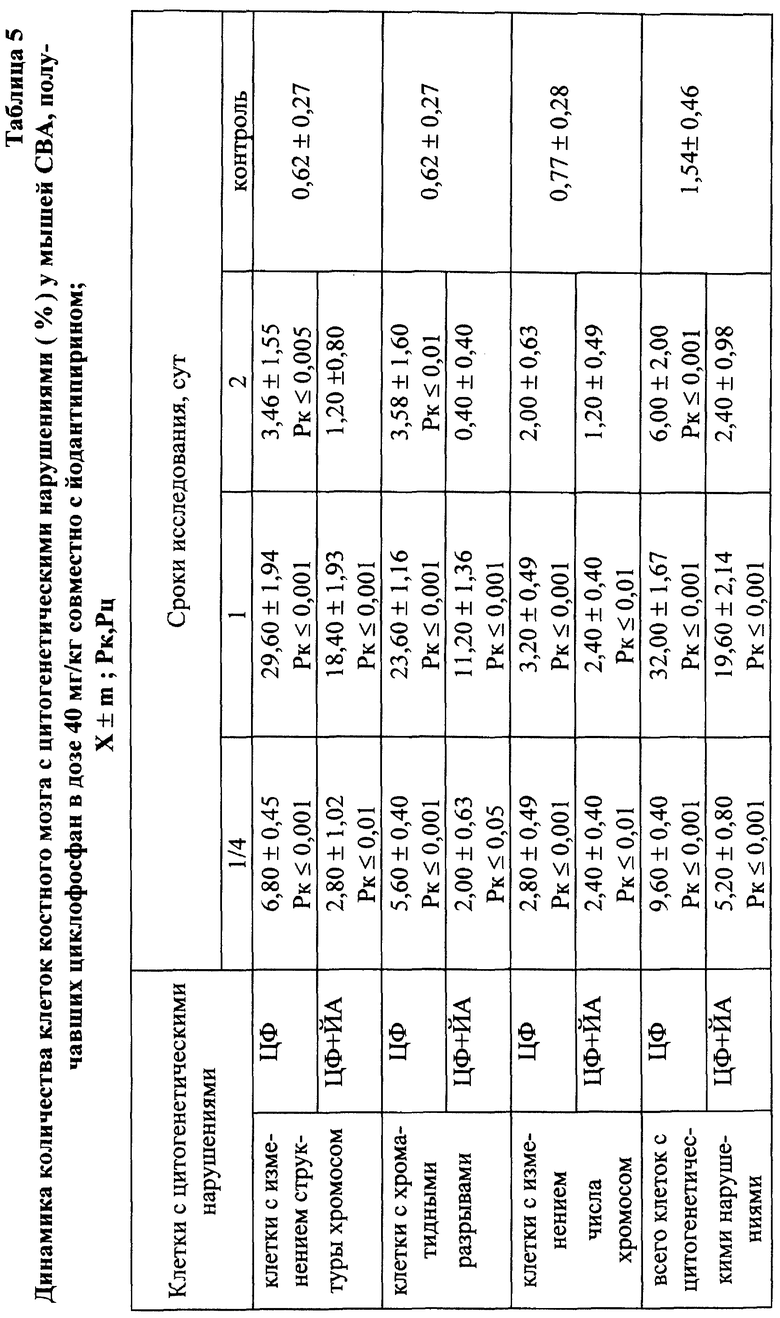
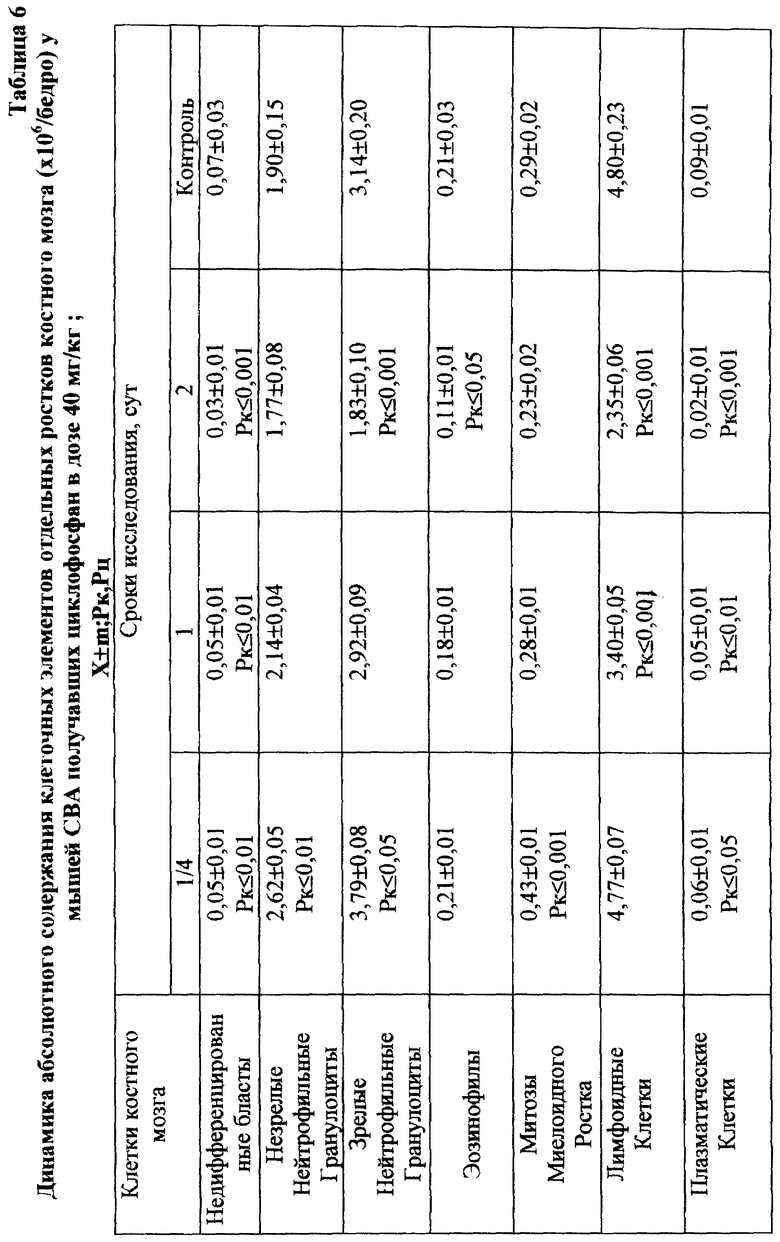
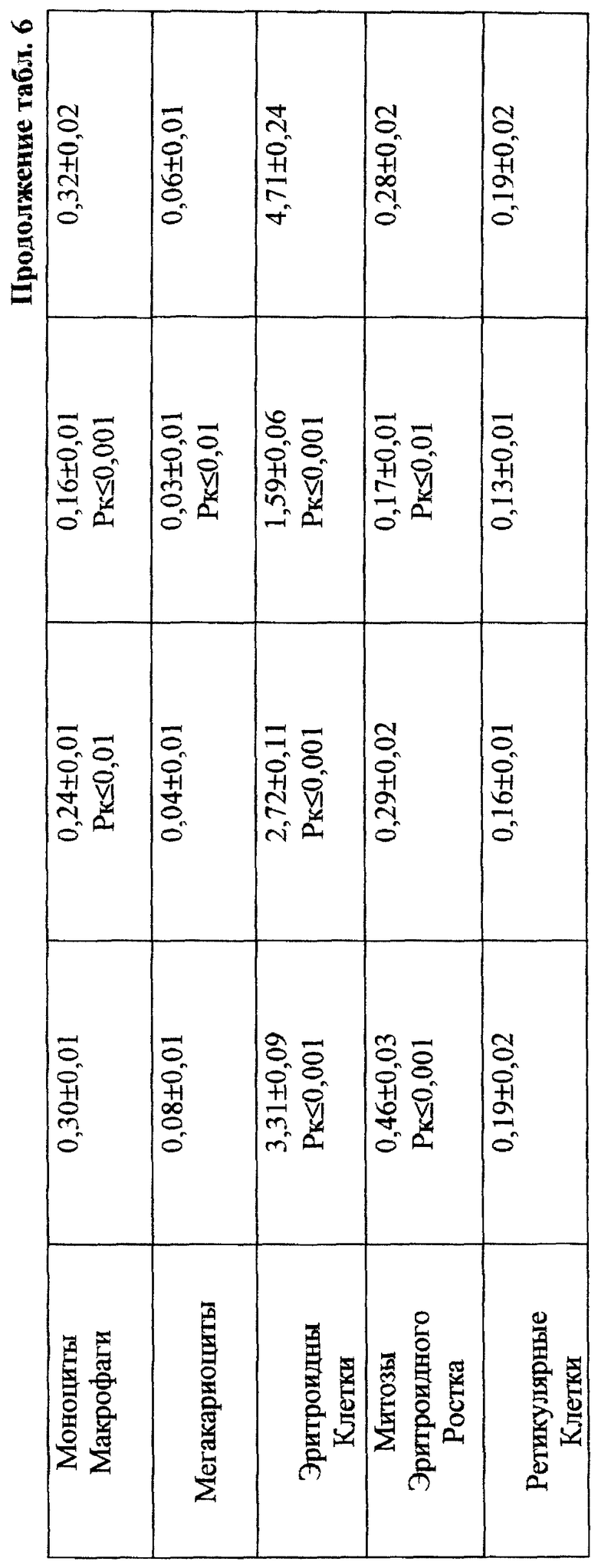
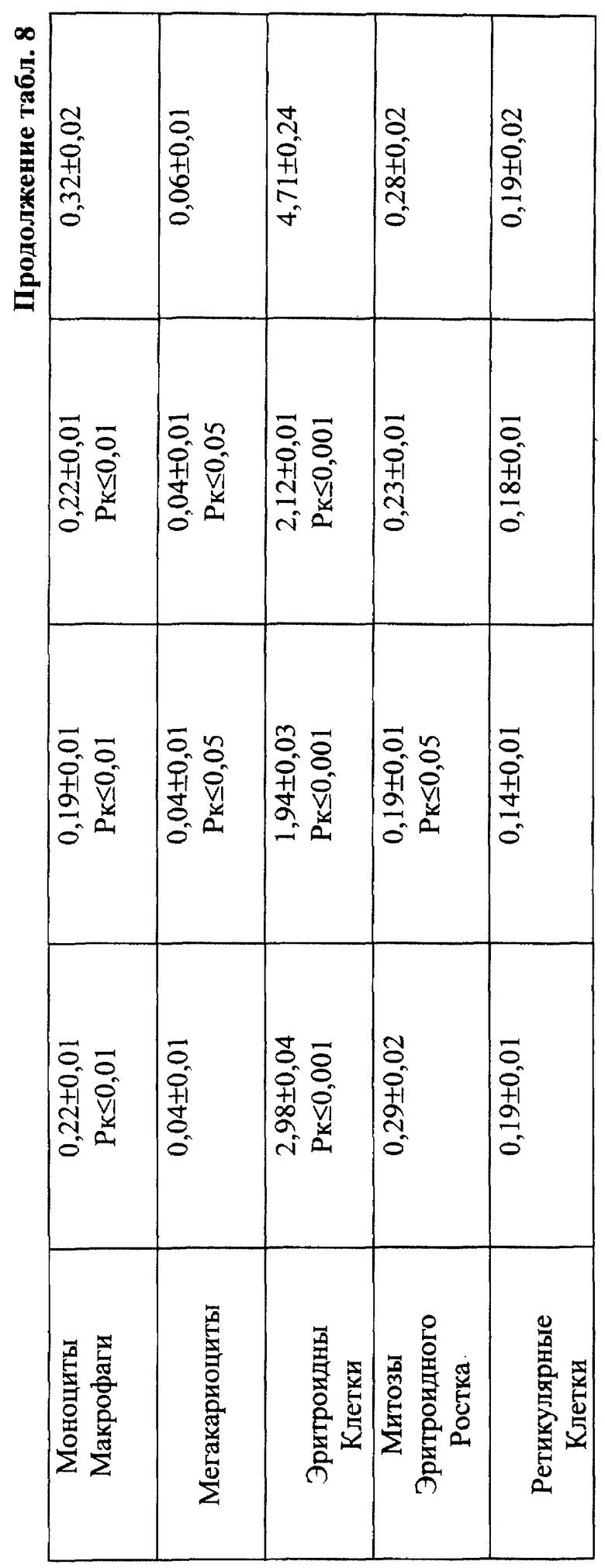
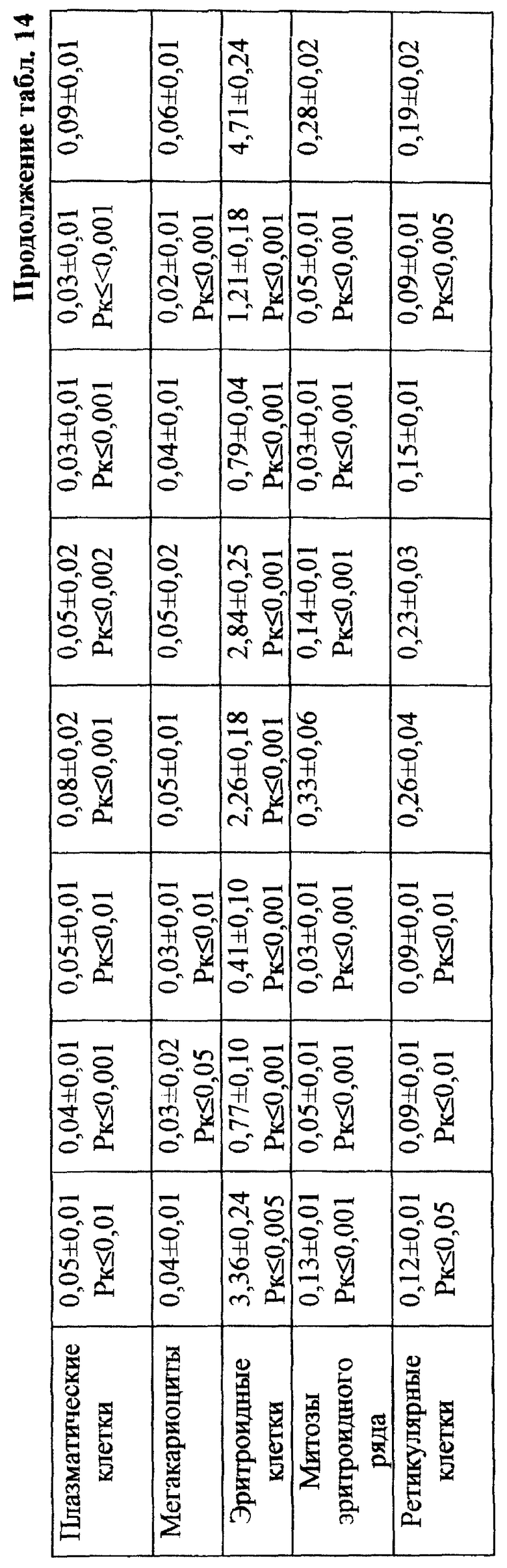
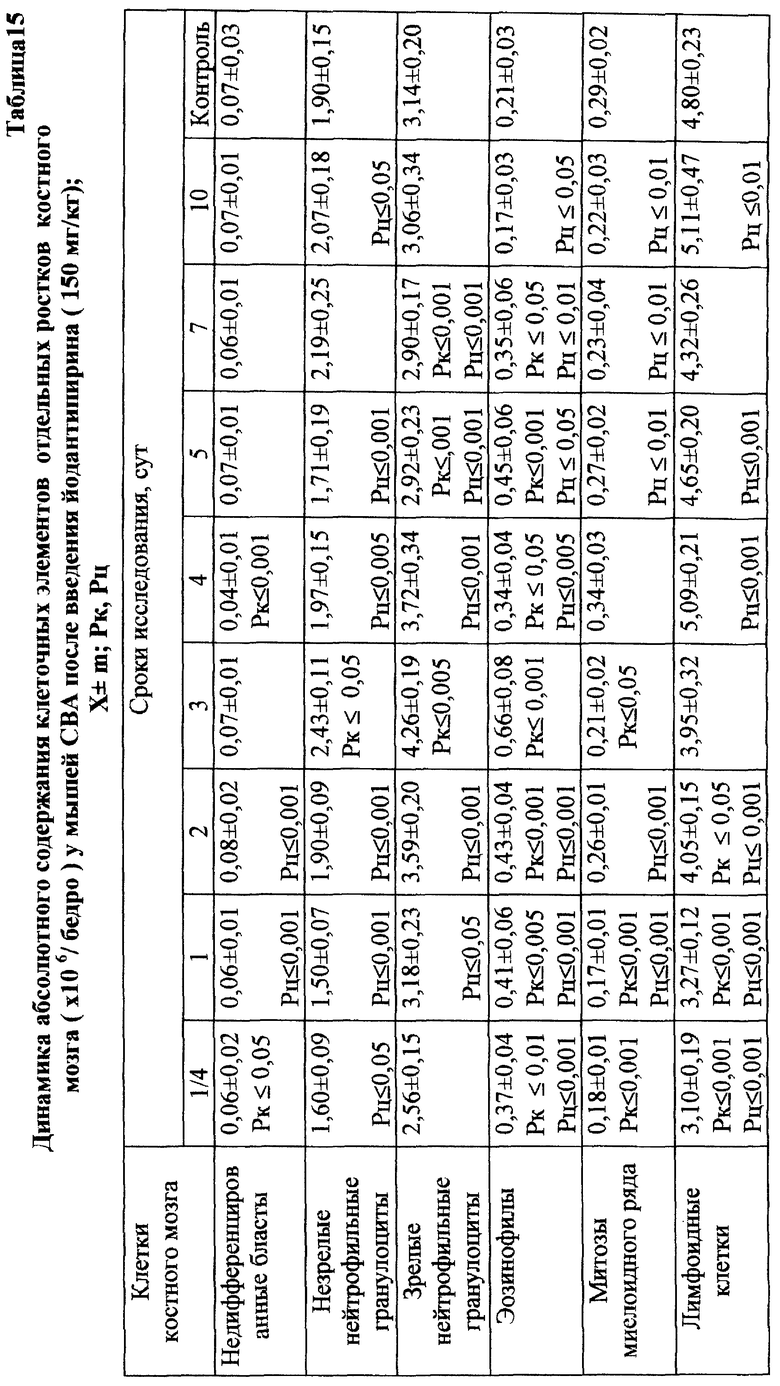
Установлено, что ЙА обладает выраженным антимутагенным эффектом при всех используемых дозах ЦФ. Максимальное снижение (на 55,2%) числа клеток с цитогенетическими нарушениями через 24 ч опыта отмечалось при введении ЦФ в дозе 10 мк/кг (табл. 3). На 41,3% этот показатель уменьшался при дозе ЦФ 20 мг/кг и на 38,75% - при дозе ЦФ 40 мг/кг (табл. 4 и 5 соответственно). При этом необходимо подчеркнуть, что введение ЙА приводило к падению уровня цитогенетически неполноценных клеток (до значений фона) уже к 48 ч эксперимента. В то же время при использовании одного ЦФ количество клеток с цитогенетическими нарушениями оставалось достоверно выше фона (табл. 3, 4, 5).
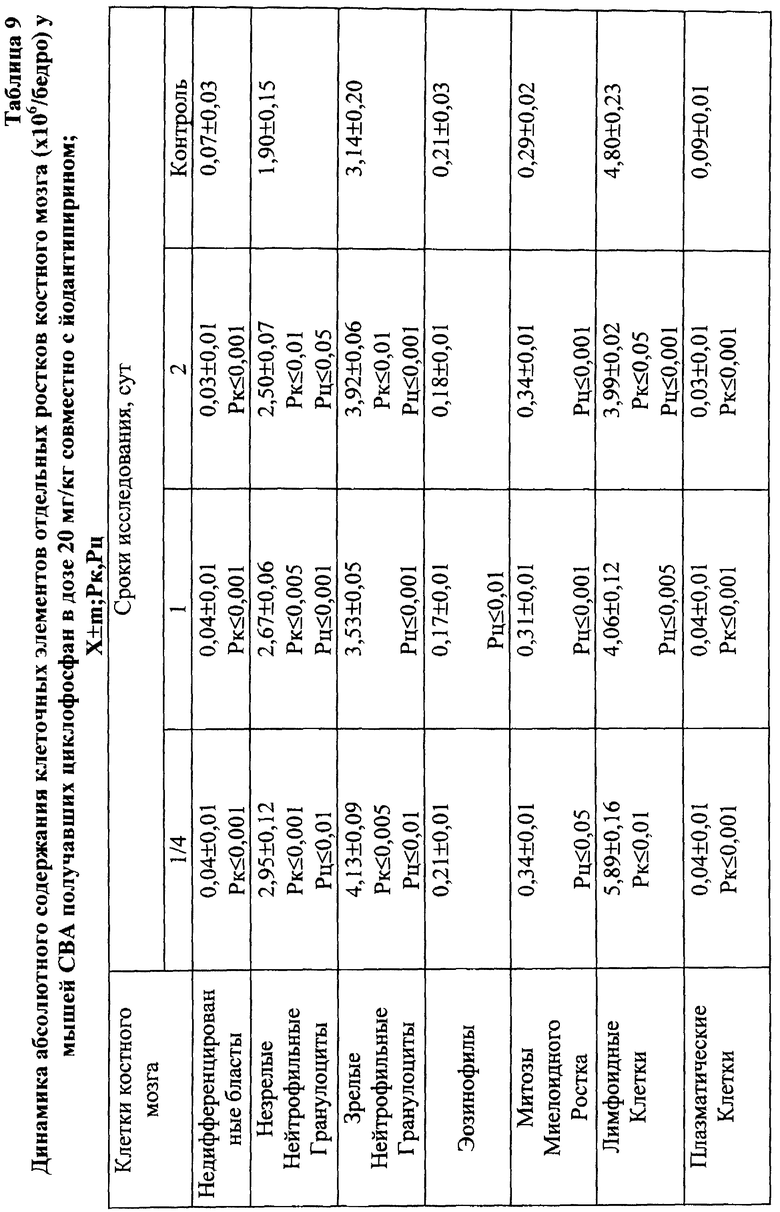
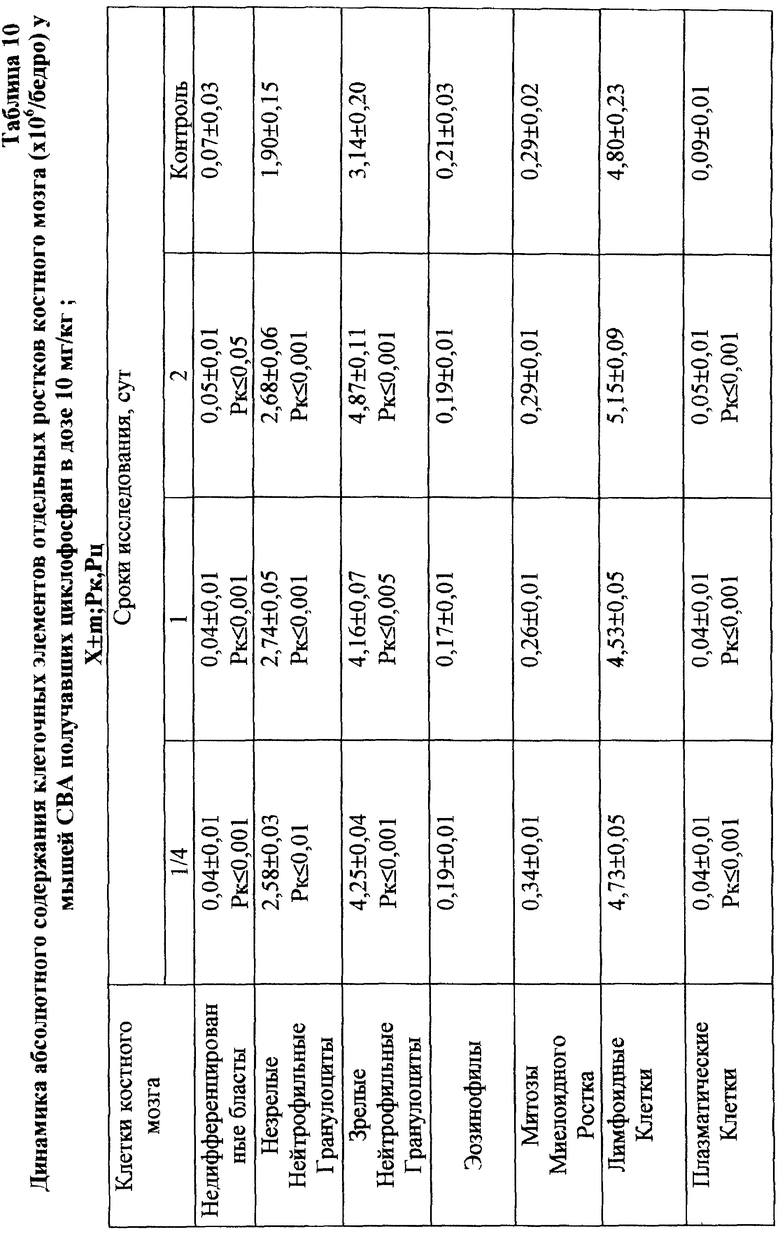
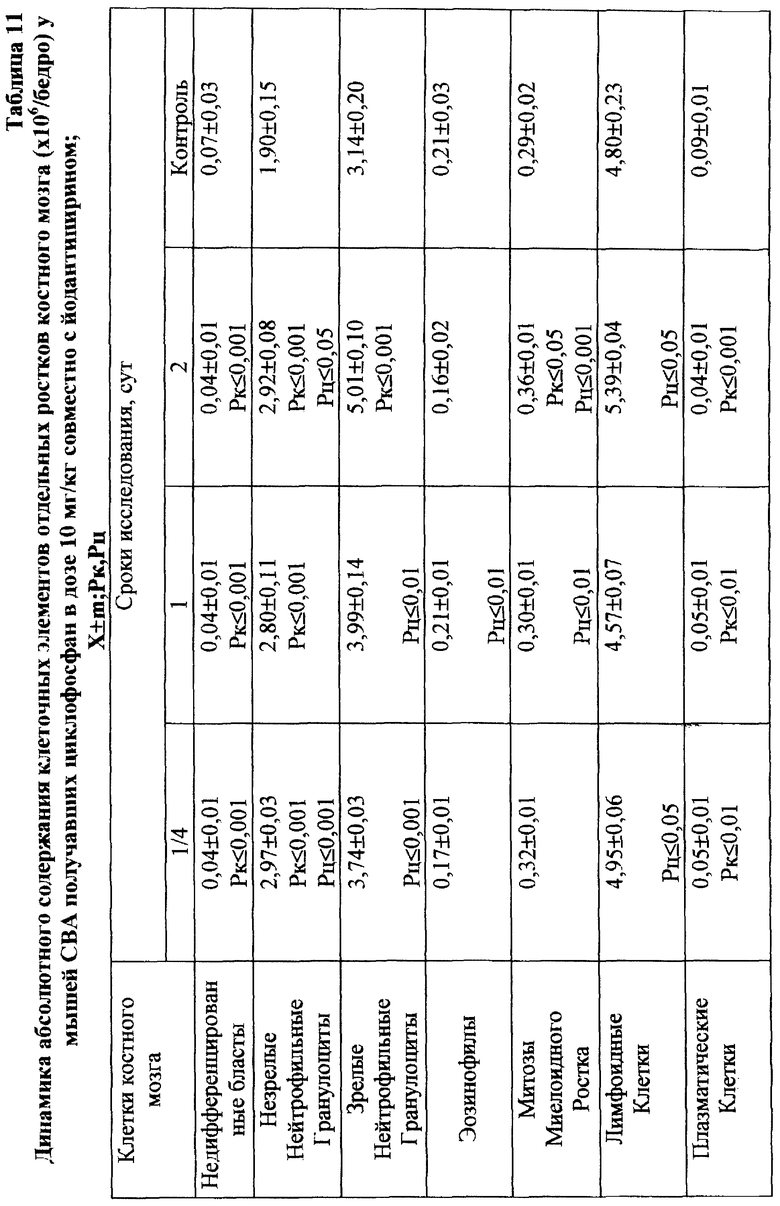
Для предварительной оценки доли "выхода" аберраций в клетках различных ростков костного мозга проводили анализ миелограмм. Так, при введении ЦФ в дозе 10 мг/кг угнетение костномозгового кроветворения не наблюдалось, ОКК находилось в пределах фона в течение всего периода наблюдения (табл. 2). При этом снижение абсолютного содержания эритроидных клеток в костном мозге компенсировалось раздражением гранулоцитарного ростка гемопоэза. Можно предположить, что зарегистрированные аберрации в клетках костного мозга в этом случае являются результатом митотической активности элементов миелоидного ряда (табл. 10). Косвенным подтверждением сказанному может служить отсутствие повышенного "выхода" эритроцитов с микроядрами в периферическую кровь (табл. 1).
Введение ЦФ мышам в дозе 20 мг/кг приводило к снижению ОКК через 24 и 48 ч опыта на 26,6 и 23,9% соответственно (табл. 2). Использование ЙА в этом случае позволяет предотвратить падение ОКК за счет повышения (по сравнению с одним ЦФ) митотической активности и количества элементов эритро- и гранулоцитопоэза (табл. 8, 9).
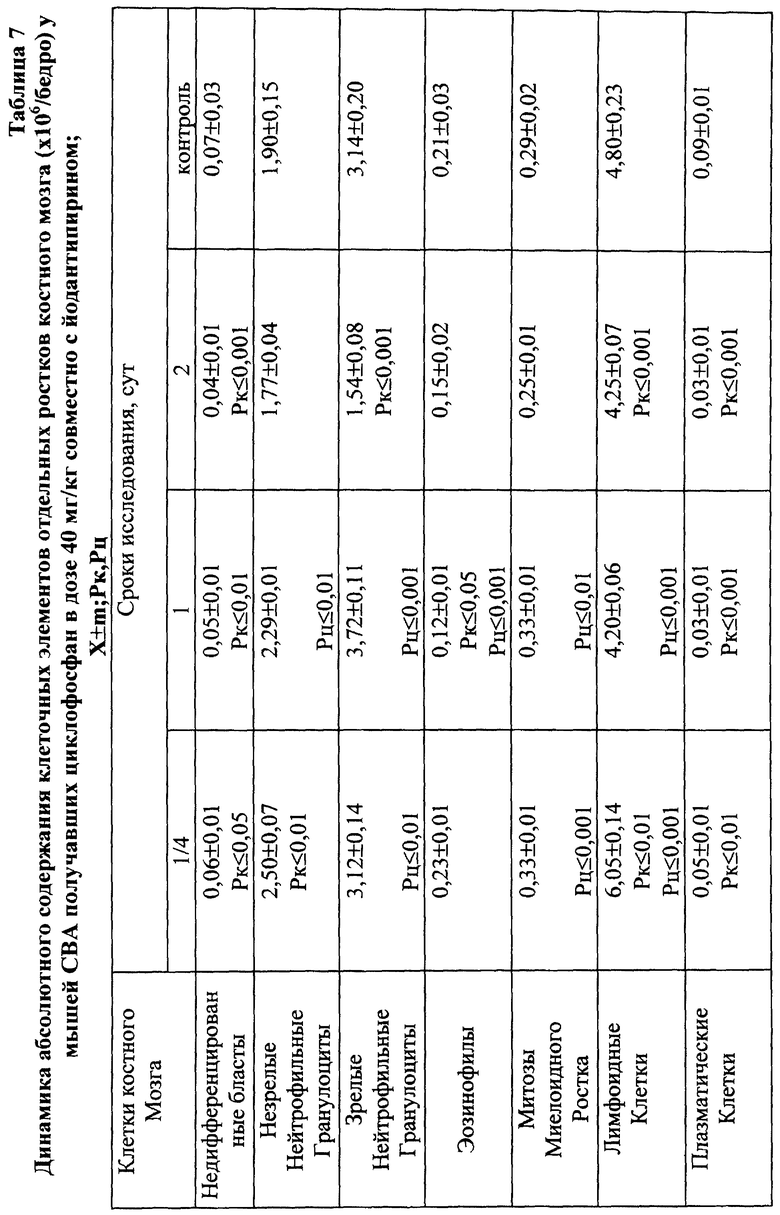
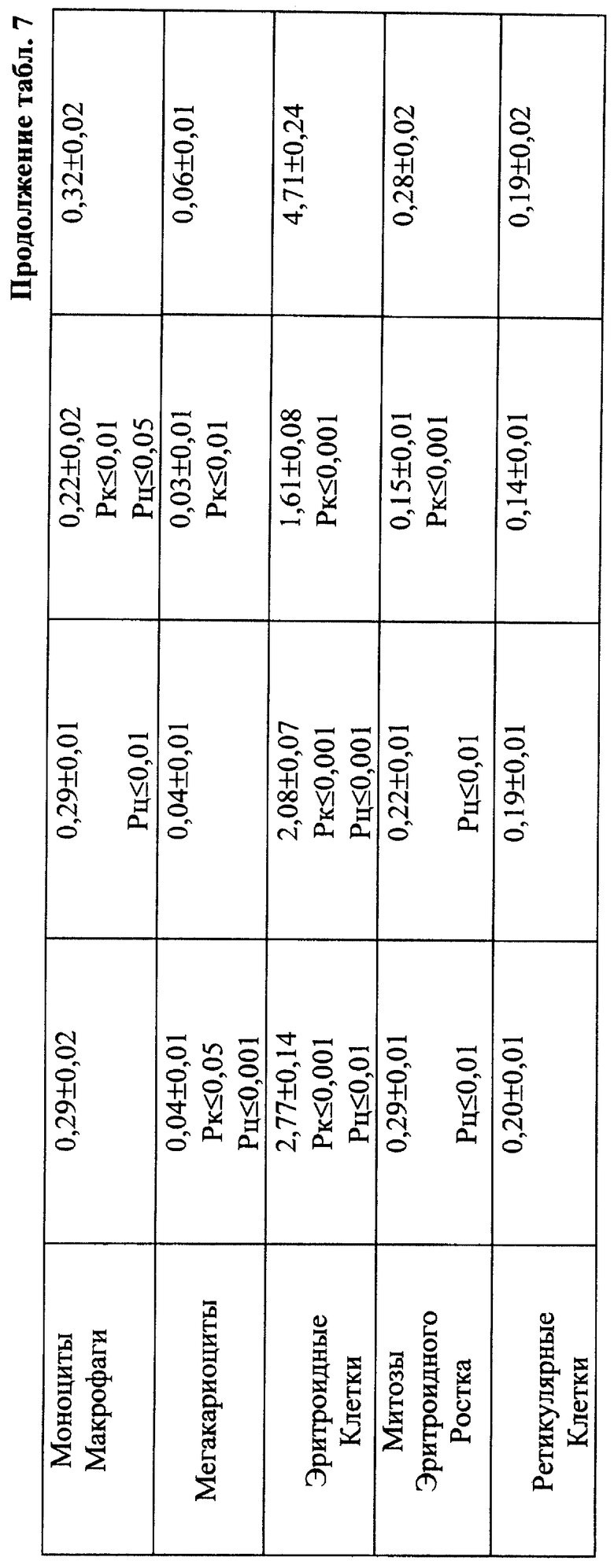
Введение ЦФ в дозе 40 мг/кг приводило к нарастающему угнетению костномозгового кроветворения (через 24 ч ОКК уменьшалось на 23% и через 48 ч - на 48% от исходного уровня) - (табл. 2). Введение ЙА в этом случае не изменяло направленность процесса, но оказывало антимутагенное защитное влияние на клетки костного мозга. Через 48 ч эксперимента ОКК достоверно (p<0,01) на 21% превышало аналогичный показатель при введении одного ЦФ, в основном, в результате более высокого уровня лимфоидных элементов (табл. 2, 6, 7).
В специальной серии экспериментов было проведено исследование на мышах CBA/Calac действия ЙА на геном клеток костного мозга в условиях цитостатической миелодепрессии, вызванной введением ЦФ в 1/2 МПД (125 мг/кг).
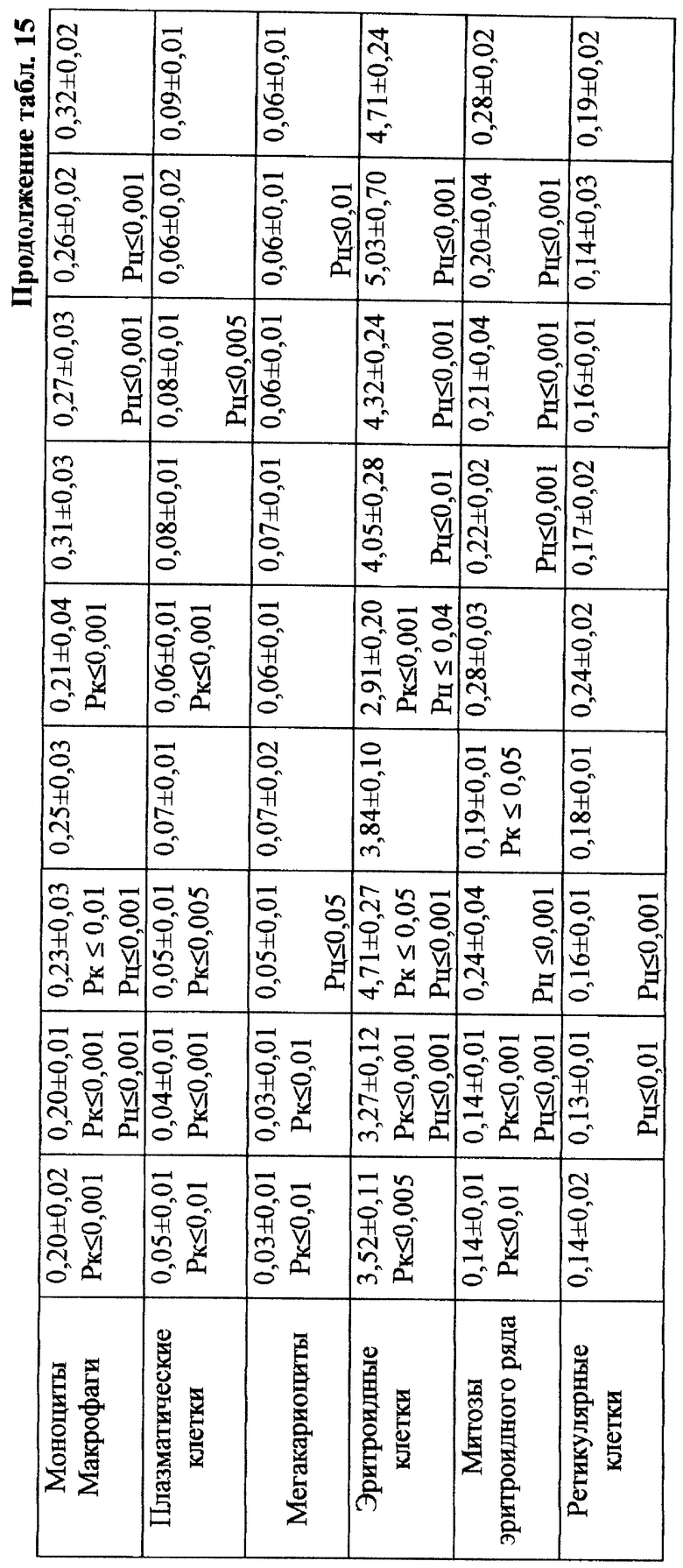
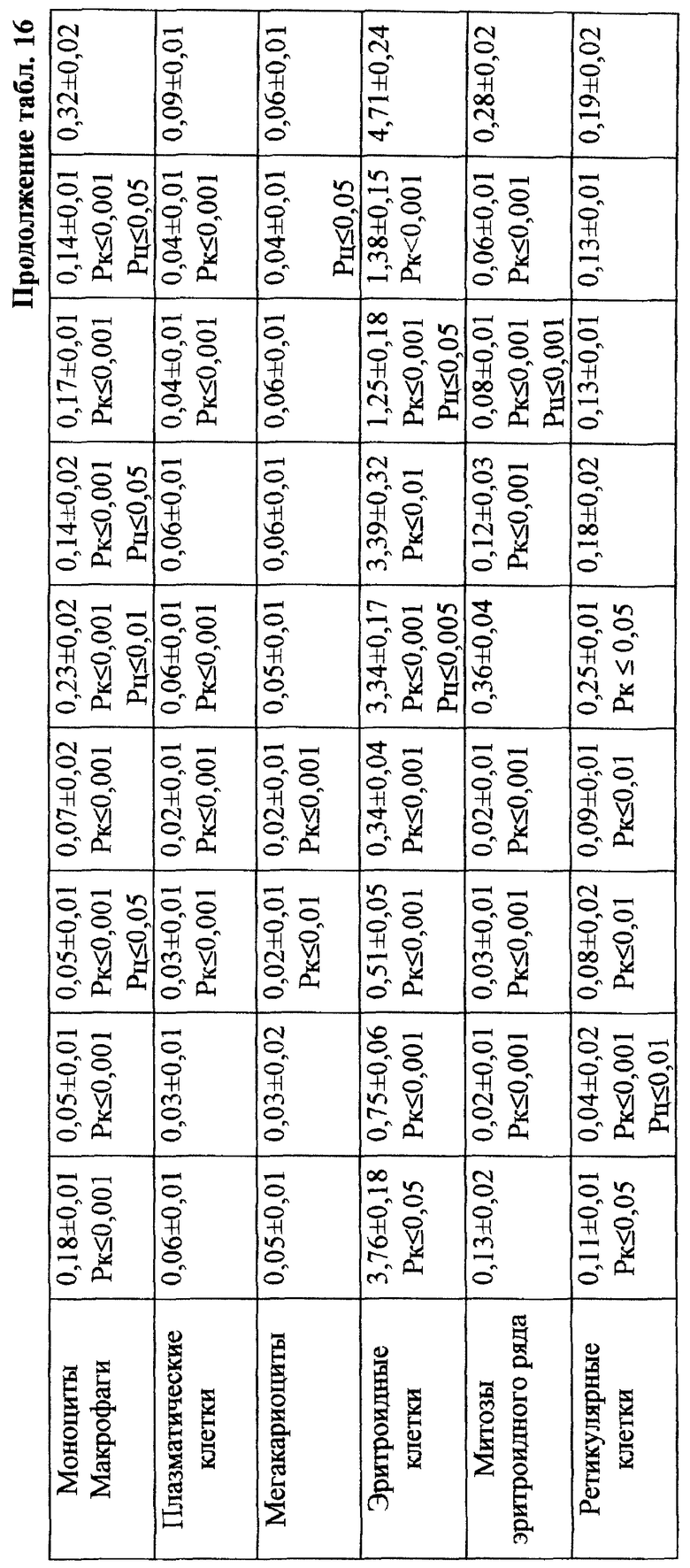
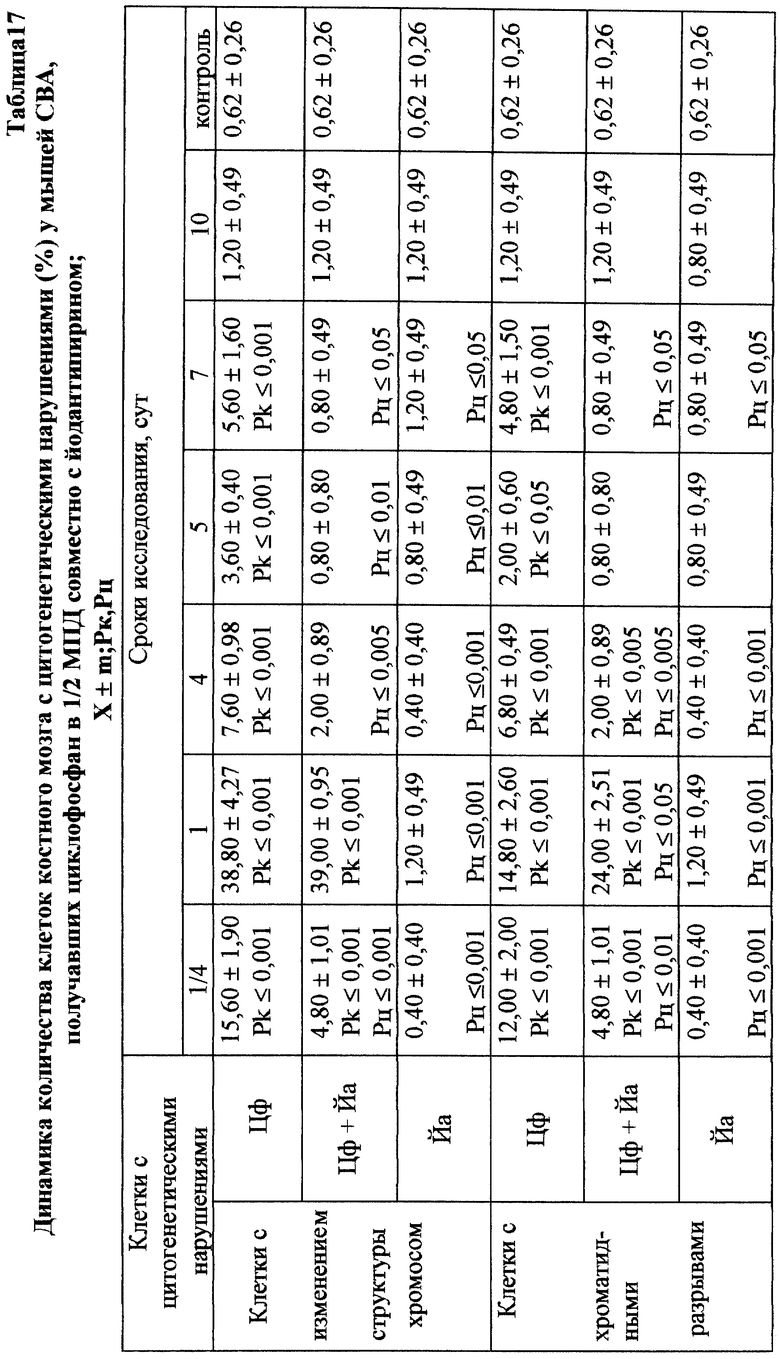
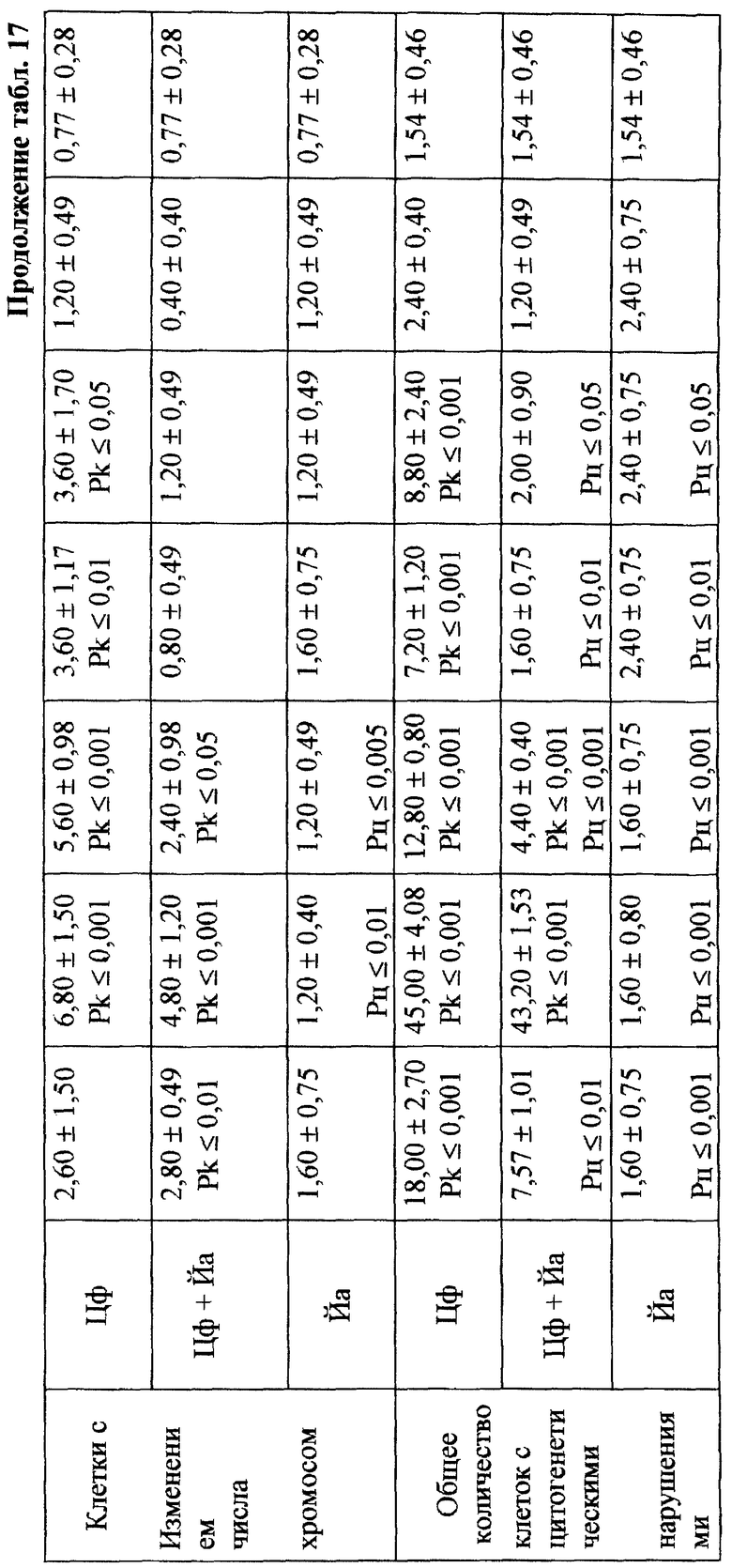
Проведенное исследование показало, что введение ЦФ в 1/2 МПД (125 мг/кг) приводило к глубокому угнетению костномозгового кроветворения (табл. 13). Уже через 24 ч эксперимента общее количество миелокариоцитов составляло лишь 30% от исходных значений. В этот период выявлялось максимальное число клеток с цитогенетическими нарушениями в костном мозге (45,00±4,08%; p<0,001). Клетки с изменениями структуры хромосом составляли при этом 38,80±4,27% (p<0,001), среди них 21,20±3,44% приходилось на метафазы со множественными разрывами хромосом; количество клеток с изменением числа хромосом (метафазы с 38, 39, 41, 42 хромосомами, полиплоиды) достигало 6,80±1,50% (p<0,001) - (табл. 17). Полученные данные согласуются с результатами, полученными ранее (7, 10).
Максимум снижения общего числа миелокариоцитов отмечался на 3-и сут исследования (в среднем на 88% от исходного уровня) - (табл. 13). Количество клеток с цитогенетическими нарушениями в костном мозге в этом случае подсчитать оказалось практически невозможным вследствие значительной гипоплазии костного мозга. С 4-х сут исследования отмечалось восстановление общего количества миелокариоцитов, что сопровождалось резким (более чем в 10 раз) увеличением числа митозов клеток миелоидного и эритроидного рядов костного мозга (0,31±0,07•106/бедро и 0,33±0,06•106/бедро соответственно) - (табл. 14). К 7-м сут эксперимента общее число миелокариоцитов составляло 74% от исходных значений (табл. 13), полностью нормализовалось содержание незрелых и зрелых нейтрофильных гранулоцитов, но сохранялось выраженное угнетение эритроидного ростка кроветворения (табл. 14). Наряду с этим в костном мозге отмечался повторный пик увеличения цитогенетически неполноценных клеток - до 8,80±2,40% (p<0,001) (табл. 17). Выход аберрантных клеток в этом случае был связан, по-видимому, с активацией пролиферации родоначальных кроветворных клеток в постцитостатический период (11).
В связи с тем, что клетки миелоидного ряда на 7-е сут эксперимента составляли преобладающее большинство нуклеаров костного мозга и число их митозов (0,10±0,01•106/бедро) в 3 раза превышало количество митозов эритрокариоцитов (0,03±0,001•106/бедро), логично утверждать, что зарегистрированные аберрации в указанный срок исследования были результатом митотической активности элементов миелоидного, а не эритроидного ряда (табл. 14). Косвенным подтверждением сказанному может служить отсутствие повышенного "выхода" эритроцитов с микроядрами в периферическую кровь после второго пика увеличения числа клеток с цитогенетическими нарушениями в костном мозге в условиях воздействия ЦФ в 1/2 МПД (табл. 12).
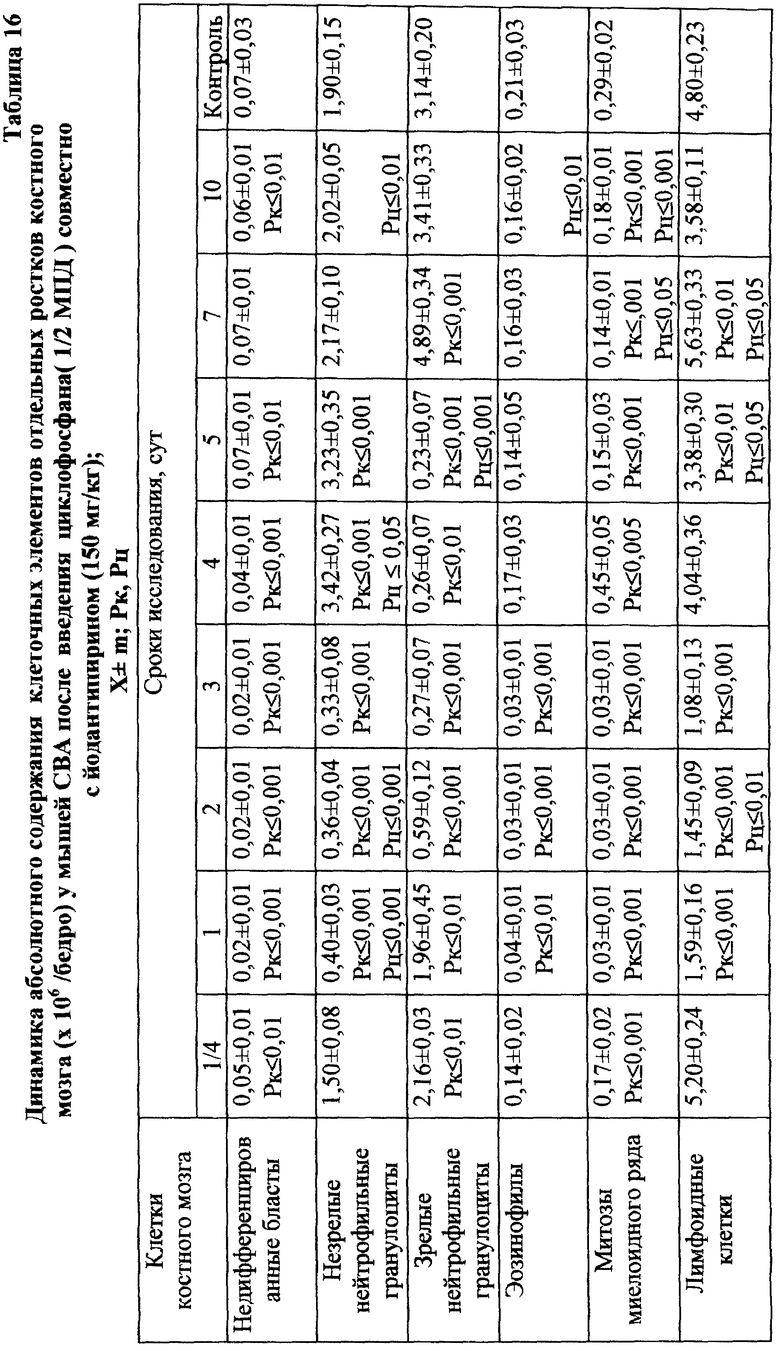
При сочетанном введении ЦФ и ЙА в костном мозге мышей имело место заметное изменение динамики количества клеток с цитогенетическими нарушениями. При незначительной разнице в числе аберрантных метафаз через 24 ч эксперимента отмечалось статистически значимое снижение данного показателя, через 6 ч на 4-е сут исследования - почти на 70 и 74% соответственно (табл. 17). При этом через 24 ч после совместного использования ЙА и ЦФ регистрировалось снижение частоты повреждений хромосом на одну клетку. Так, число клеток со множественными разрывами составляло 13,20±3,87%, что на 37,7% ниже соответствующего значения при введении одного мутагена. К 5-м сут эксперимента число клеток с цитогенетическими нарушениями у животных этой группы уже не отличалось от исходного уровня (табл. 17).
Анализ миелограмм показал, что увеличение ОКК у мышей после сочетанного введения ЦФ и ЙА было обусловлено активацией практически всех ростков гемопоэза (табл. 16). При этом число митозов в клетках миелоидного и эритроидного рядов было достоверно (p<0,05; <0,001) выше аналогичных значений при действии одного цитостатика. Важным следует признать установленный факт отсутствия повторного пика увеличения количества клеток с цитогенетическими нарушениями в костном мозге у животных, получавших ЙА на фоне действия цитостатика. Уровень аберрантных клеток на 7-е сут исследования у животных этой группы не отличался от исходного (табл. 17). Следует указать также, что содержание эритроцитов с микроядрами в периферической крови у мышей, получавших ЦФ, превышало их средний уровень в крови со 2-х до 5-х сут включительно, варьируя в пределах 3,45-3,90% (табл. 12). Применение ЙА приводило в этом случае к достоверному уменьшению данного показателя. Необходимо подчеркнуть, что введение ЙА интактным животным не выявило его влияние на спонтанный мутагенез (табл. 17). При этом, однако, в первые 24 ч снижалась клеточность практически всех ростков костного мозга (табл. 15).
Таким образом, установлено, что ЙА снижает мутагенный эффект ЦФ на кроветворные клетки костного мозга в период постцитостатической регенерации кроветворной ткани. Это приводит, в свою очередь, к ускорению темпов восстановления клеточности костного мозга. Исходя из кинетики восстановления гемопоэза после воздействия цитостатиков (11), можно предположить, что эффект препарата реализуется по крайней мере на уровне кроветворных прекурсоров. При этом механизм антимутагенного эффекта связан, по-видимому, с индукцией интерферона, обладающего тормозящим влиянием на пролиферацию кроветворных клеток-предшественников (12) и стимулирующим эффектом на эксцизионную репарацию ДНК (13), что может иметь защитный эффект в условиях применения ЦФ в высоких дозах.
Таким образом, представленные данные убедительно свидетельствуют о возможности использования йодантипирина в качестве антимутагена и расширения области применения этого препарата.
ЛИТЕРАТУРА
1. Дурнев А. Д. , Середенин С.Б. Современные принципы охраны наследственности человека. - Росс. Науион. конгресс "Человек и лекарство". - Москва, 21-25 апр. 1998.-С.331.
2. Середенин С. Б., Дурнев А.Д. Фармакологическая защита генома. - М.: ВИНИТИ.-1992.-160 с.
3. Ингель Ф.И., Сахарова Т.А., Хрипач Л.В., Ревазова Ю.А.//Вестник Росс. Акад. Мед. наук.-1993.- 3.-С.20-23.
4. Яворовская В. Е., Саратиков А.С., Федоров Ю.В., Евстропов А.Н., Соляник Р. Г., Аносова Г.В., Прищеп Т.П., Гриценко Л.Н.//Вопр. вирусологии.-1994.- 3.-С.136-138.
5. Яворовская В. Е., Гриценко Л.Н., Петров С.А., Евстропов А.Н.//Вопр. вирусологии.-1994.- 4.-С.184-187.
6. Litchfield G., Wilcokon F.G.//Pharma col. Expte. Jherap.-1949.-T.96. -С.99-113.
7. Хлусова М.Ю., Новицкий В.В., Гольдберг Е.Д.//Эксперим. и клинич. фармакология.-1992.-Т.55.- 2.-с.49-52.
8. Гольдберг Е. Д., Дыгай А.М., Шахов В.П. Методы культуры ткани в гематологии.-Томск, 1992.
9. Schlegel R., Mac Gregor G.T.//Mutat Res.-1983.-113.- 6.-P.481-487.
10. Гольдберг Е.Д., Дыгай А.М., Жданов В.В. Роль гемопоэзиндуцирующего микроокружения в регуляции кроветворения при цитостатических миелосупрессиях.-Томск, 1999.
11. Кинетические аспекты гемопоэза/Под ред. Г.И.Козинца, Е.Д.Гольдберга. -Томск, 1982.
12. Гольдберг Е.Д., Дыгай А.М., Удут В.В. и др. Закономерности структурной организации систем жизнеобеспечения в норме и при развитиии патологического процесса.-Томск, 1992.
13. Якубовская Е.Л., Македонов Г.Л., Засухина Г.Д.//Докл. АН СССР.-1987. -Т.294.- 5.-С.1240-1242.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ И КОРРЕКЦИИ ЦИТОГЕНЕТИЧЕСКИХ НАРУШЕНИЙ | 2012 |
|
RU2504392C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИМУТАГЕННЫМ ДЕЙСТВИЕМ | 2004 |
|
RU2258528C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕМОСТИМУЛИРУЮЩИМ, АНТИМУТАГЕННЫМ, ПРОТИВООПУХОЛЕВЫМ, ЦЕРЕБРОПРОТЕКТОРНЫМ, АНТИГИПОКСИЧЕСКИМ, НООТРОПНЫМ, АНКСИОЛИТИЧЕСКИМ И ПРОТИВОНЕВРОТИЧЕСКИМ ДЕЙСТВИЕМ | 2010 |
|
RU2438691C1 |
| АНТИМУТАГЕННОЕ СРЕДСТВО | 2019 |
|
RU2698204C1 |
| СПОСОБ ПРОФЕССИОНАЛЬНОГО ОТБОРА ЛИЦ ДЛЯ РАБОТ ПО УНИЧТОЖЕНИЮ БОЕВЫХ ОТРАВЛЯЮЩИХ ВЕЩЕСТВ | 2016 |
|
RU2642603C2 |
| СРЕДСТВО С АНТИМУТАГЕННОЙ АКТИВНОСТЬЮ | 2004 |
|
RU2277417C1 |
| АНТИМУТАГЕН | 2004 |
|
RU2266128C1 |
| РАДИОЗАЩИТНОЕ СРЕДСТВО | 1997 |
|
RU2179020C2 |
| СПОСОБ АНТИМУТАГЕННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ | 2003 |
|
RU2261704C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ НЕСТАБИЛЬНОСТИ ГЕНОМА У ДЕТЕЙ С ДЕТСКИМ ЦЕРЕБРАЛЬНЫМ ПАРАЛИЧОМ | 2005 |
|
RU2295130C1 |








Изобретение относится к медицине, а именно к фармакологии, и касается применения йодантипирина в качестве средства, снижающего мутагенный эффект циклофосфана. Применение предложенного препарата позволяет обеспечить антимутагенный эффект. 17 табл.
Применение йодантипирина в качестве средства, снижающего мутагенный эффект циклофосфана.
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ КЛЕЩЕВОГО ЭНЦЕФАЛИТА "ЙОДАНТИПИРИН" | 1997 |
|
RU2141826C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ВИРУСНОГО КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ИНДУЦИРОВАННОГО В ЭКСПЕРИМЕНТЕ | 1986 |
|
RU2025126C1 |
| ИНДУКТОР ИНТЕРФЕРОНА | 1998 |
|
RU2132681C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ВИРУСНОЙ ЭТИОЛОГИИ | 1997 |
|
RU2138255C1 |
| СПОСОБ АНТИМУТАГЕННОГО ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ | 1999 |
|
RU2145869C1 |
| ЛОГИНОВА Н.С | |||
| Влияние индукторов интерферона на химически индуцированный мутагенез и канцерогенез | |||
| Вестник РАМН, №3, 1996. | |||
Авторы
Даты
2002-09-20—Публикация
2000-07-10—Подача