Изобретение относится к биотехнологии и может найти применение в медицине. Герпесвирусные инфекции являются широко распространенными вирусными инфекциями человека, имеющими разнообразные клинические проявления, в ряде случаев весьма опасные для жизни индивидуума. Герпесвирусы способны к длительному латентному существованию в организме человека, однако в некоторых случаях они могут реактивироваться и вызывать тяжелые заболевания, вплоть до летальною исхода. В настоящее время известно 8 типов герпесвирусов, среди которых наиболее важное медицинское значение имеют вирус простого герпеса 1 типа (ВПГ 1), вирус простого герпеса 2 типа (ВПГ 2), вирус Эпштейн-Барра - герпесвирус 4 типа (ВЭБ), цитомегаловирус-герпесвирус 5 типа (ЦМВ)
Диагностика герпетических инфекций представляет собой достаточно сложную задачу, что объясняется как широким спектром клинических проявлений, так и недостатками традиционно использующихся диагностических методов. Перспективным подходом для выявления герпетических инфекций является ДНК-диагностика вируса при помощи полимеразной цепной реакции (ПЦР). В настоящее время ПЦР является наиболее чувствительным способом индикации микроорганизмов, способным потенциально обнаруживать единичные вирусные частицы. Прямое определение ДНК возбудителя может служить не только основой для выявления вирусоносительства в любой его форме (латентной или активной), но и для анализа генетических вариантов вируса. Однако известные способы детекции герпесвирусов и диагностики герпесвирусных инфекций заключаются в выявлении только одного типа вируса. Такой подход малоэффективен для клинического применения, т.к. в большинстве случаев возникает вопрос о дифференциальной диагностике.
Известен способ диагностики герпесвирусной инфекции, включающий детекцию вирусной ДНК в исследуемом материале путем проведения двухэтапной ПЦР с использованием на первом этапе двух внешних праймеров и матрицы в виде участка вирусной ДНК с получением амплификата, а на втором этапе - двух внутренних праймеров и матрицы в виде полученного на первом этапе амплификата с последующим определением полученных на втором этапе продуктов амплификации методом горизонтального электрофореза в агарозном геле (С.А.Клинчева и др. Использование метода nested-полимеразой цепной реакции для быстрого выявления цитомегаловируса в лейкоцитах периферической крови пациентов после трансплантации костного мозга. Вопр. вирусологии, 1996, 41.4, с.147-149) - прототип.
Однако данным известным способом определяется только один тип герпесвируса. Для определения других типов герпесвирусов необходимо проведение ПЦР с использованием иных праймеров, что делает определение длительным, дорогостоящим и трудоемким.
Техническим результатом, достигаемым настоящим изобретением, является одновременное определение четырех типов герпесвирусов в одной пробе, снижение трудозатрат, снижение расхода реактивов, ускорение определения.
Указанный технический результат достигается тем, что в способе диагностики герпесвирусной инфекции, включающем детекцию вирусной ДНК в исследуемом материале путем проведения двухэтапной полимеразной цепной реакции с использованием на первом этапе двух внешних праймеров и матрицы в виде участка вирусной ДНК с получением амплификата, а на втором этапе - двух внутренних праймеров и матрицы в виде полученного амплификата с последующей дифференциацией полученных на втором этапе продуктов амплификации, отличающийся тем, что в качестве внешних праймеров используют олигонуклеотиды формулы I и II
I
5'-CGTGTTCGACITTGCCAGCCTGTACCC-3'-
II
5'-TTGCGGACGAGATCCACGCCCTT-3'
а в качестве внутренних праймеров - олигонуклеотиды формулы I и III
III
5'-GICCGTGTCCCCGTAGAGTA-3'
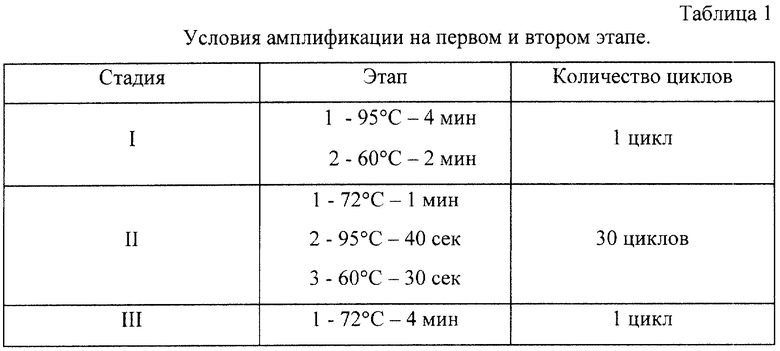
Достигается указанный технический результат тем, что первый и второй этапы полимеразной цепной реакции проводят в три этапа, при этом первый этап в один цикл включает стадию денатурации 4 мин при 95oС и стадию отжига 2 мин при 60oС, второй этап в 30 циклов включает стадию элонгации 1 мин при 72oС, затем денатурацию 40 сек при 95oС и отжиг 30 сек при 60oС и третий этап в один цикл-элонгация 4 мин при 72oС.
Продукты амплификации, полученные на втором этапе, дифференцируют посредством рестрикционного анализа с использованием эндонуклеазы TaqI и RsaI.
Продукты рестрикции ампликонов, полученных на втором этапе, определяют электрофорезом в горизонтальном агарозном геле.
Для создания новой диагностической системы был проведен попарный компьютерный анализ геномов всех герпесвирусов. В результате у герпесвирусов типов 1, 2, 4, 5 был идентифицирован фрагмент в гене ДНК-полимеразы протяженностью около 800 п.н., который был фланкирован двумя консервативными участками, а внутри данного фрагмента содержался еще один консервативный участок. К каждому консервативному участку были сконструированы праймеры формулы I и II для двух консервативных участков, которыми фланкирован идентифицированный фрагмент в гене ДНК-полимеразы и праймер формулы III для консервативного участка внутри фрагмента в гене ДНК-полимеразы.
Несмотря на то, что при 30 циклах первого этапа ПЦР с праймерами формулы I и II не удалось получить видимых ампликонов, при дальнейшем использовании в качестве матрицы полученного амплификата в последующей ПЦР (на втором этапе) были получены хорошо выраженные ампликоны расчетного размера с вирусной ДНК ВПГ 1, ВПГ 2, ВЭБ и ЦМВ.
Проверка специфичности тест-системы на основе праймеров формулы I, II, III показала отсутствие ампликонов при амплификации образцов культур клеток, содержащих вирус герпеса 6 типа и вирус герпеса 8 типа, а также образцов клинического материала от здоровых доноров. При этом использовали коммерческий препарат ДНК вируса герпеса 6-го типа (НИИ эпидемиологии РАМН) и ДНК вируса герпеса 8-го типа (НИИ Канцерогенеза РАМН).
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1.
Для создания новой диагностической системы был проведен попарный компьютерный анализ геномов всех герпесвирусов. В результате у герпесвирусов типов 1, 2, 4, 5 был идентифицирован фрагмент в гене ДНК-полимеразы протяженностью около 800 п.н., который был фланкирован двумя консервативными участками, а внутри данного фрагмента содержался еще один консервативный участок. К каждому консервативному участку были сконструированы праймеры формулы I и II для двух консервативных участков, которыми фланкирован идентифицированный фрагмент в гене ДНК-полимеразы и праймер формулы III для консервативного участка внутри фрагмента в гене ДНК-полимеразы.
Формула праймера I
5'-CGТGTTCGACТTGCCAGCCTGTACCC-3'
Формула праймера II
5'-TTGCGGACGAGATCCACGCCCТТ-3'
Формула праймера III
5'-GTCCGTGTCCCCGTAGAGTA-3'
Пример 2.
Отработку условий амплификации на первом и втором этапе проводили на клонированных фрагментах вирусной ДНК, полученных из культуральных штаммов: ВПГ1 (Л2), ВПГ2 (ВН), ЦМВ (АД-169), ВЭБ (лимфобластоидная перевиваемая линия P3HR1). Препараты культур клеток получены из лаборатории сравнительной вирусологии НИИ вирусологии им. Д.И.Ивановского РАМН. Условия амплификации на первом и втором этапе одинаковые и представлены в таблице 1.
Пример 3.
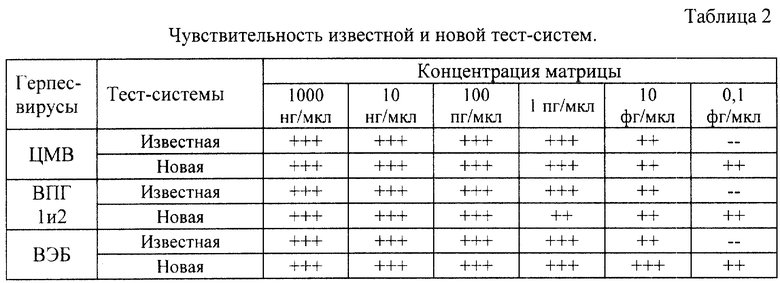
Абсолютную чувствительность новой тест-системы определяли в экспериментах с плазмидной ДНК, содержащей клонированные фрагменты вирусов ВПГ 1, ВПГ 2, ЦМВ и ВЭБ. Показали, что чувствительность новой тест системы превышает чувствительность ранее использовавшихся систем. Результаты представлены в таблице 2 и свидетельствуют о высокой чувствительности тест-систем согласно изобретению.
Пример 4.
Размеры ампликонов, получаемых на втором этапе ПЦР, для каждого типа вирусов в новой системе индикации были следующие: ВПГ1 - 531, ВПГ2 - 531, ВЭБ - 537, ЦМВ - 603 т.п.н.
В связи с тем, что размер ампликона 4-х типов герпесвирусов практически одинаковый, что затрудняет их дифференциацию, встал вопрос об удобном в исполнении методе дифференциации герпесвирусов разных типов. Анализ нуклеотидной последовательности получаемого на втором этапе ПЦР амплифицирущегося фрагмента позволил сделать предположение о возможности дифференциации герпесвирусов разного типа с помощью рестрикционного анализа (ПДРФ-полиморфизм длины рестрикционных фрагментов). Выбор рестриктаз для анализа диктовался не только вопросами дифференциации, но и возможностью проведения реакции рестрикции непосредственно в ПЦР-буфере. Учитывая оба вышеназванных фактора, для рестрикционного анализа были отобраны эндонуклеазы TaqI и RsaI. Результаты рестрикционного анализа ампликонов показывают, что рестриктазы TaqI и RsaI позволяют получить наиболее наглядные различия в рестрикционных профилях анализируемых ампликонов. Таким образом, разработанный метод анализа ПДРФ позволяет выявлять генетические различия, присущие герпесвирусам разного типа, и может быть использован для их дифференциации.
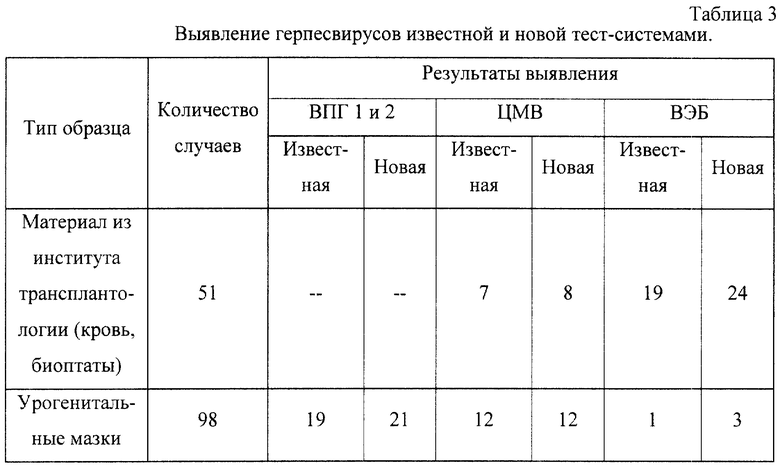
Проведенные лабораторные исследования новой универсальной тест-системы на клиническом материале, полученном из Института трансплантологии МЗ РФ, и клиническом материале от больных гинекологического профиля, показали высокие диагностические качества по сравнению с ранее использованными тест-системами. Результаты исследования показаны в таблице 3.
Полученные результаты говорят о том, что новый способ диагностики герпесвирусов прост в исполнении, дешевле раздельных тест-систем и отличается повышенной чувствительностью. Способ позволяет одновременно определять ДНК ВПГ 1, ВПГ 2, ЦМВ и ВЭБ. Присутствие в анализируемом материале вирусов 6-го и 8-го типов не мешает определению.
Изобретение относится к иммуннобиологии и может быть использовано в медицине. Способ диагностики герпесвирусной инфекции осуществляют путем проведения двухэтапной ПЦР с использованием на первом этапе двух внешних праймеров I и II, а на втором - двух внутренних праймера I и III. Два этапа ПЦР включают три стадии: первая стадия в один цикл включает денатурацию и отжиг, вторая стадия - в 30 циклов включает элонгацию, денатурацию и отжиг, а третья стадия в один цикл включает элонгацию. Продукты амплификации дифференцируют путем рестрикционного анализа, например, электрофорезом в горизонтальном агарозном геле. Способ позволяет одновременно определять четыре типа герпесвирусов в одной пробе. 3 з.п. ф-лы, 3 табл.
I
5'-CGTGTTCGACTTTGCCAGCCTGTACCC-3'
II
5'-TTGCGGACGAGATCCACGCCCTT-3'
а в качестве внутренних праймеров-олигонуклеотиды формулы I и III
III
5'-GTCCGTGTCCCCGTAGAGTA-3'.
| Способ получения папаверина и кодеина из опия | 1926 |
|
SU17219A1 |
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДЫ-ПРАЙМЕРЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВИРУСА ПРОСТОГО ГЕРПЕСА 1 ТИПА (ВПГ-1) ЧЕЛОВЕКА | 1999 |
|
RU2165977C1 |
| Устройство для приема и обработки шумоподобных сигналов | 1982 |
|
SU1084854A1 |
| WO 9116455, 31.10.1991. | |||
Авторы
Даты
2002-11-10—Публикация
2001-06-26—Подача