Изобретение относится к области медицины, а именно к клинической фармакологии.
В современных условиях лечение инфекционных заболеваний приобретает не только медицинское значение, но и социальное. Недостаточное финансирование здравоохранения, отсутствие необходимых средств на приобретение дорогостоящих медикаментов заставляет врачей подходить к назначению лекарственных препаратов только по строгим показаниям, когда есть полная уверенность, что данный препарат прогностически является высокоэффективным, безопасным и, что немаловажно, дешевым среди возможных аналогов. Сложившаяся ситуация чрезвычайно важна для эффективной терапии инфекционных заболеваний. Антибактериальные средства являются этиотропными препаратами, поэтому от правильного выбора врача зависит эффективность проводимой терапии.
Однако существующие методы определения чувствительности микроорганизмов не рассчитаны на решение вопроса о назначении препарата конкретному больному, поскольку трудоемки и весьма продолжительны по времени исполнения. Именно поэтому для приближения лабораторных бактериологических методов к клинике, к конкретному пациенту, необходимы новые подходы для прогнозирования эффективности антибактериальной терапии, которые в короткие сроки могут ответить на вопросы о том, какой препарат должен быть назначен и в какой технологии.
Современные стандартизированные методы определения чувствительности микроорганизмов к антибиотикам подразделяются на методы серийных разведений (в агаре и бульоне, метод микроразведений) и диффузионные (диско-диффузионный метод (ДДМ) и метод Е-тестов) [1, 2]. Методы серийных разведений и Е-тесты позволяют получить количественную характеристику чувствительности микроорганизмов - МПК (минимальная подавляющая концентрация) антибиотика в отношении данного возбудителя, а ДДМ является полуколичественным и позволяет подразделить все штаммы на три категории - чувствительные, умеренно-устойчивые и резистентные.
Методы разведений являются достаточно сложными, трудоемкими и используются в основном при исследовании новых антибиотиков, при проведении научных проектов, в рамках эпидемиологического надзора за лекарственной устойчивостью микроорганизмов.
ДДМ представляет наиболее простой, удобный и широко используемый метод при рутинном микробиологическом исследовании чувствительности к антибиотикам обычных быстрорастущих и некоторых микроорганизмов со сложными питательными потребностями [3]. Этот метод основан на регистрации диаметра зоны подавления роста микроорганизма вокруг бумажного диска с антибиотиком. В определенных пределах величина диаметра зоны подавления роста пропорциональна величине МПК, поэтому ДДМ позволяет косвенно судить о величине МПК. Оценка результатов проводится с использованием критериев интерпретации, разработанных на основе корреляции значений диаметров зон подавления роста и МПК антибиотика.
Однако на результаты определения чувствительности ДДМ могут влиять многие факторы, такие как состав, рН, толщина и равномерность слоя питательной среды, плотность микробной взвеси (инокулюм), скорость роста микроорганизма и возраст культуры, условия инкубации (температура, атмосфера), содержание антибиотика в диске и скорость диффузии его в агар и т.д. [4]. Поэтому эта методика требует строгой стандартизации: использование определенного агара, соблюдение правил приготовления инокулюма, условий инокуляции и инкубации чашек, правильного и регулярного проведения процедур по контролю качества как питательных сред, так и стандартных культур. Но даже при такой стандартизации ответ лабораторией будет дан через 72 часа.
Кроме того, чрезвычайно важно, что практикующий врач, получающий заключение из бактериологической лаборатории, не может быть полностью уверен в успехе терапии, даже если возбудитель расценен как чувствительный к конкретному антибиотику. Эффективность проводимой противомикробной терапии во многом зависит от фармакокинетических характеристик антибактериального препарата. Эффект антибиотика in vitro и действие препарата в организме могут не совпадать. Причиной тому может быть неучтенная способность антибактериальных препаратов по-разному проникать в различные органы, ткани и биологические жидкости. Используемые в бактериологической практике методы (в том числе и ДДМ) не учитывают фармакокинетических характеристик.
Поставлена задача объединить классический микробиологический подход и оценку фармакокинетических характеристик антибактериальных препаратов.
Принцип способа основан на методе разведении при тестировании возбудителей инфекционных заболеваний с помощью двух концентраций антибиотика в соответствии с его накоплением в тех или иных органах при применении максимальных и средних терапевтических доз. Этот принцип позволяет прогнозировать клиническую эффективность назначаемых препаратов и подобрать адекватную дозировку лекарственных средств.
Способ осуществляется следующим образом. Тестирование микроорганизмов проводится в полистироловом планшете по ТУ-64-2-375-86 с горизонтальными и вертикальными рядами ячеек (8х12). В три ячейки планшета помещается взвесь микроорганизмов, полученных от больных пациентов. В качестве инокулята используют взвесь свежевыращенной, в соответствии с утвержденными рекомендациями [5, 6], культуры. Культуру, выращенную на поверхности плотной питательной среды, суспендируют и разводят 0,9% раствором хлорида натрия, или питательного бульона, до 10 ЕД по отраслевому стандартному образцу для визуального определения мутности бактерийных взвесей, а затем взвесь разводят еще в 10000 раз. Полученный инокулят, содержащий приблизительно 105 микробных клеток в 1 мл взвеси, с помощью стерильной пипетки по ГОСТ 20292-74Е или пипеточного дозатора фирмы "Labsystem" вносят по 0,1 мл в планшет в три свободные ячейки. Для контроля стерильности в четвертую ячейку вносят 0,2 мл питательного бульона. Далее в первую ячейку вносится раствор исследуемого антибактериального средства в объеме 0,1 мл таким образом, чтобы в полученном объеме содержалось то количество препарата, которое накапливается согласно литературным данным в пораженном органе больного при введении средней терапевтической дозы лекарства. Во вторую ячейку помещают также 0,1 мл раствора антибиотика, но уже в концентрации, накапливаемой в ткани при введении высшей терапевтической дозы (в 3-6 раз больше). Планшет закрывают крышкой и инкубируют при температуре 36±1oС в течение 18-24 ч.
Периодически, с интервалом в 2-3 часа оценивают прозрачность содержимого ячеек. Учет результатов проводят визуально после инкубации по появлению видимого роста (помутнению питательной среды) в ячейке контроля роста. Необходимое время инкубации микротестсистемы зависит от скорости роста исследуемого микроорганизма и находится в пределах 6-20 часов.
Результаты оцениваются следующим образом:
- возможная клиническая эффективность антибактериального препарата расценивается как "высокая", если отсутствует рост (прозрачная среда) в ячейках с большой и малой концентрацией антибактериального препарата;
- возможная клиническая активность антибактериального препарата расценивается как "неэффективность", если наблюдается рост (помутнение) среды в обеих ячейках с лекарственным средством;
- возможная клиническая эффективность антибактериального препарата расценивается как "вероятная при использовании высшей терапевтической дозы", если отсутствует рост (прозрачная среда) лишь в ячейке с большой концентрацией, а в ячейке с малой - наблюдается рост микроорганизмов (помутнение среды).
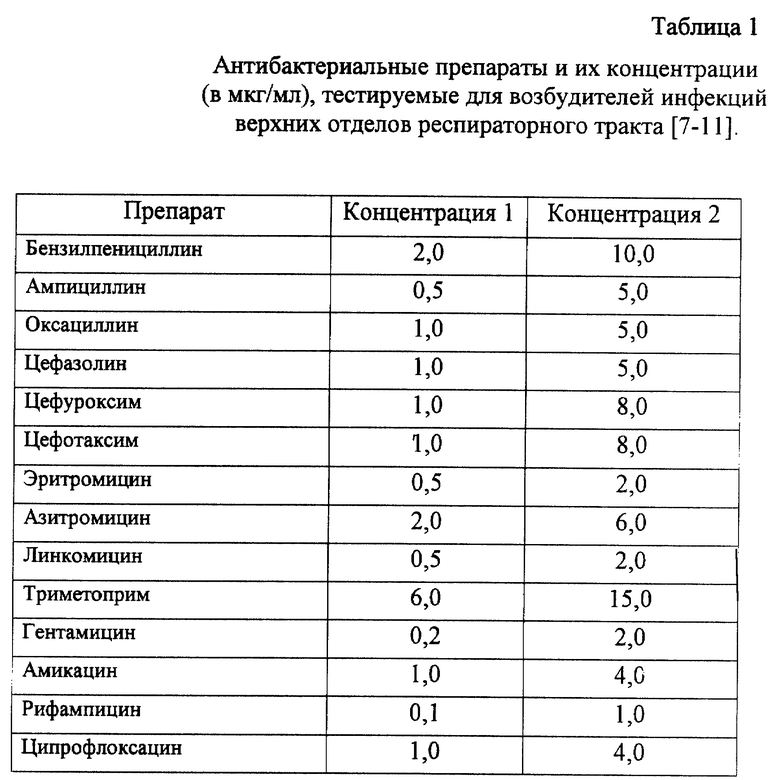
В таблицах 1-4 представлены наборы препаратов, с помощью которых предполагается тестирование возбудителей инфекционных заболеваний человека. В частности, в таблице 1 указаны антибактериальные средства и две их концентрации в мкг/мл, которые необходимо добавить к культуре микроорганизма, выделенного из материала верхних дыхательных путей (мазки из зева, пунктаты пазух носа и среднего уха), полученных от пациентов с различными формами инфекционных поражений верхнего отдела респираторного тракта.
В таблице 2 представлены антибактериальные препараты, рекомендуемые для тестирования возбудителей, полученных из мокроты пациентов с диагнозами "пневмония" и "обострение хронического бронхита". При этом концентрации антибиотиков приведены с учетом их накопления именно в паренхиме легких при введении их средних (концентрация 1) и высших (концентрация 2) терапевтических доз.
Таблица 3 содержит информацию о уроантисептиках и антибиотиках, применяемых при лечении инфекций мочевыделительного тракта. Концентрации лекарственных препаратов приведены с учетом их накопления в паренхиме почек, что дает возможность прогнозировать эффективность терапии при осложненных формах патологии, в частности при хронических пиелонефритах.
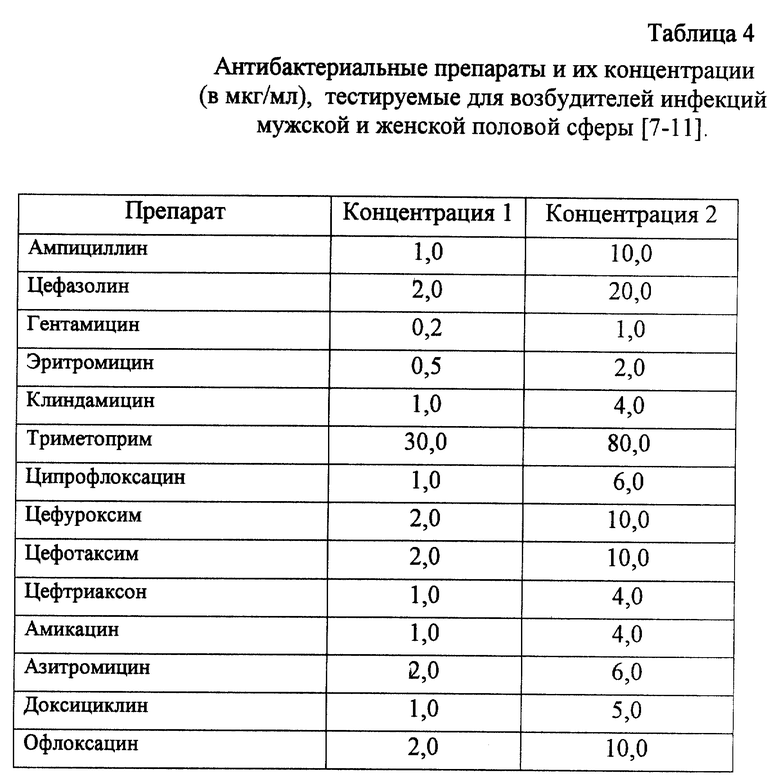
В таблице 4 указаны антибактериальные средства, тестируемые для предсказания эффективности лечения бактериальных инфекций мужской и женской половой сферы. Концентрации препаратов подобраны с учетом их возможного накопления в предстательной железе у мужчин, органах малого таза у женщин.
ИСТОЧНИКИ ИНФОРМАЦИИ:
1. Woods G.L., Washington J.A. Antibacterial susceptibility tests: dilution and disk diffusion methods. In. Manual of Clinical Microbiology./ Murray P., et al. (Eds), 6th ed. Washington.//1995. - 1327-1341.
2. Jorgensen J.H., Sahm D.F. Antibacterial susceptibility testing: general considerations. In. Manual of Clinical Microbiology./ Murray P., et al. (Eds), 6th ed. Washington.//1995.- 1277-1280.
3. Асаr J.F., Goldstein F.W. Disk susceptibility test. In. Antibiotics in laboratory medicine./ Lorian V. (Ed). Baltimore.//1996.- 1-51.
4. Определение чувствительности к ампициллину/сульбактаму (уназин) и цефоперазону (цефобид) диско-диффузионным методом.// Методические рекомендации./ Смоленск. - 1998.
5. Методические рекомендации по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков. - Министерство здравоохранения СССР, 1983.
6. Об унификации микробиологических (бактериологических) методов исследования в клинико-диагностических лабораториях лечебно-профилактических учреждений. - Приказ 535 от 22.04.85 МЗ СССР.
7. Навашин С.М., Фомина И.П. Рациональная антибиотикотерапия. - М.: Медицина. - 1982.
8. Гусель В.А., Маркова И.В. Справочник педиатра по клинической фармакологии. - М.: Медицина. - 1990.
9. Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика. - М.: Медицина. - 1985.
10. Страчунский Л. С., Козлов С.Н. Макролиды в современной клинической практике. - Смоленск. "Русич". - 1998.
11. Падейская Е.Н., Яковлев В.П. Антимикробные препараты группы фторхинолонов в клинической практике. - М.: Логата. -1998.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ КЛИНИЧЕСКОЙ ЭФФЕКТИВНОСТИ АНТИБАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ ДЛЯ ВОЗБУДИТЕЛЕЙ ОСОБО ОПАСНЫХ ИНФЕКЦИЙ Francisella tularensis И Brucella spp | 2009 |
|
RU2417376C2 |
| СПОСОБ ЛЕЧЕНИЯ ГНОЙНОГО ХОЛАНГИТА | 2008 |
|
RU2404825C2 |
| СПОСОБ ОЦЕНКИ АНТИБАКТЕРИАЛЬНОГО ДЕЙСТВИЯ ОЗОНИРОВАННОГО ФИЗИОЛОГИЧЕСКОГО РАСТВОРА (ОФР) | 2004 |
|
RU2289812C2 |
| СПОСОБ ЛЕЧЕНИЯ СТЕРТЫХ ФОРМ ДИЗЕНТЕРИЙ | 2017 |
|
RU2651752C1 |
| Экспресс-метод определения чувствительности грамотрицательных бактерий к бактериофагам | 2022 |
|
RU2785461C1 |
| Способ повышения чувствительности холерных вибрионов к антибактериальным препаратам | 2018 |
|
RU2688165C1 |
| СПОСОБ ЭКСПРЕСС-АНАЛИЗА IN VITRO ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ БАКТЕРИЙ И ГРИБОВ У ПАЦИЕНТА | 2020 |
|
RU2735983C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ПАТОГЕННЫХ БАКТЕРИЙ К КОМПЛЕКСНЫМ АНТИБАКТЕРИАЛЬНЫМ ПРЕПАРАТАМ | 2013 |
|
RU2529711C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ АНТИМИКРОБНОГО ВОЗДЕЙСТВИЯ АНТИСЕПТИКОВ НА БАКТЕРИИ, СУЩЕСТВУЮЩИЕ В ФОРМЕ БИОПЛЕНКИ | 2015 |
|
RU2603100C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ВАНКОМИЦИНА В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ У НОВОРОЖДЕННЫХ ДЕТЕЙ | 2009 |
|
RU2424523C2 |


Изобретение относится к медицине, в частности к клинической фармакологии, и касается способа прогнозирования клинической эффективности антибактериального средства. Сущностью способа является инкубация взвеси микробных клеток с антибактериальным средством, взятым в двух концентрациях, соответствующих тем, которые создаются в органах-мишенях при введении средней и высшей терапевтических доз, учет результатов проводят визуально по появлению видимого роста в ячейках планшета. Техническим результатом является возможность прогнозирования клинической эффективности назначаемых препаратов и подбор адекватной дозировки лекарственных средств. 4 табл.
Способ прогнозирования клинической эффективности антибактериального средства методом разведений, отличающийся тем, что в ячейках планшета проводят инкубацию взвеси микробных клеток с антибактериальным средством, которое берут в двух концентрациях, соответствующих тем, которые создаются в органах-мишенях при введении средней и высшей терапевтических доз, учет результатов проводят визуально по появлению видимого роста в ячейках планшета, при этом "высокая" клиническая эффективность антибактериального средства устанавливается при отсутствии роста микроорганизмов в ячейках с большей и меньшей концентрациями, "неэффективная" при росте микроорганизмов в обеих ячейках и "вероятная при использовании высшей терапевтической дозы" при отсутствии роста в ячейке с большей концентрацией, а в ячейке с малой концентрацией наблюдается рост.
| СПОСОБ ПОДБОРА АНТИСЕПТИКОВ ДЛЯ ЛЕЧЕНИЯ ГНОЙНЫХ РАН | 1996 |
|
RU2117293C1 |
| ЛЕВИ М.И | |||
| и др | |||
| Сравнение результатов анализа эффективности антибиотиков при исследовании бактериальных культур и гнойного отделяемого больных методом серийных разведений и диско-диффузионным методом | |||
| Дезинфекционное дело, 1999, № 4, с.25-28 | |||
| ДЬЯКОВ С.И | |||
| и др | |||
| Методы быстрого определения чувствительности микробов к антибиотикам | |||
| Антибиотики, 1983, № 7, с.545-554. | |||
Авторы
Даты
2002-11-10—Публикация
2000-09-07—Подача